无机有机杂化Keggin型多金属氧酸盐复合物及其制备方法和在抗菌方面的应用与流程
本发明属于无机–有机功能化多酸技术领域。具体涉及一种将具有良好杀菌效果的2–乙酰吡嗪缩氨基硫脲化合物,与具有较高氧化还原性、抗癌和抗微生物活性的pom结合制备形成无机有机杂化keggin型多金属氧酸盐复合物。该复合物将2–乙酰吡嗪缩氨基硫脲与pom自组装在一起,不仅增强了pom的稳定性和穿透能力,而且使其具有优异的抗菌性能,可在生物和食品工业以及其他应用领域发挥相当大的抗菌作用。
背景技术:
细菌感染面临严重问题,可能威胁人类健康和动植物的生长。过度使用甚至滥用抗生素会使细菌对抗菌药物产生抗药性。如今,全世界每年都有数百万人死于细菌污染。因此,抗菌材料越来越受到科研人员的关注。一些材料被用于抗菌,如金属化合物,壳聚糖和纳米复合材料等。然而,这些材料活性低,化学不稳定。因此,迫切需要开发新的、高性能的抗菌材料,以缓解细菌感染引起的危机。
poms具有有趣的结构、物理和化学特征。此外,杂多金属氧酸盐在材料科学和催化领域有着巨大的应用前景。特别是,杂多金属氧酸盐在其特异性pom-蛋白质相互作用方面的抗肿瘤、抗病毒、抗菌性能已被报道,为生物医学研究提供了机会。然而,纯无机物在生理条件下表现出不稳定性,并且由于其表面特性而限制了细胞的穿透性。具有有机基团的poms功能化是生物活性poms领域的主要研究热点。有机功能化的poms可以改变其表面、极性和氧化还原性能,从而形成一种全新的化合物,提高了稳定性和细胞穿透能力。
缩氨基硫脲(tscs)是由氨基硫脲与适当的醛或酮缩合得到的一类化合物。tscs具有重要的生物活性单元n1nh(cs)n4−。近年来,tscs及其相关金属配合物由于其配位化学和综合药理特性而引起了人们的广泛关注,特别是在抗寄生虫、抗肿瘤活性方面。因此,将金属化合物和poms进行组合开发新的抗菌药物是一个很好的选择。
技术实现要素:
本发明目的在于克服现有技术缺陷,提供一种无机有机杂化keggin型多金属氧酸盐复合物,该复合物将2–乙酰吡嗪缩氨基硫脲与pom自组装在一起,不仅增强了pom的稳定性和穿透能力,而且使其具有优异的抗菌性能,可在生物和食品工业以及其他应用领域发挥相当大的抗菌作用。
本发明还提供了上述无机有机杂化keggin型多金属氧酸盐复合物的制备方法及其在抗菌方面的应用。
为实现上述目的,本发明采用如下技术方案:
一种无机有机杂化keggin型多金属氧酸盐复合物,其化学式为:[co(l)2]3[pmo12o40],式中hl=2-乙酰吡嗪缩氨基硫脲;该复合物属于单斜晶系,c2/c空间群,晶胞参数为:a=29.1829(13)å,b=16.5031(7)å,c=18.9095(9)å,α=90°,β=103.465(1),γ=90°。
上述无机有机杂化keggin型多金属氧酸盐复合物的制备方法,其包括如下步骤:
将co(no3)2·6h2o、na2moo4·2h2o、edtmp(乙二胺四亚甲基膦酸)和2-乙酰吡嗪缩氨基硫脲溶解于溶剂中,调节ph值在2.5–3.0之间,然后在125-135℃下保持3-4天,冷却至室温,得到黑色晶体,即为无机有机杂化keggin型多金属氧酸盐复合物。
具体的,co(no3)2·6h2o、na2moo4·2h2o、edtmp和2-乙酰吡嗪缩氨基硫脲的质量比可以为0.17-0.19:0.46-0.50:0.30-0.36:0.095-0.10。
具体的,所述溶剂为甲醇和水的混合溶液,进一步优选的,所述溶剂由体积比为2:1的水和甲醇混合组成。
本发明提供了上述无机有机杂化keggin型多金属氧酸盐复合物在抗菌方面的应用,如可用作抗菌材料、抗菌试剂或制备抗菌药物。本发明复合物通过co(no3)2·6h2o、na2moo4、edtmp和hl自组装形成;co3+的正电荷可以和带负电荷的细胞壁/膜相互作用,复合物由静电作用连接,[co(l)2]+中的钴离子的极性降低,增强了复合物的亲脂性,使其能够穿透细胞的脂质膜,多酸阴离子具有较高的氧化还原性,各组分协同作用,实现了复合物优异的抗菌活性。
本发明将具有良好杀菌效果的2–乙酰吡嗪缩氨基硫脲化合物与具有较高氧化还原性、抗癌和抗微生物活性的pom结合形成一种新型复合物,该复合物将2–乙酰吡嗪缩氨基硫脲与pom自组装在一起,不仅增强了pom的稳定性和穿透能力,而且使其具有优异的抗菌性能,所获得的复合物在生物和食品工业以及其他应用领域能发挥相当大的抗菌作用。同时,本发明对目标复合物进行了其最小抑菌浓度的研究,分别对革兰氏阴性大肠杆菌和革兰氏阳性金黄色葡萄球菌两种细菌的抗菌性能进行了评价,同时对其作用机制进行了探究。和现有技术相比,本发明具有如下有益效果:
1)本发明通过x-射线单晶衍射准确地了解复合物的结构特征,通过紫外分光光度计测定复合物在溶液中有较强的稳定性;
2)本发明复合物的mic值较低。该复合物的最低抑菌浓度低于抗生素(三水阿莫西林和硫酸卡那霉素)的最低抑菌浓度;
3)本发明复合物杀菌效果好。由于复合物的各组分协同作用,使得复合物具有有效的抗菌活性,有望成为具有高效性和经济性等特点的抗菌材料、抗菌试剂或制备抗菌药物,同时对其作用机制进行了探究,并阐明了该复合物可能的作用机理。
本文发明围绕严重的细菌感染,可能威胁人类健康和动植物的生长的问题,开发了一例具有优良抗菌能力的复合物,该复合物不仅具有比抗生素还低的最低抑菌浓度(mic),而且在一定浓度下可以完全杀死大肠杆菌和金黄色葡萄球菌。该复合物的合成路线为:co2++na2moo4+hl→[co(l)2]3[pmo12o40],其中hl=2–乙酰吡嗪缩氨基硫脲。本发明复合物具有优异抗菌性能的原因是:(1)带正电荷的钴离子容易与带负电荷的细菌细胞壁接触,通过静电相互作用破坏细菌细胞壁;(2)[pmo12o40]3–可能作用于细菌细胞的内部或内膜相关的酶/蛋白,从而干扰细菌细胞壁/膜的成分;(3)[pmo12o40]3–具有较高的氧化还原性,可通过氧化一些重要的电子载体(烟酰胺腺嘌呤二核苷酸,黄嘌呤二核苷酸,还原)来干扰细菌的呼吸链,从而影响atp的产生,导致ros的升高;(4)由于co3+的正电荷与配体供体基团的部分共享,钴离子的极性降低,增强了复合物的亲脂性,使其能够穿透细胞的脂质膜,阻断细菌酶中的金属结合位点。总之,复合物各组分之间的协同作用使其具有优异的杀菌效果。
附图说明
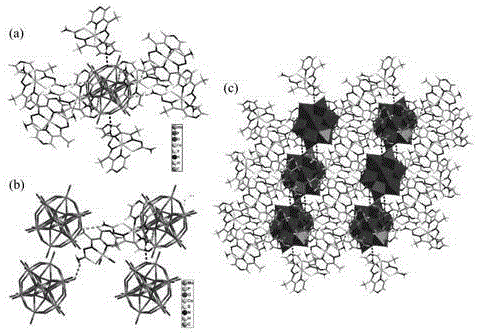
图1为本发明复合物的不对称结构图;
图2为本发明复合物中,[pmo12o40]3–(a)和[co(l)2]+(b)的氢键连接方式,复合物的2d层状结构(c);
图3为本发明复合物的ir图;
图4为本发明复合物在不同ph溶液中的稳定性:(a)ph在1‒5之间测定的谱图,(b)ph值在5‒10之间测定的谱图测定;
图5为本发明复合物的xps总谱图(a)和co2pxps谱图(b);
图6为本发明复合物的sem图像(1a,1b)及对应的co(1c)、mo(1d)和p(1e)元素mappings图;
图7为本发明复合物的xrd图;
图8为使用琼脂板扩散法co离子(a1‒a3)、hl(b1‒b3)、pmo12(c1‒c3)和复合物(d1‒d3)对e.coli的抑菌实验照片;
图9为本发明复合物对e.coli的时间杀伤图片(每组实验进行3次,a1‒a3从上往下依次为对照组,反应2小时后,反应4小时后,反应6小时后);
图10为本发明复合物对s.albus的时间杀伤图片(每组实验进行3次,b1‒b3从上往下依次为对照组,反应2小时后,反应4小时后);
图11为原菌(a)和经过为本发明复合物处理过的e.colisem图(b);
图12为细菌细胞膜完整性(a),呼吸链脱氢酶活性(b),细菌细胞胞内ros(c)和ellman’s法测定硫醇的结果;
图13为本发明复合物对e.coli作用的可能机制示意图。
具体实施方式
以下结合实施例对本发明的技术方案作进一步地详细介绍,但本发明的保护范围并不局限于此。
本发明中,2-乙酰吡嗪缩氨基硫脲为已知化合物,其制备方法具体可参见文献(cytotoxicityandstructure–activityrelationshipsoffoura-n-heterocyclicthiosemicarbazonederivativescrystalstructureof2-acetylpyrazinethiosemicarbazone,ming-xueli,chun-lingchen,chun-shengling,jingzhou,bian-shengji,yan-juanwu,jing-yangniu,bioorg.med.chem.lett.19(2009)2704–2706)进行。
实施例1
一种无机有机杂化keggin型多金属氧酸盐复合物的制备方法,其包括如下步骤:
将co(no3)2·6h2o(0.189g,1.3mmol)、na2moo4·2h2o(0.48g,2.0mmol)、edtmp(0.35g,0.8mmol)和2-乙酰吡嗪缩氨基硫脲(0.097g,0.5mmol)加入盛有60ml水和甲醇(体积比2:1)的混合溶剂中,搅拌40分钟至溶解完全,用稀盐酸调节ph值范围在2.5–3.0之间,然后转入反应瓶中,放入聚四氟乙烯内衬中在130℃下保持3天,冷却至室温,水洗、晾干得到黑色四边形晶体,即为复合物。
上述无机有机杂化keggin型多金属氧酸盐属于单斜晶系,c2/c空间群,其晶胞参数为:a=29.1829(13)å,b=16.5031(7)å,c=18.9095(9)å,α=90°,β=103.465(1),γ=90°。
以下,将上述实施例1制备得到的复合物进行相应的结构表征和抗菌性能测试。
x射线单晶衍射的分析结果表明,复合物的不对称单元由三个[co(l)2]+和一个keggin[pmo12o40]3–阴离子组成。co3+和两个l–(两个s原子和四个n原子)可以形成扭曲的八面体几何结构(见图1)。n14和s3原子位于轴向位置,而n8、n9、n13、s2原子处于赤道位置。(co1–s1–c1–n2–n3)···(co1–n3–n4–c2–c4),(co2–s3–c15–n12–n13)···(co2–n13–c16–c18–n14)和(co2–s2–c8–n7–n8)···(co2–n8–c9–c11–n9)这三个二面角大约分别为1.27°、0.91°和0.88°。co–n和co–s的距离分别约为1.887–1.961a和2.218–2.228å。n–co–s、n–co–n和s–co–s的角度分别为86.15(2)–168.95(2)°、82.43(2)–179.2(1)°和90.88(1)–91.76(1)°。keggin[pmo12o40]3–阴离子含有杂原子和配原子,杂原子{po4}呈四面体构型,配原子{moo6和wo6}呈八面体构型,每3个八面体共边相连形成三金属簇{m3o10},keggin结构中含有4个三金属簇,这些三金属簇与杂原子和氧形成的四面体之间共角相连。
此外,在复合物中还观察到(n11–h11a···o21、n11–h11b···o3、n6–h6a···o10、n1–h1b···o11)四种h键相互作用。一个[pmo12o40]3–阴离子与8个[co(l)2]+阳离子连接(图2a)。一个[co(l)2]+阳离子与四个[pmo12o40]3–连接(图2b)。在[co(l)2]+和[pmo12o40]3–单元间的h键相互作用可以构造2d层状结构(图2c)。
复合物的红外光谱如图3所示,在3341–3187cm–1和1600–1437cm–1区域的峰分别归属于l–的ν(n–h)和ν(c=n)振动吸收峰,1153–1061cm–1处的特征峰归属于ν(p–oa),在958、873和802cm-1处分别为ν(mo–od),ν(mo–ob–mo)和ν(mo–oc–mo)的特征峰,进一步证明了复合物被成功制备。
如图4,复合物在200–500nm显示三个特征峰。在230和315nm处的峰主要是由od→mo和ob,oc→mo的电荷转移跃迁引起的。在383nm处的弱吸收可能是由lmct的跃迁引起的。为了研究复合物在不同ph水溶液中的稳定性,用紫外-可见光谱法对复合物进行了详细的研究。用稀释的hcl和naoh溶液将ph值分别调整为酸性方向和碱性方向。复合物的初始ph值为5.0,在ph为9.0时,230nm处的带变得更弱,这表明pom骨架的分解。因此,在1.0‒9.0的ph范围内,复合物在水溶液中是稳定的。
复合物的xps谱图如图5a所示,xps光谱表明了co、o、n、c、mo和s元素在复合物中共存。co2p的xps光谱如图5b所示,在780.2(2p3/2)、795.3(2p1/2)处有明显的信号峰,与co3+的一致。co2pxps光谱的卫星峰不存在或很弱,进一步表明存在八面体配位的co3+离子。
如图6所示,复合物的形貌用sem进行表征,显示呈四边形结构(图6中的1a和1b)。复合物的宽度大约为106–161µm,长度约为118–168µm。在同一微米区域采集co(红色)、mo(绿色)和p(黄色)的元素映射(图6中的1c、1d和1e),结果表明元素分布均匀,进一步证明了复合物的形成。
如图7所示,用xrd光谱证明了复合物的纯度。通过对相应衍射峰位置的比较,可以看出合成的晶体和晶体模拟的xrd峰吻合良好,表明所合成的化合物具有良好的纯度。
实施例2
抗菌效果评价方法1圆盘扩散法:
以dmso为空白对照组,通过琼脂平板进行试验,对该材料的抗菌活性进行了研究。在试验前,将复合物用dmso按梯度(1mg/ml,0.5mg/ml,0.25mg/ml,0.125mg/ml,0.0625mg/ml,0.03125mg/ml…)进行稀释。所有测试过程中使用的材料被进行高压灭菌,营养琼脂板(na)被紫外线辐射消毒1小时。将107cfu/ml的金黄色葡萄球菌(s.aureus)、枯草芽孢杆菌(b.subtilis)以及106cfu/ml的大肠杆菌(e.coli)和根瘤农杆菌(a.tumefaciens)的新鲜菌液分别均匀涂布在营养琼脂(na)平板上,再进行打孔,将配置好的复合物依次吸入琼脂板孔中,再进行封膜,将培养物在37℃培养16小时,最后,测量所有样品的抑菌圈大小(zoi),并记录光学图像。试验以三水阿莫西林(am)和硫酸卡那霉素(kan)作为标准参比药物,同时对革兰氏阴性菌(e.coli、a.tumefaciens)和革兰氏阳性菌(s.aureus、b.subtilis)的抗菌性能进行了评价。结果见图8和表1。
抑菌实验的部分照片如图8所示,表1列出了hl、co(no3)2·6h2o、h3[pmo12o40](pmo12)和复合物的mic值。
表1复合物的体外抗菌活性
如表1所示,hl和pmo12的mic值低于co(no3)2·6h2o的mic值,复合物的mic值比其各组分的mic值都低,并且低于参比药物(am和kan)的值。复合物对金黄色葡萄球菌的mic值为0.48×10–3µm,其mic值约为参比药物的500‒1000倍。实验结果表明,本发明复合物具有潜在的应用价值。
实施例3
时间杀伤实验评价2菌落形成单元(cfu)法:
采用平板涂布培养法研究了该复合物的杀菌能力。将大肠杆菌和金黄色葡萄球菌溶液连续稀释至105cfu/ml,以及制备1mg/ml的复合物溶液。等体积接种菌液和复合物溶液在37℃下孵育不同的时间,没有复合物存在的菌液作为对照实验,其培养不同时间的混合液均匀涂布在营养琼脂(na)平板上,每次测定重复三次,在37℃恒温培养箱中培养16小时。实验持续到几乎观察不到菌落。实验结果显示如图9和10。细菌细胞存活率(%)=(实验组菌落数/对照组菌落数)×100%。
图9和图10分别给出了本发明复合物对e.coli和s.albus的时间杀伤图片。如图9和10所示,在没有复合物存在下,菌落几乎长满整个琼脂板,但随着复合物与大肠杆菌和金黄色葡萄球菌培养时间的增长,菌落数逐渐降低。当复合物和大肠杆菌共同培养6小时后琼脂板上几乎无大肠杆菌菌落存在(图9),复合物和金黄色葡萄球菌共同培养4小时后琼脂板上几乎无金黄色葡萄球菌菌落存在(图10),说明了复合物对细菌具有较强的抗菌活性并且可以完全杀死大肠杆菌和金黄色葡萄球菌。
实施例4
细菌细胞膜完整性评价:
通过检测细胞内各组分的释放,来评估细菌细胞膜的完整性,以260nm处的光密度值(od260nm)作为细菌细胞膜受损的指标。细菌样品在37℃下培养12h,5000rpm/min离心5min收集细菌,之后再将收集的细菌悬浮于0.75%nacl溶液中,调节溶液体积,使其在600nm处的光密度值为0.5。然后将得到的细菌悬浮液与复合物(4mg)混合在一起并在室温条件下共孵育15min作为实验组,单独将细菌悬浮液(无复合物存在)在相同条件下孵育相同的时间作为对照组。用0.22µm微孔滤膜对菌悬浮液进行过滤,以除去细菌及其它杂质。用紫外-可见分光光度计记录260nm处的光密度值。
抗菌试剂一般会对膜造成严重的损伤,导致低分子质量物种(dna,rna,k+,po42–等)的泄漏。在260nm处可检测到dna和rna的释放。因此,以260nm测定作为细菌膜损伤的标准。如图12a所示,对照组(0.033±0.0002)孵育15分钟后变化不明显,但复合物处理组(0.27±0.0002)的od260nm远高于对照组。实验结果表明,复合物可对细胞膜造成严重损伤。
实施例5
扫描电镜观察复合物-细菌相互作用:
使用扫描电子显微镜(sem)监测细菌与复合物的相互作用。采用冷冻干燥法对菌体进行处理,制取电镜样品。取大量大肠杆菌菌体样品离心(转速3500rpm/min),去除上清液,然后在菌液中加入复合物(4mg)作用8小时,离心去除复合物,用4%戊二醛固定菌样2–4h。pbs(0.1m,ph=7.2–7.4)清洗3次,每次15min,清洗时菌体温柔悬浮,离心,去除上清液,50%、70%、80%、90%、95%、100%的乙醇对细菌样品进行脱水,每次15min,然后样品充分冷冻干燥后,粘附到贴好导电胶带的样品台上,使用扫描电子显微镜(jsm-7610f)观察细菌的形态。
为了直观地验证复合物的抗菌能力,用扫描电镜观察了大肠杆菌细胞形态的变化,具体如图11a所示,大肠杆菌表面光滑,细胞未受损。然而,在复合物的存在下,如图11b一些大肠杆菌细胞似乎严重起皱、孔洞和塌陷。结果表明,复合物会破坏细胞膜的完整性。扫描电镜图像与细胞膜完整性检测数据一致,表明复合物能明显杀死细菌。
实施例6
蛋白质渗漏实验评价:
细菌细胞壁/膜完整性的破坏会导致细胞内蛋白质从细胞中释放出来。因此,蛋白质的渗漏可以作为细胞壁/膜完整性破坏的一个指标。将大肠杆菌细菌悬浮液(108cfu/ml)加入复合物(4mg)并在锥形瓶中孵育75min作为实验组,无复合物存在的情况下作为对照组。每15min取1ml细菌悬浮液移至ep管内,并加入5ml考马斯亮蓝溶液(0.1mg/ml)。然后摇匀,反应2min。测定595nm处混合溶液的光密度值。
在595nm处也能检测到大肠杆菌的蛋白质泄漏。如表2所示,复合物处理组在15、30、45分钟后逐渐升高,60分钟后稳定。因此,可以证明复合物明显增强了对细菌细胞膜的穿透性。实验结果表明,复合物可对细胞膜造成严重损伤。
表2细菌培养15、30、45、60和75min后细胞内蛋白质渗漏量变化(od595nm)
实施例7
呼吸链脱氢酶活性评价:
三磷酸腺苷(atp)是细胞内能量转移、储存和转移化学能的“能量货币”。线粒体中的atp连接酶是合成atp的最典型途径。然而,呼吸链(电子传递链)的正常运行在atp的产生过程中起着重要的作用。因此,研究了电子传递链脱氢酶的活性。在活细胞中,细菌呼吸链脱氢酶可将无色的int还原为一种深红色不溶于水的inf,从而将水溶性int还原成脂溶性inf并产生颜色变化。因此,用有机溶剂提取inf,490nm处可测定呼吸链脱氢酶活性。具体如下:
呼吸链脱氢酶活性依据碘硝基四唑氯化铵法测定,在生理条件下,细菌呼吸链脱氢酶可将无色碘硝基四唑氯化铵(int)还原为一种深红色不溶于水的碘硝基四唑甲醛(inf)。因此,可以通过改变inf的光密度值来测定呼吸链脱氢酶的活性。108cfu/ml的大肠杆菌细菌悬浮液作为标准菌样。在菌液中加入复合物(4mg)作为实验组,以没有添加复合物的菌液作为对照实验。以煮沸20min的菌液作为阴性对照(–),阴性对照组细菌细胞中的酶活性处于完全失活状态,而将未煮沸的菌液作为阳性对照(+),阳性对照中细菌细胞的酶活性则维持天然活性。将0.1ml(0.5%)的int溶液滴入上述悬浮液中,并在37℃黑暗条件下培养15min。随后加入50μl甲醛使反应停止。对混合悬浮液进行离心,收集细菌。在此基础上,用250μl丙酮和乙醇(1:1)的溶液两次提取inf。将两次收集的上清液合并,用紫外-可见分光光度计测定inf在490nm处的最大光密度值。结果见图12。
如图12b所示,对照组(正常细胞)在15分钟后酶活性显著升高,而阴性对照组(–)(煮沸20分钟)几乎保持稳定。经复合物处理后的大肠杆菌呼吸链脱氢酶活性明显降低。结果表明,复合物对呼吸链脱氢酶活性有抑制作用。复合物的某些成分可能穿透细胞外膜、肽聚糖和细胞质屏障,破坏细菌细胞的呼吸链脱氢酶,进而抑制细胞呼吸。
实施例8
细胞内活性氧(ros)的评价:
呼吸链损伤可导致ros水平的提高。抗菌试剂可以通过氧化蛋白质、脂质等直接产生ros。在正常情况下,细胞内ros的产生和消除处于动态平衡状态。一旦这种平衡被打破,它可能会引起一系列变化。因此,为了进一步了解复合物的抗菌机制,测定了细菌细胞内ros的水平。在•o2–(一种ros)的作用下,nbt可还原为蓝紫甲醛。用nbt还原法测定575nm处蓝紫甲醛的吸光度。
细菌细胞内ros的水平采用硝基苯蓝四氮唑(nbt)还原法测定。具体为:向1ml大肠杆菌悬液(108cfu/ml)中加入复合物(4mg)并在37℃下培养15min作为实验组,在相同条件下没有添加复合物作为对照组。随后,将4mlnbt溶液(1mg/ml)滴入上述溶液中,并在37℃下孵育30min。加入0.4mlhcl(0.1mol/l)终止反应。然后,将反应后的悬浮液以5000rpm/min的速度离心10min,除去上清液,收集细菌。用1ml二甲基亚砜(dmso)处理细胞,提取还原后的nbt。最后,对提取液进行稀释,并用紫外-可见分光光度计测定575nm处细胞中蓝紫甲醛的吸光度值。结果见图12。
如图12c所示,对照组的大肠杆菌细胞(未经处理的细胞)在15分钟后仍保持稳定的ros水平,但在复合物存在下,大肠杆菌的ros明显成倍增加。因此,实验结果表明复合物会导致ros的产生,如果生成的这些ros不能及时丢弃,就会导致ros的积累。现有文献研究表明,细胞内的ros可导致细菌细胞内的dna链断裂和脂质过氧化物,如果不及时处理累积的ros,一些细菌的酶活性会降低,并且过量的ros还会引起一系列氧化应激反应,最终导致细菌细胞死亡。
实施例9
gsh参与细胞保护系统,可防止氧化应激对细胞的损伤。抗菌试剂可以与细胞内gsh的–sh相互作用,并将–sh转化为二硫键(–s–s–),从而将gsh转化为谷胱甘肽二硫(gssg)。氧化的gsh可引起多余的ros的产生,从而抑制细菌的生长。因此,gsh已被用作细胞内氧化应激的指标。用ellman法可以定量测定gsh中–sh的含量。
ellman法评价:用ellman法测定谷胱甘肽中硫醇的含量。以ph=8.6碳酸氢盐缓冲液作为反应溶液,所有样品一式三份,将复合物(4mg)加入1ml谷胱甘肽(gsh)(0.8mm)中以诱导氧化作为实验组,以不添加复合物的溶液作为阴性对照组(-),以加入1mlh2o2(1mm)的溶液作为阳性对照组(+)。将混合溶液转移到ep管中,用铝箔覆盖,以防止光照,然后放置在摇床中,室温转速为150rpm/min条件下孵育15min。随后,将3.5mltris-hcl(0.05m)和0.7mldtnb(0.1m)(ellman试剂,5,5-二硫代-双(2-硝基苯甲酸),阿拉丁)(5:1)加入上述溶液中,得到黄色产物。用0.22µm微孔滤膜过滤混合物,用紫外-可见分光光度计记录412nm处的光密度值。根据以下公式计算gsh损失量:gsh%=(odcontrol(–)–odsample)/odcontrol(–)×100%。所有实验均在三次独立实验以获得有统计学意义的结果。结果见图12。
如图12d所示,阳性对照组(+)(h2o2)引起的gsh损失约为83.5%,经复合物处理15分钟后gsh损失70.2%。这些实验结果表明,复合物直接将gsh转化为gssg或诱导ros的形成,然后将gsh转化为gssg。最终,gsh的耗竭也是细菌细胞损伤的原因。
如图13给出了复合物的可能机理图。复合物中带正电荷的co3+容易与带负电荷的细菌细胞壁接触,通过静电相互作用破坏细菌细胞壁,导致细胞内物质的泄漏。[pmo12o40]3–可能作用于细菌细胞的内部或内膜相关的酶/蛋白,从而干扰细菌细胞壁/膜的成分。此外,[pmo12o40]3–具有较高的氧化还原性,可通过氧化一些重要的电子载体(烟酰胺腺嘌呤二核苷酸,黄嘌呤二核苷酸)来干扰细菌的呼吸链,从而影响atp的产生。呼吸链的破坏可能导致ros的增强。pom还可以通过直接氧化蛋白质、脂质来产生ros。pom可以氧化gsh,导致过量的ros的产生,最终导致gsh的耗尽。对于[co(l)2]+,由于配体轨道的重叠和co3+与配体供体基团部分共享,钴离子的极性降低。这可能增强[co(l)2]+的亲脂性,使其能够穿透细胞的脂质膜,阻断细菌酶中的金属结合位点,并更有效地杀死它们。总的来说,复合物的抗菌作用可能是由于几种组分的多重相互作用所致。
- 还没有人留言评论。精彩留言会获得点赞!