发根农杆菌介导南瓜根系转化方法及基因编辑方法与流程
本发明涉及植物
技术领域:
,尤其涉及一种发根农杆菌介导南瓜根系转化方法及基因编辑方法。
背景技术:
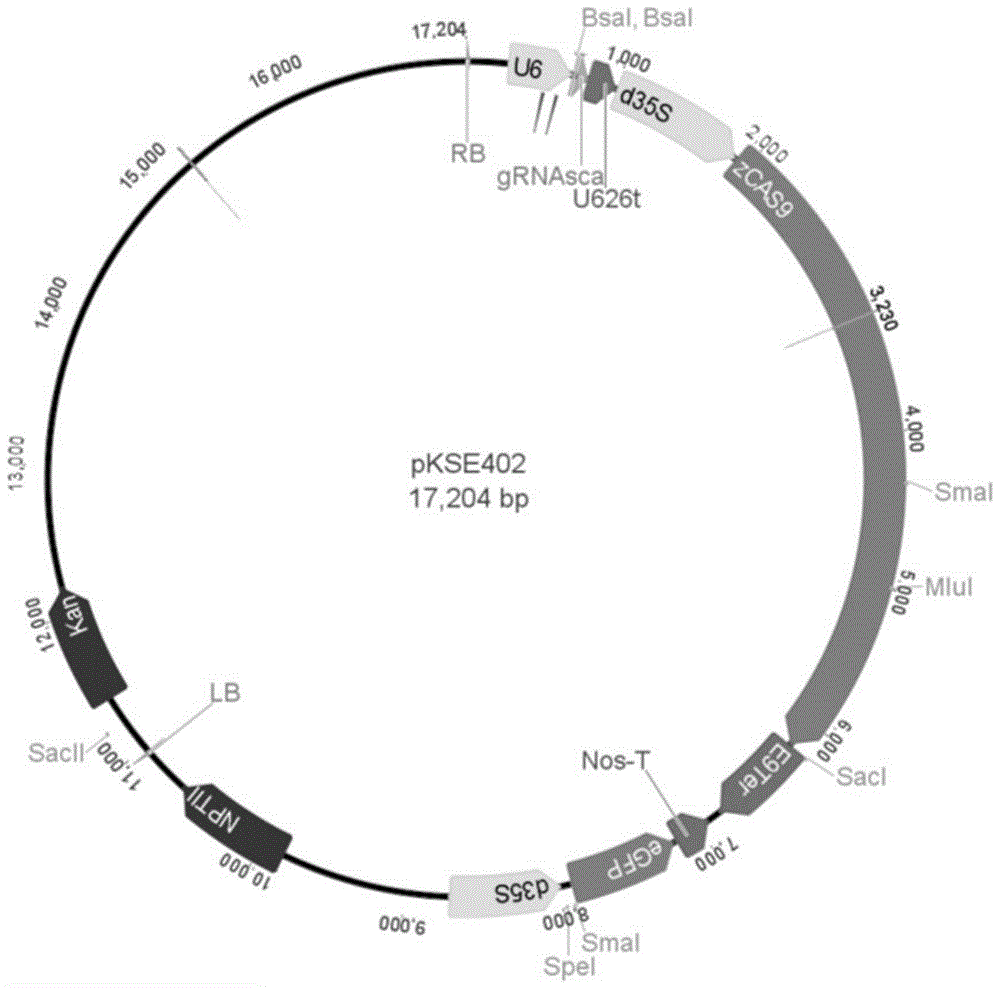
:葫芦科是世界上最重要的食用植物科之一,包括黄瓜、南瓜、丝瓜、西瓜等常见的蔬菜和瓜果。其中,南瓜的果实、幼嫩茎叶、花都可食用,营养价值高,具有一定保健功能。同时南瓜具有耐贫瘠、抗逆性好等优势,还可用作西瓜、甜瓜、黄瓜等其它葫芦科作物的砧木,解决连作障碍等问题。然而,目前并没有针对南瓜根系转化的报道,不利于推进南瓜分子生物学和基因功能的研究。技术实现要素:基于此,有必要提供一种发根农杆菌介导南瓜根系转化方法及基因编辑方法,首次实现南瓜根系转化,并有利于促进对南瓜进行分子生物学和基因功能研究。本发明解决上述技术问题的技术方案如下:本发明提供一种发根农杆菌介导南瓜根系转化方法,包括如下步骤:获取含子叶基部和胚轴连接区段的外植体;采用含发根农杆菌ar-qual的侵染液浸润外植体,并将浸润后的外植体置于共培养培养基中,于23±2℃、黑暗条件下共培养,浸染,得侵染后的外植体;将侵染后的外植体转移至生根培养基中,于光强100±10μmol/m2/s2、光周期14±0.5h/10±0.5h、温度25±3℃条件下培养8-10天,挑出生根外植体并去除其上的第一批新生根系,再置于新鲜生根培养基中和相同外在环境条件下继续培养至第二批新生根系生长,得具有转化根系的南瓜组培苗。优选地,所述共培养培养基为含100μm乙酰丁香酮、3%蔗糖和0.7%琼脂的ms培养基;所述生根培养基为含1%蔗糖、200mg/ltmt和0.3%植物凝胶的ms培养基。在其中一个实施例中,所述的发根农杆菌介导南瓜根系转化方法还包括对南瓜组培苗进行炼苗的步骤:将具有转化根系的南瓜组培苗定植于装有灭菌河沙并用透明塑料罩密封的穴盘中,于光强100±10μmol/m2/s2、光周期14±0.5h/10±0.5h、温度25±3℃条件继续培养3-5天,通风,继续培养,得具有转化根系的健壮南瓜苗。在其中一个实施例中,获取含子叶基部和胚轴连接区段的外植体的步骤为:选取饱满南瓜种子灭菌,再置于添加有含蔗糖的1/2ms培养基的组培瓶中,于28±5℃条件下催芽至胚轴伸长,再在光照条件下培养至子叶转为绿色,取出,切割。在其中一个实施例中选取饱满南瓜种子灭菌的步骤为:将南瓜种子置于55±5℃热水中浸泡2-4h,去种壳,次氯酸钠溶液消毒种子,无菌水冲洗,获得与种皮分离的种仁。进一步地,所述发根农杆菌ar-qual还含携带gus和gfp两套标记基因的载体pcambia1305.4。本发明还提供一种南瓜根系基因编辑方法,包括如下步骤:利用含cas9蛋白、sgrna表达框的载体pkse402制备含sgrna序列的基因编辑载体,转化大肠杆菌,抽提阳性菌株的pkse402质粒;构建含pkse402质粒的发根农杆菌ar-qual;按照上述所述的发根农杆菌介导南瓜根系转化方法进行南瓜根系转化,获得具有基因编辑根系的南瓜苗。优选地,sgrna序列为针对cmoch01g014300.1、cmoch14g010850.1、cmoch10g011690.1的nacsgrna、rbohsgrna或nhxsgrna。在其中一个实施例中,所述nacsgrna所对应的酶切连接体系用引物对序列分别如seqidno.1和seqidno.2所示;所述rbohsgrna所对应的酶切连接体系用引物对序列分别如seqidno.3和seqidno.4所示;所述nhxsgrna所对应的酶切连接体系用引物对序列分别如seqidno.5和seqidno.6所示。在其中一个实施例中,在所述的南瓜根系基因编辑方法中,还包括对采用含nacsgrna的基因编辑载体编辑获得南瓜苗鉴定所采用的pcr引物对分别如下seqidno.12和seqidno.13所示;对采用含rbohsgrna的基因编辑载体编辑获得南瓜苗鉴定所采用的pcr引物对分别如下seqidno.14和seqidno.15所示。对采用含nhxsgrna的基因编辑载体编辑获得南瓜苗鉴定所采用的pcr引物对分别如下seqidno.16和seqidno.17所示。本发明的有益效果是:本发明通过筛选特定工艺条件首次实现利用发根农杆菌介导南瓜根系转化,并实现对转化根系的基因编辑,便于促进对南瓜进行分子生物学和基因功能研究。附图说明图1载体pkse402的图谱;图2载体pcambia1305.4的图谱;图3为实施例3中南瓜发根体系组培关键节点图;图4为实施例3南瓜苗根系的检测图,其中,a图为gfp荧光对比检测图,c图为gus基因的表达,b图为gus染色图;图5为实施例4的南瓜苗根系基因编辑检测图。具体实施方式以下对本发明进行举例描述,所举实例只用于解释本发明,并非用于限定本发明的范围。除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的
技术领域:
的技术人员通常理解的含义相同。材料来源用于基因编辑的载体pkse402,来自于中国农科院黄三文课题组,图谱如图1所示,含有cas9蛋白和sgrna表达框,在pkse401基础上改造,插入egfp,当载体成功转入植物细胞时egfp序列会表达翻译产生绿色荧光蛋白,在荧光显微镜可以看到egfp发出的荧光,进而可以在活体和不伤害植株的情况下看到egfp的发光情况、筛选到转化成功的细胞系或植株。该载体可向社会公众提供20年。用于基因过表达的载体pcambia1305.4,来自于中国农科院黄三文课题组,图谱如图2所示,含有利用35s启动子驱动的gus和gfp两套标记基因,该载体可用于发根系统的外源基因过表达,作为筛选转化成功的细胞系或植株。该载体可向社会公众提供20年。供试材料为“青研”南瓜砧木。发根农杆菌ar-qual,购自上海,唯地生物。大肠杆菌trans5α,购自北京,全式金。实施例1本实施例提供一种含pcambia1305.4的发根农杆菌ar-qual菌株,其构建方法参考ar-qual使用说明书,转化方法为液氮冻融法,转化成功的发根农杆菌ar-qual菌株置于-80℃条件下保存。实施例2本实施例提供一种含基因编辑载体的发根农杆菌ar-qual菌株的构建方法,包括如下步骤:s1,分别针对基因idcmoch10g011690.1、cmoch14g010850.1和cmoch01g014300.1,从葫芦科基因组数据库上(http://cucurbitgenomics.org/)下载各目的基因基因组序列,然后将序列提交到geneious软件上,标出外显子、内含子,选择基因组文件,运行程序,得到sgrna序列集合,选择位于外显子上且得分最高的sgrna序列。根据该序列设计获得如下表1所示的sgrna引物对:表1sgrna引物对序列送各sgrna引物对至引物合成公司(北京,擎科)合成。将合成的引物对进行退火,按照下表2配置引物退火反应体系:表2反应体系成分浓度体积sgrna-f100μm1.5μlsgrna-r100μm1.5μl10xnebbuffer3.15μlddh20-42μl将混匀的反应液置于95℃热水中自然冷却至室温,得退火引物。s3,退火完成后,按照如下表3所示的反应体系和下表4所示的反应程序进行载体连接,获得连接产物:表3酶切连接体系退火引物1μl载体pkse402(200ng)1μl10xnebt4buffer1μl10xbsa1μlbsai(neb)1μlt4ligase(neb)1μlddh204μl总体积10μl表4反应程序反应温度反应时间37℃5h50℃5min80℃10mins4,将各连接产物分别转化大肠杆菌trans5α(北京,全式金)。具体操作参考trans5α使用说明书,待长出单克隆后进行菌落pcr鉴定(鉴定引物u626-idf:tgtcccaggattagaatgattaggc(seqinno.7)和相应sgrna-r序列。将鉴定结果为阳性的菌液送到测序公司进行测序分析,对测序结果正确的菌株进行培养和质粒抽提。s5,将含nacsgrna、rbohsgrna、nhxsgrna的pkse402质粒分别转化发根农杆菌ar-qual(上海,唯地生物),转化方法为液氮冻融法,具体操作参考ar-qual使用说明书,分别获得含nacsgrna单基因编辑载体的发根农杆菌ar-qual菌株、含rbohsgrna单基因编辑载体的发根农杆菌ar-qual菌株和含nhxsgrna单基因编辑载体的发根农杆菌ar-qual菌株。实施例3如图3所示,本实施例提供一种发根农杆菌介导南瓜根系转化方法,包括如下步骤:(1)选取饱满南瓜种子灭菌:挑选饱满健康的南瓜种子,置于55℃热水中浸泡2-4h,然后用清水冲洗干净,去种壳,而后转移至超净工作台中操作,将去完种壳的种子转移至灭菌的三角瓶中,加入75%的酒精消毒1min,而后倒掉酒精,用灭菌ddh2o冲洗种子一遍,倒掉灭菌水,再用0.3%次氯酸钠(现配现用)溶液消毒种子,无菌水冲洗使种皮与种仁完全分离,倒掉水分,获得与种皮分离的种仁。(2)获取含子叶基部和胚轴连接区段的外植体如图3(a)-(e)所示,将灭菌完成的种仁转入添加有固体培养基(含蔗糖的1/2ms培养基)的组培瓶中,每瓶8-10株,盖好盖子,将组培瓶转移至28℃培养箱中暗培养3-5天,再转移至组培室(培养环境:光强100μmol/m2/s2,光周期14h/10h,温度25℃)中培养2-3天,子叶转为绿色。再将组培瓶转移至超净工作台,利用灭菌后的手术刀将南瓜小苗从子叶节基部切离组培瓶,转移至垫有灭菌滤纸的培养皿中进一步切割,去除大部分子叶,仅保留基部三分之一子叶,去除大部分胚轴,仅保留0.3-0.5cm长度的胚轴,取出,得含子叶基部和胚轴连接区段的外植体。将外植体转移至侵染液(含100μm乙酰丁香酮和3%蔗糖的ms培养基)中保湿。(3)侵染外植体将实施例1含pcambia1305.4的发根农杆菌ar-qual菌株放在冰上融化,然后取出100μl加入到含有50ml新鲜ty培养基(添加50mg/l卡那霉素和25mg/l庆大霉素)的锥形瓶中,密封。将密封好的锥形瓶转移到摇床上过夜培养,条件为:200rpm/min,28℃。当菌液浑浊时,取出部分菌液用分光光度计测量菌液浓度(od600值),根据菌液浓度和侵染液的总体积计算加入菌液的体积,保持侵染液的od600值约为0.05。加入外植体到侵染液中,密封。将密封好的锥形瓶转移到摇床上浸染20min,条件为:200rpm/min,28℃。而后倒掉浸染液,将外植体转移至垫有两层灭菌滤纸的共培养培养基(含100μm乙酰丁香酮、3%蔗糖和0.7%琼脂的ms培养基)中,于23℃、黑暗条件下共培养2天,共培养完成后将外植体转移至灭菌锥形瓶,用灭菌水冲洗5次,倒掉水分,然后用灭菌滤纸将外植体上的水分吸干,侵染完成,得染菌外植体。如图3(f)-(i)所示,将吸干水分的染菌外植体转移至生根培养基(含1%蔗糖、200mg/ltmt和0.3%植物凝胶的ms培养基)中,胚轴向下插入,于光强100±10μmol/m2/s2、光周期14±0.5h/10±0.5h、温度25℃条件下培养8-10天,观察胚轴部位根系生长情况,将已经生根的外植体挑出,利用灭菌的镊子将所有第一批长出的根系(简称“第一批新生根系”)全部去除。该步骤为关键步骤,第一批长出根系绝大数为假阳性根系,去除完成后可以促进转化根系的生长。再将外植体的胚轴向下重新插入新鲜生根培养基中,于相同外在环境条件下继续培养8-10天,期间利用体视荧光显微镜观察组培瓶中带有gfp荧光根系的生长情况,当转化根系生长至1-2cm左右后,打开组培瓶,炼苗,得含转化根系的组培苗,并为组培苗转移至基质中栽培做准备。(4)南瓜组培苗根系培养将含转化根系的组培苗从固体培养基中轻轻取出,切勿弄断根系,然后转移至水龙头下用清水冲洗根系,去掉黏在根系的琼脂块,然后将洗净的组培苗转移至体视显微镜下,如图4a所示,用剪刀剪掉不发荧光的根系,保留有绿色荧光的根系,得修剪后的南瓜转化苗。取灭菌后的河沙加水拌湿,然后将河沙装到穴盘中,保持松散状态切勿挤压过紧,然后将有修剪后的南瓜转化苗定植到河沙中,并用透明的塑料罩将穴盘密封,保持前期的高温高湿状态,将定植好的南瓜苗转移至人工气候室(光强100μmol/m2/s2,光周期14h/10h,温度25℃)培养,3-5天后,逐渐打开通气孔进行通风,一周后,揭掉塑料罩,开始正常培养。移栽2周左右,待种苗生长较为健壮后,可以将种苗从沙土中拔出,对转化根系的生长情况进行检查,获取具有生长良好的转化pcambia1305.4南瓜苗根系。(5)对转化pcambia1305.4南瓜植株根系的检测挑选生长良好的南瓜转化苗,并将其从基质中移出,然后在水龙头下将根系沙土完全冲洗干净,全部过程中避免弄伤根系,利用体式荧光显微镜检查根系gfp发光情况,挑选具有良好发光根系的南瓜苗用一份用作于gus染色,一份用于提取rna进行反转录得到cdna,以cdna为模板,进行pcr鉴定。pcr鉴定以gus基因为检测基因和以南瓜actin作为内参,引物序列如下:gusq-f:5’-aggtggttgcaactggacaa-3’(seqidno.8)gusq-r:5’-cgcaagtccgcatcttcatg-3’(seqidno.9)actin-f:5’-ctggactctggtgatggtgt-3’(seqidno.10)actin-r:5’-cgttcagcagtggttgtgaa-3’(seqidno.11)pcr鉴定结果见图4c,表明南瓜苗根系成功导入gus基因。进一步进行根系gus染色。首先在50ml离心管中加入20ml染色液,而后将南瓜苗根系从茎基部切下,用吸水纸将根系多余的水份吸干后放入gus染色液中,将离心管置于离心机中5000rpm/min离心5min,促进根系和gus染色液充分接触。离心结束后,将离心管置于37℃培养箱中染色12小时,染色结束后,倒掉染色液,用自来水冲洗3-5遍,沥干水份,加入95%酒精脱色,结果如图4b所示,与野生型南瓜根系(wt)相比,显示选取的三株南瓜根系(oe1、oe2和oe3)很好地被染为蓝色,表明gus基因成功表达。实施例4本实施例提供一种南瓜根系基因编辑方法,采用与实施例3相同的转化步骤,分别利用实施例2获得三种含单基因编辑载体的发根农杆菌ar-qual菌株转化南瓜根系,得转化pkse402南瓜植株根系。进一步对转化pkse402南瓜植株根系编辑的检测,具体步骤如下:利用体系荧光显微镜观察根系gfp发光情况,挑选根系生长健壮、荧光信号强的根系立即置于液氮中速冻,然后将根系研磨成粉末,利用ctab法提取基因组dna。在葫芦科基因组数据库上http://cucurbitgenomics.org/下载目的基因的基因组序列,利用primer3plus网页软件在基因编辑位点上下游200bp左右设计基因编辑鉴定引物,引物对序列分别如下:naced-f:5’-gccgtaaatgtgcatcgcat-3’(seqidno.12)naced-r:5’-cgaattagcgagccggtact-3’(seqidno.13)rbohd-f:5’-ttcggacgcagatggaagaa-3’(seqidno.14)rbohd-r:5’-ttagaactcggctgtcgctc-3’(seqidno.15)nhx-f:5’-agcagggcacactcaactac-3’(seqidno.16)nhx-r:5’-cctttcggttggcgatcct-3’(seqidno.17)分别利用上述引物对和以上提取的基因组dna为模板,使用高保真酶2×high-fidelitymastermix(tsingke,中国)进行pcr扩增,获得pcr产物后连接t载体,转化大肠杆菌感受态,送北京擎科新业生物技术有限公司进行测序。获得测序结果后,利用geneious软件对测序结果进行比对分析,鉴定基因编辑的位点的编辑情况。如图5所示,鉴定结果表明sgrna成功介导了cas9蛋白对南瓜基因组dna的编辑,成功获得了基因编辑的南瓜根系。通过大量研究,本发明首次利用转化植物表达载体pcambia1305.4的发根农杆菌ar-qual为侵染农杆菌,可建立南瓜的高效发根遗传转化体系。本发明首次利用pkse402为基因编辑载体,通过geneious软件设计了不同基因的sgrna,并成功构建到pkse402载体上,并将对应的pkse402载体成功转化到发根农杆菌ar-qual中。利用已建立的南瓜发根转化系统,再用含有不同sgrna基因编辑载体pkse402的发根农杆菌ar-qual侵染南瓜,成功获得了基因编辑的南瓜转化根系,有利于促进对南瓜的分子生物学和基因功能的研究。以上实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。序列表<110>华中农业大学<120>发根农杆菌介导南瓜根系转化方法及基因编辑方法<160>17<170>siposequencelisting1.0<210>1<211>23<212>dna<213>人工序列(artificialsequence)<400>1attgtggtacttctttacgccga23<210>2<211>23<212>dna<213>人工序列(artificialsequence)<400>2aaactcggcgtaaagaagtacca23<210>3<211>23<212>dna<213>人工序列(artificialsequence)<400>3attggatgtaccctgcatttcca23<210>4<211>23<212>dna<213>人工序列(artificialsequence)<400>4aaactggaaatgcagggtacatc23<210>5<211>23<212>dna<213>人工序列(artificialsequence)<400>5attgcatgctggtcgtgagtttc23<210>6<211>23<212>dna<213>人工序列(artificialsequence)<400>6aaacgaaactcacgaccagcatg23<210>7<211>25<212>dna<213>人工序列(artificialsequence)<400>7tgtcccaggattagaatgattaggc25<210>8<211>20<212>dna<213>人工序列(artificialsequence)<400>8aggtggttgcaactggacaa20<210>9<211>20<212>dna<213>人工序列(artificialsequence)<400>9cgcaagtccgcatcttcatg20<210>10<211>20<212>dna<213>人工序列(artificialsequence)<400>10ctggactctggtgatggtgt20<210>11<211>20<212>dna<213>人工序列(artificialsequence)<400>11cgttcagcagtggttgtgaa20<210>12<211>20<212>dna<213>人工序列(artificialsequence)<400>12gccgtaaatgtgcatcgcat20<210>13<211>20<212>dna<213>人工序列(artificialsequence)<400>13cgaattagcgagccggtact20<210>14<211>20<212>dna<213>人工序列(artificialsequence)<400>14ttcggacgcagatggaagaa20<210>15<211>20<212>dna<213>人工序列(artificialsequence)<400>15ttagaactcggctgtcgctc20<210>16<211>20<212>dna<213>人工序列(artificialsequence)<400>16agcagggcacactcaactac20<210>17<211>19<212>dna<213>人工序列(artificialsequence)<400>17cctttcggttggcgatcct19当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1