利用阳离子多聚体DNA复合物促进AAV介导的基因表达方法与流程
本发明涉及一种促进aav介导的基因表达方法,具体的,尤其涉及一种利用阳离子多聚体dna复合物促进aav介导的基因表达方法,属于基因工程技术领域。
背景技术:
基因治疗是现在人类治疗肿瘤、传染病、遗传病的重要技术手段,指将特定的外源基因通过多种方式导入到目的细胞内以达到治疗甚至彻底治愈疾病的一种有效的方案。其中基因治疗最为关键的技术,即选用合适方式或者载体将用来治疗的外源基因,稳定、安全地导入目的细胞中,并高效的进行治疗。不同的方式和载体的递送效率,极大的影响着后续的研究和临床治疗效果。因此,发明出一种用于高效促进载体表达的方法是亟需必要的。
目前,用于基因递送的载体主要分为病毒载体和非病毒载体。aav作为重要的病毒载体,在科学研究和临床应用中都有着很广泛的应用。aav是一种细小病毒,自然缺陷、无包被和无致病原性。aav基因组是一个线性、单链dna(ssdna)分子,由4680个核苷酸构成,在每个末端含有一个145个碱基组成的末端重复序列(itr)。随着aav的研究发展,其在科学研究和临床应用上逐步成为主要的基因载体。因此有效的提高aav介导的基因治疗是十分必要的。
技术实现要素:
本发明的主要目的在于提供一种利用阳离子多聚体dna复合物促进aav介导的基因表达方法,以克服现有技术中的不足。
为实现前述发明目的,本发明采用的技术方案包括:
本发明实施例提供了一种利用阳离子多聚体dna复合物促进aav介导的基因表达方法,其包括:
以包含目标基因的aav载体、辅助dna与带正电荷的细胞转染试剂共孵育后共转染宿主细胞;
或者,先以辅助dna与带正电荷的细胞转染试剂孵育形成的阳离子多聚体dna复合物和包含目标基因的aav载体中的任意一者转染宿主细胞,之后以其中的另一者在设定时间内转染所述宿主细胞。
在一些优选实施例中,所述基因表达方法包括:
以包含目标基因的aav载体、辅助dna与带正电荷的细胞转染试剂共孵育后共转染宿主细胞;
或者,先以辅助dna与带正电荷的细胞转染试剂共孵育后转染宿主细胞,之后再在选定时间内以包含目标基因的aav载体转染所述宿主细胞,所述设定时间小于24h,优选小于12h,更优选为6h以内;
或者,先以包含目标基因的aav载体转染宿主细胞,之后再在选定时间内以辅助dna与带正电荷的细胞转染试剂共孵育后转染所述宿主细胞,所述设定时间小于24h以内,优选小于6h;其中同时转染为最佳。
进一步地,所述基因表达方法包括:
将辅助dna与带正电荷的细胞转染试剂在选定缓冲液中混合反应,形成阳离子多聚体dna复合物;以及
以所述阳离子多聚体dna复合物转染宿主细胞。
与现有技术相比,本发明的有益效果至少在于:
本发明提供的利用阳离子多聚体dna复合物促进aav介导的外源基因的表达能力和增强其表达时间的方法,通过利用阳离子多聚体的本身特性,将其与aav介导的基因治疗联合起来,进而提高aav介导的基因表达效果,提高基因表达效率,并加强aav介导的基因治疗效果,对推动基因治疗、细胞治疗、细胞工程等领域发展有着至关重要的意义。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明中记载的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
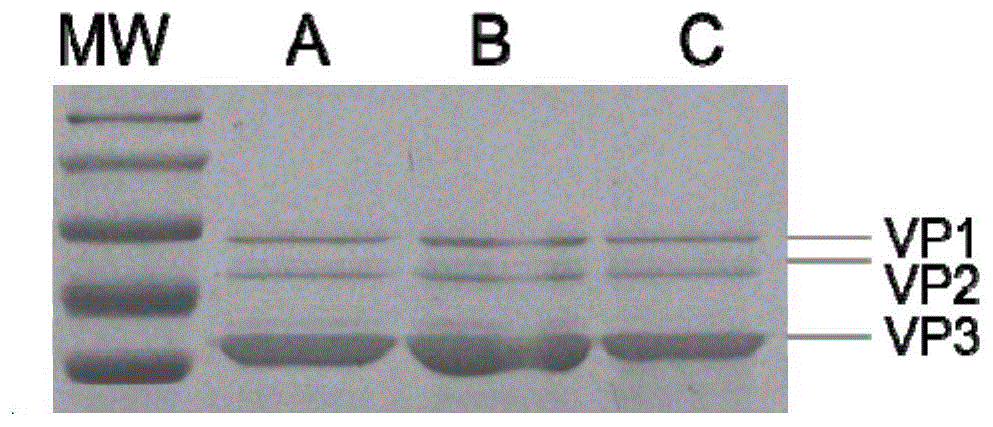
图1是本发明实施例1中sds-page电泳检测raav载体纯度的示意图。
图2a是本发明实施例1中不同细胞密度下,阳离子聚合物pei-dna介导的aav表达荧光显微镜观察结果图。
图2b是本发明实施例1中不同细胞密度下,阳离子聚合物pei-dna介导的aav表达流式分析结果图。
图3a是本发明实施例1中阳离子多聚体pei-dna介导的不同moi的aav载体的基因表达荧光显微镜观察结果图。
图3b是本发明实施例1中阳离子多聚体pei-dna介导的不同moi的aav载体的基因表达流式分析结果图。
图4a是本发明实施例1中阳离子多聚体pei-dna介导的不同时间的aav载体的基因表达荧光显微镜观察结果图。
图4b是本发明实施例1中阳离子多聚体pei-dna介导的不同时间的aav载体的基因表达流式分析结果图。
图5a是本发明实施例1中阳离子多聚体pei-dna介导的不同时间点的aav载体的基因表达荧光显微镜观察结果图。
图5b是本发明实施例1中阳离子多聚体pei-dna介导的不同时间点的aav载体的基因表达流式分析结果图。
图6a是本发明实施例1中阳离子多聚体pei-dna在不同的比例条件下介导的aav载体的基因表达荧光显微镜观察结果图。
图6b是本发明实施例1中阳离子多聚体pei-dna在不同的比例条件下介导的aav载体的基因表达流式分析结果图。
具体实施方式
raav载体以非致病性、低免疫原性、稳定表达目的基因等优点成为最有前景的病毒载体,被广泛应用于视网膜病变的基因治疗。阳离子多聚体作为非病毒载体,具有无传染性、来源广、可大量制备等优点,被广泛应用于基因治疗及细胞治疗等基础研究中。阳离子多聚体聚乙烯酰胺(pei),因为其具有良好的“质子海绵”效应,和较高效的基因递送效率已成为了基因递送的重要方式,它是分子量在200da至1500kda左右的合成高分子,主要有分支状和线性两种结构形式,其中分子量更小的线性pei具有更加优良的递送效果。
鉴于现有技术的不足,本案发明人经长期研究和大量实践,得以提出本发明的技术方案,其主要是通过利用阳离子多聚体的本身特性,将其与aav介导的基因治疗联合起来,进而提高aav介导的基因表达效果,并加强aav介导的基因治疗效果。经过阳离子多聚体与aav载体的共同使用,提供一种有效提高aav介导的基因表达的方法,即利用阳离子多聚体dna复合物高效提高aav介导的外源基因的表达能力和增强其表达时间的方法,对推动基因治疗、细胞治疗、细胞工程等领域发展有着至关重要的意义。
如下将对该技术方案、其实施过程及原理等作进一步的解释说明。
本发明实施例的一个方面提供了一种利用阳离子多聚体dna复合物促进aav介导的基因表达方法,其包括:
以包含目标基因的aav载体、辅助dna与带正电荷的细胞转染试剂共孵育后共转染宿主细胞;
或者,先以辅助dna与带正电荷的细胞转染试剂孵育形成的阳离子多聚体dna复合物和包含目标基因的aav载体中的任意一者转染宿主细胞,之后以其中的另一者在设定时间内转染所述宿主细胞。
在一些优选实施例中,所述基因表达方法包括:
以包含目标基因的aav载体、辅助dna与带正电荷的细胞转染试剂共孵育后共转染宿主细胞;
或者,先以辅助dna与带正电荷的细胞转染试剂共孵育后转染宿主细胞,之后再在选定时间内以包含目标基因的aav载体转染所述宿主细胞,所述设定时间小于24h,优选小于12h,更优选为6h以内;
或者,先以包含目标基因的aav载体转染宿主细胞,之后再在选定时间内以辅助dna与带正电荷的细胞转染试剂共孵育后转染所述宿主细胞,所述设定时间小于24h以内,优选小于6h。
进一步地,在以上方法中同时转染为最佳方案。
在一些优选实施例中,所述基因表达方法包括:
以包含目标基因的aav载体、辅助dna与带正电荷的细胞转染试剂共孵育后共转染宿主细胞,并进行基因表达24h以上,优选48h以上,尤其优选72h以上;
或者,先以辅助dna与带正电荷的细胞转染试剂孵育形成的阳离子多聚体dna复合物和包含目标基因的aav载体中的任意一者转染宿主细胞,之后以其中的另一者在设定时间内转染所述宿主细胞,并进行基因表达24h以上,优选48h以上,尤其优选72h以上。
在一些优选实施例中,所述基因表达方法包括:
当以包含目标基因的aav载体、辅助dna与带正电荷的细胞转染试剂共孵育后共转染宿主细胞时,或者,以辅助dna与带正电荷的细胞转染试剂孵育形成的阳离子多聚体dna复合物和包含目标基因的aav载体中的任意一者转染宿主细胞时,细胞浓度为10%~100%,优选为80%~90%。
在一些优选实施例中,所述含目标基因的aav载体的moi<100000,优选<10000。
在一些优选实施例中,所述基因表达方法包括:
将辅助dna与带正电荷的细胞转染试剂在选定缓冲液中混合反应,形成阳离子多聚体dna复合物;以及
以所述阳离子多聚体dna复合物转染宿主细胞。
在一些更具体的实施例中,所述基因表达方法包括:
将辅助dna与带正电荷的细胞转染试剂在选定缓冲液中混合反应,形成阳离子多聚体dna复合物;以及
以所述阳离子多聚体dna复合物转染宿主细胞。
进一步地,所述基因表达方法具体包括:以选定缓冲液分别将辅助dna、细胞转染试剂配置为第一转染液、第二转染液;
将第二转染液分批加入第一转染液,从而反应形成阳离子多聚体dna复合物。
进一步地,所述基因表达方法具体包括:将第二转染液滴加入第一转染液,共孵育从而反应形成阳离子多聚体dna复合物。
进一步地,所述选定缓冲液包括hbs缓冲液,但不限于此。
在一些优选实施例中,所述辅助dna与细胞转染试剂的质量体积比为1μg:1~5μl。
在一些优选实施例中,所述细胞转染试剂包括聚阳离子性高分子化合物,优选自线性聚乙烯亚胺,尤其优选为分子量为25kda的线性聚乙烯亚胺(pei),但不限于此。
在一些优选实施例中,本发明涉及的阳离子多聚体dna复合物中的辅助dna可以为包含质粒在内的各种形式的dna分子。
进一步地,所述辅助dna包括环状质粒、线性片段、双链dna、单链dna和细胞基因组酶切片段等中的任意一种,优选为环状质粒,如puc57质粒(puc57-sacas9-shrna-backbone),但不限于此。
在一些优选实施例中,所述含目标基因的aav载体包括aav6-egfp,但不限于此。
为使方案进一步优化,本发明涉及多方面的验证,包括不同形式的辅助dna,辅助dna用量以及转染时机等。
例如,本发明可以采用三质粒系统实现aav病毒的包装。其中所需的三个质粒分别包含aav基因组、aav突变体衣壳蛋白、复制蛋白。上述三个质粒的骨架均可以来源于pfastbacdual质粒(购自invitrogen公司),即,将目的基因表达盒通过pcr扩增、酶切连接入pfastbacdual质粒的多克隆位点(mcs)中。
本发明中涉及的第一个质粒,为aav基因组质粒pfastbacdual-itr-egfp,包含aav血清型2(aav2)的两个末端倒置重复序列(itr),还包含在真核细胞中表达的外源基因表达盒(包括启动子、增强子、内含子、polya序列,以及外源基因表达框包括绿色荧光蛋白基因egfp等)。
本发明中涉及的第二个质粒,为编码aav复制蛋白(rep)的质粒pfastbacdual-inrep,包括aav2的rep基因表达框,增强表达的intron序列等(李泰明等,昆虫细胞制备aav-itr基因表达微载体,生物工程学报,2015,31(8),1232页,1.2.1方法中的“构建pfastbacdual-itr-egfp质粒”)。
本发明中涉及的第三个质粒,为编码aav6衣壳蛋白的质粒pfastbacdual-incap6。质粒包含aav6cap基因、intron序列,其表达受pfastbacdual质粒载体上的p10启动子和hsvtkpolya元件调控等(李泰明等,昆虫细胞制备aav-itr基因表达微载体,生物工程学报,2015,31(8),1232页,1.2.2方法中的“构建pfastbacdual-incap质粒”)。
本发明中涉及的aav载体均在昆虫细胞中生产获得:
首先,将上述三个重组质粒pfastbacdual-incap6/pfastbacdual-itr-egfp/pfastbacdual-inrep用常规方法,分别转化大肠杆菌dh10bac感受态细胞,通过两轮蓝白斑筛选,包含重组杆粒的菌落为白色,未发生重组的菌落为蓝色,挑选白色菌落扩增,提取重组杆粒bacmid-incap6/bacmid-itr-egfp/bacmid-inrep。
然后,用昆虫细胞转染试剂,分别将上述三种重组杆粒bacmid-incap6/bacmid-itr-egfp/bacmid-inrep转染昆虫细胞sf9,4~5天后,收集细胞上清经0.22μm滤器过滤后,获得p1代重组杆状病毒baculovirus-incap6/baculovirus-itr-egfp/baculovirus-inrep;将p1代重组杆状病毒经过两次感染sf9细胞扩增获得p3代重组杆状病毒。采用噬菌斑法测定p3代杆状病毒的滴度,病毒滴度(pfu/ml)=1/稀释倍数×噬菌斑数×1/每孔接种体积。
最后,将p3代的三种重组杆状病毒(baculovirus-incap6/baculovirus-itr-egfp/baculovirus-inrep)共同感染sf9细胞,包装获得raav6。
以及用cscl密度梯度离心的方法纯化浓缩出高浓度的重组aav病毒的方法,荧光定量pcr检测raav6滴度的方法,sds-page检测raav6纯度的方法。
本发明涉及的阳离子多聚体dna复合物中的dna可以为包含质粒在内的各种形式的dna分子。
本发明中涉及包含聚乙烯亚胺(pei)在内的阳离子多聚体细胞转染试剂。以分子量为25kda的线性pei为例,转染前一天铺板,待细胞密度达到70%-80%时,进行转染,dna与pei比例为1:2(μg:μl)。将待转质粒和pei试剂分别与hbs混匀配制成15μl的a、b混合液,室温静置10-15分钟后一边轻轻涡旋装有a液的试管,一边将b液逐滴加入a液内(顺序不能颠倒),充分混匀(没有涡旋条件的话可以滴一滴立马混匀),室温静置10-15min后形成dna-pei复合物,将复合物逐滴加入事先换为无抗生素细胞培养基的细胞培养孔中,轻摇混匀。后续培养过程中及时更换细胞培养基以保证细胞活性。
本发明通过多种技术方案证明阳离子多聚体dna复合物能够促进aav介导的基因的表达:
第一:将puc57质粒用pei与aav6-egfp共转染hek293细胞;单转染aav6-egfp,24h后利用荧光显微镜和流式分析技术比较发现阳离子多聚体-dna复合物能够促进aav介导的egfp蛋白的表达。
第二:设定不同的aav载体转染moi,与pei转染试剂-puc57复合体共转染hek293细胞,24h后利用荧光显微镜和流式细胞仪观察结果,与单转染aav载体的结果比较,阳离子多聚体对不同aav载体的moi均有很好的促进作用,在低moi(10000<)时促进作用最为明显。
第三:先转染pei-dna复合体,6h、12h、24h、后再转染aav6-egfp;或者,先转染aav6-egfp,6h后再转染pei-dna复合体;同时转染pei-dna复合体和aav6-egfp;单转染aav6-egfp。24h后利用荧光显微镜和流式细胞仪分析结果,确定在不同转染顺序和间隔时间下的转染促进效果,发现同时转染时效果最好。
综上结果发现,阳离子多聚体dna复合物明显提高aav介导的基因表达。
藉由上述技术方案,本本发明提供的利用阳离子多聚体dna复合物促进aav介导的外源基因的表达能力和增强其表达时间的方法,通过利用阳离子多聚体的本身特性,将其与aav介导的基因治疗联合起来,进而提高aav介导的基因表达效果,提高基因表达效率,并加强aav介导的基因治疗效果,对推动基因治疗、细胞治疗、细胞工程等领域发展有着至关重要的意义。
下面结合具体实施例进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。若非特别说明,则下列实施例中使用的各种试剂均是本领域技术人员熟知的,并可以通过市场购买等途径获取。而下列实施例中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
实施例1
本实施例涉及一种高效促进aav介导的基因表达的阳离子多聚体dna复合物,具体实验方法包括如下步骤:
(1)重组质粒的制备:
a.pfastbacdual-itr-incap6的制备
质粒包含aav2cap基因、intron序列,其表达受pfastbacdual质粒载体上的p10启动子和hsvtkpolya元件调控,由实验室构建保存(参考文献:李泰明等,昆虫细胞制备aav-itr基因表达微载体,生物工程学报,2015,31(8),1232页,1.2.2方法中的“构建pfastbacdual-incap质粒”)。
b.pfastbacdual-itr-egfp的制备
pfastbacdual-itr-egfp质粒包含aav2的两个itr和cmv启动子、beta-globin内含子、编码egfp基因、hghpolya序列,由实验室构建保存(参考文献:李泰明等,昆虫细胞制备aav-itr基因表达微载体,生物工程学报,2015,31(8),1232页,1.2.1方法中的“构建pfastbacdual-itr-egfp质粒”)。
c.pfastbacdual-inrep质粒的制备
pfastbacdual-inrep质粒包含aav2rep基因、intron序列,其表达受pfastbacdual质粒载体上的p10启动子和hsvtkpolya元件调控,由实验室构建保存(参考文献:李泰明等,昆虫细胞制备aav-itr基因表达微载体,生物工程学报,2015,31(8),1232页,1.2.2方法中的“构建pfastbacdual-inrep质粒”)。
(2)重组bacmid的制备
将上一步的三个重组质粒分别制备重组bacmid,具体方法如下:
1)冰上缓慢融化100μldh10bac感受态。
2)加入50ng质粒dna,轻轻混匀。
3)冰上放置30min,42℃热休克90s,立即转入冰上放置2min。
4)加入900μlsoc培养基,37℃225rpm摇4h。
5)在含50μg/ml卡那霉素kan,7μg/ml庆大霉素gen,10μg/ml四环素tet的预制的90mm琼脂板中央滴加40μl2%(20mg/ml)的吲哚酚类底物blue-gal和7μl20%(200mg/ml)ipt。使用无菌涂布器使之分散于培养板整个表面,于室温孵育直至全部液体消失。
6)用soc培养基10倍梯度稀释细胞(10-1,10-2,10-3),每个梯度取100μl涂lb平板。
7)37℃放置48h,挑取10个白色克隆,蘸取到新的lb琼脂板(同上抗性)上,37℃过夜。挑取确认的白斑,接种到lb液体培养基中(含50μg/mlkan,7μg/mlgen,10μg/mltet)。
8)4℃放置过夜,使蓝色在这一期间充分显色。
9)对于白斑可以进行pcr鉴定正确后可以转染sf9。
10)使用omega试剂盒抽提分离重组的杆粒dna,实验方法参照试剂盒说明书,测量杆粒浓度后分装后冻于-20℃,避免反复冻融。
11)pcr鉴定bacmid,所用引物分别为:上游引物5’-cccagtcacgacgttgtaaaacg-3’,下游引物5’-gctctagattacttgtacagctcgtccat-3’。
12)取出鉴定正确的bacmid菌种,按照1:300的比例接种于3mllb(kan+,gen+,tet+)摇菌12h。然后按照1:100的比例接种于150mllb(kan+,gen+,tet+)摇菌16h,参照大型/大量质粒提取试剂盒说明书大量抽提bacmid,以备转染细胞制备杆状病毒。
(3)杆状病毒的制备
①sf9细胞培养
sf9细胞提前一天铺六孔板,50%的孔密度,使用完全培养基,95%存活度。将重组bacmiddna在70℃水浴里面温浴20min,12000g离心10min取上清液。
②细胞铺板
确保细胞密度在1.5~2.5×106cells/ml时进行操作(培养基不含抗生素)。加2ml无添加剂的grace昆虫细胞培养基grace培养基(不含抗生素和血清)到6孔板中。接种8×105细胞/ml步骤1中的sf9(未更换培养基和洗细胞),让细胞室温贴壁15min。
③配制转染试剂
a)混匀转染试剂cellfectinⅱ,加入8μl到92μl无添加剂的grace培养基(不含抗生素和血清),涡旋混匀。
b)取5μl杆粒dna(500ng/μl,保证杆粒的量为2~3μg)到95μl无添加剂的grace培养基(不含抗生素和血清),轻轻混匀。
c)把上述两溶液混匀,室温孵育30min。
④滴加上述dna-lipid混合物到铺有细胞的孔中,27℃孵育细胞5h。
⑤移去板中培养基,换2ml完全培养基。
⑥在27℃孵育72h,观察病毒感染迹象。
分离p1:
证实细胞处于晚期感染阶段后(通常是转染后4~5天),每孔收集2ml含病毒的培养基到无菌的15ml离心管中,1000g离心5min去除细胞碎片。
上清经0.22μm滤器过滤到无菌的15ml离心管中,4℃避光保存。若想长期保存,分装冻于-80℃。
扩增病毒:
取moi为0.05~0.1,10ml悬浮培养的细胞,密度为2×106cells/ml;或是6孔板中的细胞,密度为2×106细胞/孔,计算所需的p1体积。
①sf9细胞铺六孔板,2×106细胞/孔。室温放置1h使其贴附,显微镜下观察。
②每孔加入适量的p1,27℃培养48h~72h。
③每孔收集2ml含病毒的培养基于无菌的15ml离心管中,1000g离心5min。
④转移上清到无菌的15ml离心管中,该病毒上清为p2。4℃避光保存,若想长期保存,分装冻于-80℃。
⑤可按上述方法扩增得到p3(通常得到的p1病毒滴度在1×106~1×107之间,p2滴度在1×107~1×108之间)。
用噬菌斑法测定病毒滴度。详细实验步骤如下:
①2ml/孔细胞(5×105细胞/ml)种入6孔板,室温孵育1h使其贴壁,孵育后镜检其贴壁程度。
②将4%agarosegel放入70℃水浴锅融解,2×grace与一个100ml无菌瓶放入40℃水浴锅预热。
③将杆状病毒用无血清补充grace培养基supplementedgrace进行梯度稀释:10-1~10-8。
④弃6孔板内上清,快速加入稀释好的病毒,1ml/孔(复孔)室温孵育1h。
⑤配置上层琼脂,加20ml高温灭活fbs到2×grace100ml,25ml2×grace(含fbs)+12.5ml无菌水+12.5ml4%琼脂糖凝胶agarosegel,至预热的100ml无菌瓶,轻轻混匀,放入37℃水浴锅备用。
⑥弃6孔板内上清,快速加2ml上层琼脂,以防菌层干燥,静置10~20min使其凝固。将6孔板放入27℃培养箱,培养5天。
⑦配制1mg/ml中性红溶液,在grace完全培养基中,无菌过滤。
⑧1.5ml的上述溶液,16.5mlgrace完全培养基,6ml4%的琼脂配制成中性红上层琼脂。
⑨在病毒感染4天后,加1ml中性红上层琼脂。
⑩继续放到培养箱中,4~5天后即可观察噬菌斑,计数噬菌斑的数量,求得病毒滴度。
注:病毒滴度(pfu/ml)=1/稀释倍数×噬菌斑数×1/每孔接种体积
(4)raav载体的制备及纯化
用cscl密度梯度离心的方法纯化浓缩出高浓度的重组aav病毒的方法,荧光定量pcr检测raav6滴度的方法,sds-page检测raav6纯度。请参阅图1所示,是本实施例中sds-page电泳检测raav载体纯度的示意图,图1中a表示raav6-cmv-egfp,b表示raav6-s663l-cmv-egfp,c表示raav6-s663l-gfap-egfp。
(5)hbs缓冲液和pei转染试剂的配制方法
配制hbs缓冲液时,称取0.954g羟乙基哌秦乙硫磺酸hepes和1.754gnacl溶于180mlddh2o中,用1mol/l的naoh或hcl调节ph值至7.4,再用ddh2o定容至200ml,0.22μm滤膜过滤除菌后,-20℃保存。
配制50mmol/lpei溶液时,称取0.0215gpei溶于9ml事先预热至75℃的ddh2o中,加hcl后搅拌3h,待pei溶解完全后加naoh调节ph值至7.4,再用ddh2o定容至10ml,0.22μm滤膜过滤除菌后,-20℃保存。每次使用前于室温将pei储存液充分溶解,以保证每次使用的浓度相同。
(6)细胞培养方法
使用高糖dmem完全培养基(添加10%胎牛血清和1%青霉素和链霉素双抗)培养hek293细胞(购自美国菌种保藏中心),细胞贴壁生长于37℃、5%co2的恒温培养箱中。转染前一天,倒尽t25细胞培养瓶中的培养基,用1mlpbs润洗一遍后添加1ml0.05%胰酶,放于37℃培养箱中消化2-3分钟,显微镜下观察细胞成片飘落后添加1.5ml含血清的高糖dmem完全培养基,贴壁轻轻吹打后将细胞液吸入15ml离心管中,250g离心5分钟,1ml培养基贴壁轻轻重悬细胞后利用血球计数板计数,接种30万左右细胞于24孔板内进行培养,使第二天细胞密度达到70%-80%。
(7)使用pei转染试剂转染质粒方法
dna与pei的比例控制在1:1(μg:μl)。待细胞密度达到70%-80%时,将孔内培养基更换为无抗生素的高糖dmem培养基后进行转染。用hbs缓冲液分别将待转dna和pei配制成两个15μl的转染体系,记为a、b液,立即漩涡震荡混匀,瞬时离心后室温下静置10-15min.,接着一边轻轻涡旋a液一边将b液加入逐滴加入(顺序不能颠倒,若没有条件,可以滴一滴b液后迅速混匀),室温静置10-15min.,最后将a、b混合液轻轻加至24孔板中,轻摇混匀后,放入37℃培养箱中。4h后更换完全培养基,后续培养要及时更换培养基保证细胞状态完好。
(8)阳离子多聚体促进aav介导的基因表达
使用pei作为转染试剂,按上述所述转染方法将400ngpuc57-sacas9-shrna-backbone共转染入hek293细胞,同时转染aav6-egfp,24h后利用荧光显微镜观察egfp蛋白的表达情况,利用流式细胞仪分析egfp荧光表达百分比和强度。
流式细胞分析时细胞处理方法如下:
1)吸尽24孔中的培养基,每孔加入约250μl的pbs润洗细胞。
2)每孔加入约250μl的0.05%胰酶,37℃培养箱中消化2-3分钟,直至显微镜下观察细胞成片脱落。
3)每孔加入约500μl的含10%血清高糖dmem培养基,终止消化。
4)轻轻吹打细胞后,吸出细胞液于1.5mlep管中,250g离心5分钟。
5)ep管中加入700μlpbs,轻轻贴壁吹打重悬润洗细胞后,250g离心5分钟。
6)ep管中加入500μlpbs,轻轻贴壁吹打润洗细胞后将细胞液转入流式管中,准备上机分析。
(9)通过荧光显微镜观察和流式分析发现,阳离子多聚体介导的aav基因表达表达显著提高。在此实验中,本案发明人选用了多个细胞浓度(10%-100%)进行转染。
图2a示出了本实施例中不同细胞密度下,阳离子聚合物pei-dna介导的aav表达荧光显微镜观察结果图,其中abcd四组为共转染,abcd为单转染aav病毒。图2b示出了本实施例中不同细胞密度下,阳离子聚合物pei-dna介导的aav表达流式分析结果图。
(10)阳离子多聚体介导的不同moi的aav载体的基因表达
设置不同的aav载体转染moi(1000、10000、100000、500000),按上述所述转染方法将不同moi的aav载体和阳离子聚合物pei-dna(400ng,1:1)共转染入hek293细胞,24h后利用荧光显微镜观察egfp蛋白的表达情况,利用流式细胞仪分析egfp荧光表达百分比和强度,调控结果与单转染aav载体的结果比较。
通过荧光显微镜观察和流式分析发现,在moi低于100000时,共转染具有显著的促进表达作用,无论荧光强度还是整体转染效率均具有显著的提高效果,说明阳离子多聚体pei-dna复合物对aav载体的基因转染调控作用十分明显,在低moi的情况下作用最为明显。
图3a示出了本实施例中阳离子多聚体pei-dna介导的不同moi的aav载体的基因表达荧光显微镜观察结果图。图3b示出了本实施例中阳离子多聚体pei-dna介导的不同moi的aav载体的基因表达流式分析结果图。
(11)阳离子聚合物pei-dna介导的aav基因表达随时间的变化
按上述所述转染方法将阳离子聚合物pei-dna(400ng,1:1)和aav(moi:30000)共转染hek293细胞,24h、48h、72h后利用荧光显微镜观察egfp蛋白的表达情况,利用流式细胞仪分析egfp荧光表达百分比和强度,调控结果与单转染aav载体的结果比较。
通过荧光显微镜观察和流式分析发现,在阳离子聚合物pei-dna的介导下,随之基因表达时间的延长,在阳离子聚合物pei-dna的介导下,aav载体的基因表达显著增强。
图4a示出了本实施例中阳离子多聚体pei-dna介导的不同时间的aav的基因表达荧光显微镜观察结果图,其中abc三组为单转染aav载体,abc为共转染组。图4b示出了本实施例中阳离子多聚体pei-dna介导的不同时间的aav载体的基因表达流式分析结果图。
(12)阳离子聚合物pei-dna选择不同的时间点介导aav的基因表达:1)先转染阳离子聚合物pei-dna,6h、24h、48h后再转染aav(moi:30000);按上述所述转染方法将阳离子聚合物pei-dna(400ng,1:1)按时间顺序分别转染hek293细胞,然后待时间到6h、12h、24h时,再分别转染aav载体(moi:30000),24h后利用荧光显微镜观察egfp蛋白的表达情况,利用流式细胞仪分析egfp荧光表达百分比和强度,调控结果与同时共同转染的结果比较。2)先转染aav载体(moi:30000),然后等转染时间为6h时,在按上述所述转染方法将阳离子聚合物pei-dna(400ng,1:1)转染hek293细胞,24h后利用荧光显微镜观察egfp蛋白的表达情况,利用流式细胞仪分析egfp荧光表达百分比和强度,调控结果与同时共同转染的结果比较。通过荧光显微镜观察和流式分析发现,1)当时间间隔在24h以内时,阳离子多聚体pei-dna的介导增强效果最为明显,无论先转染阳离子多聚体pei-dna亦或是aav。
图5a示出了本实施例中阳离子多聚体pei-dna介导的不同时间点的aav载体的基因表达荧光显微镜观察结果图。图5b示出了本实施例中阳离子多聚体pei-dna介导的不同时间点的aav载体的基因表达流式分析结果图。
(13)阳离子多聚体pei-dna的不同比例对aav载体转染的影响
选择不同的pei-dna比例,分别为pei:dna(1:1,1:2,1:3,2:1,3:1),按上述所述转染方法将阳离子聚合物pei-dna与aav载体(moi:20000)共转染hek293细胞,24h后利用荧光显微镜观察egfp蛋白的表达情况,利用流式细胞仪分析egfp荧光表达百分比和强度。通过荧光显微镜观察和流式分析发现,在1:1时效果最为显著。
图6a示出了本实施例中阳离子多聚体pei-dna在不同的比例条件下介导的aav载体的基因表达荧光显微镜观察结果图。图6b示出了本实施例中阳离子多聚体pei-dna在不同的比例条件下介导的aav载体的基因表达流式分析结果图。
本发明的各方面、实施例、特征及实例应视为在所有方面为说明性的且不打算限制本发明,本发明的范围仅由权利要求书界定。在不背离所主张的本发明的精神及范围的情况下,所属领域的技术人员将明了其它实施例、修改及使用。
在本发明案中标题及章节的使用不意味着限制本发明;每一章节可应用于本发明的任何方面、实施例或特征。
在本发明案通篇中,在将组合物描述为具有、包含或包括特定组份之处或者在将过程描述为具有、包含或包括特定过程步骤之处,预期本发明教示的组合物也基本上由所叙述组份组成或由所叙述组份组成,且本发明教示的过程也基本上由所叙述过程步骤组成或由所叙述过程步骤组组成。
应理解,各步骤的次序或执行特定动作的次序并非十分重要,只要本发明教示保持可操作即可。此外,可同时进行两个或两个以上步骤或动作。
尽管已参考说明性实施例描述了本发明,但所属领域的技术人员将理解,在不背离本发明的精神及范围的情况下可做出各种其它改变、省略及/或添加且可用实质等效物替代所述实施例的元件。另外,可在不背离本发明的范围的情况下做出许多修改以使特定情形或材料适应本发明的教示。因此,本文并不打算将本发明限制于用于执行本发明的所揭示特定实施例,而是打算使本发明将包含归属于所附权利要求书的范围内的所有实施例。
最后,还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
- 还没有人留言评论。精彩留言会获得点赞!