硫氧还蛋白标签融合蛋白免疫亲和柱的制备方法、免疫亲和柱及其运用与流程
本发明涉及生物技术领域,具体为一种硫氧还蛋白标签融合蛋白免疫亲和柱的制备方法、免疫亲和柱及其运用。
背景技术:
分子生物学及蛋白质组学是生命科学研究领域的热门学科,为了研究蛋白质的结构、功能等性质,必须获得大量高纯度蛋白。为提高蛋白表达量和便于纯化,目前多在目标蛋白表达中人为引进一段融合标签多肽形成重组蛋白。
原核表达系统(如大肠杆菌蛋白表达)是当前重组蛋白的主要生产系统之一,但利用原核表达系统表达重组蛋白时,为了提高蛋白的表达量,往往在目的蛋白前添加硫氧还蛋白标签(trx),得到硫氧还蛋白标签重组蛋白,后期根据需要可以通过酶切的方法去掉目的蛋白前的硫氧还蛋白标签即可获得目的蛋白。
而目前普遍采用的利用组氨酸标签(6×his)亲和层析法中,由于融合蛋白的n端或c端6×his可能被目的蛋白包裹,以至于其无法与亲和填料结合,因此无法对硫氧还蛋白标签重组蛋白进行高效纯化。
技术实现要素:
针对现有技术的不足,本发明提供了一种硫氧还蛋白标签融合蛋白免疫亲和柱的制备方法、免疫亲和柱及其运用,其运用多个免疫亲和柱对同一硫氧还蛋白标签融合蛋白进行纯化,选取纯化效果达到预期值的免疫亲和柱作为目标硫氧还蛋白标签融合蛋白免疫亲和柱,再通过该目标硫氧还蛋白标签融合蛋白免疫亲和柱对硫氧还蛋白标签融合蛋白进行纯化,以提高纯化效率和效果。
为实现上述目的,本发明提供如下技术方案:
一方面,提供了一种硫氧还蛋白标签融合蛋白免疫亲和柱的制备方法,其包括如下步骤:
s1、制备n个硫氧还蛋白单克隆抗体,n为正整数;
s2、针对每一所述硫氧还蛋白单克隆抗体制备与其对应的免疫亲和柱,以获得n个免疫亲和柱;
以及s3、运用n个免疫亲和柱中的一个或多个对同一硫氧还蛋白标签融合蛋白进行纯化,选取纯化效果达到预期值的免疫亲和柱作为目标硫氧还蛋白标签融合蛋白免疫亲和柱。
优选的,所述步骤s1中包括:
s11、诱导硫氧还蛋白表达,并对硫氧还蛋白进行纯化;
s12、建立硫氧还蛋白单克隆抗体阳性杂交瘤细胞株,注射至实验动物体内后收集腹水,且在纯化腹水后获得n个硫氧还蛋白单克隆抗体。
优选的,所述步骤s11包括:s111、将表达载体转入宿主细胞内,通过化学方法和/或物理方法诱导硫氧还蛋白表达;s112、对诱导表达的硫氧还蛋白进行纯化。
优选的,所述步骤s12包括:s121、选取实验动物,且将纯化后的硫氧还蛋白作为抗原分阶段注射至实验动物体内,以完成动物免疫,且在完成动物免疫后取实验动物脾组织;
s122、用peg将实验动物脾细胞与骨髓瘤细胞进行融合,筛选出阳性融合细胞株,且在对阳性融合细胞株进行亚克隆后进行筛选,待亚克隆阳性率达到100%时建立硫氧还蛋白单克隆抗体阳性杂交瘤细胞株;
s123、取实验动物,且每只注射0.5ml石蜡油,7天后取硫氧还蛋白单克隆抗体阳性杂交瘤细胞株细胞重悬于无血清培养基中,按1×106个细胞/0.5ml/只的剂量注射至注射有石蜡油的实验动物体内,注射7-14天后收集腹水;
s124、腹水进行离心去杂后过proteing琼脂糖凝胶柱,洗脱后中和至中性,浓缩后即获得一个硫氧还蛋白单克隆抗体;
以及s125、重复步骤s121-s124,直至获得n个硫氧还蛋白单克隆抗体。
优选的,步骤s121中,将纯化后的硫氧还蛋白作为抗原分阶段注射至实验动物体内,以完成动物免疫的步骤包括:
初免:按200μg抗原/只的剂量在实验动物体内注射抗原溶液,此抗原溶液用同体积的弗式完全佐剂乳化;
二免:初免7-10天后,按100μg抗原/只的剂量在同一实验动物体内注射抗原溶液,此抗原溶液用同体积的弗式不完全佐剂乳化;
三免:二免7-10天后,按100μg抗原/只的剂量在同一实验动物体内注射抗原溶液,此抗原溶液用同体积的弗式不完全佐剂乳化。
优选的,步骤s121中,将纯化后的硫氧还蛋白作为抗原分阶段注射至实验动物体内,以完成动物免疫的步骤还包括:
四免:三免7-10天后,按100μg抗原/只的剂量在同一实验动物体内注射抗原溶液,此抗原溶液用同体积的弗式不完全佐剂乳化。
优选的,所述步骤s2包括:
s21、取proteing磁珠,离心后去上清,pbs缓冲液洗2-3次后再用pbs溶液重悬,再加入层析柱中;
s22、待层析柱中的pbs缓冲液从底部出口流出后,在层析柱中加入0.5-1.5mg硫氧还蛋白单克隆抗体,盖上层析柱盖子后于4℃摇床孵育过夜;
s23、过夜后用pbs缓冲液对硫氧还蛋白单克隆抗体清洗2-3次,排出pbs缓冲液后再加入dmp溶液,20-25℃下孵育25-35min;
s24、排出dmp溶液后分别用0.2m三乙醇胺洗2-3次、50mm乙醇胺洗1-2次、1m甘氨
酸溶液洗1-2次,以去除游离抗体;再用pbs缓冲液平衡层析柱后即获得与一个硫氧还蛋白单克隆抗体对应的免疫亲和柱;
以及s25、重复步骤s21-s24,以获得n个免疫亲和柱。
优选的,所述步骤s3包括:
s31、将表达硫氧还蛋白标签融合蛋白的宿主细胞超声破碎,离心后保留上清液;
s32、分别取10-20ml上清液过n个免疫亲和柱中的一个或几个,且每一免疫亲和柱反复过2-3次,收集流穿液;
s33、pbs缓冲液洗3次,加入甘氨酸洗脱液洗脱,并收集洗脱液;
以及s24、将上清液、流穿液和洗脱液分别进行sds-page电泳,根据电泳结果选取纯化效果达到预期值的免疫亲和柱作为目标硫氧还蛋白标签融合蛋白免疫亲和柱。
另一方面,还提供一种硫氧还蛋白标签融合蛋白免疫亲和柱,其通过上述制备方法制备获得。
另一方面,还提供一种上述硫氧还蛋白标签融合蛋白免疫亲和柱在纯化硫氧还蛋白标签融合蛋白中的运用。
与现有技术相比,本发明具备以下有益效果:
本发明运用多个免疫亲和柱对同一硫氧还蛋白标签融合蛋白进行纯化,选取纯化效果达到预期值的免疫亲和柱作为目标硫氧还蛋白标签融合蛋白免疫亲和柱,再通过该目标硫氧还蛋白标签融合蛋白免疫亲和柱对硫氧还蛋白标签融合蛋白进行纯化,以得到纯化后的目的蛋白。
附图说明
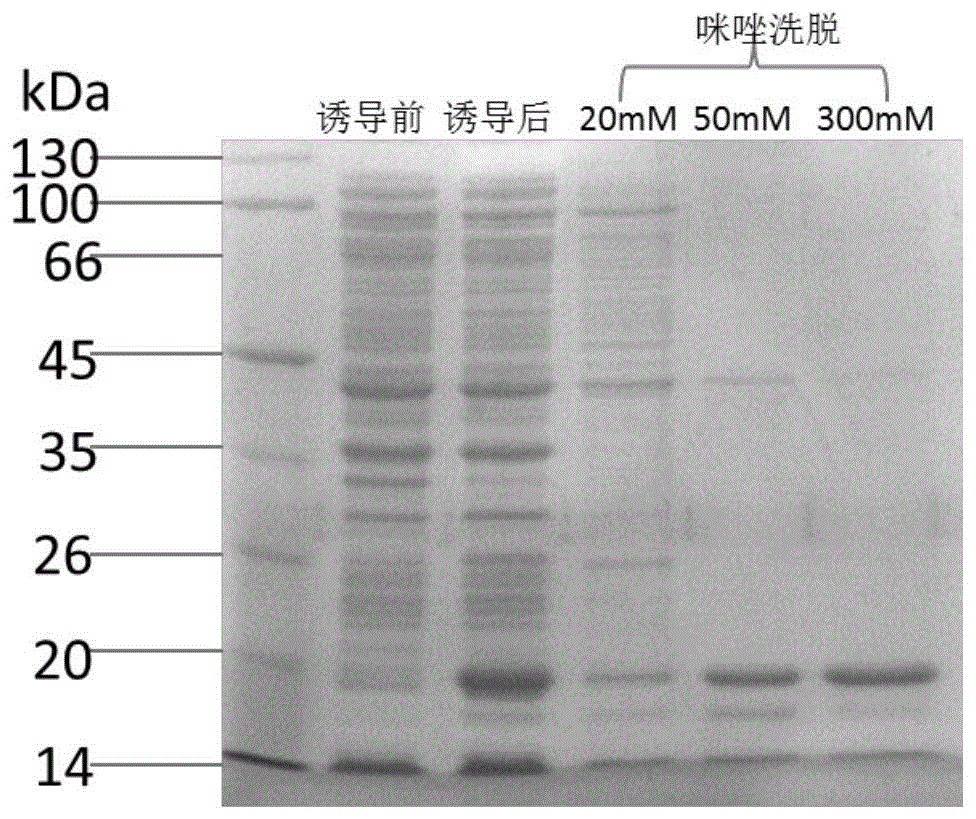
图1为本发明中ni柱亲和纯化trx蛋白后的电泳图;
图2为本发明中wb检测3只小鼠尾血中trx抗体效价的结果图;
图3a为本发明中1号trx-his蛋白板的俯视图;
图3b为本发明中2号trx-his蛋白板的俯视图;
图4a为本发明中1号his-mbpelisa板的俯视图;
图4b为本发明中2号his-mbpelisa板的俯视图;
图5a-5d为本发明中分别过1-12号免疫亲和柱后上清液、流穿液和洗脱液的电泳图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例一:
本发明中的硫氧还蛋白标签融合蛋白免疫亲和柱的制备方法包括如下步骤:
s1、制备n个硫氧还蛋白单克隆抗体,n为正整数;
s2、针对每一所述硫氧还蛋白单克隆抗体制备与其对应的免疫亲和柱,以获得n个免疫亲和柱;
以及s3、运用n个免疫亲和柱中的一个或多个对同一硫氧还蛋白标签融合蛋白进行纯化,选取纯化效果达到预期值的免疫亲和柱作为目标硫氧还蛋白标签融合蛋白免疫亲和柱。
其中,所述步骤s1中包括:
s11、诱导硫氧还蛋白表达,并对硫氧还蛋白进行纯化;
s12、建立硫氧还蛋白单克隆抗体阳性杂交瘤细胞株,注射至实验动物体内后收集腹水,且在纯化腹水后获得n个硫氧还蛋白单克隆抗体。
进一步的,所述步骤s11包括:s111、将表达载体转入宿主细胞内,通过化学方法和/或物理方法诱导硫氧还蛋白表达;s112、对诱导表达的硫氧还蛋白进行纯化;
所述步骤s12包括:s121、选取实验动物(如balb/c小鼠等),且将纯化后的硫氧还蛋白作为抗原分阶段注射至实验动物体内,以完成动物免疫,且在完成动物免疫后取实验动物脾组织(如balb/c小鼠脾脏);
s122、用peg(即聚乙二醇)将实验动物脾细胞与骨髓瘤细胞进行融合,筛选出阳性融合细胞株,且在对阳性融合细胞株进行亚克隆后进行筛选,待亚克隆阳性率达到100%时建立硫氧还蛋白单克隆抗体阳性杂交瘤细胞株;
s123、取实验动物,且每只注射0.5ml石蜡油,7天后取硫氧还蛋白单克隆抗体阳性杂交瘤细胞株重悬于无血清培养基中,按1×106个细胞/0.5ml/只的剂量注射至注射有石蜡油的实验动物体内,注射7-14天(优选10天)后收集腹水;
s124、腹水进行离心去杂后过proteing琼脂糖凝胶装柱,洗脱后中和至中性,浓缩后即获得一个硫氧还蛋白单克隆抗体;
以及s125、重复步骤s121-s124,直至获得n个硫氧还蛋白单克隆抗体。
优选的,步骤s121中,将纯化后的硫氧还蛋白作为抗原分阶段注射至实验动物体内,以完成动物免疫的步骤包括:
初免:按200μg抗原/只的剂量在实验动物体内注射抗原溶液,此抗原溶液用同体积的弗式完全佐剂乳化;
二免:初免7-10天后,按100μg抗原/只的剂量在同一实验动物体内注射抗原溶液,此抗原溶液用同体积的弗式不完全佐剂乳化;
三免:二免7-10天后,按100μg抗原/只的剂量在同一实验动物体内注射抗原溶液,此抗原溶液用同体积的弗式不完全佐剂乳化。
为保证免疫效果,步骤s121中,将纯化后的硫氧还蛋白作为抗原分阶段注射至实验动物体内,以完成动物免疫的步骤还可包括:
四免:三免7-10天后,按100μg抗原/只的剂量在同一实验动物体内注射抗原溶液,此抗原溶液用同体积的弗式不完全佐剂乳化。
进一步的,所述步骤s2包括:
s21、取proteing磁珠,离心后去上清,pbs溶液洗2-3次后再用pbs溶液重悬,再加入层析柱中;
s22、待层析柱中的pbs溶液从底部出口流出后,在层析柱中加入0.5-1.5mg硫氧还蛋白单克隆抗体,盖上层析柱盖子后于4℃摇床孵育过夜;
s23、过夜后用pbs溶液对硫氧还蛋白单克隆抗体清洗2-3次,排出pbs溶液再加入dmp(庚二亚氨酸二甲酯)溶液,20-25℃下孵育25-35min(优选30min);
s24、排出dmp溶液后分别用0.2m三乙醇胺洗2-3次、50mm乙醇胺洗1-2次、1m甘氨酸溶液洗1-2次,以去除游离抗体;再用pbs溶液平衡层析柱后即获得与一个硫氧还蛋白单克隆抗体对应的免疫亲和柱;
以及s25、重复步骤s21-s24,以获得n个免疫亲和柱。
进一步的,所述步骤s3包括:
s31、将表达硫氧还蛋白标签融合蛋白的宿主细胞超声破碎,离心后保留上清液;
s32、分别取10-20ml(优选15ml)上清液过n个免疫亲和柱中的一个或几个,且每一免疫亲和柱反复过2-3次,收集流穿液;
s33、pbs溶液洗3次,加入甘氨酸洗脱液洗脱,并收集洗脱液;
以及s24、将上清液、流穿液和洗脱液分别进行sds-page电泳,根据电泳结果选取纯化效果达到预期值的免疫亲和柱作为目标硫氧还蛋白标签融合蛋白免疫亲和柱。
实施例二:
本实施例提供了一种硫氧还蛋白标签融合蛋白免疫亲和柱,其通过实施例一所述的制备方法制备获得。
实施例三:
本实施例提供了如实施例二所述的硫氧还蛋白标签融合蛋白免疫亲和柱在纯化硫氧还蛋白标签融合蛋白中的运用。
下面以具体实例说明本发明中硫氧还蛋白标签融合蛋白免疫亲和柱的制备过程以及该硫氧还蛋白标签融合蛋白免疫亲和柱的运用。
1、抗原表达:
1)将原核表达载体pet32a(novagen公司,载体上含有trx基因)转入大肠杆菌bl21(de3)内,采用iptg(1mm)诱导硫氧还蛋白蛋白(以下均为trx蛋白)表达;
2)采用ni柱亲和纯化带有his标签的trx蛋白(以下均为trx-his蛋白),并分别用20mm、50mm、300mm的咪唑洗脱后进行电泳,电泳结果如图1所示,从图1中可以看出,300mm的咪唑洗脱后获得的trx蛋白纯度较高,可作为抗原用于下述动物免疫过程。
2、小鼠免疫和杂交瘤细胞制备:
1)选取4周龄balb/c雌鼠3只作为实验动物(即1号小鼠、2号小鼠以及3号小鼠),饲养1-2周后注射纯化后的抗原(即纯化后的trx蛋白);
2)动物免疫:
初免:第1天,按200μg抗原/只的剂量在balb/c雌鼠内注射抗原溶液,此抗原溶液用同体积的弗式完全佐剂乳化;
二免:第14天,按100μg抗原/只的剂量在同一balb/c雌鼠体内注射抗原溶液,此抗原溶液用同体积的弗式不完全佐剂乳化;
三免:第24天,按100μg抗原/只的剂量在同一balb/c雌鼠体内注射抗原溶液,此抗原溶液用同体积的弗式不完全佐剂乳化;
尾血检测:第28-29天时对1-3号小鼠均在尾静脉采集约20μl尾血,5000转离心5min,弃血细胞沉淀,吸取血清,用于wb检测效价,从图2中可以看出,2号小鼠尾血中trx抗体效价最高。
进一步的,为保证免疫效果,增加抗体效价,上述尾血检测后还可进行四免:第34天,按100μg抗原/只的剂量在同一balb/c雌鼠体内注射抗原溶液,此抗原溶液用同体积的弗式不完全佐剂乳化。
上述初免、二免、三免以及四免中,可用注射器相互注射的方式形成抗原溶液和弗式佐剂的油包水化合物,并且皮下多点注射。
三免或四免完成1周后取2号小鼠脾脏进行后续的杂交瘤细胞制备。
3)细胞融合:
将效价较高的2号小鼠脾脏细胞用常规融合方法进行细胞融合,铺2个96孔板;融合第8天后采用间接elisa方法对融合细胞上清筛选;具体的,通过铺96孔板获得2个trx-his蛋白包被的elisa板,即分别如图3a、3b所示的1号trx-his蛋白板和2号trx-his蛋白板,同时,用通过铺96孔板获得2个his-mbp包被的elisa板,即分别如图4a、4b所示的1号his-mbpelisa板和2号his-mbpelisa板,以此可依靠his-mbp包被的elisa板排除his标签造成的假阳性克隆。
4)亚克隆及建株:从1号trx-his蛋白板和2号trx-his蛋白板中分别选择出6个阳性融合细胞株,采用有限稀释方法进行亚克隆,待细胞集落生长至显微镜视野1/3时吸取上清进行筛选;待亚克隆阳性率达到100%时正式建立硫氧还蛋白单克隆抗体阳性杂交瘤细胞(以下简称“阳性杂交瘤细胞”)株。
5)阳性杂交瘤细胞株腹水制备及腹水效价检测:另取balb/c小鼠,每只注射0.5ml石蜡油,7天后取效价较高同时细胞状态好的阳性杂交瘤细胞重悬于无血清培养基中,按1×106个细胞/0.5ml/只量注射至注射有石蜡油的小鼠体内,注射细胞约7-14天后收集腹水。
3、proteing纯化腹水:
1)腹水于12000g条件下离心10分钟,充分除去杂质及沉淀,再将上清转移至干净的离心管中备用;
2)proteing琼脂糖凝胶装柱,且柱床体积为1ml,流尽20%乙醇保护液;
3)用10mmpbs缓冲液平衡10个柱床体积,流速为1ml/min;
4)将经过0.45μm滤膜过滤后的腹水上样,流速为1ml/min;
5)用10mmpbs缓冲液再次平衡20个柱床体积,流速为1ml/min;
6)用100mm甘氨酸(用hcl调整ph值至2.8)洗脱至基线,向收集的洗脱液中加入2mtris-hcl(ph值至8.8)中和至中性;
7)用10mmpbs缓冲液4℃过夜透析,次日用20000peg浓缩后即获得一个硫氧还蛋白单克隆抗体。
重复上述步骤,直至获得n个硫氧还蛋白单克隆抗体。
4、免疫亲和柱制备:
1)取1mlproteing磁珠,1500g离心3min后去上清,pbs缓冲液洗2-3次后再用pbs缓冲液重悬,再加入pd-10层析柱中;
2)流掉pbs后盖上底部出口的盖子,在层析柱中加入0.5-1.5mg(优选1mg)硫氧还蛋白单克隆抗体,盖上层析柱盖子后于4℃摇床孵育过夜;
2)过夜后用pbs缓冲液对硫氧还蛋白单克隆抗体清洗2-3次,排出pbs缓冲液后再加入临时配置的dmp(4mg/ml,ph8.0-9.0),室温下孵育30min;
3)排出dmp溶液后分别用0.2m三乙醇胺洗2-3次、50mm乙醇胺洗1-2次、1m甘氨酸溶液洗1-2次,以去除游离抗体;再用pbs缓冲液平衡层析柱后即获得与一个硫氧还蛋白单克隆抗体对应的免疫亲和柱;重复上述步骤,以获得n个免疫亲和柱。
5、trx蛋白免疫亲和柱筛选
1)将过表达硫氧还蛋白标签融合蛋白(以下均为“trx融合蛋白”)的大肠杆菌超声破碎,10000rpm离心20min后保留上清液;
2)分别取15ml上清液过不同的免疫亲和柱(编号为1-12),每一免疫亲和柱反复过3次,收集流穿液;
3)过柱后pbs缓冲液洗3次,加入甘氨酸洗脱液(ph2.8)洗脱,并收集洗脱液6ml;
4)将过柱前的上清液(即图5a-5d中的“前”)、流穿液(即图5a-5d中的“穿”)和洗脱液(即图5a-5d中的“洗”)分别进行sds-page电泳,从图5a-5d所示电泳结果中可以看出,12个免疫亲和柱中第2、5、6、8号柱的洗脱液电泳后有明显条带产生,说明trx蛋白可以结合到免疫亲和柱上,其中8号柱的流穿液电泳后无明显条带产生,说明8号柱流穿液中只有极少量目的蛋白未挂柱,其与trx融合蛋白的亲和力很强,所以可选择8号柱作为目标免疫亲和柱,可用于后续对于硫氧还蛋白标签融合蛋白的纯化中。
综上所述,本发明首先通过杂交瘤细胞制备多个硫氧还蛋白单克隆抗体;然后用proteing琼脂糖微球吸附不同的单抗;再用双功能交联剂dmp(庚二亚氨酸二甲酯)将单抗定向固定到proteing琼脂糖磁珠上,由此制备不同单抗的免疫亲和柱;应用单克隆抗体制备免疫亲和柱能够保证抗体的均一性,以及不同批次抗体之间的稳定性;同时proteing特异性结合硫氧还蛋白抗体的fc段,避免了硫氧还蛋白抗体fab段与填料的结合而使硫氧还蛋白抗体失去结合抗原的能力。
进一步的,选取纯化效果达到预期值的免疫亲和柱作为目标硫氧还蛋白标签融合蛋白免疫亲和柱,以应用到后续对于硫氧还蛋白标签融合蛋白的纯化中,由此可幅度提高纯化效果和效率。
需要说明的是,在本文中,诸如术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个……”限定的要素,并不排除在包括所述要素的过程、方法、物品或者设备中还存在另外的相同要素。
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
- 还没有人留言评论。精彩留言会获得点赞!