基于CRSIPR-Cas9技术的肺癌融合基因核酸检测质控品及其制备方法与流程
本发明属于肺癌融合基因核酸检测领域,尤其涉及一种基于组织微阵列与crsipr-cas9技术的肺癌融合基因核酸检测质控品及其制备方法。
背景技术:
肺癌是我国当前发病率最高的恶性肿瘤,也是引起肿瘤相关死亡的最主要肿瘤类型。据预测,到2025年我国每年肺癌新发病例将突破100万。因此,肺癌的诊疗已成为我国癌症研究领域一场迫在眉睫的“攻坚战”。非小细胞肺癌(non-smallcelllungcancer,nsclc)是肺癌最常见的类型,占到所有肺癌的85%以上。现有研究表明,ros1、alk融合基因是中国nsclc人群的全新驱动基因,约占到全部nsclc患者的10%,其检测对于应用新型抑制剂具有重要指导作用。然而,目前肺癌融合基因检测质量控制情况令人堪忧,解决此窘境的有效且关键性途径即为提供一种可覆盖多种检测方法的质控品。
目前肺癌融合基因质控品主要有两大类,一类为阳性病人肿瘤组织的切片、另一类是人工制备的仿肺癌组织。阳性患者肿瘤组织切片存在严重伦理问题,且阳性率不可控,批间差大等缺陷,目前已逐渐被淘汰。既往的人工制备仿肺癌组织尽管较好的解决了患者来源质控品的大部分弊端,但是还是存在诸多缺点:首先,组织来源多为293t等工具细胞,本身并不是癌细胞,在整体基因组与转录组方面与实际肺癌细胞存在大量差异;其次,质控品的融合基因发生率变异范围较大,尤其在低丰度水平;最后,整体流程较为复杂,难以转化至实际大批量的工业生产中。因此,探索新型、价格低廉、技术门槛低的方式制备非小细胞肺癌融合基因检测质控品对于规范肺癌融合基因检测,确保其准确性具有重要意义。
组织微阵列,亦称为组织芯片,由生物芯片发展延伸而来的一种特殊的生物芯片技术,是生物芯片重要的组成部分。基本原理为是多个不同个体组织标本以有序、互不干扰的阵列方式规则的排布于同一载体上,方便进行同一指标的原位组织学研究。组织微阵列具有下述特点:信息量大、一次性可获得大量结果、实验整体误差小、便捷且成本低廉,易于标准化生产。故应用组织微阵列方式进行非小细胞肺癌融合基因质控生产可有效规避既往产品的弱点。crispr-cas9是目前已成为生物工程领域中最常用的基因编辑工具。近年来,随着技术研发的进展,以cripsr-cas9技术为基础的大片段敲入表达已成为现实。相较于普通的质粒表达体系,其具有更高的表达效率与更低的错误发生率,可稳定维持特定基因的高效、持久表达,故尤其适合用于构建需要稳定比例的肺癌融合基因质控品。
技术实现要素:
本发明要解决的技术问题是提供一种基于crsipr-cas9技术的肺癌融合基因核酸检测质控品及其制备方法,结合精准基因编辑技术与精确定量的组织微阵列技术,可对现有肺癌融合基因检测过程中的突变评率有效覆盖,样本来源与实际肿瘤组织高度类似;整体制备流程简便,成本低,易储存与转运,具有良好应用前景。
为解决上述技术问题,本发明的实施例提供一种基于crsipr-cas9技术的肺癌融合基因核酸检测质控品,其特征在于,用于全方位监控融合基因检测的过程。
本发明还提供一种基于crsipr-cas9技术的肺癌融合基因核酸检测质控品的制备方法,包括如下步骤:
(1)利用crispr-cas9敲入技术构建带有eml4-alk、cd74-ros1融合基因特定融合位点的单克隆性hbe细胞株;
(2)应用步骤(1)中基因编辑成功的单克隆性hbe细胞株结合对照野生型细胞株构建小鼠皮下移植瘤模型;等待肿瘤成长至1cm3后处死模型小鼠,收集肿瘤组织,预处理后固定,石蜡包埋;
(3)利用步骤(2)收集的肿瘤组织,按照一定突变/野生比例构建病例组织切片微阵列,得到不同融合频率的肺癌融合基因核酸检测质控品。
其中,步骤(1)的具体步骤为:根据cd74-ros、eml4-alk融合区域设计特异性引物,扩增相关片段产物全长可覆盖融合位点,完成扩增整合后,插入两段各带有800bp同源臂的表达供者质粒,分别向受体hbe细胞导入crispr/cas9和供者序列,构建带有eml4-alk、cd74-ros1融合基因特定融合位点的单克隆性hbe细胞株。
其中,步骤(2)的具体步骤为:
(2-1)编辑后hbe细胞的准备
对步骤(1)中完成crispr/cas9敲入细胞编辑的hbe细胞扩增保种后,取hbe细胞通过流式细胞术、pi染色、以及cck-8实验检测细胞凋亡与增殖活性,确定细胞处于对数生长期后,计数hbe细胞并使用无血清dmem培养液将hbe细胞重悬至2x106个细胞/ml,体积为100μl;之后使用原始浓度的matrigel基质胶100μl与前述的细胞悬液按照体积比1:1的比例进行混匀,置于冰上备用;对照野生型细胞同样按照上述操作准备,置于冰上备用;
(2-2)hbe来源皮下移植瘤模型的构建
以裸鼠作为基础荷瘤动物,利用1ml注射器将步骤(2-1)中敲入表达特定融合基因的hbe细胞及其对应对照组hbe细胞小心注入裸鼠前肢肩胛骨上方,待形成肉眼可见隆起后,小心退针;
对针道进行按压防止注入肿瘤细胞悬液外漏;
对穿刺点进行碘伏消毒,防止感染;
每种细胞接种10只裸鼠,构建皮下异种来源移植瘤模型;待肿瘤增殖至1cm3时,处死皮下移植瘤小鼠,无菌条件取出肿瘤组织,剔除坏死部分后将组织分为两份,其中一份冻存于-80℃用于验证体内肿瘤的融合基因敲入表达情况;另外一半则使用4%多聚甲醛进行固定后,置于4℃环境待后续石蜡包埋及组织微阵列芯片产品构建。
其中,步骤(3)的具体步骤为:
采用细针打孔的方法,从步骤(2)的包埋蜡块中取得目标组织,其后将所有目标组织统一点样于同一载玻片上,构建组织芯片;
具体流程如下:
(3-1)选取待研究的组织;
(3-2)利用he对组织进行染色,通过显微镜观察,选取肿瘤增殖最为活跃、实质细胞密度最高、凋亡程度最低的区域作为候选组织区域;
(3-3)使用记号笔标记出待研究的区域,使用组织芯片点样仪将标记好的组织按设计排列在空白蜡块上;
(3-4)使用切片机对阵列蜡块进行连续切片即获得组织芯片;
(3-5)为达到制定融合基因比例的目的,将敲入表达组织与野生型组织按照既定比例混合,共同点样于载玻片,构建病例组织切片微阵列,得到不同融合频率的肺癌融合基因核酸检测质控品。
本发明还提供一种利用上述的制备方法制备的基于crsipr-cas9技术的肺癌融合基因核酸检测质控品的准确性鉴定方法,实验步骤为:使用数字pcr技术对不同比例融合基因质控进行检测,鉴定其准确性。
本发明还提供一种利用上述的制备方法制备的基于crsipr-cas9技术的肺癌融合基因核酸检测质控品的重复性鉴定方法,实验步骤为:使用数字pcr技术对三个不同批次制备的全水平0,0.1%,0.5%,1.0%,5%融合基因质控产品进行检测,鉴定不同批次产品的重复性。
本发明还提供一种利用上述的制备方法制备的基于crsipr-cas9技术的肺癌融合基因核酸检测质控品的稳定性鉴定方法,实验步骤为:使用数字pcr技术对室温保存半年、4℃保存1年的融合基因质控产品进行检测,鉴定其稳定性。
本发明的上述技术方案的有益效果如下:
1、本发明提供的一种以crispr-cas9大片段敲入技术联合组织微阵列技术构建非小细胞肺癌eml4-alk、cd74-ros1融合基因检测质控品及其制备方法,制备的质控品与非小细胞肺癌具有高度相似性,可极为真实地肺癌样本组织从取材到检测的全过程,实现融合基因检测的全方位监控。本发明具有成本低廉、稳定性高、便于储存与转运等优势,便于工业级别的大规模生产。综上,本发明具有重要的价值与应用前景。
2、本发明主要涉及两个技术创新,其一利用全新的crispr-cas9系统对hbe细胞实现的eml4-alk或cd74-ros1融合基因大片段敲入与表达;其二,利用组织微阵列技术,构建不同融合频率的质控产品。此外,本发明中,质控品将使用小鼠皮下移植瘤作为中间工具,用于产生相应融合/野生型病理组织。
3、本发明创新性的以人支气管上皮永生化细胞株hbe作为基础细胞系,相较于传统293t细胞,具备更高的肺相关表达谱,基础背景与实际更为接近,相较于肺癌细胞株具有更好的基因组稳定性,因此其可广泛应用于目前所有的融合基因检测方法(尤其是ngs)的性能确认、试剂盒性能验证以及日常检测质量控制;突破新的利用crispr-cas9技术构建eml4-alk、cd74-ros1融合基因表达细胞株,相较以往基因编辑技术具有更高的表达效率与稳定性;创新性的采用组织微阵列方式构建质控,与以往的参考物质相比,其具有易于大批量制备、在处理过程中不易脱片、可长时间稳定保存,并且可避免在不同常规操作中所引发的基质效应等优点;融合基因比例高度可控,创新性的采用组织微阵列形式生产质控产品,严格确保产品融合基因比例维持在极小的恒定范围内,具有高度的批内/批间稳定性;产品整体轻便而易于转运,可充分解决市场上现有产品存在的融合频率变异度大、运输不便等缺点;使用平台广,可适用于多种检测平台,实现对不同来源标本、不同检测系统的质量考评。
附图说明
图1为本发明中hbe细胞敲入片段后的鉴定结果图;
图2为本发明中hbe细胞敲入片段后的蛋白层面鉴定结果图;
图3为本发明中质控品hbe来源皮下移植瘤模型的构建中肿瘤增值示意图;
图4为本发明中质控品的准确性鉴定的结果图;
图5为本发明中质控品的重复性鉴定的结果图;
图6为本发明中质控品的稳定性鉴定的结果图。
具体实施方式
为使本发明要解决的技术问题、技术方案和优点更加清楚,下面将结合附图及具体实施例进行详细描述。
本发明将首先利用crispr-cas9技术敲入构建带有eml4-alk或cd74-ros1融合基因特定融合位点的单克隆性hbe细胞株。其后,基于此突变细胞与对应野生型细胞构建小鼠皮下移植瘤模型,待肿瘤生长至活跃期后,收获肿瘤组织质检、固定并石蜡包埋。之后根据不同突变/野生比例,构建组织微阵列。整体流程简便,较之现有人工肺癌模拟质控物质具有更好的模拟度与融合频率覆盖度,可更为真实的评估检测的特异性和灵敏度,尤其是抽提步骤的质控,真正实现对肺癌特定融合基因检测的全方位监测,对于检测结果的准确、可靠具有重要的实际应用价值。
具体的,本发明提供了一种基于crsipr-cas9技术的肺癌融合基因核酸检测质控品,用于全方位监控融合基因检测的过程。
本发明还提供一种基于crsipr-cas9技术的肺癌融合基因核酸检测质控品的制备方法,包括如下步骤:
(1)利用crispr-cas9敲入技术构建带有eml4-alk、cd74-ros1融合基因特定融合位点的单克隆性hbe细胞株;具体步骤为:
根据cd74-ros、eml4-alk融合区域设计特异性引物,扩增相关片段产物全长可覆盖融合位点,引物如表1所示。完成扩增整合后,插入两段各带有800bp同源臂的表达供者质粒,分别向受体hbe细胞导入crispr/cas9和供者序列,构建带有eml4-alk、cd74-ros1融合基因特定融合位点的单克隆性hbe细胞株。crispr/cas9分为cas9和grna两部分,cas9为无特异性核酸内切酶,负责切割dna引发dna链断裂,形成外源性片段插入缺口;grna由支架序列和靶向序列两部分构成,支架序列负责结合、引导并激活cas9切割活性,靶向序列长度则与目的序列互补序列后,起到dna定位作用,可诱导cas9靶向切割目的dna序列。
步骤(1)中导入片段的鉴定方法为:前述敲入表达载体转染hbe细胞72h后,利用流式细胞术分选gfp阳性细胞;抽提基因组dna,进行t7e1检测,筛选切割效率最高的sgrna-1用于后续质粒构建;细胞培养4周后,通过镜检排除非单克隆细胞,将单克隆细胞消化后取1/2裂解,抽提基因组dna并进行测序鉴定,通过流式细胞术鉴定细胞的表达效率,结果如图1显示,两种融合基因敲入后的细胞阳性率皆在99.5%以上,达到预期目标。
步骤(1)中敲入表达产物的蛋白层面鉴定方法为:采用westernblot技术对敲入表达的蛋白进行鉴定。采用sds-page电泳对目标蛋白进行电泳分离;采用半干转方式进行转膜;转膜完成后封闭,选择特定一抗4度孵育过夜;完成后,使用对应二抗室温孵育2小时;之后利用ecl方法进行曝光检测,imagej软件分析条带灰度,以β-actin为内参计算相对表达量,评估目标蛋白表达量。结果如图2所示,敲入后在特定分子量附近具有特异性蛋白条带,证明敲入表达成功。
(2)应用步骤(1)中基因编辑成功的单克隆性hbe细胞株结合对照野生型细胞株构建小鼠皮下移植瘤模型;等待肿瘤成长至1cm3后处死模型小鼠,收集肿瘤组织,预处理后固定,石蜡包埋;包括如下步骤:
(2-1)编辑后hbe细胞的准备
对步骤(1)中完成crispr/cas9敲入细胞编辑的hbe细胞扩增保种后,取hbe细胞通过流式细胞术、pi染色、以及cck-8实验检测细胞凋亡与增殖活性,确定细胞处于对数生长期后,计数hbe细胞并使用无血清dmem培养液将hbe细胞重悬至2x106个细胞/ml,体积为100μl;之后使用原始浓度的matrigel基质胶100μl与前述的细胞悬液按照体积比1:1的比例进行混匀,置于冰上备用;对照野生型细胞同样按照上述操作准备,置于冰上备用;
(2-2)hbe来源皮下移植瘤模型的构建
以裸鼠作为基础荷瘤动物,利用1ml注射器将步骤(2-1)中敲入表达特定融合基因的hbe细胞及其对应对照组hbe细胞小心注入裸鼠前肢肩胛骨上方,待形成肉眼可见隆起后,小心退针;对针道进行按压防止注入肿瘤细胞悬液外漏;对穿刺点进行碘伏消毒,防止感染;每种细胞接种10只裸鼠,构建皮下异种来源移植瘤模型;待肿瘤增殖至1cm3时(如图3所示),处死皮下移植瘤小鼠,无菌条件取出肿瘤组织,剔除坏死部分后将组织分为两份,其中一份冻存于-80℃用于验证体内肿瘤的融合基因敲入表达情况;另外一半则使用4%多聚甲醛进行固定后,置于4℃环境待后续石蜡包埋及组织微阵列芯片产品构建。
步骤(2)中hbe来源皮下移植瘤模型的验证方法为:使用westernblot技术检测步骤(2-1)中所获得的皮下瘤组织融合基因表达量。结果显示敲入编辑后的细胞具有融合基因相关蛋白表达;而野生型细胞则无此融合基因表达。该实验结果证实所构建皮下移植瘤模型稳定表达特定融合基因。
(3)利用步骤(2)收集的肿瘤组织,按照一定突变/野生比例构建病例组织切片微阵列,得到不同融合频率的肺癌融合基因核酸检测质控品;具体步骤为:采用细针打孔的方法,从步骤(2)的包埋蜡块中取得目标组织,其后将所有目标组织统一点样于同一载玻片上,构建组织芯片。
具体流程如下:
(3-1)选取待研究的组织;
(3-2)利用he对组织进行染色,通过显微镜观察,选取肿瘤增殖最为活跃、实质细胞密度最高、凋亡程度最低的区域作为候选组织区域;
(3-3)使用记号笔标记出待研究的区域,使用组织芯片点样仪将标记好的组织按设计排列在空白蜡块上;
(3-4)使用切片机对阵列蜡块进行连续切片即获得组织芯片;
(3-5)为达到制定融合基因比例的目的,将敲入表达组织与野生型组织按照既定比例混合,共同点样于载玻片,制得组织芯片。
下面结合几个实施例以验证本发明提供的肺癌融合基因质控品的准确性、重复性和稳定性。
实施例1
hbe来源肺癌融合基因质控品的准确性鉴定
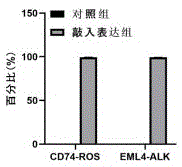
使用数字pcr技术对不同比例融合基因质控品进行检测,鉴定其准确性。结果如图4所示,在各个数量级上,数字pcr检测结果与预期混合比例具有显著相关性,且相关系数>0.95,证实质控产品具有高度准确性。
实施例2
hbe来源肺癌融合基因质控品的重复性鉴定
使用数字pcr技术对三个不同批次制备的全水平0、0.1%、0.5%、1.0%、5%融合基因质控品进行检测,鉴定不同批次产品的重复性。结果如图5所示,三个不同批次在所有水平上检测值均无显著差异,证实本产品制备流程具有优异的重复性。
实施例3
hbe来源肺癌融合基因质控品的稳定性鉴定
使用数字pcr技术对室温保存半年(每隔一个月检测)、4度保存1年(每隔一个季度检测)的融合基因质控产品进行检测,鉴定其稳定性。结果如图6所示,无论在何种环境,融合基因质控产品在所有的水平上均具有高度的表达一致性,证实本质控产品具有良好的稳定性,适合于多种保存环境,便于转运与储藏。
本发明提供的肺癌融合基因核酸检测质控品与非小细胞肺癌具有高度相似性,可极为真实地表现肺癌样本组织从取材到检测的全过程,实现融合基因检测的全方位监控。本发明利用全新的crispr-cas9系统对hbe细胞实现的eml4-alk或cd74-ros1融合基因大片段敲入与表达,利用组织微阵列技术,构建不同融合频率的质控品。本发明使用人源性支气管上皮细胞hbe作为融合基因表达的载体细胞,其来源较之常规使用293t细胞具有更好的肺组织模拟度。产品具有成本低廉、稳定性高、便于储存与转运等优势,便于工业级别的大规模生产。综上,本发明具有重要的价值与应用前景。以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明所述原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>苏州艾可瑞斯生物科技有限公司
<120>基于crsipr-cas9技术的肺癌融合基因核酸检测质控品及其制备方法
<141>2020-04-16
<160>10
<170>siposequencelisting1.0
<210>3
<211>2
<212>dna
<213>#1ccctggcaaccttcgagtg
<400>3
am2
<210>4
<211>2
<212>dna
<213>#2gagatgtgatcggcccaaaac
<400>4
am2
<210>3
<211>2
<212>dna
<213>#3aggtgcagcggtccaaaag
<400>3
am2
<210>4
<211>3
<212>dna
<213>#4agtcagcatgtctatgagcagt
<400>4
<210>5
<211>3
<212>dna
<213>#5acgaggagtcactagatgggc
<400>5
<210>6
<211>3
<212>dna
<213>#1gggtgctgtgcctgaagaa
<400>6
<210>7
<211>3
<212>dna
<213>#2aggtacaccgacttggagatg
<400>7
<210>8
<211>3
<212>dna
<213>#3ctccaagtcggtgtaccttact
<400>8
<210>9
<211>3
<212>dna
<213>#4ggcttgtcccagattgtgtaat
<400>9
<210>10
<211>3
<212>dna
<213>#5caatctgggacaagcccaatg
<400>10
- 还没有人留言评论。精彩留言会获得点赞!