花生毛状根株系在提高花生耐低氮、耐高盐能力中的应用的制作方法
本发明属于植物基因工程技术领域,尤其涉及一种花生毛状根株系在提高花生耐低氮、耐高盐能力中的应用。
背景技术:
花生是我国重要的油料作物,但随着社会发展和人民生活水平的不断提高,我国食用油产量严重不足,因此盐碱地的治理利用是解决目前我国耕地紧缺、缓解粮油争地矛盾的重要途径,低氮和高盐是目前盐碱地花生生长的两大主要危害。其中,氮素是花生生长必须的主要元素之一,氮素供应不足,花生的蛋白质、叶绿素和核酸合成受阻,导致花生植株矮小、叶面黄瘦、叶片光合强度降低,严重影响了花生产量。
目前,遗传转化途径是改良花生品种抗逆性,提高花生耐低氮、耐高盐的重要生物途径之一。同时已有研究表明c-terminallypepetides(ceps)基因在植物的生长发育及其胁迫响应过程中起到非常重要且独特的作用,但研究主要集中在拟南芥和苜蓿中,对于花生cep基因的研究甚少,因此开发出一种花生毛状根株系在提高花生耐低氮、耐高盐能力中的应用是解决我国耕地紧张、缓解粮油争地矛盾、大幅提高花生产量的有效解决方法。
技术实现要素:
本发明针对现有技术中存在的花生cep基因在花生生长发育及胁迫应答方面研究甚少的技术问题,提出一种具有定向高效性、育种周期短的花生毛状根株系在提高花生耐低氮、耐高盐能力中的应用。
为了达到上述目的,本发明采用的技术方案为:
花生毛状根株系在提高花生耐低氮、耐高盐能力中的应用,所述花生毛状根株系是通过以下方法得到的,具体步骤如下:
从花生cdna中克隆出ahcep1基因后,将所述ahcep1基因连接到表达载体上,构建含ahcep1基因的植物表达载体;
将含ahcep1基因的植物表达载体转化至发根农杆菌,获得含ahcep1基因的发根农杆菌;
利用含ahcep1基因的发根农杆菌菌液侵染花生叶片,得到被含ahcep1基因的发根农杆菌菌液侵染的花生叶片后,诱导其产生转基因花生毛状根,转入含有卡那霉素的ms固体培养基上培养;
鉴定所述转基因花生毛状根中ahcep1基因是否表达后,测定所述转基因花生毛状根中ahcep1基因的表达量,并筛选转基因花生毛状根阳性株系,即得花生毛状根株系。
在上述方法中,提取花生rna的方法为trizol抽提法或根据rna提取试剂盒说明提取得到;所述反转录过程是使用fastkinggdnadispellingrtsupermix反转录试剂盒说明制得的;利用含花生分泌肽基因的发根农杆菌菌液侵染叶片前要对花生叶片进行预处理,即在叶片上加2-3处的划痕,目的是保证发根农杆菌菌液能进入叶片内完成诱导过程;
此外还需要说明的是,转基因花生毛状根中ahcep1基因的表达量是通过qrt或rt-pcr法测得的,分别设置了对照组和实验组。其中,对照组为转化有空载体的毛状根(即cep1基因的本底表达水平)。只要实验组的表达量高于这个本底水平即为过表达株系。因为不同基因转化植物后表达水平会有差异,所以未做具体的数值限定。进行遗传转化实验会获得多个过表达株系,进一步选择表达量最高的转基因株系进行后期胁迫实验。
作为优选,构建所述植物表达载体的方法为酶切连接法或gateway系统构建法。
作为优选,利用所述含ahcep1基因的发根农杆菌菌液侵染花生叶片的方法为浸泡法或涂抹法。
作为优选,所述含ahcep1基因的发根农杆菌菌液浓度od600为1.0~2.0;所述转基因花生毛状根的培养时间为2周~8周,每隔2周更换一次新鲜的培养液。
作为优选,鉴定所述转基因花生毛状根中ahcep1基因表达的方法为rt-pcr法或qrt-pcr法。
作为优选,测定所述ahcep1基因的表达量是通过如下方法实现的,具体为:
利用rt-pcr法或qrt-pcr法鉴定所述转基因花生毛状根中ahcep1基因表达,得到不同的pcr产物;
将所述pcr产物分别进行琼脂糖凝胶电泳分析,根据条带的亮度大小判断所述转基因花生毛状根中ahcep1基因的表达量。
在上述优选中,根据条带的亮度大小判断所述转基因花生毛状根中ahcep1基因的表达量主要是通过以下方法来实现的,具体为:
利用内参基因ahactin11引物,通过多次pcr反应和琼脂糖凝胶电泳,增减样品模板含量,使最终不同样本内参基因扩增获得的目的条带亮度保持一致,以此样本上样量为最终实验模板量,利用ahcep1基因引物进行pcr扩增,此时获得的不同样本中的条带亮度就是不同转基因毛状根ahcep1基因的表达水平。
作为优选,所述方法还包括测定所述转基因花生毛状根阳性株系的生物量,步骤如下:
从同一转基因花生毛状根阳性株系中选择分支,称重后转移至液体培养基中继续培养;
每隔1~2周更换新鲜的液体培养基,最后用无菌水洗净晾干,分别称量不同转基因花生毛状根鲜重,即得所述转基因花生毛状根的生物量,公式如下:
转基因花生毛状根鲜重=每瓶转基因花生毛状根重量-接种重量。
作为优选,所述液体培养基为ms液体培养基、低氮液体培养基和高盐液体培养基。
作为优选,其特征在于,转基因花生毛状根分支的培养条件为23~26℃、150~180rpm。
在上述优选中,转基因花生毛状根分支的培养条件中温度条件可选取23、24、25、26℃或者上述限定范围内的任一数值,转速条件可选取150、160、170、180rpm或上述限定范围内的任一数值,均落在本发明的保护范围之内。
花生毛状根株系在提高花生耐低氮、耐高盐能力中的应用,低氮是指在所述液体培养基中的kno3的浓度≤1mm,高盐是指在液体培养基中nacl的浓度≥200mm。
与现有技术相比,本发明的优点和积极效果在于:
1、利用本发明提供的花生毛状根株系在提高花生耐低氮、耐高盐能力中的应用能够有效提高花生耐低氮、耐高盐的能力,通过实验表明将ahcep1基因的全长cdna连接到35s启动子启动的表达载体上,利用发根农杆菌侵染花生叶片诱导生成转基因花生毛状根,发现该基因可以增强花生毛状根耐低氮、耐高盐能力,提高在低氮、高盐环境下花生毛状根的生物量。
2、本发明提供的花生毛状根株系在提高花生耐低氮、耐高盐能力中的应用是采用遗传转化的方法实现的,该方法具备定向高效性、周期短、操作简便等优点,避免了传统的抗逆育种方法存在育种周期长、效率低、发育缓慢、突变方向难以掌控、化学诱变剂毒性较大易产生残留等缺陷。
附图说明
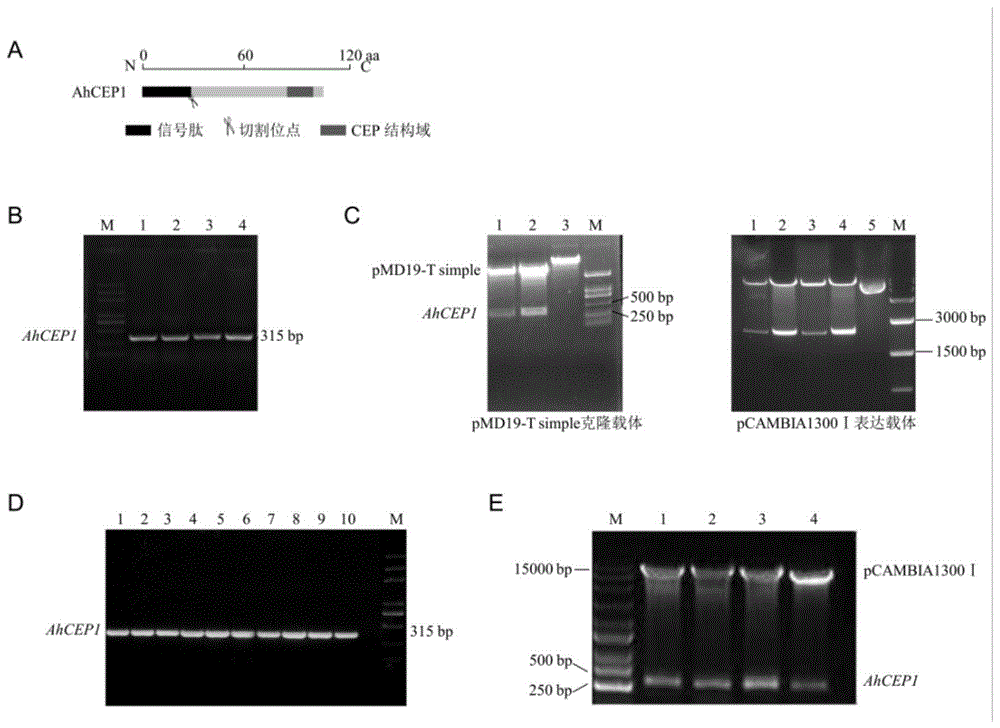
图1为本发明实施例所提供的花生ahcep1-pcambia1300表达载体构建的结果示意图,其中,图a为ahcep1保守蛋白结构域示意图,图b中的条带为克隆到目的基因ahcep1的电泳结果示意图,图c左图为目的基因ahcep1连接到克隆载体质粒酶切结果示意图,图c右图为原始表达载体质粒酶切结果示意图,图d为目的基因ahcep1连接到表达载体得到的阳性克隆,图e为带有ahcep1基因的表达载体质粒酶切结果示意图;
图2为本发明实施例所提供的转基因花生毛状根的形态示意图;
图3为本发明实施例所提供的转基因花生毛状根阳性株系的鉴定结果图,其中1号泳道为转化空载体的转基因花生毛状根(ck),其余泳道为转基因花生毛状根(35s:ahcep1),ahactin11为内参基因;
图4为本发明实施例所提供的转基因花生毛状根在高盐、低氮胁迫下的生物量统计结果图;
图5为本发明实施例所提供的转基因花生毛状根(35s:ahcep1)与对照(ck)中na+和no3-转运相关基因的表达量的qrt-pcr检测结果图。
具体实施方式
为了更清楚详细地介绍本发明实施例所提供的提高花生耐低氮、耐高盐能力的方法及其应用,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围,下面将结合具体实施例进行描述。
实施例1:花生rna的提取及反转录
(1)实验材料:
·培养基:
大肠杆菌lb液体培养基,成分:胰蛋白胨(tryptone)10g,酵母提取物(yeastextract)5g,氯化钠(nacl)10g,蒸馏水1000ml,调ph至7.0,121℃高压蒸汽灭菌20min。
发根农杆菌yep液体培养基,成分:胰蛋白胨(tryptone)10g,酵母提取物(yeastextract)10g,氯化钠(nacl)5g,蒸馏水1000ml,调ph至7.0,121℃高压蒸汽灭菌20min。
毛状根诱导和扩繁ms培养基,成分:25ml20×ms大量(3.8gkno3,3.3gnh4no3,0.34gkh2po4,蒸馏水100ml),5ml100×ms微量(0.223gmnso4·4h2o,0.086gznso4·7h2o,0.062gh3bo3,0.0083gki,2.5mgna2moo4·2h2o,0.25mgcuso4·5h2o,0.25mgcocl2·6h2o,蒸馏水100ml),5ml100×铁盐(0.374gedta-na2,0.278gfeso4·7h2o),10ml100×vb(肌醇1g,vb10.1g,vb30.01g,vb60.01g,加水100ml),5ml100×ca2+,5ml100×mg2+,蔗糖15g,蒸馏水1000ml,调ph至5.8,121℃高压蒸汽灭菌20min。
低氮培养基(0.2mmkno3):10ml1mkpi,0.2ml1mkno3,1ml1mcacl2,2ml1mmgso4,2ml500×mnsolution(1.55gh3bo3,68mgzncl2,cuso4·5h2o125mg,mnso4·h2o1.01g,na2moo4·2h2o24mg),5ml200×fena2edta(feso4·7h2o5.56g,na2edta·2h2o7.46g),蔗糖10g,蒸馏水1000ml,调ph至5.6,121℃高压蒸汽灭菌20min。
正常氮培养基(5mmkno3):10ml1mkpi,5ml1mkno3,1ml1mcacl2,2ml1mmgso4,2ml500×mnsolution(1.55gh3bo3,68mgzncl2,cuso4·5h2o125mg,mnso4·h2o1.01g,na2moo4·2h2o24mg),5ml200×fena2edta(feso4·7h2o5.56g,na2edta·2h2o7.46g),蔗糖10g,蒸馏水1000ml,调ph至5.6,121℃高压蒸汽灭菌20min。
(2)实验方法:
本发明利用花生基因组数据库网站peanutbase(https://www.peanutbase.org)找到基因ahcep1,利用pfam(proteinfamily:http://pfam.sanger.ac.uk/)和smart(simplemodulararchitectureresearchtool:http://smart.embl-heidelberg.de/)分析可知此基因编码典型的cep小肽(cds315bp如seqidno.1所示,氨基酸104aa如seqidno:2),拥有一个n端信号肽和c端保守的cep结构域(图1a)。
根据找到的花生ahcep1基因的cds序列设计引物,进行克隆,克隆方法如下:
s1、花生rna提取
使用天根植物总rna提取试剂盒(dp432)提取花生的总rna,具体步骤如下:
(s1-1)取水培生长15d左右花生幼苗在液氮中充分研磨,每50-100mg组织加入400μl试剂盒中rl试剂,漩涡振荡混匀,56℃孵育1-3min,使植物组织完全裂解;
(s1-2)将步骤一中溶液转移至过滤柱cs上(过滤柱cs放在收集管中),12,000rpm离心5min,用剪去部分末端的吸头小心吸取收集管中的上清至新的rnase-free1.5ml离心管中,吸头尽量避免接触收集管中的细胞碎片沉淀;
(s1-3)缓慢加入0.5倍上清体积的无水乙醇,轻轻混匀后将溶液转入吸附柱cr3中,12,000rpm离心1min,倒掉收集管中的废液,将吸附柱cr3放回收集管中;
(s1-4)向吸附柱cr3中加入350μl去蛋白液rw1,12,000rpm离心1min,倒掉收集管中的废液,将吸附柱cr3放回收集管中;
(s1-5)向吸附柱cr3中央加入80μl的dnasei工作液(10μldnasei储存液和70μlrdd缓冲液,轻柔混匀),室温放置15min;
(s1-6)再次向吸附柱cr3中加入350μl去蛋白液rw1,12,000rpm离心1min,倒掉收集管中的废液,将吸附柱cr3放回收集管中;
(s1-7)向吸附柱cr3中加入500μl漂洗液rw,室温静置2min,12,000rpm离心1min,倒掉收集管中的废液,再重复一次步骤(s1-7);
(s1-8)12,000rpm空转2min,倒掉废液。将吸附柱cr3置于室温放置数分钟,以彻底晾干残余的漂洗液;
(s1-9)将吸附柱cr3放入一个新的rnase-free离心管中,向吸附膜的中间部位悬空滴加50μlrnase-freeddh2o,室温放置2min,12,000rpm离心2min,获得rna溶液,并置于-80℃冰箱长久保存。
s2、反转录cdna第一链的合成
(s2-1)将提取的rna溶解后测定rna浓度,然后使用天根fastkinggdnadispellingrtsupermix反转录试剂盒进行反转录;
(s2-2)取2μg总rna,加入4μl5×fastking-rtsupermix,补水到20μl,在42℃孵育15min,95℃酶失活3min,获得花生cdna。
实施例2:ahcep1基因的克隆及表达载体构建
(1)实验材料:
ahcep1基因引物序列:
上游引物5’-ggatccatggccaattccaaacttgtgttg-3’;
下游引物5’-gagctcctagtttggcgtgggggagg-3’;
其中下划线处为酶切位点,上游引物的酶切位点为bamhi,下游引物的酶切位点为saci。
(2)实验方法:
q1、ahcep1基因的克隆
(q1-1)以花生cdna为模板,利用诺唯赞高保真酶(2×phantamaxmastermix,p515)扩增ahcep1,反应体系为:2×phantamaxmastermix12.5μl,上游引物1μl,下游引物1μl,cdna模板1μl,水补齐到25μl;
pcr反应体系为:95℃预变性5min,95℃变性25s,55℃退火25s,72℃延伸20s,35个循环,72℃后延伸5min;
(q1-2)pcr反应结束后,进行琼脂糖凝胶电泳,观测到目的条带如图1b所示,然后切胶并进行胶回收,胶回收操作根据天根普通琼脂糖凝胶dna回收试剂盒(dp209)步骤进行。
q2、表达载体构建
(q2-1)克隆载体构建:pcr产物与pmd19-tsimple克隆载体过夜连接,反应体系如下:pmd19-tsimple0.5μl,solutioni5.0μl和胶回收产物4.5μl。连接产物使用热激法转化大肠杆菌dh-5α菌株,在含有氨苄霉素的lb平板上生长过夜;
(q2-2)挑取白色单个菌落进行菌落pcr,反应体系为2×taqmastermix10μl,上游引物1μl,下游引物1μl,菌液模板1μl,水补齐到20μl,选取阳性菌落转移至5ml摇菌管中扩大培养;
(q2-3)质粒dna的提取:使用天根质粒小提中量试剂盒(dp106)提取质粒dna;
(q2-4)序列测定:测序工作由生工生物工程股份有限公司完成;
(q2-5)表达载体的构建:用bamhi和saci酶切测序正确的带有ahcep1基因的pmd19-tsimple质粒和带有35s的pcambia1300空载体,37℃酶切一个小时之后,进行琼脂糖凝胶电泳,切除正确的条带进行胶回收(图1c),将胶回收产物用thermo公司的t4dna连接酶连接,连接产物转化dh-5α菌株,在含有卡那霉素的lb平板上生长过夜。挑取白色单个菌落在lb平板上划线,进行菌落pcr(图1d),选取阳性菌落在lb液体培养基中过夜扩大培养。利用天根质粒小提试剂盒提取质粒并酶切鉴定,如图1e所示,构建得到35s:ahcep1的过表达载体;
(q2-6)取2.0μl质粒冻融法转化发根农杆菌r1601,准备侵染花生叶片。
实施例3:转基因花生毛状根诱导
p1、花生外植体获取
鲁花11号花生种子种植于人工气候室的花盆中(底部直径36cm,花盆高26cm),花生单粒种植,每盆4粒,培养温度为白天28℃,夜间25℃,16h光照/8h黑暗。花生幼苗生长至3-6片复叶时期,从底部向上选取2-4个复叶作为实验材料。用自来水冲洗花生叶片10min,用无菌水温和洗涤2min,用4%的次氯酸钠溶液浸泡2min,以叶柄切口处略显白色为准。然后用无菌水温和洗涤3-4次后,再用无菌水浸泡10min,晾干水分备用;
p2、ahcep1-r1601菌株活化
吸取100μl保存在-80℃的ahcep1-r1601农杆菌接种于100ml含卡那霉素(100μg/ml)和潮霉素(200μg/ml)的yep液体培养基中,28℃,180rpm震荡培养18h,第二天取100μl菌液接种于100ml新的yep液体培养基,28℃震荡培养,连续活化2-3次后培养至od600值1.5备用。同时取pcambia1300空载体转化发根农杆菌r1601菌株作为对照菌株。
p3、ahcep1-r1601侵染花生叶片
将消毒处理的花生叶片切成1cm左右,叶片上加2-3处划痕,用ahcep1-r1601侵染,操作过程如下:将处理的花生叶片没于ahcep1-r1601菌液中,浸泡5min,期间轻柔摇匀,使叶片表面充分沾满菌液,取出叶片,用无菌滤纸吸干菌液后,平整铺在ms固体培养基表面,每皿约8-12块花生叶片,24h后将叶片转移到添加100mg/l头孢噻肟钠的ms固体培养基上(抑制发根农杆菌的生长),24h后再转移到ms固体培养基上,依次轮流在两种培养基上转移,直至农杆菌不再生长为止,然后在含有卡那霉素的ms固体培养基上培养,诱导分化产生转基因花生毛状根。用发根农杆菌r1601作为对照,侵染方法一致。诱导形成的花生转基因毛状根。(花生转基因毛状根的形态如图2所示)。
实施例4:转基因花生毛状根阳性株系筛选和表达量鉴定
选取2cm以上的毛状根,转移到ms固体培养基上进行继代培养2周后,截取部分毛状根提取rna,具体操作如下:
(1)分别取不同转基因花生毛状根株系(空载pcambia1300转化的毛状根作为对照,即ck),用无菌水冲洗3次,晾干备用;
(2)液氮研磨成粉末,利用天根植物总rna提取试剂盒(dp432)提取花生毛状根rna。将提取的rna溶解后测定rna浓度,然后使用天根fastkinggdnadispellingrtsupermix反转录试剂盒进行反转录获得花生毛状根cdna;
(3)反转录的cdna稀释25倍作为rt-pcr模板,分别利用ahcep1和内参基因ahactin11引物分别进行rt-pcr扩增。反应体系为:2×phantamaxmastermix12.5μl,上游引物1μl,下游引物1μl,cdna模板5μl,水补齐到25μl;
pcr反应体系为:95℃预变性5min,95℃变性25s,55℃退火25s,72℃延伸25s,选取25-35个循环的pcr产物分别进行琼脂糖凝胶电泳分析,得到比较合适的扩增ahcep1和内参基因ahactin11的pcr循环数;
(4)利用ahactin11引物,通过多次pcr反应和琼脂糖凝胶电泳,增减样品模板量,使最终不同样本内参基因扩增获得的目的条带亮度一致。以此样本上样量为最终实验模板量,利用ahcep1引物进行rt-pcr扩增,此时获得的不同样本中的条带亮度就是不同转基因毛状根中ahcep1的表达水平(图3)。阳性转基因花生毛状根株系ahcep1表达量会显著高于对照,选取ahcep1表达水平较高的转基因株系(35s:ahcep1)进行表型鉴定,鉴定结果如图3所示。
实施例5:转基因花生毛状根高盐、低氮胁迫下表型鉴定
·实验方法:
选取继代培养的35s:ahcep1和对照(ck)转基因花生毛状根分支,称重后分别转移至分别转移至ms和含有150mmnaclms液体培养基中,23-26℃,160rpm,继代培养,连续培养6周,期间每隔2周更换新鲜的含nacl或正常的ms液体培养基,观察不同转基因毛状根的形态特征,最后用无菌水洗净晾干,分别称不同转基因花生毛状根鲜重即生物量(鲜重=每瓶毛状根重量-接种重量)(图4);
选取继代培养的35s:ahcep1和ck花生毛状根分支,称重后分别转移至分别转移至正常氮液体培养基(5mm硝酸钾)以及低氮液体培养基(0.2mm硝酸钾)中,23-26℃,160rpm,继代培养,连续培养6周,期间每隔2周更换新鲜的正常氮或低氮液体培养基,观察不同转基因毛状根的形态特征,最后用无菌水洗净晾干,分别称不同转基因花生毛状根生物量(图4)。
·实验结果分析:
由图4a可知,转基因花生毛状根35s:ahcep1在高盐、低氮胁迫条件下的生长状况优于空白对照组ck,然后对转基因花生毛状根35s:ahcep1和空白对照组ck进行生物量测定(图4b),结果表明:在高盐胁迫条件下,空白对照组ck的生物量为7.2g,转基因花生毛状根35s:ahcep1的生物量为9.5g;在低氮胁迫条件下,空白对照组ck的生物量为6.9g,转基因花生毛状根35s:ahcep1的生物量为9.8g;对照组中,空白对照组ck的生物量为14.5g,转基因花生毛状根35s:ahcep1的生物量为13.2g。由此可见,利用本发明实施例提供的方法诱导得到的转基因花生毛状根35s:ahcep1在高盐、低氮胁迫条件下的生物量均有显著提高,其中在高盐胁迫条件下生物量提高了31.9%,在低氮胁迫条件下生物量提高了42.0%,且均显著高于对照组。
实施例6:过表达ahcep1转基因花生毛状根35s:ahcep1中盐胁迫及氮转运相关基因表达量检测
·实验步骤:
使用beacondesigner7和primerpremier5.0等软件按照qrt-pcr实验要求设计基因特异引物,并在上海生工生物工程服务有限公司合成引物,采用page纯化。
应用qrt-pcr96孔板(axygen,美国)和高透光率封口膜(axygen,美国),荧光定量pcr仪icyclerreal-timepcrsystem(bio-rad,美国)进行qrt-pcr分析。反应体系参照sybrgreenrealtimepcrmastermix(qpk-201)说明书,反应条件如下:
95.0℃60s;(2)95.0℃10s;(3)58.0±5.0℃10s;(4)72.0℃15s;(5)plateread;(6)incubateat65℃for20s;(7)meltingcurvefrom65℃to95℃,readevery0.5℃,hold1s;(8)end;其中(2)(3)(4)50-60cycles。
将所有样品混合,进行qrt-pcr扩增,分析融解曲线验证引物扩增的特异性,单一峰说明引物能够特异扩增,如有双峰,适当调整退火温度及引物用量,若仍然不能特异扩增,重新设计引物。使用混合模板按10倍浓度依次稀释,共稀释3次,用4个浓度的样品构建相对标准曲线;
以花生ahactin11为内参,调整各模板浓度使内参ct值之差小于2。每个基因扩增均有内参同时扩增,默认条件下读取ct值,数据分析采用双标准曲线法,计算平均表达量和相对偏差,同时利用2-δδct大致计算与内参的相对表达量,确定基因的表达丰度;
·实验结果分析:
实验结果如图5所示,图5a显示,盐胁迫处理后,关键na+转运体high-affinityk+transporter1(hkt1)和sodiumhydrogenexchanger1-like在35s:ahcep1转基因花生毛状根中表达量显著上调,其余两个na+转运体表达量变化不明显。如图5b显示,低氮胁迫下,no3-关键转运体nrt1.1和nrt2.1在35s:ahcep1转基因花生毛状根中表达量高于对照,nrt3.1没有显著差异。综上所述,表明ahcep1通过调控na+转运体high-affinityk+transporter1(hkt1)和sodiumhydrogenexchanger1-like,提高na+清除,从而降低盐胁迫毒害作用;通过上调no3-转运体nrt1.1和nrt2.1表达,提高no3-吸收率,增强花生对低氮胁迫耐受能力。
序列表
<110>山东省花生研究所
<120>花生毛状根株系在提高花生耐低氮、耐高盐能力中的应用
<160>4
<170>patentinversion3.5
<210>1
<211>315
<212>dna
<213>cepno.1
<400>1
1atggccaattccaaacttgtgttcattgtcagttctatcctcctagccttggtgattttg
61aatggtaccttttcagttctaggaaggccactcaaaacggaaaacaataataatgtaaaa
121gtgccaaccgcctatgaagacgaggacaatatagacaagatggctatagcggcggaaaaa
181actgtcgtgtggcgccgttacacctcacagaattcaccgccagccgatggggtcggaaat
241tggaccgatgatttccgacccaccgatccaggccacagtcccggagcgggccattcctcc
301cccacgccaaactag315
<210>2
<211>104
<212>protein
<213>cepno.2
<400>2
1mansklvfivssillalvilngtfsvlgrplktennnnvkvptayedednidkmaiaaek
61tvvwrrytsqnsppadgvgnwtddfrptdpghspgaghssptpn104
<210>3
<211>30
<212>dna
<213>ahcep1-f
<400>3
1ggatccatggccaattccaaacttgtgttg30
<210>4
<211>26
<212>dna
<213>ahcep1-r
<400>4
1gagctcctagtttggcgtgggggagg26
- 还没有人留言评论。精彩留言会获得点赞!