SARS-CoV-2冠状病毒3C蛋白酶活性抑制剂的筛选方法及筛选试剂盒与流程
sars-cov-2冠状病毒3c蛋白酶活性抑制剂的筛选方法及筛选试剂盒
技术领域
1.本发明属于分子和细胞生物学领域,具体涉及一种病毒3c蛋白酶活性抑制剂的筛选方法及筛选试剂盒,尤其涉及一种sars-cov-2冠状病毒3c蛋白酶活性抑制剂的筛选方法及筛选试剂盒。
背景技术:
2.新型冠状病毒sars-cov-2是2019年发现的第7种可以感染人的冠状病毒,于2020年1月12日被世界卫生组织命名,其可以引发新型冠状病毒肺炎covid-19,对人类的身体健康产生严重的威胁。
3.sars-cov-2冠状病毒与2003年“非典”sars冠状病毒(sars-cov)和“中东呼吸综合征”mers冠状病毒(mers-cov)一样,同属于单正链rna病毒。通过基因序列比对,sars-cov-2与sars-cov有约80%相似性,与mers-cov有40%的相似性。sars-cov-2冠状病毒传染性强,对人类健康是一个重大的潜在威胁,因此寻找抗sars-cov-2冠状病毒的药物势在必行。
4.3c蛋白酶又称为3cl蛋白酶或m蛋白酶,在单正链rna病毒的蛋白成熟过程中发挥着重要作用,其能够识别特异的酶切位点,剪切病毒的多聚蛋白,将其剪切为多个有活性的蛋白,最终组装为新的病毒颗粒。因此,抑制3c蛋白酶的催化功能可有效抑制病毒前体蛋白的切割、阻断病毒的复制,起到抗单正链rna病毒的作用。通过筛选能够抑制3c蛋白酶活性的抑制剂已经成为当前开发抗单正链rna病毒的药物的重要途径,因此,针对一种新发现的单正链rna病毒-sars-cov-2冠状病毒,在体外建立用于筛选其3c蛋白酶活性的抑制剂的方法对于抗sars-cov-2冠状病毒药物的开发具有重要的临床意义。
技术实现要素:
5.针对现有技术中存在的问题的一个或多个,本发明的一个方面提供一种病毒3c蛋白酶活性抑制剂的筛选方法,其包括:
6.将表达具有活性的病毒3c蛋白酶的表达载体、表达病毒3c蛋白酶的底物的表达载体与候选试剂在细胞中共孵育作为实验组,同时设置不添加候选试剂的阴性对照,根据实验组相对于阴性对照的荧光信号强度的变化来筛选病毒3c蛋白酶活性抑制剂;
7.其中所述病毒3c蛋白酶的底物为il1β蛋白和gussia荧光素酶通过病毒3c蛋白酶的酶切位点连接而成的融合蛋白。
8.上述病毒3c蛋白酶为sars-cov-2冠状病毒3c蛋白酶。
9.上述表达具有活性的病毒3c蛋白酶的表达载体的构建方法包括:
10.a)在sars-cov-2冠状病毒3c蛋白酶的核苷酸序列的5’和3’端分别连接sars-cov-2冠状病毒的nsp7和nsp8序列,且在各连接处插入sars-cov-2冠状病毒3c蛋白酶的酶切位点,获得sars-cov-2冠状病毒3c蛋白酶重组表达序列;
11.b)将步骤a)的3c蛋白酶重组表达序列克隆至真核表达载体,获得表达具有活性的
病毒3c蛋白酶的表达载体。
12.上述表达病毒3c蛋白酶的底物的表达载体的构建方法包括:
13.a)将il1β蛋白表达序列和gussia荧光素酶表达序列通过sars-cov-2冠状病毒3c蛋白酶的酶切位点连接,获得融合表达序列;
14.b)将步骤a)的融合表达序列克隆至真核表达载体,获得表达病毒3c蛋白酶的底物的表达载体。
15.上述荧光信号强度的变化为荧光信号强度的降低。
16.用于上述的方法的表达具有活性的sars-cov-2冠状病毒3c蛋白酶的表达载体也属于本发明的内容;任选地,所述表达具有活性的sars-cov-2冠状病毒3c蛋白酶的表达载体的核苷酸序列如seq id no:7所示。
17.用于上述的方法的表达sars-cov-2冠状病毒3c蛋白酶的底物的表达载体也属于本发明的内容;任选地,所述表达sars-cov-2冠状病毒3c蛋白酶的底物的表达载体的核苷酸序列如seq id no:3所示。
18.本发明的另一方面提供一种用于筛选sars-cov-2冠状病毒3c蛋白酶活性抑制剂的试剂盒,其包括上述的表达具有活性的sars-cov-2冠状病毒3c蛋白酶的表达载体,和上述的表达sars-cov-2冠状病毒3c蛋白酶的底物的表达载体。
19.本发明另一方面还提供一种病毒3c蛋白酶活性的测定方法,其包括以下步骤:
20.1)将il1β蛋白表达序列和gussia荧光素酶表达序列通过病毒3c蛋白酶的酶切位点连接,获得融合表达序列;
21.2)将步骤1)的融合表达序列克隆至真核表达载体,获得表达载体;
22.3)将步骤2)的表达载体与病毒3c蛋白酶的表达体系在细胞中进行共表达,通过测定共表达体系的荧光信号强度来表征病毒3c蛋白酶的活性;
23.任选地,步骤3)中所述病毒3c蛋白酶的表达体系为将病毒3c蛋白酶的表达序列克隆至真核表达载体所构建的病毒3c蛋白酶的表达载体。
24.上述病毒3c蛋白酶为单正链rna病毒的3c蛋白酶,优选为sars-cov-2冠状病毒3c蛋白酶。
25.本发明再一方面还提供一种测定sars-cov-2冠状病毒3c蛋白酶活性的试剂盒,其包括上述的表达sars-cov-2冠状病毒3c蛋白酶的底物的表达载体;任选地,所述表达sars-cov-2冠状病毒3c蛋白酶的底物的表达载体的核苷酸序列如seq id no:3所示。
26.基于以上技术方案提供的sars-cov-2冠状病毒3c蛋白酶活性抑制剂的筛选方法通过建立表达具有活性的sars-cov-2冠状病毒3c蛋白酶的体系,并构建一个基于3c蛋白酶酶切进而激活荧光素酶活性的报告体系,能够在细胞水平对sars-cov-2冠状病毒3c蛋白酶活性进行评价,进而可以利用该评价体系对sars-cov-2冠状病毒3c蛋白酶活性的抑制剂进行筛选。基于提供的筛选方法还提供了用于筛选sars-cov-2冠状病毒3c蛋白酶活性抑制剂的试剂盒,可以快速筛选出能够抑制sars-cov-2冠状病毒3c蛋白酶活性的抑制剂,能够有效用于抗sars-cov-2冠状病毒的药物的开发。
附图说明
27.图1为sars-cov-2冠状病毒3c蛋白酶活性测定体系的构建原理图;
28.图2为表达载体s1的质粒图谱;
29.图3为表达载体c1的质粒图谱;
30.图4为表达载体c1和表达载体c2表达的3c蛋白酶的活性对比柱状图;
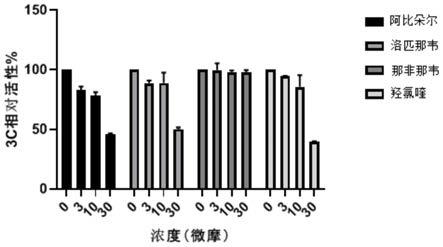
31.图5为候选化合物和阳性药物对3c蛋白酶活性的抑制效果图;
32.图6为羟氯喹对sars-cov-2冠状病毒3c蛋白酶活性的抑制曲线。
具体实施方式
33.本发明旨在提供一种病毒3c蛋白酶活性抑制剂的筛选方法,尤其是提供一种sars-cov-2冠状病毒3c蛋白酶活性抑制剂的筛选方法,并基于该筛选方法提供一种快速筛选sars-cov-2冠状病毒3c蛋白酶活性抑制剂的试剂盒。
34.为了实现上述目的,本发明人参考以下原理:il1β蛋白前体在细胞中会发生聚集沉淀,必须经过蛋白酶caspase1的剪切,才能释放出c端可溶的il1,构建了一个il1β蛋白前体和gussia荧光素酶(gluc)串联表达的融合载体,如图1所示,表达的两个蛋白之间以3c蛋白酶的酶切位点相连接,当细胞中没有3c蛋白酶时,融合蛋白会发生聚集沉淀,而当3c蛋白酶剪切il1β与gussia荧光素酶之间的酶切位点后,将释放出活化可溶的gussia荧光素酶,因此通过荧光(化学发光)信号强度的高低,就可以表征3c蛋白酶的活性,本发明构建的可以表征3c蛋白酶活性的体系也属于本发明的内容。为了筛选sars-cov-2冠状病毒3c蛋白酶活性的抑制剂,获得一种表达具有较高活性的3c蛋白酶的表达载体是关键,本发明人利用sars-cov-2冠状病毒的两个序列nsp7和nsp8编码的蛋白长度较小,且边界的酶切位点与3c蛋白酶的酶切位点同源性高的特点,构建获得一种可以表达具有较高3c蛋白酶活性的表达载体,用于对3c蛋白酶活性的抑制剂进行筛选。
35.以下以筛选sars-cov-2冠状病毒3c蛋白酶活性的抑制剂的方法为例,对本发明进一步阐述。应当理解的是,具体实施例仅用于进一步说明本发明,而不是用于限制本发明的内容。
36.下述实施例中所用方法如无特别说明均为常规方法,具体步骤可参见:《分子克隆实验指南》(《molecular cloning:a laboratory manual》sambrook,j.,russell,david w.,molecular cloning:a laboratory manual,3rd edition,2001,ny,cold spring harbor)。
37.实施例中描述到的各种生物材料的取得途径仅是提供一种实验获取的途径以达到具体公开的目的,不应成为对本发明生物材料来源的限制。事实上,所用到的生物材料的来源是广泛的,任何不违反法律和道德伦理能够获取的生物材料都可以按照实施例中的提示替换使用。
38.所用序列由上海生工有限公司合成。
39.实施例1:sars-cov-2冠状病毒3c蛋白酶活性测定体系的构建
40.该实施例构建了一个含有sars-cov-2冠状病毒3c蛋白酶酶切位点的融合蛋白作为sars-cov-2冠状病毒3c蛋白酶的底物,如图1所示,该底物包含了il1β蛋白-3c酶切位点(3c酶切位点的氨基酸序列如序列表中seq id no:1所示)-gussia荧光素酶(gluc),即il1β蛋白和gussia荧光素酶通过3c酶切位点连接,其氨基酸序列如序列表中seq id no:2所示,具体的构建方法为:
41.合成包含表达il1β蛋白-sars-cov-2冠状病毒3c酶切位点-gussia荧光素酶的基因序列,并将该基因序列克隆至载体pcdna3.1(thermo fisher scientific)上,获得表达3c蛋白酶的底物的表达载体,命名为表达载体s1,该表达载体s1的核苷酸序列如seq id no:3所示,质粒图谱如图2所示。将该表达载体s1转染hek 293t细胞,表达获得的融合蛋白可以作为sars-cov-2冠状病毒3c蛋白酶的底物,将用于以下实施例中测定3c蛋白酶的活性。
42.如果在表达载体s1进行表达时,体系中没有3c蛋白酶剪切表达的融合蛋白,那么融合蛋白将发生聚集沉淀而失活;当存在3c蛋白酶对表达的融合蛋白进行剪切时,荧光素酶得以活化,因此可以通过读取荧光信号的强度变化表征3c蛋白酶的活性,进而根据3c蛋白酶的活性筛选抑制3c蛋白酶活性的抑制剂。因此可以基于该实施例获得的表达载体s1提供一种测定sars-cov-2冠状病毒3c蛋白酶活性的试剂盒,该试剂盒中包括表达载体s1,当使用该试剂盒时,可以将表达载体s1与sars-cov-2冠状病毒3c蛋白酶的表达载体共转染hek 293t细胞共表达,通过读取共表达体系中荧光信号强度来表征3c蛋白酶的活性。
43.实施例2:在体外具有活性的sars-cov-2冠状病毒3c蛋白酶的表达
44.sars-cov-2冠状病毒入侵人体之后,以自身rna为模板翻译合成含有多个蛋白的多聚蛋白体,只有在具有活性的3c蛋白酶酶切后,才能剪切为独立的有活性的蛋白进行后续的复制和组装。然而,现有技术中表达的sars-cov-2冠状病毒3c蛋白酶,通常其蛋白酶活性非常低,甚至没有活性,因此就需要对其表达结构进行针对性设计,使得表达的3c蛋白酶能够发生自剪切和二聚化,以获得其生物功能,提高蛋白酶的活性。
45.该实施例为了提高表达的sars-cov-2冠状病毒3c蛋白酶的活性,在3c蛋白酶表达序列(其核苷酸序列如seq id no:4所示)的5’和3’端分别连接sars-cov-2冠状病毒的nsp7(其核苷酸序列如seq id no:5所示)和nsp8(其核苷酸序列如seq id no:6所示)序列,且在连接处插入了3c蛋白酶的酶切位点的表达序列,构建获得一重组表达序列,该重组表达序列可以促进3c蛋白酶在表达后完成自剪切和二聚化,进而成为具有生物功能的活化蛋白。将该重组表达序列克隆至真核表达载体pcdna3.1后,获得表达具有较高生物活性的sars-cov-2冠状病毒3c蛋白酶的表达载体,命名为表达载体c1,其核苷酸序列如序列表中seq id no:7所示,如图3所示,示出了该表达载体c1的质粒图谱。同时合成单独的3c蛋白酶表达序列,并克隆到真核表达载体pcdna3.1作为阴性对照,命名为表达载体c2,其核苷酸序列如序列表中seq id no:8所示。
46.为了验证该实施例获得的表达载体c1确实能够获得具有较高活性的3c蛋白酶,将hek293t细胞重悬至1
×
105个细胞/ml,以100μl每孔铺板于96孔板中,8小时后进行dna转染;每孔转入150ng dna,其中包含了50ng的来自表达载体s1的质粒(s1质粒)和梯度稀释的来自表达载体c1和c2的质粒(0ng、25ng、50ng、100ng,c1/c2质粒),不足的dna用pcdna3.1空载体补齐。具体转染操作为:准备10μl的opti-mem(gibco)培养基加入相应的dna后,混匀,加入dna质量3倍的lipofiter转染试剂(hanbio,上海),室温静置10分钟后,滴加入96孔板中,于5%co2培养箱中培养24小时后,每孔加入15μl的renilla-glo试剂(promega),反应5分钟后,读取荧光值。
47.结果如图4所示,可见,将该实施例构建的表达载体c1转染hek 293t细胞后表达的3c蛋白酶能够呈质量依赖性的剪切由表达载体s1表达的底物,即加入的表达载体c1越多,
剪切的底物越多,荧光信号强度越高(荧光值越大),显著高于同等转染量的c2质粒剪切底物后的荧光值,证明表达载体c1表达的3c蛋白酶的活性远远高于表达载体c2表达的3c蛋白酶的活性,经计算,由c1表达的3c蛋白酶的酶切活性约为由c2表达的3c蛋白酶的酶切活性的1000倍。
48.实施例3:sars-cov-2冠状病毒3c蛋白酶活性抑制剂的筛选
49.该实施例利用上述实施例1构建的表达载体s1和实施例2构建的表达载体c1对sars-cov-2冠状病毒3c蛋白酶活性的抑制剂进行筛选,具体包括以下操作:
50.3.1、将hek 293t细胞铺于10厘米的细胞培养皿内,密度达到75%时进行转染。
51.3.2、将表达3c蛋白酶的c1载体3μg和表达3c蛋白酶的底物的s1载体6μg混合,加入1ml的opti-mem培养基中,混匀,之后加入27μl转染试剂lipofiter,吹吸混匀,室温静置10分钟,滴加入hek 293t细胞进行蛋白表达。转染8小时后,利用0.25%胰酶对细胞进行消化,并离心重悬,稀释至1
×
105个细胞/ml。
52.3.3、分别将梯度稀释(0.0、3.0、10.0、30.0μm)的溶于dmso的化合物(阿比朵尔(arbidol)、洛匹那韦(lopinavir)、那非那韦(nelfinavir)和羟氯喹(hydroxychloroquine)(均购自medchemexpress),其中阿比朵尔和洛匹那韦作为阳性药物(zhen zhu等,arbidol monotherapy is superior to lopinavir/ritonavir in treating covid-19,journal of infection,doi:10.1016/j.jinf.2020.03.060;bodee nutho等,why are lopinavir and ritonavir effective against the newly emerged coronavirus 2019?atomistic insights into the inhibitory mechanisms,biochemistry,2020.04.15,doi:10.1021/acs.biochem.0c00160),那非那韦和羟氯喹作为候选化合物)按体积比为1:1000加入细胞重悬液,随后每孔100μl铺至96孔培养板,继续于5%co2的37℃培养箱中培养16个小时;将96孔培养板取出,加入15μl renilla glo reagent(promega),室温孵育5分钟,读取荧光值。同时设置不加细胞的空白培养基的空白对照和不加候选化合物或阳性药物的阴性对照,在扣除空白对照孔的读值后,分别通过各自的荧光值计算每种候选化合物或阳性药物在梯度浓度下的3c蛋白酶的相对活性。结果如图5所示,为上述两种候选化合物和两种阳性药物在不同浓度下的3c蛋白酶的相对活性,可见两种阳性药物均表现出对sars-cov-2冠状病毒3c蛋白酶活性的抑制效果,并且呈现剂量依赖性,即在一定浓度范围内,阳性药物的浓度越高,对3c蛋白酶的活性抑制作用越强。另外两种候选化合物中那非那韦未表现出对sars-cov-2冠状病毒3c蛋白酶活性的抑制,而羟氯喹表现出能够抑制sars-cov-2冠状病毒3c蛋白酶的活性,并且同两种阳性药物一样,呈现出剂量依赖性,因此,可以选择羟氯喹作为制备抗sars-cov-2冠状病毒感染的药物的候选化合物。
53.3.4、按照以上操作,使用梯度浓度为0、0.01、0.03、0.1、0.3、1、3、10、30、100μm的羟氯喹对c1载体和s1载体在hek 293t细胞中的共表达体系进行处理,同时设置不加细胞的空白培养基的空白对照和不加羟氯喹的阴性对照,在扣除空白对照孔的读值后,分别通过各自的荧光值计算每种浓度下对3c蛋白酶的抑制率。结果如图6所示,为梯度稀释浓度的羟氯喹对sars-cov-2冠状病毒3c蛋白酶活性的抑制曲线,经计算,羟氯喹抑制sars-cov-2冠状病毒3c蛋白酶活性的半数抑制浓度ic
50
约为30nm。
54.综上实施例的描述,本发明构建一种能够测定3c蛋白酶活性的体系,并构建一种
表达具有较高活性的3c蛋白酶的载体,两者可以组合作为筛选sars-cov-2冠状病毒3c蛋白酶活性抑制剂的试剂盒,即该试剂盒中包括表达3c蛋白酶的底物的s1载体和表达具有活性的3c蛋白酶的c1载体,两者可以用于快速筛选出sars-cov-2冠状病毒3c蛋白酶活性的抑制剂,对于抗sars-cov-2冠状病毒感染的药物的开发提供了重要的数据支撑。
55.以上实施例仅仅描述了sars-cov-2冠状病毒3c蛋白酶活性抑制剂的筛选方法,由于在单正链rna病毒中均存在3c蛋白酶,并且各自能够识别特异的酶切位点,因此可以根据上述实施例的描述构建单正链rna病毒各自的测定3c蛋白酶活性的体系以及表达各自的具有活性的3c蛋白酶的表达载体,均可以用于筛选各自病毒的3c蛋白酶活性的抑制剂,用于抗病毒药物的开发。
56.最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1