一种吲哚-二氢化萘类化合物及其制备方法和应用与流程
本发明涉及化合物合成技术领域,尤其涉及一种吲哚-二氢化萘类化合物及其制备方法和应用。
背景技术:
吲哚类化合物,是广泛存在于植物和中草药中的生物碱。许多吲哚衍生物都具有广泛的生理功能和活性,如抗炎、止吐、抗真菌、抗便秘等作用,以下列出了一些代表性的有生物活性的已上市的吲哚类药物:
氧/氮杂苯并降冰片烯的不对称开环反应是得到光学纯二氢化萘比较直接最有效的方法。过渡金属催化的不对称氢官能团化反应具有对环境影响小,原子经济性高,操作简便的优点,这些特点早已被学术界和工业界所证实。若反应中引入吲哚为亲核试剂,就能比较方便地合成具有吲哚骨架及氢化萘结构的化合物。2000年,加拿大多伦多大学lautens等人报道了利用手性铑/二茂铁双膦配合物催化下吲哚对氧杂苯并降冰片烯不对称开环反应,仅得到了吲哚c3位对氧杂苯并降冰片烯开环的的产物(于2003年证实)(lautens,m.;fagnou,k.;rovis,t.rhodium-catalyzedasymmetricalcoholysisandaminolysisofoxabenzonorbornadiene:anewenantioselectivecarbon-heteroatombondformingprocess.j.am.chem.soc.2000,122,5650-5651;lautens,m.;fagnou,k.effectsofhalideligandsandproticadditivesonenantioselectivityandreactivityinrhodium-catalyzedasymmetricring-openingreactions.j.am.chem.soc.2001,123,7170-7171;lautens,m.;fagnou,k.;yang,d.-q.rhodium-catalyzedasymmetricringopeningreactionsofoxabicyclicalkenes:applicationofhalideeffectsinthedevelopmentofageneralprocess.j.am.chem.soc.2003,125,14884-14892)。
其后,云南民族大学樊保敏教授于2016年报道了一例手性铑/双膦配合物催化下吲哚对氧杂苯并降冰片烯不对称开环反应,同样只得到了吲哚c3位对氧杂苯并降冰片烯开环的的产物(xu,x.;chen,j.;he,z.;zhou,y.;fan,b.rhodium-catalyzedasymmetricringopeningreactionofoxabenzonorbornadieneswithaminesusingzni2astheactivator.org.biomol.chem.2016,14,2480-2486)。可见,吲哚对氧杂苯并降冰片烯的不对称开环反应较小希望得到氮吲哚取代的开环产物。
因此,本领域亟待开发更多种类的吲哚类药物及制备方法,同时实现高对映选择性及高收率。
技术实现要素:
针对现有技术的不足,本发明的目的之一在于提供一种吲哚-二氢化萘类化合物。所述化合物具有较好的抗炎活性,能够应用于制备抗炎药物。
为达此目的,本发明采用如下技术方案:
本发明提供一种吲哚-二氢化萘类化合物,所述化合物具有式ii所示的结构;
式ii中,*代表手性碳原子;
式ii中,两个手性碳原子的构型组合为(r,r)、(s,s)、(r,s)或(s,r)中的任意一种;括号内,前者代表羟基连接的手性碳原子的构型,后者代表n原子连接的手性碳原子的构型
示例性地,(r,s)指的是:羟基连接的手性碳原子为(r)构型,n原子连接的手性碳原子为(s)构型,其中构型(r)和构型(s)为本领域公知常识;
式ii中,所述r1、r2、r3和r4各自独立地选自氢、羟基、取代或未取代的c1-c6烷基、取代或未取代的c1-c6烷氧基、c1-c6全氟烷基、卤素、取代或未取代的c2-c6烷羰基、取代或未取代的c6-c12芳基、取代或未取代的苄基、取代或未取代的c2-c6酯基、取代或未取代的c2-c8含烯基取代基、取代或未取代的c2-c8含炔基取代基、取代或未取代的c2-c10杂环基、氨基、胺基中的任意一种,且r1、r2、r3和r4中任意相邻的两个基团可以连接成环;
式ii中,所述r'选自氢、取代或未取代的c1-c8烷基、取代或未取代的c6-c12芳基、取代或未取代的苄基、取代或未取代的c2-c6酯基、取代或未取代的c2-c8含烯基取代基、取代或未取代的c2-c8含炔基取代基、取代或未取代的c2-c10杂环基、取代或未取代的硅基、胺基中的任意一种;
r1、r2、r3、r4和r'中,所述取代的基团各自独立地选自c1-c6烷基、c1-c6烷氧基、c1-c6全氟烷基、卤素、苯基、苄基、萘基、c2-c6酯基、c2-c10杂环基、氰基、硝基、羟基、氨基或胺基中的任意一种或至少两种组合。
本发明提供的吲哚-二氢化萘类化合物相较于其他类型的吲哚类化合物,具有更加优异的抗炎效果。
本发明的制备方法选用铑、钯金属催化剂,选用邻乙炔基苯胺作为吲哚来源,操作简便安全,反应步骤少,原料易得,催化剂用量少,反应条件温和、无副产物、底物拓展范围广、化合物官能团容忍度高,对映选择性保持在92%以上,甚至高达99%,收率高,产物收率可以达到86%以上,高对映选择性和收率地制备得到的氮-吲哚基手性二氢化萘类化合物及其衍生物具有一定生物活性,如抗炎活性。
本发明中,c1-c6烷基、c1-c6烷氧基、c1-c6全氟烷基的碳个数各自独立地可以为c2、c3、c4、c5等;c2-c6烷羰基、c2-c6酯基的碳个数各自独立地可以为c2、c3、c4、c5等;含烯基取代基的碳个数可以为c2、c3、c4、c5、c6、c7、c8等;含炔基取代基的碳个数可以为c2、c3、c4、c5、c6、c7、c8等;c6-c12芳基的碳个数可以为c8、c10、c12等;c2-c10杂环基的碳个数可以为c3、c4、c5、c6、c7、c8、c9等。
本发明中,氨基为-nh2,胺基指的是-nh2中的至少一个氢原子被取代后的基团。
优选地,所述r1、r2、r3和r4各自独立地选自氢、取代或未取代的c1-c6烷氧基、取代或未取代的c1-c6烷基、取代或未取代的c2-c6酯基、取代或未取代的c2-c8含烯基取代基、取代或未取代的c2-c8含炔基取代基、卤素、取代或未取代的c2-c6烷羰基、取代或未取代的c6-c12芳基、取代或未取代的苄基中的任意一种。
优选地,所述r'选自取代或未取代的c1-c6烷基、取代或未取代芳基或取代的硅基中的任意一种。
优选地,所述取代或未取代的c6-c12芳基包括苯基或萘基。
优选地,所述卤素包括氟、氯、溴或碘,优选氟或溴。
优选地,所述取代的硅基包括三甲基硅基、三乙基硅基、三异丙基硅基、三叔丁基硅基、二甲基苯基硅基、二苯基甲基硅基、二乙氧基甲基硅基或二甲氧基苯基硅基,优选三乙基硅基或三异丙基硅基。
优选地,所述吲哚-二氢化萘类化合物具有如下结构中的任意一种:
其中,cf3代表三氟甲基,ocf3代表三氟甲氧基,no2代表硝基,cn代表氰基,oh代表羟基,ome代表甲氧基,
其中,bu代表正丁基,ipr代表异丙基,me代表甲基,(r)、(s)代表手性碳原子的构型。手性碳原子的构型包括(r)和(s),鉴于该类化合物有两个手性中心,该类化合物具有两对完全不同的构型,其中(r,r)与(s,s)为对映异构体,(r,s)与(s,r)为对映异构体,两对对映异构体中的任一构型是另一对对映异构体中任一构型的非对映异构体,一对对映异构体可以通过使用配体的对映异构体获得。
优选地,所述吲哚-二氢化萘类化合物的对映选择性在92%以上,优选99%。
本发明的目的之二在于提供一种目的之一所述的吲哚-二氢化萘类化合物的制备方法,所述制备方法包括:式i-1所示的化合物和式i-2所示的化合物在铑催化剂和钯催化剂的存在下进行氢胺化反应,得到式ii所示的化合物,反应式如下:
式ii中,*代表手性碳原子;
式ii中,两个手性碳原子的构型组合为(r,r)、(s,s)、(r,s)或(s,r)中的任意一种;
所述r1、r2、r3、r4和r'均具有与式ii中相同的选择范围;
本发明的制备方法选用铑、钯金属催化剂,选用邻乙炔基苯胺作为吲哚来源,操作简便安全,反应步骤少,原料易得,催化剂用量少,反应条件温和、无副产物、底物拓展范围广、化合物官能团容忍度高,对映选择性保持在92%以上,甚至高达99%,收率高,产物收率可以达到86%以上,高对映选择性和收率地制备得到的氮-吲哚基手性二氢化萘类化合物及其衍生物具有较好的生物活性,如抗炎活性。
优选地,所述铑催化剂包括铑金属配合物。
优选地,所述铑金属配合物包括铑与膦配体的配合物。
优选地,所述铑金属配合物通过铑金属盐和膦配体反应得到。
优选地,所述膦配体为手性膦配体。
优选地,所述铑金属盐包括铑的卤化物、铑的氢氧根盐、铑的烷氧基共价盐、铑的硫酸盐、铑的硝酸盐、铑的高氯酸盐、铑的醋酸盐、铑的三氟乙酸盐、铑的三氟甲烷磺酸盐、铑的四氟硼酸盐、铑的六氟磷酸盐或铑的六氟锑酸盐中的任意一种或至少两种的组合。
优选地,所述手性膦配体包括式a至式p所示的配体或者与式a至式p所示的配体具有相反构型的配体中的任意一种或至少两种组合;
所述ar选自苯基、4-甲基苯基、3,5-二甲基苯基、2,4,6-三甲基苯基、3,5-二(三氟甲基)苯基、4-甲氧基-3,5-二甲基苯基或4-甲氧基-3,5-二叔丁基苯基;
所述r为甲基、乙基、异丙基、叔丁基、环丙基、环己基、环戊基、苯基或苄基;
所述me为甲基,所述ph为苯基。
优选地,所述手性膦配体包括式a、式b、式l或式m所示的配体中的任意一种或至少两种组合。
优选地,所述铑金属盐中所含金属元素与膦配体的摩尔比为1:1.1-1:5,例如1:1.2、1:1.5、1:2、1:3、1:4等。
优选地,所述铑金属盐和膦配体反应的温度为0-70℃,例如5℃、10℃、15℃、20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃等。
优选地,所述铑金属盐和膦配体反应的时间为0.1-12h,例如1h、2h、3h、4h、5h、6h、7h、8h、9h等。
优选地,所述铑金属盐和膦配体的反应在有机溶剂中进行。
优选地,所述有机溶剂包括苯、甲苯、环己烷、乙苯、二甲苯、四氯化碳、乙酸乙酯、乙腈、二氯甲烷、氯乙烷、二氯乙烷、1,2-二氯丙烷、氯丙烷、丙酮、三氯甲烷、正己烷、四氢呋喃、1,4-二氧六环、二甲基甲酰胺或二甲基乙酰胺中的任意一种或至少两种组合,优选四氢呋喃和/或二甲基甲酰胺。
优选地,所述钯催化剂包括二价钯金属盐、二价钯与乙腈的配合物、二价钯与1,10-菲罗啉类化合物的配合物或零价钯配合物中的任意一种或至少两种组合,优选二价钯金属盐、二价钯与乙腈的配合物或二价钯与1,10-菲罗啉类化合物的配合物中的任意一种或至少两种组合。
优选地,所述钯催化剂包括钯的卤化物、钯的硫酸盐、钯的硝酸盐、钯的高氯酸盐、钯的醋酸盐、钯的三氟乙酸盐、钯的三氟甲烷磺酸盐、钯的四氟硼酸盐、钯的六氟磷酸盐、钯的六氟锑酸盐、钯金属盐与乙腈的配合物、钯金属盐与1,10-菲罗啉类化合物的配合物或零价钯配合物中的任意一种或至少两种组合。
优选地,所述铑催化剂与钯催化剂的摩尔比为1:(1-10),例如1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9等,优选1:(1-5)。
优选地,所述氢胺化反应在有机溶剂中进行。
优选地,所述有机溶剂包括苯、甲苯、环己烷、乙苯、二甲苯、四氯化碳、乙酸乙酯、乙腈、二氯甲烷、氯乙烷、二氯乙烷、1,2-二氯丙烷、氯丙烷、丙酮、三氯甲烷、正己烷、四氢呋喃、1,4-二氧六环、二甲基甲酰胺或二甲基乙酰胺中的任意一种或至少两种组合,优选四氢呋喃和/或二甲基甲酰胺。
优选地,所述铑催化剂中金属元素的物质的量与式i-1所示化合物的物质的量之比为0.0005:1-0.1:1,例如0.001:1、0.005:1、0.01:1、0.015:1、0.02:1、0.025:1、0.03:1、0.035:1、0.04:1、0.045:1、0.05:1、0.06:1、0.07:1、0.08:1、0.09:1等,优选0.001:1-0.05:1。
优选地,所述氢胺化反应的温度为0-100℃,例如10℃、20℃、30℃、40℃、50℃、60℃、70℃、80℃、90℃等。
优选地,所述氢胺化反应的时间为0.1-48h,例如1h、5h、10h、15h、20h、25h、30h、35h、40h、45h等。
优选地,在所述氢胺化反应结束后,浓缩有机溶剂,分离得到所述吲哚-二氢化萘类化合物。
优选地,所述分离的方法包括柱层析、薄层层析或重结晶中的任意一种或至少两种组合。
优选地,所述柱层析使用的洗脱液为石油醚和乙酸乙酯的混合液。
优选地,石油醚和乙酸乙酯的体积比为5:1-80:1,例如10:1、15:1、20:1、25:1、30:1、35:1、40:1、45:1、50:1、55:1、60:1、65:1、70:1、75:1等。
优选地,所述制备方法包括如下步骤:
(1)式i-1所示的化合物和式i-2所示的化合物在铑催化剂的存在下发生第一次氢胺化反应,得到中间体,反应式如下:
(2)所述中间体在钯催化剂的存在下发生第二次氢胺化反应,得到式ii所示的吲哚-二氢化萘类化合物,反应式如下:
式ii中,*代表手性碳原子;
式ii中,两个手性碳原子的构型组合为(r,r)、(s,s)、(r,s)或(s,r)中的任意一种;
所述r1、r2、r3、r4和r'均具有与式ii中相同的选择范围;
步骤(1)中所述的“第一次氢胺化反应”和步骤(2)所述的“第二次氢胺化反应”可统称为“氢胺化反应”。
优选地,所述制备方法包括如下步骤:
(1’)铑金属盐与膦配体反应形成铑金属配合物;
(2’)将步骤(1’)得到的铑配合物、钯催化剂、式i-1所示的化合物和式i-2所示的化合物混合,进行氢胺化反应,得到式ii所示的吲哚-二氢化萘类化合物。式i-1、式i-2和式ii如前文所示。
本发明的目的之三在于提供一种用于制备目的之一所述的吲哚-二氢化萘类化合物的中间体,所述中间体具有如下结构:
所述r1、r2、r3、r4和r'均具有与式ii中相同的选择范围。
本发明的目的之三在于提供一种目的之一所述的吲哚-二氢化萘类化合物在制备抗炎药物、抗肿瘤药物、抗抑郁药物、抗多巴胺药物、抗真菌药物、抗氧化药物、抗心血管疾病药物、抗哮喘药物、抗胆碱酯酶药物、抗偏头痛药物、抗hiv药物或抗便秘药物中的应用。
优选地,所述抗炎药物包括吲哚类药物或四氢化萘类药物。
相较于现有技术,本发明具有如下有益效果:
(1)本发明提供了一种新型的吲哚-二氢化萘类化合物,相较与普通的吲哚类化合物,其具有更好的抗炎活性。
(2)本发明的制备方法选用铑、钯金属催化剂,选用邻乙炔基苯胺作为吲哚来源,操作简便安全,反应步骤少,原料易得,催化剂用量少,反应条件温和、无副产物、底物拓展范围广、化合物官能团容忍度高,对映选择性保持在92%以上,甚至高达99%,收率可以达到86%以上,实现了高对映选择性和高收率。
附图说明
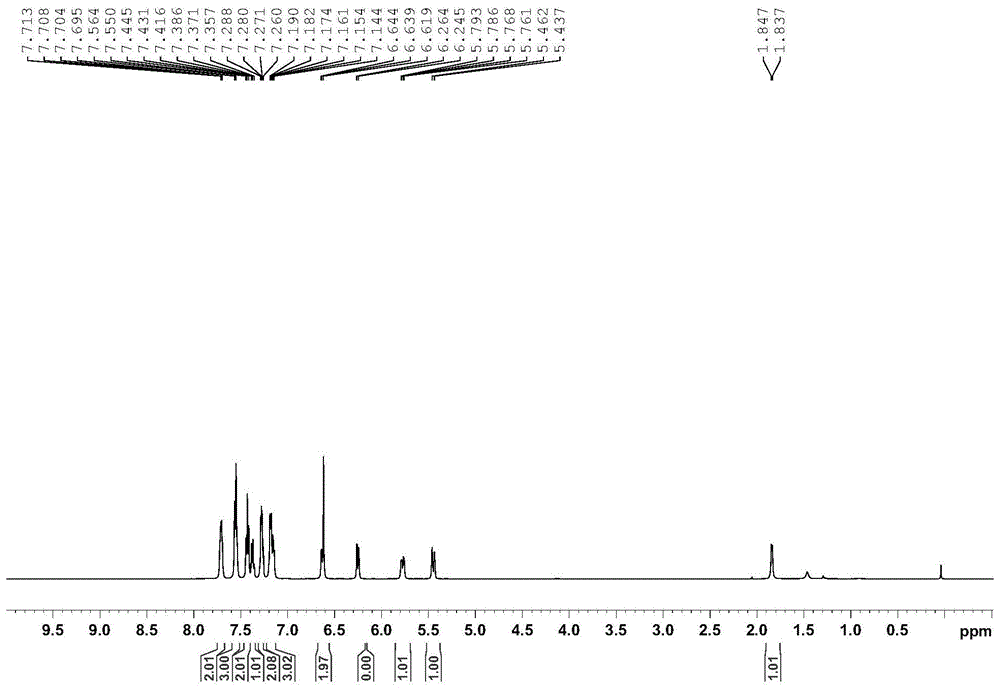
图1是本发明实施例1产物的核磁氢谱图。
图2是本发明实施例1产物的核磁碳谱图。
图3是本发明实施例9中间体的核磁氢谱图。
图4是本发明实施例9中间体的核磁碳谱图。
图5是不同化合物对炎症因子生成的抑制率的柱状图。
具体实施方式
为便于理解本发明,本发明列举实施例如下。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
实施例1
在本实施例中,制备(r,r)-2-(氮-2-苯基吲哚基)二氢化萘-1-醇,其结构式如下:
制备方法包括以下步骤:
取干燥的10ml的反应试管,装入磁力搅拌子,于手套箱中加入1.2mg[rh(cod)cl]2(2.5mol%铑元素)和3.5mg配体(r,s)-ppf-ptbu2(2.75mol%,式m所示的配体)的2ml二甲基甲酰胺溶液中,室温下搅拌20min,溶液显红褐色。然后,一次性加入38.6mg2-苯基乙炔基苯胺(0.2mmol)、34.6mg氧杂苯并降冰片烯(0.24mmol)以及5.6mgpd(mecn)4(otf)2(0.01mmol)到上述体系中,并于室温下搅拌反应,薄层色谱法(tlc)监测待原料反应完全(约12h)。旋转蒸发除去溶剂进行柱层析分离,选用100-200目的硅胶,流动相是体积比为石油醚:乙酸乙酯=20:1。
产物为无白色固体(收率86%);熔点=221–223℃;比旋光度
最终产物的结构表征数据如下:
1hnmr(500mhz,chloroform-d)δ7.76–7.66(m,2h),7.60-7.52(m,3h),7.43(t,j=7.5hz,2h),7.38(d,j=7.3hz,1h),7.32–7.24(m,2h),7.22–7.13(m,3h),6.68–6.58(m,2h),6.25(dd,j=9.8,2.3hz,1h),5.78(dd,j=12.6,4.6hz,1h),5.45(d,j=12.7hz,1h),1.84(d,j=5.5hz,1h).核磁氢谱如图1所示。
13cnmr(126mhz,cdcl3)δ143.29,136.69,136.03,132.84,132.26,130.11,129.40,129.09,128.99,128.64,128.28,128.13,127.94,126.49,124.88,121.31,121.08,120.21,113.49,103.10,70.96,60.66.核磁碳谱如图2所示。
高分辨质谱法hrms(esi-iontrap)m/z:[m+h]+计算值c24h20no338.1539,测定值388.1538。
实施例2
在本实施例中,制备(r,r)-2-(氮-2-4’-氰基苯基吲哚基)二氢化萘-1-醇,其结构式如下:
制备方法包括以下步骤:
取干燥的10ml的反应试管,装入磁力搅拌子,于手套箱中加入1.2mg[rh(cod)cl]2(2.5mol%铑元素)和3.3mg配体(r,s)-cy2pf-ptbu2(2.75mol%,式l所示的配体)的2ml二甲基甲酰胺溶液中,室温下搅拌20min,溶液显红褐色。然后,一次性加入43.6mg2-(4-氰基苯基)乙炔基苯胺(0.2mmol)、34.6mg氧杂苯并降冰片烯(0.24mmol)以及1.8mgpdcl2(0.01mmol)到上述体系中,并于室温下搅拌反应,薄层色谱法(tlc)监测待原料反应完全(约48h)。将反应液导入50毫升水中,用30毫升乙酸乙酯分三次萃取,合并有机相并用无水硫酸钠干燥一小时,旋转蒸发除去溶剂进行柱层析分离,选用100-200目的硅胶,流动相是体积比为石油醚:乙酸乙酯=5:1。
产物为褐色固体(收率57%);熔点为161–163℃;比旋光度
1hnmr(500mhz,chloroform-d)δ7.75–7.63(m,6h),7.55–7.50(m,1h),7.35–7.27(m,2h),7.24–7.11(m,3h),6.67(s,1h),6.65(dd,j=9.8,3.2hz,1h),6.20(dd,j=9.8,2.3hz,1h),5.75(dd,j=12.6,4.7hz,1h),5.35(dt,j=12.6,2.7hz,1h),2.09(d,j=4.9hz,1h).
13cnmr(126mhz,cdcl3)δ141.20,137.47,136.61,136.48,132.38,132.13,130.42,129.41,129.15,128.46,128.38,128.11,126.64,124.80,122.20,121.48,120.63,118.68,113.73,111.43,104.60,70.93,60.87.
高分辨质谱法hrms(esi-iontrap)m/z:[m+h]+c25h19n2o,计算值363.1492,测定值363.1489。
实施例3
在本实施例中,制备(r,r)-2-(氮-2-3’-羟基苯基吲哚基)二氢化萘-1-醇,其结构式如下:
制备方法包括以下步骤:
取干燥的10ml的反应试管,装入磁力搅拌子,于手套箱中加入1.1mg[rh(nbd)cl]2(2.5mol%铑元素)和3.3mg配体(r,s)-cy2pf-ptbu2(2.75mol%,式l所示的配体)的2ml二甲基甲酰胺溶液中,室温下搅拌20min,溶液显红褐色。然后,一次性加入41.8mg2-(3-羟基苯基)乙炔基苯胺(0.2mmol)、34.6mg氧杂苯并降冰片烯(0.24mmol)以及5.6mgpd(mecn)4(otf)2(0.01mmol)到上述体系中,并于室温下搅拌反应,薄层色谱法(tlc)监测待原料反应完全(约48h)。将反应液导入50毫升水中,用30毫升乙酸乙酯分三次萃取,合并有机相并用无水硫酸钠干燥一小时,旋转蒸发除去溶剂进行柱层析分离,选用100-200目的硅胶,流动相是体积比为石油醚:乙酸乙酯=10:1。
产物为褐色固体(收率57%);熔点为153–155℃;比旋光度
1hnmr(500mhz,chloroform-d)δ7.64(dt,j=23.1,4.3hz,2h),7.40(d,j=7.6hz,1h),7.31–7.25(m,1h),7.24–7.12(m,5h),7.10–6.99(m,2h),6.72(d,j=8.2hz,1h),6.66–6.55(m,2h),6.13(d,j=8.2hz,2h),5.76(d,j=12.2hz,1h),5.50(d,j=12.2hz,1h),2.60(s,1h).
13cnmr(126mhz,cdcl3)δ155.65,142.76,136.06,135.97,133.95,132.18,129.96,129.18,128.93,128.72,128.42,128.12,126.63,124.92,122.25,122.22,121.41,121.09,120.25,116.88,115.26,113.35,103.04,71.37,60.37.
高分辨质谱法hrms(esi-iontrap)m/z:[m+h]+c24h20no2,计算值354.1489,测定值354.1487。
实施例4
在本实施例中,制备(r,r)-2-(氮-2-丁基吲哚基)二氢化萘-1-醇,其结构式如下:
制备方法包括以下步骤:
取干燥的10ml的反应试管,装入磁力搅拌子,于手套箱中加入1.2mg[rh(cod)cl]2(2.5mol%铑元素)和3.3mg配体(r,s)-cy2pf-ptbu2(2.75mol%,式l所示的配体)的2ml四氢呋喃溶液中,室温下搅拌20min,溶液显红褐色。然后,一次性加入34.6mg2-丁基乙炔基苯胺(0.2mmol)、34.6mg氧杂苯并降冰片烯(0.24mmol)以及1.8mgpdcl2(0.01mmol)到上述体系中,并于室温下搅拌反应,薄层色谱法(tlc)监测待原料反应完全(约12h)。旋转蒸发除去溶剂进行柱层析分离,选用100-200目的硅胶,流动相是体积比为石油醚:乙酸乙酯=20:1。
产物为墨绿色粘稠物(收率83%);比旋光度
1hnmr(500mhz,chloroform-d)δ7.61–7.50(m,3h),7.34–7.25(m,2h),7.19–7.13(m,1h),7.08–7.00(m,2h),6.61(d,j=9.2hz,1h),6.29(s,1h),6.11(d,j=9.8hz,1h),5.62(d,j=12.7hz,1h),5.26(d,j=12.7hz,1h),2.90–2.69(m,2h),2.13(s,1h),1.73-1.61(m,2h),1.45–1.36(m,2h),0.93(t,j=7.3hz,3h).
13cnmr(126mhz,cdcl3)δ142.92,136.56,135.35,132.36,129.24,128.96,128.31,127.99,126.53,124.91,120.23,119.50,112.64,99.68,71.01,59.85,30.80,27.06,22.61,14.04.
高分辨质谱法hrms(esi-iontrap)m/z:[m+h]+c22h24no,计算值318.1852,测定值318.1852。
实施例5
在本实施例中,制备(r,r)-2-(氮-2-三异丙硅基吲哚基)二氢化萘-1-醇,其结构式如下:
制备方法包括以下步骤:
取干燥的10ml的反应试管,装入磁力搅拌子,于手套箱中加入1.2mg[rh(cod)cl]2(2.5mol%铑元素)和4.1mg配体(r)-xylbinap(2.75mol%,式b所示的配体)的2ml二甲基甲酰胺溶液中,室温下搅拌20min,溶液显红褐色。然后,一次性加入54.6mg2-三异丙硅基乙炔基苯胺(0.2mmol)、34.6mg氧杂苯并降冰片烯(0.24mmol)以及5.6mgpd(mecn)4(otf)2(0.01mmol)到上述体系中,并于室温下搅拌反应,薄层色谱法(tlc)监测待原料反应完全(约12h)。将反应液导入50毫升水中,用30毫升乙酸乙酯分三次萃取,合并有机相并用无水硫酸钠干燥一小时,旋转蒸发除去溶剂进行柱层析分离,选用100-200目的硅胶,流动相是体积比为石油醚:乙酸乙酯=20:1。
产物为墨绿色粘稠物(收率67%);比旋光度
结构表征数据如下:
1hnmr(500mhz,chloroform-d)δ7.50-7.45(m,1h),7.36(dd,j=7.6,1.6hz,1h),7.33–7.27(m,2h),7.27-7.22(m,1h),7.17(dd,j=7.0,1.8hz,1h),6.87(d,j=8.3hz,1h),6.69(t,j=7.2hz,1h),6.61(dd,j=9.5,1.5hz,1h),6.05(dd,j=9.6,4.0hz,1h),4.85(dd,j=6.6,2.3hz,1h),4.74(d,j=9.0hz,1h),4.50–4.38(m,1h),2.27(s,1h),1.06(s,18h),1.05–0.98(m,3h).
13cnmr(126mhz,cdcl3)δ148.10,135.12,132.38,131.68,130.05,128.86,128.63,128.28,127.58,127.20,126.91,117.00,110.38,109.01,103.35,96.93,71.42,54.65,18.67,11.18.
高分辨质谱法hrms(esi-iontrap)m/z:[m+h]+c27h36nosi计算值418.2561,测定值418.2560。
实施例6
在本实施例中,制备(r,r)-2-(氮-2-3’-噻吩基吲哚基)二氢化萘-1-醇,其结构式如下:
制备方法包括以下步骤:
取干燥的10ml的反应试管,装入磁力搅拌子,于手套箱中加入1.2mg[rh(cod)cl]2(2.5mol%铑元素)和4.1mg配体(r)-xylbinap(2.75mol%,式b所示的配体)的2ml四氢呋喃溶液中,室温下搅拌20min,溶液显红褐色。然后,一次性加入39.9mg2-3’-噻吩基乙炔基苯胺(0.2mmol)、34.6mg氧杂苯并降冰片烯(0.24mmol)以及1.8mgpdcl2(0.01mmol)到上述体系中,并于室温下搅拌反应,薄层色谱法(tlc)监测待原料反应完全(约12h)。旋转蒸发除去溶剂进行柱层析分离,选用100-200目的硅胶,流动相是体积比为石油醚:乙酸乙酯=20:1。
产物为墨绿色粘稠物(收率67%);比旋光度
结构表征数据如下:
1hnmr(500mhz,chloroform-d)δ7.50-7.45(m,1h),7.36(dd,j=7.6,1.6hz,1h),7.33–7.27(m,2h),7.27-7.22(m,1h),7.17(dd,j=7.0,1.8hz,1h),6.87(d,j=8.3hz,1h),6.69(t,j=7.2hz,1h),6.61(dd,j=9.5,1.5hz,1h),6.05(dd,j=9.6,4.0hz,1h),4.85(dd,j=6.6,2.3hz,1h),4.74(d,j=9.0hz,1h),4.50–4.38(m,1h),2.27(s,1h),1.06(s,18h),1.05–0.98(m,3h).
13cnmr(126mhz,cdcl3)δ148.10,135.12,132.38,131.68,130.05,128.86,128.63,128.28,127.58,127.20,126.91,117.00,110.38,109.01,103.35,96.93,71.42,54.65,18.67,11.18.
高分辨质谱法hrms(esi-iontrap)m/z:[m+h]+c27h36nosi计算值418.2561,测定值418.2560。
实施例7
在本实施例中,制备(r,r)-2-(氮-2-苯基基吲哚基)-5,8-二甲基二氢化萘-1-醇,其结构式如下:
制备方法包括以下步骤:
取干燥的10ml的反应试管,装入磁力搅拌子,于手套箱中加入1.1mg[rh(nbd)cl]2(2.5mol%铑元素)和3.3mg配体(r,s)-cy2pf-ptbu2(2.75mol%,式l所示的配体)的2ml二甲基甲酰胺溶液中,室温下搅拌20min,溶液显红褐色。然后,一次性加入46.3mg2-苯基乙炔基苯胺(0.24mmol)、34.4mg5,8-二甲基氧杂苯并降冰片烯(0.2mmol)以及5.6mgpd(mecn)4(otf)2(0.01mmol)到上述体系中,并于室温下搅拌反应,薄层色谱法(tlc)监测待原料反应完全(约12h)。将反应液导入50毫升水中,用30毫升乙酸乙酯分三次萃取,合并有机相并用无水硫酸钠干燥一小时,旋转蒸发除去溶剂进行柱层析分离,选用100-200目的硅胶,流动相是体积比为石油醚:乙酸乙酯=20:1。
产物为白色固体(收率81%);熔点为167–168℃;比旋光度
1hnmr(500mhz,chloroform-d)δ7.61(d,j=7.8hz,1h),7.56(d,j=7.4hz,2h),7.48–7.39(m,3h),7.16(d,j=7.7hz,1h),7.12-7.04(m,2h),6.97–6.89(m,2h),6.77(d,j=8.4hz,1h),6.58(s,1h),5.92(dd,j=10.0,4.8hz,1h),5.44(s,1h),5.33(s,1h),2.42(s,3h),2.35(s,3h),1.62(s,1h).
13cnmr(126mhz,cdcl3)δ141.96,136.45,134.74,133.00,132.74,132.49,131.13,130.76,130.17,129.51,128.67,128.41,128.17,125.94,123.69,121.64,120.48,120.00,111.76,103.25,70.12,57.89,19.17,18.89.
高分辨质谱法hrms(esi-iontrap)m/z:[m+h]+c26h24no计算值366.1852,测定值366.1852。
实施例8
在本实施例中,制备(r,r)-2-(氮-2-苯基基吲哚基)-[1,3]二氧戊环并二氢化萘-1-醇,其结构式如下:
制备方法包括以下步骤:
取干燥的10ml的反应试管,装入磁力搅拌子,于手套箱中加入1.2mg[rh(cod)cl]2(2.5mol%铑元素)和3.5mg配体(r,s)-cy2pf-pcy2(2.75mol%,式l所示的配体)的2ml二甲基甲酰胺溶液中,室温下搅拌20min,溶液显红褐色。然后,一次性加入46.3mg2-苯基乙炔基苯胺(0.24mmol)、37.6mg[1,3]二氧戊环并氧杂苯并降冰片烯(0.2mmol)以及5.6mgpd(mecn)4(otf)2(0.01mmol)到上述体系中,并于室温下搅拌反应,薄层色谱法(tlc)监测待原料反应完全(约12h)。将反应液导入50毫升水中,用30毫升乙酸乙酯分三次萃取,合并有机相并用无水硫酸钠干燥一小时,旋转蒸发除去溶剂进行柱层析分离,选用100-200目的硅胶,流动相是体积比为石油醚:乙酸乙酯=10:1。
产物为墨绿色粘稠物(收率83%);比旋光度
1hnmr(500mhz,chloroform-d)δ7.72–7.65(m,2h),7.54(d,j=7.6hz,2h),7.43(t,j=7.5hz,2h),7.41–7.33(m,1h),7.23–7.12(m,2h),7.06(s,1h),6.64(s,1h),6.59(s,1h),6.48(dd,j=9.8,3.1hz,1h),6.14(dd,j=9.8,2.2hz,1h),5.99–5.88(m,2h),5.73–5.54(m,1h),5.37(d,j=12.2hz,1h),1.81(s,1h).
13cnmr(126mhz,cdcl3)δ147.47,147.03,143.22,136.00,132.81,131.23,130.05,129.31,128.61,128.59,128.09,127.16,126.36,121.22,121.01,120.16,113.49,107.13,106.34,103.05,101.16,71.10,60.71.
高分辨质谱法hrms(esi-iontrap)m/z:[m+h]+c25h20no3计算值382.1438,测定值382.1438。
实施例9-1
在本实施例中,制备中间体(r,r)-2-(氨基-2-苯乙炔基苯基)二氢化萘-1-醇,其结构式如下:
制备方法包括以下步骤:
取干燥的10ml的反应试管,装入磁力搅拌子,于手套箱中加入1.2mg[rh(cod)cl]2(2.5mol%铑元素)和3.5mg配体(r,s)-ppf-ptbu2(2.75mol%,式m所示的配体)的2ml二甲基甲酰胺溶液中,室温下搅拌20min,溶液显红褐色。然后,一次性加入46.3mg2-苯基乙炔基苯胺(0.24mmol)、28.8mg氧杂苯并降冰片烯(0.2mmol)于室温下搅拌反应,薄层色谱法(tlc)监测待原料反应完全(约12h)。旋转蒸发除去溶剂进行柱层析分离,选用100-200目的硅胶,流动相是体积比为石油醚:乙酸乙酯=20:1。
产物为无白色固体(收率95%);熔点=154–156℃;比旋光度
最终产物的结构表征数据如下:
1hnmr(500mhz,chloroform-d)δ7.46(d,j=7.2hz,1h),7.37(d,j=7.2hz,1h),7.36-7.31(m,2h),7.31–7.24(m,5h),7.24–7.17(m,1h),7.14–7.09(m,1h),6.83(d,j=8.3hz,1h),6.70(t,j=7.5hz,1h),6.54(dd,j=9.6hz,1h),6.01(dd,j=9.6,3.5hz,1h),4.87(d,j=7.8hz,1h),4.68(s,1h),4.38(d,j=5.4hz,1h),2.50(s,1h).核磁碳谱如图3所示。
13cnmr(126mhz,cdcl3)δ147.74,135.50,132.41,131.91,131.45,130.10,128.81,128.55,128.45,128.34,128.32,127.96,127.05,126.82,123.10,117.58,111.25,108.98,95.60,85.77,71.87,55.63.核磁碳谱如图4所示。
高分辨质谱法hrms(esi-iontrap)m/z:[m+h]+计算值c24h20no338.1539,测定值388.1539。
实施例9-2
向实施例9-1得到的中间体中加入1.8mgpdcl2(0.01mmol),并于室温下搅拌反应,薄层色谱法(tlc)监测待原料反应完全(约12h)。旋转蒸发除去溶剂进行柱层析分离,选用100-200目的硅胶,流动相是体积比为石油醚:乙酸乙酯=20:1,得到
实施例10
与实施例1的区别在于,所述膦配体换为等物质的量的(s,r)-ppf-ptbu2,反应时间为6h得到了实施例1的对映异构体(s,s)-2-(氮-2-苯基吲哚基)二氢化萘-1-醇,其结构式如下:
产物为无白色固体(收率83%);熔点=221–223℃;比旋光度
1hnmr(500mhz,chloroform-d)δ7.76–7.66(m,2h),7.60-7.52(m,3h),7.43(t,j=7.5hz,2h),7.38(d,j=7.3hz,1h),7.32–7.24(m,2h),7.22–7.13(m,3h),6.68–6.58(m,2h),6.25(dd,j=9.8,2.3hz,1h),5.78(dd,j=12.6,4.6hz,1h),5.45(d,j=12.7hz,1h),1.84(d,j=5.5hz,1h).
13cnmr(126mhz,cdcl3)δ143.29,136.69,136.03,132.84,132.26,130.11,129.40,129.09,128.99,128.64,128.28,128.13,127.94,126.49,124.88,121.31,121.08,120.21,113.49,103.10,70.96,60.66.
高分辨质谱法hrms(esi-iontrap)m/z:[m+h]+计算值c24h20no338.1539,测定值388.1538。
实施例11
与实施例1的区别在于,所述铑金属盐和膦配体反应的温度为30℃,时间为1h;连续氢胺化反应的温度为100℃,时间为2h。
产物为无白色固体(收率58%);熔点=221–223℃;比旋光度
1hnmr(500mhz,chloroform-d)δ7.76–7.66(m,2h),7.60-7.52(m,3h),7.43(t,j=7.5hz,2h),7.38(d,j=7.3hz,1h),7.32–7.24(m,2h),7.22–7.13(m,3h),6.68–6.58(m,2h),6.25(dd,j=9.8,2.3hz,1h),5.78(dd,j=12.6,4.6hz,1h),5.45(d,j=12.7hz,1h),1.84(d,j=5.5hz,1h).
13cnmr(126mhz,cdcl3)δ143.29,136.69,136.03,132.84,132.26,130.11,129.40,129.09,128.99,128.64,128.28,128.13,127.94,126.49,124.88,121.31,121.08,120.21,113.49,103.10,70.96,60.66.
高分辨质谱法hrms(esi-iontrap)m/z:[m+h]+计算值c24h20no338.1539,测定值388.1538。
对比例1
与实施例1的区别在于,将铑催化剂分别替换为铜、金、钴催化剂,均无法制备得到(r,r)-2-(氮-2-苯基吲哚基)二氢化萘-1-醇。
对比例2
与实施例1的区别在于,将钯催化剂分别替换为铜、铁、铱催化剂,均无法制备得到(r,r)-2-(氮-2-苯基吲哚基)二氢化萘-1-醇。
生物活性测定
选取已上市药物吲哚美辛为标准物,在细胞层面考察了示例当中氮-吲哚基手性二氢化萘类化合物及其衍生物的抗炎活性。使用elisa试剂盒检测实施例1-8的化合物以及吲哚美辛对于促炎症因子的抑制作用,具体方法如下:
把raw264.7细胞(小鼠单核巨噬细胞)按每孔20000枚的密度接种在96孔板上,培养基为加入10wt%fbs(血清)和1wt%双抗的1640培养基。在接种raw264.7细胞的96孔板上每孔加入90μl培养基和10μllps(脂多糖),然后在每孔中分别加入10μl上述10μm的实施例1-8的化合物以及吲哚美辛的水溶性试剂(以dmso作为空白对照,吲哚美辛作为阳性对照);以不添加lps且水溶性试剂为dmso的组作为本底;然后在37℃培养箱中培养2天。
培养结束后,利用酶标仪在405nm的波长下测量培养液的吸光度,并计算对黑色素生成的抑制率。抑制率=[1-(od加药-od本底)/(od空白-od本底)]×100%,其中od加药为实验组的吸光度,od空白为空白组的吸光度,od本底为本底的吸光度。
测试结果如图5所示,图5中显示,相对于对照组,实施例6和8能够较显著地降低炎症因子il-1β,il-6以及tnf-α的含量,甚至低于吲哚美辛的水平。可见,相较于抗炎药物吲哚美辛,本申请提供的吲哚衍生物对促炎症因子生成的抑制率得到了一定提升。
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!