一种成纤维细胞与癌细胞的3D共培养模型及其制备方法和应用与流程
本发明属于细胞培养技术领域,具体涉及一种成纤维细胞与癌细胞的3d共培养模型及其制备方法和应用,尤其涉及一种用于研究成纤维细胞引导的癌细胞定向迁移的3d共培养模型及其制备方法和应用。
背景技术:
肿瘤是由恶性肿瘤细胞以及周围大量的基质细胞所构成的复合体。基质细胞主要包括成纤维细胞、浸润的免疫细胞、血管和细胞外基质(ecm)大分子等,能够为肿瘤细胞外环境提供结构和生化成分上的支持。基质细胞以及各种细胞因子和趋化因子共同构成了肿瘤微环境,能够与肿瘤细胞相互影响,共同演化从而促进肿瘤的生长。
肿瘤组织中的成纤维细胞被统称为肿瘤相关成纤维细胞(cafs),是肿瘤微环境中最主要的基质细胞。作为近期肿瘤研究的热门领域之一,越来越多的体外和临床研究表明cafs在肿瘤的生长、转移、耐药以及存活等方面发挥至关重要的作用。与普通成纤维细胞相比,cafs是一种特殊的处于不可逆激活状态下的成纤维细胞,生长增值速度更快且细胞活动更加活跃,通过分泌多种生长因子以及对细胞外基质的重构,能够促进癌细胞的增殖,分化和侵袭。
普通成纤维细胞可以在生长因子和机械压力等外部刺激下被激活而具有类似cafs的功能。目前为止,对成纤维细胞与肿瘤细胞之间的相互作用机制的研究多侧重于间接的相互作用如旁分泌机制,成纤维细胞通过分泌生长因子等调节癌细胞的增殖和扩散,但对于两种细胞之间直接接触产生的物理相互作用对肿瘤的发展所产生的影响了解甚少。
对成纤维细胞与癌细胞之间直接相互作用的研究需要将两种细胞在合适的模型下进行共同培养,而传统的2d单层细胞培养缺乏立体的结构,难以为两种细胞的相互作用提供合适的环境。另一方面,由于组织环境的复杂性和不可穿透性,动物模型也无法对不同细胞间的相互作用进行仔细的观察和研究。虽然有些无创的成像技术可以实现对细胞的体内追踪,但这些技术通常比较复杂昂贵,并且很难获得对细胞间的相互作用的高质量图像。
3d细胞培养是一种在体外通过立体培养模式为细胞提供一个更加接近体内生存条件的微环境的新型培养方式,在近几年发展迅速,成为肿瘤药物筛选和组织工程领域中有力的工具。越来越多的研究致力于揭示癌细胞在体外3d环境中是如何增殖及转移的,以及成纤维细胞对这些过程所产生的促进作用。有实验结果表明将成纤维细胞和癌细胞在3d环境下共同培养,对两种细胞的侵袭能力都有显著的提升,并且能观察到癌细胞通过粘附在成纤维细胞形成的突起上跟随成纤维细胞进行侵袭。类似有关成纤维细胞对癌细胞转移的引导作用的研究都表明,成纤维细胞在分泌生长刺激因子的同时,也可以通过细胞间的直接相互作用对癌细胞的转移侵袭进行调节。
目前,现有的3d共培养模型无法对其中单个细胞的生长过程进行单独的观察,也不能为研究不同细胞的独立生长、产生相互影响的关联与过程提供观察的窗口期,所以将两种细胞间的吸引和相互作用的过程可视化并实时的观察追踪是此类研究中所面临的主要困难之一,但尚没有成熟的模型能够模拟这一过程。
因此,提供一种能够实时的观察追踪成纤维细胞与癌细胞之间吸引和相互作用的3d培养模型,对于研究癌细胞的生长、转移、耐药以及存活等方面具有重要的意义。
技术实现要素:
鉴于现有技术中存在的问题,本发明提供一种成纤维细胞与癌细胞的3d共培养模型及其制备方法和应用。所述3d共培养模型能够有效实现成纤维细胞与癌细胞之间吸引和相互作用的可视化及实时追踪,可应用于成纤维细胞引导的癌细胞迁移的体外研究。
为达此目的,本发明采用以下技术方案:
第一方面,本发明提供一种成纤维细胞与癌细胞的3d共培养模型,所述3d共培养模型包括成纤维细胞液滴与癌细胞液滴;所述成纤维细胞液滴与癌细胞液滴之间通过matrigel通道相连。
本发明提供的成纤维细胞与癌细胞的3d共培养模型,是将成纤维细胞和癌细胞分别接种在3d培养基悬液中,形成两种相互独立的细胞液滴,使得成纤维细胞和癌细胞在相互作用之前有各自独立生长的阶段;同时,所述3d共培养模型于细胞液滴之间构建matrigel通道,得到一种3d“哑铃型”的细胞培养模型,使得成纤维细胞与癌细胞能够通过细胞因子等物质或其他影响因子的交换发生相互作用。
在两种细胞之间构建可供3d移动的matrigel通道,将成纤维细胞的浸润前沿限制在固定的区域内,可以对两种细胞之间相互吸引并迁移的过程的各个阶段实现及时的监测和观察;继而成纤维细胞向癌细胞发生定向迁移,成纤维细胞迁移过matrigel通道与癌细胞产生接触后,可以观察到癌细胞通过粘附成纤维细胞的脉管上随着成纤维细胞的收缩产生移动;从而便于研究成纤维细胞通过物理接触的直接作用对癌细胞的迁移侵袭所产生的影响;同时,在整个培养过程中,这种直接的相互作用及影响可以在共培养过程中被直观的可视化,便于研究成纤维细胞与癌细胞之间的形态变化;
因此,所述3d共培养模型中的两种细胞在3d环境中各自独立的生长特性以及成纤维细胞对癌细胞的吸引和引导其迁移侵袭的过程都可以用此共培养模型进行观察研究。相较于现有的3d细胞共培养体系,本发明在最开始接种细胞时就将两种细胞类型单独培养在3d模型中,但是两者之间又并未完全分离,在独自生长一定时间后又能够相互影响。
作为本发明优选的技术方案,所述matrigel通道的长度为1~5mm,例如可以是1mm、1.5mm、2mm、2.5mm、3mm、3.5mm、4mm、4.5mm或5mm等,优选为1~2mm。
本发明中,所述matrigel通道的长度较为关键,若是长度大于2mm会相应增长培养时间,也可以进行观察,但如果两细胞间距离过大,超过5mm,成纤维细胞与癌细胞之间距离过远,容易导致两细胞间吸引作用不足,两种细胞之间无法产生相互作用,导致成纤维细胞无法向癌细胞定向迁移,最终无法接触融合;若是长度小于1mm,会导致成纤维细胞迁移至癌细胞的时间过短,容易导致成纤维细胞自身3d突起的形成不充分,且对两种细胞互相吸引的过程观察窗口期较短。因此,把握matrigel通道的长度对于研究细胞间相互作用尤为重要,其长度优选为1~2mm。
优选地,所述matrigel通道由matrigel溶液凝固后形成,所述matrigel溶液中matrigel的质量分数为30~80%,例如可以是30%、35%、40%、45%、50%、55%、60%、65%、70%、75%或80%等。通道组分尽量保持与细胞液滴中的成分相同,保证细胞生长过程中的一致性,优选为30~50%。
作为本发明优选的技术方案,所述成纤维细胞液滴中成纤维细胞的浓度为(2~10)×105个/ml,例如可以是2×105个/ml、3×105个/ml、5×105个/ml、8×105个/ml、9×105个/ml或10×105个/ml等。
优选地,所述癌细胞液滴中癌细胞的浓度为(2~10)×105个/ml,例如可以是2×105个/ml、3×105个/ml、5×105个/ml、8×105个/ml、9×105个/ml或10×105个/ml等。
优选地,所述成纤维细胞液滴中matrigel的质量分数为30~80%,例如可以是30%、35%、40%、45%、50%、55%、60%、65%、70%、75%或80%等。
优选地,所述癌细胞液滴中matrigel的质量分数为30~80%,例如可以是30%、35%、40%、45%、50%、55%、60%、65%、70%、75%或80%等。
在现有的3d培养技术中,matrigel通常作为基底使用,但用于直接包裹细胞时的使用浓度较低(<10%),本发明中matrigel的使用浓度在30~80%之间,以保证培养基在37℃下可凝固形成对细胞的3d支撑,并更有利于成纤维细胞3d突起的快速形成。
作为本发明优选的技术方案,所述3d共培养模型还包括包覆培养基,所述包覆培养基用于包被所述成纤维细胞液滴、癌细胞液滴和matrigel通道。
优选地,所述包覆培养基包括dmem培养基。
本发明中并不限制癌细胞的类型,所述癌细胞包括但不限于结肠癌细胞、肝癌细胞、胃癌细胞、食管癌细胞、宫颈癌细胞、人类黑素瘤细胞或肺腺癌细胞中的任意一种。
所述3d共培养模型对各类型的细胞系具有普适性,可以用于研究各种癌细胞与成纤维细胞之间的相互作用。优选地,所述癌细胞包括caki-1、hela、a375或a549中的任意一种。
本发明中也并不限制成纤维细胞的类型,所述成纤维细胞包括如bhk-21细胞在内的所有成纤维细胞。本发明中,以bhk-21细胞为建立模型的示例细胞,因为其容易获得及培养;实际在实验中可将bhk-21替换为与癌细胞种类对应的普通成纤维细胞或者从肿瘤中直接分离的肿瘤相关成纤维细胞
第二方面,本发明提供一种如第一方面所述的3d共培养模型的制备方法,所述制备方法包括如下步骤:
(1)将成纤维细胞和癌细胞分别重悬于培养基中,加入matrigel制备得到成纤维细胞悬液和癌细胞悬液;
(2)再将所述成纤维细胞悬液和癌细胞悬液分别加在培养器皿上,而后凝固,所得到的成纤维细胞液滴与癌细胞液滴之间留有间隔;
(3)在所述的间隔中加入matrigel溶液,凝固后形成matrigel通道,再加入包覆培养基后得到所述3d共培养模型。
作为本发明优选的技术方案,步骤(1)所述的培养基包括dmem培养基。
优选地,所述dmem培养基包含5~10%(例如可以是5%、6%、7%、8%、9%或10%等)的血清。
优选地,步骤(1)所述的培养基与细胞混合前经过预冷。
优选地,步骤(1)所述成纤维细胞悬液中细胞浓度为(2~10)×105个/ml,例如可以是2×105个/ml、3×105个/ml、5×105个/ml、8×105个/ml、9×105个/ml或10×105个/ml等。
优选地,步骤(1)所述成纤维细胞悬液中matrigel的质量浓度为30~80%,例如可以是30%、35%、40%、45%、50%、55%、60%、65%、70%、75%或80%等。
优选地,步骤(1)所述癌细胞悬液中细胞浓度为(2~10)×105个/ml,例如可以是2×105个/ml、3×105个/ml、5×105个/ml、8×105个/ml、9×105个/ml或10×105个/ml等。
优选地,步骤(1)所述癌细胞悬液中matrigel的质量浓度为30~80%,例如可以是30%、35%、40%、45%、50%、55%、60%、65%、70%、75%或80%等。
作为本发明优选的技术方案,步骤(2)所述间隔为1~5mm,例如可以是1mm、1.5mm、2mm、2.5mm、3mm、3.5mm、4mm、4.5mm或5mm等,优选为1~2mm。
优选地,步骤(3)所述matrigel溶液中matrigel的质量分数为30~80%,例如可以是30%、35%、40%、45%、50%、55%、60%、65%、70%、75%或80%等。
优选地,所述matrigel溶液为含有matrigel的dmem培养基。
优选地,步骤(3)所述的包覆培养基包括dmem培养基。
作为本发明优选的技术方案,所述制备方法包括如下步骤:
(1)将成纤维细胞和癌细胞分别重悬于dmem培养基中,所述dmem培养基中包含质量分数为5~10%的血清,再加入matrigel制备得到成纤维细胞悬液和癌细胞悬液;
所述成纤维细胞悬液中细胞浓度为(2~10)×105个/ml,matrigel的质量浓度为30~80%;所述癌细胞悬液中细胞浓度为(2~10)×105个/ml,matrigel的质量浓度为30~80%;
(2)再将所述成纤维细胞悬液和癌细胞悬液分别加在培养器皿上,所得到的成纤维细胞液滴与癌细胞液滴之间留有1~2mm的间隔,37℃下静置直到细胞悬液凝固;
(3)在所述的间隔中加入matrigel溶液,所述matrigel溶液中matrigel的质量分数为30~80%,凝固后形成matrigel通道,再加入dmem培养基,得到所述3d共培养模型。
示例性的,本发明提供的成纤维细胞与癌细胞的3d共培养模型可以通过如下步骤进行制备:
(1)将成纤维细胞系和经荧光蛋白(可选红色荧光蛋白rfp)标记的癌细胞分别重悬于预冷的包含5~10%血清的dmem培养基中;其中,各细胞的最低浓度为1×106个/ml;
(2)4℃将经下解冻的matrigel分别加入到成纤维细胞和癌细胞悬液中:matrigel加入后所得细胞悬液需同时满足如下条件:
a.细胞数在(2~10)×105cells/ml;
b.matrigel的终浓度在30~80%之间;
(3)将混合matrigel后的成纤维细胞悬液和癌细胞悬液(悬液体积约为4~10μl)相邻的滴在24孔培养板的同一个孔中,注意在两种细胞液滴中间留有1~2mm的间隔;
(4)将培养板置于37℃培养箱中直到混合matrigel的细胞悬液凝固;
(5)构建matrigel通道:在两个细胞液滴中间滴入5~10μl的液态matrigel(用dmem稀释至浓度30~80%)形成“哑铃型”的结构,以允许成纤维细胞通过并与癌细胞能够相互联通。
(6)将培养板置于37℃培养箱中直到matrigel通道凝固;
(7)向孔内加入1ml预热的包含5%血清的dmem培养基,37℃,5%co2培养箱中培养,并用倒置荧光显微镜观察并拍照记录。
第三方面,本发明提供一种如第一方面所述的3d共培养模型在研究细胞间相互作用的机理或筛选肿瘤药物中的应用。
所述3d共培养模型可应用于肿瘤药物的筛选、研究细胞间相互作用的机理以及确定影响细胞间直接相互作用的细胞因子等方面。
本发明所述的数值范围不仅包括上述列举的点值,还包括没有列举出的上述数值范围之间的任意的点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
与现有技术相比,本发明至少具有以下有益效果:
(1)本发明提供的3d共培养模型呈“哑铃型”,不仅能够单独培养成纤维细胞和癌细胞,使两者在相互作用之前有各自独立生长的阶段,从而更便于对比研究共培养对两种细胞所造成的影响;同时通过matrigel通道,还能够观察到成纤维细胞和癌细胞之间相互影响与相互作用时发生的形态变化,为研究不同细胞的独立生长与产生相互影响的过程提供观察的窗口期;
(2)通过本发明所述的共培养模型,能够观察到成纤维细胞与癌细胞产生接触后,癌细胞开始被成纤维细胞的脉管所吸引;而后成纤维细胞脉管网继续向癌细胞方向移动,同时开始收缩形成球状体并对粘附在其脉管上的癌细胞产生拖拽;最终,成纤维细胞的脉管系统收缩并最终将癌细胞全部包裹,形成一个球状体;该培养模型使成纤维细胞与癌细胞之间的直接相互作用在共培养过程中被直观的可视化;
(3)本发明提供的3d共培养模型通过在两种细胞之间构建可供3d移动的matrigel通道,将成纤维细胞的浸润前沿限制在固定的区域内,可以对两种细胞之间相互吸引并迁移的过程的各个阶段实现及时的监测和观察,同时这种相互作用对癌细胞迁移的影响可以通过延时摄影等技术进行动态的纪录和研究;同时,该3d共培养模型对各类型的细胞系具有普遍的适用性,在肿瘤药物筛选以及确定影响细胞间直接相互作用的细胞因子等方面具有广泛应用的潜力。
附图说明
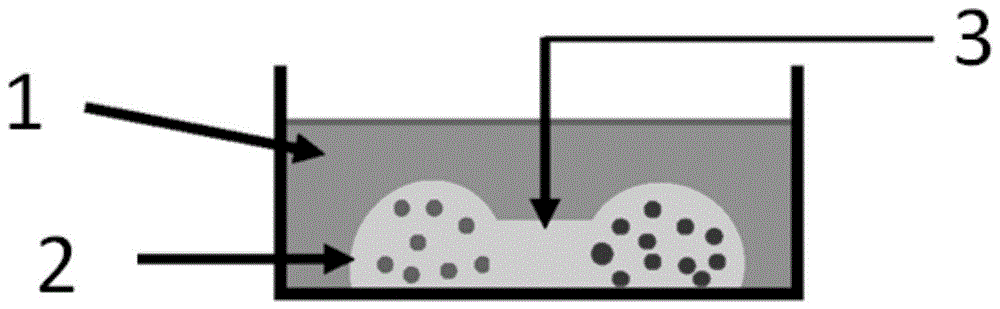
图1为本发明提供的3d共培养模型的正视示意图;其中1-包覆培养基,2-细胞液滴,3-matrigel通道。
图2为本发明提供的3d共培养模型的俯视示意图;其中1-包覆培养基,2-细胞液滴,3-matrigel通道。
图3为成纤维细胞bhk-21与癌细胞的3d共培养体系在明场和荧光显微镜下的视野图,其中a为明场视野图,b为荧光视野图(标尺500μm)。
图4为成纤维细胞在3dmatrigel中培养不同天数时的生长形态图。
图5为成纤维细胞bhk-21形成的脉管的图像(标尺100μm)。
图6为caki-1、hela、a375和a549四种癌细胞在3dmatrigel悬液中培养后明场和荧光显微镜下的显微图像(标尺500μm)。
图7为成纤维细胞bhk-21与caki-1细胞形成的3d共培养体系在培养不同天数时明场和荧光显微镜下的显微图像(标尺1mm)。
图8为成纤维细胞bhk-21与caki-1细胞形成的3d共培养体系在培养第6天时明场和荧光显微镜下的显微图像(标尺500μm)。
图9为成纤维细胞bhk-21与caki-1细胞在3d共培养体系中产生接触时在明场和荧光显微镜下的显微图像。
图10为caki-1细胞沿着成纤维细胞bhk-21脉管收缩方向移动时得到的延时拍摄图像。
图11为成纤维细胞球状体包裹的caki-1细胞在明场、荧光以及重叠状态下的得到的显微图像(标尺250μm)。
图12为成纤维细胞bhk-21与caki-1细胞在3d共培养体系中的相互作用示意图。
图13为不同癌细胞系与成纤维细胞在3d共培养体系中培养4天后明场、荧光以及重叠状态下的得到的显微图像(标尺100μm)。
具体实施方式
下面结合附图并通过具体实施方式来进一步说明本发明的技术方案,但下述的实例仅仅是本发明的简易例子,并不代表或限制本发明的权利保护范围,本发明的保护范围以权利要求书为准。
以下实施例中所用的试剂和细胞均可由常规厂商或常规渠道购得,未具体说明的实验步骤或操作均使用本领域常规的实验操作进行。
实施例1
本实施例提供一种成纤维细胞与癌细胞的3d共培养体系。
(1)将成纤维细胞系(bhk-21)和经红色荧光蛋白(rfp)标记的癌细胞caki-1重悬于预冷的包含5%血清的dmem培养基中;
(2)4℃下将经解冻的matrigel分别加入到成纤维细胞和癌细胞悬液中,matrigel加入后所得细胞悬液同时满足如下条件:
a.细胞数在5×105cells/ml;b.matrigel终浓度在80%。
(3)将混合matrigel后的成纤维细胞悬液5μl和癌细胞悬液5μl相邻的滴在24孔培养板的同一个孔中,在两种细胞液滴中间留有约2mm的间隔;
(4)将培养板置于37℃培养箱中直到matrigel悬液凝固
(5)构建matrigel通道:在两个细胞液滴中间滴入液态matrigel(所述液态matrigel为matrigel用dmem稀释至质量浓度为50%),形成“哑铃型”的结构,所需液态matrigel的体积约为8μl,使成纤维细胞通过并与癌细胞能够相互联通。
如图1和图2所示,所得3d共培养模型呈“哑铃型”,其中1表示包覆培养基,2表示细胞液滴,在共培养模型中细胞液滴已经凝固,3表示matrigel通道。
(6)将培养板置于37℃培养箱中直到matrigel悬液凝固;
(7)向孔内加入1ml预热的含5%血清的dmem培养基作为包覆培养基;
(8)用倒置荧光显微镜观察并拍照记录,将接种时记为第0天,所得3d共培养体系的显微图像如图3所示,图中a为明场显微镜下的视野,图中b为荧光显微镜下的视野,左侧为bhk-21细胞,右侧为rfp标记的癌细胞caki-1,由于bhk-21细胞不带荧光标记,因而在荧光显微镜下的视野中无法观察到。
实施例2
本实施例用于记录实施例1中所得的3d共培养体系内细胞的生长情况。
为了方便比较,本实施例中同时还观察了成纤维细胞与癌细胞(包括caki-1肾癌细胞、hela宫颈癌细胞、a375人类黑素瘤细胞以及a549肺腺癌细胞)单独培养时的细胞形态变化。
(1)成纤维细胞单独培养时,所得显微图像如图4所示,观察成纤维细胞在培养的第0,3,5,8,11,22天的形态变化可知,成纤维细胞在3dmatrigel中自发的形成脉管系统(如图5所示),并最终收缩称为球状体。
(2)癌细胞单独培养时,所得显微图像如图6所示,癌细胞在3dmatrigel悬液中不形成成纤维细胞式的脉管系统,而是聚集形成许多以小而分散的细胞球体进行增殖生长。图中所示依次为caki-1肾癌细胞在单独培养的第12天,a375人类黑素瘤细胞在单独培养的第7天,hela宫颈癌细胞在单独培养的第10天,以及a549肺腺癌细胞在单独培养的第12天时的生长形态。
(3)在实施例1中提供的“哑铃型”3d培养体系中,可以观察得到如下结果:
(i)两种细胞的总体生长情况如图7所示,观察3d培养体系在培养的第2、4、6、8、10、12、14、19和21天的形态变化可知,bhk-21细胞在形成脉管网系统的同时向癌细胞方向移动,并穿过matrigel通道与癌细胞接触产生相互作用,最终形成球状体并将所有癌细胞包裹在其中;
(ii)高倍率图像(如图8所示)显示接种后第6天,bhk-21细胞3d脉管网的前沿穿过matrigel通道与癌细胞的matrigel悬液产生接触;
(iii)处于前沿的成纤维细胞通过matrigel通道后与癌细胞产生接触,逐渐将粘附在周围的癌细胞拉向自身形成的脉管网络。如图9所示,放大后的视野可明显观察到粘附的caki-1细胞在移动过程中受到成纤维细胞的直接作用影响,细胞形态被高度的拉伸和拉长(如箭头所示)。
(iv)caki-1细胞可通过粘附在成纤维细胞形成的脉管上,并通过细胞间的相互作用随着成纤维细胞的收缩移动在3d环境中进行迁移。如图10所示,延时拍摄的图像表明caki-1细胞(箭头所指)沿着成纤维细胞脉管收缩的方向移动。
(v)如图11所示,在3d培养体系下,癌细胞caki-1被包裹在成纤维细胞形成的球状体中。
(4)通过上述观察实验,可知3d培养体系中成纤维细胞和癌细胞的相互作用过程可简单概括为如下步骤,如图12所示:
i:成纤维细胞和癌细胞以“哑铃型”接种在3d培养模型中(第0天);
ii:成纤维细胞形状改变开始形成脉管系统(第2天);
iii:成纤维细胞穿过matrigel通道(第4天);
iv:成纤维细胞与癌细胞首次产生接触,癌细胞开始被成纤维细胞的脉管所吸引(第6天);
v:成纤维细胞脉管网继续向癌细胞方向移动,同时开始收缩形成球状体并对粘附在其脉管上的癌细胞产生拖拽(第10天);
vi:成纤维细胞的脉管系统收缩并最终将癌细胞全部包裹,形成一个球状体(第21天)。
实施例3
本实施例用于研究不同癌细胞系在3d共培养体系中对成纤维细胞脉管系统的亲和性。3d共培养体系的构建方法与实施例1相同。
所得观察结果如图13所示,在高倍率视野下的显微视野显示不同的癌细胞系(hela,a375以及a549)在接种4天后开始倾向于粘附在成纤维细胞形成的脉管网上。
综上所示,通过本发明所述的共培养模型,能够观察到成纤维细胞与癌细胞产生接触后,癌细胞开始被成纤维细胞的脉管所吸引;而后成纤维细胞脉管网继续向癌细胞方向移动,同时开始收缩形成球状体并对粘附在其脉管上的癌细胞产生拖拽;最终,成纤维细胞的脉管系统收缩并最终将癌细胞全部包裹,形成一个球状体。
申请人声明,以上所述仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,所属技术领域的技术人员应该明了,任何属于本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!