一种检测单增李斯特菌的试剂盒和方法与流程
本发明涉及微生物的检测,具体涉及一种检测单增李斯特菌的试剂盒和方法。
背景技术:
近年来,随着人民生活水平的提高,食品安全日益受到关注,成为公共政策的重要议题。尤其是病原体引起的食源性疾病已严重威胁公共卫生安全和人类健康。单核细胞增生李斯特氏菌(listeriamonocytogenes)简称单增李斯特菌,是主要的食源性病原体之一,可对人类造成流感样疾病和严重并发症等症状,包括脑膜炎、败血症,甚至在脆弱人群中发生自然流产。因此,为保障公众食品安全,建立快速可靠的单增李斯特杆菌等食源性病原体检测方法是非常重要和必要的。
各种分析方法已广泛应用于食源性病原体的检测,包括微生物培养、色谱-质谱、酶联免疫吸附试验(elisa)和基于聚合酶链反应(pcr)的分析。尽管这些传统方法具有很高的敏感性和特异性,但仍然存在一些局限性。例如,细菌培养需要耗时和费力的程序和费力的任务;色谱-质谱需要昂贵的设备和复杂的预处理程序;pcr方法可能会遇到与样品基质相关的问题,因为样品基质可能包含生物样品中通常发现的pcr抑制剂。与上述方法相比,elisa方法操作简单,适用于现场检测,但缺乏敏感性和抗干扰性能。因此,需要一种新的或改进的方法来实现对病原菌的快速、灵敏、准确的检测,并具有较高的抗变换性。
为了开发检测技术以克服目前的限制,已经进行了多种研究,其中生物传感器已成为食品分析和生物检测中一种有前途的重要工具。相对于与电化学、电化学发光、比色和荧光相关的生物传感器,磁弛豫开关时间(mrs)生物传感器具有两个独特的优势,(1)信号标签易于分离或不需要分离步骤;(2)由于食品样品的磁信号背景较低,磁信号可以避免复杂样品基质对信号的干扰。其中,顺磁离子介导的mrs生物传感器具有更好的稳定性和更低的成本,因为顺磁离子如fe3+/fe2+、cu2+/cu+和mn7+/mn2+的价态变化导致了t1或t2信号的显著变化。然而,考虑到基于fe3+/fe2+或cu2+/cu+介导型磁性生物传感器的磁信号变化有限,mn7+/mn2+介导型磁性生物传感器已被证明是检测病原体甚至小分子的一种高灵敏度和可靠的方法。然而,以往的mrs生物传感器主要依赖昂贵的抗体,这限制了其进一步的应用。
由于脱氧核糖核酸(dna)的特异性和稳定性,基于核酸的分析技术提供了对病原体的特异性检测。因此,dna的高识别效率可以用于病原体检测的dna生物传感器。基于光学和电化学方法的dna生物传感器已经成功地检测到各种病原体。然而,大多数dna生物传感器采用pcr扩增来提高灵敏度,导致检测周期长、成本高。因此,开发一种灵敏度高、准确度高、响应快、操作简单的dna生物传感器是非常有必要的。因此,将mrs方法与dna识别相结合,是一种很有前途的食源性致病菌检测方法。
技术实现要素:
本发明的目的在于提供一种检测单增李斯特菌的试剂盒,以及一种检测单增李斯特菌的方法。
本发明的目的通过下述技术方案实现:
一种检测单增李斯特菌的试剂盒,包含:磁性纳米颗粒(mnps)修饰的捕获探针,生物素标记的信号探针,碱性磷酸酶标记的链霉亲和素(alp-sa),2-磷酸-l-抗坏血酸三钠盐(aap),高锰酸钾等。
所述的捕获探针、信号探针能与单增李斯特菌的基因组dna特异性结合。进一步地,所述的捕获探针、信号探针能与单增李斯特菌的毒力基因hly特异性结合。更进一步的,所述的捕获探针、信号探针的序列为:
捕获探针hly1:5’-cacgagagcacctggat-3’;
信号探针hly2:5’-gacaggaagaacatcggg-3’。
所述的磁性纳米颗粒(mnps)修饰的捕获探针为:
mnps-co-nh-(ch2)6-tttttttttttttcacgagagcacctggat。
所述的生物素标记的信号探针为:
gacaggaagaacatcgggtttttttttttt-(ch2)7-biotin。
所述的检测单增李斯特菌的试剂盒,还包含:生理盐水柠檬酸钠缓冲液。
一种检测单增李斯特菌的方法,包括如下步骤:
(1)提取待检样品的基因组dna。
(2)将磁性纳米颗粒修饰的捕获探针、生物素标记的信号探针、步骤(1)提取的基因组dna进行热变性处理,热变性处理后加入到生理盐水柠檬酸钠缓冲液中进行孵育使目标dna与探针杂交,通过磁分离收集磁吸附物1。
(3)往步骤(2)得到的磁吸附物1中加入碱性磷酸酶标记的链霉亲和素进行反应使链霉亲和素和生物素连接,通过磁分离收集磁吸附物2。
(4)往步骤(3)得到的磁吸附物2中加入2-磷酸-l-抗坏血酸三钠盐进行反应去除其磷酸基团,通过磁分离收集上清液。
(5)往步骤(4)收集的上清液中加入高锰酸钾进行反应将mno4-还原为mn2+,反应后通过低场核磁共振(lf-nmr)测量反应混合物的t2值,根据t2值的变化来对单增李斯特菌进行定性、定量检测。
进一步地,所述的检测单增李斯特菌的方法,包括如下步骤:
(1)提取待检样品的基因组dna。
(2)将80-120μl的浓度为1mg/ml、修饰量为0.15-0.3nmol/g(捕获探针/磁性纳米颗粒)磁性纳米颗粒修饰的捕获探针、80-120μl的1.5nmol/l生物素标记的信号探针、20-100μl步骤(1)提取的基因组dna于90-100℃下热变性处理5-10min,热变性处理后加入到100-180μl生理盐水柠檬酸钠缓冲液中于50-60℃下孵育1-1.5h,从而使目标dna与探针杂交,通过磁分离收集磁吸附物1。
(3)往步骤(2)得到的磁吸附物1中加入50-150ml的1μg/ml碱性磷酸酶标记的链霉亲和素,于36.5-37.5℃下摇动反应0.5-1h使链霉亲和素和生物素连接,通过磁分离收集磁吸附物2。
(4)往步骤(3)得到的磁吸附物2中加入50-150μl的25mmol/l2-磷酸-l-抗坏血酸三钠盐,于36.5-37.5℃下摇动反应0.5-1h来去除其磷酸基团,通过磁分离收集上清液。
(5)往步骤(4)收集的上清液中加入25-75μl的0.5mmol/l高锰酸钾,于常温下反应5-10min,将mno4-还原为mn2+后通过低场核磁共振测量反应混合物的t2值,根据t2值的变化来对单增李斯特菌进行定性、定量检测。
上述步骤(5)中使用carr-purcell-meiboom-gill脉冲序列在35℃采集t2,参数如下:核磁共振频率19.894mhz;90°脉冲宽度,13μs;180°脉冲宽度,26μs;tw=12000ms;nech=12000ms;sw=100khz;te=1.0ms;ns=2。对每个点进行三次分析(n=3),并且对于每个间隔,使用下式计算t2值的变化(δt2):δt2=|t2样品-t2空白|。
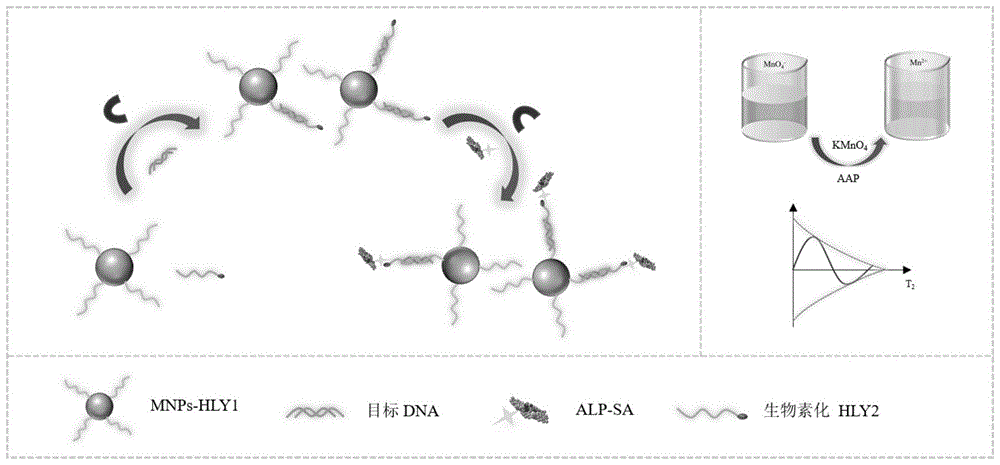
本发明的原理见图1,主要为:提取的单增李斯特菌的基因组dna通过热变性处理从双螺旋结构变成单链结构;mnps-hly1偶联物和生物素化的hly2通过热变性处理得到充分延伸。根据碱基互补配对原理,hly1和hly2可以与靶dna序列结合形成的双链夹心复合物。通过生物素-链霉亲和素系统将alp-sa连接到双链夹心复合物上。alp能去除aap中的磷酸基团将其转变为抗坏血酸(aa)。最后,生成的aa会将mno4-还原为mn2+,而mn(ⅵ)向mn(ⅱ)的转化会引起横向弛豫时间(t2)的显著变化,t2的变化可以作为指示单增李斯特菌的信号读出。
本发明具有如下优点与有益效果:
(1)本发明使用磁弛豫时间(mrs)传感系统,信号标签易于分离或不需要分离步骤,食品样品的磁信号背景较低,可以避免复杂样品基质对信号的干扰;
(2)本发明选择顺磁离子mn(vii)/mn(ii),顺磁离子稳定性更好,成本更低;且mn(vii)/mn(ii)引起的磁信号变化最为显著,灵敏度更高;
(3)本发明利用单增李斯特菌的毒力基因-hly和dna的高识别效率来设计特异性探针和引物用于检测,取代了以往dna传感器常用的昂贵抗体;
(4)本发明制备的磁传感器使用生物素-链霉亲和素系统进行级联,利用alp催化aap产生aa,从而实现mn(vii)/mn(ii)信号放大,避免了pcr的复杂过程和原位杂交的多步骤操作。
附图说明
图1是本发明检测单增李斯特菌的方法的原理图。
图2是用mn(vii)/mn(ii)转换作为信号读出验证基于mnps的磁弛豫;a是alp酶介导的mn(ⅵ)/mn(ii)转化诱导(高δt2,低δt2)的原理;b是mno4-与mn2+水溶液中δt2值的变化;c是不同浓度的alp对kmno4溶液的影响;d是kmno4与aa水溶液反应引起的颜色变化;e是不同浓度的aa对kmno4溶液的影响。
图3是利用uv-vis光谱和dls对mnps-hly1偶联物进行表征和分析;a是通过差示扫描量热仪(dls)表征了1000nm大小的mnps以及mnps和dna探针hly1的复合物;b是通过差示扫描量热法(dls)表征了mnps和mnps-hly1复合物的zeta电位;c是mnps、hly1和mnps-hly1复合物的紫外-可见吸收光谱。
图4是本发明检测单增李斯特菌的灵敏性、特异性;a是用于检测单增李斯特菌的标准曲线;b是用于检测单增李斯特菌的线性范围;c是探针-dna诱导的杂交反应原理和酶介导的mn(vii)/mn(ii)转化诱导(高δt2,低δt2)的磁弛豫开关传感的原理;d是本发明检测方法的特异性。(菌落总数均为105cfu/ml,误差棒显示三个实验的标准偏差)。
具体实施方式
下面结合实施例及附图来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅是帮助理解本发明,不应视为对本发明的具体限制。
实施例1
采用一种广泛使用的标记酶——碱性磷酸酶(alp),可以将aap转化为aa,为酶催化mn(vii)/mn(ii)转化提供了平台(图2a)。因此,将形成的双链夹心复合物与alp-sa反应,通过剪切磷酸基团将aap转化为aa,生成的aa会将mno4-还原为mn2+,而mn(vii)向mn(ii)的转化会引起横向弛豫时间(δt2)的显著变化。通过测量不同浓度梯度的mno4-和mn2+水溶液中δt2值,则可以明显看出δt2依赖于mn(ii)的浓度,而mn(vii)对δt2的影响可以忽略不计(图2b)。因此,选择mno4-作为反应底物。此外,通过更改不同溶度梯度验证了不同浓度的aa和alp对kmno4溶液的影响(图2c和2e)。在aa存在下,mn(vii)还原为mn(ii),溶液颜色发生明显变化,浅红色mn(vii)转变为无色mn(ii)(图2d)。通过这种方法,可以有效地检测出目标dna序列。
实施例2
本实施例检测单增李斯特菌所使用到的设备、材料如下:
设备:使用ms-3振荡器进行振荡;supermag磁选机进行磁分离和洗涤步骤;0.5t低场核磁共振谱仪(lf-nmr)测量t2信号;uv-1800获得紫外-可见光(uv-vis)吸收光谱;马尔文zeta粒度分析仪(nano-zs)进行动态光散射(dls),测量流体动力学尺寸和zeta电位;纳米光度计-n60touch获得dna的浓度和纯度;hl-2000杂交链接器(uvp)进行杂交反应;t100tm热循环仪和geldocxr+系统分别用作扩增产物和凝胶成像。
材料:磁性纳米颗粒(mnps,直径:1000nm;固相含量:10mg/ml,有羧基修饰)购自oceannanotech(美国);抗坏血酸(aa)、2-磷酸-l-抗坏血酸三钠盐(aap)、n-乙基-n’-(3-二甲氨基丙基)碳二亚胺盐酸盐(edc)、n-羟基琥珀酰亚胺(nhs)、2-(n-吗啡啉)乙磺酸和牛血清白蛋白(bsa)均购自sigma-aldrich(美国);碱性磷酸酶标记的链霉亲和素购自beyotimebiotechnology(1mg/ml,alp-sa,中国上海);生理盐水柠檬酸钠缓冲液(20×ssc,ph7.0)和细菌基因组dna试剂盒购自zomanbio(中国,北京);胰蛋白酶大豆肉汤(tsb)和胰蛋白胨大豆琼脂(tsa)培养基购自qingdaohopebio-technologyco.,ltd.(中国,青岛);dna溶解用tris-edta缓冲液(te,ph8.0)购自shanghaidouble-helixbiotechco.,ltd.(中国,上海);所有其他化学药品均为分析级,购自sinopharmchemicalco.,ltd.(中国,上海);整个实验过程中都使用了milli-q水。
经hplc纯化的寡核苷酸序列均购自tsingkebiologicaltechnology(中国武汉),其序列如下:
表1
(1)mnps-hly1偶联物的制备
通过edc/nhs的活化将捕获探针hly1偶联到羧基修饰磁性纳米颗粒上,具体过程为:取100μlmnps(1000nm,10mg/ml,有羧基修饰)到1.5ml离心管中,使用500μlmest(10mmol/lmes,ph=6.0,0.05%tween-20)洗涤2次后进行第一次磁分离。去掉上清液后,在离心管中加入200μl5mg/ml的edc和200μl5mg/ml的nhs与mnps反应,然后将混合物在涡流振荡器中于37℃轻轻摇动30分钟,进行第二次磁分离并使用mest洗涤2次。接下来,在上述离心管中加入150μl1.5nmol/l的寡核苷酸探针hly1(pbst作溶剂),用pbst(0.01mol/lpbs,ph=7.4,0.05%tween-20)调节体积至500μl,将混合物在涡流振荡器中于37℃轻轻摇动3h,进行第三次磁分离来去掉上清液,然后在mnps-hly1偶联物中加入1ml含1%bsa的pbst,于37℃反应30min来封闭残余位点,进行第四次磁分离并使用500μlpbst洗涤4次。最后获得了mnps-hly1,并将其分散在1ml含0.5%bsa的pbst中,储存在4℃下备用。
采用动态光散射(dls)和紫外-可见光谱(uv-vis)对mnps-hly1偶联物进行表征。修饰hly1后,mnps-hly1偶联物的平均流体力学直径(1411nm)比未修饰的mnps(1036nm)显著增大(图3a)。对于表面电位,表面改性后从-27mv略微增加到-25mv(图3b)。这种微小的电位变化可能是由于寡核苷酸探针本身具有负电位。此外,图3c显示mnps-hly1偶联物的吸收光谱在278nm处有最大吸收峰,而原始mnps在任何波长都没有吸附峰。而且由于dna分子中碱基之间的电子相互作用,dna的吸收光谱在260nm处有一个最大吸收峰,因此,dna寡核苷酸(hly1)的最大吸附峰位于260nm左右(图3c)。显然,mnps-hly1偶联物的吸附峰相对于纯dna寡核苷酸(hly1)的吸附峰发生了18nm的红移,表明hly1吸附在mnps表面,mnps与hly1之间形成了氨基键合。这些结果表明,hly1成功地修饰到了mnps的表面。
(2)单增李斯特菌的检测
从不同浓度(20~2×107cfu/ml)的单增李斯特菌培养物中提取基因组dna,dna溶解用tris-edta缓冲液(te,ph8.0)。选择肠炎链球菌、大肠杆菌、金黄色葡萄球菌、副溶血性弧菌4种病原菌,收集各病原菌浓度为105cfu/ml的1ml菌液,提取基因组dna,作为阴性对照。
将100μl步骤(1)得到的mnps-hly1溶液、100μl1.5nmol/l生物素化的寡核苷酸探针hly2(1×ssc、ph7.0做溶剂)、40μl不同浓度的基因组dna和160μl生理盐水柠檬酸钠缓冲液(1×ssc,ph7.0)加入到1.5ml离心管中混合,杂交前每个离心管中的复合物都在95℃下热处理10min,之后立即在冰中冷却5min,冷却后放置于烘箱中53℃连续摇晃孵育1h以使目标dna与探针杂交。对离心管进行第一次磁分离并洗涤复合物后,加入100μl1μg/ml的alp-sa(1×ssc作溶剂来稀释原液)于37℃下轻轻摇动反应30min,再进行第二次磁分离并洗涤。第一次磁分离时去除上清液,各管复合物分别用0.5×ssc缓冲液洗涤3次;第二次磁分离时用tbst缓冲液洗涤4次、纯水洗涤1次,以除去多余的alp-sa。随后往离心管中加入100μl25mmol/l的aap水溶液于37℃下轻轻摇动反应30min,经第三次磁分离后收集每管的上清液。最后将上清液与0.5mmol/l高锰酸钾水溶液以2:1的体积比反应5min,用0.5t的lf-nmr测量反应混合物的t2值。
使用carr-purcell-meiboom-gill脉冲序列在35℃采集t2,参数如下:核磁共振频率19.894mhz;90°脉冲宽度,13μs;180°脉冲宽度,26μs;tw=12000ms;nech=12000ms;sw=100khz;te=1.0ms;ns=2。对每个点进行三次分析(n=3),并且对于每个间隔,使用下式计算t2的变化(δt2):δt2=|t2样品-t2空白|。
结果见图4:图4a显示了从20到2×107cfu/ml的单增李斯特菌浓度的结果,目标菌越多,获得的δt2值越高,该结果表明通过捕获mnps-hly1和杂交反应可以富集目标dna序列,通过酶催化反应介导的mn(vii)/mn(ii)相互转化可以扩增信号。图4b还显示δt2值与目标细菌的浓度在2×102~2×107cfu/ml范围内呈线性关系,线性方程为y=62.45x+35.67(x=log([单增李斯特菌(cfu/ml)],r2=0.9976),检出限(s/n=3)为102cfu/ml。单增李斯特菌检测的δt2值远高于阴性对照(图4d),也表明基于碱基互补配对原理设计的寡核苷酸探针对靶序列具有较好的特异性,也就是说通过mnps-hly1偶联物和hly2可以特异性地识别和捕获单增李斯特菌的基因组dna(图4c)。
实施例3
本实施例按基本实施例2,不同在于:步骤(1)中,加入hly1的浓度分别改为1nmol/l、2nmol/l和3nmol/l,结果发现所有的偶联物都在278nm处有一个吸附峰。同时,当hly1的浓度大于1nmol/l时,mnps-hly1共轭的吸收光谱几乎不变。因此,采用1.5nmol/l的hly1与mnps进行偶联,以提高偶联效率。
实施例4
本实施例按基本实施例2,不同在于:步骤(2)中,加入aap的浓度分别改为20mmol/l和30mmol/l。在20~2×107cfu/ml的七组对照数据中,与最初25mmol/l的浓度进行对比,δt2值明显降低,差值在0-150ms中波动,极不稳定。因此,aap的最佳浓度为25mmol/l。
实施例5
本实施例按基本实施例2,不同在于:步骤(2)中,混合物与0.5mmol/lkmno4水溶液的反应体积比改为1:1。在七组对照数据中,与最初2:1的体积比进行对比,δt2值明显降低,差值很大,在150-300ms中波动。因此,混合物与0.5mmol/lkmno4的最佳反应体积比为2:1。
实施例6
本实施例做本发明与常规pcr扩增方法检测单增李斯特菌的对比。首先,将单增李斯特菌纯培养物用无菌磷酸盐缓冲液进行10倍梯度稀释,最终浓度为108~10cfu/ml,然后将1ml不同浓度的菌液加入到1.5ml离心管中提取基因组dna。总反应体积为25μl,包括2.5μl的10×pcr缓冲液、0.25μl的taqdna聚合酶(5u/ml)、2.0μl的2.5mmol/ldntp混合物、1μl的基因组dna、18.25μl的双蒸水、0.5μl的正向引物(hlyaf,10μmol/l)和0.5μl的反向引物(hlyar,10μmol/l),引物序列见表1。pcr反应条件为:95℃预变性5min,然后95℃变性1min,62℃退火1min,72℃延伸1min,共35个循环,最后72℃延伸8min。最终pcr产物用1%琼脂糖凝胶电泳进行检测。
结果发现pcr方法检测单增李斯特菌的灵敏度约为103cfu/ml。未经pcr扩增的提取dna的凝胶成像中,只有从108cfu/ml和107cfu/ml的菌液中提取的基因组dna才显示出微弱的条带。因此,本发明研制的磁性dna生物传感器不仅可以避免pcr操作等复杂的操作步骤,而且为食源性致病菌的检测提供了一种耗时少、灵敏度高的有前途的方法。
实施例7
本实施例做本发明的火腿样品加标回收试验,对添加不同浓度单增李斯特菌的火腿匀浆样品进行了检测。如上所述提取基因组dna并进行检测。回收率为87.2%-101.3%,变异系数为6.46%-9.54%(表2),表明构建的生物传感器检测复杂样品中单增李斯特菌的潜力和可行性。
表2不同浓度水平的火腿中单增李斯特菌的回收率
申请人声明,本发明通过上述实施例来说明本发明的工艺方法,但本发明并不局限于上述工艺步骤,即不意味着本发明必须依赖上述工艺步骤才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明所选用原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
序列表
<110>湖北工业大学
<120>一种检测单增李斯特菌的试剂盒和方法
<141>2020-08-24
<160>4
<170>siposequencelisting1.0
<210>1
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>1
cacgagagcacctggat17
<210>2
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>2
gacaggaagaacatcggg18
<210>3
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>3
gcctgcaagtcctaagacgccaatc25
<210>4
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>4
cttgcaactgctctttagtaacagc25
- 还没有人留言评论。精彩留言会获得点赞!