Cas9蛋白的核酸适配体及其应用
cas9蛋白的核酸适配体及其应用
技术领域
1.本技术属于分子生物学技术领域,具体涉及核酸适配体,更具体涉及cas9蛋白的核酸适配体及其应用。
背景技术:
2.核酸适配体(aptamer)是一段寡核苷酸序列(dna或rna),通常是利用体外筛选技术——指数富集的配体系统进化技术(systematic evolution of ligands by exponential enrichment,selex)从随机合成的寡核苷酸核酸分子文库中筛选得到的寡核苷酸片段。核酸适配体通过二、三级结构的折叠形成特定的三维空间构型,可与靶分子进行高亲和性、高特异性的结合,靶分子包括蛋白质、核酸、代谢小分子、化合物和氨基酸等。核酸适配体在分析化学、蛋白质组学研究、药物研发及基因调控等领域已经成为了一种重要的研究工具。
3.crispr-cas9系统是细菌和古细菌在长期演化过程中形成的一种免疫防御机制,可对抗入侵病毒及外源dna。crispr-cas9基因编辑技术则是一种对靶基因进行特定dna修饰从而进行基因编辑的前沿技术。cas9蛋白在引导rna(guide rna,grna)的引导下,可结合到基因的靶位点进行精准切割。cas9蛋白包含的hnh核酸酶结构域负责切割外源dna与间隔序列互补的链,而ruvc结构域负责切割外源dna的另一条链。dcas9蛋白是cas9蛋白的突变体,同时突变ruvc和hnh两个核酸酶区域,因此dcas9蛋白失去内切酶活性,只保留在grna引导下结合基因组的能力。crispr-dcas9系统为分子生物学家提供了一个研究定点转录调控的平台,可进行基因调控等研究。但是,本领域还没有关于利用核酸适配体对crispr-dcas9系统的调控作用进行反调控(例如干扰)的报道。
技术实现要素:
4.本发明的目的在于提供cas9蛋白的核酸适配体,可用于对crispr-dcas9系统的调控作用进行干扰。
5.本发明通过以下技术方案来实现本发明的目的。
6.在第一方面,本发明提供cas9蛋白的核酸适配体,该核酸适配体的核苷酸序列如seq id no:1、seq id no:4、seq id no:7、seq id no:10或者seq id no:13所示,该核酸适配体对cas9蛋白具有1.0e-9
m或更低的kd值所表示的亲和力。
7.进一步地,该核酸适配体与grna(tre)spacer序列的3’端连接,连接所得的核苷酸序列分别如seq id no:2、seq id no:5、seq id no:8、seq id no:11或者seq id no:14所示。
8.进一步地,该核酸适配体与grna(tre)spacer序列的5’端连接,连接所得的核苷酸序列分别如seq id no:3、seq id no:6、seq id no:9、seq id no:12或者seq id no:15所示。
9.进一步地,本发明还提供由具有seq id no:1-15所示的核苷酸序列的核酸适配体
衍生、并且保持该亲和力的核酸适配体。这些衍生的核酸适配体也落入本发明的核酸适配体的范围内。
10.在一些实施方案中,衍生的核酸适配体包含对上述核苷酸序列进行一个或多个碱基插入、缺失或者置换突变得到的核苷酸序列并且保持该亲和力。本领域技术人员熟知如何对核苷酸序列进行一个或多个碱基插入、缺失或者置换突变。
11.在一些实施方案中,衍生的核酸适配体包含与上述核苷酸序列互补的核苷酸序列并且保持该亲和力。本领域技术人员熟知如何获得一条核苷酸序列的互补序列。
12.在一些实施方案中,衍生的核酸适配体的核苷酸序列包含碱基修饰并且保持该亲和力。
13.具体地,该碱基修饰为硫代修饰、磷酸化修饰、甲基化修饰、氨基化修饰或者巯基化修饰。优选地,该碱基修饰为硫代修饰。本领域技术人员熟知如何如何对一条核苷酸序列作出上述碱基修饰。
14.在一些实施方案中,衍生的核酸适配体的核苷酸序列包含标记物并且保持该亲和力。
15.具体地,该标记物为同位素标记物、生物素标记物、化学发光标记物、荧光标记物或者酶标记物。本领域技术人员熟知如何对一条核苷酸序列添加上述标记物。
16.如实施例5的试验所证实,本发明的cas9蛋白的核酸适配体能够抑制dcas9-vpr融合蛋白对egfp基因的转录激活作用,显示了本发明的cas9蛋白的核酸适配体对crispr-dcas9的调控作用(例如转录激活作用)具有干扰作用,可以作为干扰crispr-dcas9的工具。
17.相应地,在第二方面,本发明提供本发明第一方面的cas9蛋白的核酸适配体在制备干扰crispr-dcas9的试剂或者试剂盒中的用途。
18.本发明的试剂或者试剂盒可以用于相关的分子生物学研究与试验。
附图说明
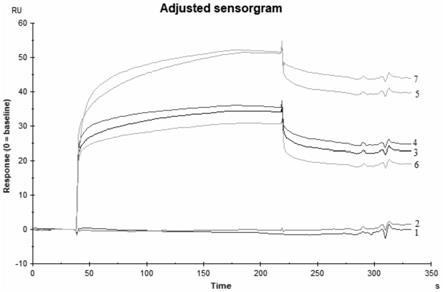
19.图1显示本发明实施例1获得的5条cas9蛋白核酸适配体ssdna序列与cas9蛋白的亲和力分析结果;
20.图2显示本发明实施例4制备的ssdna、ssdna-spacer和spacer-ssdna共15条序列都能抑制dcas9-vpr对egfp基因的转录激活作用。
具体实施方式
21.为了使本发明所解决的技术问题、所采用的技术方案及所获得的有益效果更加清楚明白,以下结合附图及具体实施例对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
22.除非另外定义,本文使用的所有技术和科学术语与本公开所属领域技术人员通常理解的含义相同。如果有冲突,以本说明书的定义为准。
23.除另有说明的外,本文所用的化学物质和仪器可市售获得。本文中使用的材料、方法和示例仅作说明用途,无意作为限制,除非特别指明。
24.实施例中涉及的数据分析使用spss19.0统计软件,正态分布的数据采用x
±
s表示,两组间比较采用独立样本t检验,检验水准以p《0.05表示差别具有统计学意义。
25.实施例1:selex法筛选cas9蛋白核酸适配体ssdna序列
26.(一)实验准备
27.1.缓冲液的配制
28.需要配制两种缓冲液,一种是含有牛血清白蛋白(bsa)的缓冲液(以下简称“缓冲液a”),其成分为1
×
pbs ph 7.4,1mm mgcl2,0.05%tween20,2mg/ml bsa,另一种是不含牛血清白蛋白(bsa)的无蛋白缓冲液(以下简称“缓冲液b”),其成分为1x pbs ph 7.4,1mm mgcl2,0.05%(v/v)tween20。
29.2.cas9蛋白的生物素标记
30.本实施例使用nhs-peg4-biotin试剂盒(ez-link,thermo scientific)进行cas9蛋白的生物素标记。该试剂盒适用于抗体、蛋白质和其他的含胺大分子的标记,且简单高效。nhs-peg4-biotin中的聚乙二醇间隔臂是水溶性的,因此nhs-peg4-biotin标记的蛋白在水溶液中很少聚集。
31.用nhs-peg4-biotin对cas9蛋白进行标记,在一个cas9蛋白上标记3-5个生物素。标记时使用的反应缓冲液为磷酸盐缓冲液(pbs;0.1m磷酸钠,0.15m氯化钠;ph 7.2),或者其他不含伯胺的缓冲液,要求ph在7.0-8.5之间。通过调整cas9蛋白和生物素的摩尔比来达到所需的标记水平,低浓度蛋白(2mg/ml)比高浓度蛋白(10mg/ml)使用的生物素摩尔比要高。本实施例使用20倍过量的生物素进行标记。具体地,向2mg的nhs-peg4-biotin中加入170μl超纯水,制成20mm的原液;向cas9蛋白溶液中加入适量的nhs-peg4-biotin溶液(生物素:cas9蛋白=20:1),冰上孵育2h;通过透析法或者凝胶过滤法除去多余的nhs-peg4-biotin;使用与非生物素化蛋白相同的保存方法保存生物素标记的cas9蛋白。在使用透析法除去多余的nhs-peg4-biotin时,对于10-100μl的反应体积,可以使用slide-a-lyzer mini dialysis unit(thermo scientific)装置来进行,对于0.1-12ml的反应体积,可以使用slide-a-lyzer dialysis cassettes(thermo scientific)来进行,将生物素标记cas9蛋白溶解或交换到反应缓冲液中。
32.(二)实验步骤
33.1.待筛选文库溶液的制备
34.委托生工生物工程(上海)股份有限公司合成随机单链寡核苷酸文库。将0.3ml缓冲液b加入到文库中,混匀转移到1.5ml离心管。室温3000g离心1min。95℃水浴5min,自然冷却到室温(约30min)。再加0.7ml缓冲液a,混匀。室温3000g离心1min,得到待筛选文库溶液(1ml)。
35.2.阴性筛选
36.吸取250μl链霉素亲和磁珠(2.5mg,invitrogen 11205d)到1.5ml离心管中,磁力架吸附1min。吸弃上清液,加500μl的缓冲液a,洗涤1次,磁力架吸附1min。重复上一步2次。再加50μl的缓冲液a重悬,将其全部加到待筛选文库溶液中,室温旋转孵育1h。磁力架吸附1min,转移上清到新的1.5ml离心管中,室温3000g离心1min,得到阴性筛选后的文库溶液,其中去除了文库中与链霉素亲和磁珠结合的寡核苷酸。
37.3.生物素标记cas9蛋白与链霉素亲和磁珠偶联
38.吸取50μl链霉素亲和磁珠(0.5mg)到1.5ml离心管中,磁性架吸附1min。吸弃上清,加入250μl缓冲液b旋转洗涤,磁性架吸附1min。重复上一步2次,加100μl缓冲液b重悬。然后
加10-15μg生物素标记cas9蛋白,在室温下孵育30min。磁性架吸附1min,吸弃上清,再用200μl缓冲液b重悬,重复洗2次(共3次)。加100μl缓冲液a重悬,得到偶联的生物素标记cas9蛋白溶液。
39.4.阳性筛选
40.将偶联的生物素标记cas9蛋白溶液加到阴性筛选后的文库溶液中,室温旋转孵育90min。旋转混匀,分别吸取1/2体积到2个1.5ml离心管,磁力架吸附1-2min。每管使用0.5-1.0ml的缓冲液a洗涤。将上述2个管中的链霉素亲和磁珠混合,用缓冲液b洗涤两次,每次500μl,最后用50μl的缓冲液b重悬,得到阳性筛选后的链霉素亲和磁珠。
41.5.核酸适配体解离
42.向上述50μl阳性筛选后的链霉素亲和磁珠中加入50μl的1n naoh,在65℃下孵育30min,再加入40μl的2m tris-cl中和naoh。使用磁力架吸附链霉素亲和磁珠,将上清液转移到1.5ml管中,得到生物素标记cas9蛋白的核酸适配体样品液。
43.6.核酸适配体样品液脱盐
44.将过滤柱(thermo 89883)放在1.5ml离心管中,室温1500g离心1min。在树脂层顶部加入300μl缓冲液b,1500g离心1min,弃去收集管中的冲洗液。重复2-3次,弃去每次收集管中的冲洗液。将过滤柱放在新的1.5ml离心管中,将生物素标记cas9蛋白的核酸适配体样品液加到过滤柱的顶部,1500g离心2min,收集滤液。通常,每个过滤柱可以处理30-130μl样品。将核酸适配体样品液分成两份,每一份用一个过滤柱,将2个收集管收集的滤液合并在一管,得到脱盐后的纯化核酸适配体样品液。
45.7.特异性筛选
46.上述阳性筛选使用了10μg生物素标记cas9蛋白/50μl链霉素亲和磁珠或更高的蛋白量,结果会有大量的非特异性核酸适配体结合。为此进行特异性筛选,使用极低的蛋白量,例如上述蛋白量的十分之一的蛋白量,以便去除大量非特异性核酸适配体。特异性筛选要求蛋白纯度较高,最好是单一蛋白,不含有杂蛋白。特异性筛选的具体操作如下:
47.将上述纯化核酸适配体样品液分到3个反应管中,依次标记1号管、2号管、3号管,每管15μl。1号管作为起始溶液对照组,2号管作为样品组,3号管作为链霉素亲和磁珠对照组,用于后续高通量测序对照。2号管作为样品组加入30μl50mm生物素标记cas蛋白,1号管和3号管作为对照组不加入生物素标记cas蛋白。各管(组)的具体试剂和加入量如下表1所示,其中链霉素亲和磁珠经如下处理:取60μl的链霉素亲和磁珠(2.5mg,invitrogen 11205d),用500μl的缓冲液a洗涤,重复洗涤2次,最后用30μl的缓冲液a重悬链霉素亲和磁珠。
48.表1:特异性筛选中1号管、2号管、3号管的组别和试剂用量
[0049][0050]
1号管、2号管、3号管中加入相应的试剂后,室温下漩涡孵育1h。利用磁力架,分别
分离2号管和3号管中的链霉素亲和磁珠,用150μl的缓冲液a洗涤3次,最后分别加100μl的缓冲液a重悬。此时,1号管为150μl,2号管和3号管分别为100μl,供下一步进行pcr实验,制备次级文库。
[0051]
8.pcr和凝胶电泳分析
[0052]
1号管、2号管、3号管各取10μl进行pcr扩增,1号管和3号管作为对照pcr。每个管使用自设计的引物。每个反应管使用100μl的1
×
pcr缓冲液(2.5mm mgcl2,0.2mm dntp,0.4μm正向引物,0.08μm反向引物和1u taq polymerase)。扩增条件为:预变性94℃1min;循环条件94℃30s,50-60℃30s,72℃1min;最后72℃延长3min;一般设置20个循环。采用8-10%非变性聚丙烯酰胺电泳进行分析。如果聚丙烯酰胺电泳结果不太满意,可以适当改变pcr循环数(一般一个梯度4个循环),通过pcr条带清晰度来确定最终循环数。切胶回收核酸适配体ssdna,使用异丙醇浓缩ssdna,作为次级文库,用于下一轮筛选。
[0053]
9.高通量测序
[0054]
重复步骤3至步骤8共10轮,最后取第一轮的起始溶液对照组和最后一轮的样品组和磁珠对照组,采用illumina miseq测序系统进行高通量测序。
[0055]
10.数据处理
[0056]
高通量测序读长模式为双末端各300bp,由于一般核酸适配体只有100bp左右,因此单向测序的数据即足够使用。首先采用cutadapt软件对正向测序的数据进行切割,切除上下游固定引物序列,仅保留中间部分序列,数据格式为fastq。然后对保留的数据采用prinseq-lite软件进行质量控制,保证每个碱基质量值均大于30,转换数据格式为fasta。最后用自写perl脚本统计各unique序列出现的频率并计算占比。
[0057]
(三)实验结果
[0058]
结果共测到304413条有效序列。以序列》ssdna1_4381_304413_0.0144为例,其表示第一条unique序列,一共测到4381次,占比为1.44%。根据各条unique序列测到的次数进行排序,排序越靠前,表明其与cas9蛋白的亲和力可能越高,越可能是cas9蛋白的核酸适配体ssdna。排序前5名的5条序列的具体序列如下所示,在序列表中分别以seq id no:1、seq id no:4、seq id no:7、seq id no:10和seq id no:13显示:
[0059]
》ssdna1_4381_304413_0.0144
[0060]
aacacgacgtgtctgtgaatcacacagtccaacaatgtcgtg(seq id no:1)
[0061]
》ssdna2_2759_304413_0.0091
[0062]
aacacgactccactgtgcgtcgcgaactctgccacggtcgtg(seq id no:4)
[0063]
》ssdna3_1506_304413_0.0049
[0064]
aacacgacgcagctgtggccagcgaactgtgtgggagtgggc(seq id no:7)
[0065]
》ssdna4_1280_304413_0.0042
[0066]
aagcccactggtctgtggacaacgaacgccggtgtggtcgtg(seq id no:10)
[0067]
》ssdna5_1233_304413_0.0041
[0068]
aacacgacacaagttcgaaggacgaacgtcatgcaagtgggc(seq id no:13)
[0069]
实施例2:cas9蛋白核酸适配体ssdna序列与cas9蛋白的亲和力测定
[0070]
选取实施例1的selex核酸适配体筛选结果中排序前5名的5条序列(ssdna1、ssdna2、ssdna3、ssdna4、ssdna5)进行与cas9蛋白的亲和力测定,以验证cas9蛋白核酸适配
体ssdna序列与cas9蛋白的结合强度。
[0071]
使用cas9蛋白适配体ssdna序列与cas9蛋白的平衡解离常数(即kd值)来表示cas9蛋白核酸适配体ssdna序列与cas9蛋白的亲和力。kd值的大小可以判断cas9蛋白适配体ssdna序列与cas9蛋白的亲和力的高低,kd值越小,亲和力越高。本实施例采用表面等离子共振法(spr)测定kd值。
[0072]
(一)实验步骤
[0073]
1.将cas9蛋白偶联到cm5芯片表面的第4通道。具体地,先用50mm naoh水溶液进样20μl清洗芯片,流速10μl/min。然后用0.4m edc+0.1m nhs混合溶液进样50μl活化芯片,流速5μl/min。将cas9蛋白用ph=5.0、浓度为10mm的醋酸钠水溶液稀释至终浓度为50μg/ml后进样进行偶联,进样体积50μl,流速5μl/min,cas9蛋白偶联量为6120ru。进样完成后,进50μl乙醇胺封闭芯片,流速5μl/min。
[0074]
2.第3通道按照上述步骤1的方法处理,只是不进行蛋白偶联的步骤,活化和封闭的步骤完全一样,作为对照通道。
[0075]
3.检测:使用表面等离子共振仪(ge healthcare,型号biacore t200),设定动力学检测参数,取ssdna1、ssdna2、ssdna3、ssdna4、ssdna5序列分别用进样缓冲液(ph7.4 dpbs)稀释至500nm,依次流过第3通道和第4通道,进样流速30μl/min,时间2min。然后用解离缓冲液(1m nacl)进行解离,解离流速30μl/min,时间3min。每个序列用1m nacl再生,流速30μl/min,时间0.5min。
[0076]
(二)实验结果
[0077]
ssdna1、ssdna2、ssdna3、ssdna4、ssdna5与cas蛋白的亲和力测定结果如表2和图1所示。
[0078]
表2:ssdna1、ssdna2、ssdna3、ssdna4、ssdna5与cas9蛋白的kd值
[0079]
cas9蛋白适配体ssdna序列名称与cas9蛋白的kd值ssdna14.095e-9
mssdna23.373e-9
mssdna38.769e-11
mssdna44.661e-9
mssdna53.534e-10m[0080]
由表2可见,ssdna3与cas9蛋白的亲和力最高。理论上,1.0e-9
m或更低的kd值所表示的亲和力可以满足cas9蛋白适配体ssdna序列与cas9蛋白结合调控其功能的需求。
[0081]
图1中1、2为startup程序,3-7分别对应seq1至seq5。图1显示,dpbs不与cas9蛋白结合,ssdna5与dna3的亲和力较高,ssdna2、ssdna1和ssdna4的亲和力依次降低。
[0082]
实施例3:cas9蛋白核酸适配体ssdna序列与cas9蛋白的分子对接
[0083]
(一)实验方法
[0084]
1.cas9蛋白核酸适配体ssdna序列的三维结构建模
[0085]
将上述cas9蛋白核酸适配体ssdna序列ssdna1、ssdna2、ssdna3、ssdna4、ssdna5提交到mc-fold/mc-sym1,这是一种基于网络的核酸二级和三级结构预测服务。mc-fold输出二级结构,核酸适配体的发夹环随后提交给mc-sym预测三维结构。生成的3d模型使用tinker分子建模软件包进一步最小化,使用解除和细化方法来最小化模型。
[0086]
2.cas9蛋白核酸适配体ssdna序列与cas9蛋白对接
[0087]
使用hdock4将cas9蛋白核酸适配体ssdna序列与cas9蛋白对接,采用混合对接策略,利用hdock服务器预测蛋白质和核酸两个分子之间的结合。在对接过程中,选择cas9蛋白作为受体,核酸适配体ssdna序列作为配体。在moe中分析配体和受体的相互作用,并用pymol软件进行可视化分析。
[0088]
(二)实验结果
[0089]
对cas蛋白核酸适配体ssdna序列ssdna1、ssdna2、ssdna3、ssdna4、ssdna5进行了三维结构建模,与cas9蛋白成功进行了对接,对接分数如表3所示。
[0090]
表3:ssdna1、ssdna2、ssdna3、ssdna4、ssdna5与cas9蛋白对接的对接分数
[0091]
受体配体对接分数(kcal/mol)cas9蛋白ssdna1-240.21cas9蛋白ssdna2-269.84cas9蛋白ssdna3-331.66cas9蛋白ssdna4-275.56cas9蛋白ssdna5-316.91
[0092]
分子对接实验模拟cas蛋白核酸适配体ssdna序列与cas蛋白的结合位置,可以反映它们的结合的强度和稳定性。对接分数越低,表示对接结构越稳定。由表3可见,ssdna3与cas9蛋白的对接结构的稳定性最高,然后依次是ssdna5、ssdna4、ssdna2、ssdna1。
[0093]
实施例4:cas9蛋白核酸适配体ssdna序列与grna(tre)spacer序列的连接
[0094]
体外化学合成cas9蛋白核酸适配体ssdna序列ssdna1、ssdna2、ssdna3、ssdna4、ssdna5共5条序列,并将各ssdna序列分别连接在靶基因特异性的grna(tre)spacer序列(tacgttctctatcactgata)的5’端和3’端,形成ssdna-spacer与spacer-ssdna两种连接方式,得到5条ssdna-spacer序列和5条spacer-ssdna序列。优选地,对上述15条序列进行硫代修饰,以防止在细胞内被降解。具体序列如下所示,并且5条ssdna-spacer序列在序列表中分别以seq id no:2、seq id no:5、seq id no:8、seq id no:11、seq id no:14表示,5条spacer-ssdna序列在序列表中分别以seq id no:3、seq id no:6、seq id no:9、seq id no:12、seq id no:15表示(*代表硫代修饰,下划线代表spacer序列):
[0095]
ssdna1:
[0096]
a*a*c*acgacgtgtctgtgaatcacacagtccaacaatgtc*g*t*g(seq id no:1)
[0097]
ssdna1-spacer:
[0098]
a*a*c*acgacgtgtctgtgaatcacacagtccaacaatgtcgtgtacgttctctatcactg*a*t*a(seq id no:2)
[0099]
spacer-ssdna1:
[0100]
t*a*c*gttctctatcactgataaacacgacgtgtctgtgaatcacacagtccaacaatgtc*g*t*g(seq id no:3)
[0101]
ssdna2:
[0102]
a*a*c*acgactccactgtgcgtcgcgaactctgccacggtc*g*t*g(seq id no:4)
[0103]
ssdna2-spacer:
[0104]
a*a*c*acgactccactgtgcgtcgcgaactctgccacggtcgtgtacgttctctatcactg*a*t*a
(seq id no:5)
[0105]
spacer-ssdna2:
[0106]
t*a*c*gttctctatcactgataaacacgactccactgtgcgtcgcgaactctgccacggtc*g*t*g(seq id no:6)
[0107]
ssdna3:
[0108]
a*a*c*acgacgcagctgtggccagcgaactgtgtgggagtg*g*g*c(seq id no:7)
[0109]
ssdna3-spacer:
[0110]
a*a*c*acgacgcagctgtggccagcgaactgtgtgggagtgggctacgttctctatcactg*a*t*a(seq id no:8)
[0111]
spacer-ssdna1:
[0112]
t*a*c*gttctctatcactgataaacacgacgcagctgtggccagcgaactgtgtgggagtg*g*g*c(seq id no:9)
[0113]
ssdna4:
[0114]
a*a*g*cccactggtctgtggacaacgaacgccggtgtggtc*g*t*g(seq id no:10)
[0115]
ssdna4-spacer:
[0116]
a*a*g*cccactggtctgtggacaacgaacgccggtgtggtcgtgtacgttctctatcactg*a*t*a(seq id no:11)
[0117]
spacer-ssdna4:
[0118]
t*a*c*gttctctatcactgataaagcccactggtctgtggacaacgaacgccggtgtggtc*g*t*g(seq id no:12)
[0119]
ssdna5:
[0120]
a*a*c*acgacacaagttcgaaggacgaacgtcatgcaagtg*g*g*c(seq id no:13)
[0121]
ssdna5-spacer:
[0122]
a*a*c*acgacacaagttcgaaggacgaacgtcatgcaagtgggctacgttctctatcactg*a*t*a(seq id no:14)
[0123]
spacer-ssdna5:
[0124]
t*a*c*gttctctatcactgataaacacgacacaagttcgaaggacgaacgtcatgcaagtg*g*g*c(seq id no:15)
[0125]
实施例5:cas9蛋白核酸适配体ssdna序列对crispr-dcas9转录激活作用的调控
[0126]
293ft稳转株细胞(tre-egfp)(由北京合生基因科技有限公司构建)具有增强型绿色荧光蛋白(egfp)基因和四环素响应性启动子元件(tre)。通过构建u6-grna(tre)-hef1a-dcas9-vpr质粒并将该质粒导入细胞中,在grna(tre)引导下靶向tre基因,并表达dcas9-vpr融合蛋白,在细胞中表达转录激活因子vpr,tre在vpr作用下激活egfp基因表达,细胞显示绿色荧光。
[0127]
本实施例采用293ft稳转株细胞(tre-egfp)进行cas9蛋白核酸适配体ssdna序列的细胞转染实验。转染前一天,将细胞接种在6孔板上,加2ml含胎牛血清(fbs)的dmem培养基,放在37℃、5%co2培养箱内生长。生长24小时后,细胞汇合度达到70%。将u6-grna(tre)-hef1a-dcas9-vpr质粒与实施例4制备的15条核酸适配体ssdna序列分别配制成“质粒+ssdna”混合物,组成样本测试组。同时,设置单独质粒阳性对照测试组和质粒+非特异性
ssdna对照测试组。对于每一个测试,在125μl的无血清opti-mem培养基中加入2.5μg的“质粒+ssdna”混合物,或单独质粒,或非特异性ssdna,并加入5μl p3000溶液(invitrogen),柔和混匀,得到溶液a。在125μl无血清培养基中加入7.5μl lipofectamin3000(invitrogen),得到溶液b。将各个溶液a分别与溶液b混合,轻柔混匀,室温放置15min,然后将混合液加入6孔板内,轻柔摇晃。将6孔板放入培养箱内,4-6h后更换培养基,48h后收集细胞。
[0128]
贴壁细胞经胰酶消化后经轻吹打收集到15ml的离心管中,用含血清dmem培养基终止消化后1000r/min离心3min弃去培养液。细胞经pbs清洗两遍,离心后使用500μl pbs重悬。用流式细胞仪(epics,xl-4,beckman)分析细胞中的egfp荧光表达量。结果在图2中显示,可见ssdna、ssdna-spacer和spacer-ssdna共15条序列都能干扰dcas9-vpr融合蛋白对egfp基因的转录激活作用。
[0129]
应该说明的是,尽管dcas9是在cas9蛋白的基础上突变得到,但只有少量碱基突变,结构上并未发生大的变化,本发明的cas9蛋白的核酸适配体是针对cas9蛋白筛选得到的,而本实施例的功能实验验证了本发明的cas9蛋白的核酸适配体对dcas9的功能具有干扰作用。
[0130]
以上应用了具体实例对本发明进行了阐述,只是用于帮助理解本发明,并不用以限制本发明。本发明所属技术领域的技术人员依据本发明的构思,还可以做出若干简单推演、变形或替换。这些推演、变形或替换方案也落入本发明的权利要求范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1