一种培养专用于生物医药功能研究的人肺癌类器官3D模型的方法与流程
本发明属于生物医药技术领域,具体涉及一种培养专用于生物医药功能研究的人肺癌类器官3d模型的方法。
背景技术:
2018globocan及中国癌症中心的数据显示,肺癌的发病率和死亡率均居全球癌症之首。中国肺癌每年新发病例约78万,因肺癌导致死亡人数约为63万。对于大部分晚期非小细胞肺癌(non-smallcelllungcancer,nsclc)患者,顺铂(cisplatin)是有效并广泛应用的一线化疗药物。尽管近几年肺癌化疗有了长足的进步,但是预后仍然不容乐观。过去25年肺癌患者化疗后的5年生存率仍未见显著提高,仅为15%。长期化疗导致的耐药性,是影响肺癌患者整体治疗效果,导致化疗失败的主要原因之一。因此,深入地开展肺癌化疗耐药机制的研究及针对性地开发新的靶向药物是我们迫切需要解决的问题,对提高肺癌患者的治疗和生存率具有重要的临床现实意义。然而从基础科研研究到临床实际治疗的转化成了开发肺癌治疗新药的主要障碍之一。传统肿瘤研究模型包括肿瘤细胞系(patient-derivedcancercelllines,pdc)及人体肿瘤组织小鼠移植模型(patient-derivedxeografts,pdx)面临的弊端日益显露,包括瘤细胞异质性和瘤细胞体内特征的丢失,肿瘤移植成功率低、肿瘤样本量大和实验周期较长在内的诸多问题。类器官技术被science杂志评选为2013年科技发展的十大突破之一,研究者们利用该技术成功建立了肿瘤类器官模型(patient-derivedorganoids,pdo)。pdo主要是利用患者肿瘤组织进行体外3-d培养用于模拟体内肿瘤组织的生物学特征,为个性化癌症治疗开辟了新的视野。2019年sejinjang等利用肺癌患者的肿瘤组织进行3-d培养,建立了肺癌类器官库。并且研究结果证明肺癌类器官作为肺癌患者药物筛选和个体化治疗的可行性,是肺癌化疗耐药机制研究及个体化靶向药物研发的理想模型。然而目前国内尚没有建立关于肺癌组织类器官培养的成熟方法,成功在体外构建肺癌组织类器官培养体系,将能够很好地模拟体内肺癌肿瘤组织的生长特点和微环境,相对2d体外细胞培养更能客观地反映体内肺癌肿瘤组织对药物的反应过程;并且相对动物模型能在短期内完成肺癌疾病模型的建立和药物筛选平台的构建,及时快速地进行药物敏感性检测与药物筛选,为肺癌患者药物研发提供理想体外模型。
nrf2信号通路是引起肺癌细胞增殖和耐药的重要信号通路,可作为提高肺癌患者对化疗药物敏感性的潜在靶点。目前大部分nrf2抑制剂都是从中草药中发现并分离出来的,然而这些nrf2天然抑制剂其潜在的细胞毒性效应并非依赖针对nrf2的特异性抑制作用,而是由于其广谱的蛋白翻译抑制特性,并且这些nrf2天然抑制剂还未得到临床应用。因此开发有效的nrf2特异性抑制剂并将其应用于临床,这是我们迫切需要探讨的问题。在最近的一项anjusingh的研究中,作者通过利用nsclc肺腺癌细胞系(a549)对mlsmr药物库中400000种临床化合物进行高通量筛选,发现ml385能通过与转录因子nrf2的dna结合域特异性结合,抑制其下游靶基因的转录与表达。然而作为nrf2特异性抑制剂,ml385能否在与化疗药联合应用时促进肺癌细胞对于化疗药物的敏感性及其具体机制,这方面的研究国内尚未见报道。
技术实现要素:
针对现有技术存在的上述问题,本发明所要解决的技术问题是提供一种培养专用于生物医药功能研究的人肺癌类器官3d模型的方法;本发明所要解决的另一技术问题是提供一种人肺癌类器官3d模型的体外培养基;本发明所要解决的最后一个技术问题是提供人肺癌类器官3d模型的在肺癌靶向药物的体外高通量筛选与抗肺癌药物敏感性评价中的应用。
为了解决上述技术问题,本发明所采用的技术方案如下:
一种培养专用于生物医药功能研究的人肺癌类器官3d模型的方法,包括以下步骤:
1)获取肺癌肿瘤组织,消化肿瘤组织,分离形成单细胞悬液;
2)细胞计数并将单细胞悬液与基质胶重悬,接种于细胞培养板,转移至培养箱,凝固基质胶;
3)加入肺癌类器官条件培养基并完全没过基质胶,培养至得到人肺癌类器官3d模型;
肺癌类器官条件培养基包括dmem/f-12基础培养基和添加因子,添加因子包括glutamax、hepes、antibiotic-antimycotic、b-27supplement、n-acetyl-l-cysteine、egf、fgf-10、fgf-4、noggin、a83-01和y-27632。
进一步的,步骤1)中,肺癌肿瘤组织为新鲜离体的肺癌肿瘤组织,消化肿瘤组织为用胶原酶和胰酶消化肿瘤组织。
进一步的,步骤1)中,获取新鲜离体的肺癌肿瘤组织,冰上剪碎并用冷pbs缓冲液冲洗,用胶原酶消化肿瘤组织1小时并继而用胰酶37℃消化肿瘤组织10分钟,形成单细胞悬液。
进一步的,步骤2)中,细胞计数并将单细胞悬液与基质胶重悬,按50μl每孔接种于细胞培养板,随后将细胞培养板转移至培养箱,37℃10-20分钟,凝固基质胶。
进一步的,步骤3)中,肺癌类器官条件培养基的培养条件为于37℃,5%co2条件下维持培养。
所述添加因子为:2mmglutamax、10mmhepes、100u/mlantibiotic-antimycotic、1xb-27supplement、1.25mmn-acetyl-l-cysteine、50ng/mlegf、100ng/mlfgf-10、100ng/mlfgf-4、100ng/mlnoggin、0.5μma83-01和10μmy-27632。
所述生物医药功能研究包括肺癌靶向药物的体外高通量筛选、抗肺癌药物敏感性评价等。
所述培养专用于生物医药功能研究的人肺癌类器官3d模型的方法获得的人肺癌类器官3d模型。
所述的人肺癌类器官3d模型在肺癌靶向药物的体外高通量筛选中的应用。
所述的人肺癌类器官3d模型在抗肺癌药物敏感性评价中的应用。
有益效果:相比于现有技术,本发明的优点为:
本申请公开了一种培养专用于生物医药功能研究的人肺癌类器官3d模型的方法,应用该方法所建立的人肺癌类器官3d模型分析ml385对肺癌细胞化疗敏感性,发现人肺癌类器官单独顺铂刺激组在顺铂浓度达到5μm时才可见明显的细胞坏死,而顺铂联合ml385组在顺铂浓度达到1μm时即可见明显的细胞坏死,促进了nrf2通路特异性抑制剂ml385对肺癌细胞的化疗敏感性。该模型可广泛应用于其他肺癌靶向药物的体外高通量筛选,相对于传统pdo及pdx模型更加准确、高效和快速。
附图说明
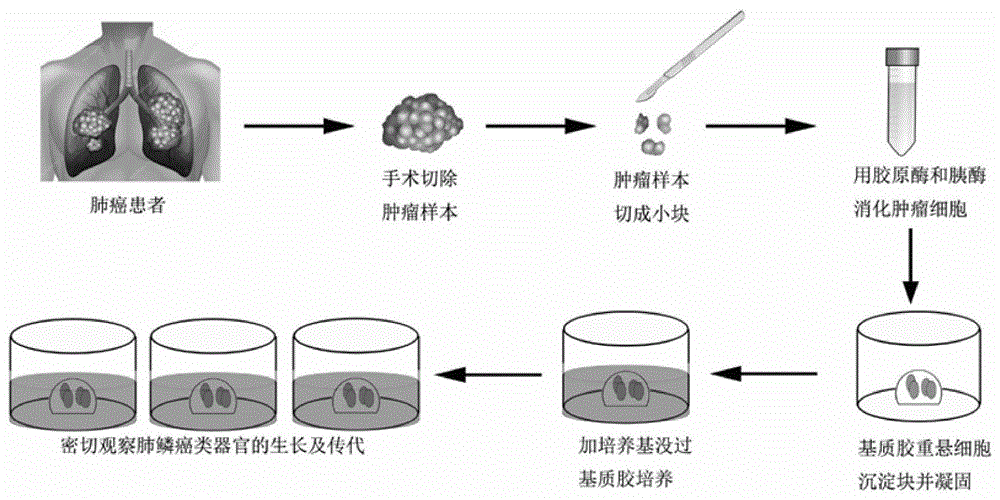
图1是收集临床肺癌患者手术切除肿瘤标本制作成体外培养的肺癌类器官的技术线路图;
图2是人肺鳞癌类器官的体外倒置显微镜显示最佳冻存期及复苏照片图;
图3是对成功建立的肺癌类器官进行体外连续培养15天,明视野倒置显微镜下观察肺癌类器官的形态图;
图4是对人肺癌患者肿瘤组织及对应类器官的he及免疫组化染色检测nsclc常用标志物图;
图5是对人肺癌患者肿瘤组织及对应类器官的nrf2通路水平的免疫组化染色鉴定图;
图6是ml385对肺癌类器官中nrf2通路的抑制作用图;
图7是对体外培养的肺癌类器官进行细胞增殖实验的主要技术线路图;
图8是ml385促进肺癌类器官对顺铂的药物敏感性图;
图9是明视野倒置显微镜下检测肺癌类器官在分别单独顺铂刺激或顺铂联合ml385刺激时,类器官的细胞形态图。
具体实施方式
下面结合具体实施例对本发明进一步进行描述。以下实施例中未作具体说明的分子生物学实验方法,均可参照《分子克隆实验指南》(第三版)j.萨姆布鲁克一书中所列的方法或本领域的常规方法进行,或者按照试剂盒和产品说明书进行。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1人肺鳞癌肿瘤细胞的分离及体外类器官的建立培养
收集临床肺癌患者手术切除的新鲜肿瘤标本,冰上剪碎为约4mm直径大小瘤组织块并用冷pbs缓冲液冲洗。瘤组织块随后用胶原酶(sigma,st.louis,mo,usa)消化1小时并继而用胰酶trypleexpress(invitrogen,carlsbad,ca,usa)37℃轻微震荡消化10分钟,形成单细胞悬液,细胞计数并将单细胞悬液与基质胶(matrigel,vwr,radnor,pa,usa)重悬,按50μl每孔(1x104)接种于24孔板以形成matrigeldome。随后将24孔板转移至培养箱,37℃环境下10-20分钟,凝固基质胶。每孔加入500μl的肺癌类器官条件培养基以完全没过matrigeldome,具体技术路线见图1,其中培养基具体成分见下表1。37℃,5%co2条件下维持培养。
表1人肺癌类器官条件培养基成分
备注:基础培养基为advanceddmem/f-12(gibco)。
实施例2人肺鳞癌类器官的传代和培养
预先将无菌24孔培养板放置37℃培养箱预热;基质胶提前1-2小时冰上融化。培养的类器官弃去培养基,加入4℃的dpbs(dulbecco′sphosphate-bufferedsaline(杜氏磷酸盐缓冲液)),将基质胶吹打成碎片,转移至15ml离心管。100xg离心5min,弃去上清,加入0.25%胰酶后吹打均匀,37℃水浴10-30min。期间用1ml枪头每个10min反复吹打,把类器官吹打成碎片。显微镜下观察细胞分离情况,当观察到大部分解离为单细胞或含3-4个细胞的细胞团块时,迅速终止消化。加入含10%fbs的培养基,转移至15ml离心管,250g离心5min(4℃)。弃去绝大多数上清,仅在管底留5-10μl离心上清。离心管冰上静置3min以使管壁上残余的液体沉至管底。然后小心地吸去多余的上清。按照每个24孔加入200μl的基质胶的量(按照1∶4的比例重新接种),重悬细胞沉淀后,再次垂直种于24孔板(50μl/孔)。24孔板先超净台室温静置1-2min,随后置于37℃细胞培养箱5-10min以使基质胶变硬,最后按照每孔加入500μl培养基,放于37℃细胞培养箱培养,隔天换液1次。
实施例3人肺鳞癌类器官的冷冻
以24孔板为例,冻存前一天移去多余的培养液,每孔加入1ml的recoverycellculture.freezingmedium(gibco)。用含有10%fbs的预冷dpbs预冷1ml枪头,按照细胞传代培养手册,收集分散细胞,轻柔地将基质胶打散为小块。将含有freezingmedium的类器官细胞悬液吸入预先标记好的2ml冷冻管中。将冷冻管置于室温平衡的冷冻皿中,并转移至-80℃过夜,第二天将冷冻管最后放入液氮罐中长期保存。
如图2所示,在正常传代日期前提前3-4天冻存肺鳞癌类器官,冻存的类器官在解冻复苏后细胞生长状态较好(图2)。
实施例4对建立的肺癌组织类器官从形态学及分子病理学方面证实其与来源的人肺癌肿瘤的一致性
经过酶解、培养及传代至少3代后,用倒置显微镜观察类器官培养形态,镜检可见细胞团样生长状况良好的样本,可判定为成功建模的类器官。图3为对成功建立的肺鳞癌类器官进行体外连续培养15天,明视野显微镜下观察肺鳞癌类器官的镜下生长状态,其中scalebar(比例尺)=400μm。用基质胶凝固液滴的方法进行培养,生长的类器官在倒置显微镜下呈团样生长,并在体外培养至15天内传代,传代按照1∶4的比例。肺鳞癌类器官的维持可以通过长期传代或冷冻保存,为实验提供稳定的细胞来源。随后需要对肺癌组织类器官进行histogel(组织凝胶)包埋及后续肺癌常用标志物的免疫组化染色。具体操作步骤如下:histogel提前65℃水浴1-2小时使其液化。培养的肺癌类器官吸掉多余培养基,用常温pbs轻柔地清洗2遍,4%的室温多聚甲醛固定2小时。等待固定过程中将冷冻包埋模具冰上预冷,取150μl已经液化的histogel铺于包埋模具的底部并继续放置于冰上冷冻凝固。将固定好的类器官组织中的多聚甲醛吸掉。用ddh2o小心清洗3遍。随后用手术刀将类器官组织连同基质胶轻刮下来置于包埋模具中已凝固的histogel胶面上,随后在其上方继续加入150μlhistogel冰上10-15分钟以待其凝固形成三明治结构。将凝固好的histogel组织块用手术刀从冷冻包埋模型中切下来转移至组织包埋盒中。组织包埋盒置于10%的福尔马林固定16-20小时,70%乙醇脱水1-2天后进行常规石蜡包埋及后续he及免疫组化染色。
he染色及免疫组化染色方面,类器官切片的处理方式与其他组织切片一样,使用一般脱蜡,补液,抗原修复等的常规步骤。免疫组化检测nsclc常用的标志物,包括肺鳞癌最常用的标记物p63,及肺腺癌最常用的免疫标志物ttf-1。人肺癌患者肿瘤组织及对应类器官的he及免疫组化染色见图4。其中人肺癌患者肿瘤组织组scalebar=200μm;类器官组织组scalebar=100μm。he染色镜下可见细胞核浆比增高,细胞核具有明显的异型性,符合恶性肿瘤细胞的形态特征。细胞成团分布,与其来源原肿瘤组织学鳞癌的癌巢结构特征相似。免疫组化镜检结果如图4所示,p63和ttf-1为胞核定位。并且染色结果显示:p63阳性,ttf-1阴性。免疫组化染色结果符合原起源肿瘤组织肺鳞癌的分子病理学特征。
同时在后续使用nrf2通路抑制剂ml385刺激肺癌类器官之前,免疫组化染色检测人肺癌肿瘤组织及类器官组织内自身nrf2及其靶基因nqo1的蛋白表达水平。结果如图5所示,nrf2为核定位,nqo1为胞浆定位;无论人肺癌肿瘤组织还是其对应的类器官组织,nrf2通路的基础活化水平均较高,nrf2及nqo1蛋白免疫组化染色强度及染色阳性率均较高,提示在此基础上应用nrf2通路抑制剂ml385可能达到很好的抑制效应。其中人肺癌患者肿瘤组织组scalebar=200μm;类器官组织组scalebar=100μm。
实施例5以体外培养肺癌类器官为研究模型,western检测分析ml385刺激前后对nrf2及其下游靶基因蛋白nqo1表达水平
采用5um浓度的ml385持续刺激体外培养的肺癌类器官48小时后,westernblot分别检测nrf2通路重要分子nrf2、nqo1的蛋白水平,以此明确在肺癌类器官中,ml385对nrf2通路的抑制作用。结果如图6所示,在肺癌类器官中,ml385的刺激使nrf2信号通路明显受到抑制。
实施例6以体外培养肺癌类器官为研究模型,分析ml385对肺癌细胞化疗敏感性这一重要生物学行为的影响
celltiter细胞增殖实验分析单独顺铂或顺铂联合ml385刺激细胞前后对瘤细胞的细胞活力差异。具体做法如下:将体外培养的肺癌类器官消化为单细胞。在消化为单细胞后与matrigel混匀并接种至384孔中形成matrigeldome。随后将384孔板转移至培养箱,37℃环境下10-20分钟,凝固matrigel,随后加入特定的肺癌类器官培养基继续培养,该部分技术线路图具体见图7。首先为了明确ml385促顺铂敏感性作用不是由于其自身药物毒性所致,我们以dmso或不同浓度(0-20μm)的ml385刺激细胞96小时后,比较细胞活力。结果如图8(a)显示,在ml385浓度8μm以下时,其对细胞活力的影响与对照组dmso无统计差异。随后我们对肺癌类器官单独给予不同浓度梯度的顺铂(0.01μm-10μm)刺激,或与5μm的ml385协同刺激培养96小时,celltiter细胞增殖实验分析比较两组之间细胞活力的差异。结果如图8(b)显示,与单独顺铂刺激相比,联合5μmml385共刺激后使细胞对顺铂敏感性提高,ic50从4.727μm降至1.047μm。并且明视野显微镜下可见(图9)类器官单独顺铂刺激组在顺铂浓度达到5μm时才可见明显的细胞坏死,而顺铂联合ml385组在顺铂浓度达到1μm时即可见明显的细胞坏死。scalebar=1000μm。
- 还没有人留言评论。精彩留言会获得点赞!