一种从中药中筛选药物活性化合物的方法及作用剂与流程
本发明涉及中药领域,特别涉及一种从中药中筛选药物活性化合物的方法及作用剂。
背景技术:
新冠肺炎(covid-19)已经成为全球性的重大疫情,对人们的精神和身体健康带来威胁,也对各国的经济、教育和医疗造成了非常重大的影响。它具有强传染性和发病率高的特点,主要临床症状表现为发烧、咳嗽和呼吸困难。
人们普遍认为新冠肺炎患者病情的快速恶化与细胞因子风暴密切相关。在大多数严重感染的患者体内,淋巴细胞会减少,而促炎细胞因子如il-6和tnf-α水平显著增加。由于过度的免疫反应,细胞因子风暴可导致组织损伤,甚至多器官衰竭。在99例早期病例中,有17例患者因细胞因子风暴导致病情恶化,其中11例患者最后死亡。当前研究表明,il-6信号通路和tnf-α信号通路可能是引起细胞因子风暴的最重要的两条信号通路,阻断il-6和tnf-α通路或许是抑制细胞因子风暴的有效方式。但如何有效控制新冠肺炎相关的细胞因子风暴还没有很好的就解决方案。
中医药的应用为抗击疫情做出重大贡献。据国家中医药管理局报告,中国有90%以上的新冠肺炎患者接受过中药治疗,有效率超过90%。在中药尽早干预的地区,病人死亡率相对较低。尽管中药在治疗新冠肺炎中疗效显著,但中药对细胞因子风暴的抑制作用及其作用机理仍不清晰。
现有技术是通过酶联免疫吸附反应、聚合酶链式反应、蛋白质印迹法、微阵列芯片等方式去检测单个或数个中药对相关细胞因子的抑制作用。现有通量小、效率低,一次只能检测数个中药的药效作用;工作量大,耗时长,需要进行多种实验进行评估;成本高,需要做大量重复实验,实验材料耗费多;受试样品需要量大;样本间差异大。另外,微阵列芯片存在着定制困难,一张芯片只可以测少量样品,成本较高等缺点,不适合高通量检测特征基因表达谱。
技术实现要素:
目前没有从大规模实验水平上研究中药对细胞因子风暴相关信号通路的影响,部分原因在于没有合适的高通量药物筛选平台。通过细胞实验和动物实验进行药物筛选,可以很好地检测药物对相关细胞因子水平的药效作用,但都不适合大规模药物初筛。在新冠肺炎病情恶化过程中,细胞因子风暴涉及体内多条信号通路的传递,每条信号通路又涉及多个基因的表达情况,抑制最主要信号通路的基因表达或许能起到决定性的作用。如果有单个化合物,或通过联合用药,可以抑制细胞因子风暴最相关通路的关键基因表达,此化合物极有可能具有抑制新冠肺炎相关细胞因子风暴的活性。
随着高通量生物技术的快速发展,微阵列芯片和二代测序技术都可以方便地检测药物处理后的基因表达谱的变化,但微阵列芯片存在定制困难、成本较高等缺点,不适合高通量检测特征基因表达谱。二代测序可以将index不同的样本文库根据测序深度要求,合并在一起测序,大大提高了通量。因此,以细胞因子风暴关键信号通路基因表达谱的基因为检测对象,通过基于高通量测序的高通量筛选技术进行中药活性成分筛选,对抗新冠肺炎相关细胞因子风暴的药物筛选提供了新的研究思路。
在一种实施方式中,本发明提供一种从中药中筛选药物活性化合物的方法,所述方法包括以下步骤:步骤1:确定与疾病相关的关键信号通路,将不同中药提取物作用于与疾病相关的细胞系,并且基于特征基因表达谱定量分析细胞中转录谱的变化情况,从而确定不同中药提取物对所述关键信号通路的调节作用,挑选出对于疾病相关的关键信号通路有作用的中药;步骤2:从不同中药数据库中收集中药的成分化合物,并从中筛选出潜在的活性化合物,优选地根据口服生物利用度和/或药物相似度从中筛选出潜在的活性化合物;步骤3:筛选出所述关键信号通路中可以作为药物作用的药物靶标;和,步骤4:利用步骤3中的所述药物靶标进一步筛选步骤2中的潜在活性化合物,得到药物活性化合物。
在一种实施方式中,所述步骤1包括以下步骤:步骤1.1:选定合适的细胞作为中药活性化合物筛选的细胞,并进行培养;步骤1.2:从不同中药中制备不同中药的提取物;步骤1.3:收集所述关键信号通路的基因表达谱,并选择靶基因作为探针;步骤1.4:通过mrna富集、探针连接产物的洗脱和线性扩增,以及二代测序,得到每种中药干预下对应靶基因的mrna水平;和,步骤1.5.通过对每种中药干预下对应靶基因的mrna水平的数据分析,确定每种中药提取物对于所述关键信号通路的基因的表达变化情况的影响,从而确定对于所述关键信号通路有作用的中药。
在一种实施方式中,在步骤1.5中通过基因集富集分析方法评估每种中药提取物对于所述关键信号通路的基因的表达变化情况的影响。
在一种实施方式中,步骤2中的中药数据库是中药系统药理学数据库与分析平台、中药综合数据库和/或中国科学院上海有机化学研究所化学数据库。
在一种实施方式中,步骤3中通过string数据库将参与所述关键信号通道通路的所有基因分别构建ppi网络,然后对所述网络进行拓扑分析,以度中心性、接近中心性和中介中心性三种算法为参数来对药物靶标进行筛选,得到可以作为药物作用的药物靶标。
在一种实施方式中,步骤4中将所述潜在活性化合物与作为药物作用的药物靶标进行分子对接,根据glidegscore值进行排序,得到药物活性化合物。
在一种实施方式中,步骤4中还包括将所述潜在活性化合物与作为药物作用的药物靶标分子的分子对接结果进行分子动力学模拟分析,确定两者结合情况。
在一种实施方式中,所述疾病是细胞因子风暴疾病,优选地为与covid-19相关的细胞因子风暴。
在一种实施方式中,所述关键信号通路选为il-6和/或tnf-α信号通路。
在一种实施方式中,对il-6信号通道有抑制作用的中药是木芙蓉叶、野菊花、鹅不食草、雄黄、银柴胡、桂枝、金沸草、皂角刺、旋覆花、大蓟碳、三颗针、杜仲、莲房、硫磺、荆芥炭或谷精草;和/或对tnf-α信号通道有抑制作用的中药是委陵菜、禹州漏芦、西洋参、茵陈、白及、制首乌、白扁豆、金果榄、使君子、骨碎补、山香圆叶、防己、皂角刺、关黄柏、西红花、九里香、延胡索、水牛角、鹿角、白术、马鞭草、藁本、党参、亚麻子、泽泻、大腹皮、红粉、车前子、香附、荷叶、制天南星、明党参、硫磺、夏天无、荆芥穗炭、天花粉或川射干。
在一种实施方式中,所述il-6信号通路的药物靶标为stat3,所述tnf-α信号通路的药物靶标为tnf-α。
在一种实施方式中,本发明提供一种治疗细胞因子风暴的作用剂,其包括以下化合物或其药学上可接受的盐一种或多种:六羟黄酮,花青素-3-芸香糖甙-5-葡萄糖苷,(+)-表儿茶素,京尼平苷酸,草木樨苷,银柴胡胺b,木犀草素,假荆芥属苷,花旗松素,东莨菪甙;4-(3-苯基丙烯酰氧基甲基)-6,7-二甲氧基香豆素,灰绿曲霉酰胺,4,7-二羟基-1-对-羟苄基-2-甲氧基-9,10-二氢菲,3-(对-羟苄基)-4-甲氧基-9,10-二氢菲,黄柏双糖甙元,双氢轮叶十齿草碱,黑龙江罂粟素,壬酸,好望角芦荟内脂,5-(3-羟基-4-异乙酰氧基丁炔-1)-联噻吩。
上述化合物可以从无机或有机酸所衍生的盐型式使用。取决于特别的化合物而定,化合物的盐可由于一或多个盐的物理性质而有利,诸如增进在不同温度及湿度中的医药稳定性,或在水或油中的所欲溶解性。在一些实例中,化合物的盐亦可用做为化合物隔离、纯化和/或解析的辅助剂。
当可能时,本发明化合物的适合的药学上可接受的盐的酸加成盐包括那些从无机酸,诸如氢氯酸、氢溴酸、氢氟酸、硼酸、氟硼酸、磷酸、偏磷酸、硝酸、碳酸、磺酸及硫酸,以及从有机酸,诸如乙酸、苯磺酸、苯甲酸、柠檬酸、乙烷磺酸、富马酸、葡萄糖酸、甘醇酸、羟基乙磺酸、乳酸、乳糖酸、马来酸、苹果酸、甲烷磺酸、三氟甲烷磺酸、琥珀酸、甲苯磺酸、酒石酸及三氟乙酸所衍生的盐。适合的有机酸通常包含(但不限于此)脂族、环脂族、芳香族、芳脂族、杂环状、羧羧及磺酸类别的有机酸。
适合的药学上可接受的盐的特殊实例包括(但不限于此)乙酸盐、三氟乙酸盐、甲酸盐、丙酸盐、琥珀酸盐、甘醇酸盐、葡萄糖酸盐、二葡萄糖酸盐、乳酸盐、苹果酸盐、酒石酸、柠檬酸盐、抗坏血酸盐、葡糖醛酸盐、马来酸盐、富马酸盐、丙酮酸盐、天门冬胺酸盐、麸胺酸盐、苯甲酸盐、邻胺酸苯甲酸、硬脂酸盐、水杨酸盐、对-羟基苯甲酸盐、苯基乙酸盐、杏仁酸盐、恩波酸盐(embonate)(双羟萘酸盐)、甲烷磺酸盐、乙烷磺酸盐、苯磺酸盐、泛酸盐、甲苯磺酸盐、2-羟基乙烷磺酸盐、磺胺酸盐、环己胺基磺酸盐、海藻酸、β-羟基丁酸、半乳糖二酸盐、半乳糖醛酸盐、己二酸盐、海藻酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、环戊烷丙酸盐、十二烷基硫酸盐、葡糖庚酸盐、甘油磷酸盐、庚酸盐、己酸盐、烟碱酸盐、2-萘磺酸盐、草酸盐、棕榈酸盐、果胶酸盐、3-苯基丙酸盐、苦味酸盐、特戊酸盐、硫代氰酸盐及十一烷酸盐。
此外,在本发明化合物携带酸性部份时,其适合的可医药用的盐可包括碱金属盐,亦即钠或钾盐;碱土金属盐,例如钙或镁盐;及与适合的有机配位体所形成的盐,例如季铵盐。在另一实施方式,碱盐系从形成无毒性盐的碱所形成,包括铝、精胺酸、苄星(benzathine)、胆碱、二乙胺、二醇胺、甘胺酸、离胺酸、甲基葡胺(meglumine)、乙醇胺(olamine)、胺丁三醇及锌盐。
有机盐可从仲、叔或季胺盐制得,诸如胺丁三醇、二乙胺、n,n’-二苯甲基乙二胺、氯普鲁卡因(chloroprocaine)、胆碱、二乙醇胺、乙二胺、甲基葡胺(n-甲基葡糖胺)及普鲁卡因。碱性含氮基团可以如下的剂四级化,诸如低碳烷基(c1-c6)卤化物(例如,甲基、乙基、丙基及丁基氯化物、溴化物及碘化物)、硫酸二烷酯(亦即硫酸二甲酯、二乙酯、二丁酯及二戊酯)、长链卤化物(亦即癸基、月桂基、肉荳蔻基及硬脂基氯化物、溴化物及碘化物)、芳烷基卤化物(亦即苯甲基及苯乙基溴化物)及其他等。
在一个实施方式中,亦可形成酸及碱的半盐,例如半硫酸盐及半钙盐。
本发明是高通量药物筛选平台和二代测序技术,以及分子对接和分子动力学模拟相结合,在转录水平上大规模筛选药物或者小分子化合物的方法,筛选效率高,为药物筛选方面提供了新的思路。另外,本技术方案得到的活性化合物对细胞因子风暴具有潜在的抑制作用,有可能为抗新冠肺炎药物的研发提供宝贵的资源。
附图说明
为了更清楚地说明本申请实施例中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本申请中记载的一些实施例,对于本领域普通技术人员来说,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
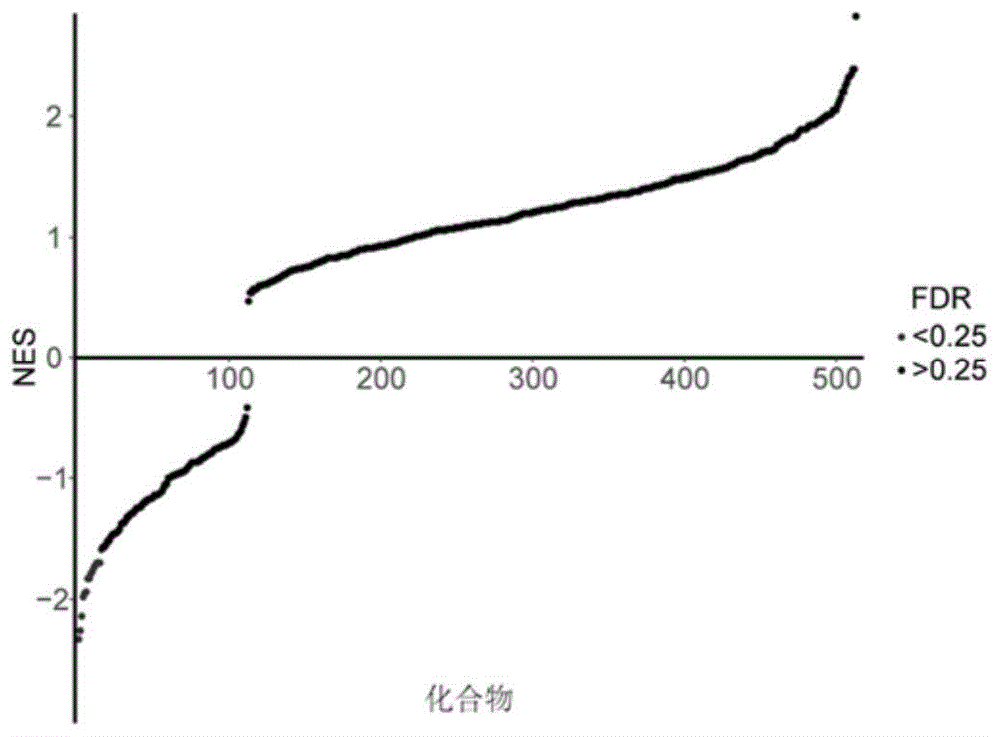
图1为根据标准化的富集分数,基因集富集分析(gsea)将513种中药进行打分排序,显著抑制il-6通路的中药有16种,以红点标出;
图2为16种中药影响il-6通路中基因表达的热图;
图3为影响il-6通路的16种中药的相关性热图;
图4为根据标准化的富集分数,基因集富集分析(gsea)将513种中药进行打分排序,显著抑制tnf-α通路的中药有37种,以红点标出;
图5为37种中药影响tnf-α通路中的基因表达的热图;
图6为影响tnf-α通路的37种中药的相关性热图;
图7为基于il-6信号通路基因构建的ppi网络图;
图8为基于tnf-α通路基因构建的ppi网络图;
图9为分子动力学模拟中,最佳活性化合物与stat3和tnf-ɑ对接过程中rmsd值的时间演变图;
图10为分子动力学模拟中,最佳活性化合物与stat3和tnf-ɑ对接过程中rmsf值的时间演变图;
图11为六羟黄酮和stat3靶点口袋对接的三维结构和正交视图;
图12为4-(3-苯基丙烯酰氧基甲基)-6,7-二甲氧基香豆素与tnf靶点口袋对接的三维结构和正交视图。
具体实施方式
为了使本领域技术领域人员更好地理解本申请中的技术方案,下面将结合下面结合实施例对本发明作进一步说明,显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。基于本申请中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都应当属于本申请保护的范围。
一、基于高通量测序的高通量筛选
基于特征基因表达谱的高通量筛选平台可以大规模定量分析细胞中转录谱的变化情况。我们检测了513种中药提取物对免疫细胞thp1中细胞因子风暴关键信号通路的调节作用。这513种中药囊括了中国药典中收录的大部分中药。关键信号通路选为il-6和tnf-α通路,分别包含70和71个基因,具体信息见表1。
表1.il-6和tnf-α通路基因详细信息
通过大规模的中药筛选,我们期望找到能够有效抑制细胞因子风暴的中药。具体操作步骤如下:
1.细胞培养
本实验中选用的人急性单核细胞白血病细胞thp1细胞作为中药活性化合物筛选的细胞。该细胞以含有10%胎牛血清和100u/ml双抗的rpmi-1640培养基进行培养,培养箱co2浓度设为5%、温度设为37℃。铺板时以100ng/mlpma诱导贴壁。
2.中药提取物的制备
将513种中药制成粉末,在索氏提取器中用90%乙醇溶剂提取。然后将提取液浓缩,并放置在45℃的干燥箱干燥成浸膏。称取一定量的提取物,以dmso溶解稀释至固定浓度,保存在-80℃冰箱备用。
3.探针设计
从数据库中收集il-6和tnf-α信号通路的基因表达谱,并选择相关基因作为探针。在探针设计时,针对所选基因的相邻两两外显子的结合点序列设计探针,其优势是可以有效避免基因组的污染。为每个基因设计了三对探针,通过预实验进行测试,选出可以反映基因表达量且读值稳定的探针,保证每个基因有一对最佳探针。
4.高通量检测
将培养至对数生长期的thp1细胞,消化后以每孔4000个细胞的密度接种到384孔板中。贴壁培养48h后,用513种中药提取物或dmso对照对细胞进行干预,化合物浓度为100μg/ml,dmso浓度为0.5%。24h后,加入细胞裂解液进行裂解10分钟,细胞中的rna释放到裂解液中。使用自动化平台加入包含基因探针、生物素标记的oligo-dt(20nt)、链霉亲和磁珠的结合缓冲液,65℃条件下孵育5min使rna结构舒展,再45℃孵育1h,探针通过碱基互配原理退火结合到靶基因的mrna上。通过mrna富集、探针连接产物的洗脱和线性扩增,以及二代测序,得到每种药物干预下对应靶基因的mrna水平。
5.数据处理
测序数据为各基因探针的条数,因为引物探针与mrna为1:1互补配对,探针可以很好地反映基因的mrna水平。首先将所有reads定位到探针序列,该序列允许三个碱基对错配,并根据5个管家基因的表达进行标准化。其次,为了评估转录谱的可靠性和可重复性,dmso组进行了16次重复,513种中药提取物组进行了3次重复。实验数据之间计算pearson相关系数,相关系数>0.9表示分析结果可靠且可重复。最后,通过r包deseq2计算基因表达的倍数变化(fc)和p值,将计算结果符合|fc|>2和p值<0.05的基因被视为差异表达基因,其中fc值大于0表示基因mrna水平被上调,fc值小于0表示基因mrna水平被下调。
二、中药评分
基于高通量测序的高通量筛选部分所获得的513种中药提取物在thp1细胞系上对于il-6和tnf-α信号通路相关的131个基因的表达变化表。对于这个表格,我们采用了基因集富集分析(gsea)方法,该方法可以评估了513种中药提取物分别对于il-6和tnf-α信号通路的整体影响情况。gsea的具体步骤是通过基因倍数变化值从高到低对il-6和tnf-α信号通路基因进行排序,将其标准化后获得标准化富集得分(nes),nes值为负值,代表药物对于整条通路产生抑制作用。然后通过计算fdr进行筛选评估,其值小于0.25表示具有统计学显著性。
结果1:图1显示基于gsea结果共有16种中药显著抑制il-6通路。这16种中药包括木芙蓉叶、野菊花、鹅不食草、雄黄、银柴胡、桂枝、金沸草、皂角刺、旋覆花、大蓟碳、三颗针、杜仲、莲房、硫磺、荆芥炭、谷精草,其详细信息见表2。将这些基因表达数据绘制成热图,其结果见图2,在热图中有一半基因表达下调,表明这16种中药对il-6信号通路中大多数基因具有抑制作用。此外,我们还探索了这16种中药之间的作用相关性,见图3,可以发现这些中药在抑制il-6通路上具有相似的作用模式。
表2.抑制il-6信号通路的16种中药的详细信息
结果2:图4显示基于gsea结果共有37种中药显著抑制tnf-α通路。这37种中药包括委陵菜、禹州漏芦、西洋参、茵陈、白及、制首乌、白扁豆、金果榄、使君子、骨碎补、山香圆叶、防己、皂角刺、关黄柏、西红花、九里香、延胡索、水牛角、鹿角、白术、马鞭草、藁本、党参、亚麻子、泽泻、大腹皮、红粉、车前子、香附、荷叶、制天南星、明党参、硫磺、夏天无、荆芥穗炭、天花粉、川射干,其详细信息见表3。将这些基因表达数据绘制热图,其结果见图5,在热图中几乎所有基因被下调,表明这37种中药对tnf-α通路相关基因具有明显的抑制作用。此外,我们还探索了这37种中药的相关热图,见图6,发现这些药物抑制tnf-α通路的作用模式并不相同。
表3.抑制tnf-α通路的37种中药详细信息表
三.活性化合物筛选与潜在药物发现
1.中药中活性成分的筛选和收集
通过中药评分部分的分析发现,其中有16种中药对于il-6信号通路具有显著抑制作用,此外有37种中药对于tnf-α信号通路具有显著抑制作用。为了深入研究这些中药中哪些有效成分发挥了对于这两条信号通路的抑制效果,我们首先通过以下三个数据库进行收集这些中药的全部化学成分,具体如下:中药系统药理学数据库与分析平台(tcmsp,https://tcmspw.com/tcmsp.php),中药综合数据库(tcmid,http://119.3.41.228:8000/tcmid/)和中国科学院上海有机化学研究所化学数据库(csdb,http://www.organchem.csdb.cn/)。然后又通过口服生物利用度(ob)和药物相似度(dl)对全部化学成分进行筛选,将符合ob≥30%且dl≥0.18的化合物视为潜在活性化合物。所有潜在活性化合物的化学结构均从pubchem(https://pubchem.ncbi.nlm.nih.gov/)下载。
2.蛋白质-蛋白质相互作用(ppi)网络的构建和关键靶标的筛选
在找到潜在活性化合物的基础上,我们需要进一步筛选il-6和tnf-α信号通路中哪些靶标可以作为主要的药物靶标。我们通过string数据库(https://string-db.org/)将参与这两条通路的所有基因分别用来构建ppi网络,见图7和图8。使用cytoscape软件中包含的网络分析器插件对这两个网络进行拓扑分析,以度中心性、接近中心性和中介中心性三种算法为主要参数来对关键靶标进行筛选。
3.分子对接
在有了明确的关键靶标之后,我们则可以对于潜在活性化合物进行进一步的研究,分析哪些化合物具有潜在的对于这两条信号通路的抑制作用。分子对接技术可以用来分析多种化合物与关键靶标的结合能力。其中关键靶标蛋白的晶体结构是从rcsb蛋白质数据库(rcsbpdb,https://www.rcsb.org/)获得,选择具有最佳分辨率的结构。利用proteinpreparation模块(
4.分子动力学模拟
为了进一步优化分子对接结果,采用amber18软件包对蛋白-小分子复合物进行分子动力学模拟。蛋白使用ff14sb力场参数,小分子配体则使用gaff通用力场参数,并使用antechamber模块计算其am1-bcc原子电荷。将蛋白-小分子复合物载入tleap模块,自动添加氢原子和拮抗离子以中和电荷。选择tip3p显性水模型,设置周期性边界条件。分子动力学模拟工作流程共包括能量最小化、加热、平衡、生产动力学模拟等4步。首先,约束蛋白(和小分子)重原子,对水分子进行10000步能量最小化;随后,在50ps时间内,将体系缓慢加热至300k;加热完成后,在npt系综下对体系进行50ps的平衡。最后,将体系在npt系综下进行50ns的分子动力学模拟。每隔10ps保存一次轨迹数据,并用cpptraj模块进行相关分析。配体和蛋白的结合自由能计算则采用mmpbsa.py模块进行。
结果1:将il-6信号通路中70个相关基因构建ppi网络,见图7。结合拓扑分析结果,我们得到了top10关键靶标,见表4。尽管il-6在所有三种中心性算法中均排名第一,但目前针对il-6的药物都是单克隆抗体,无法作为小分子药物的靶标。因此,我们选择在三种中心性算法中排名均靠前的stat3作为il-6通路的关键靶标。
表4.il-6通路ppi网络的拓扑分析结果
将tnf-α信号通路中71个相关基因构建ppi网络,如图8。结合拓扑分析结果,我们得到了top10关键靶标,见表5。tnf-α在所有三种中心性算法中均排名靠前,被选为tnf-α通路的关键靶标。
表5.tnf-α通路ppi网络的拓扑分析结果
结果2:在数据库收集过程中有5种药物没有找到化合物信息,因此在抑制il-6信号通路的16种中药中的14种中共获得685种潜在活性化合物,而在抑制tnf-α信号通路的37种中药中的34种中共收集了2608种潜在活性化合物。通过删除重复值,抑制il-6和tnf-α信号通路的中药中,分别具有582种和2099种潜在活性化合物。
结果3:分子对接是化合物虚拟筛选的一种有效方法。我们将收集到的所有的小分子化合物分别与stat3和tnf-α进行分子对接,根据glidegscore值进行排序,分别得到top10的小分子化合物,见表6。glidegscore值越低,代表结合越稳定。由结果可以发现,与stat3结合最好的化合物是六羟黄酮,glidegscore值为-6.095。与tnf-α结合最稳定的化合物是4-(3-苯基丙烯酰氧基甲基)-6,7-二甲氧基香豆素,glidegscore值为-10.427。
表6与stat3和tnf-α稳定结合的top10活性化合物
结果4:为了进一步探究对接结果最好的这两个活性化合物与其相应靶点的结合情况,我们进行了分子动力学模拟分析。均方根偏差rmsd变化曲线表示蛋白构象的整体波动情况。图9显示stat3与六羟黄酮动力学过程中的rmsd曲线在初始阶段波动较大,随着模拟的进行,在30ns后趋于平稳,最终稳定在
图11展示了六羟黄酮与stat3的对接结构图。可以发现stat3与配体互作的结合位点残基含亲水残基和疏水残基,表明该结合口袋具有两亲性。亲水残基主要是glu499和asp535等,疏水残基则包括ile533和val545等。配体羟基可以与ala536骨架n,met534骨架o,以及pro543骨架氧形成氢键作用,对于稳定其结合亦至关重要。此外,图12显示tnf-α与配体相互作用的结合位点残基主要是疏水残基,包括tyr151、leu120、tyr59、tyr119、tyr59、leu57、tyr59、val123等,可以与配体形成极强的疏水堆积和范德华势能,极大地稳定了配体的结合。配体氧也可以与tyr119侧链羟基、tyr151侧链羟基形成氢键作用,亦有利于其稳定结合。
结合自由能结果见表7,可以看出stat3与六羟黄酮结合自由能为-12.14kcal/mol,其主要贡献来源于范德华势能(-15.75kcal/mol)和静电作用(-44.26kcal/mol),而极性溶剂化作用则不利于二者结合。另外,tnf和4-(3-苯基丙烯酰氧基甲基)-6,7-二甲氧基香豆素具有较高水平的结合,二者结合自由能为-42.06kcal/mol,其主要贡献来源于范德华势能(-53.84kcal/mol)和静电作用(-10.34kcal/mol),极性溶剂化作用同样不利于二者结合。以上结果均表明stat3与六羟黄酮以及tnf和4-(3-苯基丙烯酰氧基甲基)-6,7-二甲氧基香豆素均能较好的相互结合。
表7通过mm-gbsa方法计算化合物与蛋白质的结合亲和力(δg:kcal/mol)
δeele代表静电能的贡献,δevdw代表范德华力相互作用的贡献,δgpol代表极性溶剂相互作用能的贡献,δgnonpol代表非极性溶剂相互作用能的贡献,δgmm/gbsa代表结合自由能的贡献,δgmm/gbsa=δevdw+δeele+δgpol+δgnonpol。
应该理解到披露的本发明不仅仅限于描述的特定的方法、方案和物质,因为这些均可变化。还应理解这里所用的术语仅仅是为了描述特定的实施方式方案的目的,而不是意欲限制本发明的范围,本发明的范围仅受限于所附的权利要求。
本领域的技术人员还将认识到,或者能够确认使用不超过常规实验,在本文中所述的本发明的具体的实施方案的许多等价物。这些等价物也包含在所附的权利要求中。
- 还没有人留言评论。精彩留言会获得点赞!