一株高产2-苯乙醇酵母菌的筛选及其应用的制作方法
本发明涉及一株高产2-苯乙醇酵母菌的筛选及其应用,属于发酵工程技术领域。
背景技术:
2-苯乙醇(2-pe)是一种具有玫瑰香味的高级芳香醇,由于这个特点,使得2-苯乙醇成为香水、化妆品和食品工业中最常用的芳香化合物之一,作为最终产品的感官增强剂。然而2-pe还显示出其他有趣的特性,如它的抗真菌和抗菌性能,使这种化合物在消毒剂、害虫控制、清洁和个人护理产品中成为受欢迎的添加剂。此外2-pe可以很容易地酯化生成一种重要的风味物质,2-苯乙酸乙酯,它也有花香和玫瑰般的气味,用途与2-pe类似。目前,2-pe的生产方法主要有化学合成、植物提取。
大多2-pe是由化学法合成而来,主要通过苯或苯乙烯的化学合成获得。然而化学合成法通常对环境不利,并且产生副产物,从而降低效率和下游成本。并且化学合成的2-pe在许多行业是禁止使用的,尤其是食品行业中。天然2-pe是消费者首选。它存在于许多花卉和植物精油中,如风信子、茉莉、玫瑰和百合,尤其是玫瑰。而从花卉中提取的天然2-pe价格昂贵,由于原材料稀缺,提取效率低、过程复杂,成本较高,无法满足市场需求。因此2-pe的生物合成受到广泛关注。
细菌、丝状真菌和酵母等各种微生物都具有合成2-pe的能力。在已报道的2-pe生产菌中,有saccharomycescerevisiae,kluyveromycesmarxianus和yarrowialipolytica是合成2-pe效率较高的菌。在酵母中,存在两条2-pe生物合成途径:莽草酸途径和埃利希途径。莽草酸盐途径是一种具有多分支和多种反馈抑制的长生物合成途径,以这种方式生产2-pe非常低,一般只能生产400-500mg/l。当l-苯丙氨酸作为唯一氮源时,2-pe可通过埃里希途径进行合成。zhaoyuewang等(regulationofcrucialenzymesandtranscriptionfactorson2-phenylethanolbiosynthesisviaehrlichpathwayinsaccharomycescerevisiae.2017)通过对s.cerevisiae的埃里希途径中的关键酶和转录因子来调控2-pe生物合成,产量达3.73g/l。通过培养优化,使k.marxianus的2-pe产量从0.39提高到0.5g/l。yanggu等(refactoringehrlichpathwayforhigh-yield2-phenylethanolproductioninyarrowialipolytica.2020)在y.lipolytica中通过阻断预处理竞争途径和减缓脂肪酸合成,2-pe产量为2669.54mg/l。jinbinliu等(mimickinganew2-phenylethanolproductionpathwayfromproteusmirabilisjn458inescherichiacoli.2018)从proteusmirabilisjn458中获得一条产2-pe的新途径,通过在重组e.colie-paeakag中,以10g/l的l-苯丙氨酸为底物,经过16h的转化,获得3.21±0.10g/l的2-pe。虽然生物合成2-pe得到人们的重视,但2-pe对大多微生物有一定的毒性,由此限制了2-pe的产量。为了降低毒性,将原位产物回收(ispr)应用于2-pe生产,并将2-pe的产量提高了。但利用有机相进行提取,被证明是不经济的。因此,发展2-pe生物技术生产的第一个具有挑战性的目标是鉴定高产菌株,筛选一株野生菌且高产2-pe将是一种更经济可行的方法。
根据文献报道,2-苯乙醇在微生物中代谢途径主要有三种:莽草酸/苯丙酮酸途径、埃里希途径和苯乙胺途径。
1、埃里希途径(ehrlichpathway)
在这三个途径中,最重要的是埃里希途径,在氮不足情况下,l-苯丙氨酸(l-苯丙氨酸)通过三个酶促步骤转化为2-pe。l-苯丙氨酸首先被转氨酶(aro8,aro9,bat1/twt1和bat2/twt2)氨基化为丙酮酸,然后被苯基丙酮酸脱羧酶(ydr380w/aro10,ydl080c/thi3,pdc1,pdc5,和pdc6),最后通过醇脱氢酶(adh1,adh2,adh3,adh4和adh5)或甲醛脱氢酶(sfa1)还原为2-pe。
2、莽草酸/苯丙酮酸途径(shikimatepathway/phenylpyruvatepathway)
莽草酸/苯丙酮酸途径将碳水化合物代谢与芳香族化合物合成联系起来,包括三种芳香族氨基酸(苯丙氨酸、酪氨酸和色氨酸)和其他芳香族次生代谢物,直接从葡萄糖生成2-pe。据文献报道,a.oryzae、k.marxianus和s.cerevisiae表现出从葡萄糖中生产2-pe的能力,但由于复杂的生物合成途径、多分支和多种反馈抑制,产量很低。在最佳生长条件下,芳香氨基酸的胞内浓度足以使对phe和tyr敏感的同工酶大量失活。因此,寻找具有增加l-苯丙氨酸或苯基丙酮酸盐的更健壮的菌株是提高莽草酸盐生产2-pe途径效率的关键。
3、苯乙胺途径(phenylethylaminepathway)
苯乙胺途径与埃里希途径平行,在植物中起着更重要的作用,如西红柿。这条途径首先在酿酒酵母(s.cerevisiae)和米曲霉(a.oryzae)中发现。在这个过程中,l-苯丙氨酸首先脱羧为苯乙胺,然后氧化脱氨为苯乙醛,最后还原为2-pe。在矮牵牛和玫瑰花瓣中已发现了该途径的替代方法,其中的l-苯丙氨酸可以通过苯乙醛合酶(phenylacetaldehydesynthase,paas)一步转化为l-苯乙醛,然后进一步合成2-pe。
在这三种途径中,大多利用埃里希途径,即以苯丙氨酸为底物进行全细胞转化生产2-苯乙醇。但是目前以苯丙氨酸为底物,利用全细胞转化法生产2-苯乙醇的产量还比较低,无法满足工业化生产的需求。因此获得一株对苯丙氨酸利用率且转化率都较高的野生菌株,对合成2-苯乙醇才具有重要作用。
技术实现要素:
本发明提供了一种异常威克汉姆酵母(wickerhamomycesanomalus)1d6,已于2020年7月20日保藏于中国典型培养物保藏中心,保藏编号为cctccno:m2020333。
本发明提供了一种微生物菌剂,所述菌剂中含有异常威克汉姆酵母1d6。
在本发明的一种实施方式中,所述微生物菌剂中异常威克汉姆酵母的含量不低于1.0×106cfu/ml或1.0×106cfu/g。
在本发明的一种实施方式中,所述微生物菌剂中异常威克汉姆酵母的含量不低于1.0×108cfu/ml或1.0×108cfu/g。
在本发明的一种实施方式中,所述菌剂的制备方法为:取200~600μl的威克汉姆酵母1d6接种于10~30mlypd液体培养基中,28℃下活化2至3代,待异常威克汉姆酵母1d6达到1.0×108cfu/ml以上活菌数时,5000~10000rpm下离心10~20min,去除上清液后,在无菌环境下依次加入缓冲液和冷冻保护剂,待细胞浓度不低于1.0×106cfu/ml时,真空冷冻干燥处理得到固体菌剂。
在本发明的一种实施方式中,待细胞浓度不低于1.0×107cfu/ml时,真空冷冻干燥处理得到固体菌剂。
在本发明的一种实施方式中,所述缓冲液为生理盐水或ph值为5~8的0.1~1m磷酸盐缓冲液,所述保护剂为浓度为10~25g/100ml的蔗糖溶液。
在本发明的一种实施方式中,所述缓冲液为双蒸水和/或生理盐水或ph值为7的0.2m磷酸盐缓冲液,所述冷冻保护剂为15~20g/100ml的蔗糖溶液。
本发明提供了一种生产2-苯乙醇的方法,是在含有l-苯丙氨酸的发酵体系中,以异常威克汉姆酵母1d6为发酵菌株,或加入所述微生物菌剂,生产2-苯乙醇。
在本发明的一种实施方式中,将od600为0.1~4的异常威克汉姆酵母1d6以10~30ml/250ml的接种量接种至发酵体系。
本发明提供了一种提高2-苯乙醇转化率的方法,利用异常威克汉姆酵母1d6,在以l-苯丙氨酸为底物的体系中,转化生成2-苯乙醇。
在本发明的一种实施方式中,l-苯丙氨酸的浓度为5~7g/l。
在本发明的一种实施方式中,其特征在于,所述体系中还含有葡萄糖,葡萄糖浓度为20~40g/l。
在本发明的一种实施方式中,反应时间为24~72h。
在本发明的一种实施方式中,反应时间为24~48h。
本发明提供一种提高2-苯乙醇产量的方法,将所述异常威克汉姆酵母1d6在l-苯丙氨酸为底物的体系中生产2-苯乙醇。
在本发明的一种实施方式中,l-苯丙氨酸的浓度为5~7g/l。
在本发明的一种实施方式中,其特征在于,所述体系中还含有葡萄糖,葡萄糖浓度为20~40g/l。
在本发明的一种实施方式中,反应时间为24~72h。
在本发明的一种实施方式中,反应时间为24~48h。
本发明还保护所述异常威克汉姆酵母1d6或微生物菌剂在生产2-苯乙醇中的应用。
本发明还保护所述生产2-苯乙醇的方法,或提高2-苯乙醇转化率的方法,或提高2-苯乙醇产量的方法在生产2-苯乙醇中的应用。
本发明的有益效果:
本发明筛选得到的异常威克汉姆酵母1d6具有较高的l-苯丙氨酸转化率,并且对反应体系中葡萄糖含量需求较低,葡萄糖浓度在20~40g/l就能达到较好的产量效果,并且对底物l-苯丙氨酸的浓度要求低,仅需5~7g/l,在摇瓶发酵条件下,产量就能够达到2500mg/l以上。通过在发酵罐中扩大培养,产量可达到4727.29mg/l,具备良好的应用前景。
生物材料保藏
本发明所提供的异常威克汉姆酵母1d6,分类命名为wickerhamomycesanomalus1d6,已于2020年7月20日保藏于中国典型培养物保藏中心,保藏编号为cctccno:m2020333,保藏地址为中国.武汉.武汉大学。
附图说明
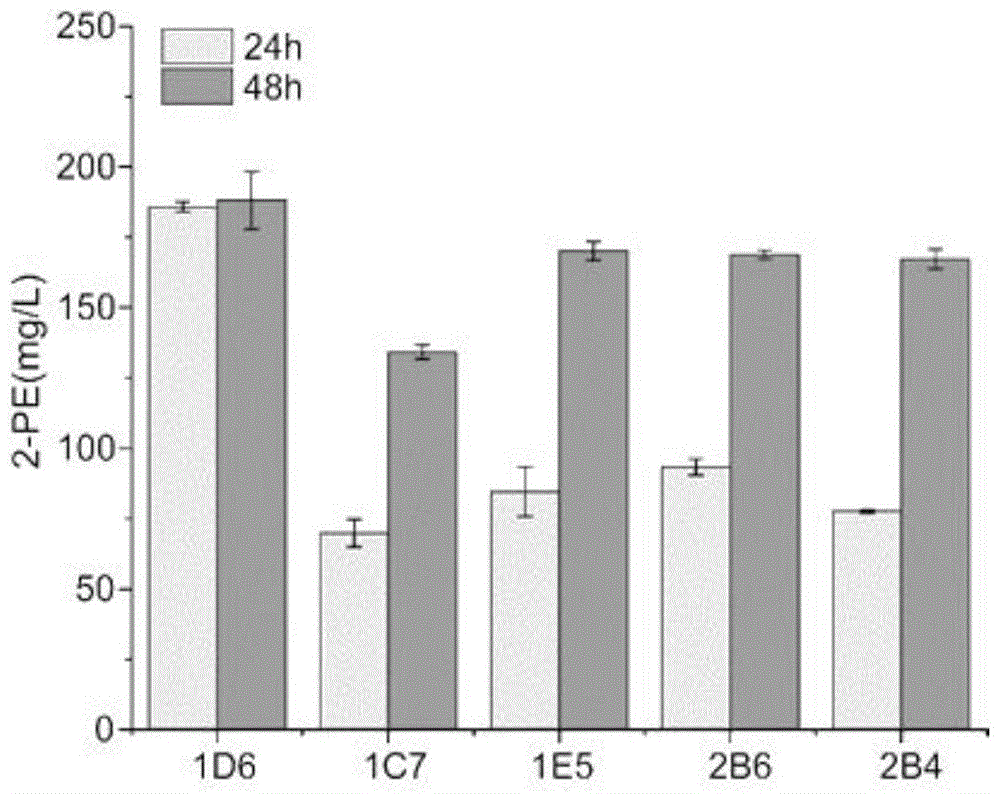
图1为ypd发酵液中2-苯乙醇含量比较结果图;
图2为酵母在ypd培养基上菌落形态特征及显微镜下细胞形态特征图;
图3为酵母pcr鉴定电泳结果图;
图4为酵母基于itsii序列及neighbor-joining法构建的系统发育树;
图5酵母在sc培养基中的2-苯乙醇产量图;
图6为酵母在优化后sc培养基中的2-苯乙醇产量图。
具体实施方式
(一)培养基
ypd培养基:酵母粉10g/l,蛋白胨20g/l,葡萄糖20g/l,固体培养基额外添加2%琼脂。
sc培养基:葡萄糖20g/l,mgso4·7h2o0.5g/l,kh2po45g/l,l-苯丙氨酸5g/l,ynb1.7g/l。
优化后sc培养基:葡萄糖40g/l,mgso4·7h2o0.5g/l,kh2po45g/l,l-苯丙氨酸7g/l,ynb1.7g/l,ph4.5。
上述培养基的灭菌条件均为115℃,15min。
(二)2-苯乙醇检测方法
苯乙醇标准液制备:准确称取50mg2-苯乙醇,以流动相溶解,定容至50ml,配制1.0mg/ml的标准储备液。分别取标准液50ul、100ul、200ul、500ul、1ml和2ml于容量瓶中,定容10ml,分别得浓度为5.0、10.0、20.0、50.0、100.0、200ug/ml的工作液。使用配备二极管阵列检测器的hplc,以甲醇:水为1:1为流动相,柱温35℃,进样体积10ul,流速为0.8ml/min。
(三)酵母dna的提取方法
1.取od600=3左右的酵母菌液500ul,12000g,2min,去上清;
2.加入等体积0.1mm的玻璃珠和100ulstesbuffer,用振荡器频率最大状态下,震荡15min,或用fast-prep两个循环;
3.加入200ul无菌水和200ul苯酚:氯仿:异戊醇(25:24:1),震荡30s,4℃,13500g,5min;
4.去上清200ul至新的ep管,加20ul3m的醋酸锂溶液,再加550ul的预冷过夜的100%乙醇,混匀,4℃,13500g,5min;
5.小心去上清,再用500ul预冷过夜的70%乙醇洗涤一次,4℃,13500g,5min;
6.去上清,60℃,15-30min,烘干,加适量无菌水重悬,测浓度。
实施例1:菌株的筛选和分离
(1)称取1g药曲,加入9ml无菌水,浸泡15min后充分振荡,制成菌悬液;在无菌操作条件下,用无菌水逐级稀释至10-6、10-5、10-4、10-3、10-2、10-1梯度的菌悬液;取各梯度菌悬液100μl涂布于ypd平板上,每个稀释梯度做三个平行;将培养基平板倒置于30℃恒温培养箱中培养2d,挑选平板上表面突起、乳白色、边缘不规则、不透明的单菌落,划线于ypd平板上,至长出单菌落,在平板上重复划线至每个平板均长出一种单一菌落(即每个平板上的菌落形态一致);从每个平板上挑取单菌落并保存于ypd斜面培养基上。
(2)菌株初筛:将步骤(1)筛选获得的菌株接于ypd培养基中,于30℃,转速为220r/min的摇床中培养16h,再以初始od600值为0.1的接种量转接于ypd新鲜培养基中,于30℃,转速为220r/min,培养48h。分别取培养24h和48h的发酵液,发酵液于4℃,12000r/min离心5min,经过0.22μm有机滤膜过滤,进行hplc分析2-苯乙醇含量。
(3)菌株复筛:将步骤(2)获得的菌株接于ypd培养基中,于30℃,转速为220r/min的摇床中培养16h,再以初始od600值为0.1的接种量转接于sc培养基中,于30℃,转速为220r/min,培养48h。分别取培养24h和48h的发酵液,发酵液于4℃,12000r/min离心5min,经过0.22μm有机滤膜过滤,进行hplc分析2-苯乙醇含量。结果见图1。
(4)菌落形态观察及显微结构观察
将复筛选获得的高产2-苯乙醇菌株(1d6)接种到ypd培养基上进行活化,30℃下,培养48~72h,2d后进行形态观察。
挑取上述中ypd平板上单菌落的少量菌体,轻柔、均匀涂布在载玻片中的无菌水液滴中,固定后,制作临时装片,于40×100油镜下观察,记录细胞形态特征、细胞大小、出芽情况。置于荧光显微镜下进行观察。结果见图2。酵母1d6在ypd培养基上菌落呈乳白色,边缘不规则,中间突起(图2a)。其在显微镜下细胞呈圆形,且有椭圆形的细胞,生殖方式为顶端出芽,属典型酵母特征(图2b)。
(5)分子生物学鉴定
its2rdna基因的pcr扩增与序列测定:以提取的基因组dna为模板扩增its2rdna,以通用pcr引物扩增its2区域序列750bp。pcr扩增产物通过琼脂糖凝胶电泳检测,在紫外成像系统上拍照分析(图3)。将验证后的pcr扩增产物送至天霖生物科技(无锡)有限公司测序,将测序结果在ncbi上进行blast,与现有的基因序列比对,并使用mega7.0生物学软件对测试菌株和相关菌株的多个序列进行比对分析及neighbor-joining方法构建系统发育树结果见图4。结果表明,酵母1d6与异常威克汉姆酵母(wickerhamomycesanomalus)的its2rrna序列同源性最高,相似度达到99%。使用分子软件mega7.0对与酵母1d6相似度较高的10株菌株进行多序列比对分析,并利用neighbor-joining方法构建系统发育树。由图可以看出酵母1d6与异常威克汉姆酵母同源性最高,鉴定为异常威克汉姆酵母(w.anomalus)。
its2-f:5'-gcatcgatgaagaacgcagc-3';
its2-r:5'-tcctccgcttattgatatgc-3'。
实施例2:酵母菌摇瓶培养生产2-苯乙醇
(1)菌株在sc培养基中的发酵培养
将筛选得到的异常威克汉姆酵母1d6在ypd液体培养基中活化,以初始od600值为0.1、30ml/250ml的接种量接种于sc培养基中,于30℃,转速为220r/min下,每8h取一次发酵液,培养56h。发酵液于4℃,12000r/min离心10min,经过0.22μm有机滤膜过滤,进行hplc分析。
结果显示培养24h后产量基本趋于稳定,2-pe产量最高达2274.73mg/l(图5)。
(2)sc培养基中葡萄糖浓度对2-苯乙醇产量的影响
具体方式见步骤(1),区别在于,将sc培养基中的葡萄糖浓度进行替换,发酵48h,测定2-苯乙醇产量。
表1培养基中不同葡萄糖浓度中2-苯乙醇产量
(3)sc培养基中l-苯丙氨酸浓度对2-苯乙醇产量的影响
具体方式见步骤(1),区别在于,将sc培养基中的葡萄糖浓度确定为40g/l,将l-苯丙氨酸的浓度替换,发酵48h,测定2-苯乙醇产量。
表2培养基中不同l-苯丙氨酸浓度中2-苯乙醇产量
(4)菌株在优化条件下实时生产2-苯乙醇
将异常威克汉姆酵母1d6在ypd液体培养基中活化,以初始od600值为0.1、30ml/250ml的接种量接种于优化后sc培养基中(葡萄糖40g/l,l-苯丙氨酸7g/l),于30℃,转速为220r/min下,培养56h,每8h取一次发酵液。结果显示2-pe产量在40h后趋于稳定,最高产量达3040.84mg/l(图6)。
实施例3:酵母菌发酵罐培养生产2-苯乙醇
将异常威克汉姆酵母1d6进行放大培养,在ypd平板上培养2-3天。然后挑取单菌落接种到含100ml/500mlypd培养基中,于30℃,220rpm/min摇床培养24h为种子液。分批和补料分批发酵均在装有2.5l发酵培养基(即优化后sc培养基)的5l发酵罐中进行。
将od600为4.0为种子液,以10ml/100ml的接种量接种至发酵培养基中,搅拌速度为400rpm,通气率为2.0vvm。使用无菌4mol/lnaoh溶液和4mol/lhcl溶液控制发酵培养基的ph为4.5所有培养均在30℃下进行。每隔12小时发酵液测定2-苯乙醇含量,结果见表3。在发酵24h时,进行一次性补料添加终浓度为5g/l的l-苯丙氨酸,发酵至48h时2-pe产量达4727.29mg/l。
表3发酵罐全细胞转化生产2-苯乙醇
实施例4:酵母菌的遗传稳定性
检测异常威克汉姆酵母1d6的传代稳定性,分别在ypd平板上进行传代培养,于30℃,培养2-3天。然后分别挑取单菌落接种到ypd培养基中,于30℃,220rpm/min摇床培养16h为种子液。转接到sc培养基,培养48h。从以下结果看,在传至第六代后,产量仍有2765.36mg/l,应用于工业生产的菌株,在传至5-6代后,其产量维持在5%左右就视其稳定性较好,因此,异常威克汉姆酵母1d6具有工业生产的价值。
表4菌株遗传稳定性
实施例5:酵母菌的微生物菌剂的制备
取200~600μl的异常威克汉姆酵母1d6接种于10~30mlypd液体培养基中,28℃下活化2至3代,待异常威克汉姆酵母1d6达到1.0×108cfu/ml以上活菌数时,5000~10000rpm下离心10~20min,去除上清液后,在无菌环境下依次加入缓冲液(生理盐水或ph值为7的0.2m磷酸盐缓冲液)和冷冻保护剂(15~20g/100ml的蔗糖溶液),待细胞浓度不低于107cfu/ml时,真空冷冻干燥处理得到固体菌剂。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!