基于RAA-LF技术的金黄色葡萄球菌扩增引物及应用的制作方法
本发明属于分子生物学检测技术领域,涉及一种基于raa-lf技术的金黄色葡萄球菌扩增引物及应用,特别涉及一种用于快速检测金黄色葡萄球菌的raa-lf引物、由其制成的试剂盒及其检测方法。
背景技术:
奶牛乳房炎(bovinemastitis,bm)是世界范围内最常见的奶牛疾病,严重影响感染动物的健康和福利。有研究表明,全世界每年因奶牛乳房炎造成的经济损失高达350亿美元,美国、英国和日本等国家奶牛乳房炎发病率达50%左右,而我国的奶牛乳房炎发病率高达70%左右,对奶牛饲养管理产生了较大的影响。奶牛乳房炎主要是由物理、化学或微生物等因素刺激奶牛乳腺所产生的一种炎症反应。而微生物的入侵是不可忽略的因素,其中以接触性致病菌为代表的金黄色葡萄球菌是主要病原之一。在现代化、集约化规模的奶牛场中,及时、准确地鉴别致病菌,对能否有效防控乳房炎并获得好的治疗效果以及实现最大限度的降低经济损失有直接影响。
目前用于奶牛乳房炎病原菌诊断的方法有常规微生物生化鉴定法、全自动微生物鉴定系统、16srrna基因序列测序、pcr、基因芯片以及环介导等温扩增技术等。传统的检测方法繁琐操作步骤,耗时费力,不能满足检测的现场实施。基因芯片技术和环介导等温扩增技术存在成本高昂、重复性差且易出现假阳性结果等缺点。pcr检测试剂仪器成本昂贵;且需精密检测设备和严格操作流程;无法满足现场快速检测和大规模监测的需求,限制其在基层单位的应用。核酸等温扩增技术的出现有效弥补了现有分子检测方法的不足,扩大了核酸检测技术应用范围,在保证高灵敏度和高特异性的基础上,向快速、低成本、微型化的方向发展,并逐渐成为致病菌核酸检测领域的研究热点。目前raa技术已经应用到病毒、细菌、支原体、寄生虫等的快速检测中。cn110564881a公开了一种重组酶等温扩增技术检测副溶血性弧菌的方法,首次将raa-lf用于检测病原体,为检测病原体提供了一种全新的思路。但是,raa方法在牛源性金黄色葡萄球菌检测的相关研究还处于空白阶段,检测金黄色葡萄球菌的raa方法的研究难点在于基于raa-lf技术的金黄色葡萄球菌扩增引物的开发,在样品中不仅可能包含金黄色葡萄球菌而且还包括很多其他菌种如大肠杆菌及肺炎克雷伯氏菌等,如何能够保证引物的特异性及扩增速度这是困扰本领域技术人员的核心问题。
因此,开发一种能够在现场快速检测金黄色葡萄球菌的raa方法极具现实意义。
技术实现要素:
本发明的目的在于克服现有技术检测速度较慢且无法在现场完成检测的缺陷,提供一种能够在现场快速检测金黄色葡萄球菌的raa方法,具体为提供了一种基于raa-lf技术的金黄色葡萄球菌扩增引物,该引物对金黄色葡萄球菌的特异性好,其扩增速度快,灵敏度高,实现了金黄色葡萄球菌的现场快速检测,极大地降低了金黄色葡萄球菌快速检测的硬件限制(只需一台恒温设备即可在现场完成检测),极具应用前景。
为实现上述目的,本发明提供如下技术方案:
一种基于raa-lf技术的金黄色葡萄球菌扩增引物,上游引物和下游引物分别含有如下所示的核苷酸序列:
f(上游引物):5’-gacaaaggtcaaagaactgataaatatgga-3’;
r(下游引物):5’-ttcactttttcttaaaagttgttcatgtgt-3’。
本发明的基于raa-lf技术的金黄色葡萄球菌扩增引物,是通过针对金黄色葡萄球菌的特异性基因保守区域实现扩增的,这能够保证引物的特异性,进而避免后期对金黄色葡萄球菌进行检验时其他菌种的影响,同时本发明对扩增引物进行了特定的选择以保证引物的扩增速度(灵敏度)。
作为优选的技术方案:
如上所述的一种基于raa-lf技术的金黄色葡萄球菌扩增引物,上游引物和下游引物的核苷酸序列为:
f:5’-gacaaaggtcaaagaactgataaatatgga-3’;
r:5’-ttcactttttcttaaaagttgttcatgtgt-3’。
如上所述的一种基于raa-lf技术的金黄色葡萄球菌扩增引物,上游引物及下游引物的5’端分别用荧光素和生物素类化合物标记。本发明的保护范围并不仅限于此,具体的标记物本领域技术人员可根据实际情况进行选择,此处仅给出一种可行的技术方案而已。
如上所述的一种基于raa-lf技术的金黄色葡萄球菌扩增引物,所述荧光素为羧基荧光素6-fam;所述生物素类化合物为生物素biotin。本发明的保护范围并不仅限于此,本领域技术人员可根据实际需求选择合适的荧光素和生物素类化合物。
如上所述的一种基于raa-lf技术的金黄色葡萄球菌扩增引物,所述金黄色葡萄球菌为牛源性金黄色葡萄球菌,本发明的扩增引物并不仅仅限于牛源性金黄色葡萄球菌,也可能适用于其他金黄色葡萄球菌,本发明对牛源性金黄色葡萄球菌进行了相关验证,并提供了其对牛源性金黄色葡萄球菌的最佳扩增条件,其他金黄色葡萄球菌的具体扩增条件可能与本发明给出的条件不同。
本发明还提供了一种基于raa-lf技术的金黄色葡萄球菌检测试剂盒,所述试剂盒中含有如上所述的扩增引物对。
作为优选的技术方案:
如上所述的基于raa-lf技术的金黄色葡萄球菌检测试剂盒,还包括raa反应试剂盒和侧流层析试纸条。此外,金黄色葡萄球菌检测试剂盒还可配套设置金黄色葡萄球菌nuc基因阳性对照样品和阴性对照样品,通过金黄色葡萄球菌nuc基因阳性对照样品和阴性对照样品能够极大地方便操作人员进行比对。
如上所述的基于raa-lf技术的金黄色葡萄球菌检测试剂盒,所述raa反应试剂盒包括含冻干酶粉的反应管、基础缓冲液、无菌去离子水以及醋酸镁,其他raa反应必需的物品包括在raa反应试剂盒内。
本发明还提供了一种金黄色葡萄球菌的raa-lf检测方法,步骤如下:
(1)提取待测样品的dna;
(2)将如上所述的引物和步骤(1)获取的待测样品的dna配制得到raa反应体系,raa反应体系在33℃下恒温raa扩增反应20~30min;
(3)取步骤(2)获取的raa扩增产物滴加到侧流层析试纸条的加样区,将侧流层析试纸条加样区的末端垂直插入含有lf缓冲液的离心管中,5~10min后取出侧流层析试纸条进行观察并记录结果;
如侧流层析试纸条在质控线和检测线位置均有条带,待测样品含有金黄色葡萄球菌;
如侧流层析试纸条在质控线位置有条带且在检测线位置没有条带,待测样品不含有金黄色葡萄球菌,或待测样品中金黄色葡萄球菌的含量低于最低检出量;
如侧流层析试纸条在质控线和检测线位置均没有条带,侧流层析试纸条失效需重新检测。
本发明的金黄色葡萄球菌的raa-lf检测方法,整体操作简便,实验条件低(仅需恒温环境),所需时间短,通过肉眼即可直接确认测试结果,实现了金黄色葡萄球菌的现场快速检测,极大地降低了金黄色葡萄球菌快速检测的硬件限制(只需一台恒温设备即可在现场完成检测),极具应用前景。
作为优选的技术方案:
如上所述的一种金黄色葡萄球菌的raa-lf检测方法,步骤(2)raa反应体系中含有的所述上游引物和下游引物的浓度均为200nm,并且含有14mm醋酸镁。
有益效果:
(1)本发明的基于raa-lf技术的金黄色葡萄球菌扩增引物,特异性强,灵敏度高,可重复性好;
(2)本发明的金黄色葡萄球菌的raa-lf检测方法,在恒温装置中快速扩增形成双标记产物,并通过lf肉眼观察即可判定结果,其无需特异性探针,检测更为方便,降低成本;
(3)本发明的金黄色葡萄球菌的raa-lf检测方法,操作简单、特异性好、灵敏度高以及便携式携带等特点,更加适合临床现场检测;
(4)本发明的金黄色葡萄球菌的raa-lf检测方法,在现代化、集约化规模的奶牛场中,及时、准确地鉴别牛源性金黄色葡萄球菌,对能否有效防控乳房炎并获得好的治疗效果以及实现最大限度的降低经济损失有直接的影响,极具应用前景。
附图说明
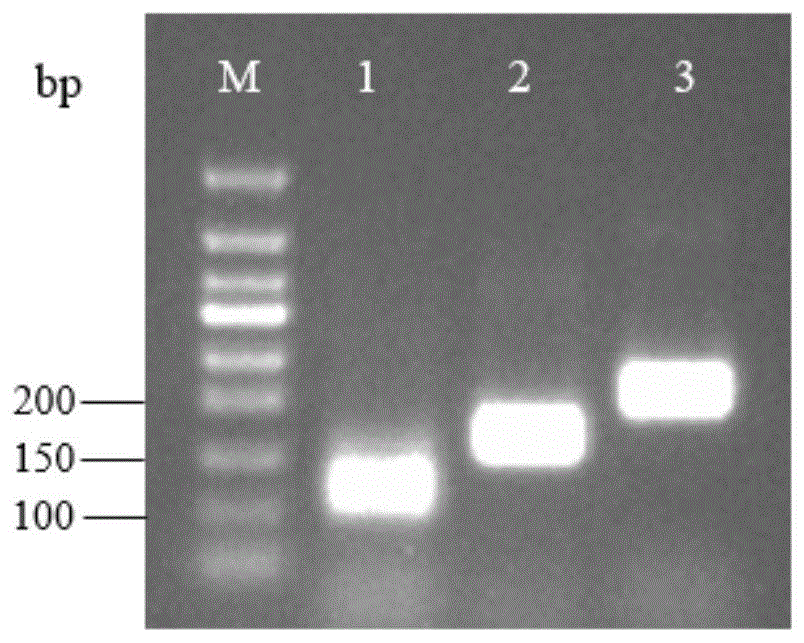
图1为本发明的扩增引物筛选结果图(其中1、2、3分别代表第一对引物、第二对引物及第三对引物);
图2为本发明的金黄色葡萄球菌raa-lf扩增反应条件的优化结果图(其中,a为引物对浓度优化结果,b为反应温度的优化结果,c为反应时间的优化结果);
图3为本发明的金黄色葡萄球菌扩增引物特异性验证结果图;
图4为本发明的金黄色葡萄球菌扩增引物灵敏度验证结果图(其中,a为raa-lf检测结果图,b为常规pcr检测结果图,c为raa-lf检测细菌纯培养物灵敏度结果图)。
具体实施方式
为了更好地理解本发明的内容,下面结合具体实施例和附图作进一步说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改或替换均属于本发明的保护范围。
若未特别指明,实施例中的原料、化学试剂均为常规市售商品,技术手段为本领域技术人员所用的常规手段。
实施例1
牛源性金黄色葡萄球菌raa-lf引物(基于raa-lf技术的牛源性金黄色葡萄球菌扩增引物)设计与筛选:
根据raa引物设计原则靶向金黄色葡萄球菌的特异性nuc基因序列,通过primer-blast和primer5设计引物;从genbank下载多条特异性基因nuc(ls483300.1,lr134088.1,ef529607.1,ef529597.1,aj938182.1),比对分析同源性和保守区域设计引物,利用ncbi-blast比对引物的同源性,靶标序列通过conserveddomainsearch比对高度保守区域以及通过2%琼脂糖凝胶电泳扩增效果评价引物序列的特异性,筛选引物。共设计得到三对引物(见下表),确定单一最佳引物后在上下游5’端分别标记荧光素6-fam和生物素biotin,用于结合胶体金颗粒进行试纸条检测,本实施例的所有引物均由生工生物工程(上海)股份有限公司合成。
经多次重复性试验及琼脂糖凝胶电泳(结果如图1所示),通过稳定性、灵敏度、特异性的评估,优选为raa-f2/raa-r2,具体为:
seqidno.1:
5’-gacaaaggtcaaagaactgataaatatgga-3’;
seqidno.2:
5’-ttcactttttcttaaaagttgttcatgtgt-3’。
实施例2
一种基于raa-lf技术的金黄色葡萄球菌检测试剂盒,包括seqidno.1和no.2的基于raa-lf技术的金黄色葡萄球菌扩增引物、raa反应试剂盒、侧流层析试纸条、金黄色葡萄球菌nuc基因阳性对照样品和阴性对照样品,其中raa反应试剂盒包括含冻干酶粉的反应管、基础缓冲液(含dntp)、无菌去离子水以及醋酸镁。
实施例3
raa-lf检测牛源性金黄色葡萄球菌反应条件优化:
牛源性金黄色葡萄球菌dna模板是通过细菌基因组dna提取试剂盒(天根生化科技(北京)有限公司,产品编号:dp302)提取得到的,在后续研究中便于样本处理,细菌纯菌液培养与模拟样品中细菌基因组dna是采用普通热裂解法提取的。
用raa反应试剂盒(购自江苏奇天基因生物科技有限公司,产品编号为b000000a)进行raa扩增,包括含冻干酶粉的反应管、基础缓冲液(含dntp)、无菌去离子水以及280mm的醋酸镁。侧流层析试纸条购自杭州优思达生物技术有限公司,产品型号为d003-03。
raa扩增体系具体如下:先将基础缓冲液25μl、上下游引物各1μl、模板dna1μl、无菌去离子水19.5μl配制混匀后加入反应单元管,轻轻混匀后在管壁内滴加2.5μl醋酸镁,离心混匀,raa扩增反应体系的总体积为50μl;
(1)上下游引物的浓度的优化:
分别配制上下游引物浓度为400nm、200nm、100nm、50nm、25nm、12.5nm、6.25nm的raa扩增体系,各raa扩增体系置于39℃条件下反应30min,反应结束后取10μl核酸扩增产物滴加到加样区,将试纸条加样区末端垂直插入含有100μllf缓冲液的ep管中,5min后取出试纸条进行观察并记录结果,其结果如图2a所示,发现上下游引物浓度大于等于200nm时,质控线和检测线均能看到明显反馈,为降低成本,选定上下游引物的浓度为200nm;
(2)raa反应的反应温度的优化:
各raa扩增体系(上下游引物的浓度为200nm)置于25℃、31℃、33℃、35℃、37℃、39℃、41℃、43℃条件下反应30min,反应结束后取10μl核酸扩增产物滴加到加样区,将试纸条加样区末端垂直插入含有100μllf缓冲液的ep管中,5min后取出试纸条进行观察并记录结果,其结果如图2b所示,发现反应温度为33℃的组别对应的质控线和检测线反馈最为明显,因此选定raa反应温度为33℃;
(3)raa反应的反应时间的优化:
各raa扩增体系(上下游引物的浓度为200nm)后置于33℃条件下反应5min、10min、15min、20min、25min、30min,反应结束后取10μl核酸扩增产物滴加到加样区,将试纸条加样区末端垂直插入含有100μllf缓冲液的ep管中,5min后取出试纸条进行观察并记录结果,其结果如图2c所示,发现反应时间大于等于20min的组别对应的质控线和检测线均能看到明显反馈,为缩短检测时长,选定raa反应时间为20min;
最终优化得到的raa扩增反应体系含有上下游引物各200nm、14mm的醋酸镁;优化后的raa扩增反应条件为:反应温度为33℃,反应时间为20min。
即优化得到的金黄色葡萄球菌的raa-lf检测方法的具体步骤如下:
1)提取待测样品的dna;
2)先将基础缓冲液25μl、10μm上游引物和游引物下游引物各1μl、步骤1)获取的待测样品的dna1μl、无菌去离子水19.5μl配制混匀后加入反应单元管,轻轻混匀后在管壁内滴加2.5μl280mm的醋酸镁,离心混匀,在33℃下恒温raa扩增反应20min;
3)取10μl步骤2)获取的raa扩增产物滴加到侧流层析试纸条的加样区,将侧流层析试纸条加样区的末端垂直插入含有100μllf缓冲液的离心管中,5min后取出侧流层析试纸条进行观察并记录结果;
如侧流层析试纸条在质控线和检测线位置均有条带,待测样品含有金黄色葡萄球菌;
如侧流层析试纸条在质控线位置有条带且在检测线位置没有条带,待测样品不含有金黄色葡萄球菌,或待测样品中金黄色葡萄球菌的含量低于最低检出量;
如侧流层析试纸条在质控线和检测线位置均没有条带,侧流层析试纸条失效需重新检测。
实施例4
raa-lf检测牛源性金黄色葡萄球菌的特异性验证:
使用实施例3优化得到的金黄色葡萄球菌的raa-lf检测方法,对13种致病菌(表1)分别进行检测,对扩增引物进行特异性分析评价;
表1用于raa-lf检测特异性分析的菌株
牛源性金黄色葡萄球菌扩增引物特异性验证结果图如图3所示,由图中可以看出,除金黄色葡萄球菌核酸有扩增条带的出现,结果呈阳性外,其他10株病原菌结果均呈阴性,这说明本发明的扩增引物对于金黄色葡萄球菌具有良好的特异性。
实施例5
raa-lf检测牛源性金黄色葡萄球菌的灵敏度验证:
以金黄色葡萄球菌cdcab91093基因组dna为模板,将其浓度分别稀释至4ng·μl-1,400pg·μl-1,40pg·μl-1,4pg·μl-1,400fg·μl-1,40fg·μl-1和4fg·μl-1,采取实施例3优化得到的金黄色葡萄球菌的raa-lf检测方法检测灵敏度。
同时以相同浓度的基因组dna为模板,进行常规pcr扩增,比较本发明的方法和pcr技术的灵敏度。
常规pcr为25μl体系:premixtaqtm(takarataqtmversion2.0)12.5μl,上下游引物(10μm)各0.5μl,模板1μl,其余用无菌去离子水补齐。pcr反应程序:94℃,5min;94℃30s,56℃30s,72℃50s,30cycles;72℃,5min;4℃。
灵敏度的验证结果如图4所示,本发明的raa-lf最低检出限为4fg·μl-1(图4a),常规pcr最低检出限是400fg·μl-1(图4b),结果表明本发明方法相比较常规pcr具有较高的灵敏度,可以满足检测较低含量牛源性金黄色葡萄球菌的要求。
实施例6
raa-lf检测牛源性金黄色葡萄球菌纯培养物:
将金黄色葡萄球菌接种于5mltsb培养基中,37℃过夜培养,对其采用平板计数法计数后用生理盐水对纯菌液进行10倍梯度稀释,按实施例3优化得到的金黄色葡萄球菌的raa-lf检测方法进行检测。纯细菌培养液计数为1.83×109cfu/ml,分别稀释至1.83×106cfu/ml、1.83×105cfu/ml、1.83×104cfu/ml、1.83×103cfu/ml、1.83×102cfu/ml、1.83cfu/ml。纯培养物检测结果如图4c所示,该方法检测细菌纯培养物的最低检测限为1.83×102cfu/ml。
实施例7
实际样品检测:
严格按照标准牛奶采样程序,于上海周边地区奶牛场采集临床样本64份,保存至冰盒,尽快带回本实验室进行相关检测。采用传统微生物分离培养法、pcr法与本研究所建的可视化raa-lf方法进行检测,统计这三种方法的检测结果,根据公式分析各方法的敏感性、特异性和总符合率。
各检测方法之间,敏感性、特异性和符合率的计算公式为:
敏感性=(真阳性数)/(真阳性数+假阴性数);
特异性=(真阴性数)/(真阴性数+假阳性数);
总符合率=(真阳性数+真阴性数)/(被检总数)。
结果如下表2所示,与传统微生物分离培养法相比,可视化raa-lf方法敏感性高达100%,特异性为93.75%,两种方法的总符合率为95.31%;与pcr方法相比,可视化raa-lf方法敏感性高达100%,特异性为97.83%,两种方法的总符合率98.44%。由此可见本发明的raa-lf方法可作为一种行之有效的手段去现场检测金黄色葡萄球菌性奶牛乳腺炎。
表2实际样品检测结果
经验证,本发明的基于raa-lf技术的金黄色葡萄球菌扩增引物,特异性强,灵敏度高,可重复性好;金黄色葡萄球菌的raa-lf检测方法,可快速完成检测,简单、快捷、方便、特异性强且灵敏度高,极具应用前景。
虽然以上描述了本发明的具体实施方式,但是本领域的技术人员应该理解,这些仅是举例说明,在不违背本发明的原理和实质的前提下,可以对这些实施方式做出多种变更或修改。
序列表
<110>上海海洋大学
<120>基于raa-lf技术的金黄色葡萄球菌扩增引物及应用
<141>2020-11-24
<150>2020107836630
<151>2020-08-06
<160>2
<170>siposequencelisting1.0
<210>1
<211>30
<212>dna
<213>artificialsequence
<400>1
gacaaaggtcaaagaactgataaatatgga30
<210>2
<211>30
<212>dna
<213>artificialsequence
<400>2
ttcactttttcttaaaagttgttcatgtgt30
- 还没有人留言评论。精彩留言会获得点赞!