一种用于检测布赫纳蝗螨的引物探针组及其应用的制作方法
1.本发明涉及动物卫生技术领域,尤其涉及一种用于检测布赫纳蝗螨的引物探针组及其应用。
背景技术:
2.人工繁育的熊蜂蜂群广泛应用于世界设施栽培果蔬生产中的授粉环节,其规模繁育的质量与效率是决定成功应用的重要基础。自然条件下,熊蜂蜂王的病虫害可导致蜂王死亡、推迟或不产卵,蜂群不发展,甚至无法成群而影响蜂群的质量。人工繁育熊蜂蜂群时,饲养室相对稳定的环境往往更适宜多种病原物的生长和繁殖。内寄生螨、微孢子虫具有强传染性,是诸多危害熊蜂蜂王及蜂群发育的病虫害中最严重的两类病原(寄生)物。
3.布赫纳蝗螨(locustacurus buchneri,简称l.buchneri)是商业化生产的熊蜂体内经常发生的一种病害,因为商品化生产条件温暖高湿条件有利于该螨的繁殖,而且该螨寄生于熊蜂气囊和气管内,现场查验不易发现其寄生为害。布赫纳蝗螨寄生于熊蜂气囊和气管内,成螨在越冬熊蜂蜂王的气管内越冬,当春季蜂王出巢活动时,布赫纳蝗螨开始产卵发育繁殖。雌成螨可入侵到同巢工蜂气管内产卵为害。布赫纳蝗螨以雌若螨虫态完成寄主间转移行为。雌若螨发育成熟后,从寄主气孔迁出,转移至另一寄主。因此,可以通过被寄生的工蜂误入本地其它蜂群而传到另一蜂群内寄生为害。尤其是在夏季,经常发生工蜂误入其他蜂群内。同时,授粉时通过传染给花器也可传播扩散。该螨可以侵染25种熊蜂及其它种类的昆虫,不同熊蜂种类该螨的寄生率有差异,寄生率最高可达20%。在我国明亮熊蜂和小蜂熊蜂已有寄生报道。据研究表明,该螨是造成北美本地熊蜂数量大幅减少的一个重要因素。因此,该螨如果在我国大范围内定殖寄生为害,对我为本地熊蜂的种群和生物多样性会带来严重的影响。其潜在经济和生态影响为大。
4.目前对于布赫纳蝗螨最常用的检测方法就是光学显微镜观察,由于布赫纳蝗螨个体较大,在光学显微镜下就可以直接观察,简单易行,但是该方法对于初期和轻度的感染容易漏检,所需样本量较大,且容易受其他蜂螨的干扰,无法鉴别其种类,而且实际检测效果主要依靠检测人员的业务水平与经验,具有不稳定性,因此受到很大的局限。
5.随着分子生物学技术的快速发展,以核糖体rna为基础的各种pcr方法越来越多被用于蜂螨的种类鉴别。大部分研究者设计出了可以检测蜂螨的引物,但可以鉴别出蜂螨种类的特异性引物较少。实时荧光pcr方法通过利用荧光探针使特异性进一步增强,直接显示扩增结果,而无需电泳检测,更缩短了检测时间。目前,检测布赫纳蝗螨的实时荧光pcr检测方法未见报道。
技术实现要素:
6.本发明的目的在于提供一种用于检测布赫纳蝗螨的引物探针组及其应用,能将布赫纳蝗螨与其他熊蜂病原物区分出来,具有优异的特异性。
7.为了实现上述发明目的,本发明提供以下技术方案:
8.本发明提供了一种用于检测布赫纳蝗螨的引物探针组,包括正向引物loc-f、反向引物loc-r和探针,所述正向引物loc-f的序列如seq id no:1所示,所述反向引物loc-r的序列如seq id no:2所示,所述探针的序列如seq id no:3所示。
9.作为优选,所述探针的5’端和3’端均采用荧光基团进行修饰。
10.作为优选,所述探针的5’端采用荧光基团fam进行修饰,3’端采用荧光基团bhq1进行修饰。
11.本发明还提供了所述的用于检测布赫纳蝗螨的引物探针组在制备布赫纳蝗螨检测试剂盒中的应用。
12.本发明还提供了含有权利要求1~3任意一项所述引物探针组的试剂盒。
13.本发明提供了一种用于检测布赫纳蝗螨的引物探针组及其应用,包括正向引物loc-f、反向引物loc-r和探针,所述正向引物loc-f的序列如seq id no:1所示,所述反向引物loc-r的序列如seq id no:2所示,所述探针的序列如seq id no:3所示。本发明具有以下优点:(1)良好的稳定性和特异性:对布赫纳蝗螨的检测具有高度特异性,与其它蜂螨和蜂类病原物无交叉反应,且重复性好;(2)灵敏度高:灵敏度能达到10拷贝/μl;(3)操作简便、快速:整个反应可在1小时内完成。本发明可用于布赫纳蝗螨的检测及其熊蜂、蜜蜂的检疫,对该病的早期预防和及时治疗具有重要意义。
附图说明
14.图1为本申请的布赫纳蝗螨特异性目的片段pcr扩增后电泳结果;
15.图2为实施例4的布赫纳蝗螨实时荧光pcr检测方法的退火温度优化结果;
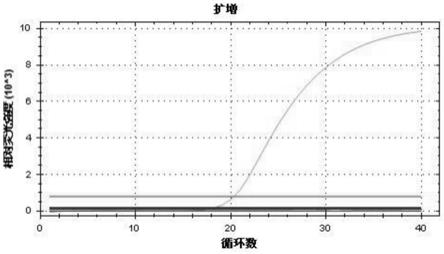
16.图3为实施例5的布赫纳蝗螨标准品荧光pcr的动力学曲线;
17.图4为实施例5的布赫纳蝗螨实时荧光pcr扩增的标准曲线;
18.图5为实施例6布赫纳蝗螨实时荧光pcr检测方法的特异性测定结果。
具体实施方式
19.本发明提供了一种用于检测布赫纳蝗螨的引物探针组,包括正向引物loc-f、反向引物loc-r和探针,所述正向引物loc-f的序列如seq id no:1所示,所述反向引物loc-r的序列如seq id no:2所示,所述探针的序列如seq id no:3所示。
20.在本发明中,所述探针的5’端和3’端优选均采用荧光基团进行修饰。
21.在本发明中,所述探针的5’端优选采用荧光基团fam进行修饰,3’端优选采用荧光基团bhq1进行修饰。
22.本发明还提供了所述的用于检测布赫纳蝗螨的引物探针组在制备布赫纳蝗螨检测试剂盒中的应用。
23.本发明还提供了含有权利要求1~3任意一项所述引物探针组的试剂盒。
24.本发明还提供了一种布赫纳蝗螨的检测方法,包括如下步骤:
25.(1)配置反应体系:2
×
pcrbuffer 9~11μl,24~26mmol/l mgcl21.8~2.2μl,2.4~2.6mmol/l dntps 1.4~1.6μl,8~12μmol/l正向引物和反向引物各0.48~0.52μl,8~12μmol/l探针0.48~0.52μl,4~6u/μl dna聚合酶0.48~0.52μl,待测样品dna 1.8~2.2μl,ddh2o 2.4~2.6μl;
26.(2)反应程序:93~97℃预变性4~6min;然后93~97℃变性4~6s、58~60℃退火延伸28~32s,共35~45个循环,在58~60℃进行单点荧光检测。
27.在本发明中,所述dna聚合酶优选为ex taq dna聚合酶。
28.在本发明中,所述2
×
pcrbuffer的体积优选为10μl。
29.在本发明中,所述mgcl2的浓度优选为25mmol/l。
30.在本发明中,所述mgcl2的体积优选为2μl。
31.在本发明中,所述dntps的浓度优选为2.5mmol/l。
32.在本发明中,所述dntps的体积优选为1.5μl。
33.在本发明中,所述正向引物和反向引物的浓度优选为10μmol/l。
34.在本发明中,所述正向引物和反向引物的体积优选为0.5μl。
35.在本发明中,所述探针的浓度优选为10μmol/l。
36.在本发明中,所述探针的体积优选为0.5μl。
37.在本发明中,所述dna聚合酶的浓度优选为5u/μl。
38.在本发明中,所述dna聚合酶的体积优选为0.5μl。
39.在本发明中,所述待测样品dna的体积优选为2μl。
40.在本发明中,所述ddh2o的体积优选为2.5μl。
41.在本发明中,所述预变性的温度优选为95℃。
42.在本发明中,所述预变性的时间优选为5min。
43.在本发明中,所述变性的温度优选为95℃。
44.在本发明中,所述变性的时间优选为5s。
45.在本发明中,所述退火延伸的温度优选为59℃。
46.在本发明中,所述退火延伸的时间优选为30s。
47.在本发明中,所述循环数优选为37~42个,进一步优选为40个。
48.在本发明中,所述单点荧光检测的温度优选为59℃。
49.在本发明中,所述待测样品dna序列优选为seq id no:4。
50.在本发明中,所述反应体系的总体积优选为20μl。
51.在本发明中,所述检测的结果判定标准优选为:阴性对照无ct值且无扩增曲线,同时阳性对照ct值≤35,并且出现典型的扩增曲线,说明实验为有效实验,否则实验无效;在实验有效的情况下,待测样品无ct值且无扩增曲线,表示样品中不含布赫纳蝗螨;待测样品ct值≤35,且出现典型的扩增曲线,表示样品中含有布赫纳蝗螨;待测样品ct值>35,则对该样品重复检测:重复检测结果无ct值则该样品不含布赫纳蝗螨;重复检测结果有ct值则该样品中含有布赫纳蝗螨。
52.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
53.在本申请实施例中采用的正向引物loc-f的序列如seq id no:1所示,反向引物loc-r的序列如seq id no:2所示,探针的序列如seq id no:3所示,待测样品dna序列如seq id no:4所示,其pcr扩增后电泳结果如图1所示,其中m为50bp ladder dnamarker;1为阳性样品,大小为103bp;2为阴性对照。
54.实施例1
55.一种布赫纳蝗螨的检测方法,包括如下步骤:
56.(1)配置反应体系:2
×
pcr buffer 9μl,24mmol/l mgcl21.8μl,2.4mmol/l dntps 1.4μl,8μmol/l正向引物和反向引物各0.48μl,8μmol/l探针0.48μl,4u/μl dna聚合酶0.48μl,待测样品dna 1.8μl,ddh2o 2.4μl;
57.(2)反应程序:93℃预变性4min;然后93℃变性4s、58℃退火延伸28s,共35个循环,在58℃进行单点荧光检测。
58.实施例2
59.一种布赫纳蝗螨的检测方法,包括如下步骤:
60.(1)配置反应体系:2
×
pcr buffer 10μl,25mmol/l mgcl22μl,2.5mmol/l dntps 1.5μl,10μmol/l正向引物和反向引物各0.5μl,10μmol/l探针0.5μl,5u/μl dna聚合酶0.5μl,待测样品dna2μl,ddh2o 2.5μl;
61.(2)反应程序:95℃预变性5min;然后95℃变性5s、59℃退火延伸30s,共40个循环,在59℃进行单点荧光检测。
62.实施例3
63.一种布赫纳蝗螨的检测方法,包括如下步骤:
64.(1)配置反应体系:2
×
pcr buffer 11μl,26mmol/l mgcl22.2μl,2.6mmol/l dntps 1.6μl,12μmol/l正向引物和反向引物各0.52μl,12μmol/l探针0.52μl,6u/μl dna聚合酶0.52μl,待测样品dna2.2μl,ddh2o 2.6μl;
65.(2)反应程序:97℃预变性6min;然后97℃变性6s、60℃退火延伸32s,共45个循环,在60℃进行单点荧光检测。
66.实施例4
67.赫纳蝗螨实时荧光pcr检测试剂盒检测方法的退火温度优化
68.(1)pcr反应体系:2
×
pcr buffer 10μl,25mmol/l mgcl22μl,2.5mmol/l dntps 1.5μl,10μmol/l正向引物和反向引物各0.5μl,10μmol/l探针0.5μl,5u/μl dna聚合酶0.5μl,待测样品dna2μl,ddh2o 2.5μl,使反应总体积为20.0μl;
69.(2)pcr优化反应程序:95℃预变性5min;然后95℃变性5s,按照55.0℃、55.7℃、57.0℃、59.0℃、61.4℃、63.3℃、64.5℃、65.0℃的梯度温度分别退火延伸30s,每个梯度温度设置3个重复,共40个循环;
70.(3)退火温度选择:退火温度优化结果如图2所示,当退火温度为59℃时,荧光强度最强,所以选择最佳退火温度为59℃。
71.实施例5
72.布赫纳蝗螨实时荧光pcr检测方法检测标准曲线的建立
73.(1)标准品dna稀释:将含有目的片段的阳性克隆质粒用无菌水10倍递增稀释成一系列浓度的质粒dna标准品。
74.(2)标准曲线方程建立:以稀释后的dna标准品为模板,每个标准样品处理重复3次,并以未感染布赫纳蝗螨的健康熊蜂组织总dna为对照,以无菌水为空白对照。按实施例2所述方式配置20μl的实时荧光pcr反应体系并进行实时荧光pcr反应;获得如图3所示的扩增曲线,图中横坐标代表荧光pcr扩增的循环数,纵坐标代表荧光信号强度,从左至右扩增曲线阳性标准品的浓度10倍递减;然后绘制如图4所示的标准曲线,图中横坐标代表样品核
酸浓度对数值,纵坐标代表pcr扩增循环数;r代表相关系数,决定系数r2为0.996构建标准曲线方程。本实施例构建的标准曲线方程为y=-3.489x+47.053,决定系数r2为0.996,扩增效率为93.5%,满足荧光pcr正常的标准曲线要求。
75.实施例6
76.布赫纳蝗螨实时荧光pcr检测试剂盒的特异性测定
77.分别以布赫纳蝗螨、熊蜂微孢子虫、熊蜂短膜虫、熊蜂孢子虫和狄斯瓦螨等5种常见的蜂类寄生虫为样品,按常规方法提取dna后以实施例2的方法进行pcr反应和结果判定,结果如图5所示,其中1:布赫纳蝗螨;2:熊蜂微孢子虫;3:熊蜂短膜虫;4:熊蜂孢子虫;5:狄斯瓦螨;6:阴性对照。由图5可知,仅布赫纳蝗螨有产生典型的扩增曲线(ct值为18.11),其他样品均无扩增曲线,说明本试剂盒具有较强的特异性。
78.由以上实施例可知,本发明提供了一种用于检测布赫纳蝗螨的引物探针组及其应用,包括正向引物loc-f、反向引物loc-r和探针,所述正向引物loc-f的序列如seq id no:1所示,所述反向引物loc-r的序列如seq id no:2所示,所述探针的序列如seq id no:3所示。本发明具有以下优点:(1)良好的稳定性和特异性:对布赫纳蝗螨的检测具有高度特异性,与其它蜂螨和蜂类病原物无交叉反应,且重复性好;(2)灵敏度高:灵敏度能达到10拷贝/μl;(3)操作简便、快速:整个反应可在1小时内完成。本发明可用于布赫纳蝗螨的检测及其熊蜂、蜜蜂的检疫,对该病的早期预防和及时治疗具有重要意义。
79.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1