经移植前暴露于死亡配体的造血祖细胞的活化的制作方法
本申请是申请日为2014年10月7日,申请号为201480056068.x,发明名称为“经移植前暴露于死亡配体的造血祖细胞的活化”的分案申请。
背景技术:
造血干细胞和造血祖细胞移植是肿瘤学中的常规疗法,其在各种耐放射化疗的恶性肿瘤中都具有治疗能力。移植程序的改进和逐步推进,开启了造血移植在非肿瘤疾病中的广泛实施,其中非肿瘤疾病包括先天性缺陷、先天性和获得性免疫缺陷综合征、免疫力异常、自身免疫性疾病,以及对器官和组织移植物的耐受性的诱导。
tnf家族包括19种已知的受体/配体相互作用,它们在诱导体细胞凋亡中具有相同的活性。
在使用鼠科和人类细胞的应力造血和移植模型中所进行的研究,对肿瘤坏死因子(tnf)家族受体作为细胞凋亡和刺激的双重介质的作用[1-4],取得了有争议性的证据和解释。一方面,传统观念主要认为这些受体起到细胞凋亡(细胞发育的少数不可逆事件之一)介质的作用。因此,认为fas/fasl的相互作用是使造血祖细胞发育的负调节因子,类似于在分化末期对克隆扩增进行抑制[5-7]。这一观念是基于如下数据,该数据显示出fas受体在体外抑制造血祖细胞的功能[8,9],阻遏克隆形成活性[10,11],以及损害免疫低下的小鼠[12,13]和人类[11]中的人类细胞植入。
有人提出,祖细胞免于发生细胞凋亡是归因于,转导细胞凋亡和抑制信号的tnf家族受体的低水平表达。
另一方面,在归巢且接种到受体骨髓内之后不久,就在供体细胞中观察到几种tnf家族受体发生剧烈上调。
如wo2007/138597中所记载的,造血祖细胞对细胞凋亡的抗性在移植环境中具有几种重要意义。一方面,wo2007/138597提出作为基于表型进行选择的替代方式,基于功能特性,使用凋亡挑战来富集用于移植的祖细胞。该有效且可靠的选择程序是简单且低廉的,并且在供体移植物中包括了表达低水平或不表达诸如cd34和cd133标记物的祖细胞。此外,基于细胞凋亡的细胞制剂具有以下明显优势:消除了移植物抗宿主(gvhd)的效应物和自身反应性t细胞,以及来自供体移植物的恶性细胞[33,34]。
本发明人早先曾表明,tnf家族受体在体外对造血细胞功能的负面影响仅限于经细胞因子刺激的骨髓和ucb细胞[8-20,23,27],而且通过去除细胞因子进一步加剧了该负面影响[35]。在与逐渐丧失植入潜能相关的长期离体培养期间,表达fas的cd34+祖细胞部分对自发性细胞凋亡显示出过度敏感性[12,13],然而,这种现象与fas受体交联无关[28,31]。已表明,移植后祖细胞在体内保持对细胞凋亡的固有抗性,从而使对细胞凋亡不敏感的祖细胞优先植入到被搞糟的骨髓环境中[28],其中被搞糟的骨髓环境是由移植前调节所造成的损伤导致的。祖细胞的这种特性使得它们成为免疫细胞的有效替代物,用于进行免疫调节,以减轻体内介导排斥反应的宿主抗移植物(hvg)的同种免疫应答,这是通过fasl膜蛋白的异位表达来实现的[36,37]。
技术实现要素:
本发明涉及通过活化tnf家族受体,来改进造血细胞的植入。与死亡受体的活化不利于造血祖细胞的植入和功能这一传统观念相反的是,本发明人证实了,对受体介导的细胞凋亡具有固有抗性的祖细胞中的那些受体的诱导活性。离体暴露于fas-配体、tnf-α和trail以及它们的组合,增加了scid小鼠中的定量异嵌合性(quantitativexenochimerism)并且改善了体内骨髓重建。在培养物中,还证明了骨髓祖细胞活性的诱导。对于新鲜的脐带血和经低温保存的动员外周血,示出了具体实施例,以证明造血祖细胞的活化包括普通来源的供体细胞移植物,并且与储存无关。活化不同来源的祖细胞所需的时间和配体浓度是不同的,并且进行了相应优化。根据本发明,使供体造血移植物暴露于用于祖细胞活化的tnf超家族配体,以实现优秀的定量和定性的植入和重建。
因此,在本发明的第一方面,本发明提供了一种增加干细胞和祖细胞(spc)在需要进行spc移植的受体内的植入的方法,所述方法包括:
a.使从供体获得的生物样品与tnf超家族的至少一个成员或其任意片段或衍生物进行离体接触,所述生物样品包括spc的群;以及
b.在所述接触步骤(a)之后,将所述spc移植到所述受体内;
其中,移植的所述spc显示出增加的植入。
另一方面,本发明提供了用于移植方法的细胞的群,其中,所述细胞为具有增加的植入特性的干细胞和祖细胞(spc),其中,通过使从供体获得的生物样品与tnf超家族的至少一个成员或其任意片段或衍生物进行离体接触,来获得所述具有增加的植入特性的spc的群,所述生物样品包括spc的群。
附图说明
图1a为示出小鼠的存活率的曲线图(n=20),该小鼠植入有在培养基中孵育且预暴露于500ng/mltrail的细胞。在此,超过4周的时长中并没有额外的死亡。图1b为示出与250ng/mlfasl嵌合蛋白、20ng/mltnfα及其组合预孵育的细胞的受体的存活率的曲线图(n=20)。图1c为示出在移植后3周,在对应实验组(每组中n=6)中供体嵌合体的水平的图解。图1d为示出小鼠中的品系嵌合体的曲线图,该小鼠植入有预暴露于代表gr-1+骨髓细胞、cd4+和cd8+t细胞以及b220+b淋巴细胞的死亡配体。
图2a为演示实验开始的示意图。图2b为示出了通过用人抗-cd45的单克隆抗体对新鲜的ucb(n=27),移植前在培养基中孵育24、48和72小时的ucb(n分别=12、10、5),在具有fasl的培养基中孵育24、48和72小时的ucb(n分别=8、8、8),在具有tnf-α的培养基中孵育24、48和72小时的ucb(n分别=7、7、5),以及在具有trail的培养基中孵育24、48和72小时的ucb(n分别=7、8、9)进行染色,所确定的人类嵌合体百分比的图解。图2c为示出了利用物种特异性cd45对鼠科动物骨髓中的人类细胞嵌合体进行代表性测量的示意图。
图3a为在移植后12周,在鼠科动物骨髓中,由人类ucb细胞发育出的谱系的示意图。在移植前,移植细胞与20ng/mltnf-α进行预孵育:cd34+和阴性(lin-)祖细胞系、cd3+t细胞、cd19+b淋巴细胞、cd33+骨髓细胞。图3b为示出了在细胞移植后12周,骨髓中的人类细胞植入百分比的柱状图,其中细胞与50ng/mlfasl预孵育48小时、与20ng/mltnf和1.5μg/mltrail预孵育48(每组中n=7~12)。图3c为示出在预暴露于死亡配体(含有cd14+单核细胞)24~48小时后的定性植入的示意图(每组中n=4~7)。绘制出了增加的骨髓单细胞部分。
图4a是示出了与对照和经tnf-α处理的ucb细胞相比,在首次受体(primaryrecipient)和二次受体(secondaryrecipient)中的植入百分比的图解。图4b是示出了在经tnf或对照(培养基)处理24小时或48小时的ucb细胞的受体中,骨髓集落数目的柱状图。
图5a为在培养基中、具有50ng/mlfasl或1.5μg/mltrail的培养基中孵育后的ucb细胞中,fas、tnf受体和trail受体的分数表达的示意图(每组中n=5~9)。图5b为示出了在与fasl、tnf-α和trail孵育48小时后,单核(mnc)ucb细胞、cd34+和阴性祖细胞系(lin-)的增殖指数的图解(每组中n=4~7)。右图是利用modfit模拟软件测量来自cfse稀释的增殖的指示图。图5c为示出了在与配体孵育48小时后,cd34+和lin-祖细胞中的细胞周期时相的柱状图。右图为利用碘化丙啶测量dna含量的指示图(每组中,n=4~7)。
图6a为演示实验开始的示意图。图6b为示出了对于新鲜的ucb(对照),和在培养基中孵育后以及在具有死亡配体的培养基中孵育24~72小时(在每个时间点,n=6~14)之后,每103铺板细胞表示的骨髓集落形成的柱状图。图6c为示出了在cd34+祖细胞中,fas表达百分比的柱状图(n=9)。图6d为示出了在甲基纤维素培养物中,骨髓祖细胞活性的柱状图(n=7~15)。
图7a为示出了在新鲜的样品中,以及与各配体孵育后,fas表达%的柱状图(n=29新鲜的,n=11孵育的);图7b为示出了在新鲜的样品中,以及与配体tnf-rl(n=7新鲜的,n=5孵育的)和tnf-r2(n=12新鲜的,n=10孵育的)中的每一种孵育后,fas表达%的柱状图图;图7c为示出了在新鲜的样品中,以及与配体trail-r1(dr4,n=9)和trail-r2(dr5,n=8)中的每一种孵育后,fas表达%的柱状图。图7d至图7f为受体串扰(cross-talk)以及被同源配体诱导的结果的示意图:图7d为受体的诱导表达,图7e为细胞增殖的衰减,图7f为基于膜下信号传导通路的示意图的细胞凋亡。
图8a为示出了在培养基和含配体的培养基中孵育之后,移植了11个mpb样品,然后通过人类抗cd45染色,所确定的人类供体嵌合体的累积水平的图解(每个实验组中,n=9~17只小鼠)。图8b为在移植后12周,宿主骨髓中谱系的分数分布的示意图,其中包括:cd34+和阴性祖细胞系(lin-)、cd3+t细胞、cd19+b淋巴细胞和cd33+骨髓细胞(在每组中,n=4~7)。
图9a为示出了cfu/103mpb细胞的数目的柱状图。图9b为示出了与配体孵育4小时和16小时后,大骨髓集落(>50个细胞)和小骨髓集落(30~50个细胞)的分配的柱状图。
具体实施方式
本发明涉及利用tnf家族受体的信号传导,来诱导干细胞和祖细胞的活化。因为细胞凋亡机制在所有细胞(包括最原始的干细胞和祖细胞)中都是高度保守的,所以该通路用于进行营养性(trophic)信号传导。根据本发明,在移植前,将造血细胞移植物暴露于tnf家族受体的配体的各种组合,以诱导它们随后在体内的活性。
本发明基于以下的新发现:干细胞和祖细胞(spc),尤其是造血干细胞和造血祖细胞(hspc)上的tnf家族受体在移植前的活化,通过促进造血祖细胞的植入和重建而改进了移植的结果。尽管每一单独的受体在造血干细胞和造血祖细胞的相对少的部分中表达,但是在约50%的新鲜脐带血(ucb)祖细胞中发现了这些受体。因此,联合活化具有影响显著一部分祖细胞的活性的能力。结果证明了,tnf家族受体活化足以体内诱导造血祖细胞的活性。
此外,在没有额外的细胞因子和生长因子的情况下,利用tnf家族配体持续相对短的时间段,进行tnf家族受体的活化。对于移植物(其通常不包括支持因子和刺激因子)的移植前制备的情况,该方法是可行的。
此外,本发明与移植物制剂的细胞凋亡介导的机制不同,其中移植物制剂细胞凋亡介导的机制,使用祖细胞对细胞凋亡的抗性,来消除产生gvhd的细胞凋亡敏感的亚群并且排除来自自体移植物的残余恶性细胞。未来实现祖细胞的营养性移植前活化,暴露时间、配体浓度以及活化受体的性质不同于基于祖细胞对细胞凋亡的不敏感性来对组细胞进行功能性阴性选择(wo2007/138597)。
脐带血是造血干细胞和造血祖细胞的丰富来源,脐带血的应用使得通过移植来治疗恶性疾病和非恶性疾病发生指数增加。ucb作为供体细胞源的主要限制是:低于成人受体移植所需阈值的,较少数量的祖细胞;以及,缓慢植入,该缓慢植入延长了再生障碍以及宿主暴露于感染的危险期延长。对于这些限制所提出的解决方案包括:共移植数个脐带单元(cordunit),以及对祖细胞进行离体扩增。本发明人先前已经证明了,与基于表型标记物(cd34、cd133)进行的分离相比,对细胞凋亡具有抗性的ucb祖细胞的功能性选择,增加了它们的有效数目。此外,消除变得对细胞凋亡敏感的分化细胞,通过赋予未定向的细胞凋亡-不敏感前体优点,而提高了ucb祖细胞的离体扩增产量。
本发明提供了一种通过移植前活化祖细胞来缩短植入时间的额外途径,这是持续的且引起定量和定性的造血细胞重建加速。
造血祖细胞的另一常见来源是动员外周血(mpb),该外动员外周血(mpb)基于利用动员剂刺激骨髓后,通过血浆分离法收集的单个核细胞。本发明人先前已经证明了,对来自mpb移植物的t淋巴细胞和b淋巴细胞进行功能性阴性选择,显著降低了gvhd严重性,同时维持了gvt活性[38]。该程序通过保留具有降低的gvhd能力的t细胞的植入物促进效果,而显著提高了植入效率。
本发明提供了一种通过移植前活化祖细胞,来增强定量和定性的mpb细胞植入的额外途径。
先前已经提出了,祖细胞免于发生细胞凋亡是归因于,转导细胞凋亡和抑制信号的tnf家族受体的低水平表达[8-10]。支持性证据是,通过阻断抗体和可溶性fasl而明显保护造血细胞[14-16],其通过防止fas三聚化而发挥抗细胞凋亡效果[2]。体外实验已经证明了,tnf-α通过诱导细胞凋亡[19,20]而对经细胞因子活化的造血细胞[17,18]产生不利影响,这是通过与其同源受体的直接相互作用以及间接上调fas受体介导的[8-10]。在所有这些研究中,在与显著的表型和功能性变化相关的离体条件下[23],包括通过与tnf-α受体串扰来诱导fas表达[12,16,18],使用各种细胞因子和趋化因子培养细胞,持续不同的时段。已经认为细胞功能的变化是tnf家族受体的不利影响造成的,从而导致归巢受损、细胞周期的诱导以及植入潜力的丧失[24-27]。这些数据表明,尤其在移植背景中,fas和tnf受体的中和可能有益于造血细胞的功能,因为这一通路参与了移植物抗宿主疾病。
另一方面,在归巢且接种到受体骨髓内之后不久,就在供体细胞中观察到几种tnf家族受体发生剧烈上调。在应力条件下,最原始的造血干细胞和造血祖细胞普遍上调fas受体[28]、tnf受体[29]以及肿瘤坏死因子相关的凋亡诱导配体(trail)受体[30]。通过缺乏fas受体[31]和tnf受体[29]的祖细胞的有缺陷的植入和长期重建的可能性,突出了这些受体的生理学意义。
通过活化和死亡的机制、不可逆的负调控的主要机制,严格调控细胞活性。控制细胞活力的细胞凋亡机制是在所有细胞中都表达的高度保守的通路,但是,干细胞和祖细胞在很大程度上对受体介导的细胞凋亡具有抗性。已经证明了,在移植后,tnf家族受体表达上调的鼠科造血祖细胞在很大程度上对细胞凋亡信号不敏感[28,29]。这些数据已延伸至,源自对fas(研究中)、tnf-r1[32]和trail-r1[30]介导的细胞凋亡具有抗性的脐带血(ucb)和动员外周血(mpb)的人类祖细胞。
与现有技术相比,本发明涉及在移植之前,使造血干细胞和造血祖细胞暴露于tnf超家族的配体,以通过活化至少一部分移植的细胞来改进移植的结果。不希望受到理论的限制,该效果涉及由tnf超家族受体介导的营养性刺激。活化fas-配体、tnf-α以及trail的受体中的每一种或它们的组合,来增强定量和定性的造血细胞重建。对tnf超家族受体进行离体的移植前活化,能够调节祖细胞在体内的后续行为,从而根据活化受体的移植前的存活时间和类型,增强早期造血重建并且培养特定谱系。根据移植物的来源、抗原差异、供体接种物大小(祖细胞的数目),特定环境中受体的病症以及预期发病率,可变地设置配体的性质和浓度,组合,以及暴露的持续时间。受体可能在使用配体对其进行活化之前或同时,被上调。
因此,在本发明的第一方面中,本发明提供了一种增加干细胞和祖细胞(spc)植入需要进行spc移植的受体内的方法,所述方法包括:
a.使从供体获得的生物样品与tnf超家族的至少一个成员或其任意片段或衍生物进行离体接触,所述生物样品包括spc的群;以及
b.在所述接触步骤(a)之后,将所述spc移植到所述受体内;
其中,移植的所述spc显示出增加的植入。
另一方面,本发明提供了用于移植方法的细胞的群,其中,所述细胞为具有增加的植入特性的干细胞和祖细胞(spc),其中,通过使从供体获得的生物样品与tnf超家族的至少一个成员或其任意片段或衍生物进行离体接触来获得所述具有增加的植入特性的spc的群,所述生物样品包括spc的群。
在具体实施方式中,所述spc为造血干细胞和造血祖细胞(hspc)。
如本文中所使用的,表述“增加干细胞和祖细胞(spc)的植入”指,细胞移植的效率、质量或速度(rapidity)得到改进,或加快了定量和定性的造血重建,这可通过使细胞暴露于tnf超家族成员之一且被活化来实现。例如,增加的植入包括提高骨髓、淋巴、血小板或红细胞的重建或活性。用于测定细胞植入的方法包括,例如,细胞迁移和其它体外技术,以及如下面详细描述的生物样品(例如血液样品)的组织学、免疫学和/或放射性测定法。
如本文所使用的,术语“离体”指如下过程:将从活生物体(优选人类)中以生物样品的形式取出的细胞,保持在生物体外(例如,在测试烧瓶中)并且可选地进行增殖。
如本文中所使用的,表述“细胞的群”指细胞的同种隔离群或异种隔离群。“spc的群或hspc的群”分别指干细胞和祖细胞的同种隔离群或异种隔离群,或者造血干细胞和造血祖细胞的同种隔离群或异种隔离群。
如本文所使用的,术语“干细胞和祖细胞”指,在组织和身体中生成细胞团的最早期的可再生细胞群;以及非常早期的祖细胞,其中该非常早期的祖细胞更分化一些,但是还没有定向并且能容易地恢复成最早期可再生细胞群的一部分。
如本文所使用的,术语“造血干细胞和造血祖细胞”指,用于生成所有血细胞系的干细胞和祖血细胞。
在一些实施方式中,可通过干细胞标记物,诸如cd34+、cd34+/cd38-、cd133+、cd34+/lin-或本领域中已知的其它干细胞标记物来识别干细胞。
spc的来源可以是脐带血(ucb)、动员外周血(mpb)或骨髓。即,在具体实施方式中,包括spc的群或hspc的群的生物样品选自由脐带血(ucb)、动员外周血(mpb)或骨髓所组成的组。
制备用于移植的细胞的方法是本领域所熟知的。利用无菌过程,取出组织(例如,脐带血和骨髓抽吸物)。可将制备的用于移植的细胞维持在生理溶液中,或培养在悬浮液中或培养在固定基底上。能支持细胞的合适的培养基包括hem、dmem、rpmi、f-12等。如果需要,培养基可包含细胞代谢所需的补充剂,如谷氨酰胺和其它氨基酸、维生素、矿物质、转铁蛋白等。培养基还可包含诸如青霉素、链霉素、庆大霉素等抗生素,以防止被酵母、细菌和真菌污染。在培养中,条件应接近生理条件(优选,ph为约6至约8,温度为约30℃至约40℃,优选约37℃)。
可根据本领域已知的任意方法获得来自脐带血(ucb)的细胞,例如,在正常足月分娩后(收到知情同意书后),获得来自ucb的细胞。例如,可根据rubinstein等人(pnasusa1995;92(22):10119-10122),在产后24小时内收集并冷冻样品。在使用前,细胞可在含2.5%人血清白蛋白的葡聚糖(dextran)缓冲液中解冻,层叠在聚蔗糖-泛影葡胺(ficoll-hypaque)梯度上,并以800×g离心30分钟。可收集界面层中的单个核的细胞,并用含0.5%hsa的磷酸盐缓冲盐水(pbs)洗涤三次。
所述生物样品可为新收获的、经保存的或经低温保存的。可通过本领域已知的任意方法,对新鲜或经培养的细胞制剂进行低温保存,直至需要使用这些细胞制剂。可将细胞悬浮在含特定低温保存剂的等渗溶液,优选细胞培养基中。这样的冷冻保存剂包括二甲亚砜(dmso)、甘油等。用于移植的细胞的制备和保存的其他方法在本领域中是已知的,并详细公开在例如移植手册(handbookoftransplantation)(kipshidze和serruys编辑,伦敦,uk,2004)中。
在具体实施方式中,所述增加的植入包括提高骨髓、淋巴、血小板或红细胞的重建或活性。
“肿瘤坏死因子(tnf)超家族”目前由人类中的19种配体和29种受体,以及在小鼠中识别的3种额外的tnf超家族受体组成。大多数tnf配体是ii型跨膜蛋白,可通过特定的金属蛋白酶对它们的胞外结构域进行剪切,以生成可溶性细胞因子。tnf超家族配体的受体为低聚的i型或iii型跨膜蛋白。tnf超家族的成员包括4-1bb/tnfsf9、april/tnfsf13、baff/blys/tnfsf13b、cd27配体/tnfsf7、cd30配体/tnfsf8、cd40配体/tnfsf5、eda/外异蛋白、eda-al/外异蛋白al、eda-a2/外异蛋白a2、fas配体/tnfsf6、gitr配体/tnfsf18、light/tnfsf14、淋巴毒素、淋巴毒素β/tnfsf3、淋巴毒素-α/tnf-β、ox40配体/tnfsf4、tl1a/tnfsf15、tnf-α、trail/tnfsf10、trance/tnfsf11/rankl、tweak/tnfsf12。
该家族中的所有受体和配体都显示出显著的结构同源性(~85%)。而且,具有不同活性的末端介导配体与同源受体的选择性结合,且在家族内不发生交叉活化。tnf具有两种同源受体;并且,trail具有四种膜相关的受体以及一种可溶性受体,这些受体中的三种(包括可溶性受体)被认为是与配体结合,但不进行信号转导的诱饵受体。在tnf家族中,fas被认为是细胞凋亡的共同执行者,与家族的其它成员相比,fas表现出几种独特特征[1,2]。fas的活化需要受体三聚化,因此fasl的活性异构型(isoform)在生理条件下是与膜结合的,并且需要进行接合以生成用于药物用途的低聚物。fasl的可溶性异构型具有抗细胞凋亡活性,因为不发生三聚化的fas的连接阻断了细胞凋亡信号转导。
在具体的实施方式中,所述tnf超家族的至少一个成员选自由fas配体(fasl)、肿瘤坏死因子α(tnf-α)以及肿瘤坏死因子相关的凋亡诱导配体(trail)所组成的组。
在具体的实施方式中,所述生物样品为ucb,并且,步骤(a)的所述接触持续约18小时至约48小时。
在另一具体的实施方式中,所述生物样品为骨髓,并且,步骤(a)的所述接触持续约12小时至约32小时。
在另一具体的实施方式中,所述生物样品为mpb,并且,步骤(a)的所述接触持续约3小时至约18小时。
在具体的实施方式中,利用浓度在约10ng/ml至约20ng/ml之间的tnf-α,和/或浓度在约10ng/ml至约50ng/ml之间fasl,和/或浓度在约500ng/ml至约1500ng/ml之间trail,孵育所述spc。
在具体的实施方式中,在没有任何额外的细胞因子、趋化因子和生长因子的情况下,利用tnf超家族的至少一个成员或其任意片段或衍生物来孵育spc。
如本文中使用的,术语tnf超家族成员的“片段或衍生物”指,相对于如上所限定的提高的植入,蛋白中保留完整蛋白活性的任意部分。
在具体的实施方式中,所述tnf超家族的至少一个成员与表面(例如,珠子)接合。所述接合可经由接头进行。
在具体的实施方式中,所述tnf超家族的至少一个成员为tnf-α和fasl的组合。
如在下文实施例中所证明的,在有限稀释条件下,使源自小鼠骨髓的祖细胞在移植前暴露于tnf家族的配体,改善了受体的存活率。另外,利用每种配体对祖细胞进行活化,都大大改善了定量和定性的造血细胞重建。这些数据证明了tnf家族受体(经暴露于tnf家族的配体),能够活化鼠科祖细胞并且增强初期植入,从而拯救了受辐照的小鼠。
在移植之前,移植前暴露于tnf家族的配体改善了人类ucb和mpb细胞的定量植入。scid重建细胞(src)被认为是与人类重建细胞(hrc)有关的,人类细胞的最可靠的替代测定。然而,人体细胞样本间的广泛变异性以及在各小鼠中植入的生物变异性,是该测定的显著缺点。此外,在细胞因子和生长因子的小鼠-人部分相容性的条件下,人类细胞进行发育。因此,使用相对大量的人类样品(65ucb单元)(每个样品被植入3至7个受体内),来进行死亡配体对植入影响的比较分析。如在下文实施例中所示出的,tnf家族受体在移植前的活化,使新鲜的ucb细胞以及经低温保存的mpb样品得到了优秀的定量植入。总体而言,使人类细胞在移植前暴露于tnf超家族的配体,改善了scid异嵌合体中的定量人类细胞植入。
在移植前暴露于tnf家族的配体,调节了人类ucb和mpb细胞的定性植入。b淋巴细胞和骨髓细胞为在scid小鼠中,由人类祖细胞发育的第一人类细胞系。如实施例中所示,在利用tnf家族的配体孵育的ucb细胞的受体中,提高了b淋巴细胞的部分并且证实了优秀的骨髓植入。因此,得到改善的定量植入是早期植入和增强的祖细胞功能的结果。此外,tnf家族受体在移植前活化的时间调控节了造血祖细胞功能的质量。
通过tnf受体的连接来活化造血祖细胞,在鼠科细胞和人类细胞中涉及相同通路。如在实施例中所证实的,如通过优秀的定量和定性植入阐明的,活化在体内持续。该证据指出,增强的植入和早期祖细胞活性是由tnf超家族受体的活化介导的。
与骨髓和动员外周血相比,脐带血是造血祖细胞的丰富来源。与107mpb细胞相比,在移植了ucb细胞的小鼠中,高频率的src在优秀水平的人类嵌合体中是明显的。脐带血移植的主要限制是,祖细胞的数目低以及植入的速度慢。ucb祖细胞由于其幼稚性
本发明适用于在任意类型的移植中,即,不同来源的供体细胞以及受体的多变条件。在移植之前,经常估计可能的并发症,从而对移植物临床相关性进行移植前调节。植入的时间是移植的重要参数之一,显著地影响感染的易感性,在发育不全期间对输注的需要,在血小板回复前不能被治疗的出血及静脉闭塞。
预计移植后给予g-csf,能在通过tnf家族受体连接对祖细胞进行移植前活化之后,更有效地促进供体细胞的植入。
动员外周血为广泛用于肿瘤移植的细胞的有效来源,其受限于由成熟供体t细胞介导的潜在致命性gvhd。除了通过功能性缺失细胞凋亡敏感性t细胞来降低gvhd严重性之外[36,38],所提及的方法很可能通过增大植入,来影响移植物抗肿瘤反应性。由于肿瘤细胞的无限制生长,因此移植期间的免疫抑制时段是危险的。
通过二次移植实验来阐明祖细胞活化的真实性质。由祖细胞活化所带来的问题之一是,其是否通过使具有短期和长期造血细胞重键能力的祖细胞发生分化。而导致消失。首次scid受体的骨髓中阴性细胞系的相反降低,伴随着b淋巴细胞和骨髓子代的增加。然而,由于首次受体中优秀的定量重建,后续二次受体的重建也得到了改善。不希望受理论的束缚,这些结果表明,tnf家族受体通过祖细胞活化,而不是通过消减,来改善植入。
如先前所示,通过与刺激因子,诸如粒细胞巨噬细胞集落刺激因子(gm-csf)和干细胞因子(scf)的协同作用,诱导祖细胞以参与克隆活性[29,30]。在鼠科细胞中,这些信号是由fas、tnf-r1和trail-r2(唯一的鼠科trail受体)介导的[29-31]。一致地是,在培养物中持续存在的配体的营养性信号,与生产因子协同作用,以刺激人类ucb和mpb样品的活性[36,38]。这些信号主要由tnf-r1和trail-r1介导,并且对fas具有较小的阳性影响。同时,tnf家族配体在终末分化的子代中用作负性调节子,减小集落的大小以及各个受体间的显著差异[29-31]。人类细胞的这些替代测验的一个显著限制是,凋亡细胞对集落发育具有负性影响,而该负性影响通过死亡配体在敏感细胞中诱导凋亡而被扩大[29,31]。因此,由于即使利用纯化的祖细胞开始培养,分化的子代也变得对细胞凋亡敏感,所以培养中配体的真实营养性效果由于内在因子而被低估。
通过从首次受体的骨髓中收获的细胞的骨髓集落的数目增加,来示例根据本发明的干细胞和祖细胞活化的机制。即使在移植后12周,利用tnf-α预处理的细胞的受体中,克隆活性也是增加。该体外测定与体内增强的骨髓活性一致,并且验证了体内增强的骨髓活性。因此,通过tnf超家族受体进行移植前活化的祖细胞,具有持续的移植后结果。
进行体外克隆测定,以验证在体内观察到tnf家族受体连接的结果。半固体甲基纤维素培养物中的克隆活性反映了,与经诸如scf、il-3和gm-csf的生长因子刺激的scid重建细胞相比的,祖细胞的更加定向的亚群的活性。该克隆测定很大程度上确定了在利用tnf家族配体短期孵育ucb和mpb后,活性增强。这些数据证实了通过tnf家族受体刺激定向的造血祖细胞。重要的是,由于培养物中包含大量的死亡细胞,所以在此进行的克隆测定低估了tnf家族受体的真实的诱导效果。死细胞的存在大大抑制了半固体培养物中的克隆活性[32]。这些测定证实了直接营养性效果,并且不同于通过去除死亡细胞得到的存活群内的增加的祖细胞频率[33,34]。
随着成熟过程,分化的造血细胞获得对细胞凋亡信号传导的敏感性,同时,tnf家族受体成为负调节的主要体内平衡机制。这从存在死亡配体的培养物中,集落尺寸减小可以清楚看到[29-32]。然而,如下文实施例中所示,在mpb祖细胞预活化之后,tnf-α的诱导活性在较大的集落中是明显的。配体不存在于培养物中,因此不对分化的子代施加负调节。
如下文实施例中所示,通过在利用tnf家族配体进行短期孵育时段结束时的分析,来显示祖细胞的一些特性。受体的活化不影响有丝分裂休眠细胞的部分。这些细胞含有src亚群[24-26]。此外,受体的活化不诱导cd34+祖细胞和阴性ucb祖细胞系的增殖。这些数据证明,tnf家族受体活化祖细胞活性,而不使它们数目扩增或诱导增殖。
与传统理念相反[8-10,17-22,27],阐明了tnf家族受体的活化不会对造血祖细胞存活力和功能带来有害后果。之前报道了tnf家族受体对造血细胞功能有有害影响的研究,通过补充和去除生长因子和支撑趋化因子,在体外刺激祖细胞[12,13,16-21,27,35]。如在本发明中所示,设计实验以模拟临床环境,其中,在移植之前,不刺激祖细胞也不补充支撑趋化因子。与现有技术相比,本发明的发明人发现祖细胞中的tnf受体活化具有营养性活性。数据表明了,受体介导的信号传导诱导持续转导活化且支配后续祖细胞功能的营养性途径。
如下文所示,尽管小部分的新鲜的ucb细胞中表达各受体,但是约50%的祖细胞对通过受体之一进行的信号传导有应答。在人类细胞中的营养性受体为具有tnf-r2的未知活性的tnf-r1[32],和具有trail-r2的拮抗活性的trail-r1[30]。
本发明考虑了以下要素:a)活化的靶受体,b)配体的浓度,c)受体连接以实现祖细胞活化的持续时间,d)受体表达的调节,以及e)应用的配体的组合。
下文中的非限制性实施例示出了fas受体、tnf受体和trail受体的活化。这些受体中的每一种在造血祖细胞中均展示出营养性活性。在鼠科细胞中,对于最佳浓度的配体,三种受体的活化具有类似的结果。在变型中,在ucb源和mpb源的人类细胞中,tnf-r1和trail-r1的诱导活性比fas更有效。用于人类祖细胞活化的配体的有效浓度在以下范围内:fasl10~50ng/ml,tnf-α10~20ng/ml,和trail500~1500ng/ml(悬浮浓度为1~5×l07细胞/ml)。
暴露于配体的持续时间不同。ucb细胞孵育18小时至48小时,骨髓细胞孵育12小时至32小时,mpb孵育3小时至18小时。用于营养性信号传导的孵育时段是不同的,并且通常比用于祖细胞的功能性阴性选择的暴露时间长。人类细胞在移植前的孵育时段受限于动态表型变化,这些细胞进行培养并且在离体培养三天后丧失植入潜能。如下文中实施例所示,,ucb祖细胞在离体培养72小时后丧失植入潜能,与tnf家族受体介导的细胞凋亡信号传导无关。因此,总的目的是最大限度地缩短培养时段。如上详述,孵育时间也决定了淋巴分化和骨髓分化的优先诱导。
使用tnf家族配体的组合,提供了对移植前孵育条件组成进行调整和个别处理的机会。一种这样的组合是fasl和tnf-α,显示了如每一种配体类似的营养性活性。
通过调节受体表达,祖细胞对细胞凋亡的抗性提供了对tnf家族配体各成员的应答模式进行调节的机会。例如,在应用同源配体之前或在应用同源配体之时,可通过干扰素-γ上调fas受体和tnf受体。调节受体表达的模式能够减弱祖细胞的应答。作为促进植入的方法,若干种配体的使用允许在不同的移植背景下,对来自各种来源的细胞的预处理具有一定程度的灵活性。值得注意的是,在tnf家族受体与配体之间没有交叉反应,并且每个分子仅限于其同源受体。
除了由同源配体直接活化之外,诱导串扰还增加各种受体的倾向性。如在下文实施例中所示,tnf-α对fas表达的得到充分表征的诱导效果[8,12]是通过两种tnf受体介导的。此外,公开了额外的诱导相互作用:fas诱导trail-r1的表达;并且trail诱导trail-r1和trail-r2两者的表达。受体串扰的功能性结果包括:响应于fas串扰,诱导表达trail-r1和trail-r2的祖细胞增殖;以及,共表达fas和tnf-r2的细胞发生额外的细胞凋亡。然而,fas与tnf-r1或trail-r1的联合表达不增加对细胞凋亡的易感性。事实上,fas在~40%的cd34+ucb中的经tnf-α诱导的表达,以及通过fasl的交联不损害半固体培养物中的骨髓祖细胞的刺激。总而言之,下文给出数据阐明了tnf家族受体之间的显著串扰,其与造血祖细胞中的细胞凋亡信号传导是分开的。
不同配体的影响之间所存在的差异,使得可以使用混合物,来获得针对各种来源的造血细胞的特定亚群的可变结果。然而,其他因素也可能影响所确定的配体的最优组合,作为移植相关的因素的若干实例诸如,供体-受体的hla错配程度,abo血型不相容性,可用于移植的细胞和祖细胞的绝对数目(近似阈值为5×l06cd34+细胞/kg),活性恶性疾病(急性转化期)相对微小残留病变(1:10,000恶性细胞)和完全缓解,在中性粒细胞和淋巴细胞的移植后阶段中可能被再活化的早先存在的感染(例如cmv、ebv、水痘、疱疹),持续慢性gvhd(例如在先前未成功的移植之后),急性gvhd(例如,半相合移植)的风险,宿主对植入物的抗性(例如范可尼贫血)。将类似的标准应用到自身免疫性疾病,其可以是主要的异常骨髓(例如风湿性关节炎)或淋巴样细胞病因(例如1型糖尿病、多发性硬化、系统性红斑狼疮、炎症性肠病)。
实施例
实施例1:鼠科骨髓离体暴露于死亡配体改善了祖细胞的功能
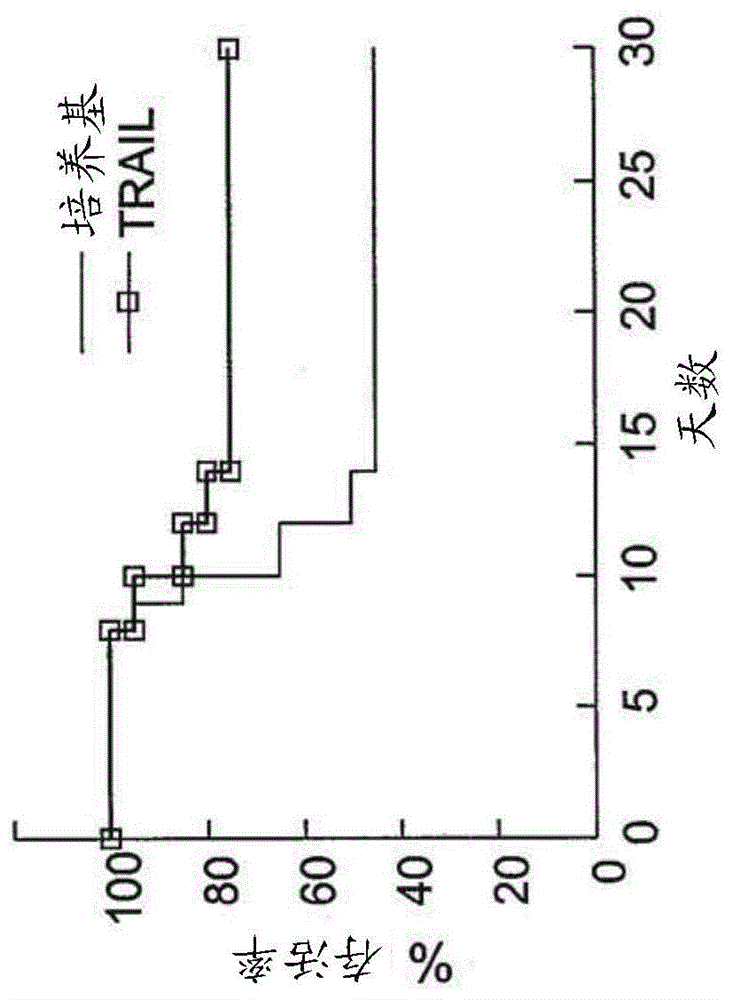
本实施例证明了在移植前,tnf家族受体活化对源自鼠科骨髓的祖细胞植入的影响。在死亡配体的存在下,在培养基中孵育18小时之后,将1.5×105阴性同源系(cd45.1→cd45.2)祖细胞系植入经850拉德(rad)tbi调节的受体小鼠中。由于大部分细胞孵育受到死亡细胞内容物的污染,这降低了祖细胞的克隆活性[29,31],所以在有限稀释移植物之前,使分离的阴性祖细胞系暴露于死亡配体。通过移植临界数目的细胞,即1.5×105的源自同源骨髓的lin-祖细胞,得到了~50%的小鼠存活率。经trail(图1a)、fasl和tnf-α(图1b)持续18小时预刺激1.5×105lin-祖细胞的移植,大大改善了优秀的存活率。此外,联合暴露于tnf-α以诱导fas受体表达,以及经fasl引起的受体交联,在有限稀释移植中得到同等优秀的存活率(图1b)。这些数据阐明了,在移植前,利用死亡配体短期刺激鼠科骨髓细胞,对有限稀释条件下改善存活率的程度具有生理学显著意义。
为了在几种可能机制中验证受体活化对植入的诱导效果,在混合嵌合体中监控了供体细胞的发育。预暴露于死亡配体任一种或者预暴露于tnf-α和fasl组合的受体细胞,在移植三周后显示出升高水平的供体嵌合性(图1c)。为了完善死亡受体活化对混合嵌合体中的子代的诱导效果,对骨髓前体的子代进行免疫分型。骨髓植入物在移植后3周时是稳定的,这最有可能是通过这些移植条件下的饱和值造成的(图1d)。在变型中,淋巴部分的cd4+和cd8+t细胞存在小幅度下降,而b淋巴细胞显著增加。由于b细胞为在移植后发育的第一淋巴细胞系,因此这些数据清楚地表明受体活化对祖细胞功能具有诱导效果。
实施例2
ucb细胞移植前离体暴露于死亡配体增强了植入
ucb细胞的明显限制为祖细胞的数目低,以及这些无髓经历的细胞的植入速度缓慢。在培养基(没有补充趋化因子)以及具有50ng/mlfasl、20ng/mltnf-α和1,500ng/mltrail的培养基中,孵育新鲜的脐带血单元不同的时间段(1~3天)。将等量的初始细胞植入利用25μg/g白消安调节的免疫缺陷nod.scid小鼠中。为了进行比较,以新鲜或经培养基孵育的,以及暴露于死亡配体后的形式,植入来自同一ucb单元的细胞。在鼠科骨髓中,在移植后12周进行读数(图2a)。来自9个脐带血单元(每个脐带血用于3个实验组中的3至6只小鼠的移植)的移植实验总体表明:与单独的培养基相比,移植前持续24小时至48小时暴露于fasl、tnf-α和trail,具有增加的嵌合性的趋势(图2b)。对于利用tnf-α进行的预孵育,示出了鼠科骨髓中的人类嵌合性的示范测量值。当ucb细胞预暴露于与链霉亲和素连接的缺失金属蛋白酶剪切位点的fasl的截短亚型时,也得到了类似结果[28,31,37]。重要的是,tnfα诱导fas受体表达(见下文),但是与fasl的联合孵育不损害人类异种嵌合性(xenochimerism)的增强。超过两天的ub细胞孵育与植入效力的显著下降相关,而与配体的存在无关。这些数据证实了,通过移植前暴露于tnf超家族的死亡配体,引起了定量ucb细胞植入的增强。
实施例3
移植前使ucb细胞移暴露于死亡配体改善了定性的骨髓重建
根据与感染的易感性降低相关的外周循环中稳定存在的粒细胞(>500细胞/dl),来确定临床环境中的植入的时间。为了评价死亡配体在体内对ucb祖细胞的影响,测定了鼠科骨髓中人类造血细胞系。示出的实施例是,利用tnf-α预处理的细胞显示出在对人类细胞的门控(gate)中,主要是b淋巴细胞子代,并具有较少的t细胞发育(图3a)。根据图2a中示出的条件,对小鼠进行植入。ucb细胞在移植前预暴露于死亡配体调节了植入模式,并伴随增加的骨髓单核细胞子代(p<0.05)以及增加的b淋巴细胞嵌合性(这是在nod.scid小鼠中发育的第一人类造血细胞系)(p<0.01,图3b)。人类祖细胞活性的诱导与鼠科骨髓中阴性人类细胞系的数目的相反下降(p<0.005)是一致的。值得注意的是,在ucb细胞孵育48小时后,观察到最显著的诱导效果,并且该最显著的诱导效果在体内植入12周的长时间内持续存在(图3c)。这些数据证明了,在移植前经死亡配体诱导之后,体内的初期人类骨髓祖细胞活性和b淋巴祖细胞活性增强。scid重建细胞(src)被认为与短期人类重建细胞的活性的相关性最好。
实施例4
增强的祖细胞活性改善了二次重建
scid重建细胞的活化可能会导致人类祖细胞的消减并且损害植入的持久性。然而,与对照培养基相比,通过持续24小时和48小时预暴露于tnf-α,科鼠骨髓中人类cd34+细胞的绝对含量在移植后12周分别增加了34±30%(非显著性)和21%±24%(非显著性)。因此,在二次受体中的植入功能测定中,进一步测定了在首次受体中植入的人类细胞。根据图1a中示出的条件,对首次受体进行植入。在第一阶段中,通过将首次受体的骨髓内容物移植入二次受体中,以确定tnf-α对带来持久性重建的祖细胞的影响。在移植后12周,将在培养基和在具有tnf-α的培养基中预孵育24小时的ucb细胞的首次受体的股骨细胞内容物的一半,植入经白消安调节的二次nod.scid小鼠中。与在培养基中预孵育24小时的5.3±3.1×l05人类cd34+(非显著性)相比,利用tnfα预孵育的细胞的首次受体的股骨细胞内容物的一半含3.2±1.4×l05人类cd34+细胞。12周后,测量骨髓中的人类异嵌合性(每组6只小鼠中,3个ucb单元)。将股骨细胞内容物的一半移植入二次nod.scid受体内展现出:在预暴露于tnf-α之后,人类嵌合性水平增加(p<0.05,图4a),从而证实了细胞因子对人类祖细胞没有有害影响。在第二阶段中,在体外,在经人类细胞因子刺激的甲基纤维素培养物中,进一步测定了体内骨髓中骨髓表型的明显增加。在经人类scf、il-3和gm-csf刺激的半固体甲基纤维素测定的试验结束点,测定源自首次受体骨髓的相等数目的cd34+人类祖细胞。使预孵育24小时(n=6,来自3个ucb单元)和48小时(n=7,来自3个ucb单元)的ucb细胞的受体集落,相对于在培养基(标准化的)中预孵育的细胞的受体中测量的克隆活性进行标准化。证实了在持续24小时和48小时暴露于tnf-α后,骨髓克隆活性增加(图4b)。增加的祖细胞数目和增强的骨髓再生,指由于离体暴露于tnf-α(作为示例性配体)而被提高的ucb祖细胞的有效自我更新。
实施例5
ucb细胞预孵育的影响的表征
在下一阶段,我们对在移植前孵育期间以及暴露于tnf家族配体期间,ucb细胞的一些特性进行了表征。配体对ucb细胞的影响取决于同源受体的表达。在fasl和trail的可变影响下,在培养基中孵育48小时的ucb细胞中,所有的受体都以相对低的水平表达(图5a)。以下详述tnf-α的影响。与液体培养物中的大部分阳性ucb细胞系相比,暴露于任一种配体均并不诱导增殖,cd34+和阴性祖细胞系都具有缓慢的周期(图5b)。同样地,配体不影响细胞周期,其中约50%的阴性祖细胞系处于g0/g1期,而仅非常少量的cd34+祖细胞处于有丝分裂休眠中(图5b)。由于src(和人类重建细胞)的活性受限于有丝分裂休眠的祖细胞的亚群,所以这种模式与保守的且增强的植入一致[24-26]。
实施例6
ucb暴露于死亡配体使半固体培养物中骨髓祖细胞的活性增强
在经scf、il-3和gm-csf刺激的半固体甲基纤维素培养物中,进一步确定利用tnf家族配体预孵育的ucb细胞对骨髓祖细胞活性的影响(图6a)。使ucb细胞持续1至3天暴露于50ng/ml的fasl、20ng/ml的tnf-α和1500ng/ml的trail。为了确定祖细胞刺激,无论是否存活(即,不去除死细胞),将相等数目的总预孵育的细胞铺在半固体甲基纤维素培养物上。用粒细胞-巨噬细胞集落刺激因子(gm-csf)、白介素-3(il-3)和干细胞因子(scf)刺激培养物。与新鲜细胞以及在对照培养基中孵育的细胞相比,持续48小时暴露于所有配体的ucb细胞刺激了半固体培养物中骨髓祖细胞的活性(图6b)。为了比较分析,在暴露于配体之后,将同一ucb样品与新鲜的细胞或对照细胞一样进行铺板。尽管src活性显著降低,但是一个例外是:利用trail孵育72小时后,具有增强的克隆活性(图2b)。持续48小时暴露于tnf-α的ucb细胞,上调了~50%的cd34+ucb祖细胞中的fas表达(图6c)。由于tnf-α为fas表达的有效诱导物,我们对该诱导对祖细胞活性的影响在体外进行了测定。联合暴露于50ng/mlfasl和20ng/mltnf-α的ucb细胞,同样对骨髓祖细胞活化是有效的,与fasl和tnf-α各自单独的影响相当(图6d)。这些数据证实了,tnf诱导的fas表达不使祖细胞对细胞凋亡敏感,但他们的效果是冗余的,而不是加合或协同的。这些体外数据符合并且解释了tnf家族配体在体内对骨髓祖细胞的刺激效果。
实施例7
tnf家族受体的串扰(cross-talk)
虽然tnf家族受体在克隆测定中显示出冗余的活性,但是它们的不同影响可能需要应用活化配体的组合,以完成不同的任务。在本实施例中,测定了受体之间诱导性串扰的存在,其可能对细胞凋亡和营养性影响敏感。检测液体培养物中死亡受体表达的动态变化。利用50ng/mlfasl、20ng/mltnf-α和1.5μg/mltrail持续72小时孵育单个核的ucb细胞,并在利用每一配体孵育后,通过对新鲜样品中的cd34+祖细胞进行门控来确定受体的表达。如在先前的研究[8,12]中所阐明的,tnf-α是诱导cd34+ucb祖细胞中的fas表达的唯一配体(图7a)。与配体对tnf受体表达没有影响(图7b)不同,fasl在祖细胞中诱导了trail-r1的显著表达(图7c)。此外,trail诱导其自身的受体,这可能在72小时的长时间孵育后引起持续的阳性影响(图6b)。综上所述,在两种tnf受体和fas之间均观察到了显著的串扰(图7d),而只有tnfr2诱导的fas导致对fasl介导的细胞凋亡的易感性增加,而tnfr1诱导的fas表达在很大程度上没有促细胞凋亡活性(图7f)。另一相互作用是fas诱导的trail-r1表达(图7d),其不具有促细胞凋亡结果并且不诱导表达两种受体的细胞的增殖(图7e)。这些相互作用限定了,通过诱导性串扰活化受体所介导的影响的性质。
实施例8
mpb细胞暴露于死亡配体提高了植入
为了验证死亡配体的影响不是ucb细胞的选择性特性,利用经低温保存的动员外周血(mpb)进行实验。使经低温保存的mpb细胞解冻,并利用50ng/mlfasl、20ng/mltnf和1500ng/mltrail孵育4小时。为了进行比较分析,将来自同一mpb单元的细胞在未经处理(解冻)或在培养基中孵育之后,以及暴露于配体之后进行植入。将总共107的细胞(没有去除死细胞)移植到经白消安调节的nod.scid小鼠中(如图2a所示),并且在12周后对骨髓进行分析。这些样品通过如下方式来获得:通过g-csf动员5天,并且通过提取法来收集单个核的细胞。利用dmso冷冻这些样品,并且该样品在解冻后含有~15%的死细胞。与ucb细胞移植相比(图8a),移植入经白消安调节的nod.scid小鼠中(图2a)显示出显著较低水平的供体嵌合性。但是,利用fasl和tnf-α(而不是在单独的对照培养基中)在移植前孵育细胞,大幅度增加了人类异嵌合性的水平。在移植后12周,对鼠科骨髓的分析表明:在经fasl和tnf-α预处理的细胞(该细胞利用配体预孵育4小时或16小时)的受体中,人类b淋巴细胞显著增加(图8b),其是在异嵌合体中人类细胞分化的早期主要的细胞系。这些数据证明了,tnf家族受体的离体活化调节,被动员到外周血并且经冷冻保存的人类造血细胞的定量和定性的植入。
实施例9
mpb细胞暴露于死亡配体增强了骨髓祖细胞的功能
在半固体培养物中,在骨髓祖细胞测定中,额外分析了死亡配体的影响。使经低温保存的mpb细胞解冻,并利用死亡配体(50ng/mlfasl和20ng/ml)孵育4小时和16小时。将总细胞(不去除死细胞)数目相等的细胞铺在经gm-csf、il-3和scf(n=5~11)刺激的甲基纤维素培养物中(图6a)。利用fasl和tnf-α短暂孵育4小时,集落数目小幅度上升,而在孵育16小时后,集落数目显著增加(图9a)。骨髓祖细胞活化的另一明显证据是tnf-α诱导了集落大小的增加(图9b)。并不奇怪的是,由于前体的发育受到体内和体外不同环境的影响,所以死亡配体对祖细胞活化的结果对祖细胞功能具有不同的结果。这些数据证明了,死亡配体对被动员至外周血的骨髓祖细胞的活性具有营养性效果。
参考文献
1.aggarwalbb.signallingpathwaysofthetnfsuperfamily:adouble-edgedsword.natrevimmunol.2003;3:745-756.
2.askenasyn,yolcues,yanivi,shirwanh.fas-ligandasadouble-edgedimmunomodulatortoinducetransplantationtolerance.blood2005;105:1396-1404.
3.dempseypw,doylese,hejq,chengg.thesignallingadaptorsandpathwaysactivatedbytnfsuperfamily.cytokinegrowthfactorrev2003;14:193-209.
4.warecf.thetnfsuperfamily.cytokinegrowthfactorrev2003;14:181-184.
5.demariar,testau,luchettil,zeunera,stassig,pelosie,riccionir,fellin,samoggiap,peschlec.apoptoticroleoffas/fasligandsystemintheregulationoferythropoiesis.blood.1999;93:796-803.
6.gauru,aggarwalbb.regulationofproliferation,survivalandapoptosisbymembersofthetnfsuperfamily.biochempharmacol.2003;66:1403-1408.
7.testau.apoptoticmechanismsinthecontroloferythropoiesis.leukemia.2004;18:1176-1199.
8.maciejewskij,selleric,andersons,youngns.fasantigenexpressiononcd34+humanmarrowcellsisinducedbyinterferongammaandtumornecrosisfactoralphaandpotentiatescytokine-mediatedhematopoieticsuppressioninvitro.blood1995;85:3183-3190.
9.takenakak,nagafujik,haradam,mizunos,miyamotot,makinos,gondoh,okamurat,nihoy.invitroexpansionofhematopoieticprogenitorcellsinducesfunctionalexpressionoffasantigen(cd95).blood.1996;88:2871–2877.
10.nagafujik,shibuyat,haradam,mizunos,takenakak,miyamotot,okamurat,gondoh,nihoy.functionalexpressionoffasantigen(cd95)onhematopoieticprogenitorcells.blood.1995;86:883-889.
11.sahekik,fujimoriy,takemotoy,kakishitae.increasedexpressionoffas(apo-1,cd95)oncd34+haematopoieticprogenitorcellsafterallogeneicbonemarrowtransplantation.brjhaematol.2000;109:447
12.bryderd,ramsfjellv,dybedali,theilgaard-
13.youngjc,link,travism,hansteeng,abitorabia,sirenkoo,murrayl,hillb.investigationintoanengraftmentdefectinducedbyculturingprimitivehematopoieticcellswithcytokines.cytotherapy.2001;3(4):307-20.
14.barcenaa,muenchm,songks,ohkubot,harrisonmr.roleofcd95/fasanditsligandintheregulationofthegrowthofhumancd34++cd38-fetallivercells.exphematol.1999,27:1428-1439.
15.josefsend,myklebustjh,lynchdh,stokket,blomhoffhk,smelandeb.fasligandpromotescellsurvivalofimmaturehumanbonemarrowcd34+cd38-hematopoieticprogenitorcellsbysuppressingapoptosis.exphematol.1999;27:1451-1459.
16.dybedali,yangl,bryderd,aastrand-grundstromi,leanderssonk,jacobsense.humanreconstitutinghematopoieticstemcellsup-regulatefasexpressionuponactivecellcyclingbutremainresistanttofas-inducedsuppression.blood2003;102:118-126.
17.broxmeyerhe,williamsde,lul,coopers,andersonsl,beyergs,hoffmanr,rubinby.thesuppressiveinfluencesofhumantumornecrosisfactorsonbonemarrowhematopoieticprogenitorcellsfromnormaldonorsandpatientswithleukemia:synergismoftumornecrosisfactorandinterferon-gamma.jimmunol1986;136:4487-4495
18.dybedali,bryderd,fossuma,rustenls,jacobsense.tumornecrosisfactor(tnf)-mediatedactivationofthep55tnfreceptornegativelyregulatesmaintenanceofcyclingreconstitutinghumanhematopoieticstemcells.blood.2001;98:1782-1791.
19.jacobsenfw,rothem,rustenl,goeddeldv,smelandeb,veibyop,
20.zhangy,haradaa,bluethmannh,wangjb,nakaos,mukaidan,matsushimak.tumornecrosisfactor(tnf)isaphysiologicregulatorofhematopoieticprogenitorcells:increaseofearlyhematopoieticprogenitorcellsintnfreceptorp55-deficientmiceinvivoandpotentinhibitionofprogenitorcellproliferationbytnfalphainvitro.blood.1995;86:2930-2937
21.cauxc,favrec,saelands,duvertv,durandi,mannonip,banchereauj.potentiationofearlyhematopoiesisbytumornecrosisfactor-alphaisfollowedbyinhibitionofgranulopoieticdifferentiationandproliferation.blood.1991;78:635-644.
22.theusjw,justusrs,theussa.acorrelationbetweengrowthrate,apoptosis,andtumornecrosisfactor-alphainumbilicalcordbloodcellsinfectedwithtwostrainsofmycobacteriumtuberculosis.transfusion2009;49:1720-1727.
23.danetgh,leehw,luongojl,simonmc,bonnetda.dissociationbetweenstemcellphenotypeandnod/scidrepopulatingactivityinhumanperipheralbloodcd34(+)cellsafterexvivoexpansion.exphematol2001;29:1465-1473.
24.gothota,vanderloojcm,clappdw,srouref.cellcycle–relatedchangesinrepopulatingcapacityofhumanmobilizedperipheralbloodcd34cellsinnon-obesediabetic/severecombinedimmunedeficientmice.blood.1998;92:2641–2649.
25.glimmh,ohih,eavescj.humanhematopoieticstemcellsstimulatedtoproliferateinvitroloseengraftmentpotentialduringtheirs/g(2)/mtransitanddonotreenterg(0).blood.2000;96:4185–4193.
26.jetmorea,plettpa,tongx,wolberfm,breeser,abonourr,orschell-traycoffcm,srouref.homingefficiency,cellcyclekinetics,andsurvivalofquiescentandcyclinghumancd34cellstransplantedintoconditionednod/scidrecipients.blood.2002;99:1585–1593.
27.liub,buckleysm,lewisid,goldmanai,wagnerje,vanderloojc.homingdefectofculturedhumanhematopoieticcellsinthenod/scidmouseismediatedbyfas/cd95.exphematol.2003;31:824-832.
28.pearl-yafem,yolcues,steinj,kaplano,shirwanh,yanivi,askenasyn.expressionoffasandfas-ligandindonorhematopoieticstemandprogenitorcellsisdissociatedfromthesensitivitytoapoptosis.exphematol2007a;35:1601-1612.
29.pearl-yafem,mizrahik,steinj,yolcues,kaplano,shirwanh,yanivi,askenasyn.tumornecrosisfactorreceptorssupportmurinehematopoieticprogenitorfunctionintheearlystagesofengraftment.stemcells.2010;28:1270-1280.
30.mizrahik,steinj,pearl-yafem,kaplano,yanivi,askenasyn.regulatoryfunctionsoftrailinhematopoieticprogenitors:humanumbilicalcordbloodandmurinebonemarrowtransplantation.leukemia.2010;24:1325-1334
31.pearl-yafem,steinj,yolcues,farkasdl,shirwanh,yanivi,askenasyn.fastransducesdualapoptoticandtrophicsignalsinhematopoieticprogenitors.stemcells2007b;25:3194-203
32.mizrahik,steinj,yanivi,kaplano,askenasyn.tnf-αhastropicratherthanapoptoticactivityinhumanhematopoieticprogenitors:involvementoftnfreceptor-1andcaspase-8.stemcells.2013jan;31(1):156-66.
33.askenasyn,mizrahik,ashs,askenasyem,yanivi,steinj.depletionof
34.mizrahik,yanivi,steinj,askenasyn.apoptoticsignalingthroughfasandtnfreceptor-1amelioratesgvhdinmobilizedperipheralbloodgrafts.bonemarrowtransplant.2013;inpress
35.wangls,liuhj,xiazb,broxmeyerhe,lul.expressionandactivationofcaspase-3/cpp32incd34(+)cordbloodcellsislinkedtoapoptosisaftergrowthfactorwithdrawal.exphematol2000;28:907–915.
36.whartenbyka,straleyee,kimh,rackef,tanavdev,gorskiks,chengl,pardolldm,civinci.transductionofdonorhematopoieticstem-progenitorcellswithfasligandenhancedshort-termengraftmentinamurinemodelofallogeneicbonemarrowtransplantation.blood.2002;100:3147-3154.
37.pearl-yafem,yolcues,steinj,kaplano,yanivi,shirwanh,askenasyn.fasligandenhanceshematopoieticcellengraftmentthroughabrogationofalloimmuneresponsesandnonimmunogenicinteractions.stemcells2007c;25:1448-1455.
- 还没有人留言评论。精彩留言会获得点赞!