适用于MassARRAY质谱平台Iplex分析的肺癌相关基因的突变检测试剂盒的制作方法
适用于massarray质谱平台iplex分析的肺癌相关基因的突变检测试剂盒
技术领域
1.本发明涉及一种生物技术领域,特别是涉及一种适用于massarray质谱平台iplex分析的肺癌相关基因的突变检测试剂盒。
背景技术:
2.肺癌是发病率和死亡率增长最快,对人群健康和生命威胁最大的恶性肿瘤之一。近50年来许多国家都报道肺癌的发病率和死亡率均明显增高,男性肺癌发病率和死亡率均占所有恶性肿瘤的第一位,女性发病率占第二位,死亡率占第二位。肺癌有不同的组织学类型,如鳞癌、腺癌等。此外,肿瘤有不同的发展时期,如早期、中期、晚期。更重要的是,肺癌有不同的驱动基因,而每个驱动基因代表不同的肿瘤生物学行为(包括肿瘤的生长方式、扩散转移等)。调查发现,60%—70%的肺癌患者确诊时即为晚期。如果确诊时就为晚期肺癌,这时患者已经丧失手术或放射治疗的机会。这种病人在以前只能做化疗,而现在事实表明,化疗如果不加以选择,效果并不是很好,因为肺癌不是一种疾病,而是由不同致病基因组成的一组疾病。因此,晚期肺癌患者需要做基因检测,清楚自己是哪种驱动基因引起的肺癌,例如有没有egfr基因突变、alk融合基因突变、ros1融合基因突变等。等到明确肺癌的分子病理特征后,再进行针对性治疗,这时的疗效将非常好。
3.总而言之,现在治疗肺癌,尤其晚期肺癌,不但要清楚是什么组织类型的肺癌,还要清楚肺癌的分子病理特征,这时基因检测就尤为重要。
4.目前,关于肺癌的基因检测研究还并不深入。
技术实现要素:
5.鉴于以上所述现有技术的缺点,本发明的目的在于提供一种适用于massarray质谱平台iplex分析的肺癌相关基因的突变检测试剂盒,用于解决现有技术中缺乏有效的关于肺癌的基因检测的问题。
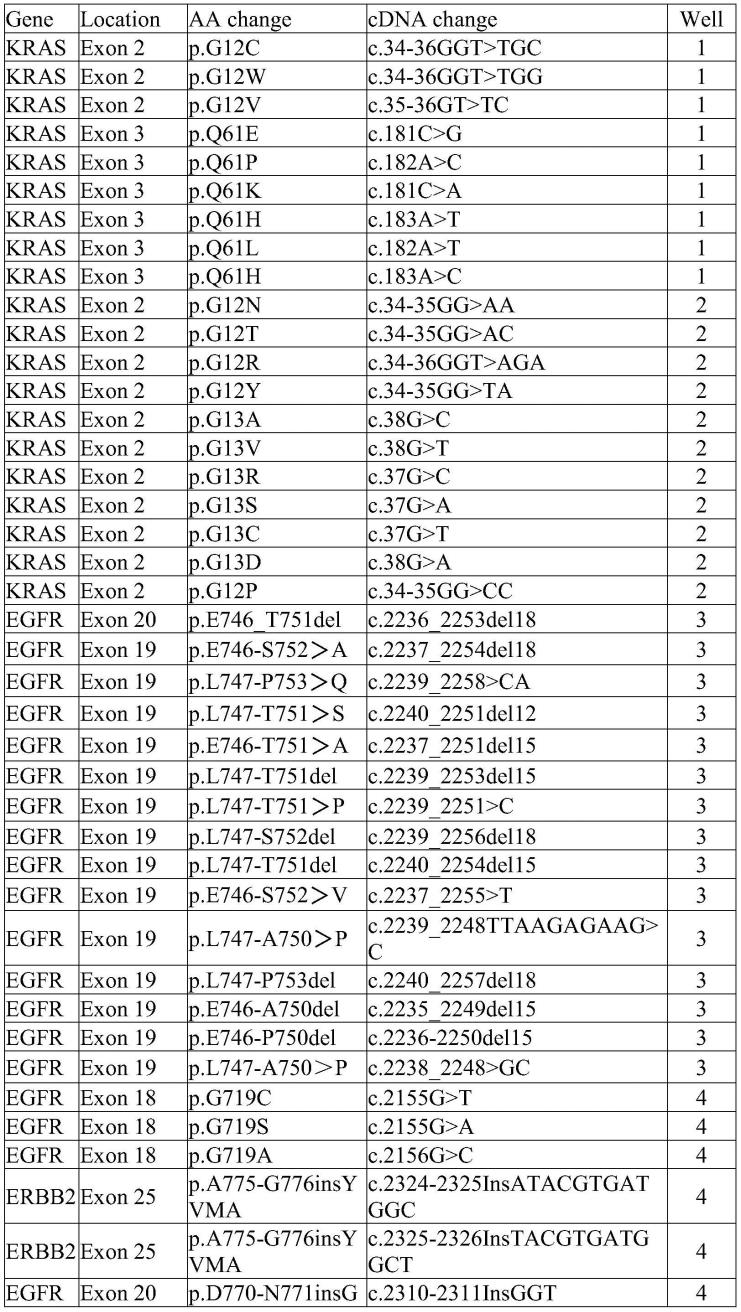
6.本发明可适用于massarray质谱平台iplex分析的肺癌相关九个基因,基因包括alk、egfr、braf、met、erbb2、kras、nras、pik3ca、和pten。所述检测试剂盒针对的位点如表1。
7.表1检测位点
8.9.[0010][0011]
本发明一方面提供了用于检测肺癌的检测试剂,所述检测试剂包括alk基因突变检测引物组、egfr基因突变检测引物组、braf基因突变检测引物组、met基因突变检测引物组、erbb2基因突变检测引物组、kras基因突变检测引物组、nras基因突变检测引物组、pik3ca基因突变检测引物组、和pten基因突变检测引物组中任一种或几种;所述alk基因突
变检测引物组包括基因alk扩展引物和延伸引物,所述egfr基因突变检测引物组包括基因egfr扩展引物和延伸引物,所述braf基因突变检测引物组包括基因braf扩展引物和延伸引物,所述met基因突变检测引物组包括基因met扩展引物和延伸引物,所述erbb2基因突变检测引物组包括基因erbb2扩展引物和延伸引物,所述kras基因突变检测引物组包括基因kras扩展引物和延伸引物,所述nras基因突变检测引物组包括基因nras扩展引物和延伸引物,所述pik3ca基因突变检测引物组包括基因pik3ca扩展引物和延伸引物,所述pten基因突变检测引物组包括基因pten扩展引物和延伸引物。
[0012]
进一步地,所述几种可以是两种、三种、四种、五种、六种、七种、八种或九种。
[0013]
进一步地,所述扩展引物选自以下任一组或几组:
[0014]
(1)seqid no.1-seq idno.4;(2)seqid no.5-seq idno.6;(3)seqid no.7-seq idno.8;(4)seqid no.9-seq idno.14;(5)seqid no.15-seq idno.20;(6)seqid no.21-seq idno.26;(7)seqid no.27-seq idno.36;(8)seqid no.37-seq idno.46;(9)seqid no.47-seq idno.50;(10)seqid no.51-seq idno.56;(11)seqid no.57-seq idno.64;
[0015]
所述延伸引物选自以下任一组或几组:
[0016]
(12)seqid no.65-seq idno.71;(13)seqid no.72-seq idno.79;(14)seqid no.80-seq idno.88;(15)seqid no.89-seq idno.95;(16)seqid no.96-seq idno.103;(17)seqid no.104-seq idno.111;(18)seqid no.112-seq idno.118;(19)seqid no.119-seq idno.125;(20)seqid no.126-seq idno.128;(21)seqid no.129-seq idno.135;(22)seqid no.136-seq idno.142。
[0017]
10、其中,(1)所述alk基因突变检测引物组中,基因alk扩展引物序列如seqid no.21、22、23、24、27、28、29、30所示,延伸引物序列如seqid no.104、105、106、107、109、110、111、112、113、114、118所示;(2)所述egfr基因突变检测引物组中,基因egfr扩展引物序列如seqid no.7、8、9、10、11、12、15、16、17、18所示,延伸引物序列如seqid no.80、81、82、83、84、85、86、87、88、89、90、91、92、94、96、97、98、99、100所示;(3)所述braf基因突变检测引物组中,基因braf扩展引物序列如seqid no.31、32、33、34所示,延伸引物序列如seqid no.116、117所示;(4)所述met基因突变检测引物组中,基因met扩展引物序列如seqid no.35、36、51、52所示,延伸引物序列如seqid no.115、130、135所示;(5)所述erbb2基因突变检测引物组中,基因erbb2扩展引物序列如seqid no.13、14所示,延伸引物序列如seqid no.93、95所示;(6)所述kras基因突变检测引物组中,基因kras扩展引物序列如seqid no.1、2、3、4、5、6、19、20、57、58所示,延伸引物序列如seqid no.65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、101、102、103、137、138、140所示;(7)所述nras基因突变检测引物组中,基因nras扩展引物序列如seqid no.37、38、47、48、49、50、55、56所示,延伸引物序列如seqid no.124、126、127、128、131、133所示;(8)所述pik3ca基因突变检测引物组中,基因pik3ca扩展引物序列如seqid no.25、26、41、42、43、44、45、46、53、54、59、60、61、62、63、64所示,延伸引物序列如seqid no.108、120、121、122、123、125、129、132、134、136、139、141、142所示;(9)所述pten基因突变检测引物组中,基因pten扩展引物序列如seqid no.39、40所示,延伸引物序列如seqid no.119所示。进一步地,上述扩展引物和延伸引物分别形成11组,分别为:
[0018]
组合1:seqid no.1-seq idno.4和seqid no.65-seq idno.71;
no.80-seq idno.88;(15)seqid no.89-seq idno.95;(16)seqid no.96-seq idno.103;(17)seqid no.104-seq idno.111;(18)seqid no.112-seq idno.118;(19)seqid no.119-seq idno.125;(20)seqid no.126-seq idno.128;(21)seqid no.129-seq idno.135;(22)seqid no.136-seq idno.142。
[0046]
如上所述,本发明的适用于massarray质谱平台iplex分析的肺癌相关基因的突变检测试剂盒,具有以下有益效果:
[0047]
检测灵活,可对9个基因中任意单个或多个位点进行检测,有效的降低了检测成本;检测周期短,三天即可得到检测结果;与一代测序、arms-pcr、数字pcr相比检测通量的优势明显;检测灵敏度和特异性高;检测可选样本类型多,包括组织、胸水、石蜡切片、血浆cfdna。
附图说明
[0048]
图1显示为本发明检测方法示意图。
[0049]
图2显示为本发明点样仪参数设置图。
[0050]
图3显示临床样本kras基因3号外显子p.q61k/e处的突变为阴性。
[0051]
图4显示阴性质控品kras基因2号外显子p.g12v处的突变为阴性。
[0052]
图5显示临床样本kras基因2号外显子p.g12v处的突变为阴性。
[0053]
图6显示临床样本kras基因2号外显子p.g12v处的突变为阳性。
[0054]
图7显示2019年上海临床检验质量控制中心第一次室间质评braf基因突变结果报告,其中编号为1911的样本结果为野生型,编号为1912、1913、1914、1915的样本检测结果为v600e突变。该结果和上海临检中心的结果相符。
[0055]
图8显示2019年上海临床检验质量控制中心第一次室间质评中egfr基因突变结果报告,其中编号为1911的样本结果为野生型,编号为1912、1913、1914、1915的样本检测结果依次为t790m、e746_a750del、s768i、l858r突变。该结果和上海临检中心的结果相符。
[0056]
图9显示2019年上海临床检验质量控制中心第一次室间质评中kras基因突变结果报告,其中编号为1912的样本结果为野生型,编号为1911、1913、1914、1915的样本检测结果依次为q61h、g12d、g12a、g13d突变。该结果和上海临检中心的结果相符。
[0057]
图10显示2019年上海临床检验质量控制中心第一次室间质评中pik3ca基因突变结果报告,其中编号为1915的样本结果为野生型,编号为1911、1912、1913、1914的样本检测结果依次为e545k、e542k、h1047r、e545k突变。该结果和上海临检中心的结果相符。
[0058]
图11显示2019年上海临床检验质量控制中心第二次室间质评中braf基因突变结果报告,其中编号为1922的样本结果为野生型,编号为1921、1923、1924、1925的样本检测结果为v600e突变。该结果和上海临检中心的结果相符。
[0059]
图12显示2019年上海临床检验质量控制中心第二次室间质评中egfr基因突变结果报告,其中编号为1925的样本结果为野生型,编号为1921、1922、1923、1924的样本检测结果依次为g719s、g719s、t790m、e746_a750del突变。该结果和上海临检中心的结果相符。
[0060]
图13显示2019年上海临床检验质量控制中心第二次室间质评中kras基因突变结果报告,其中编号为1925的样本结果为野生型,编号为1921、1922、1923、1924的样本检测结果依次为q61h、g12a、g12d、g13d突变。该结果和上海临检中心的结果相符。
[0061]
图14显示2019年上海临床检验质量控制中心第二次室间质评中nras基因突变结果报告,其中编号为1921、1922、1925的样本结果为野生型,编号为1923、1924的样本检测结果依次为exon2-g13r/g12c/g12v/g23a/g13v和exon2-g13d突变。该结果和上海临检中心的结果相符。
[0062]
图15显示2019年上海临床检验质量控制中心第二次室间质评中pik3ca基因突变结果报告,其中编号为1923的样本结果为野生型,编号为1921、1922、1924、1925的样本检测结果依次为e542k、e545k、e545k、h1047r突变。该结果和上海临检中心的结果相符。
[0063]
图16显示2020年上海临床检验质量控制中心第一次室间质评中braf基因突变结果报告,其中编号为2013的样本结果为野生型,编号为2011、2012、2014、2015的样本检测结果为v600e突变。该结果和上海临检中心的结果相符。
[0064]
图17显示2020年上海临床检验质量控制中心第一次室间质评中egfr基因突变结果报告,其中编号为2014的样本结果为野生型,编号为2011、2012、2013、2015的样本检测结果依次为t790m、e746_a750del、l861q、l858r突变。该结果和上海临检中心的结果相符。
[0065]
图18显示2020年上海临床检验质量控制中心第一次室间质评中kras基因突变结果报告,其中编号为2012的样本结果为野生型,编号为2011、2013、2014、2015的样本检测结果依次为q61h、g12v、g13d、g12d突变。该结果和上海临检中心的结果相符。
[0066]
图19显示2020年上海临床检验质量控制中心第一次室间质评中nras基因突变结果报告,其中编号为2012和2015的样本结果为野生型,编号为2011、2013、2014的样本检测结果依次为exon3-q61r/q61k/q61l/q61h、exon2-g13d、exon2-g12d/g12s突变。该结果和上海临检中心的结果相符。
[0067]
图20显示2020年上海临床检验质量控制中心第一次室间质评中pik3ca基因突变结果报告,其中编号为2015的样本结果为野生型,编号为2011、2012、2013、2014的样本检测结果依次为h1047r、e542k、e545k、h1047r突变。该结果和上海临检中心的结果相符。
具体实施方式
[0068]
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
[0069]
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
[0070]
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等molecular cloning:a laboratory manual,second edition,cold spring harbor laboratory press,1989and third edition,2001;ausubel等,current protocols in molecular biology,john wiley&sons,new york,1987and periodic updates;the series methods in enzymology,academic press,san diego;wolffe,chromatin structure and function,third edition,academic press,san diego,1998;methods in enzymology,vol.304,chromatin(p.m.wassarman and a.p.wolffe,eds.),academic press,san diego,1999;和methods in molecular biology,vol.119,chromatin protocols(p.b.becker,ed.)humana press,totowa,1999等。
[0071]
本方法选取了九个肺癌的驱动基因,运用massarray平台进行基因检查测。检测包含9种基因,69个位点共计186种基因型。如下:
[0072]
表2
[0073][0074][0075]
具体突变位点见表1。
[0076]
sequenom snp检测系统基本原理为基质辅助激光解吸电离飞行时间质谱(maldi-tof ms)技术。主要特点是,pcr扩增后的产物,加入snp序列特异延伸引物,在snp位点上,延伸1个碱基。然后将制备的样品分析物与芯片基质共结晶,将该晶体放入质谱仪的真空管,而后用瞬时纳秒(10-9
s)强激光激发,由于基质分子经辐射所吸收的能量,导致能量蓄积并迅速产热,从而使基质晶体升华,核酸分子就会解吸附并转变为亚稳态离子,产生的离子多为单电荷离子,这些单电荷离子在加速电场中获得相同的动能,进而在一非电场漂移区内按照其质荷比率加以分离,在真空小管中飞行到达检测器。maldi产生的离子常用飞行时间(time-of-flight,tof)检测器来检测,离子质量越小,就越快到达。理论上讲,只要飞行管长度足够,tof检测器可检测分子的质量数是没有上限的。massarray snp检测的质谱范围为5000到8500dalton。
[0077]
与其他方法相比,本方法具有以下优点:基于中国人自己的大数据及权威tcga数
据库,完整覆盖肺癌相关热点突变(突变/插入/缺失/融合),涵盖nccn指南推荐的肺癌靶向用药靶点;检测灵活,可对9个基因中任意单个或多个位点进行检测,有效的降低了检测成本;检测周期短,三天即可得到检测结果;与一代测序、arms-pcr、数字pcr相比检测通量的优势明显;检测灵敏度和特异性高;检测可选样本类型多,包括组织、胸水、石蜡切片、血浆cfdna。
[0078]
实施例1肺癌多基因检测试剂和检测方法
[0079]
(1)确定肺癌的驱动基因如下
[0080]
表3
[0081][0082]
具体位点见表1。
[0083]
采用以下pcr反应体系以及引物扩增样本,所述样本来源于患者病灶位置的新鲜组织、石蜡包埋组织、石蜡切片、肺泡灌洗液等经过核酸提取得到的dna。
[0084]
表4 pcr反应体系
[0085][0086]
表5引物信息及pcr引物mix的配置
[0087]
[0088][0089]
以well 1为例,单条引物稀释至100um,四条引物各取10ul,然后补水至终体积为1000ul配置成pcr引物mix。引物mix中每条引物的终浓度为1um。
[0090]
反应程序:
[0091]
step1:95℃5min;
[0092]
step 2:92℃35s,
[0093]
step 3:60℃35s,
[0094]
step 4:72℃40s;
[0095]
step 5:go to step 2for 35cycles;
[0096]
step 6:72℃7min;
[0097]
step 7:8℃永久。
[0098]
(2)pcr产物纯化
[0099]
2.1实验前先将磁珠从冰箱中取出,室温放置至少10分钟(恢复室温),漩涡震荡,使其充分混匀。向pcr产物中每孔加入50μl混匀的磁珠,封膜,再次漩涡震荡混匀,瞬时离心,静置2min。
[0100]
2.2将混有磁珠的pcr产物(96孔板)放至96孔磁力架上,静置3min。使用200μl的排枪插入管底吸弃废液,注意枪头不要触碰到周围的磁珠。
[0101]
注:若使用的磁力架磁铁为环形的,则磁珠会被吸附在管壁上,形成环圈,离心管中心为废液,吸液时要注意不可触碰到磁珠环圈;若使用的磁力架磁铁被固定在底部或某一端的,则磁珠会被吸附在管底一侧,形成斜面,吸液时要注意枪头不可触碰到磁珠沉淀,且吸液时力度要轻,切不可有吹打的动作。
[0102]
2.3(不分离磁力架)每孔加200μl80%乙醇,静置3min,吸弃废液。
[0103]
2.4重复步骤3.3一次。
[0104]
2.5(不分离磁力架)处置离心管底的痕量液体:
[0105]
2.5.1当样本量较少时,使用200μl排枪,套上中号枪头,再套上小号枪头吸干废液(不同样本间需更换小枪头);
[0106]
2.5.2当样本量较多时,使用真空泵将残留废液吸干(真空泵每两周清洁维护一次)。当使用真空泵吸废液时,待压力稳定在10kpa左右时开始吸液操作。吸液前,软管上套上大枪头,再依次套上中号、小号枪头,最后使用小号枪头执行吸液操作。吸液结束后静置1min,让痕量乙醇充分挥发干净。
[0107]
2.6分离磁力架,每孔加入30μl灭菌水洗脱,封膜,漩涡震荡混匀,离心,室温静置2-3min,重新放回磁力架,静置2-3min,从中转移20μl洗脱液至洁净的八联管或96孔板中。
[0108]
3.i plex反应配置
[0109]
3.1 mixa体系配制
[0110]
表6
[0111][0112]
3.2 iplex体系配制
[0113]
表7
[0114][0115]
3.3 mixa+iplex混合液
[0116]
表8
[0117]
试剂名称单一反应加入体积(μl)n个反应加入体积(μl)mixa11
×
(1+n)iplex1.061.06
×
(1+n)延伸引物mix0.940.94
×
(1+n)总体积3.00n/a
[0118]
使用1.5ml的ep管将上述表格配制好的mixa+iplex混合液体系漩涡震荡后瞬时离心。
[0119]
3.4终反应体系配制
[0120]
表9
[0121][0122][0123]
按上表配置好的mixa+iplex混合液加入3ul体系至384孔板中,将纯化结束后pcr产物转移6μl至加入延伸引物mix混合液3ul体系的384孔板中,瞬时离心,封膜,用刮板将整个板子推紧,震荡离心,进行iplex反应,程序如下:(注:封膜一定要贴严实,避免封膜不牢,使试剂蒸发,进而导致实验失败。)
[0124]
表10
[0125][0126]
表11延伸引物序列及组合
[0127]
[0128]
[0129][0130]
4脱盐、上机
[0131]
4.1洁净树脂(resin)以每孔6mg的量铺平在384dimple plate上,风干5-10min。注:新开封的树脂风干需要10min,使用过半的树脂风干需要5min。
[0132]
4.2向每个样本孔里加入16μl水(18.2超纯水),封膜,瞬离。
[0133]
4.3轻轻的将384孔板凌空翻转,放在已铺有树脂的dimple plate上,注意对齐,然后再将dimple plate连同384孔板一起翻转,让树脂自然掉落到样本孔中。
[0134]
注:翻转动作务必要轻,严禁剧烈晃动,过程中不可将两块板横向交叉移动(384孔板与dimple plate)。若个别孔的树脂未能顺利落入样本孔中,可轻轻敲打dimple plate背面。
[0135]
4.4封膜,将384孔板固定在反转摇匀仪上,混匀15min。
[0136]
4.5配平,3600rpm(1860g)离心5min。
[0137]
4.6使用浸有75%酒精的棉球擦拭dimple plate板,晾干,放入指定抽屉中。
[0138]
4.7点样、编板、打谱;点样仪参数设置如图1。
[0139]
5结果分析
[0140]
5.1点击软件typer
→
弹出一个对话框点击typeranalyzer,在点击左上角date
→
找到当日打谱的芯片文件夹,双击芯片,勾选chip栏中芯片名称,出现芯片信息,点击检测样本,进入数据分析如下图2。
[0141]
5.2出现details面板,可以点击任意assay的名称来查看质谱检测结果,如下图3-图5中出现三条亮色线,左侧红色虚线位置处的峰为uep(即未延伸的引物作为对照),右侧分别为检测出的目的wt峰图和突变型峰图。
[0142]
按照上述方2019年和2020年上海临检中心组织的室间质评中,结果如图6-19。5个基因突变检测项目,共70个样本,我们收到临检中心的样本后会进行检测,检测后的结果再上报给临检中心。临检中心会把上报的结果和样本的预期检测结果进行核对,采用我们的方法检测结果与实际情况全部一致,符合率为100%。
[0143]
实施例2准确度度和特异性实验
[0144]
(一)准确度实验
[0145]
实验材料
[0146]
据表一所述检测位点设计质粒,结合阳性参考品进行准确度测试,合成质粒信息如下:
[0147]
表12质粒信息
[0148]
[0149]
[0150][0151]
表13阳性标准品及涵盖位点说明
[0152]
阴性对照说明:该项目阴性对照采用人基因组dna,供应商生工,cas g3041。该项目第二部扩增为了降低非特异性延伸,体系中添加人鱼精dna,供应商生工,cas 100403-24-5。
[0153]
实验方法:
[0154]
1、引物:参照“表5”合成扩增引物;
[0155]
2、pcr模板的准备:阳性模板详细信息见上述“表12”阳性质粒及“表13”中样本,horizon阳性标品dna及自研样品。质粒的按照每一个well进行等比例的混合,混合好后然后将样品浓度稀释到10-20ng/ul之间备用,horizon标准品及准备的自研样品(石蜡8,xs单独使用,直接稀释到0-20ng/ul之间备用)。
[0156]
并且准备空白对照ntc用到的模板鱼精斑,阴性对照的模板:人基因组dna。浓度均
要求为10ng/ul。
[0157]
3、pcr反应
[0158]
3.1pcr反应体系的制备
[0159]
表14
[0160]
试剂名称工作浓度加入体积(ul)18.2纯水na1.5pcr引物mix0.5um10takara taq mixna12.5模板10ng/ul1总体积na25
[0161]
3.2 pcr反应体程序
[0162]
step 1:95℃5min;
[0163]
step 2:95℃35s,
[0164]
step 3:60℃35s,
[0165]
step 4:72℃1min;
[0166]
step 5:go to step 2for 35cycles;
[0167]
step 6:72℃7min;
[0168]
step 7:4℃永久保存。
[0169]
4、pcr反应产物纯化
[0170]
4.1 pcr反应液中加入100ul buffer pcr-a,混匀后移入纯化柱中,12000g离心1min;
[0171]
4.2加500ul buffer w2,12000g离心1min,弃废液;
[0172]
4.3加500ul buffer w2,12000g离心1min,弃废液;
[0173]
4.4加入500ul buffer w2,12000g离心1min,弃废液;
[0174]
4.5 12000g空载离心1min,将纯化柱转移到干净的1.5ml离心管中;
[0175]
4.6在纯化膜中央加入20ul水(最好预热到25℃),枪头不要触碰纯化膜,室温静置2min,12000g离心1min;
[0176]
4.7将1.5ml离心管底部的水重新吸出加到膜上,室温静置1min,12000g离心1min;
[0177]
4.8向每组的nc孔中加入3.5ul 250ng的基因组dna。
[0178]
5、延伸反应
[0179]
5.1 mixa体系配置
[0180]
表15
[0181]
试剂名称加入体积(ul)pcr mg2+0.4sap buffer0.17pcr buffer0.5总体积1.07
[0182]
5.2 iplex体系配置
[0183]
表16
[0184]
试剂名称加入体积(ul)18.2纯水0.619iplex buffer0.2termination mix0.2延伸引物mix0.94iplex酶0.041总体积2
[0185]
5.3终反应体系配置
[0186]
表17
[0187]
试剂名称加入体积(ul)pcr回收产物6mixa1iplex体系2总反应体积9
[0188]
5.4延伸反应程序
[0189]
step 1:94℃30s;
[0190]
step 2:94℃5s;
[0191]
step 3:58℃5s;
[0192]
step 4:80℃5s;
[0193]
step 5:go to step 3for 4cycles;
[0194]
step 6:go to step 2for 39cycles;
[0195]
step 7:72℃3min;
[0196]
step 8:4℃永久保存。
[0197]
6、脱盐处理
[0198]
洁净树脂(resin)铺平在384/6mg dimple plate上,风干最少10min。在样本板的每一个有样本的孔里加入16ul水。如果有器材和方法,这一步可以使用液体处理器。完成后,用膜把板封好,涡旋震荡和离心。加入6mg洁净树脂(resin):轻轻将样本板凌空反转,放在已放树脂的dimple plate上,然后将dimple plate连样本板一起反转(过程中两快板不可水平移动),让树脂掉到孔里。用膜把板封好,放在旋转器上颠倒摇匀15min。以3200g(标准板离心机的2000rpm)将板离心5min。
[0199]
6.7样品点样,质谱编板,质谱打谱。
[0200]
实验结果:准确率为100%,具体结果如表18。
[0201]
表18
[0202]
[0203][0204]
(二)灵敏度实验
[0205]
将验证准确度的32个样本稀释至最低检出限(10ng/ul)进行验证,以考察本试剂盒对各检测位点的最低检出限。具体实验方法同上。
[0206]
表19最低检测限测试结果
[0207]
[0208]
[0209][0210]
结果表明:使用本试剂盒对样品进行最低检测线(10ng/ul)检测,均能成功检测。
[0211]
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法、组合物的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1