一种免疫调节剂的开发及其应用的制作方法
1.本公开涉及一种免疫调节剂的开发及其应用,特别是结合程序性死亡配体1(pd-l1)抗体及其应用。
背景技术:
2.pd-l1为一种细胞表面糖蛋白,其为两种用于程序性死亡1(pd-1)的已知配体之一,认为其在免疫调节和维持外周耐受性中起重要作用。已在许多免疫细胞的表面上观察到pd-l1的表达,所述免疫细胞包括未处理淋巴细胞和活化b和t细胞、单核细胞和树突状细胞(同上)。此外,pd-l1 mrna由非淋巴组织(包括血管内皮细胞、上皮细胞、肌细胞)以及在扁桃体和胎盘组织中表达。
3.尽管免疫检查点疗法在一部分患者中获得了持久的缓解,但是,目前上市的免疫检查点抑制剂(包括ctla-4、pd-1或pd-l1单抗),仅对约15%-40%的患者有效(ribas,a.and j.d.wolchok,cancer immunotherapy using checkpoint blockade.science,2018.359(6382):p.1350-1355)。研究发现,对免疫疗法有反应的肿瘤组织中,通常肿瘤抗原特异性cd8+t细胞的浸润水平较高;而对免疫治疗无反应的肿瘤,通常内部缺乏有效活化的t淋巴细胞(gajewski,t.f.,the next hurdle in cancer immunotherapy:overcoming the non-t-cell-inflamed tumor microenvironment.semin oncol,2015.42(4):p.663-71)。
4.研究发现,对pd-l1抗体atezolizumab治疗无反应的转移性尿路上皮癌患者,其肿瘤组织中tgfβ通路相关基因(tgfb1和tgfbr2)表达上调。将tgfβ中和抗体和pd-l1抗体联用,在小鼠emt6乳腺癌和mc38结肠癌模型中,可诱导cd8+t细胞浸润和肿瘤消退,疗效显著优于单独使用pd-l1抗体(mariathasan,s.,et al.,tgfbeta attenuates tumour response to pd-l1 blockade by contributing to exclusion of t cells.nature,2018.554(7693):p.544-548)。
5.另一项研究显示,发生wnt、egfr、p53和tgfβ通路突变的纯合小鼠体内产生了类似人类免疫排斥型的结肠癌肿瘤,肿瘤细胞周围高水平的tgfβ主要由肿瘤相关成纤维细胞产生。使用tgfβ受体1激酶抑制剂,可以减少肿瘤的转移灶数量,增加肿瘤组织cd4+t细胞和t-bet+淋巴细胞浸润。tgfβ抑制剂与pd
–
l1抗体联合治疗,可诱导产生明显的免疫应答,显著延长荷瘤小鼠生存期(tauriello,d.v.f.,et al.,tgfbeta drives immune evasion in genetically reconstituted colon cancer metastasis.nature,2018.554(7693):p.538-543)。
6.tgfβ是一组具有多种生物学功能的细胞因子,包括tgfβ1、tgfβ2和tgfβ3,对细胞的生长、增殖、分化、凋亡、迁移和免疫有重要的调节作用。tgfβ二聚体与细胞膜上的ii型受体tgfbr2和i型受体tgfbr1结合后,诱导受体激酶活化,招募下游smad蛋白,聚集在细胞核内发挥转录调控作用。
7.一般认为tgfβ在肿瘤发生早期可以抑制肿瘤生长,在晚期则转变成肿瘤促进因
子。tgfβ受体下游的信号转导分子smad可调控dapk、gadd45β、bim和ship等凋亡基因的表达,引发细胞凋亡,还可以抑制肿瘤血管的生成。但随着肿瘤细胞内突变的积累,尤其tgfβ受体或其下游的smad基因突变,可导致其抑制作用减弱;tgfβ可通过肿瘤微环境中的间充质细胞、内皮细胞、免疫细胞和源自骨髓的干细胞等细胞表面的tgfβ受体,影响微环境的纤维化、血管生产和免疫细胞浸润(neuzillet,c.,et al.,perspectives of tgf-beta inhibition in pancreatic and hepatocellular carcinomas.oncotarget,2014.5(1):p.78-94);同时,tgfβ可阻断未成熟的t细胞向th1细胞分化,促进其向treg亚群的转化,从而导致肿瘤细胞的免疫逃逸;tgfβ还可促进上皮细胞间质转型,从而获得侵袭和迁移的能力。
8.由于tgfβ广泛的生物学功能,一种新的策略是利用肿瘤靶向抗体与tgfβ抑制剂(如tgfβ受体)形成融合蛋白,可以定向改造肿瘤微环境,同时避免系统性抑制tgfβ带来严重的副作用。
9.中国专利申请cn104334573a中,将抗egfr1等抗体与ii型受体tgfbr2胞外区连接形成融合蛋白,利用靶向抗体将tgfbr2定位到肿瘤,以抵消肿瘤微环境中tgfβ作用产生的免疫耐受。
10.中国专利申请cn106103488a中,将抗pd-l1抗体通过柔性接头g4s与tgfbr2胞外区连接,通过抵消tgfβ免疫抑制作用,同时阻断pd-1/pd-l1检查点,以进一步释放t细胞的抗肿瘤活性。
11.pct申请wo2018205985a1中披露了一种方法,将与pd-l1抗体连接的tgfbr2胞外区n端截短14-26个连续氨基酸,可以增加生产过程中融合蛋白的稳定性或表达量。
技术实现要素:
12.本发明人发现了一种新的具有高阻断活性的鼠源pd-l1抗体及其人源化抗体,并将所述pd-l1抗体通过柔性接头与更稳定的tgfbr2异构体(突变体)进行连接,形成一种新型双功能抗体。该新型双功能抗体可通过阻断pd-l1与pd-1的相互作用,释放t细胞抗肿瘤活性,同时有效阻断肿瘤微环境中tgf-β激活smad信号通路引起的免疫抑制,有助于在原本无反应的肿瘤中诱导有效而持久的抗肿瘤免疫反应。
13.在一方面,本公开提供了一种结合pd-l1的抗体或其抗原结合部分。
14.在一方面,本公开提供了一种双特异性或多特异性抗体分子,其包含前述结合pd-l1的抗体或其抗原结合部分。
15.在一方面,本公开提供了一种抗体融合蛋白,其包含:
16.a)抗体的至少一个重链可变结构域,所述抗体选自前述结合pd-l1的抗体;和
17.b)人tgfbrii或其能够结合tgfβ的片段。
18.在一方面,本公开提供了编码前述结合pd-l1的抗体或其抗原结合部分、双特异性或多特异性抗体分子或抗体融合蛋白的核酸。
19.在一方面,本公开提供了包含前述的核酸的载体。
20.在一方面,本公开提供了包含前述的载体的细胞。
21.在一方面,本公开提供了一种组合物,所述组合物包含前述结合pd-l1抗体或其抗原结合部分、双特异性或多特异性分子、抗体融合蛋白、核酸、载体和/或细胞,和药学上可
接受的载体。
22.在一方面,本公开提供了一种抗体-药物缀合物,所述抗体-药物缀合物包含共价至治疗部分的前述结合pd-l1抗体或其抗原结合部分、双特异性或多特异性分子或抗体融合蛋白。
23.在一方面,本公开提供了一种试剂盒,所述试剂盒包含前述结合pd-l1抗体或其抗原结合部分、双特异性或多特异性分子、抗体融合蛋白、核酸、载体和/或细胞。
24.在一方面,本公开提供了治疗与pd-l1相关病症的方法,其包括下述步骤:向所述受试者施用治疗有效量的前述抗体或其抗原结合片段、核酸、载体、细胞和/或组合物。
25.在一方面,本公开提供了前述抗体或其抗原结合片段、核酸、载体、细胞和/或药物组合物在制备用于治疗受试者中与pd-l1相关病症的药物或试剂盒中的用途。
附图说明
26.图1示出了人源化抗体与pd-l1的结合。
27.图2示出了人源化抗体对pd-1和pd-l1结合的阻断。
28.图3示出了人源化抗体与细胞膜上pd-l1的结合。
29.图4示出了人源化抗体阻断细胞膜上人pd-l1与pd-1的结合。
30.图5示出了人源化抗体阻断pd-l1信号传导通路。
31.图6示出了人源化抗体的记忆应答试验。
32.图7示出了pd-l1人源化抗体对人pd-l1的结合。
33.图8示出了pd-l1人源化抗体对食蟹猴pd-l1的结合。
34.图9示出了tgfbrii不同剪接异构体的序列比较。
35.图10示出了cho稳转细胞表达的质谱检测结果。
36.图11示出了pdl1-tgfbrii融合蛋白trap端序列。
37.图12示出了pdl1-tgfbrii抗体融合蛋白的质谱检测结果。
38.图13示出了pdl1-tgfbrii抗体融合蛋白同时结合pd-l1与tgfβ。
39.图14示出了pdl1-tgfbrii抗体融合蛋白与pd-l1的结合。
40.图15示出了pdl1-tgfbrii抗体融合蛋白对pd-1和pd-l1结合的阻断。
41.图16示出了pdl1-tgfbrii抗体融合蛋白与pd-l1的结合。
42.图17示出了facs检测pdl1-tgfbrii阻断人pd-1/pd-l1的结合。
43.图18示出了pdl1-tgfbrii抗体融合蛋白对pd1/pd-l1信号通路的阻断。
44.图19示出了hek293-sbe luc荧光素酶报告基因细胞。
45.图20示出了pdl1-tgfbrii对tgfβ1诱导smad活化的抑制情况。
46.图21示出了pdl1-tgfbrii对tgfβ3诱导nrk-49f产生胶原的抑制。
47.图22示出了抗体融合蛋白pdl1-tgfbrii在人源化小鼠移植瘤模型中的抑制作用。
具体实施方式
48.i.定义
49.在本公开中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的蛋白质和核酸化学、分子生物学、细胞和组织
培养、微生物学、免疫学相关术语和实验室操作步骤均为相应领域内广泛使用的术语和常规步骤。同时,为了更好地理解本公开,下面提供相关术语的定义和解释。
50.术语“抗pd-l1抗体”、“抗pd-l1”、“pd-l1抗体”或“结合pd-l1的抗体”指能够以足够亲和力结合pd-l1,使得抗体作为靶向pd-l1中的诊断和/或治疗剂是有用的抗体。在一个实施方案中,抗pd-l1抗体结合无关的非pd-l1蛋白的程度小于抗体对pd-l1的结合的约10%,例如通过放射性免疫测定法(ria)测量的。在某些实施方案中,结合pd-l1的抗体具有≤1μm、≤100nm、≤10nm、≤1nm、≤0.1nm、≤0.01nm、或≤0.001nm(例如10-8
m或更少,例如10-8
m至10-13
m,例如10-9
m至10-13
m)的解离常数(kd)。在某些实施方案中,抗pd-l1抗体结合在来自不同物种的pd-l1间保守的pd-l1表位。
51.术语“tgf-β受体”或“tgfβr”在本文用于涵盖tgfβr家族的全部三种亚型(即,tgfβri,tgfβrii,tgfβriii)。tgfβ受体的特征在于丝氨酸/苏氨酸激酶活性并且以几种不同的同种型(可以是同源二聚体或异源二聚体)存在。
52.术语“tgfβrii”指来自任何脊椎动物来源的任何天然tgfβrii(转化生长因子β受体2;也称作tgfr-2或tgfβ-rii),包括哺乳动物,诸如灵长类(例如人)和啮齿类(例如小鼠和大鼠),除非另外指明。该术语涵盖“全长”,未加工的tgfbr2以及源自细胞中的加工的任何形式的tgfbr2。该术语还涵盖tgfbr2的天然发生变体,例如剪接变体或等位变体。
53.如本文使用的和除非另作说明,术语“约”或“大约”是指在给定值或范围的加或减10%之内。在需要整数的情况下,该术语是指在给定值或范围的加或减10%之内、向上或向下舍入到最接近的整数。
54.就抗体链多肽序列而言,短语“基本相同”可理解为表现出与参照多肽序列至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或更多的序列同一性的抗体链。就核酸序列而言,该术语可理解为表现出与参照核酸序列至少大于60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或更高的序列同一性的核苷酸序列。
55.序列“相同性”或“同一性”具有本领域公认的含义,并且可以利用公开的技术计算两个核酸或多肽分子或区域之间序列相同性的百分比。可以沿着多核苷酸或多肽的全长或者沿着该分子的区域测量序列相同性(参见,例如:computational molecular biology,lesk,a.m.,ed.,oxford university pres,new york,1988;biocomputing:informatics and genome projects,smith,d.w.,ed.,academic press,new york,1993;computer analysis of sequence data,part i,griffin,a.m.,and griffin,h.g.,eds.,humana press,new jersey,1994;sequence analysis in molecular biology,von heinje,g.,academic press,1987;and sequence analysis primer,gribskov,m.and devereux,j.,eds.,m stockton press,new york,1991)。虽然存在许多测量两个多核苷酸或多肽之间的相同性的方法,但是术语“相同性”是技术人员公知的(carrillo,h.&lipman,d.,siam j applied math 48:1073(1988))。
[0056]“取代型”变体是天然序列中至少一个氨基酸残基被除去并被不同的氨基酸插入其相同位置的变体。所述取代可为单个的,其中该分子中仅有一个氨基酸被取代;或可为多个的,其中该相同分子有两个或更多的氨基酸被取代。多个取代可位于连续的位点。同样,一个氨基酸可被多个残基取代,其中这样的变体包括取代和插入二者。“插入型”变体是一
个或多个氨基酸被插入到紧邻一段天然序列某个特定位置处的氨基酸的变体。紧邻氨基酸意指与该氨基酸的α-羧基或α-氨基官能团连接。“缺失型”变体是天然氨基酸序列中一个或多个氨基酸被除去的变体。通常情况下,缺失型变体在其分子的特定区域内有一个或两个氨基酸被缺失。
[0057]
就抗体的可变结构域而言,术语“可变”系指抗体之间有广泛序列差异的相关分子的某些部分,且被用于针对其特异靶的特定抗体的特异识别和结合。但是,可变性在抗体的整个可变结构域内不是均匀分布的。可变性集中在被称为互补决定区域(cdrs;即cdr1、cdr2和cdr3)或超变区的三个区段,它们均位于轻链和重链的可变结构域内。可变结构域内保守程度更高的部分被称为构架(fr)区或构架序列。天然重链和轻链的每个可变结构域均包括四个fr区,其主要采用β-折叠构型,它们籍三个cdrs连接起来,cdrs形成环,所述环连接β-折叠结构并在某些情形下形成部分的β-折叠结构。每条链的cdrs通常被fr区在邻近连接起来,并且借助于来自其它链的cdr,有助于抗体靶结合位点(表位或决定簇)的形成(参看kabat等人sequences of proteins of immunological interest,nationalinstitute of health,bethesda,md(1987))。正如本文所使用,免疫球蛋白氨基酸残基的编号是依据kabat等人的免疫球蛋白氨基酸残基编号系统而进行的,除非另有说明。一个cdr可具有特异结合关联表位的能力。
[0058]
如本文所用,抗体的“抗体片段”或“抗原结合片段”指全长抗体的任何部分,其少于全长,但是至少包含结合抗原的所述抗体的部分可变区(例如一个或多个cdr和/或一个或多个抗体结合位点),并且因此保留结合特异性以及所述全长抗体的至少部分特异性结合能力。因此,抗原结合片段指包含与衍生抗体片段的抗体结合相同抗原的抗原结合部分的抗体片段。抗体片段包括通过酶促处理全长抗体所产生的抗体衍生物,以及合成产生的衍生物,例如重组产生的衍生物。抗体包括抗体片段。抗体片段的实例包括但不限于fab、fab'、f(ab')2、单链fv(scfv)、fv、dsfv、双抗体、fd和fd'片段以及其他片段,包括修饰的片段(参见,例如,methods in molecular biology,vol 207:recombinant antibodies for cancer therapy methods and protocols(2003);chapter 1;p 3-25,kipriyanov)。所述片段可以包括连接在一起的多条链,例如通过二硫键和/或通过肽接头。抗体片段一般包含至少或约50个氨基酸,并且典型至少或约200个氨基酸。抗原结合片段包括任何抗体片段,其在被插入抗体框架(例如通过置换相应区域)时获得免疫特异性地结合(即表现出至少或至少约10
7-108m-1的ka)抗原的抗体。“功能片段”或“抗pd-l1抗体的类似物”是可防止或实质降低所述受体结合配体或启动信号转导的能力的片段或类似物。正如本文所使用,功能片段一般与“抗体片段
″
含义相同,且就抗体而论,可指能防止或实质降低所述受体结合配体或启动信号转导的能力的片段,例如fv、fab、f(ab')2等等。“fv”片段由一条重链的可变结构域和一条轻链的可变结构域籍非共价结合方式而形成的二聚体(v
h-v
l
二聚体)组成。在该构型中,每个可变结构域的三个cdrs相互作用,以确定v
h-v
l
二聚体表面上的靶结合位点,与完整抗体的情况一样。所述六个cdrs共同赋予完整抗体的靶结合特异性。但是,即使是单个可变结构域(或仅包括3个靶特异的cdrs的fv的一半),仍可具有识别和结合靶的能力。
[0059]
如本文中所用,术语“双特异性”(bispecific antibody,bsab)指抗体和/或抗原结合分子能够特异性结合两种不同的抗原性决定簇,通常,双特异性抗体和/或抗原结合分子包含两种抗原结合位点,其中每种特异于不同的抗原性决定簇。在某些实施方案中,所述
双特异性抗体和/或抗原结合分子能够同时结合两种抗原决定簇,特别是在两种不同的细胞上表达的两种抗原性决定簇。
[0060]
如本文所用,“单克隆抗体”指相同抗体的群体,表示单克隆抗体群体中的每个单独的抗体分子与其他抗体分子相同。这种特性与抗体的多克隆群体的特性相反,所述抗体的多克隆群体包含具有多种不同序列的抗体。单克隆抗体可以通过许多公知的方法来制备(smith et al.(2004)j.clin.pathol.57,912-917;和nelson et al.,j clin pathol(2000),53,111-117)。例如,单克隆抗体可以通过永生化b细胞来制备,例如通过与骨髓瘤细胞融合以产生杂交瘤细胞系或者通过用诸如ebv的病毒感染b细胞。重组技术还可以用来在体外通过用携带编码抗体的核苷酸的人工序列的质粒转化宿主细胞来从宿主细胞的克隆群体制备抗体。
[0061]
如本文中所用,术语“杂交瘤”或“杂交瘤细胞”指由融合产抗体的淋巴细胞和不产抗体的癌细胞而产生的细胞或细胞系(通常为骨髓瘤或淋巴瘤细胞)。如本领域普通技术人员所知的,杂交瘤可增殖并持续供应产生特定单克隆抗体。用于产生杂交瘤的方法为本领域已知的(见例如,harlow&lane,1988)。当提及术语“杂交瘤”或“杂交瘤细胞”时,其还包括杂交瘤的亚克隆和后代细胞。
[0062]
如本文所用,全长抗体是具有两条全长重链(例如vh-ch1-ch2-ch3或vh-ch1-ch2-ch3-ch4)和两条全长轻链(vl-cl)和铰链区的抗体,例如通过抗体分泌b细胞天然产生的抗体以及合成产生的具有相同结构域的抗体。
[0063]
术语“嵌合抗体”是指这样的抗体,其中可变区序列源自一个物种,恒定区序列源自另一物种,如其中可变区序列源自小鼠抗体及恒定区序列源自人抗体的抗体。
[0064]“人源化”抗体是指非人(例如小鼠)抗体形式,其是嵌合的免疫球蛋白、免疫球蛋白链或者其片段(如fv、fab、fab'、f(ab')2或者抗体的其它抗原结合亚序列),含有源自非人免疫球蛋白的最小序列。优选地,人源化抗体是人免疫球蛋白(接受者抗体),其中接受者抗体的互补决定区(cdr)的残基由来自具有希望的特异性、亲和性和能力的非人物种(供体抗体)如小鼠、大鼠或者兔的cdr残基置换。
[0065]
此外,在人源化中,还可能对vh和/或vl的cdr1、cdr2和/或cdr3区内的氨基酸残基进行突变,由此改善抗体的一或多种结合特性(例如亲和性)。可进行例如pcr介导的突变引入突变,其对抗体结合或其它功能特性的影响可利用本文所述的体外或体内测试评估。通常,引入保守性突变。此类突变可为氨基酸取代、添加或缺失。另外,cdr内的突变通常不超过一个或两个。因此,本公开所述人源化抗体还涵盖cdr内包含1或2两个氨基酸突变的抗体。
[0066]
如本文所用,术语“cdr”指互补决定区(complementarity-determining region),已知抗体分子的每个重链和轻链具有3个cdr。cdr也称作高变区,且存在于抗体的每个重链和轻链的可变区中,在cdr的一级结构中具有非常高的变异性位点。本说明书中,重链的cdr由来自重链的氨基端序列的氨基端的cdr1、cdr2、cdr3表示,轻链的cdr由来自轻链的氨基端序列的氨基端的cdr1、cdr2、cdr3表示。这些位点在三级结构中彼此临近,并决定抗体所结合的抗原的特异性。
[0067]
如本文所用,术语“表位”指抗体的互补位结合的抗原上的任何抗原决定簇。表位决定簇通常包含分子的化学活性表面分型,例如氨基酸或糖侧链,并且通常具有特定的三
维结构特征以及特定的电荷特征。
[0068]
如本文所用,关于抗体或其抗原结合片段的“特异性结合”或“免疫特异性地结合”在本文中可交换使用,并且指抗体或抗原结合片段通过抗体和抗原的抗体结合位点之间的非共价相互作用与同种抗原形成一个或多个非共价键的能力。所述抗原可以是分离的抗原或存在于肿瘤细胞。通常,免疫特异性地结合(或特异性结合)抗原的抗体是以约或1
×
107m-1
或1
×
108m-1
或更大的亲和常数ka(或者1
×
10-7
m或1
×
10-8
m或更低的解离常数(kd))结合所述抗原。亲和常数可以通过抗体反应的标准动力学方法来测定,例如,免疫测定、表面等离子共振(spr)(rich and myszka(2000)curr.opin.biotechnol 11:54;englebienne(1998)analyst.123:1599)、等温滴定量热法(itc)或本领域已知的其他动力学相互作用测定(参见,例如,paul,ed.,fundamental immunology,2nd ed.,raven press,new york,pages 332-336(1989);还参见描述用于计算抗体的结合亲和力的示例性spr和itc方法的美国专利第7,229,619号)。用于实时检测和监测结合速率的仪器和方法是已知的,并且可商购(参见,biacore 2000,biacore ab,upsala,sweden and ge healthcare life sciences;malmqvist(2000)biochem.soc.trans.27:335)。
[0069]
如本文所用,术语“多核苷酸”和“核酸分子”指包含至少两个连接的核苷酸或核苷酸衍生物的寡聚体或聚合物,包括通常通过磷酸二酯键连接在一起的脱氧核糖核酸(dna)和核糖核酸(rna)。如本文所使用,术语“核酸分子”意欲包括dna分子及rna分子。核酸分子可为单链或双链,且可为cdna。
[0070]
如本文所用,分离的核酸分子是从存在于核酸分子的天然来源中的其他核酸分子分离的核酸分子。诸如cdna分子的“分离的”核酸分子可以在通过重组技术制备时基本上不含其他细胞物质或培养基,或者在化学合成时基本上不含化学前体或其他化学成分。本文所提供的示例性分离的核酸分子包括编码所提供的抗体或抗原结合片段的分离的核酸分子。
[0071]
如本文所用,关于核酸序列、区域、元件或结构域的“可操作地连接”表示核酸区域互相功能相关。例如,启动子可以可操作地连接至编码多肽的核酸,从而所述启动子调控或介导所述核酸的转录。
[0072]
亦提供本文所述序列表中所述序列的“保守序列修饰”,即不消除由核苷酸序列编码或含有氨基酸序列的抗体与抗原的结合的核苷酸及氨基酸序列修饰。这些保守序列修饰包括保守核苷酸及氨基酸取代以及核苷酸及氨基酸添加及缺失。例如,可通过本领域已知的标准技术(例如定点诱变及pcr介导的诱变)将修饰引入本文所述的序列表中。保守序列修饰包括保守氨基酸取代,其中氨基酸残基被替换为具有类似侧链的氨基酸残基。具有类似侧链的氨基酸残基的家族是本领域中已有定义的。这些家族包括具有碱性侧链的氨基酸(例如赖氨酸、精氨酸、组氨酸)、具有酸性侧链的氨基酸(例如天冬氨酸、谷氨酸)、具有不带电极性侧链的氨基酸(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、色氨酸)、具有非极性侧链的氨基酸(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸)、具有β分枝侧链的氨基酸(例如苏氨酸、缬氨酸、异亮氨酸)及具有芳香族侧链的氨基酸(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。因此,抗pd-l1抗体中的预测的非必需氨基酸残基优选被来自同一侧链家族的另一氨基酸残基替代。鉴定不消除抗原结合的核苷酸及氨基酸保守取代的方法为本领域所熟知(例如,参见brummell et al.,
biochem.32:1180-1187(1993);kobayashi et al.,protein eng.12(10):879-884(1999);burks et al.,proc.natl.acad.sci.usa 94:412-417(1997))。
[0073]
作为另一选择,在另一实施方案中,可通过例如饱和诱变沿抗pd-l1抗体编码序列的全部或一部分随机引入突变,且可针对改良的结合活性筛选所得经修饰抗pd-l1抗体。
[0074]
如本文所用,“表达”指通过多核苷酸的转录和翻译产生多肽的过程。多肽的表达水平可以利用本领域已知的任何方法来评价,包括例如测定从宿主细胞产生的多肽的量的方法。这类方法可以包括但不限于通过elisa定量细胞裂解物中的多肽,凝胶电泳之后考马斯蓝染色,lowry蛋白测定以及bradford蛋白测定。
[0075]
如本文所用,“宿主细胞”是用于接受、保持、复制和扩增载体的细胞。宿主细胞还可以用来表达载体所编码的多肽。当宿主细胞分裂时,载体中所含的核酸复制,从而扩增核酸。宿主细胞可以是真核细胞或原核细胞。合适的宿主细胞包括但不限于cho细胞、各种cos细胞、hela细胞、hek细胞例如hek 293细胞。
[0076]
如本文所用,“载体”是可复制的核酸,当载体转化入适当的宿主细胞时,可以从该载体表达一种或多种异源蛋白。关于载体包括那些通常通过限制酶切消化和连接可以将编码多肽或其片段的核酸引入其中的载体。关于载体还包括那些包含编码多肽的核酸的载体。载体用来将编码多肽的核酸引入宿主细胞,用于扩增核酸或者用于表达/展示核酸所编码的多肽。载体通常保持游离,但是可以设计为使基因或其部分整合入基因组的染色体。还考虑人工染色体的载体,例如酵母人工载体和哺乳动物人工染色体。这类媒介物的选择和用途是本领域技术人员公知的。
[0077]
如本文所用,载体还包括“病毒载体”或“病毒的载体”。病毒的载体是工程化的病毒,其可操作地连接至外源基因以将外源基因转移(作为媒介物或穿梭(shuttle)入细胞。
[0078]
如本文所用,“表达载体”包括能够表达dna的载体,所述dna与诸如启动子区的能够影响这类dna片段表达的调控序列可操作地连接。这类额外的片段可以包括启动子和终止子序列,并且任选地可以包括一个或多个复制起点、一个或多个选择标记、增强子、多腺苷酸化信号等。表达载体一般来源于质粒或病毒dna,或者可以包含这两者的元件。因此,表达载体指重组dna或rna构建体,例如质粒、噬菌体、重组病毒或其他载体,当引入适当的宿主细胞时,导致克隆dna的表达。适当的表达载体是本领域技术人员公知的,并且包括在真核细胞和/或原核细胞中可复制的表达载体以及保持游离的表达载体或者整合入宿主细胞基因组的表达载体。
[0079]
如本文所用,“治疗”患有疾病或疾病状况的个体表示所述个体的症状部分或全部缓解,或者在治疗后保持不变。因此,治疗包括预防、治疗和/或治愈。预防指防止潜在疾病和/或防止症状恶化或疾病发展。治疗还包括所提供的任何抗体或其抗原结合片段以及本文所提供的组合物的任何药学用途。
[0080]
如本文所用,“疗效”表示由个体的治疗所导致的效果,其改变、通常改良或改善疾病或疾病状况的症状,或者治愈疾病或疾病状况。
[0081]
如本文所用,“治疗有效量”或“治疗有效剂量”指施用于对象之后至少足以产生疗效的物质、化合物、材料或包含化合物的组合物的量。因此,其为防止、治愈、改善、阻滞或部分阻滞疾病或病症的症状所必需的量。
[0082]
如本文所用,“预防有效量”或“预防有效剂量”指在施用于对象时会具有预期的预
防效果的物质、化合物、材料或包含化合物的组合物的量,例如,防止或延迟疾病或症状的发生或复发,减少疾病或症状发生或复发的可能性。完全预防有效剂量不必通过施用一个剂量发生,并且可以仅在施用一系列剂量之后发生。因此,预防有效量可以在一次或多次施用中施用。
[0083]
如本文中所使用的,术语“患者”是指哺乳动物,例如人。
[0084]
ii.具体实施方案详述
[0085]
在一方面,本公开提供了一种结合pd-l1的抗体或其抗原结合部分,其包含选自氨基酸序列seq id no:2、3、4、15或其任何变体的轻链cdr,和/或选自氨基酸序列seq id no:7、8、9、20或任何变体的重链cdr。
[0086]
根据前一方面的抗体或其抗原结合部分,其包含选自氨基酸序列seq id no:2、15或其任何变体的轻链cdr1,选自氨基酸序列seq id no:3或其任何变体的轻链cdr2,选自氨基酸序列seq id no:4或其任何变体的轻链cdr3;和/或选自氨基酸序列seq id no:7或其任何变体的重链cdr1,选自氨基酸序列seq id no:8、20或其任何变体的重链cdr2,选自氨基酸序列seq id no:9或其任何变体的重链cdr3。
[0087]
根据前一方面的抗体或其抗原结合部分,其包含选自下列的重链和轻链的cdr组合:
[0088]
(1)分别包含seq id no:2、3、4的轻链cdr、cdr及cdr序列,和/或分别包含seq id no:7、8、9的重链cdr、cdr及cdr序列;
[0089]
(2)分别包含seq id no:2、3、4的轻链cdr、cdr及cdr序列,和/或分别包含seq id no:7、20、9的重链cdr、cdr及cdr序列;
[0090]
(3)分别包含seq id no:15、3、4的轻链cdr、cdr及cdr序列,和/或分别包含seq id no:7、8、9的重链cdr、cdr及cdr序列;
[0091]
(4)分别包含seq id no:15、3、4的轻链cdr、cdr及cdr序列,和/或分别包含seq id no:7、20、9的重链cdr、cdr及cdr序列。
[0092]
根据前一方面的抗体或其抗原结合部分,其包含选自氨基酸序列seq id no:1、11、13轻链可变区和/或选自氨基酸序列seq id no:6、16、18或其任何变体的重链可变区。
[0093]
在本公开的一些优选实施方案中,其包含氨基酸序列seq id no:1或其任何变体的轻链可变区,和氨基酸序列seq id no:6或其任何变体的重链可变区。
[0094]
在本公开的一些优选实施方案中,其包含氨基酸序列seq id no:11或其任何变体的轻链可变区,和氨基酸序列seq id no:16或其任何变体的重链可变区。
[0095]
在本公开的一些优选实施方案中,其包含氨基酸序列seq id no:11或其任何变体的轻链可变区,和氨基酸序列seq id no:18或其任何变体的重链可变区。
[0096]
在本公开的一些优选实施方案中,其包含氨基酸序列seq id no:13或其任何变体的轻链可变区,和氨基酸序列seq id no:16或其任何变体的重链可变区。
[0097]
在本公开的一些优选实施方案中,其包含氨基酸序列seq id no:13或其任何变体的轻链可变区,和氨基酸序列seq id no:18或其任何变体的重链可变区。
[0098]
在一方面,本公开提供了一种双特异性或多特异性分子,其包含所述的结合pd-l1的抗体或其抗原结合部分。
[0099]
在一方面,本公开提供了一种pdl1-tgfbrii抗体融合蛋白,其包含:
[0100]
a)融合多肽部分,所述融合多肽部分包含抗体的重链部分和tgfbrii部分,所述抗体的重链部分包含重链或所述重链的抗原结合部分,所述tgfbrii部分包含tgfbrii或所述tgfbrii的tgfβ结合部分;和
[0101]
b)抗体的轻链部分,所述抗体的轻链部分包含所述抗体的轻链或所述轻链的抗原结合部分。
[0102]
其中,所述抗体为权利要求1-4任一项所述的结合pd-l1的抗体。
[0103]
在本公开的一些优选实施方案中,所述抗体的重链部分的c末端与所述tgfbrii部分的n末端连接。在本公开的一些优选实施方案中,所述连接是通过接头连接。在本公开的一些优选实施方案中,所述接头是g4s或g(g4s)3g。
[0104]
在本公开的一些优选实施方案中,所述tgfbrii包含选自氨基酸序列seq id no:21、23、25、27、29或其任何变体的序列。
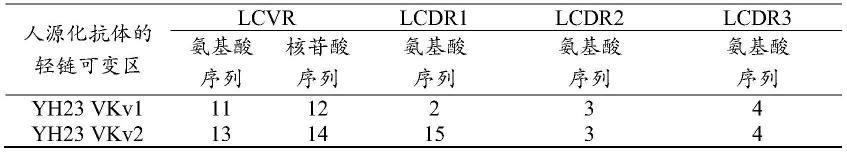
[0105]
在本公开的一些优选实施方案中,所述tgfbrii的tgfβ结合部分包含tgfbrii胞外结构域片段。在本公开的一些优选实施方案中,所述胞外结构域片段包含选自胞外结构域第1-200位氨基酸的片段。在本公开的一些优选实施方案中,所述胞外结构域片段为seq id no.23所示第24-159位的氨基酸片段或其变体。在本公开的一些优选实施方案中,所述变体存在lys30glu突变和/或asn34ser突变。在本公开的一些优选实施方案中,所述胞外结构域片段为seq id no.27所示第1-124位的氨基酸片段或其变体。在本公开的一些优选实施方案中,所述变体存在asn7ser突变。
[0106]
在本公开的一些优选实施方案中,所述pdl1-tgfbrii抗体融合蛋白的融合多肽包含选自氨基酸序列seq id no:31、35、37、39、41或其任何变体的序列;抗体的轻链部分包含氨基酸序列seq id no:33。
[0107]
在一个具体实施方案中,所述pdl1-tgfbrii抗体融合蛋白的融合多肽包含氨基酸序列seq id no:31和抗体的轻链部分包含氨基酸序列seq id no:33。
[0108]
在一个具体实施方案中,所述pdl1-tgfbrii抗体融合蛋白的融合多肽包含氨基酸序列seq id no:35和抗体的轻链部分包含氨基酸序列seq id no:33。
[0109]
,所述pdl1-tgfbrii抗体融合蛋白的融合多肽包含氨基酸序列seq id no:37和抗体的轻链部分包含氨基酸序列seq id no:33。
[0110]
在一个具体实施方案中,所述pdl1-tgfbrii抗体融合蛋白的融合多肽包含氨基酸序列seq id no:39和抗体的轻链部分包含氨基酸序列seq id no:33。
[0111]
在一个具体实施方案中,所述pdl1-tgfbrii抗体融合蛋白的融合多肽包含氨基酸序列seq id no:41和抗体的轻链部分包含氨基酸序列seq id no:33。
[0112]
在本公开的一些优选实施方案中,所述抗体或其抗原结合部分是人源化的。
[0113]
在一些实施方案中,结合pd-l1的抗体或其抗原结合部分与前述任一方面的抗体或其抗原结合部分具有至少大于60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或更高的序列同一性。
[0114]
在一方面,本公开提供了编码前述任一方面的抗体或其抗原结合部分、双特异性或多特异性分子、抗体融合蛋白,或与其具有至少大于60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或更高的序列同一性的核酸分子。
[0115]
在本公开的一些优选实施方案中,所述核酸包含选自抗体轻链可变区核苷酸序列
seq id no:5、12、14或其任何变体的序列,和/或选自重链可变区核苷酸序列seq id no:10、17、19或其任何变体的序列。
[0116]
在本公开的一些优选实施方案中,所述核酸包含抗体轻链可变区核苷酸序列seq id no:5或其任何变体的序列,和重链可变区核苷酸序列seq id no:10或其任何变体的序列。
[0117]
在本公开的一些优选实施方案中,所述核酸包含抗体轻链可变区核苷酸序列seq id no:12或其任何变体的序列,和重链可变区核苷酸序列seq id no:17或其任何变体的序列。
[0118]
在本公开的一些优选实施方案中,所述核酸包含抗体轻链可变区核苷酸序列seq id no:12或其任何变体的序列,和重链可变区核苷酸序列seq id no:19或其任何变体的序列。
[0119]
在本公开的一些优选实施方案中,所述核酸包含抗体轻链可变区核苷酸序列seq id no:14或其任何变体的序列,和重链可变区核苷酸序列seq id no:17或其任何变体的序列。
[0120]
在本公开的一些优选实施方案中,所述核酸包含抗体轻链可变区核苷酸序列seq id no:14或其任何变体的序列,和重链可变区核苷酸序列seq id no:19或其任何变体的序列。
[0121]
在本公开的一些优选实施方案中,所述核酸包含选自融合多肽部分核苷酸序列seq id no:32、36、38、40、42或其任何变体的序列,和抗体的轻链部分核苷酸序列包含seq id no:34或其任何变体的序列。
[0122]
在本公开的一些优选实施方案中,所述核酸包含选自融合多肽部分核苷酸序列seq id no:32或其任何变体的序列,和抗体的轻链部分核苷酸序列包含seq id no:34或其任何变体的序列。
[0123]
在本公开的一些优选实施方案中,所述核酸包含选自融合多肽部分核苷酸序列seq id no:36或其任何变体的序列,和抗体的轻链部分核苷酸序列包含seq id no:34或其任何变体的序列。
[0124]
在本公开的一些优选实施方案中,所述核酸包含选自融合多肽部分核苷酸序列seq id no:38或其任何变体的序列,和抗体的轻链部分核苷酸序列包含seq id no:34或其任何变体的序列。
[0125]
在本公开的一些优选实施方案中,所述核酸包含选自融合多肽部分核苷酸序列seq id no:40或其任何变体的序列,和抗体的轻链部分核苷酸序列包含seq id no:34或其任何变体的序列。
[0126]
在本公开的一些优选实施方案中,所述核酸包含选自融合多肽部分核苷酸序列seq id no:42或其任何变体的序列,和抗体的轻链部分核苷酸序列包含seq id no:34或其任何变体的序列。
[0127]
在一方面,本公开提供了包含如前述任一方面的核酸的载体。
[0128]
在一方面,本公开提供了包含如前述任一方面的载体的细胞。
[0129]
在一方面,本公开一种组合物,其包含前述的抗体或其抗原结合部分、双特异性或多特异性分子、抗体融合蛋白、核酸、权利载体和/或细胞,和药学上可接受的载体。
[0130]
本公开的抗体可用于治疗、预防和/或改善疾病或障碍或病症,例如癌症、自身免疫病或病毒感染和/或改善与这样的疾病、障碍或病症相关的至少一种症状。在本公开的一些实施方案中,本文所述的抗体可用于治疗患有原发性或复发性癌症,包括例如肾细胞癌、前列腺癌、卵巢癌、肾癌、结肠直肠癌、胃癌、乳腺癌、头颈癌、非小细胞肺癌、脑癌、多发性骨髓瘤和黑素瘤的对象。所述抗体可用于治疗癌症的早期或晚期症状。在一个实施方案中,本公开的抗体或其片段可用于治疗转移癌。抗体可用于减少或抑制或缩小实体瘤和血液癌症二者的肿瘤生长。在某些实施方案中,抗体可用于防止肿瘤的复发。在某些实施方案中,用本公开的抗体或其抗原结合片段进行治疗可导致对象中肿瘤大于50%的消退、大于60%的消退、大于70%的消退、大于80%的消退或大于90%的消退。在某些实施方案中,抗体可用于提高患有癌症对象的存活。
[0131]
在某些实施方案中,本公开的抗体可用于治疗患有慢性病毒感染的对象。在一些实施方案中,本公开的抗体可用于在宿主中降低病毒效价和/或拯救衰竭的t细胞。在一个实施方案中,可以向被人免疫缺陷病毒(hiv)或人乳头瘤病毒(hpv)或乙型肝炎/丙型肝炎病毒(hbv/hcv)感染的患者以治疗剂量施用本公开的抗体或其抗原结合片段。在一个相关的实施方案中,本公开的抗体或其抗原结合片段可用于在猿猴对象(例如食蟹猴)中治疗由猿猴免疫缺陷病毒(siv)引起的感染。在另一个实施方案中,本公开的抗体或其片段可用于治疗由淋巴细胞性脉络丛脑膜炎病毒(lcmv)引起的慢性病毒感染。
[0132]
在某些实施方案中,可以向患有癌症或病毒感染的对象以治疗有效量施用本公开的阻断抗体。
[0133]
在某些实施方案中,本公开的抗体可用于治疗自身免疫病,包括但不限于:斑秃、自身免疫性肝炎、腹腔疾病、格雷夫斯病、格林-巴利综合征、桥本病、溶血性贫血、炎性肠病、炎性肌病、多发性硬化、原发性胆汁性肝硬化、银屑病、类风湿性关节炎、硬皮病、舍格伦综合征、系统性红斑狼疮、白斑、自身免疫性胰腺炎、自身免疫性荨麻疹、自身免疫性血小板减少性紫癜、克罗恩病、i型糖尿病、嗜酸性细胞增多性筋膜炎、嗜酸性细胞增多性肠胃炎、古德帕斯丘综合征、重症肌无力、银屑病关节炎、风湿热、溃疡性结肠炎、脉管炎和韦格纳肉芽肿病。在某些实施方案中,本公开的活化抗体可用于治疗患有自身免疫病的对象。
[0134]
可施用一种或更多种本公开的抗体以缓解或预防或降低疾病或病症的一个或更多个症状或状况的严重性。
[0135]
本文还考虑向处于发生疾病或病症(例如癌症和慢性病毒感染)风险中的患者预防性使用本公开的一种或更多种抗体。
[0136]
在本公开的一个实施方案中,本公开的抗体用于制备用于治疗患有癌症、自身免疫病或病毒感染之患者的药物组合物。在本公开的另一个实施方案中,本公开的抗体用作与本领域技术人员已知的用于治疗癌症、自身免疫病或病毒感染的任何其他药剂或任何其他疗法一起的辅助疗法。
[0137]
本公开的抗pd-l1抗体和可有利地与本公开的抗体或本公开抗体的生物活性片段组合的任何其他治疗剂。
[0138]
本公开的抗体可与用于治疗癌症,包括例如,肾细胞癌、卵巢癌、前列腺癌、结肠直肠癌、非小细胞肺癌和黑素瘤的一种或更多种抗癌药物或疗法协同组合。本文考虑使用本公开的抗pd-l1抗体与免疫刺激和/或免疫支持疗法组合以抑制肿瘤的生长和/或增加癌症
患者的存活。所述免疫刺激疗法包括直接免疫疗法,其通过在抑制的免疫细胞上“松开制动(releasing the brake)”或“踩油门(stepping on the gas)”来激活免疫应答以加强免疫细胞活性。实例包括靶向其他检查点受体、接种疫苗和佐剂。免疫支持形式通过促进免疫原性细胞死亡、炎症可提高肿瘤的抗原性或具有促进抗肿瘤免疫应答的其他间接作用。实例包括辐射、化疗、抗血管生成剂和手术。
[0139]
本公开所述的pdl1-tgfbrii抗体融合蛋白可用于在患者中治疗癌症或减少肿瘤生长。示例性的癌症包括:结直肠、乳腺、卵巢、胰腺、胃、前列腺、肾、宫颈、骨髓瘤、淋巴瘤、白血病、甲状腺、子宫内膜、子宫、膀胱、神经内分泌、头部颈部、肝、鼻咽、睾丸、小细胞肺癌、非小细胞肺癌、黑素瘤、基底细胞皮肤癌、鳞状细胞皮肤癌、隆突性皮肤纤维肉瘤、梅克尔细胞癌、成胶质细胞瘤、胶质瘤、肉瘤、间皮瘤,和骨髓增生异常综合征。
[0140]
待用pdl1-tgfbrii抗体融合蛋白治疗的癌症或肿瘤可基于肿瘤中pd-l1和tgfβ的表达或升高的表达、其表达水平与预后或疾病进展的相关性,以及针对肿瘤对于靶向pd-l1和tgfβ的治疗的敏感性进行的临床前和临床经验来选择。所述癌症或肿瘤包括但不限于,结直肠、乳腺、卵巢、胰腺、胃、前列腺、肾、宫颈、膀胱、头部颈部、肝、非小细胞肺癌、黑素瘤、梅克尔细胞癌,和间皮瘤。
[0141]
在多个实施方案中,本公开的一种或更多种抗体可用于与以下进行组合来治疗癌症:针对pd-l1的第二抗体、针对pd-1的抗体(例如,纳武单抗(nivolumab))、lag-3抑制剂、ctla-4抑制剂(例如,伊匹单抗)、tim3抑制剂、btla抑制剂、tigit抑制剂、cd47抑制剂、其他t细胞共抑制剂或配体的拮抗剂(例如,针对cd-28、2b4、ly108、lair1、icos、cd160或vista的抗体)、吲哚胺-2,3-双加氧酶(ido)抑制剂、血管内皮生长因子(vegf)拮抗剂[例如,“vegf-陷阱”,例如如在us 7,087,411中所述的阿柏西普或其他vegf抑制融合蛋白,或者抗-vegf抗体或其抗原结合片段(例如,贝伐单抗或雷珠单抗)或vegf受体的小分子激酶抑制剂(例如,舒尼替尼、索拉非尼或帕唑帕尼)]、ang2抑制剂(例如,nesvacumab),转化生长因子β(tgfβ)抑制剂、表皮生长因子受体(egfr)抑制剂(例如,埃罗替尼、西妥昔单抗)、共刺激受体的激动剂(例如,糖皮质激素诱导的tnfr相关蛋白的激动剂)、肿瘤特异性抗原的抗体(例如,ca9、ca125、黑素瘤相关抗原3(mage3)、癌胚抗原(cea)、波形蛋白、肿瘤m2-pk、前列腺特异性抗原(psa)、粘蛋白-1、mart-1和ca19-9)、疫苗(例如,卡介苗、癌症疫苗)、提高抗原呈递的佐剂(例如,粒细胞-巨噬细胞集落刺激因子)、双特异性抗体(例如,cd3
×
cd20双特异性抗体、psma
×
cd3双特异性抗体)、细胞毒素、化疗剂(例如,达卡巴嗪、替莫唑胺、环磷酰胺、多西他赛、阿霉素、柔红霉素、顺铂、卡铂、吉西他滨、甲氨蝶呤、米托蒽醌、奥沙利铂、紫杉醇和长春新碱)、环磷酰胺、放射疗法、il-6r抑制剂(例如,sarilumab)、il-4r抑制剂(例如,dupilumab)、il-10抑制剂、细胞因子(例如il-2、il-7、il-21和il-15)、抗体-药物缀合物(adc)(例如,抗cd19-dm4 adc和抗ds6-dm4 adc)、消炎药(例如,皮质类固醇和非甾体类消炎药)、食品添加剂(例如抗氧化剂)或任何姑息治疗。在某些实施方案中,本公开的抗pd-l1抗体可用于与癌症疫苗(包括树突细胞疫苗、溶瘤病毒、肿瘤细胞疫苗等)组合以加强抗肿瘤应答。可用于与本公开的抗pd-l1抗体组合的癌症疫苗的实例包括:黑素瘤和膀胱癌的mage3疫苗、乳腺癌的muc1疫苗、脑癌(包括多形性胶质母细胞瘤)的egfrv3(例如,rindopepimut)、或alvac-cea(针对cea+癌)。在某些实施方案中,本公开的抗pd-l1抗体可与食品添加剂(例如抗氧化剂)或任何姑息治疗组合来治疗癌症。
[0142]
在一些实施方案中,本公开的人源化抗体与治疗部分(即药物)偶联。治疗部分可以是例如细胞毒素、化疗剂、细胞因子、免疫抑制剂、免疫刺激剂、裂解肽或放射性同位素。此类缀合物在本文中称为“抗体-药物缀合物”或“adc”。
[0143]
在一些实施方案中,抗体与细胞毒性部分偶联。细胞毒性部分可以例如选自以下:紫杉醇;细胞松弛素b;短杆菌肽d;溴化乙锭;吐根碱;丝裂霉素;依托泊苷;替尼泊苷;长春新碱;长春碱;秋水仙碱;多柔比星;柔红霉素;二羟基蒽二酮;微管蛋白抑制剂如美登素或其类似物或衍生物;抗有丝分裂剂如单甲基奥瑞他汀e或f或其类似物或衍生物;海兔毒素10或15或其类似物;伊立替康或其类似物;米托蒽醌;光辉霉素;放线菌素d;1-脱氢睾酮;糖皮质激素;普鲁卡因;丁卡因;利多卡因;普萘洛尔;嘌呤霉素;卡奇霉素或其类似物或衍生物;抗代谢药,如甲氨喋呤、6巯基嘌呤、6硫鸟嘌呤、阿糖胞苷、氟达拉滨、5氟尿嘧啶、癸二嗪、羟基脲、天冬酰胺酶、吉西他滨或克拉屈滨;烷化剂,如二氯甲基二乙胺、硫代嘌呤、苯丁酸氮芥、美法仑、卡莫司汀(bsnu)、洛莫司汀(ccnu)、环磷酰胺、白消安、二溴甘露醇、链脲佐菌素、达卡巴嗪(dtic)、丙卡巴嗪、丝裂霉素c;铂类衍生物,如顺铂或卡铂;多卡霉素a、多卡霉素sa、雷切霉素(cc-1065)或其类似物或衍生物;抗生素,如放线菌素、博来霉素、柔红霉素、多柔比星、伊达比星、光霉素、丝裂霉素、米托蒽醌、普力霉素、安定霉素(amc);吡咯并[2,1-c][1,4]-苯并二氮杂卓(pdb);白喉毒素及相关分子如白喉a链及其活性片段和杂合分子、蓖麻毒素如蓖麻毒素a或去糖基化蓖麻毒素a链毒素、霍乱毒素、志贺样毒素如slt i、slt ii、slt iiv、lt毒素、c3毒素、志贺毒素、百日咳毒素、破伤风毒素、大豆bowman-birk蛋白酶抑制剂、假单胞菌外毒素、阿罗林、皂草素、蒴莲根毒素、胶凝蛋白、相思豆毒素a链、蒴莲根毒素a链、α-sarcin、油桐(aleurites fordii)蛋白、石竹素蛋白、美洲商陆蛋白如papi、papii和pap-s、苦瓜(momordica charantia)抑制剂、泻果素、巴豆毒素、肥阜草(sapaonaria officinalis)抑制剂、白树毒素、丝裂霉素、局限曲菌素、酚霉素和依诺霉素毒素;核糖核酸酶(rnase);dnase i、葡萄球菌内毒素a;商陆抗病毒蛋白;白喉毒素和假单胞菌内毒素。
[0144]
在一些实施方案中,抗体与选自以下的细胞毒性部分偶联:蒽环类抗生素、美登素、卡奇霉素、多卡霉素、雷切霉素(cc-1065)、海兔毒素10、海兔毒素15、伊立替康、单甲基奥瑞他汀e、单甲基奥瑞他汀f、pdb,或它们任何的类似物、衍生物或前药。
[0145]
在一些实施方案中,抗体与蒽环类抗生素或其类似物、衍生物或前药偶联。在一些实施方案中,抗体与美登素或其类似物、衍生物或前药偶联。在一些实施方案中,抗体与卡奇霉素或其类似物、衍生物或前药偶联。在一些实施方案中,抗体与多卡霉素或其类似物、衍生物或前药偶联。在一些实施方案中,抗体与雷切霉素(cc-1065)或其类似物、衍生物或前药偶联。在一些实施方案中,抗体与海兔霉素10或其类似物、衍生物或前药偶联。在一些实施方案中,抗体与海兔霉素15或其类似物、衍生物或前药偶联。在一些实施方案中,抗体与单甲基奥瑞他汀e或其类似物、衍生物或前药偶联。在一些实施方案中,抗体与单甲基奥瑞他汀f或其类似物、衍生物或前药偶联。在一些实施方案中,抗体与吡咯并[2,1-c][1,4]-苯并二氮杂卓或其类似物、衍生物或前药偶联。在一些实施方案中,抗体与伊立替康或其类似物、衍生物或前药偶联。
[0146]
在一些实施方案中,抗体与细胞因子(例如il-2、il-4、il-6、il-7、il-10、il-12、il-13、il-15、il-18、il-23、il-24、il-27、il-28a、il-28b、il-29、kgf、ifna、ifn3、ifny、
gm-csf、cd40l、flt3配体、干细胞因子、安西司亭和tnfa)偶联。
[0147]
在一些实施方案中,抗体与放射性同位素或含放射性同位素的螯合物偶联。例如,抗体可以与允许抗体与放射性同位素络合的螯合剂接头(例如dota、dtpa或噻西坦)偶联。抗体还可以或可选地包含一个或多个放射性标记的氨基酸或其他放射性标记的分子或与之偶联。放射性同位素的非限制性实例包括3h、
14
c、
15
n、
35
s、
90
y、
99
tc、
125
i、
131
i、
186
re、
213
bi、
225
ac和
227
th。为了治疗目的,可以使用发射β或α颗粒辐射的放射性同位素,例如
131
i、
90
y、
211
at、
212
bi、
67
cu、
186
re、
188
re和
212
pb。
[0148]
将分子与抗体偶联的技术是本领域熟知的。通常,核酸分子分别通过n-羟基琥珀酰亚胺酯或马来酰亚胺官能团与抗体上的赖氨酸或半胱氨酸共价连接。据报道,使用工程化半胱氨酸或整合非天然氨基酸的偶联方法可改进偶联物的同质性。特别地,本领域技术人员还可以预期用含酰基供体谷氨酰胺的标签(例如含有gin肽的标签或q-标签)或通过多肽工程(例如通过多肽上的氨基酸缺失、插入、取代或突变)产生反应性的内源性谷氨酰胺工程化的含fc多肽。然后,转谷氨酰胺酶可与胺供体剂(例如,包含或连接于反应性胺的小分子)共价交联,以形成稳定且均质的工程化含fc多肽偶联物群,其中胺供体剂通过含酰基供体谷氨酰胺标签或可接近/暴露/反应性的内源性谷氨酰胺位点特异性地与含fc多肽偶联(wo2012059882)。
[0149]
应当理解,根据所述实施方案的治疗剂将与合适的药学上可接受的载体、赋形剂、以及其它被掺入制剂中以提供改善的转移、递送、耐受性等的试剂一同施用。大量适当的制剂可见于所有药物化学工作者已知的药典中:remington's pharmaceutical sciences(第15版,mack publishing company,easton,pa.(1975)),特别是其中blaug、seymour的第87章。这些制剂包括例如粉末、糊剂、膏剂、凝胶剂、蜡、油、脂质、含脂质(阳离子或阴离子)载体(例如lipofectin
tm
)、dna缀合物、无水吸浆、水包油和油包水乳液、乳液聚乙二醇(各种分子量的聚乙二醇)、半固态凝胶以及含有聚乙二醇的半固态混合物。任何前述混合物均可适用于根据本公开的治疗或疗法,条件是制剂中的活性成分不被制剂灭活并且制剂在生理学上是相容的并耐受给药途径。
[0150]
可将本文所述抗体和其衍生物、片段、类似物和同系物掺入适于施用的药物组合物中。制备此类组合物所涉及的原理和考虑事项以及选择组分的指南在本领域中是熟知的,例如参见remington's pharmaceutical sciences:the science and practice of pharmacy第19版(alfonso r.gennaro等人编辑)mack pub.co.,easton,pa.:1995;drug absorption enhancement:concepts,possibilities,limitations,and trends,harwood academic publishers,langhorne,pa.,1994;以及peptide and protein drug delivery(advances in parenteral sciences,第4卷),1991,m.dekker,new york。
[0151]
此类组合物通常包含抗体和药学上可接受的载体。当使用抗体片段时,与靶蛋白结合结构域特异性结合的最小抑制片段可为优选的。例如,基于抗体的可变区序列,可以设计保留结合靶蛋白质序列能力的肽分子。此类肽可化学合成和/或通过重组dna技术产生(参见例如marasco等人,proc.natl.acad.sci.usa,90:7889-7893(1993))。
[0152]
如本文所用,术语“药学上可接受的载体”旨在包括与药物给药相容的任何和所有溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延缓剂等。合适的药学上可接受的载体描述于最新版的remington's pharmaceutical sciences中,这是本领域的标准参
考书目,其以引用方式并入本文。此类载体或稀释剂的优选示例包括但不限于水、盐水、林格氏溶液、葡萄糖溶液和5%的人血清白蛋白。也可以使用脂质体和非水性载体,例如固定化油。将此类介质和试剂用于药物活性物质是本领域熟知的。除去任何常规的介质或试剂与抗体不相容之外,设想其在组合物中的用途。
[0153]
将所述实施方案的药物组合物配制成与其预期施用途径相容。给药途径的示例包括肠胃外,例如静脉内、皮内、皮下、经口(例如吸入)、经皮(即局部的)、经粘膜和直肠给药。用于肠胃外、皮内或皮下施用的溶液或悬浮液可包括以下组分:注射用无菌稀释剂例如水、盐溶液、固定油、聚乙二醇类、甘油、丙二醇或其它合成溶剂;抗细菌剂,例如苄醇或对羟基苯甲酸甲酯;抗氧化剂,例如抗坏血酸或亚硫酸氢钠;螯合剂,例如乙二胺四乙酸(edta);缓冲剂,例如乙酸盐、柠檬酸盐或磷酸盐、以及调节渗透压的试剂,例如氯化钠或右旋糖。ph可用酸或碱进行调节,例如盐酸或氢氧化钠。可将肠胃外制剂包装在安瓿、一次性注射器或玻璃或塑料制多剂量小瓶内。
[0154]
适于注射用途的药物组合物包括无菌水性溶液(在此是水溶性的)或分散体以及用于即时制备无菌注射液或分散体的无菌粉末。对于静脉内施用,合适的药学上可接受的载体包括生理盐水、抑菌水、cremophor el
tm
(basf,parsippany,n.j.)或磷酸盐缓冲盐水(pbs)。在所有情况下,组合物必须是无菌的并且应当为流动性达到易于注射的程度。其在制造和储存条件下必须是稳定的并且必须能防止微生物例如细菌和真菌的污染作用。载体可以是含有例如水、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇等)的溶剂或分散介质,及其适宜的混合物。例如通过利用涂层例如卵磷脂,在分散体情况下维持所需颗粒尺寸,以及利用表面活性剂,可以保持适宜的流动性。对微生物作用的防止可以通过各种抗细菌剂和抗真菌剂例如对羟基苯甲酸酯、氯代丁醇、苯酚、抗坏血酸、硫柳汞等来实现。在许多情况下,将优选在组合物中包含等渗剂,例如糖、多元醇(诸如甘露糖醇、山梨醇)、氯化钠。注射用组合物的延长吸收可通过在所述组合物中包含延缓吸收的试剂例如单硬脂酸铝和明胶来达到。
[0155]
根据需要,可以通过将抗体以所需量掺入具有上文所列成分中的一种或组合(按需要)的合适溶剂中来制备无菌注射溶液,然后过滤消毒。一般来讲,通过将抗体掺入含有碱性分散介质和上文所列那些中的所需其它成分的无菌载体中来制备分散体。就用于制备无菌注射溶液的无菌粉末而言,制备方法是获得粉末的真空干燥和冷冻干燥,该粉末包含活性成分和任何另外的期望成分,它们来自前述的这些成分的无菌过滤溶液。
[0156]
对于吸入给药,从包含合适推进剂如二氧化碳等气体的加压容器或分配器或者喷雾器以气溶胶喷雾形式递送化合物。
[0157]
还可以通过经粘膜或透皮方式全身给药。对于经粘膜或透皮给药,在制剂中使用适于渗透屏障的渗透剂。此类渗透剂通常在本领域是通常所知的,并且包括如用于经粘膜给药的去污剂、胆盐和夫西地酸衍生物。经粘膜给药可以通过使用喷鼻剂或栓剂来实现。对于透皮给药,可将一种或多种所述抗体配制成如本领域通常所知的膏剂、软膏、凝胶、或霜膏。
[0158]
还可将化合物以栓剂(例如,具有常规栓剂基质,如可可脂或其它甘油酯)或滞留性灌肠剂形式进行制备以用于经直肠递送。
[0159]
在一个实施方案中,所述抗体可用防止其不被身体迅速消除的载体制备,例如缓
释/控释制剂,包括植入体和微胶囊化递送体系。可使用可生物降解、可生物相容的聚合物,例如乙烯-乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。用于制备此类制剂的方法对于本领域技术人员而言是显而易见的。
[0160]
尤其有利的是以剂量单位形式配制肠胃外组合物以易于施用和剂量的一致性。如本文所用,剂量单位形式是指用于待治疗的受试者,适合作为单位剂量的物理上可分离的单位;每个单位含有经计算与所需药物载体结合产生期望治疗效果的预定量的一种或多种所述抗体。所述实施方案的剂量单位形式的规格由以下指示并直接取决于:抗体的独特特征和待实现的具体治疗效果,和用于治疗个体的此类抗体的调配领域中固有的局限性。
[0161]
所述药物组合物可与给药说明书一起放于容器、包装、或分配器中。
[0162]
在某些实施方案中,本公开的抗pd-l1抗体可与方法中的放射疗法联合施用以产生长期持久的抗肿瘤应答和/或增加癌症患者的存活。在一些实施方案中,可在向癌症患者施用放射疗法之前、同时或之后施用本公开的抗pd-l1抗体。例如,可以以一个或更多个剂量向肿瘤病灶施用放射疗法,之后施用一个或更多个剂量的本公开的抗pd-l1抗体。在一些实施方案中,可以向肿瘤病灶局部施用放射疗法以增加患者肿瘤的局部免疫原性(辅助辐射)和/或杀伤肿瘤细胞(烧蚀辐射(ablative radiation)),之后全身施用本公开的抗pd-l1抗体。例如,可以向患有脑癌(例如,多形性胶质母细胞瘤)的患者施用颅内辐射以及全身施用本公开的抗pd-l1抗体。在某些实施方案中,本公开的抗pd-l1抗体可与放射疗法和化疗剂(例如,替莫唑胺)或vegf拮抗剂(例如,阿柏西普)联合施用。
[0163]
本公开的抗体或其片段可与本领域中已知的一种或更多种抗病毒药物联合施用,所述抗病毒药物包括但不限于:齐多夫定、拉米夫定、阿波卡韦、利巴韦林、洛匹那韦、依非韦伦、cobicistat、替诺福韦、利匹韦林和皮质类固醇。在一些实施方案中,本公开的抗pd-l1抗体可与lag3抑制剂、ctla-4抑制剂、pd-1抑制剂、或其他t细胞共抑制剂的任何拮抗剂联合施用来治疗慢性病毒感染。
[0164]
本公开的抗体或其片段可以与本领域中已知的任何药物或疗法(例如,皮质类固醇和其他免疫抑制剂)组合使用来治疗自身免疫病或病症,所述自身免疫病病或病症包括但不限于:斑秃、自身免疫性肝炎、腹腔疾病、格雷夫斯病、格林-巴利综合症、桥本病、溶血性贫血、炎性肠疾病、炎性肌病、多发性硬化、原发性胆汁性肝硬化、银屑病、类风湿性关节炎、硬皮病、舍格伦综合征、系统性红斑狼疮、白斑、自身免疫性胰腺炎、自身免疫性荨麻疹、自身免疫性血小板减少性紫癜、克罗恩病、i型糖尿病、嗜酸性细胞增多性筋膜炎、嗜酸性细胞增多性肠胃炎、古德帕斯丘综合征、重症肌无力、银屑病关节炎、风湿热、溃疡性结肠炎、脉管炎和韦格纳肉芽肿病。
[0165]
可在施用本公开的抗pd-l1抗体之前、同时或之后施用另外的治疗活性组分。为了本公开内容的目的,认为这样的施用方案是与第二治疗活性组分“组合”施用抗pd-l1抗体。
[0166]
可在施用本公开的抗pd-l1抗体之前向对象施用另外的治疗活性组分。例如,如果在施用第二组分前1周、前72小时、前60小时、前48小时、前36小时、前24小时、前12小时、前6小时、前5小时、前4小时、前3小时、前2小时、前1小时、前30分钟、前15分钟、前10分钟、前5分钟,或前小于1分钟施用第一组分,则可认为所述第一组分在所述第二组分“之前”施用。在另一些实施方案中,可在施用本公开的抗pd-l1抗体之后向对象施用另外的治疗活性组分。例如,如果在施用第二组分后1分钟、后5分钟、后10分钟、后15分钟、后30分钟、后1小时、后2
小时、后3小时、后4小时、后5小时、后6小时、后12小时、后24小时、后36小时、后48小时、后60小时、后72小时施用第一组分,则可认为所述第一组分在所述第二组分“之后”施用。在又一些实施方案中,可以在施用本公开的抗pd-l1抗体的同时向对象施用另外的治疗活性组分。出于本公开的目的,“同时”施用包括,例如将抗pd-l1抗体和另外的治疗活性组分以单个剂型(例如,共配制的)向对象施用,或者在相差约30分钟或更短时间内以单独剂型向所述对象施用。如果以单独剂型施用时,则每个剂型可通过相同的途径施用(例如,抗pd-l1抗体和另外的治疗活性组分可经静脉内、皮下等施用);或者,每个剂型可通过不同的途径施用(例如,可经静脉内施用抗pd-l1抗体,且可经皮下施用另外的治疗活性组分)。在任何情况下,出于本公开内容的目的,以单个剂型、以单独剂型通过相同途径施用或以单独剂型通过不同途径施用组分均被认为是“同时施用”。出于本公开内容的目的,在施用另外的治疗活性组分“之前”,“同时”或“之后”(如本文上面所定义的那些术语)施用抗pd-l1抗体均被认为是将抗pd-l1抗体与另外的治疗活性组分“组合”施用。
[0167]
本公开包括这样的药物组合物,其中使用多种剂量组合将本公开的抗pd-l1抗体与一种或更多种如本文其他地方所述的另外的治疗活性组分共配制。
[0168]
在其中本公开的抗pd-l1抗体与vegf拮抗剂(例如,vegf陷阱,例如阿柏西普)联合施用的示例性实施方案中,其包括施用包含抗pd-l1抗体和vegf拮抗剂的共制剂,可以向对象施用单个组分和/或使用多种剂量组合进行共配制。例如,可以向对象施用的和/或包含在共制剂中的抗pd-l1抗体的量选自:0.01mg、0.02mg、0.03mg、0.04mg、0.05mg、0.1mg、0.2mg、0.3mg、0.4mg、0.5mg、0.6mg、0.7mg、0.8mg、0.9mg、1.0mg、1.5mg、2.0mg、2.5mg、3.0mg、3.5mg、4.0mg、4.5mg、5.0mg、6.0mg、7.0mg、8.0mg、9.0mg和10.0mg;可以向对象施用的和/或包含在共制剂中的vegf拮抗剂(例如,vegf陷阱,例如阿柏西普)的量选自:0.1mg、0.2mg、0.3mg、0.4mg、0.5mg、0.6mg、0.7mg、0.8mg、0.9mg、1.0mg、1.1mg、1.2mg、1.3mg、1.4mg、1.5mg、1.6mg、1.7mg、1.8mg、1.9mg、2.0mg、2.1mg、2.2mg、2.3mg、2.4mg、2.5mg、2.6mg、2.7mg、2.8mg、2.9mg和3.0mg。可根据本文其他地方公开的任何施用方案向对象施用组合/共制剂,包括例如,每周两次、每周一次、每2周一次、每3周一次、每月一次、每2月一次、每3月一次、每4月一次、每5月一次、每6月一次等。
[0169]
根据本公开的某些实施方案,可在限定的时间进程内向对象施用多个剂量的抗pd-l1抗体(或包含抗pd-l1抗体和本文提及的任何另外的治疗活性剂之组合的药物组合物)。根据本公开的这个方面的方法包括向对象依次施用多个剂量的本公开抗pd-l1抗体。如本文所用的“依次施用”意指在相隔预定间隔(例如,数小时、数天、数周或数月)的不同的时间点(例如在不同天)向对象施用每个剂量的抗pd-l1抗体。本公开包括这样的方法,其包括向患者依次施用单个起始剂量的抗pd-l1抗体,随后施用一个或更多个第二剂量的抗pd-l1抗体,以及任选地随后施用一个或更多个第三剂量的抗pd-l1抗体。可以以0.1mg/kg至约100mg/kg的剂量施用抗pd-l1抗体。
[0170]
术语“初始剂量”、“第二剂量”和“第三剂量”是指施用本公开的抗pd-l1抗体的时间顺序。因此,“起始剂量”是在治疗方案开始时施用的剂量(也称为“基线剂量”);“第二剂量”是在初始剂量之后施用的剂量;而“第三剂量”是在第二剂量之后施用的剂量。起始剂量、第二剂量和第三剂量可都含有相同量的抗pd-l1抗体,但一般在施用频率方面彼此可有所不同。然而,在某些实施方案中,在治疗的进程中初始剂量、第二剂量和/或第三剂量中包
含的抗pd-l1抗体的量彼此不同(例如,适当时向上或向下调整)。在某些实施方案中,在治疗方案开始时以“负荷剂量”施用两个或更多个(例如,2、3、4或5)剂量,随后以较低的频率施用后续剂量(例如,“维持剂量”)。
[0171]
根据本公开这一方面的方法可包括向患者施用任意数量的第二和/或第三剂量的抗pd-l1抗体。例如,在某些实施方案中,仅向患者施用单个第二剂量。在另一些实施方案中,向患者施用两个或更多个(例如,2、3、4、5、6、7、8或更多)第二剂量。同样地,在某些实施方案中,仅向患者施用单个第三剂量。在另一些实施方案中,向患者施用两个或更多个(例如,2、3、4、5、6、7、8或更多)第三剂量。
[0172]
在涉及多个第二剂量的实施方案中,可以以与其他第二剂量相同的频率施用每个第二剂量。例如,可在紧接其前的剂量后1至2周或1至2个月向患者施用每个第二剂量。类似地,在涉及多个第三剂量的实施方案中,可以以与其他第三剂量相同的频率施用每个第三剂量。例如,可以在紧接其前的剂量后2至12周向患者施用每个第三剂量。在本公开的某些实施方案中,向患者施用第二和/或第三剂量的频率在治疗方案的进程中可以变化。也可由医师根据在临床检查后个体患者的需求在治疗进程期间调整施用频率。
[0173]
本公开包括这样的施用方案,其中以第一频率(例如,每周一次、每两周一次、每三周一次、每月一次、每两月一次等)向患者施用2至6个负荷剂量,然后以较低的频率向患者施用两个或更多个维持剂量。例如,根据本公开的这一方面,如果以例如每月一次的频率施用负荷剂量(例如,每月一次施用两个、三个、四个或更多个负荷剂量),则可以向患者每5周一次、每6周一次、每7周一次、每8周一次、每10周一次、每12周一次等施用维持剂量。
[0174]
在一方面,本公开的抗体具有诊断用途。例如出于诊断目的,本公开的抗pd-l1抗体可用于检测和/或测量样品中的pd-l1。一些实施方案考虑在测定中使用本公开的一种或更多种抗体来检测疾病或病症,例如癌症、自身免疫病或慢性病毒感染。用于pd-l1的示例性诊断测定可包含例如:使从患者获得的样品与本公开的抗pd-l1抗体接触,其中所述抗pd-l1抗体标记有可检测的标记或报道分子或用作捕获配体以选择性地从患者样品分离pd-l1。或者,可将未标记的抗pd-l1抗体与本身可检测标记的二抗组合用于诊断应用中。可检测标记或报道分子可以是放射性同位素,例如3h、14c、32p、35s或125i;荧光或化学发光部分,例如异硫氰酸荧光素或罗丹明;或者酶,例如碱性磷酸酶、β-半乳糖苷酶、辣根过氧化物酶或萤光素酶。可用于检测或测量样品中pd-l1的具体示例性测定包括酶联免疫吸附测定(elisa)、放射免疫测定(ria)和荧光激活细胞分选(facs)。
[0175]
可用于根据本公开的pd-l1诊断测定的样品包括可从患者获得的任何组织或流体样品,其在正常或病理条件下含有可检测量的pd-l1蛋白或其片段。一般而言,将测量从健康患者(例如,未患有癌症或自身免疫病的患者)获得的特定样品中pd-l1的水平以初始建立pd-l1的基线或标准水平。然后可以将pd-l1的这一基线水平与从怀疑患有癌症相关病症或这样的病症相关症状的个体获得的样品中测量的pd-l1水平进行比较。
[0176]
对pd-l1有特异性的抗体可不包含另外的标记或部分,或者它们可包含n-末端或c-末端标记或部分。在一个实施方案中,标记或部分是生物素。在结合测定中,标记(如果有的话)的位置可在肽与表面结合后,确定肽相对于表面的定向。例如,如果表面包被有抗生物素蛋白,则含n-末端生物素的肽将被定向以使得肽的c末端部分远离表面。
[0177]
本公开的一些方面涉及使用所公开的抗体作为用于预测患者中癌症或自身免疫
病预后的标志物。本公开的抗体可用于诊断测定中以评估患者中癌症的预后并预测存活。
[0178]
为了达到清楚和简洁描述的目的,本文中作为相同的或分开的一些实施方案的一部分来描述特征,然而,将要理解的是,本公开的范围可包括具有所描述的所有或一些特征的组合的一些实施方案。
[0179]
实施例
[0180]
实施例1、pd-l1人源化抗体
[0181]
pd-l1抗体来源于免疫动物得到的鼠杂交瘤克隆pdl1-3f2,其抗体可变区序列如下:
[0182]
pdl1-3f2轻链可变区的氨基酸序列如seq id no.1所示,其cdr1、cdr2和cdr3分别如seq id no.2、3、4所示,其编码核酸如seq id no.5所示。
[0183]
《
‑‑‑‑‑‑‑‑‑
fr1
‑‑‑‑‑‑‑‑‑
》cdr1《
‑‑‑‑‑
fr2
‑‑‑‑‑
》cdr2《
‑‑‑‑‑‑‑‑‑‑‑‑‑
divlaqspatlsvtpgdsvslscrasqsisnnlhwyqqkshesprllikyasqsisgipsrfsgsgsgt
‑‑
fr3
‑‑‑‑‑‑‑‑‑‑‑‑‑
》cdr3《
‑‑
fr4
‑‑
》
[0184]
dftlsinsvetedfgmyfcqqskswpftfgsgtrleik
[0185]
核酸序列
[0186]
gatattgtgctagctcagtctccagccaccctgtctgtgactccaggagatagcgtcagtctttcctgcagggccagccaaagtattagcaacaacctacactggtatcaacaaaaatcacatgagtctccaaggcttctcatcaagtatgcttcccagtccatctctgggatcccctctaggttcagtggcagtggatcagggacagatttcactctcagtatcaacagtgtggagactgaagattttggaatgtatttctgtcaacagagtaaaagctggccattcacgttcggctcggggacaaggttggaaataaaa
[0187]
pdl1-3f2重链可变区的氨基酸序列如seq id no.6所示,其cdr1、cdr2和cdr3分别如seq id no.7、8、9所示,其编码核酸如seq id no.10所示。
[0188]
《
‑‑‑‑‑‑‑‑‑‑‑‑‑‑
fr1
‑‑‑‑‑‑‑‑‑‑‑
》cdr1《
‑‑‑‑‑
fr2
‑‑‑‑‑
》cdr2《
‑‑
dvqlqesgpdlvkpsqtlsltctvtgysitsgynwhwirqfpgnklewmgyihhssitnynpslksris
‑‑‑‑‑‑‑‑‑‑‑
fr3
‑‑‑‑‑‑‑‑‑‑‑‑‑‑
》cdr3《
‑‑‑
fr4
‑‑‑
》
[0189]
itrdtsknqfflqlssvttedtatfycaregydydwfaywgqgtlvtvsa
[0190]
核酸序列
[0191]
gatgtgcagcttcaggagtcaggacctgacctggtgaaaccttctcagacactttcactcacctgcactgtcactggctactccatcaccagtgggtataactggcactggatccggcagtttccaggaaacaaactggaatggatgggctacatacaccacagtagtatcactaactacaacccatctctcaaaagtcgaatctctatcactcgagacacatccaagaaccagttcttcctgcagttgagttctgtgactactgaggacacagccacattttactgtgcaagagaggggtatgattacgactggtttgcttactggggccaagggactctggtcactgtctctgca
[0192]
对鼠单抗pdl1-3f2进行人源化改造,将轻链cdr分别移植到人轻链胚系基因vk3-20和重链胚系基因vh4-59,得到如下不同的重链衍生物和轻链衍生物:
[0193]
表1、pd-l1人源化抗体的轻链可变区序列
[0194]
[0195]
yh23 vkv1轻链可变区的氨基酸序列如seq id no.11所示,其编码核酸如seq id no.12所示,其cdr1、cdr2和cdr3分别如seq id no.2、3、4所示。
[0196]
《
‑‑‑‑‑‑‑‑‑
fr1
‑‑‑‑‑‑‑‑‑
》cdr1《
‑‑‑‑‑
fr2
‑‑‑‑‑
》cdr2《
‑‑‑‑‑‑‑‑‑‑‑‑
eivltqspgtlslspgeratlscrasqsisnnlhwyqqkpgqaprllikyasqsisgipdrfsgsgsgt
‑‑
fr3
‑‑‑‑‑‑‑‑‑‑‑‑‑
》cdr3《
‑‑
fr4
‑‑
》
[0197]
dftltisrlepedfavyfcqqskswpftfgqgtkleik
[0198]
核酸序列
[0199]
gagatcgtgctgacacagagccctggcacactgtcactgtctccaggcgagagagccacactgagctgtagagccagccagagcatcagcaacaacctgcactggtatcagcagaagcctggacaggcccctagactgctgattaagtacgccagccagtctatcagcggcatccccgacagattcagcggctctggctctggcacagacttcaccctgaccatcagcagactggaacccgaggacttcgccgtgtacttctgccagcagagcaagagctggcccttcacatttggccagggcaccaagctggaaatcaag
[0200]
yh23 vkv2轻链可变区的氨基酸序列如seq id no.13所示,其编码核酸如seq id no.14所示,其cdr1、cdr2和cdr3分别如seq id no.15、3、4所示。
[0201]
《
‑‑‑‑‑‑‑‑‑
fr1
‑‑‑‑‑‑‑‑‑
》cdr1《
‑‑‑‑‑
fr2
‑‑‑‑‑
》cdr2《
‑‑‑‑‑‑‑‑‑‑‑‑
eivltqspgtlslspgeratlscrasqsissnlhwyqqkpgqaprllikyasqsisgipdrfsgsgsgt
‑‑
fr3
‑‑‑‑‑‑‑‑‑‑‑‑‑
》cdr3《
‑‑
fr4
‑‑
》
[0202]
dftltisrlepedfavyfcqqskswpftfgqgtkleik
[0203]
核酸序列
[0204]
gagatcgtgctgacacagagccctggcacactgtcactgtctccaggcgagagagccacactgagctgtagagccagccagagcatcagcagcaacctgcactggtatcagcagaagcctggacaggcccctagactgctgattaagtacgccagccagtctatcagcggcatccccgacagattcagcggctctggctctggcacagacttcaccctgaccatcagcagactggaacccgaggacttcgccgtgtacttctgccagcagagcaagagctggcccttcacatttggccagggcaccaagctggaaatcaag
[0205]
表2、pd-l1人源化抗体的重链可变区序列
[0206][0207]
yh23 vhv1轻链可变区的氨基酸序列如seq id no.16所示,其编码核酸如seq id no.17所示,其cdr1、cdr2和cdr3分别如seq id no.7、8、9所示。
[0208]
《
‑‑‑‑‑‑‑‑‑‑‑‑‑‑
fr1
‑‑‑‑‑‑‑‑‑‑‑
》cdr1《
‑‑‑‑‑
fr2
‑‑‑‑
》cdr2《
‑‑
qvqlqesgpglvkpsetlsltctvsgysitsgynwhwirqppgkglewigyihhssitnynpslksrvt
‑‑‑‑‑‑‑‑‑‑‑
fr3
‑‑‑‑‑‑‑‑‑‑‑‑‑‑
》cdr3《
‑‑‑
fr4
‑‑‑
》
[0209]
isrdtsknqfslklssvtaadtavyycaregydydwfaywgqgtlvtvss
[0210]
核酸序列
[0211]
caggttcagctgcaagagtctggacctggcctggtcaagcctagcgagacactgagcctgacctgtaccgtgtccggctactctatcaccagcggctacaactggcactggatcagacagcctccaggcaaaggcctggaatggatcggctacatccaccacagcagcatcaccaactacaaccccagcctgaagtccagagtgaccatcagcagagacacca
gcaagaaccagttctccctgaagctgagcagcgtgacagccgccgatacagccgtgtactactgtgccagagagggctacgactacgattggttcgcttactggggccagggcaccctggttacagtctcttct
[0212]
yh23 vhv2轻链可变区的氨基酸序列如seq id no.18所示,其编码核酸如seq id no.19所示,其cdr1、cdr2和cdr3分别如seq id no.7、20、9所示。
[0213]
《
‑‑‑‑‑‑‑‑‑‑‑‑‑‑
fr1
‑‑‑‑‑‑‑‑‑‑‑
》cdr1《
‑‑‑‑‑
fr2
‑‑‑‑
》cdr2《
‑‑
qvqlqesgpglvkpsetlsltctvsgysitsgynwhwirqppgkglewigyihhssityynpslksrvt
‑‑‑‑‑‑‑‑‑‑‑
fr3
‑‑‑‑‑‑‑‑‑‑‑‑‑‑
》cdr3《
‑‑‑
fr4
‑‑‑
》
[0214]
isrdtsknqfslklssvtaadtavyycaregydydwfaywgqgtlvtvss
[0215]
核酸序列
[0216]
caggttcagctgcaagagtctggacctggcctggtcaagcctagcgagacactgagcctgacctgtaccgtgtccggctactctatcaccagcggctacaactggcactggatcagacagcctccaggcaaaggcctggaatggatcggctacatccaccacagcagcatcacctactacaaccccagcctgaagtccagagtgaccatcagcagagacaccagcaagaaccagttctccctgaagctgagcagcgtgacagccgccgatacagccgtgtactactgtgccagagagggctacgactacgattggttcgcttactggggccagggcaccctggttacagtctcttct
[0217]
将编码上述氨基酸序列的dna进行全序列合成,分别克隆到含有抗体kappa链恒定区或人igg1恒定区ch1-ch3的载体,以制备嵌合抗体。轻、重链质粒进行组合配对后,转染hek293e细胞(safc biosciences),表达3-5天后收集细胞培养液,利用protein a亲和层析纯化得到母本3f2嵌合抗体、pd-l1人源化抗体(yh23-vh1/vk1、yh23-vh1/vk2、yh23-vh2/vk1、yh23-vh2/vk2)。
[0218]
实施例2、pd-l1人源化抗体的结合与阻断活性
[0219]
1、elisa检测人源化抗体与人pd-l1结合
[0220]
在96孔酶标板上包被1μg/ml的人pd-l1蛋白(sinobiological#10084-h08h),4℃过夜。2%的牛奶封闭后,每孔加入100μl重组表达的实施例1制备的pd-l1人源化抗体,室温孵育1小时;用pbst和pbs各洗3遍后,每孔加入100μl hrp标记的抗人igg f(ab)
’2二抗,室温孵育60分钟。用pbst和pbs各洗三遍后,每孔加入100μl tmb底物37℃显色10分钟后,以每孔50μl 2m硫酸溶液终止反应,并在450nm波长处读取吸光度。对照抗体atezolizumab按照imgt公布序列合成,在hek293e细胞中表达制备。
[0221]
检测结果见图1。图1显示,人源化pd-l1抗体在抗原水平上结合pd-l1的能力与母本3f2嵌合抗体以及atezolizumab相当。
[0222]
2、elisa检测人源化抗体阻断人pd-1/pd-l1的结合
[0223]
在96孔酶标板上包被1μg/ml人pd-1重组蛋白(sinobiological#10377-h05h),4℃过夜。用pbs洗三次,每孔加入200μl含有2%的milk封闭1小时。将实施例1制备的pd-l1人源化抗体与生物素标记的人pd-l1蛋白混合,室温孵育30分钟。用pbs洗三次96孔酶标板,每孔加入100μl已孵育好的混合物,室温孵育1小时。分别用pbst和pbs洗三次后,每孔加入100μl sa-hrp,室温避光孵育30分钟。分别用pbst和pbs洗三次后每孔加入100μl tmb底物37℃显色10分钟后,以每孔50μl 2m硫酸溶液终止反应,并在450nm波长处读取吸光度。
[0224]
检测结果见图2。图2显示,人源化pd-l1抗体在抗原水平上对pd-1与pd-l1结合的阻断能力与atezolizumab相当。
[0225]
3、facs检测人源化抗体与细胞膜上pd-l1的结合
[0226]
将人pd-l1全长基因转染cho细胞,48小时后添加8μg/ml嘌呤霉素加压筛选,得到稳定表达人pd-l1的cho-pd-l1细胞株。以每孔5
×
104个细胞计算所需细胞数,取cho-pd-l1稳转细胞300g离心5分钟,吸弃上清;加入1ml的1%bsa洗涤细胞一次。加入3%bsa置于冰上30分钟,用1%的bsa稀释细胞至1
×
106个细胞/ml,将已重悬的细胞100μl/孔铺至96孔板中,300g离心5分钟,弃上清,50μl/孔加入梯度稀释的实施例1制备的pd-l1抗体,冰上孵育45分钟。加入200μl/孔的1%bsa洗涤细胞二次,每孔加入50μl的af647-山羊抗人igg,fcγ二抗溶液,冰上孵育45分钟。加入200μl/孔的1%bsa洗涤细胞三次,每孔加入60μl的5μg/ml pi/pbs溶液染色后上机检测。分析pi阴性细胞群的荧光值。
[0227]
检测结果见图3。图3显示,人源化抗体在细胞水平上对细胞膜上pd-l1的结合能力与母本3f2嵌合抗体以及atezolizumab相当。
[0228]
4、facs检测人源化抗体对细胞膜上pd-l1和pd-1结合的阻断
[0229]
以每孔5
×
104个细胞计算所需细胞数,取cho-pd-l1细胞,300g离心5分钟,吸弃上清;加入1ml的1%bsa洗涤细胞一次。加入3%bsa置于冰上30分钟,用1%的bsa稀释细胞至1
×
106个细胞/ml,将已重悬的细胞100μl/孔铺至96孔板中,300g离心5分钟,弃上清,50μl/孔加入梯度稀释的实施例1制备的pd-l1抗体,冰上孵育45分钟,每孔加入50μl的6μg/ml生物素标记的pd-1抗原,冰上孵育45分钟。加入200μl孔的1%bsa洗涤细胞三次,每孔加入50μl 1:300稀释的sa-pe(jackson immunoresearch,#016-130-084),冰上孵育45分钟。加入200μl/孔的1%bsa洗涤细胞三次,每孔加入60μl的5μg/ml pi/pbs溶液染色后上机检测。分析pi阴性细胞群的荧光值。
[0230]
检测结果见图4。图4显示,人源化抗体在细胞水平上对细胞膜上pd-l1和pd-1结合的阻断能力与母本3f2嵌合抗体以及atezolizumab相当。
[0231]
表3列出了pd-l1抗体与重组蛋白的结合或阻断结果。
[0232]
表3、pd-l1抗体与重组蛋白的结合或阻断
[0233][0234]
实施例3、人源化抗体与pd-l1亲和力测定
[0235]
通过氨基偶联试剂,将10μg/ml人pd-l1重组蛋白偶联到cm5芯片(ge healthcare),流速10μl/min,通过biacoret200控制抗原偶联量约200ru。芯片用缓冲液冲洗至基线平稳后,将梯度稀释的实施例1制备的pd-l1抗体(从10μg/ml起,2倍稀释7个梯度),以30μl/min的流速流过芯片,设置结合时间350秒,解离时间600秒。用biacore t200 evaluation软件以1:1结合模型,拟合得到动力学常数(表4)。
[0236]
表4、pd-l1人源化抗体与pd-l1重组蛋白的亲和力
[0237][0238]
实施例4、人源化抗体对pd-l1信号传导通路的阻断
[0239]
将人pd-1基因转染jurkat细胞(atcc tib-152),48小时后添加0.5μg/ml嘌呤霉素加压筛选,得到稳定表达人pd-1的jurkat细胞株jurkat-pd1,随后将报告质粒pgl4.22-luc2p nfat hygro(promega)转染至jurkat-pd1稳转细胞中,添加200μg/ml潮霉素b筛选,最终得到jurkat pd1 nfat报告基因细胞株。
[0240]
将scfv cd3抗体基因转染cho-pd-l1细胞,得到构建稳定表达cd3抗体和人pd-l1的cho-pd-l1-cd3稳转细胞(wang l等,j pharm biomed anal.2017oct 25;145:447-453),f12完全培养基重悬细胞密度至5
×
105个细胞/ml。将已重悬的细胞100μl/孔铺至96孔板中,将96孔板放至37℃、5%co2培养箱培养18-20小时。收集jurkat pd1nfat细胞,10ml pbs清洗一次,用反应缓冲液重悬细胞密度至2
×
106个细胞/ml。取出96孔板,弃上清,将已重悬的细胞50μl/孔铺至96孔板中,50μl/孔加入实施例1制备的pd-l1抗体,将96孔板放至37℃、5%co2培养箱培养6小时。加入配置好的荧光检测底物溶液,轻轻振荡孔板,室温放置3分钟,用酶标仪检测化学发光。
[0241]
检测结果见图5。图5显示,人源化pd-l1抗体能够有效地阻断表达有pd-1分子的jurkat细胞同cho-pd-l1-cd3细胞结合,其阻断活性与母本3f2嵌合抗体及atezolizumab相当,有药物浓度剂量依赖效应,ic50约2-3nm(表5)。
[0242]
表5、pd-l1人源化抗体对pd-l1/pd1信号通路的阻断
[0243][0244]
实施例5、抗原记忆应答试验
[0245]
用x-vivo15培养基(lonza#04-418q)作为缓冲液,调整pbmc密度至2
×
106个细胞/ml,100μl/孔加入平底96孔板中,8μg/ml cmv 50μl/孔加入孔板中,再加入稀释好的实施例1制备的pd-l1抗体(终浓度20μg/ml,5倍梯度稀释,共两个稀释度)。于37℃、5%co2条件下培养96小时,用human ifn-γelisa kit(bd,货号#555142)测定培养上清中ifn-γ含量。用包被液稀释捕获抗体抗-人ifn-γ(1:250),以100μl/孔加入酶标板,4℃包被过夜。0.05%pbst清洗三次,100μl/孔加入5%小牛血清/pbs,室温封闭1小时。0.05%pbst清洗三次,100
μl/孔加入样品(从培养箱中取出96孔板,1000rpm离心3分钟,取上清,用5%小牛血清/pbs稀释20倍)和梯度稀释的标准品ifn-γ。室温孵育2小时。0.05%pbst清洗五次,100μl/孔加入均用5%小牛血清/pbs稀释250倍的生物素抗-人ifn-γ/sa-hrp,室温孵育1h。0.05%pbst清洗七次,100μl/孔加入显色液,室温避光10-15分钟。50μl/孔加入2m的浓硫酸终止反应,在450nm波长处读取吸光度。
[0246]
检测结果见图6。图6显示,pd-l1人源化抗体可显著刺激t细胞的大量增殖,促进ifn-γ的生成,其活性与母本3f2及atezolizumab相当。
[0247]
实施例6、种属交叉反应
[0248]
在96孔酶标板上分别包被1μg/ml的人和食蟹猴pd-l1蛋白,4℃过夜。2%milk封闭后,每孔加入100μl抗pd-l1抗体,室温孵育1小时;用pbst和pbs各洗3遍后,每孔加入100μl hrp标记的抗人igg f(ab)
’2二抗,室温孵育60分钟。用pbst和pbs各洗三遍后,每孔加入100μl tmb底物37℃显色10分钟后,以每孔50μl 2m硫酸溶液终止反应,并在450nm波长处读取吸光度。
[0249]
检测结果见图7和图8。图7显示,人源化抗体yh23-vh1/vk1与人pd-l1重组抗原的结合;图8显示,人源化抗体yh23-vh1/vk1与食蟹猴pd-l1重组抗原的结合。人源化抗体yh23-vh1/vk1与人和食蟹猴pd-l1的亲和力相当,结合食蟹猴pd-l1略强于atezolizumab(表6)。
[0250]
表6、人源化抗体对人和食蟹猴pd-l1的结合
[0251][0252]
实施例7、pdl1-tgfbrii抗体融合蛋白的构建
[0253]
tgfbr2基因位于人3号染色体3p24.1,含有7个外显子,由于基因的选择性剪接,tgfbrii受体存在多个异构体,genebank显示tgfbrii异构体包括:异构体a(np_001020018.1,其氨基酸序列如seq id no.21所示,编码核酸序列如seq id no.22所示),异构体b(np_003233.4,其氨基酸序列如seq id no.23所示,编码核酸序列如seq id no.24所示),异构体x1(xp_011532345.1,其氨基酸序列如seq id no.25所示,编码核酸序列如seq id no.26所示)和异构体x2(xp_011532347.1,其氨基酸序列如seq id no.27所示,编码核酸序列如seq id no.28所示;xp_016862595.1,其氨基酸序列如seq id no.29所示,编码核酸序列如seq id no.30所示),其区别在于n端胞外区的起始翻译位点不同(图9)。
[0254]
表7、不同tgfβrii异构体序列
[0255][0256]
首先将编码tgfbrii异构体b胞外结构域(24-159)的基因片段,通过柔性接头g
(g4s)3g,连接到实施例1制备的pd-l1人源化抗体(yh23-vh1/vk1)的重链(yh23 vhv1)的c末端,与编码轻链(yh23 vkv1)的序列一同克隆至merck pcgs3表达质粒载体,线性化后转染cho细胞(merck),加压筛选得到mini pool。37℃5%co2125rpm表达8天后,收获细胞培养上清液,利用proteina亲和层析纯化得到重组的抗体融合蛋白pdl1-tgfbrii-01,其中,pd-l1抗体重链与tgfbrii融合的多肽的氨基酸序列如seq id no.31所示,其编码序列如seq id no.32所示;pd-l1抗体轻链的氨基酸序列如seq id no.33所示,其编码序列如seq id no.34所示。质谱分析发现,除了完整pd-l1-tgfbrii蛋白外,纯化蛋白中还存在缺失15kda左右的降解片段(图10),其断裂位点在重链469和473位点(对应tgfbrii受体异构体b第30位lys、第34位asn)。有意思的是,相同质粒在hek293e细胞中表达时未发现降解片段,纯化蛋白进行的强制降解试验显示,37℃孵育10天也同样未见降解片段(结果未显示)。
[0257]
由于tgfbrii异构体x2不含发生降解的位点,因此以异构体x2胞外结构域(1-124)构建得到新的抗体融合蛋白pdl1-tgfbrii-02和pdl1-tgfbrii-03,或对原异构体b中可能产生断裂的位点进行突变后,构建得到抗体融合蛋白pdl1-tgfbrii-04和pdl1-tgfbrii-05(图11)。转染cho-s细胞(thermofisher,r80007),37℃5%co2125rpm表达8天,细胞活率降至80%时,收获细胞培养上清液,利用proteina亲和层析纯化得到重组抗体融合蛋白pd-l1-tgfbrii。
[0258]
表8、pdl1-tgfbrii抗体融合蛋白序列
[0259][0260]
其中,pdl1-tgfbrii-01中的pd-l1抗体重链与tgfbrii融合的多肽的氨基酸序列如seq id no.31所示,其编码序列如seq id no.32所示;pdl1-tgfbrii-01中的pd-l1抗体轻链的氨基酸序列如seq id no.33所示,其编码序列如seq id no.34所示;
[0261]
其中,pdl1-tgfbrii-02中的pd-l1抗体重链与tgfbrii融合的多肽的氨基酸序列如seq id no.35所示,其编码序列如seq id no.36所示;pdl1-tgfbrii-02中的pd-l1抗体轻链的氨基酸序列如seq id no.33所示,其编码序列如seq id no.34所示;
[0262]
其中,pdl1-tgfbrii-03中的pd-l1抗体重链与tgfbrii融合的多肽的氨基酸序列如seq id no.37所示,其编码序列如seq id no.38所示;pdl1-tgfbrii-03中的pd-l1抗体轻链的氨基酸序列如seq id no.33所示,其编码序列如seq id no.34所示;
[0263]
其中,pdl1-tgfbrii-04中的pd-l1抗体重链与tgfbrii融合的多肽的氨基酸序列如seq id no.39所示,其编码序列如seq id no.40所示;pdl1-tgfbrii-04中的pd-l1抗体轻链的氨基酸序列如seq id no.33所示,其编码序列如seq id no.34所示。
[0264]
其中,pdl1-tgfbrii-05中的pd-l1抗体重链与tgfbrii融合的多肽的氨基酸序列如seq id no.41所示,其编码序列如seq id no.42所示;pdl1-tgfbrii-05中的pd-l1抗体轻链的氨基酸序列如seq id no.33所示,其编码序列如seq id no.34所示。
[0265]
使用agilent 1100高效液相色谱仪,tosoh凝胶色谱柱(g3000swxl,7.8*300mm,
5um)对重组蛋白进行鉴定。结果显示,cho细胞表达的pd-l1-tgfbrii-03、pd-l1-tgfbrii-04和pd-l1-tgfbrii-05sec-hplc片段含量均在1%左右,显著低于pd-l1-tgfbrii-01(约20%,见表9)。去糖后质谱检测显示,pd-l1/tgfβrii-01在163kda附近出现tgfbrii脱落的碎片峰,而新的构建体pd-l1-tgfbrii-03、pd-l1-tgfbrii-04和pd-l1-tgfbrii-05均未检测到任何tgfbrii脱落形成的降解片段(图12)。
[0266]
表9、抗体融合蛋白pd-l1-tgfbrii的sec-hplc
[0267][0268]
实施例8、抗体融合蛋白pdl1-tgfbrii与tgfβ的亲和力
[0269]
使用表面等离子体共振(spr),测定完整的抗体融合蛋白pdl1-tgfbrii与人tgfβ1、tgfβ2和tgfβ3的动力学结合活性。将5μg/ml抗体融合蛋白pdl1-tgfbrii以10μl/分钟流速捕获到传感器芯片protein a上,再将人tgfβ1、tgfβ2和tgfβ3(起始浓度为3.9nm,2倍梯度稀释),分别以30μl/分钟的流速通过芯片表面上。每个循环后,用10mm甘氨酸(ph2.0)再生protein a芯片表面。利用biacore t200自带的biacore biaevaluation软件,采用langmuir 1:1kinetics模型拟合得到表观结合常数kd。
[0270]
结果显示,抗体融合蛋白pdl1-tgfbrii-01、pdl1-tgfbrii-03、pdl1-tgfbrii-04和pdl1-tgfbrii-05均以高亲和力结合人tgfβ1、tgfβ2和tgfβ3同源二聚体(表10),和文献报道一致(derynck and budi,sci.signal.12,eaav5183(2019)),重链fc端融合的tgfbrii可同时结合tgfβ二聚体。
[0271]
表10、pdl1-tgfbrii融合蛋白与tgfβ的亲和力
[0272][0273][0274]
实施例9、抗体融合蛋白pdl1-tgfbrii同时结合pd-l1与tgfβ的活性
[0275]
将人pd-l1重组蛋白通过氨基偶联至cm5芯片(ge healthcare),分别捕获完整的抗体融合蛋白pdl1-tgfbrii-01、pdl1-tgfbrii-03和pdl1-tgfbrii-05,再将人tgfβ1、tgfβ2和tgfβ3梯度稀释样品,分别以30μl/分钟的流速通过芯片表面。
[0276]
结果显示,完整的抗体融合蛋白pdl1-tgfbrii可通过fab端,识别并结合到固定于芯片上的pd-l1蛋白,同时fc端融合的tgfbrii以高表观亲和力(2:2)结合人tgfβ1、tgfβ2和tgfβ3同源二聚体,与pdl1-tgfbrii-01相比,结合活性相当(图13)。
[0277]
实施例10、抗体融合蛋白pdl1-tgfbrii的结合与阻断活性
[0278]
1、elisa检测抗体融合蛋白pdl1-tgfbrii与人pd-l1结合
[0279]
在96孔酶标板上包被1μg/ml的人pd-l1重组蛋白,4℃过夜。2%的牛奶封闭后,每
孔加入100μl重组表达的抗体融合蛋白pdl1-tgfbrii,室温孵育1小时;用pbst和pbs各洗3遍后,每孔加入100μl hrp标记的抗人igg f(ab)
’2二抗,室温孵育60分钟。用pbst和pbs各洗三遍后,每孔加入100μl tmb底物37℃显色10分钟后,以每孔50μl 2m硫酸溶液终止反应,并在450nm波长处读取吸光度。抗pd-l1/tgfβ阱对照分子按文献wo2015118175合成,在hek293e中表达并制备。
[0280]
检测结果见图14。图14显示,抗体融合蛋白pdl1-tgfbrii能够与pd-l1结合,ec50为0.18nm,新构建体pdl1-tgfbrii-03、pdl1-tgfbrii-05与pdl1-tgfbrii-01相比,亲和力无显著差别,ec50分别为0.16nm和0.18nm,均与对照分子抗pd-l1/tgfβ阱的亲和力相当。
[0281]
表11列出了抗体融合蛋白pdl1-tgfbrii与pd-l1的结合结果。
[0282]
表11、抗体融合蛋白pdl1-tgfbrii与pd-l1的结合
[0283][0284]
2、elisa检测抗体融合蛋白pdl1-tgfbrii阻断人pd-1/pd-l1的结合
[0285]
在96孔酶标板上包被2μg/ml人pd-1重组蛋白,4℃过夜。用pbs洗三次,每孔加入200μl含有2%的milk封闭1小时。将抗体融合蛋白pdl1-tgfbrii与生物素标记的人pd-1蛋白混合,室温孵育30分钟。用pbs洗三次96孔酶标板,每孔加入100μl已孵育好的混合物,室温孵育1小时。分别用pbst和pbs洗三次后,每孔加入100μl抗鼠igg fc-hrp,室温避光孵育30分钟。分别用pbst和pbs洗三次后每孔加入100μl tmb底物37℃显色10分钟后,以每孔50μl 2m硫酸溶液终止反应,并在450nm波长处读取吸光度。
[0286]
检测结果见图15。图15显示,抗体融合蛋白pdl1-tgfbrii能够阻断pd-1/pd-l1结合,ic50为11.1nm,新构建体pdl1-tgfbrii-03、pdl1-tgfbrii-05与pdl1-tgfbrii-01相比,亲和力无显著差别,ic50均为11.4nm,与对照分子抗pd-l1/tgfβ阱阻断活性相当。
[0287]
表12列出了抗体融合蛋白pdl1-tgfbrii对pd-1和pd-l1结合的阻断结果。
[0288]
表12、抗体融合蛋白pdl1-tgfbrii对pd-1和pd-l1结合的阻断
[0289][0290]
3、facs检测抗体融合蛋白pdl1-tgfbrii与人pd-l1的结合
[0291]
以每孔5
×
104计算所需细胞数,取cho-pd-l1稳转细胞,300g离心5分钟,吸弃上清;加入1ml的1%bsa洗涤细胞一次。加入3%bsa置于冰上30分钟,用1%的bsa稀释细胞至1
×
106个细胞/ml,将已重悬的细胞100μl/孔铺至96孔板中,300g离心5分钟,弃上清,50μl/孔加入一抗溶液,冰上孵育45分钟。加入200μl/孔的1%bsa洗涤细胞二次,每孔加入50μl的af647-山羊抗-人igg,fcγ(1:300)二抗。冰上孵育45分钟。加入200μl/孔的1%bsa洗涤细
胞三次,每孔加入60μl的5μg/ml pi/pbs溶液染色后上机检测。分析pi阴性细胞群的荧光值。
[0292]
结果显示,抗体融合蛋白pdl1-tgfbrii能够与细胞表面的人pd-l1结合,ec50为1.88nm,新构建体pdl1-tgfbrii-03、pdl1-tgfbrii-05与pdl1-tgfbrii-01相比,亲和力无显著差别,ec50分别为2.31nm和1.77nm,与对照分子抗pd-l1/tgfβ阱结合活性相当(图16)。
[0293]
表13列出了抗体融合蛋白pdl1-tgfbrii与pd-l1结合的结果。
[0294]
表13、pdl1-tgfbrii抗体融合蛋白与pd-l1的结合
[0295][0296]
4、facs检测pdl1-tgfbrii抗体融合蛋白阻断人pd-1/pd-l1的结合
[0297]
以每孔5
×
104个细胞计算所需细胞数,取细胞cho-pd-l1稳转细胞,300g离心5分钟,吸弃上清;加入1ml的1%bsa洗涤细胞一次。加入3%bsa置于冰上30分钟,用1%的bsa稀释细胞至1
×
106个细胞/ml,将已重悬的细胞100μl/孔铺至96孔板中,300g离心5分钟,弃上清,50μl/孔加入梯度稀释的抗体,冰上孵育45分钟,每孔加入50μl的6μg/ml的生物素标记的pd-1抗原,冰上孵育45分钟。加入200μl/孔的1%bsa洗涤细胞三次,每孔加入50μl的sa-pe(1:3000)二抗,冰上孵育45分钟。加入200μl/孔的1%bsa洗涤细胞三次,每孔加入60μl的5μg/ml pi/pbs溶液染色后上机检测。分析pi阴性细胞群的荧光值。
[0298]
检测结果见图17。图17显示,抗体融合蛋白pdl1-tgfbrii能够阻断pd-1/pd-l1结合,ic50为0.72nm,新构建体pdl1-tgfbrii-03、pdl1-tgfbrii-05与pdl1-tgfbrii-01相比,亲和力无显著差别,ic50分别为0.70nm和0.63nm,与对照分子抗pd-l1/tgfβ阱阻断活性相当。
[0299]
表14列出了facs检测pdl1-tgfbrii阻断人pd-1/pd-l1结合的结果。
[0300]
表14、facs检测pdl1-tgfbrii阻断人pd-1/pd-l1的结合
[0301][0302]
实施例11、抗体融合蛋白pdl1-tgfbrii对pd1/pd-l1信号通路阻断
[0303]
收集cho-pdl1细胞,10ml pbs清洗一次,f-12完全培养基重悬细胞密度至5
×
105个细胞/ml。将已重悬的细胞100μl/孔铺至96孔板中,将96孔板放至37℃、5%co2培养箱培养18-20小时。收集jurkat pd1 nfat细胞,10ml pbs清洗一次,用反应缓冲液重悬细胞密度至2
×
106个细胞/ml。取出96孔板,弃上清,将已重悬的细胞50μl/孔铺至96孔板中,50μl/孔加入梯度稀释的抗体,将96孔板放至37℃、5%co2培养箱培养6小时。100μl/孔加入配置好的荧光检测底物溶液,轻轻振荡孔板,室温放置3分钟,酶标仪检测化学发光。
[0304]
结果显示,抗体融合蛋白pdl1-tgfbrii能够阻断pd-1/pd-l1结合,ic50为1.1nm,新构建体pdl1-tgfbrii-03、pdl1-tgfbrii-05与pdl1-tgfbrii-01相比,亲和力无显著差别,ic50分别为1.5nm和1.1nm,与对照分子抗pd-l1/tgfβ阱阻断活性相当(图18)。
[0305]
表15列出了抗体融合蛋白pdl1-tgfbrii对pd1/pd-l1信号通路阻断的结果。
[0306]
表15、抗体融合蛋白pdl1-tgfbrii对pd1/pd-l1信号通路的阻断
[0307][0308]
实施例12、抗体融合蛋白pdl1-tgfbrii对tgfβ1诱导smad活化的抑制
[0309]
hek293-sbe luc报告基因细胞株
[0310]
细胞膜tgfbr受体识别tgf-β后,可激活胞内信号转导,通过活化的转录因子smads,进入核内并结合启动子上smad结合元件(sbe),调控下游靶基因的转录。将启动子上的seq id no.43所示的sbe序列元件(5
’‑
ggtacctgagctcagtatgtctagactgaagtatgtctagactgaagtatgtctagactgactcgag-3’),经kpni/xhoi双酶切连入pgl4.22[luc2cp/hygro]质粒(promega),构建得到pgl4.22-luc2p sbe报告质粒,转染hek293细胞(atcc crl-1573),48小时后添加150μg/ml潮霉素b溶液进行加压筛选,得到的稳转细胞作为hek293-sbe luc报告基因细胞株进行单克隆筛选。加入不同浓度的tgf-β1刺激24小时后,检测阳性单克隆细胞株的荧光信号。结果显示,随着加入的tgf-β1浓度增高,构建得到的hek293-sbe luc报告基因细胞表达的荧光信号逐渐增强,表明该细胞株可用于检测tgf-β1对tgf-β/smad信号通路的活化(图19)。
[0311]
hek293-sbe luc报告基因细胞用完全培养液于37℃、5%co2条件下培养,控制细胞浓度为每1ml含3.0~6.0
×
105个细胞。用胰蛋白酶edta溶液(0.25%)消化后,于4℃每分钟300g离心3-5分钟,弃去上清液,收集细胞。用0.5%fbs/dmem培养基将细胞重悬成每1ml含有3.0
×
106个细胞的细胞悬液,接种于96孔无菌荧光检测白板中,每孔100μl,于37℃、5%co2条件下培养。16~18小时后,弃去孔板中细胞上清,加入50μl 0.5%fbs/dmem培养基。将不同浓度的抗体融合蛋白pdl1-tgfbrii与4ng/ml的tgfβ1等体积混合孵育15-30分钟后,再向细胞中加入50μl抗体/tgfβ1混合液,每孔总体积100μl,37℃、5%co2条件下培养24小时后,使用荧光素酶检测试剂盒检测荧光强度,记录测定结果。
[0312]
结果显示,抗体融合蛋白pdl1-tgfbrii能够阻断tgf/smad信号通路,ic50为0.008nm,新构建体pdl1-tgfbrii-03、pdl1-tgfbrii-05与pdl1-tgfbrii-01相比,亲和力无显著差别,ic50分别为0.008nm和0.007nm,与对照分子抗pd-l1/tgfβ阱阻断活性相当(图20)。
[0313]
表16列出了抗体融合蛋白pdl1-tgfbrii对tgfβ1诱导smad活化的抑制情况。
[0314]
表16、pdl1-tgfbrii对tgfβ1诱导smad活化的抑制情况
[0315][0316]
实施例13、抗体融合蛋白pdl1-tgfbrii对tgfβ3诱导nrk-49f产生胶原的抑制
[0317]
收集nrk-49f细胞(atcc,crl-1570),10ml pbs清洗一次,用dmem完全培养基重悬细胞密度至1.3
×
105细胞/ml。将已重悬的细胞600μl/孔铺至24孔板中,将24孔板放至37℃、5%co2培养箱培养18-20小时。弃上清,用pbs洗一次,加100μl/孔的0.1%dmem,37℃、5%co2培养饥饿过夜。弃上清,250μl/孔加入抗体融合蛋白pdl1-tgfbrii梯度稀释的蛋白,250μl/孔加入tgfβ3(20ng/ml),将孔板置于5%co2、37℃培养72小时。取出24孔板,收集上清置于4℃待检。将收集的上清100μl/孔加入酶标板,4℃过夜。用pbs洗1次。加入200μl/孔2%bsa至板内,室温孵育2h。pbs洗4次。每孔加入100μl的一抗兔抗-小鼠胶原抗体,室温孵育2小时。pbs洗4次。每孔加入100μl的二goat anti-rabbit igg-hrp,室温孵育2小时。pbs洗4次。每孔加入100μl tmb底物37℃显色10分钟后,以每孔50μl 2m硫酸溶液终止反应,酶标仪测od450。
[0318]
结果显示,抗体融合蛋白pdl1-tgfbrii能够有效地抑制tgfβ3诱导nrk-49f产生胶原,并且有药物浓度剂量依赖效应(图21)。
[0319]
实施例14、抗体融合蛋白pdl1-tgfbrii在人源化小鼠移植瘤模型中的抑制作用
[0320]
选择6-8周的雌性b-hpd-l1小鼠(南方模式),将稳定转染人pd-l1基因的mc38肿瘤细胞,以5*105/只接种于小鼠皮下。接瘤后连续3天尾静脉注射抗-小鼠cd20抗体18b2 muigg2a(ahuja a等.j immunol.2007)。待肿瘤体积达到~100mm3时,进行随机分组给药。分别设定有给药组10mg/kg pdl1-tgfbrii-03、10mg/kg pdl1-tgfbrii-05、抗pd-l1/tgfβ阱和anti-klh higg4 10mg/kg。给药体积为100μl/只,给药间隔为每3天给药,共给药5次。每一次记录小鼠肿瘤体积及小鼠体重,实验结束后断颈处死小鼠。结果如图22所示,肿瘤生长缓慢,pdl1-tgfbrii-03和pdl1-tgfbrii-05给药后肿瘤消退。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1