具有血管紧张素转化酶抑制活性的单环刺螠多肽及其应用的制作方法
1.本发明属于生物医药技术领域,尤其涉及具有血管紧张素转化酶抑制活性的单环刺螠多肽及其应用。
背景技术:
2.高血压病,是血管内压力持续升高的一种状况,该病大大增加了心脏、大脑、肾脏等器官患病的风险,也大大增加了患其他疾病的风险。
3.血管紧张素转化酶通过将血管紧张素i转化为具有强血管收缩作用的八肽血管紧张素ii,并通过血管舒张作用降解缓激肽,这一过程在调节血压方面发挥重要作用。ace抑制肽也叫血管紧张素转化酶抑制肽,可与ace的两个活性功能区产生竞争性结合,抑制ace活性,抑制血管紧张素i转化为血管紧张素ⅱ。目前,已经从花生、大豆略蛋白、鱼类以及各种肉类的蛋白酶水解产物中分离出血管紧张素转化酶抑制肽。这类ace抑制肽由于其对正常人无降压作用,因此就大大降低了产生降压过度的副作用。它们一般是从食品中直接提取,或是在比较温和的条件下,通过食品级蛋白酶水解蛋白质而获得,安全性较高,而且,这些肽类除了有降压作用之外,还有抗氧化,促进消化,增强人体免疫力等重要生物活性功能。因此,近年来天然食品蛋白来源的ace抑制肽备受关注,成为研制控制和治疗高血压药品的热点之一。但是目前,现有技术中还没有关于单环刺螠来源的ace抑制肽的记载和报道。
技术实现要素:
4.本发明的目的在于提供具有血管紧张素转化酶抑制活性的单环刺螠多肽及其应用,本发明的单环刺螠多肽具有血管紧张素转化酶竞争性抑制活性。
5.为了实现上述发明目的,本发明提供以下技术方案:
6.本发明提供了具有血管紧张素转化酶抑制活性的单环刺螠多肽,所述单环刺螠多肽包括第一多肽和/或第二多肽;所述第一多肽的氨基酸序列如seq id no.1所示;所述第二多肽的氨基酸序列如seq id no.2所示。
7.本发明提供了具有血管紧张素转化酶抑制活性的单环刺螠多肽的制备方法
8.本发明还提供了上述方案所述单环刺螠多肽在制备血管紧张素转化酶竞争性抑制剂中的应用。
9.本发明还提供了上述方案单环刺螠多肽在制备降低血压的药物中的应用。
10.优选的,所述药物中单环刺螠多肽的含量为50~200μm。
11.本发明的有益效果:本发明提供了具有血管紧张素转化酶(ace)抑制活性的单环刺螠多肽,所述单环刺螠多肽包括第一多肽和/或第二多肽;所述第一多肽的氨基酸序列如seq id no.1所示;所述第二多肽的氨基酸序列如seq id no.2所示。本发明的单环刺螠多肽具有ace竞争性抑制活性,其中第一多肽的ace抑制活性ic
50
为0.47mg/ml;第二多肽的ace抑制活性ic
50
为0.38mg/ml。本发明的单环刺螠多肽对huvec细胞的增殖没有抑制作用,能够
拮抗去甲肾上腺素(ne)抑制细胞中no释放的作用,能够抑制由于ne所引起的促进细胞释放et
‑
1的作用,进而达到降压的目的。本发明的单环刺螠多肽通过抑制ace的活性,提高缓激肽含量,影响一氧化氮合成酶(enos)处的磷酸化作用,从而提高enos活性,释放更多的no,进而抑制et
‑
1,达到降血压的效果。
附图说明
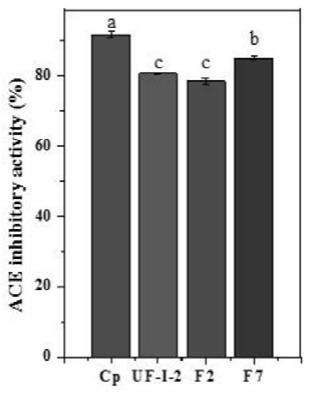
12.图1为2条纯肽的ace抑制活性
a
‑
c
间字母相同无显著性(p>0.05);
13.图2为f2的ace抑制模式lineweaver
‑
burk图;
14.图3为f7的ace抑制模式lineweaver
‑
burk图;
15.图4为f2与ace的结合方式分子模拟对接;
16.图5为f2肽结合模式的二维示意图,虚线表示在肽和结合位点的残基之间形成的相互作用力;
17.图6为f7与ace的结合方式分子模拟对接;
18.图7为f7肽结合模式的二维示意图,虚线表示在肽和结合位点的残基之间形成的相互作用力;
19.图8为不同浓度多肽(f2和f7)对huvec细胞增殖活性的影响,注:a~c间字母相同无显著性(p>0.05);
20.图9为bsa蛋白标准曲线;
21.图10为不同浓度多肽(f2和f7)对huvec细胞no含量的影响,其中:##p<0.01,#p<0.05vs control组;**p<0.01,*p<0.05vs ne组;
22.图11为et
‑
1标准曲线;
23.图12为不同浓度多肽(f2和f7)对人脐静脉内皮细胞et
‑
1含量的影响;
24.图13为不同浓度多肽(f2和f7)对人脐静脉内皮细胞inos活性的影响;其中,##p<0.01,#p<0.05vs control组;**p<0.01,*p<0.05vs ne组;
25.图14为不同浓度多肽(f2和f7)对人脐静脉内皮细胞enos(b)活性的影响;其中,##p<0.01,#p<0.05vs control组;**p<0.01,*p<0.05vs ne组。
具体实施方式
26.本发明提供了具有血管紧张素转化酶抑制活性的单环刺螠多肽,所述单环刺螠多肽包括第一多肽和/或第二多肽;所述第一多肽的氨基酸序列如seq id no.1所示,具体为ile
‑
val
‑
lys
‑
his
‑
phe;所述第二多肽的氨基酸序列如seq id no.2所示,具体为:ile
‑
val
‑
met
‑
arg
‑
ile。
27.本发明还提供了上述方案所述单环刺螠多肽在制备血管紧张素转化酶竞争性抑制剂中的应用。
28.本发明还提供了上述方案单环刺螠多肽在制备降低血压的药物中的应用:所述药物中单环刺螠多肽的含量优选为50~200μm,更优选为100~150μm。
29.下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属
于本发明保护的范围。
30.实施例1本发明的单环刺螠多肽对血管内皮细胞中血压调控因子的影响
31.1、实验材料与仪器
32.1.1实验材料
33.f2:ile
‑
val
‑
lys
‑
his
‑
phe
34.f7:ile
‑
val
‑
met
‑
arg
‑
ile
35.人脐静脉内皮细胞(huvec),由中科院上海生科院细胞库提供。
36.1.2主要试剂参见表1
37.表1主要试剂
38.[0039][0040]
1.3实验仪器参加表2
[0041]
表2实验仪器
[0042][0043]
2实验方法
[0044]
2.1多肽抑制模式
[0045]
根据先前研究报道的方法(参见【forghani b,zarei m,ebrahimpour a,et al.purification and characterization of angiotensin converting enzyme
‑
inhibitory peptides derived from stichopus horrens:stability study against the ace and inhibition kinetics[j].journal of functional foods,2016,20:276
‑
290.】),通过使用lineweaver
‑
burk图确定多肽的acei活性动力学。根据“acei活性的测定”部分,将hhl溶解在硼酸钠缓冲液中,按照实验需求依次配制hhl溶液,至终浓度为8mg/ml、4mg/ml、2mg/ml、1mg/ml和0.5mg/ml。将多肽溶于去离子水中至终浓度为1mg/ml和0.5mg/ml。不同浓度的多肽与不同浓度的hhl反应。取20μl反应溶液,使用如下方法测定两种固定多肽的浓度(0.5mg/ml、1mg/ml)的ha峰面积。用1/[s]和1/area描绘lineweaver
‑
burk曲线,
并通过比较所获得的曲线评估多肽的acei动力学。
[0046]
ha峰面积的测定方法如下:
[0047]
根据cushman和cheung的方法确定ace抑制活性,并稍作了一些修改(参见【li h,aluko r e.kinetics of the inhibition of calcium/calmodulin
‑
dependent protein kinase ii by pea protein
‑
derived peptides[j].the journal of nutritional biochemistry,2005,16(11):656
‑
662.】)。将ace溶于硼酸缓冲液中至终浓度为0.1u/ml以便用于后续实验测定。将超滤冻干所得样品溶解在去离子水中以制备不同浓度的样品肽溶液;然后将180μlhhl溶液与30μl一定浓度的肽溶液混合,将混合物在37℃下孵育5min,随后将15μl、0.1u/mlace添加到上述混合物中以启动反应。将反应在37℃保持60min,然后添加225μl的1m hcl以终止反应。将反应液用0.22μm滤膜过滤,用针管抽取20μl过滤后的反应液加载到rp
‑
hplc中,并在228nm处检测其吸光度。所有测定均重复三次。ace抑制活性计算如下:
[0048][0049]
其中ainhibitor是ace和hhl与抑制剂(acei)反应得到的马尿酸(ha)峰的相对面积。acontrol是无抑制剂的ace和hhl的反应所得的马尿酸(ha)峰的相对面积。
[0050]
2.2分子对接模拟
[0051]
使用autodock软件包(vina,圣地亚哥,加利福尼亚,美国)通过分子对接详细说明纯化的ace抑制肽与ace相互作用的机制及其活性之间的关系。ace的天然晶体结构(pdb代码:1o8a)和ace与卡托普利的晶体复合结构(pdb代码:1uzf)可从protein data bank下载,并使用ucsf chimera 1.13.1软件绘制肽结构并进行能量最小化;autodocktools用于制备ace和用于对接的肽。通过autodock vina,计算结合自由能,并选择对蛋白质显示最低结合亲和力的肽作为最佳构象;使用pymol 2.3.0分子图形系统使蛋白质
‑
配体结构可视化。
[0052]
2.3实验分组及处理
[0053]
将对数生长期的huvec细胞,接种于若干6孔细胞培养板中,每孔1.8ml,细胞数5.0
×
105个/孔,接种结束后将其置于37℃、5%co2的恒温细胞箱中孵育24h,实验时随机分组如下表3所示:
[0054]
表3实验分组与具体实验操作
[0055]
[0056]
2.4多肽对细胞增殖作用的影响(mtt法)
[0057]
将对数生长期的人脐静脉内皮细胞(huvec),接种于若干96孔培养板。每孔180μl,细胞数1.5
×
104个/孔,置于37℃、5%co2的恒温箱中孵育24h。将每个96孔板分为空白对照组和样品组,空白对照组加入20μl pbs,样品组加入20μl的多肽(样品浓度为50μm、100μm、200μm),恒温细胞培养箱中培养24h。每孔加mtt溶液20μl,于37℃、5%co2培养4h,将孔内液体倒置在吸水纸上吸干,每孔再加入180μl的二甲基亚砜(dmso),37℃避光震荡15min,使用酶标仪在570nm波长处测定od值。mtt法测细胞相对存活率,计算公式为:
[0058]
细胞存活率(%)=(od
实验组
/od
空白对照组
)*100%
[0059]
2.5总蛋白含量测定(bca法)
[0060]
将对数生长期的人脐静脉内皮细胞(huvec),接种于6孔培养板中。每孔1.8ml,细胞数5.0
×
105个/孔,置于37℃、5%co2的恒温箱中孵育24h。将每个6孔板分为空白对照组、卡托普利组(cp,1μm)、去甲肾上腺组(ne,0.5μm)、样品组(50μm、100μm、200μm)以及ace抑制肽+ne组(100μm+0.5μm)。
[0061]
细胞处理:轻轻移去6孔板中的培养液,用少量胰酶室温消化3min,随后加完全培养液终止消化,用移液器将依然贴壁的细胞轻轻吹下,并将细胞液吸入到4ml ep管中。在3000r/min条件下离心10min,弃上清,加1ml pbs重悬沉淀的细胞,重复离心两次后留沉淀细胞。在沉淀细胞中加入一定量pbs,在功率300w,冰水浴条件下用细胞超声破碎仪超声,频率为3~5秒/次,间隔4次,每次间隔30秒。实验操作:将所得细胞破碎液用bca试剂盒测其蛋白浓度,具体操作步骤(bca工作液的配制、绘制标准曲线以及样品测定)参照solarbio公司生产的bca试剂盒说明书。根据样品在562nm处的吸光值,带入根据标准品已绘制好的标准曲线可计算得样品的蛋白总含量。
[0062]
2.6no含量测定
[0063]
细胞处理:同2.5总蛋白含量测定的细胞处理方法。
[0064]
实验操作:将所得破碎细胞液用bca试剂盒测其蛋白浓度,其余步骤即具体试剂添加顺序与添加量按南京建成生物工程研究所所生产的no试剂盒说明书进行。将反应所得混合液进行混匀,室温静置10min,波长550nm,光径0.5cm,双蒸水调零,测定各管吸光度值。
[0065]
计算公式为:
[0066][0067]
2.7内皮素(et
‑
1)含量测定
[0068]
细胞处理:同2.5总蛋白含量测定的细胞处理方法。
[0069]
检测原理:该试剂盒采用双抗体一步夹心法进行酶联免疫吸附测定(elisa法)。向预先涂有内皮素
‑
1(et
‑
1)抗体的包被的微孔中,依次加入标本,标准品和辣根过氧化物酶(hrp)标记的检测抗体,在恒温条件下孵育并彻底洗涤。当使用底物四甲基联苯胺(tmb)进行显色时,tmb将被过氧化物酶催化转化为蓝色,而在酸的作用下转化为最终的黄色。颜色的深浅与样品中内皮素1(et
‑
1)的含量呈正相关。用酶标仪测量450nm处的吸光度(od值),绘制标准曲线,并计算样品浓度。
[0070]
实验操作:et
‑
1含量测定的具体操作方法按试剂盒说明书进行。
[0071]
2.8一氧化氮合酶(nos)活力测定
[0072]
细胞处理:同2.5总蛋白含量测定的细胞处理方法。
[0073]
实验操作:将所得破碎细胞液用bca试剂盒测其蛋白浓度,其余步骤按表4进行。
[0074]
表4实验操作表
[0075][0076]
混匀,530nm处,1cm光径,蒸馏水调零,测各管的吸光度值。
[0077]
计算公式如下:
[0078][0079][0080]
3、结果与分析
[0081]
3.1纯化多肽的ace抑制活性分析
[0082]
如图1所示,在1mg/ml的条件下,参照2.1测定第一多肽(f2)和第二多肽(f7)的ace抑制率。测定2条纯肽的活性如下所示:78.34
±
0.85%(f2,642.8da)、84.95
±
0.53%(f7,630.86da)。
[0083]
与卡托普利(91.53
±
0.86%)相比,分别测定f2和f7在不同浓度下的ace抑制率,结果表5所示。
[0084]
表5 f2和f7五条纯肽的ace抑制活性
[0085][0086]
3.2多肽抑制ace抑制模式的表征
[0087]
不同的acei动力学是由肽的不同结构引起的,通常使用lineweaver
‑
burk图确定acei肽的动力学,抑制性参数由y轴和x轴截距表示(参见【刁静静,王凯凯,张丽萍,等.模拟移动床色谱分离纯化绿豆ace抑制肽[j].中国食品学报,2017,17(9):142
‑
150.】)。图2和图3分别表示的是多肽f2和f7的ace抑制作用的lineweaver
‑
burk图。从图2和图3中可以看出,随着多肽f2和f7浓度的增加,三条线在y轴上截取了同一点,这证实了多肽f2和f7与底物竞争ace的活性位点,从而揭示了竞争性抑制模式(参见【rao s,sun j,liu y,et al.ace inhibitory peptides and antioxidant peptides derived from in vitro digestion hydrolysate of hen egg white lysozyme[j].food chemistry,2012,135(3):1245
‑
1252.】)。
[0088]
3.3分子对接
[0089]
为了进一步阐明多肽f2和f7与ace的分子相互作用以及潜在的抑制机制,使用autodock软件进行对接模拟,结果参见图4~图7。已知ace分子中有三个主要的活性位点口袋,包括s1(ala354,glu384和tyr523),s2(gln281,his353,lys511,his513和tyr520)和s3(glu162残基)(参见【wu q,du j,jia j,et al.production of ace inhibitory peptides from sweet sorghum grain protein using alcalase:hydrolysis kinetic,purification and molecular docking study[j].food chemistry,2016,199:140
‑
149.】)。但通过分析ace与卡托普利晶体的复合结构,发现其作用残基除了传统的s1、s2和s3三个活性口袋外,还有his383、his387、phe457三个残基。
[0090]
肽和ace残基主要通过氢键,疏水作用以及极性,范德华力和静电力连接(参见【sun s,xu x,sun x,et al.preparation and identification of ace inhibitory peptides from the marine macroalga ulva intestinalis[j].marine drugs,2019,17(3):179.】)。如图5所示,f2(ivkhf)与ace残基asp377、thr166、tyr523、thr282、ser284、glu376、asp453、glu162之间形成了氢键;与glu376、asp453、glu162形成静电力;通过疏水作用力与his383、val380、phe527、leu375、val379、met450相互作用。如图7所示,多肽f7(ivmri)与ace氨基酸残基his353、cys370、thr372形成氢键;与his387、his383、phe457、phe527、tyr523、trp279形成疏水力;与his513、asp453、asp415、asp377、glu162则通过静电力相互作用。综上,f2与活性s1口袋(tyr523),s3口袋(glu162)有相互作用;f7与s2口袋(his353)相互作用,因此多肽f2和f7是竞争性抑制剂。
[0091]
3.4ace抑制肽对细胞增殖作用的影响
[0092]
如图8所示,与空白对照组相比,多肽f2和f7在浓度50~200μm的范围内,细胞存活率均在90%以上,说明在该系列浓度下,f2和f7ace抑制肽对huvec细胞的增殖没有抑制作用。因此,选择浓度在50~200μm范围内的f2和f7多肽进行下一步实验。
[0093]
3.5总蛋白含量标准曲线的绘制
[0094]
经bca试剂盒测定,计算所得蛋白标准曲线如图9所示:曲线方程为y=1.0077x+0.1,r2=0.997,呈良好的线性关系。可通过此方程计算细胞样本的蛋白浓度,以便于后期相关ace抑制因子计算的使用。
[0095]
3.6no含量的测定
[0096]
从图10中可以看出各实验组中no含量的变化,如图所示:阳性药卡托普利(cp)组与各浓度抑制肽组的no含量呈上升趋势,其中cp组no含量最高,说明其能极大的促进细胞
释放no,从而实现降压;当抑制肽浓度为200μm时,no的释放量较浓度为50μm有极大的提升,因此选择高剂量组(200μm)进行后续实验。从图中可以看出去甲肾上腺素(ne)能够明显抑制细胞中的no释放,当向实验组中加入100μm ace抑制肽后,no含量显著增加,表明ne抑制细胞中no释放的作用可能被一定浓度的ace抑制肽所拮抗,进而达到降压的目的。
[0097]
3.7et
‑
1含量的测定
[0098]
本实验选用elisa试剂盒测定细胞中的et
‑
1含量,在excel中,以标准品浓度作横坐标,各浓度相对应的吸光度值(od值)作纵坐标,绘制标准曲线,并根据曲线方程来计算各样本浓度值。所得标准曲线如图11所示,回归方程为y=0.0111x+0.2561,r2=0.9926,说明该曲线具有较好的拟合能力。
[0099]
从图12中可以看出各组的et
‑
1含量变化,如图所示:与空白组相比,阳性药卡托普利(cp)和单环刺螠ace抑制肽可以显著降低细胞内的et
‑
1含量,并且呈一定程度的浓度依赖关系。由此可知,ace抑制肽(f2和f7)与卡托普利(cp)的作用类似,通过抑制血管内皮细胞释放et
‑
1从而起到降压的作用。与促进细胞no释放的作用相同,均是高浓度组对et
‑
1释放的抑制作用最明显,说明一定浓度的ace抑制肽(acei)能够抑制由于去甲肾上腺素(ne)所引起的促进细胞释放et
‑
1的作用。
[0100]
3.8一氧化氮合酶(nos)活力的测定
[0101]
内皮型nos(enos)在维持内皮细胞功能完整性方面发挥了十分重要的作用,它可以激活鸟苷酸环化酶并引起细胞内环磷酸鸟苷(cgmp)增加,从而发挥一系列的生物作用。一旦enos产生的no降低,血管的正常舒张状态不能保持,血压上升。另一方面,诱导型nos(inos)的表达将引发过量的no的产生,而no会与超氧阴离子自由基反应产生过氧化硝基阴离子,从而引起细胞损伤(参见【taddei s,virdis a,ghiadoni l,et al.vitamin c improves endothelium
‑
dependent vasodilation by restoring nitric oxide activity in essential hypertension[j].circulation,1998,97(22):2222
‑
2229.】)。本实验所选用的nos试剂盒为分型测定试剂盒,可以分别测定总nos(tnos)和诱导型nos(inos),而内皮型nos(enos)可以用tnos减去inos得到。
[0102]
如图13和图14可知:卡托普利和ace抑制肽组可以激活enos,抑制inos的活性,从而释放更多的no。
[0103]
综合3.6与3.7的结果可以看出,多肽(f2和f7)对huvecs释放no及nos活性的影响作用机制为:多肽通过抑制ace的活性,提高缓激肽含量,影响enos处的磷酸化作用从而提高enos活性,释放更多的no,进而抑制et
‑
1,达到降血压的效果。
[0104]
4小结
[0105]
本发明中f2(ile
‑
val
‑
lys
‑
his
‑
phe,642.8da)和f7(ile
‑
val
‑
met
‑
arg
‑
ile,630.86da)的ace抑制活性良好,其ic
50
分别为f2(0.47mg/ml),f7(0.38mg/ml)。
[0106]
通过酶动力学研究,绘制lineweaver
‑
burk图发现,随着多肽f2和f7的浓度增加,三条线在y轴上相交于同一点,从而揭示了其为竞争性抑制模式。为了进一步阐明多肽f2和f7与ace分子的相互作用以及潜在的抑制机制,使用autodock软件进行对接模拟。分子对接结果与lineweaver
‑
burk图结果相一致,进一步证实f2和f7是竞争性抑制剂。
[0107]
细胞水平实验验证了:在50~200μm的浓度范围内,具有ace抑制活性的多肽(f2和f7)对huvecs的增殖无显著性抑制作用,其细胞存活率皆为90%以上,说明此五条多肽在该
浓度范围内对huvecs无毒副作用。对属于血管舒张因子的no,f2和f7与降压药物卡托普利均显示出不同程度的促进所用;对属于血管紧张因子的et
‑
1,f2和f7也呈现出不同程度的抑制作用;对于一氧化氮合酶(nos)的不同类型,其能激活enos,抑制inos的活性,从而释放更多的no。f2和f7对内皮型nos(enos)和诱导型nos(inos)的双重作用表明其对细胞的降压功能具有一定的促进作用。
[0108]
综上所述:f2和f7与阳性药(卡托普利,cp)均可以促进细胞激活内皮型nos(enos),抑制诱导型nos(inos)的活性从而释放更多的no,以达到降低血压的目的。f2和f7还能够延迟由ne引起的内皮细胞的增殖,纠正其生理功能,增加no含量,降低et含量,从而达到降压的效果。
[0109]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1