3D多器官共培养芯片的制作方法
3d多器官共培养芯片
技术领域
[0001]
本申请涉及生物组织工程技术领域,例如涉及一种3d多器官共培养芯片。
背景技术:
[0002]
常规的2d细胞培养已经发展了将近一个世纪,且在生物医药领域贡献了巨大的价值,但是,2d培养方式,不能实现多种细胞类型的组织特异性、以及分化功能或者精确预测体内的组织功能和药物活性。体外构建的3d细胞模型可以更好地代表活体组织的空间和化学复杂性模型。与传统2d模型相比,3d细胞模型在研究组织功能的分子机制、收集信号通路、以及某些疾病药物响应中具有很大优势。然而传统3d模型也有一些限制性,比如,类器官是大小和形状多变的,很难将细胞固定在一致的位置上进行下一步的分析。除此之外,很多3d模型系统,缺乏微小尺度结构以及多器官共培养的组织-组织界面。比如,血管内皮细胞层以及周围结缔组织和实质细胞,这个对所有器官来说都是至关重要的。而且,细胞通常无法暴露在正常的机械信号如流体剪切力、张力、压缩力中,这些都会影响器官的发育和功能。缺乏流体流动,会影响培养的组织细胞、循环血细胞以及免疫细胞之间的相互作用。
[0003]
微流控器官芯片技术是一种新兴的技术,则可以克服这些限制。器官芯片包括持续灌流的模拟组织和器官水平的生理结构的细胞培养通道,可以重现多细胞的结构、组织-组织界面、物理化学微环境以及身体的血管灌注,这些装置可以再现组织和器官的功能水平。而且,可以实现活细胞高分辨率、实时成像,以及监测生物化学、基因、代谢活性。这个技术有很大的潜力,促进组织发育、器官生理和疾病病理学的研究。在药物发现和开发过程中,器官芯片技术在先导化合物研究、药物毒性测试以及生物标志物鉴定过程中有重要作用。器官芯片技术可以构建低成本的体外模型,重现组织和器官水平的功能。
[0004]
在实现本公开实施例的过程中,发现相关技术中至少存在如下问题:现有的共培养微流控器官芯片应用范围狭窄,普适性差,模型构建操作复杂,流体控制方式复杂。
技术实现要素:
[0005]
为了对披露的实施例的一些方面有基本的理解,下面给出了简单的概括。所述概括不是泛泛评述,也不是要确定关键/重要组成元素或描绘这些实施例的保护范围,而是作为后面的详细说明的序言。
[0006]
本公开实施例提供一种3d多器官共培养芯片,以解决现有的共培养微流控器官芯片应用范围狭窄,普适性差,模型构建操作复杂,流体控制方式复杂的问题。
[0007]
在一些实施例中,所述3d多器官共培养芯片,包括:芯片本体,其上设置有一组或多组培养模块;其中,每组培养模块,包括:
[0008]
储液孔,一端为敞口且位于芯片本体的上表面;
[0009]
第一培养微孔,位于储液孔下方且与储液孔连通;
[0010]
第二培养微孔,位于第一培养微孔下方且与第一培养微孔连通;
[0011]
多个第二流体操作孔,一端呈敞口且位于芯片本体的上表面,另一端分别通过通
道与第二培养微孔连通。
[0012]
本公开实施例提供的3d多器官共培养芯片,可以实现以下技术效果:
[0013]
本公开实施例提供的3d多器官共培养芯片,结构简单,通过通道(例如,贯通通道)将第二流体操作孔与第二培养微孔连通,通过储液孔和流体操作孔进行简单操作,方便细胞接种、换液、取样等操作,操作简单,不需要专业技术人员,扩大了培养芯片的应用范围,普适性提高。第一和第二培养微孔可灵活实现2d和3d器官单独或共培养。基于重力的流体驱动是是一种简单、精准的流体控制方式,可实现第二培养微孔内培养环境的实时动态更新,而且,可实现多器官的长时间体外动态共培养。多个培养模块按照多孔板间距高通量布局,与高通量、自动化设备兼容。还可以结合物理作用力包括生理水平相关的流体剪切力、循环压力和机械压缩力,可以实现器官特异性的响应如聚集循环免疫细胞、响应药物、毒素以及其他环境干扰。而且,可实现多器官的长时间体外动态共培养。
[0014]
以上的总体描述和下文中的描述仅是示例性和解释性的,不用于限制本申请。
附图说明
[0015]
一个或多个实施例通过与之对应的附图进行示例性说明,这些示例性说明和附图并不构成对实施例的限定,附图中具有相同参考数字标号的元件示为类似的元件,附图不构成比例限制,并且其中:
[0016]
图1是本公开实施例提供的一种3d多器官共培养芯片的培养模块的结构爆炸示意图;
[0017]
图2是本公开实施例提供的另一种3d多器官共培养芯片的培养模块的结构爆炸示意图;
[0018]
图3是本公开实施例提供的一种3d多器官共培养芯片的培养模块的俯视结构示意图;
[0019]
图4是本公开实施例提供的另一种3d多器官共培养芯片的培养模块的结构爆炸示意图;
[0020]
图5是图4所示的培养模块的俯视结构示意图;
[0021]
图6是本公开实施例提供的另一种3d多器官共培养芯片的培养模块的局部结构示意图;
[0022]
图7是本公开实施例提供的另一种3d多器官共培养芯片的培养模块的局部结构示意图;
[0023]
图8是本公开实施例提供的另一种3d多器官共培养芯片的培养模块的结构爆炸示意图;
[0024]
图9是图8所示的培养模块的俯视结构示意图;
[0025]
图10是本公开实施例提供的另一种3d多器官共培养芯片的培养模块的结构爆炸示意图;
[0026]
图11是图10所示的培养模块的俯视结构示意图;
[0027]
图12是本公开实施例提供的另一种3d多器官共培养芯片的培养模块的结构爆炸示意图;
[0028]
图13是图12所示的培养模块的俯视结构示意图。
[0029]
附图标记:
[0030]
11、第一储液层;12、第一培养层;13、第二培养层;14、薄膜层;21、储液孔;22、第一培养微孔;23、第二培养微孔;231、第一侧边;232、第二侧边;233、第三侧边;234、第四侧边;24、第二流体操作孔;2401、第一侧第二流体操作孔;2402、第二侧第二流体操作孔;241、第二操作孔ⅰ;242、第二操作孔ⅱ;243、第二操作孔ⅲ;25、贯通通道;251、第一侧贯通通道;252、第二侧贯通通道;26、旁通通道;261、竖向栅栏;262、竖向微通道;263、横向栅栏;264、横向微通道;27、第一流体操作孔;271、第一侧第一流体操作孔;272、第二侧第一流体操作孔;28、第一连通通道;29、边侧流体操作孔;291、边侧操作孔ⅰ;292、边侧操作孔ⅱ;293、边侧操作孔ⅲ。
具体实施方式
[0031]
为了能够更加详尽地了解本公开实施例的特点与技术内容,下面结合附图对本公开实施例的实现进行详细阐述,所附附图仅供参考说明之用,并非用来限定本公开实施例。在以下的技术描述中,为方便解释起见,通过多个细节以提供对所披露实施例的充分理解。然而,在没有这些细节的情况下,一个或多个实施例仍然可以实施。在其它情况下,为简化附图,熟知的结构和装置可以简化展示。
[0032]
本公开实施例的说明书和权利要求书及上述附图中的术语“第一”、“第二”等是用于区别类似的对象,而不必用于描述特定的顺序或先后次序。应该理解这样使用的数据在适当情况下可以互换,以便这里描述的本公开实施例的实施例。此外,术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含。
[0033]
本公开实施例中,术语“上”、“下”、“内”、“中”、“外”、“前”、“后”等指示的方位或位置关系为基于附图所示的方位或位置关系。这些术语主要是为了更好地描述本公开实施例及其实施例,并非用于限定所指示的装置、元件或组成部分必须具有特定方位,或以特定方位进行构造和操作。并且,上述部分术语除了可以用于表示方位或位置关系以外,还可能用于表示其他含义,例如术语“上”在某些情况下也可能用于表示某种依附关系或连接关系。对于本领域普通技术人员而言,可以根据具体情况理解这些术语在本公开实施例中的具体含义。
[0034]
另外,术语“设置”、“连接”、“固定”应做广义理解。例如,“连接”可以是固定连接,可拆卸连接,或整体式构造;可以是机械连接,或电连接;可以是直接相连,或者是通过中间媒介间接相连,又或者是两个装置、元件或组成部分之间内部的连通。对于本领域普通技术人员而言,可以根据具体情况理解上述术语在本公开实施例中的具体含义。
[0035]
除非另有说明,术语“多个”表示两个或两个以上。
[0036]
需要说明的是,在不冲突的情况下,本公开实施例中的实施例及实施例中的特征可以相互组合。
[0037]
结合图1-11所示,本公开实施例提供一种3d多器官共培养芯片,包括芯片本体,其上设置有一个或多个培养模块。其中,每个培养模块包括储液孔21,第一培养微孔22,第二培养微孔23和多个第二流体操作孔24。储液孔21的一端为敞口且位于芯片本体的上表面。第一培养微孔22用于培养第一器官细胞;位于储液孔21下方且与储液孔21连通。第二培养微孔23用于培养第二器官细胞;位于第一培养微孔22下方且与第一培养微孔22连通。多个
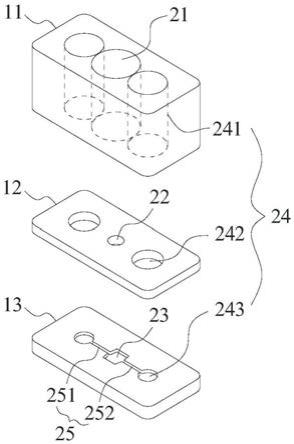
第二流体操作孔24的一端呈敞口且位于芯片本体的上表面,另一端分别通过通道与第二培养微孔23连通。
[0038]
本公开实施例提供的3d多器官共培养芯片,结构简单,通过通道(例如,贯通通道)将第二流体操作孔与第二培养微孔连通,通过储液孔和流体操作孔进行简单操作,方便细胞接种、换液、取样等操作,操作简单,不需要专业技术人员,扩大了培养芯片的应用范围,普适性提高。第一和第二培养微孔可灵活实现2d和3d器官单独或共培养。基于重力的流体驱动是是一种简单、精准的流体控制方式,可实现第二培养微孔内培养环境的实时动态更新,而且,可实现多器官的长时间体外动态共培养。多个培养模块按照多孔板间距高通量布局,与高通量、自动化设备兼容。还可以结合物理作用力包括生理水平相关的流体剪切力、循环压力和机械压缩力,可以实现器官特异性的响应如聚集循环免疫细胞、响应药物、毒素以及其他环境干扰。而且,可实现多器官的长时间体外动态共培养。
[0039]
本公开实施例的3d多器官共培养芯片可用于体外构建多器官模型。其中,第二培养微孔23中培养的第二器官细胞可以是同一器官相关的一种或多种细胞,例如,2种、3种甚至更多种。该共培养芯片可实现多种器官类型的原位2d或3d共培养。可构建用于研究多种器官相互作用的模型,如血管-肿瘤模型、血脑屏障-肿瘤模型等,用于研究血管发生、药物渗透、细胞极化、细胞迁移和药物活性评价等。
[0040]
本公开实施例中,培养模块中,储液孔21中盛放的是培养基或者药物稀释液等,为第一器官细胞提供所需的培养液或者需要测试的药物等。第一培养微孔22内可以3d培养第一器官细胞。第二培养微孔23内培养第二器官细胞,即储液孔21、第一培养微孔22和第二培养微孔23同轴连通设置。而第二流体操作孔24和通道实现第二培养微孔23内的培养液的微流控制,同时通过储液孔21和第二流体操作孔24进行流体操作,是一种简单、精准的流体控制方式。
[0041]
本公开实施例中,储液孔21、第一培养微孔22、第二培养微孔23和第二流体操作孔24的形状不限定,可以是圆孔、椭圆形、正方形、长方形、扇形或多边形(例如六边形、八边形等)等几何形状,在满足设计要求的情况下,储液孔21和第二流体操作孔24的形状以尽量盛放更多的培养基或者药物稀释液为设计依据,第一培养微孔22和第二培养微孔23的形状以便于生长为设计依据。
[0042]
可选地,储液孔21和第二流体操作孔24的形状包括圆形或椭圆形。
[0043]
可选地,第一培养微孔22的形状为圆形。
[0044]
可选地,第二培养微孔23的形状为正方形、长方形或六边形。
[0045]
另外,第一培养微孔22内第一器官细胞的种植和培养采用开放通孔的方式,方便后续上机检测以及细胞回收进行rna、蛋白提取等分析。芯片本体上设置的培养模块的数量和排布形式不限定,依据需要确定即可。
[0046]
本公开实施例中,第二培养微孔23可以是通孔,也可以是凹槽。
[0047]
可选地,第二培养微孔23为通孔。则储液孔21、第一培养微孔22和第二培养微孔23构成通孔,该芯片本体在使用时,配合底板使用即可。
[0048]
可选地,第二培养微孔23为凹槽。则储液孔21、第一培养微孔22和第二培养微孔23构成非通孔,无需配合底板使用。
[0049]
可选地,芯片本体上设置的多个培养模块的数量为12个、24个、36个或96个等,多
个培养模块中的排布方式与现有商品化的加样设备、检测器(如,酶标仪、高内涵成像系统等)兼容匹配。实现高通量器官培养和检测。
[0050]
在一些实施例中,储液孔21的横截面大于第一培养微孔22的横截面;第二培养微孔23的横截面大于或等于第一培养微孔22的横截面。本实施例中,储液孔21的横截面大于第一培养微孔22的横截面,使换液过程不影响第一培养微孔22内的细胞。第二培养微孔23的横截面大于第一培养微孔22的横截面,使第二培养微孔23边缘生长的细胞不与或少与第一培养微孔22中的细胞接触。
[0051]
本公开实施例中,储液孔21的横截面与第二培养微孔23的横截面的相对大小不限定,依据实际需要设定即可。
[0052]
可选地,当储液孔21的横截面大于第一培养微孔22的横截面时,使储液孔21的横截面大于所述第二培养微孔23的横截面。便于培养操作和观察。
[0053]
本公开实施例中,培养模块中,储液孔21、第一培养微孔22和第二培养微孔23的具体尺寸参数可依据实际需要确定,在此不作限定。
[0054]
本公开实施例中,储液孔21采用柱孔设计,降低孔间交叉污染的风险,减少蒸发导致的边缘效应。
[0055]
本公开实施例中,第一培养微孔22与第二培养微孔23连通,此处的连通作广义理解,不但包括第一培养微孔22与第二培养微孔23直接连通(如图1所示),也包括两者之间通过隔膜连通,例如,如图2所示,第一培养微孔22与第二培养微孔23之间设置薄膜层14,但该薄膜层14上分布有微纳尺寸的孔,通过这些微纳尺寸的孔,第一培养微孔22与第二培养微孔23内的培养液可以进行物质交换,也认为是第一培养微孔22与第二培养微孔23连通。依据第一培养微孔22与第二培养微孔23之间是直接连通,还是隔膜连通,可以构建不同的器官模型,进行相关的研究。
[0056]
可选地,第一培养微孔22与第二培养微孔23之间的连通方式为直接连接,即没有设置隔膜。由该种培养模块构成的3d多器官共培养芯片定义为无膜芯片。针对该无膜芯片,在进行器官细胞种植时,通过3d基质将两种器官进行物理隔离,3d培养的第一器官和第二器官细胞、分泌因子可以通过基质产生互作。由无膜芯片构建的器官模型可用于研究两种器官来源细胞的相互作用,研究细胞的诱导迁移、研究血管与各种组织器官的共培养过程中,血管的生长、出芽等。
[0057]
可选地,第一培养微孔22与第二培养微孔23之间的连通方式为隔膜连接。由该种培养模块构成的3d多器官共培养芯片定义为有膜芯片。针对该种有膜芯片,第一培养微孔22内的第一器官细胞与第二培养微孔23内的第二器官细胞之间通过隔膜相通,既可以实现物理隔离,又可以实现生物和化学因子的共通讯。由该种有膜芯片构建的器官模型可用于模拟屏障类模型与其他器官的相互作用,如血脑屏障,隔膜层为人脑微血管内皮细胞粘附提供机械支撑。通道(例如,贯通通道)可以实现流体流动为屏障形成提供必需的剪切力。用于基于血脑屏障的神经类药物、肿瘤类药物筛选及相关研究,例如,用于血脑屏障的抗脑胶质瘤化合物。
[0058]
在一些实施例中,结合图3所示,第二流体操作孔24呈阶梯孔,且由芯片本体的上表面至内部,阶梯孔的孔径变小。减少接种的细胞在第二流体操作孔24的底部的沉降。可选地,阶梯孔包括一阶阶梯孔或者二阶阶梯孔。依据实际需要确定即可。具体可参见下述的一
种3d多器官共培养芯片的具体结构形式中关于阶梯孔的相关内容。
[0059]
在一些实施例中,储液孔21与第二流体操作孔24的中心间距是1~10mm。与跨膜电阻仪电极兼容,可实时测量teer值。其中,中心间距是指的储液孔21的中心与第二流体操作孔24的中心之间的距离。
[0060]
可选地,储液孔21与第二流体操作孔24的中心间距是3~8mm。
[0061]
在一些实施例中,培养模块中,多个第二流体操作孔24成对设置;每对第二流体操作孔24通过一个贯通通道25连通;贯通通道25包括第一侧贯通通道251和第二侧贯通通道252,且第一侧贯通通道251与第二侧贯通通道252相对设置于第二培养微孔23的相对两侧。本公开实施例中,与第一侧贯通通道251连通的第二流体操作孔24定义为第一侧第二流体操作孔2401,与第二侧贯通通道252连通的第二流体操作孔24定义为第二侧第二流体操作孔2402。在3d器官培养过程中,第一侧第二流体操作孔2401和第一侧贯通通道251可以作为进样通道,第二侧第二流体操作孔2402和第二侧贯通通道252作为出样通道;也可以交换,不限定。在芯片本体的上表面,即可对第一侧第二流体操作孔2401或第二侧第二流体操作孔2402中的培养液进行操作,使第一侧贯通通道251(或者第二侧贯通通道252)内的培养液流入第二培养微孔23中,第二培养微孔23中的培养液再流入第二侧贯通通道252(或者第一侧贯通通道251)内,实现第二培养微孔23内的培养液的连通和流动。
[0062]
在一些实施例中,如图1和图2所示,第一种培养模块,包括储液孔21、第一培养微孔22,第二培养微孔23,两个第二流体操作孔24(一对第二流体操作孔24),以及一个贯通通道25;储液孔21、第一培养微孔22和第二培养微孔23由上至下依次连通且同轴设置;两个第二流体操作孔24分别位于储液孔21的两侧;第一侧第二流体操作孔2401通过第一侧贯通通道251与第二培养微孔23连通,第二侧第二流体操作孔2402通过第二侧贯通通道252与第二培养微孔23连通。
[0063]
当然,还可以在前述的第一种培养模块的基础上,增加贯通通道25的数量,并相应地增加第二流体操作孔24对数,即一个贯通通道25对应一对第二流体操作孔24,来获得不同变形的培养模块,在此不再赘述。
[0064]
在一些实施例中,培养模块中,还包括,多个边侧流体操作孔29和旁通通道26,边侧流体操作孔29的一端呈敞口且位于芯片本体的上表面;旁通通道26的两端分别与一个边侧流体操作孔29连通,中部与第二培养微孔23连通。本公开实施例中,旁通通道26内可添加与第二培养微孔23内的细胞属于同一器官的其他类型细胞,在旁通通道26与第二培养微孔23的连通处实现共培养。而一个旁通通道26的两端的边侧流体操作孔29内可以填充细胞培养液,且实现微流培养。
[0065]
可选地,旁通通道26与第二培养微孔23的连通处设置为一个或多个微通道。此处,微通道可以通过在连通处的连通口上设置栅栏(一个或多个)而形成的一个或多个微通道。微通道的尺寸不限定,以能够使得旁通通道26内的细胞不能通过进入第二培养微孔23内,但能够实现物质交换为依据。实现旁通通道26内的细胞与第二培养微孔23内的细胞进行物理分离,同时实现旁通通道26与第二培养微孔23的细胞分泌因子交换。
[0066]
结合图4和图5所示,旁通通道26与第二培养微孔23的连通处设置有多个栅栏,形成多个微通道。多个栅栏以及微通道的构造方式不限定。
[0067]
可选地,如图4和图5所示,在旁通通道26的中部的一侧侧壁与第二培养微孔23的
连通口上以设定间隔设置一个或多个竖向栅栏261,将连通口分隔为多个竖向且平行的竖向微通道262。可以通过控制竖向微通道高度和宽度控制第二培养微孔23和旁通通道26内的细胞或3d基质独立生长又保持因子交换。
[0068]
可选地,在旁通通道26的中部的一侧侧壁与第二培养微孔23的连通口上沿横向设置一个或多个横向栅栏263。当沿横向设置一个横向栅栏263时,该一个横向栅栏设置于连通口的竖向上的中间,即在该一个横向栅栏的上方和下方分别形成一个横向微通道264。当沿横向设置多个横向栅栏时,以设定间隔设置即可。
[0069]
结合图7所示,旁通通道26与第二培养微孔23的连通处设置为一个微通道。一个微通道的构造方式不限定,可选地,在旁通通道26的中部的一侧侧壁与第二培养微孔23的连通口上沿横向设置一个横向栅栏262,将连通口的下部(如图7所示)或上部遮挡,从而在该一个横向栅栏262的上方(如图7所示)或下方形成一个横向微通道264。
[0070]
在一些实施例中,旁通通道26设置在未与贯通通道25连通的第二培养微孔23的另外两个相对侧的两侧或单侧。则,相应地增加与旁通通道26的数量相同的对数的第二流体操作孔24,分别对应与旁通通道26的两端口连通。
[0071]
可选地,如图4和图5所示,第二种培养模块,其是在第一种培养模块的基础上,增加了两个旁通通道26,分别设置在未与贯通通道25连通的第二培养微孔23的另外两个相对侧;且旁通通道26与第二培养微孔23的连通处的连通口利用多个竖向栅栏261分隔设置为多个竖向微通道262。并相应地增加了两对边侧流体操作孔29,分别对应与两个旁通通道26的四个端口连通。
[0072]
可选地,第二种培养模块的一种变形,其是在第一种培养模块的基础上,只增加了一个旁通通道26,设置在未与贯通通道25连通的第二培养微孔23的另外两个相对侧中的单侧;且旁通通道26与第二培养微孔23的连通处的连通口利用多个竖向栅栏261分隔设置为多个竖向微通道262。并相应地增加了一对边侧流体操作孔29,对应与一个旁通通道26的两个端口连通。参考图4和图5,仅在其中一个侧边上增加一个旁通通道26即可。
[0073]
在一些实施例中,如图7所示,第三种培养模块,其是第二种培养模块的基础上,将旁通通道26与第二培养微孔23的连通处的连通口设置为一个微通道。该一个微通道的构建参见前述相关内容,在此不再赘述。
[0074]
在一些实施例中,参见图4至图7所示,旁通通道26的延伸方向与贯通通道25的延伸方向一致。使第二培养微孔23中的培养液的流动呈一定规律,培养效果好。例如,利用重力驱动的双向流动或单向驱动流动。
[0075]
可选地,如图7所示,所述第二培养微孔呈方形,具有第一侧边231、第二侧边232、第三侧边233和第三侧边233。其中,第一侧边231和第二侧边232为相对的两侧边,第三侧边233和第四侧边234为相对的两侧边;在第一侧边231侧设置贯通通道25的第一侧贯通通道251,第二侧边232侧设置贯通通道25的第二侧贯通通道252,在第三侧边233和/或第四侧边234上开设连通口,用于与旁通通道26的中部连通。
[0076]
在一些实施例中,结合图8至图13所示,培养模块,还包括多个第一流体操作孔27;多个第一流体操作孔27的一端呈敞口且位于芯片本体的上表面,另一端分别通过第一连通通道28与储液孔21连通。通过第一连通通道28实现储液孔21与第一流体操作孔27内的流体的连通和流动,则对第一流体操作孔27内培养液进行操作,可实现储液孔21内的培养液的
流动,即使处于储液孔21内培养液包围的第一培养微孔22内的培养环境处于流动状态,形成动态培养环境。
[0077]
本公开实施例中,多个第一流体操作孔27的设置位置和数量不限定,只要通过操作其内的培养液可实现储液孔21内的培养的流体即可。可选地,多个第一流体操作孔27分为两组,分别设置于储液孔21的相对两侧。即多个第一流体操作孔27分为第一侧第一流体操作孔271和第二侧第一流体操作孔272。其中,此处的第一侧和第二侧可以与前述第二流体操作孔24部分的第一侧和第二侧相同。
[0078]
可选地,培养模块中,多个第一流体操作孔27成对设置,每对第一流体操作孔27分别设置于储液孔21的相对两侧。
[0079]
可选地,培养模块中,包括两个第一流体操作孔27,分别设置于储液孔21的相对两侧。如图10至图13所示,第一流体操作孔27设置于储液孔21的过直径的相对两侧,且与贯通通道25平行。或者,如图8和图9所示,两个第一流体操作孔27与储液孔21中心连线呈设定夹角,即第一流体操作孔27设置于非过直径的相对两侧。其中,设定夹角不限定。即,本公开实施例中的第一流体操作孔27的设置位置不限定。
[0080]
本公开实施例中,在前述的第一种培养模块、第二种培养模块和第三种培养模块的基础上,分别增加多个第一流体操作孔27,使之分别通过第一连通通道28与储液孔21连通,形成对应的第四种培养模块、第五种培养模块和第六种培养模块。
[0081]
本公开实施例的3d多器官共培养芯片中,只要具有前述的一个或多个培养模块即可,具体的构成形式不限定。下面给出一种3d多器官共培养芯片的具体结构形式,但不限于该种具体结构形式。
[0082]
在一些实施例中,芯片本体,包括:
[0083]
第一储液层11,其上设置有储液孔21、第二流体操作孔24的第二操作孔ⅰ241;
[0084]
第一培养层12,其上设置有第一培养微孔22、第二流体操作孔24的第二操作孔ⅱ242;第一培养层12叠置于第一储液层11下方,且使得第一培养微孔22与储液孔21连通;第二操作孔ⅱ242与第二操作孔ⅰ241连通;
[0085]
第二培养层13,其上设置有第二培养微孔23和通道(例如,贯通通道25);第二培养层13叠置于第一培养层12下方,且使得第二培养微孔23与第一培养微孔22连通,通道连通第二培养微孔23与第二操作孔ⅱ242。
[0086]
本公开实施例中,芯片本体包括三层芯片结构,将三层芯片结构按顺序叠置连接即可。可以利用双面胶、超声、热键合、plasma、热压等封接工艺将各层芯片粘结组装到一起。其中,第一储液层11和第一培养层12可合并设置为一层结构进行加工,依据实际情况确定即可。
[0087]
本公开实施例中,芯片本体中的各层芯片结构的材质为聚甲基丙烯酸甲酯(pmma)、聚二甲基硅氧烷(pdms)、聚碳酸酯(pc)、ps、coc、cop等一种或几种。各层结构的制作可以采用软光刻、塑模法、激光刻蚀、机加工、liga或者一次性注塑等方式获得各层芯片结构。
[0088]
可选地,第二流体操作孔24呈阶梯孔;且第二操作孔ⅰ241的孔径大于第二操作孔ⅱ242的孔径。本实施例的第二流体操作孔24为一阶阶梯孔。
[0089]
本公开实施例中,第二培养层13上的通道(贯通通道25)与第一培养层12上的第二
操作孔ⅱ242连通。连通方式不限定。可选地,使通道的一端延伸至第二操作孔ⅱ242内,使两者连通。
[0090]
可选地,第二培养层13上还设置有孔槽,通道的一端口设置于该孔槽的侧壁,即孔槽可视为第二流体操作孔24的第二操作孔ⅲ243。
[0091]
可选地,第二操作孔ⅰ241的孔径大于第二操作孔ⅱ242的孔径,第二操作孔ⅱ242的孔径大于第二操作孔ⅲ243的孔径。减少接种细胞时细胞在孔内的驻留。本实施例的第二流体操作孔24为二阶阶梯孔。
[0092]
可选地,第二操作孔ⅰ241的孔径等于第二操作孔ⅱ242的孔径,第二操作孔ⅱ242的孔径大于第二操作孔ⅲ243的孔径。第二操作孔ⅰ241和第二操作孔ⅱ242大小相同,减少气泡的产生,第二操作孔ⅲ243的孔径最小,减少接种细胞时细胞在孔内的沉积。本实施例的第二流体操作孔24为一阶阶梯孔。
[0093]
在一些实施例中,培养模块包括边侧流体操作孔29时,第一储液层11上还设置有边侧流体操作孔29的边侧操作孔ⅰ291,第一培养层12上还设置有边侧流体操作孔29的边侧操作孔ⅱ292,边侧操作孔ⅱ292与边侧操作孔ⅰ291连通;第二培养层13上还设置有旁通通道26,旁通通道26连通第二培养微孔23与边侧操作孔ⅱ292。
[0094]
本公开实施例中,第二培养层13上的旁通通道26与第一培养层12上的边侧操作孔ⅱ292连通。连通方式不限定。可选地,使旁通通道26的一端延伸至边侧操作孔ⅱ292内,使两者连通。
[0095]
可选地,第二培养层13上还设置有孔槽,旁通通道26的一端口设置于该孔槽的侧壁,即孔槽可视为边侧流体操作孔29的边侧操作孔ⅲ293。
[0096]
本公开实施例中,边侧流体操作孔29的结构形式同前述的第二流体操作孔24。可选地,边侧流体操作孔29呈阶梯孔;阶梯孔的构成形式参考第二流体操作孔24即可。
[0097]
在一些实施例中,培养模块包括第一流体操作孔27时,第一储液层11上还设置有第一流体操作孔27和第一连通通道28。
[0098]
可选地,第一流体操作孔27为直孔。
[0099]
可选地,第一连通通道28贯通设置于储液孔21与第一流体操作孔27之间的侧壁上。
[0100]
在一些实施例中,芯片本体,还包括薄膜层14,薄膜层14上分布微纳尺寸的孔;薄膜层14设置于第一培养微孔22与第二培养微孔23之间。即在前述的三层芯片本体的基础上,增加薄膜层14构成四层芯片本体。本公开实施例中,薄膜层14可以采用透明、带有孔径的聚酯(polyethylene terephthalate,pet)薄膜。在组装本公开实施例的四层芯片本体时,可先将薄膜层14与与第一储液层11和第一培养层12组装后,作为整体再与第二培养层13进行组装。本公开实施例中,薄膜层14的设置需让开第二流体操作孔24与微通道(贯通通道25和旁通通道26)的连通处。
[0101]
本公开实施例中,依据第一培养微孔22与第二培养微孔23之间是否设置薄膜层14将3d多器官共培养芯片区分为无膜芯片和有膜芯片(同前述的无膜芯片和有膜芯片)。
[0102]
在一些实施例中,第一储液层11上设置的储液孔21和第二操作孔ⅰ241呈柱孔。当培养模块包括边侧流体操作孔时,第一储液层上设置的边侧操作孔ⅰ呈柱孔。当培养模块包括第一流体操作孔时,第一流体操作孔呈柱孔。本实施例中,第一储液层11呈上具有多个凸
出其表面的柱孔,避免不同孔内的流体相互影响,避免污染。
[0103]
本公开实施例一种前述的3d多器官共培养芯片用于体外构建多器官模型的应用。下面给出一种具体的多器官模型的体外构建方法,仅作参考,在本公开实施例的3d多器官共培养芯片用于体外构建多器官模型的应用时,不限于采用下述的构建方法。
[0104]
本公开实施例的共培养芯片构建3d血管与肿瘤多器官模型的构建方法,包括以下步骤:
[0105]
将芯片紫外灭菌,灭菌结束后于第二流体操作孔24中加入20μl的低浓度鼠尾i型胶原,37℃孵育,然后弃去,并用pbs清洗三遍。将2ul纤维蛋白(2.5mg/ml)-胶原(0.2mg/ml)凝胶沿第一培养微孔22加入到第二培养微孔23中培养,保证凝胶仅能充满第二培养微孔23,37℃凝固0.5h。
[0106]
消化离心huvecs,用完全培养基重悬成一定浓度(1
×
106cells/ml)的单细胞悬液,在第一侧贯通通道251(包括贯通通道25和旁通通道26)的端口(可定义为进样口)处,加入20μl内皮细胞悬液。并倾斜芯片使内皮细胞充分贴壁于凝固的纤维蛋白和胶原凝胶表面上。
[0107]
在huvecs接种后的第二天消化离心u251细胞,用含有10%血清的培养基重悬成200w/ml的单细胞悬液,在1.5ml ep管中,按照比例加入特定体积的5mg/ml胶原或基质胶等其它基质材料,保证该浓度下3d材料形成良好的三维结构。再按比例加入细胞悬液,移液枪吹打混和均匀,快速高通量转移接种于第一培养微孔22中,根据微孔尺寸每孔6~12μl;细胞种植结束后,将整块芯片转移至37℃培养箱培养。
[0108]
以上描述和附图充分地示出了本公开的实施例,以使本领域的技术人员能够实践它们。其他实施例可以包括结构的以及其他的改变。实施例仅代表可能的变化。除非明确要求,否则单独的部件和功能是可选的,并且操作的顺序可以变化。一些实施例的部分和特征可以被包括在或替换其他实施例的部分和特征。本公开的实施例并不局限于上面已经描述并在附图中示出的结构,并且可以在不脱离其范围进行各种修改和改变。本公开的范围仅由所附的权利要求来限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1