蛋白质异二聚体及其用途的制作方法
蛋白质异二聚体及其用途
背景技术:
1.尽管可以检测针对肿瘤抗原的免疫反应(disis等人(1997)j.clin.oncol.(《临床肿瘤学杂志》)15:3363
‑
3367),但导致疾病的恶性细胞通常不会引发引起排斥的免疫反应。研究证实,可以通过向肿瘤细胞引入诸如细胞因子和共刺激分子等免疫调节分子来增强肿瘤细胞的免疫原性。然而,所引入的免疫调节分子的表达和稳定性通常不尽如人意。由免疫系统细胞产生的诸如细胞因子等免疫调节因子可以直接或间接地活化具有适应性免疫反应的细胞,并且能够在引发保护性抗肿瘤免疫中发挥重要作用。先天免疫系统可以由引起释放诸如ifn
‑
α、tnf
‑
α和白介素等促炎性细胞因子的细菌产物或“危险”信号触发。
2.多个研究已显示,免疫调节因子(诸如白介素)可能适用于对动物模型和癌症患者发挥抗肿瘤作用。然而,白介素在体内具有相对较短的血清半衰期。例如,如通过体外生物检定或通过感染性休克模型系统中的功效所测量的(参见smith等人,cellular immunology(《细胞免疫学》)173:207
‑
214(1996)),il10在小鼠中的半衰期为约2小时到6小时。白介素活性丧失可能由若干因素所致,包含肾清除率、蛋白质水解性降解和血流中的单体化。
3.因此,十分需要可以按工业规模以相对较高产率进行生产并且将在体内具有相对较长半衰期以适用于治疗与细胞和/或组织的过度增殖相关的病症或疾病(例如,各种赘生物、不同类型的癌症和/或肿瘤)的长效免疫调节剂。另外,此类产品的产率应足够高,以避免复杂的纯化工艺和/或降低与不期望的杂质相关的风险。
技术实现要素:
4.本公开解决这类需求同时提供相关优势。本公开涵盖适用于抑制肿瘤生长的蛋白质异二聚体,以及包括所述蛋白质异二聚体的组合物、药物和/或试剂盒。另外,本公开提供了蛋白质混合物,其包括所述蛋白质异二聚体并具有极少(如果有)不期望的杂质(诸如不期望的蛋白质同二聚体或蛋白质聚集体)。本公开还提供了产生蛋白质异二聚体或蛋白质混合物的方法,以及蛋白质异二聚体和/或蛋白质混合物在抑制肿瘤生长(包含但不限于治疗癌症)中的药学用途。
5.一方面,本公开提供了一种蛋白质异二聚体,其包括第一单体成员和不同于第一单体成员的第二单体成员,其中:第一单体成员包括第一fc亚基,第二单体成员包括第二fc亚基,并且第一单体成员与第二单体成员缔合,以通过第一fc亚基与第二fc亚基的复合而形成异二聚体;其中,蛋白质异二聚体进一步包括一个或多个与第一fc亚基或第二fc亚基的羧基端氨基酸直接或间接融合的il10;并且其中,蛋白质异二聚体不包括展现对肿瘤抗原的结合特异性的任何抗体重链可变区或任何抗体轻链可变区。
6.在一些实施方案中,第一单体成员和第二单体成员形成不对称二聚体。
7.在一些实施方案中,所述蛋白质异二聚体包括两个与第一fc亚基或第二fc亚基的羧基端氨基酸直接或间接融合的il10。
8.在一些实施方案中,两个il10彼此直接或间接融合。
9.在一些实施方案中,两个il10通过肽接头彼此融合。
10.在一些实施方案中,两个il10中的第一il10与第一fc亚基或第二fc亚基的羧基端氨基酸直接或间接融合,并且两个il10中的第二il10与第一il10的羧基端氨基酸直接或间接融合。
11.在一些实施方案中,所述一个或多个il10通过肽接头与第一fc亚基或第二fc亚基的羧基端氨基酸融合。
12.在一些实施方案中,第一fc亚基和/或第二fc亚基源自igg分子。在一些实施方案中,igg选自igg1、igg2、igg3和igg4。在一些实施方案中,igg是人igg1。
13.在一些实施方案中,所述蛋白质异二聚体不包括展现对任何肿瘤抗原的结合特异性的任何靶向部分。
14.在一些实施方案中,所述蛋白质异二聚体不包括任何抗体重链可变区或任何抗体轻链可变区。
15.在一些实施方案中,第一fc亚基不同于第二fc亚基,并且第一和/或第二fc亚基包括促进第一fc亚基和第二fc亚基之间的异二聚体化的修饰。
16.在一些实施方案中,第一fc亚基包括第一修饰,并且第二fc亚基包括第二修饰。
17.在一些实施方案中,第一修饰包括在t366位置处的氨基酸取代,以及在选自由以下各项构成的组的一个或多个位置处的氨基酸取代:y349、f405、k409、d399、k360、q347、k392和s354,其中,所述氨基酸的位置根据kabat编号的eu索引确定。
18.在一些实施方案中,第一修饰包括的氨基酸取代选自y349c、y349d、d399s、f405k、k360e、k409a、k409e、q347e、q347r、s354d、k392d和t366w,其中,氨基酸的位置根据kabat编号的eu索引确定。
19.在一些实施方案中,第一修饰包括2至5个氨基酸取代。
20.在一些实施方案中,第一修饰包括在选自以下任一组的一组位置处的氨基酸取代:1)y349和t366;2)y349、t366和f405;3)y349、t366和k409;4)y349、t366、f405、k360和q347;5)y349、t366、f405和q347;6)y349、t366、k409、k360和q347;7)y349、t366、k409和q347;8)t366、k409和k392;9)t366和k409;10)t366、k409、y349和s354;11)t366和f405;12)t366、f405和d399;以及13)t366、f405、y349和s354;其中,所述氨基酸的位置根据kabat编号的eu索引确定。
21.在一些实施方案中,第一修饰包括选自以下任一组的一组氨基酸取代:1)y349c和t366w;2)y349c、t366w和f405k;3)y349c、t366w和k409e;4)y349c、t366w和k409a;5)y349c、t366w、f405k、k360e和q347e;6)y349c、t366w、f405k和q347r;7)y349c、t366w、k409a、k360e和q347e;8)y349c、t366w、k409a和q347r;9)t366w、k409a和k392d;10)t366w和k409a;11)t366w、k409a和y349d;12)t366w、k409a、y349d和s354d;13)t366w和f405k;14)t366w、f405k和d399s;15)t366w、f405k和y349d;以及16)t366w、f405k、y349d和s354d;其中,所述氨基酸的位置根据kabat编号的eu索引确定。
22.在一些实施方案中,第二修饰包括在t366、l368和y407位置处的氨基酸取代,以及在选自由d356、d399、e357、f405、k360、k392、k409和q347构成的组的一个或多个位置处的氨基酸取代,其中,氨基酸的位置根据kabat编号的eu索引确定。
23.在一些实施方案中,第二修饰包括的氨基酸取代选自d356c、d399s、e357a、f405k、
k360e、k392d、k409a、l368a、l368g、q347e、q347r、t366s、y407a和y407v,其中,氨基酸的位置根据kabat编号的eu索引确定。
24.在一些实施方案中,第二修饰包括4至6个氨基酸取代。
25.在一些实施方案中,第二修饰包括在选自以下任一组的一组位置处的氨基酸取代:1)d356、t366、l368、y407和f405;2)d356、t366、l368和y407;3)d356、t366、l368、y407和q347;4)d356、t366、l368、y407、k360和q347;5)d356、t366、l368、y407、f405和q347;6)d356、t366、l368、y407、f405、k360和q347;7)t366、l368、y407、d399和f405;8)t366、l368、y407和f405;9)t366、l368、y407、f405和e357;10)t366、l368、y407和k409;11)t366、l368、y407、k409和k392;and 12)t366、l368、y407、k409和e357;其中,所述氨基酸的位置根据kabat编号的eu索引确定。
26.在一些实施方案中,第二修饰包括在选自以下任一组的一组位置处的氨基酸取代:1)d356c、t366s、l368a、y407v和f405k;2)d356c、t366s、l368a和y407v;3)d356c、t366s、l368a、y407v和q347r;4)d356c、t366s、l368a、y407v、k360e和q347e;5)d356c、t366s、l368a、y407v、f405k和q347r;6)d356c、t366s、l368a、y407v、f405k、k360e和q347e;7)t366s、l368a、y407v、d399s和f405k;8)t366s、l368g、y407a和f405k;9)t366s、l368a、y407v、f405k和e357a;10)t366s、l368a、y407v和k409a;11)t366s、l368a、y407v、k409a和k392d;12)t366s、l368g、y407a和k409a;13)t366s、l368a、y407v、k409a和e357a;其中,所述氨基酸的位置根据kabat编号的eu索引确定。
27.在一些实施方案中,第一fc亚基包括第一修饰,第二fc亚基包括第二修饰,并且第一修饰和第二修饰包括在选自以下任一组的一组位置处的氨基酸取代:1)第一修饰:y349和t366;和第二修饰:d356、t366、l368、y407和f405;2)第一修饰:y349、t366和f405;和第二修饰:d356、t366、l368和y407;3)第一修饰:y349、t366和k409;和第二修饰:d356、t366、l368、y407和f405;4)第一修饰:y349、t366、f405、k360和q347;和第二修饰:d356、t366、l368、y407和q347;5)第一修饰:y349、t366、f405和q347;和第二修饰:d356、t366、l368、y407、k360和q347;6)第一修饰:y349、t366、k409、k360和q347;和第二修饰:d356、t366、l368、y407、f405和q347;7)第一修饰:y349、t366、k409和q347;和第二修饰:d356、t366、l368、y407、f405、k360和q347;8)第一修饰:t366、k409和k392;和第二修饰:t366、l368、y407、d399和f405;9)第一修饰:t366和k409;和第二修饰:t366、l368、y407和f405;10)第一修饰:t366、k409和y349;和第二修饰:t366、l368、y407、f405和e357;11)第一修饰:t366、k409、y349和s354;和第二修饰:t366、l368、y407、f405和e357;12)第一修饰:t366和f405;和第二修饰:t366、l368、y407和k409;13)第一修饰:t366、f405和d399;和第二修饰:t366、l368、y407、k409和k392;14)第一修饰:t366、f405和y349;和第二修饰:t366、l368、y407、k409和e357;15)第一修饰:t366、f405、y349和s354;和第二修饰:t366、l368、y407、k409和e357;其中,所述氨基酸的位置根据kabat编号的eu索引确定。
28.在一些实施方案中,第一fc亚基包括第一修饰,第二fc亚基包括第二修饰,其中,第一修饰和第二修饰包括选自以下任一组的一组氨基酸取代:1)第一修饰:y349c和t366w;和第二修饰:d356c、t366s、l368a、y407v和f405k;2)第一修饰:y349c、t366w和f405k;和第二修饰:d356c、t366s、l368a和y407v;3)第一修饰:y349c、t366w和k409e;和第二修饰:d356c、t366s、l368a、y407v和f405k;4)第一修饰:y349c、t366w和k409a;和第二修饰:
d356c、t366s、l368a、y407v和f405k;5)第一修饰:y349c、t366w、f405k、k360e和q347e;和第二修饰:d356c、t366s、l368a、y407v和q347r;6)第一修饰:y349c、t366w、f405k和q347r;和第二修饰:d356c、t366s、l368a、y407v、k360e和q347e;7)第一修饰:y349c、t366w、k409a、k360e和q347e;和第二修饰:d356c、t366s、l368a、y407v、f405k和q347r;8)第一修饰:y349c、t366w、k409a和q347r;和第二修饰:d356c、t366s、l368a、y407v、f405k、k360e和q347e;9)第一修饰:t366w、k409a和k392d;和第二修饰:t366s、l368a、y407v、d399s和f405k;10)第一修饰:t366w和k409a;和第二修饰:t366s、l368g、y407a和f405k;11)第一修饰:t366w、k409a和y349d;和第二修饰:t366s、l368a、y407v、f405k和e357a;12)第一修饰:t366w、k409a、y349d和s354d;和第二修饰:t366s、l368a、y407v、f405k和e357a;13)第一修饰:t366w和f405k;和第二修饰:t366s、l368a、y407v和k409a;14)第一修饰:t366w、f405k和d399s;和第二修饰:t366s、l368a、y407v、k409a和k392d;15)第一修饰:t366w和f405k;和第二修饰:t366s、l368g、y407a和k409a;16)第一修饰:t366w、f405k和y349d;和第二修饰:t366s、l368a、y407v、k409a和e357a;17)第一修饰:t366w、f405k、y349d和s354d;和第二修饰:t366s、l368a、y407v、k409a和e357a;其中,所述氨基酸的位置根据kabat编号的eu索引确定。
29.在一些实施方案中,第一fc亚基包括第一修饰,第二fc亚基包括第二修饰,第一修饰包括氨基酸取代t366w和k409a,并且第二修饰包括氨基酸取代t366s、l368g、y407a和f405k,其中,氨基酸的位置根据kabat编号的eu索引确定。
30.在一些实施方案中,一个或多个il10中的至少一个与第二fc亚基直接或间接融合。
31.在一些实施方案中,一个或多个il10中的至少一个与第二fc亚基的羧基端氨基酸直接或间接融合。
32.在一些实施方案中,第二单体成员包括两个il10,所述两个il10中的第一il10与第二fc亚基的羧基端氨基酸直接或间接融合,并且所述两个il10中的第二il10与第一il10的羧基端氨基酸直接或间接融合。
33.在一些实施方案中,第一单体成员不包括任何il10。
34.在一些实施方案中,第一单体成员由第一fc亚基构成。
35.在一些实施方案中,第二单体成员由与第二fc亚基的羧基端氨基酸直接融合或通过肽接头融合的一个il10构成。
36.在一些实施方案中,第二单体成员由与第二fc亚基直接融合或通过肽接头融合的两个il10构成,其中,所述两个il10中的第一il10与第二fc亚基的羧基端氨基酸直接融合或通过肽接头融合,并且所述两个il10中的第二il10与第一il10的羧基端氨基酸直接融合或通过肽接头融合。
37.在一些实施方案中,第二单体成员的氨基酸序列如seq id no.18、no.38、no.53、no.55、no.60和no.62中任一项所示。
38.在一些实施方案中,第一单体成员的氨基酸序列如seq id no.17和no.57中任一项所示。
39.另一方面,本公开提供了一种或多种分离的核酸,其编码根据本公开的蛋白质异二聚体。
40.另一方面,本公开提供了一种或多种载体,其包括根据本公开的一种或多种分离的核酸。
41.另一方面,本公开提供了一种分离的宿主细胞,其包括根据本公开的一种或多种分离的核酸或根据本公开的一种或多种载体。
42.另一方面,本公开提供了一种蛋白质混合物,其包括:1)根据本公开的蛋白质异二聚体;2)由根据本公开的第一单体成员的两个相同拷贝形成的第一同二聚体;以及3)由根据本公开的第二单体成员的两个相同拷贝形成的第二同二聚体;其中,所述蛋白质异二聚体在蛋白质混合物中的百分比为至少50%。
43.在一些实施方案中,第二同二聚体的百分比小于第一同二聚体的百分比。
44.在一些实施方案中,第二同二聚体的百分比为至多10%。
45.在一些实施方案中,蛋白质混合物基本上不包括第二同二聚体。
46.在一些实施方案中,蛋白质混合物由宿主细胞直接产生,没有富集蛋白质异二聚体和/或去除第一或第二同二聚体。
47.另一方面,本公开提供了一种药物组合物,其包括根据本公开的蛋白质异二聚体,或根据本公开的蛋白质混合物,以及可选的药学上可接受的赋形剂。
48.在一些实施方案中,所述蛋白质异二聚体被配制成用于经口施用、静脉内施用、肌肉内施用、肿瘤部位原位施用、吸入、直肠施用、阴道施用、透皮施用或经皮下贮库施用。
49.另一方面,本公开提供了一种根据本公开的蛋白质异二聚体或根据本公开的蛋白质混合物用于制备用于抑制肿瘤或肿瘤细胞生长的药物和/或试剂盒的用途。
50.另一方面,本公开提供了一种根据本公开的蛋白质异二聚体或根据本公开的蛋白质混合物用于制备用于治疗有需要的受试者的癌症的药物的用途。
51.另一方面,本公开提供了一种抑制肿瘤或肿瘤细胞生长的方法,其包括使肿瘤或肿瘤细胞与有效量的根据本公开的蛋白质异二聚体或根据本公开的蛋白质混合物接触。
52.在一些实施方案中,所述接触在体外或体内进行。
53.另一方面,本公开提供了一种治疗有需要的受试者的癌症的方法,其包括向受试者施用有效量的根据本公开的蛋白质异二聚体或根据本公开的蛋白质混合物。
54.另一方面,本公开提供了一种产生根据本公开的蛋白质异二聚体的方法,其包括(i)在实现所述蛋白质异二聚体的表达的条件下培养根据本公开的宿主细胞,以及(ii)收获已表达的蛋白质异二聚体或包括所述蛋白质异二聚体的蛋白质混合物。
55.本领域技术人员能够从下文的详细描述中容易地洞察到本技术的其它方面和优势。下文的详细描述中仅显示和描述了本技术的示例性实施方式。如本领域技术人员将认识到的,本技术的内容使得本领域技术人员能够对所公开的具体实施方式进行改动而不脱离本技术所涉及发明的精神和范围。相应地,本技术的附图和说明书中的描述仅仅是示例性的,而非为限制性的。
56.通过引用并入
57.在本说明书中提及的所有出版物、专利和专利申请均通过引用并入本文,其引用程度如同各个单独的出版物、专利或专利申请被具体地并且分别地指出以引用的方式并入一样。
附图说明
58.本技术所涉及的发明的具体特征如所附权利要求书所显示。通过参考下文中详细描述的示例性实施方式和附图能够更好地理解本技术所涉及发明的特点和优势。对附图简要说明书如下:
59.图1a至图1e示出了根据本技术的蛋白质异二聚体的实施例。
60.图2a至图2g示出了本公开的蛋白质异二聚体的如sds
‑
page和sec
‑
hplc分析所示的纯化结果。
61.图3示出了与人il10r1蛋白的结合亲和力(elisa)。
62.图4a至图4c示出了mc/9细胞的增殖的增强。
63.图5示出了对tnf
‑
α分泌的抑制。
64.图6a至图6b示出了本公开的蛋白质异二聚体的肿瘤控制效果。
65.图7a至图7b示出了在肿瘤控制中蛋白质异二聚体的高、低浓度之间的比较以及蛋白质异二聚体和蛋白质同二聚体的肿瘤控制效果之间的比较。
66.图8a至图8b示出了本公开的蛋白质异二聚体的肿瘤控制和肿瘤清除的效果。
具体实施方式
67.以下由特定的具体实施例说明本技术发明的实施方式,熟悉此技术的人士可由本说明书所公开的内容容易地了解本技术发明的其他优点及效果。
68.在描述本公开的实施方案之前,应理解这些实施方案仅以举例的方式提供,本文中描述的本公开实施例的各种替代方案可以用于实践本公开。本领域技术人员将会想到不脱离本公开的众多变化、改变和替换。
69.除非另有定义,否则本文中使用的所有技术和科学术语具有与本技术所属领域的普通技术人员通常所理解的相同的含义。虽然可以使用与本文中所描述的方法和材料类似或等效的方法和材料实践或测试本公开,但下文描述了合适的方法和材料。在发生冲突的情况下,将以本专利说明书(包含定义)为准。另外,材料、方法和实施例仅为说明性的且没有限制性的意图。本领域技术人员将会想到不脱离本公开的众多变化、改变和替换。
70.除非上下文另有明确规定,否则如本文所使用的单数形式“一”、“一个”和“所述”通常包括复数指代物。
71.如本文所用,术语“蛋白质的(proteinaceous)”通常是指具有多肽或蛋白质性质、与多肽或蛋白质有关、类似于多肽或蛋白质或者是多肽或蛋白质的材料或分子。例如,本公开的蛋白质异二聚体可以是异二聚体蛋白或包括两个或更多个多肽的异二聚体。
72.如本文所用,术语“异二聚体”通常是指由两个不同成员构成的分子(例如,蛋白质分子)。异二聚体的两个成员可能在结构、功能、活性和/或组成方面不同。例如,两个不同成员可以包括在形成多肽的氨基酸残基的顺序、数目或种类方面不同的多肽。异二聚体的两个不同成员中的每一个可以单独包括一个、两个或更多个单位、多肽链或部分。
73.如本文所用,术语“靶向部分”通常是指特异性地、选择性地或优先地与靶分子、靶细胞、靶粒子、靶组织或靶聚集体结合的分子、复合体或聚集体。例如,靶向部分可以是抗体、抗原结合抗体片段、双特异性抗体或其它基于抗体的分子或化合物。靶向部分的其它实例可以包含但不限于适配体(aptamer)、高亲和性多聚体(avimer)、受体结合配体、核酸、生
物素
‑
亲和素结合对(biotin
‑
avidin binding pair)、结合肽或结合蛋白等。术语“靶向部分”与“结合部分”在本文中可以互换使用。
74.如本文所用,术语“肿瘤抗原”通常是指肿瘤细胞中产生或由肿瘤细胞产生的抗原物质,其可能具有触发宿主的免疫反应的能力。例如,肿瘤抗原可以是构成肿瘤细胞的一部分并且能够诱导肿瘤特异性细胞毒性t淋巴细胞的蛋白质、多肽、肽或其片段。肿瘤抗原肽可以是因肿瘤细胞中肿瘤抗原降解而产生的肽,并且在通过与hla分子结合而在细胞表面表达时,可以诱导或激活肿瘤特异性细胞毒性t淋巴细胞。在一些实施方案中,术语“肿瘤抗原”还可以指在癌细胞上排他地或优先地或差异地表达和/或发现与癌细胞相关从而提供对癌症优先或特异的靶标的生物分子(例如,蛋白质、碳水化合物、糖蛋白等)。例如,优先表达可以是与生物体中任何其他细胞相比的优先表达,或者是生物体特定区域内(例如特定器官或组织内)的优先表达。
75.术语“肿瘤抗原表位”和“肿瘤抗原决定簇”在本文中可互换使用,并且通常是指诱导肿瘤特异性细胞毒性t淋巴细胞的肿瘤抗原中存在的氨基酸序列的位点。
76.如在本文中蛋白质异二聚体的上下文中所用,术语“表达产率”通常是指在表达时(例如当由宿主细胞表达时)以功能形式产生的蛋白质异二聚体的量。
77.如本文所用,术语“二聚化序列”通常是指能够形成二聚体或进行二聚化的氨基酸序列。在一些实施方案中,二聚体是由两个不同成员形成的异二聚体。在一些情况下,异二聚体的两个不同成员可以包括不同的二聚化序列。
78.如本文所用,术语“异二聚化(heterodimerization)”通常是指在两个不同成员之间形成或不形成共价键的情况下,诸如通过复合、缔合或聚集在两个不同成员(例如两个不同多肽)之间形成异二聚体的过程。
79.如本文所用,术语“共价键”通常是指通过共用电子在原子之间形成的化学键。例如,共价键可以是极性或非极性的。在一些实施方案中,共价键为二硫键。
80.如本文所用,术语“非共价成对亲和力”通常是指能够经由非共价相互作用,例如,经由离子对、氢键、偶极间相互作用、电荷转移相互作用、π
‑
π相互作用、阳离子
‑
π
‑
电子相互作用、范德华相互作用以及分散相互作用、疏水性(亲脂性)相互作用、复合物形成(例如过度金属阳离子的复合物形成)或这些相互作用的组合,彼此结合的二聚化序列或异二聚化序列。
81.如本文所用,术语“接头(linker)”通常是指连接或链接两个多肽序列(例如链接两个多肽域)的合成氨基酸序列。接头可以经由肽键连接两个氨基酸序列。在一些实施方案中,本公开的接头将生物活性部分连接至直链序列中的第二部分。
82.术语“多肽”、“肽”和“蛋白质”在本文中可互换地用于指代任何长度的氨基酸的聚合物。聚合物可以是直链的或支链的,其可以包括经修饰的氨基酸,且可能被非氨基酸中断。上述术语还涵盖例如通过二硫键形成、糖基化、脂化、乙酰化、磷酸化或任何其它处理(诸如与标记组分缀合)已进行修饰的氨基酸聚合物。上述术语可以应用于其中的一个或多个氨基酸残基为对应的天然存在氨基酸的人工化学类似物的氨基酸聚合物,以及应用于天然存在的氨基酸聚合物。上述术语还可以包含接合氨基酸组成多肽的传统肽键的变异体。例如,“肽”、“多肽”和“蛋白质”可以是其α碳是通过肽键链接的氨基酸链。因此,所述链的一端(氨基端)处的末端氨基酸可以具有游离氨基,而所述链的另一端(羧基端)处的末端氨基
酸可以具有游离羧基。如本文所用,术语“氨基端”(缩写为n端)通常是指肽的氨基端处的氨基酸上的游离α氨基或指代肽内的任何其它位置处的氨基酸的α氨基(参与肽键的亚氨基)。类似地,术语“羧基端”通常是指肽的羧基端上的游离羧基或肽内的任何其它位置处的氨基酸的羧基。肽还可以包含基本上任何聚氨基酸,包含但不限于肽模拟物,诸如由醚而不是酰胺键接合的氨基酸。
83.如本文所用,术语“氨基酸”通常是指天然和/或非天然或合成氨基酸,包含但不限于d或l光学异构体或这两者、氨基酸类似物以及肽模拟物。使用标准的单字母或三字母代码命名氨基酸。
84.如本文所用,术语“天然l氨基酸”通常是指甘氨酸(g)、脯氨酸(p)、丙氨酸(a)、缬氨酸(v)、亮氨酸(l)、异亮氨酸(i)、蛋氨酸(m)、半胱氨酸(c)、苯丙氨酸(f)、酪氨酸(y)、色氨酸(w)、组氨酸(h)、赖氨酸(k)、精氨酸(r)、谷氨酰胺(q)、天冬酰胺(n)、谷氨酸(e)、天冬氨酸(d)、丝氨酸(s)和苏氨酸(t)的l光学异构体形式。
85.如本文所用,术语“非天然存在的”通常是指不与野生型或天然存在序列(例如,在受试者中发现的那些序列)对应、不与其互补或与其不具有高度同源性的多肽或多核苷酸序列。例如,在适合比对时,非天然存在的多肽或片段可以与天然序列共有低于99%、98%、95%、90%、80%、70%、60%、50%或甚至更低的氨基酸序列一致性。或者,在适合比对时,非天然存在的多肽或片段可以与天然序列共有高于99%、98%、95%、90%、80%、70%、60%、50%或甚至更高的氨基酸序列一致性。
86.如本文所用,术语“亲水性”和“疏水性”通常是指物质与水的亲和程度。亲水性物质对水具有较强亲和力,倾向于溶解于水中、与水混合或被水润湿,而疏水性物质对水基本上缺乏亲和力,倾向于排斥水并且不吸收水,且不倾向于溶解于水中或与水混合或被水润湿。氨基酸可以基于其疏水性进行表征。已制定一些衡量标志。例如由levitt,m等人在j mol biol(《生物分子学杂志》)(1976)104:59中制定的衡量标志,其列举在hopp,tp等人,proc natl acad sci u s a(《美国国家科学院院刊》)(1981)78:3824中。“亲水性氨基酸”的实例为精氨酸、赖氨酸、苏氨酸、丙氨酸、天冬酰胺和谷氨酰胺。尤其关注的是亲水性氨基酸天冬氨酸盐、谷氨酸盐以及丝氨酸和甘氨酸。“疏水性氨基酸”的实例为色氨酸、酪氨酸、苯丙氨酸、蛋氨酸、亮氨酸、异亮氨酸和缬氨酸。
87.在蛋白质分子(例如多肽或蛋白质)的上下文中使用的术语“片段”通常是指天然生物活性蛋白的截短形式,其可能保留或可能未保留具有治疗活性和/或生物活性的部分。
88.在蛋白质分子(例如多肽或蛋白质)的上下文中使用的术语“变体”通常是指与天然生物活性蛋白具有序列同源性的蛋白质分子,其至少保留生物活性蛋白的具有治疗活性和/或生物活性的部分。例如,变体蛋白可以与参考生物活性蛋白共有至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%的氨基酸序列一致性。在一些实施方案中,“变体”可以包含例如通过定点诱变、编码基因合成、插入而有意地修饰的或通过突变随机地修饰的蛋白质。
89.术语“缀合(conjugated)”、“链接(linked)”和“融合(fused/fusion)”在本文中可互换使用,且通常是指两种或多种化学元素、序列或成分例如通过包含化学缀合或重组方式的方式接合在一起。例如,启动子或增强子在实现编码序列的转录时可操作地链接到所述编码序列。通常,“可操作地链接”意指链接的dna序列是连续的并处于阅读相或框架内。
“
框内融合”是指两个或更多个开放阅读框(orf)按维持原始orf的正确阅读框的方式接合以形成相连较长orf。因此,所得的“融合多肽”是含有对应于由原始orf编码的多肽的两个或更多个片段(这些片段在自然界中一般不会如此接合)的单一蛋白质。“融合位点”是指两个或更多个片段接合在一起处的序列。在一些情况下,融合位点可以是与所述两个或更多个接合的片段中的序列一致的序列。在一些情况下,融合位点可以进一步包括与所述两个或更多个接合的片段中任意一个的序列均不一致的空段。
90.在多肽的上下文中,“直链序列”或“序列”为多肽中的氨基酸在氨基端到羧基端方向上的顺序,其中所述序列中紧挨彼此的残基在所述多肽的一级结构中是连续的。“部分序列”为形成部分多肽的已知在一个或两个方向上包括额外残基的直链序列。
91.术语“多核苷酸”、“核酸”、“核苷酸”和“寡核苷酸”在本文中可互换使用,且其通常是指具有任何长度的核苷酸的聚合形式,即脱氧核糖核苷酸或核糖核苷酸,或其类似物。多核苷酸可以具有任何三维结构并且可以执行任何已知或未知功能。以下为多核苷酸的非限制性实例:基因或基因片段的编码或非编码区、根据链接分析定义的基因位(基因座)、外显子、内含子、信使rna(mrna)、转移rna、核糖体rna、核酶、cdna、重组多核苷酸、支链多核苷酸、质粒、载体、具有任何序列的分离dna、具有任何序列的分离rna、核酸探针和引物。多核苷酸可以包括经修饰的核苷酸,诸如甲基化核苷酸和核苷酸类似物。如果存在,对核苷酸结构的修饰可以在聚合物组装之前或之后给予。核苷酸的序列可能由非核苷酸组分中断。多核苷酸可以在聚合后诸如通过与标记组分缀合而进一步被修饰。
92.术语“基因”和“基因片段”在本文中可互换使用且通常是指含有至少一个能够在转录和翻译后编码特定蛋白质的开放阅读框的多核苷酸。基因或基因片段可以是基因组或cdna,只要所述多核苷酸含有至少一个可以覆盖整个编码区或其区段的开放阅读框。“融合基因”为由至少两个异源多核苷酸链接在一起构成的基因。
93.如本文所用,术语“抗体”通常是指包括一种或多种实质上由免疫球蛋白基因或免疫球蛋白基因的片段编码的多肽的蛋白质。免疫球蛋白基因可以包含κ、λ、α、γ、δ、ε和μ恒定区基因以及无数免疫球蛋白可变区基因。如本文所使用,轻链可以分类为κ轻链或λ轻链。重链可以分类为γ、μ、α、δ或ε重链,其进而分别定义免疫球蛋白类别igg、igm、iga、igd和ige。如在本公开中使用的抗体可以具有包括四聚体的结构单位。每一个四聚体可以由两个相同的多肽链对构成,每一对具有一个“轻”链(约25kd)和一个“重”链(约50至70kd)。每一条链的n端可以定义具有主要负责抗原识别的约100至110或更多个氨基酸的可变区。如本文所用,术语“轻链可变区”(vl)和“重链可变区”(vh)通常分别是指轻链和重链的上述区。抗体可能以完整免疫球蛋白形式或以通过由各种肽酶消化产生或重新表达的许多充分表征的片段形式存在。因此,例如,胃蛋白酶可以在铰链区中的二硫键下消化抗体以产生f(ab)’2(fab的二聚体,fab本身为通过二硫键轻链接合到vh
‑
ch1)。f(ab)’2可以在温和条件下还原以打破铰链区中的二硫键,从而将(fab’)2二聚体转化成fab’单体。fab’单体实质上为具有部分铰链区的fab(关于其它抗体片段的更详细描述,参见fundamental immunology(《基础免疫学》),w.e.paul编,raven press,n.y.(1993))。虽然依据完整抗体的消化而定义了各种抗体片段,但本领域的普通技术人员将了解,这些fab’片段可以以化学方式或通过利用重组dna方法重新合成。因此,如本文所用,术语抗体还可以包含通过修饰完整抗体产生的或使用重组dna方法重新合成的抗体片段,包含但不限于fab’2、igg、igm、iga、ige、
scfv、dab、纳米抗体(nanobody)、单抗体(unibody)和双抗体(diabody)。在一些实施方案中,上述抗体包含但不限于fab’2、igg、igm、iga、ige以及单链抗体,例如可变重链与可变轻链(直接地或通过肽接头)接合在一起以形成相连多肽的单链fv(scfv)抗体。
94.如本文所用,术语“抗原结合位点”或“结合部分”通常是指参与抗原结合的抗体部分。抗原结合位点可以由重(“h”)链和/或轻(“l”)链的n端可变(“v”)区的氨基酸残基形成。重链和轻链的v区内的三个高度不同的段被称为“高变区”,其插入称为“框架区”或“fr”的多个保守侧接段之间。因此,如本文所用,术语“fr”通常是指天然地在免疫球蛋白中的高变区之间和附近发现的氨基酸序列。在抗体分子中,轻链的三个高变区和重链的三个高变区在三维空间中相对于彼此设置以形成抗原结合“表面”。这个表面可以介导靶抗原的识别和结合。重链和轻链中的三个高变区的每一个被称为“互补决定区”或“cdr”并且例如由kabat等人sequences of proteins of immunological interest(《具有免疫学意义的蛋白质序列》),第4版.美国卫生与公众服务部,公共卫生署,贝塞斯达,马里兰州(1987)进行了表征。
95.如本文所用,术语“宿主细胞”通常包含个别细胞、细胞系或细胞培养物,其可以接受或已经接受主题质粒或载体,包含本公开的多核苷酸或表达本公开的蛋白质异二聚体(例如异二聚体蛋白)。宿主细胞可以包含单个宿主细胞的后代。上述后代可能因天然、偶然或有意突变所致而不一定与原始亲本细胞完全一致(在形态方面或在总dna补足的基因组方面)。宿主细胞可以包含用本公开的载体体外转染的细胞。宿主细胞可以是细菌细胞(例如大肠杆菌)、酵母细胞或其它真核细胞,例如cos细胞、中国仓鼠卵巢(cho)细胞、hela细胞、hek293细胞、cos
‑
1细胞、ns0细胞或骨髓瘤细胞。在一些实施方案中,宿主细胞是哺乳动物细胞。在一些实施方案中,宿主细胞是hek293细胞。
96.如本文所用,术语“载体”通常是指能够在适当宿主内自我复制的核苷酸分子,其将插入的核苷酸分子转移到宿主细胞中和/或在宿主细胞之间转移。所述术语可以包含主要用于将dna或rna插入细胞中的载体、主要用于复制dna或rna的载体复制以及用于转录和/或翻译dna或rna的表达载体。还包含提供一个以上上述功能的载体。“表达载体”是在引入到适当宿主细胞中时可以转录和翻译成多肽的多核苷酸。“表达系统”通常意味着包含可以用于产生所期望的表达产物的表达载体的合适宿主细胞。
97.术语“有效量”或“治疗有效量”是指足以实现预期应用(包含但不限于疾病治疗)的组合物(例如本文所描述的蛋白质异二聚体)的量。治疗有效量可以根据预期应用(例如体外或体内)或正在治疗的个体和疾病状况(例如可以由本领域的普通技术人员容易地确定的个体的体重和年龄、疾病状况的严重程度、施用方式等)而变化。所述术语还可能适用于将诱导靶细胞中的特定反应(例如靶基因诱导、增殖和/或细胞凋亡)的剂量。具体剂量将根据所选的特定化合物、依循的给药方案、是否与其它化合物组合施用、施用时间、所施用到的组织以及进行携带的实体递送系统而变化。
98.术语“治疗(treatment或treating)”或“减轻(palliating)”或“改善(ameliorating)”在本文中可互换使用,且是指获得有益或期望的结果(包含但不限于治疗效益和/或预防效益)的途径。如本文所使,治疗效益通常是指根除正在治疗的潜在病症或降低其严重程度。而且,如下达到治疗效益:根除与潜在病症相关的一个或多个生理症状、降低其严重程度或降低其发生率,以使得尽管受试者可能仍受到潜在病症的困扰,但在受试者体内观察到改善。为了预防效益,可以向存在患上特定疾病的风险的受试者或向报告
疾病的一个或多个生理症状但可能尚未进行所述疾病的诊断的受试者施用组合物。
99.如本文所用,术语“治疗效果”通常涵盖上文所述的治疗效益和/或预防效益。预防效益包含延迟或消除疾病或病况的出现,延迟或消除疾病或病况的症状的发作,减缓、停止或逆转疾病或病况的进展,或其任何组合。
100.如本文所用,术语“药剂”或“生物活性剂”通常是指生物、药物或化学化合物或其它部分。非限制性实例包含简单或复杂有机或无机分子、肽、蛋白质、寡核苷酸、抗体、抗体衍生物、抗体片段、维生素衍生物、碳水化合物、毒素或化疗化合物。可以合成各种化合物,例如小分子和寡聚物(例如寡肽和寡核苷酸)以及基于各种核心结构的合成有机化合物。另外,各种天然来源可以提供用于筛选诸如植物或动物提取物等的化合物。
101.如本文所用,术语“细胞增殖”通常是指细胞数由于分裂而变化的现象。例如,细胞增殖可以引起细胞数增加。这个术语还涵盖细胞形态变化(例如尺寸增大)与增殖信号一致的细胞生长。
102.如本文所用,术语“体内”通常是指在受试者的身体内部发生的事件。
103.如本文所用,术语“体外”通常是指在受试者的身体外部发生的事件。例如,体外分析涵盖任何在受试者外部进行的分析。体外分析涵盖采用死细胞或活细胞的基于细胞的分析。体外分析还涵盖不采用完整细胞的无细胞分析。
104.如本文所用,术语“白介素”通常是指能够促进t和/或b淋巴细胞和/或造血细胞的发育与分化的分泌性蛋白或信号分子。白介素可以通过辅助cd4 t淋巴细胞以及通过单核细胞、巨噬细胞和内皮细胞合成。如本文所使用,白介素(il)可以包含il
‑
1、il
‑
2、il
‑
3、il
‑
4、il
‑
5、il
‑
6、il
‑
7、il
‑
8、il
‑
9、il
‑
10、il
‑
11、il
‑
12、il
‑
13、il
‑
14、il
‑
15、il
‑
16、il
‑
17、il
‑
18、il
‑
19、il
‑
20、il
‑
21、il
‑
22、il
‑
23、il
‑
24、il
‑
25、il
‑
26、il
‑
27、il
‑
28、il
‑
29、il
‑
30、il
‑
31、il
‑
32、il
‑
33、il
‑
34、il
‑
35和/或il
‑
36。如本文所使用,术语“白介素”可以包含实质上维持对应野生型白介素的生物活性(例如具有的生物活性为对应野生型白介素的生物活性的至少80%、至少90%、至少95%、至少98%、至少99%或甚至至少100%)的全长白介素或其片段(例如截短形式)或变异体。如本文所用,白介素可以源自任何哺乳动物物种。在一些实施方案中,白介素源自选自由以下各项构成的组的物种:人、马、牛、鼠类、猪、兔、猫、狗、大鼠、山羊、绵羊和非人灵长动物。在一些实施方案中,白介素可以呈突变形式,例如与其受体的亲和力增加或减少。在具体实施方案中,白介素可以是超级il
‑
2(也称为sil2,参见nature(《自然》)484,529
–
533,2012年4月26日),其可以通过修饰il
‑
2以增加其对il
‑
2rβ的结合亲和力来获得。sil
‑
2中的突变主要在细胞因子的核心中,且分子动力学模拟表明,进化突变使il
‑
2稳定,将il
‑
2rβ结合位点中螺旋的灵活性降低成为优化的受体结合构象,类似于与cd25结合时的构象。与il
‑
2相比,sil
‑
2诱导细胞毒性t细胞的优良扩增,使得体内抗肿瘤反应增强,sil
‑
2引起t调节细胞的扩增的按比例减少并减少了肺水肿。
105.如本文所用,术语“受试者”通常是指人或非人动物,包含但不限于猫、狗、马、猪、奶牛、绵羊、山羊、兔、小鼠、大鼠或猴。
106.术语“抑制生长和/或增殖”在用于癌细胞时通常是指降低癌细胞的生长速率和/或增殖速率。例如,这个术语可以包含癌细胞的死亡(例如经由细胞凋亡)。在一些实施方案中,这个术语还可以是指抑制实体肿瘤的生长和/或增殖和/或诱导肿瘤尺寸减小或肿瘤的消除。
107.如本文所用,术语“癌细胞表面标记”或“癌细胞相关标记”通常是指排他地或优先地或差异性地表达于癌细胞上和/或发现与癌细胞缔合并从而提供对癌症优先或特异的靶标的生物分子(例如蛋白质、碳水化合物、糖蛋白等)。在一些实施方案中,优先表达可以是与生物体中任何其他细胞相比的优先表达,或者是生物体特定区域内(例如特定器官或组织内)的优先表达。
108.如本文所用,术语“单体成员”通常是指以单体形式存在且为蛋白质异二聚体的组分/亚基的多肽、亚基或部分。
109.如本文所用,术语“fc亚基”通常是指能够结合fc受体的免疫球蛋白重链恒定区的羧基端部分或其类似物或部分。众所周知,每一个免疫球蛋白重链恒定区包括四个或五个结构域。所述结构域如下依次命名:ch1
‑
铰链
‑
ch2
‑
ch3(
‑
ch4)。ch4以igm的形式存在,其不具有铰链区。用于本公开中的免疫球蛋白重链恒定区可以包括免疫球蛋白铰链区,并且还可以包含ch3结构域。例如,免疫球蛋白重链恒定区可以包括免疫球蛋白铰链区、ch2结构域和ch3结构域。在一些实施方案中,本公开所述的fc亚基由铰链
‑
ch2
‑
ch3结构域构成。
110.如本文所用,术语“与
…
复合”或“复合”通常是指分子(例如蛋白质异二聚体)的一个成员/亚基与另一个成员/亚基的缔合(例如结合)。例如,第一fc亚基可以与第二亚基复合以形成二聚体。
111.如本文所用,术语“结合特异性”通常是指特异性结合给定靶标(例如,与给定靶标免疫反应)(而不结合或实质上不结合非靶标)的能力。本公开的靶向部分可以是单特异性的且含有一个或多个特异性结合靶标的结合位点,或可以是多特异性的(例如双特异性或三特异性的)且含有两个或更多个特异性结合相同或不同靶标的结合位点。
112.如本文所用,术语“与
…
缔合”或“使得与
…
缔合”通常是指一个实体与另一个实体物理缔合或接触。例如,蛋白质异二聚体的第一单体成员可以共价地或非共价地与第二单体成员“缔合”。在一些实施方案中,蛋白质异二聚体的第一单体成员经由界面与第二单体成员缔合,所述界面是由分别来自第一单体成员和第二单体成员的氨基酸残基(即界面残基)形成的。
113.如本文所用,术语“修饰”通常是指对肽主链(例如氨基酸序列)的任何处理或对多肽的任何翻译后修饰(例如糖基化)。例如,修饰是相对于对应野生型多肽的序列而言的。修饰可以是一个或多个氨基酸(例如,1、2、3、4、5、6、7、8、9、10个或大于10个)的取代、添加和/或缺失。
114.如本文所用,术语“杵臼修饰(knob
‑
and
‑
hole modification)”通常是指在多肽界面处引入修饰以形成凸起(杵修饰)并在另一多肽的对应位置处引入修饰以形成空腔(臼修饰),凸起的尺寸与空腔的尺寸相同或类似。例如,杵臼修饰使得形成异二聚体,同时抑制同二聚体的形成。参见文献美国专利第5,731,168号;美国专利第7,695,936号;ridgway等人,prot eng 9,617
‑
621(1996)和carter,j immunol meth 248,7
‑
15(2001)。相应地,如本文所用,术语“杵修饰”通常是指在多肽界面处的修饰,其用具有较大侧链的氨基酸(例如酪氨酸或色氨酸)置换具有较小侧链的氨基酸(例如丙氨酸或苏氨酸)以形成凸起。如本文所用,术语“臼修饰”通常是指在另一多肽的对应位置处的修饰,其用具有较小侧链的氨基酸(例如丙氨酸或苏氨酸)置换具有较大侧链的氨基酸(例如酪氨酸或色氨酸)以形成空腔。杵修饰和臼修饰可以通过变更编码多肽的核苷酸(例如通过位点特异性诱变)或通过肽合成来
进行。在具体实施方案中,杵修饰包括fc区的两个亚基中的一个中的氨基酸取代y349c和t366w,臼修饰包括fc区的两个亚基中的另一个中的氨基酸取代d356c、t366s、l368a和y407v。
115.如本文所用,术语“hek293细胞”通常是指来源于转化的人胚肾(hek)细胞的克隆分离株。hek293细胞株为293细胞系的变体,其在单层培养中展示较好粘附性并且容易用于噬斑分析和其它锚着依赖应用。其已适应于无血清培养基(293sfm ii)中的悬浮培养。
116.如本文所用,术语“cho细胞”通常是指中国仓鼠卵巢细胞,其为非分泌性永生成纤维细胞。cho细胞极少分泌cho内源性蛋白,因此有利于分离和纯化靶蛋白。
117.如本文所用,术语“cho
‑
1细胞”通常是指来源于猴肾组织的成纤维细胞样细胞系。cos细胞是通过用可以产生较大t抗原但在基因组复制方面存在缺陷的某一型式的sv40病毒使cv
‑
1细胞永生来获得。cos细胞系的一种常用形式为cos
‑
1。
118.如本文所用,术语“ns0细胞”通常是指来源于非分泌性小鼠骨髓瘤的模型细胞系。所述细胞系是由nsi/1的支系产生的胆固醇依赖性细胞系。
119.如本文所用,术语“融合蛋白”通常是指如下多肽,其包括氨基酸序列或替代地由所述氨基酸序列构成,所述氨基酸序列是一种多肽与异源多肽(即与前一多肽或其域无关的多肽)的氨基酸序列直接或间接地(例如经由接头)融合的氨基酸序列。
120.如本文所用,术语“c端”通常是指多肽的羧基端。
121.如本文所用,术语“n端”通常是指多肽的氨基端。
122.如本文所用,术语“免疫球蛋白”通常是指由一个或多个实质上由免疫球蛋白基因编码的多肽构成的蛋白质。已识别的免疫球蛋白基因包含κ、λ、α、γ(igg1、igg2、igg3、igg4)、δ、ε和μ恒定区基因以及无数免疫球蛋白可变区基因。一种形式的免疫球蛋白构成抗体的基本结构单位。这种形式为四聚体且由两个相同的免疫球蛋白链对组成,每一对具有一个轻链和一个重链。在每一对中,轻链可变区和重链可变区共同负责结合抗原,而恒定区负责抗体效应功能。除抗体以外,免疫球蛋白可以以包含例如fv、fab、fab’和(fab’)2的各种其它形式存在。
123.如本文所用,术语“框内融合(fusedinframe或inframefused)”通常是指以维持原始orfs的正确阅读框的方式接合两个或更多个开放阅读框(orf)以形成连续的的较长orf。
124.如本文所用,术语“接头”通常是指连接或链接两个多肽序列(例如链接两个多肽结构域)的合成氨基酸序列。接头可以经由肽键连接两个氨基酸序列。在一些实施方案中,本公开的接头将免疫调节因子连接到直链序列中的第二fc区。
125.如本文所用,术语“位于
…
的n端”通常是指位于另一分子(例如另一多肽)的n端位置处。例如,根据本公开,两个或更多个免疫调节因子可以位于第二fc区的n端。
126.如本文所用,术语“氨基酸取代”通常是指多肽的特定位置处的氨基酸被另一氨基酸置换。
127.如本文所用,术语“kabat编号的eu索引”通常是指根据kabat等人(1971)ann.ny acad,sci.(《纽约科学院年报》)190:382
‑
391和kabat,e.a.等人(1991)sequences of proteins of immunological interest(具有免疫学意义的蛋白质序列),第五版,美国卫生及公共服务部,nih第91
‑
3242号出版物的对应于氨基酸序列的eu编号的索引。
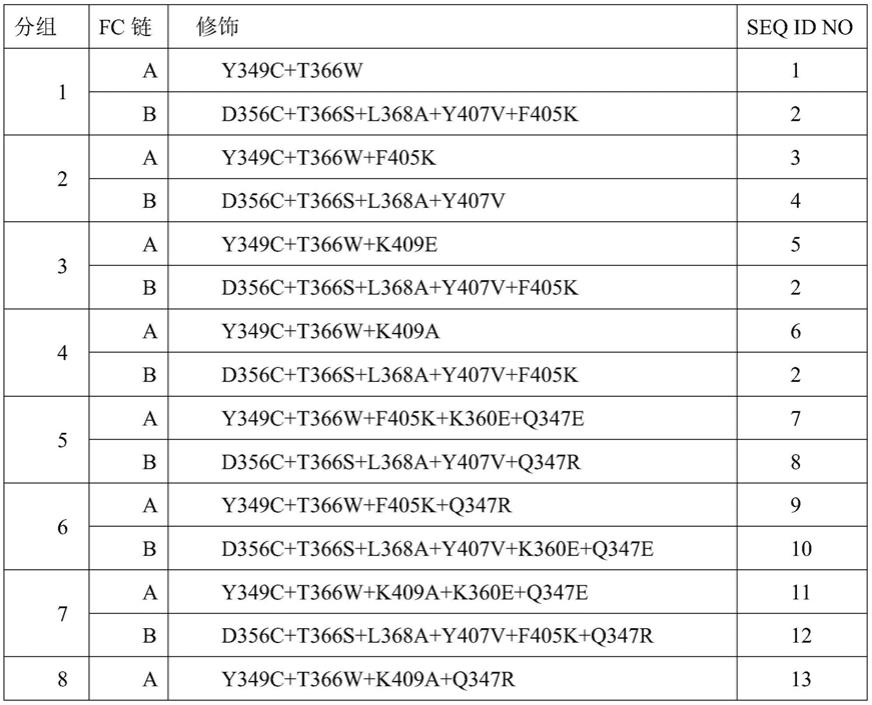
128.如本文所用,术语“分离的多核苷酸”通常是指从其天然环境分离的或人工合成的
具有任何长度的聚合形式的核苷酸,可以是脱氧核糖核苷酸或核糖核苷酸或其类似物。
129.如本文所用,术语“蛋白质混合物”通常是指两种或多种蛋白质的混合物。
130.如本文所用,术语“同二聚体”通常是指由两个相同单体(例如两个相同成员或亚基)形成的分子。所述两个单体可以经由共价和/或非共价相互作用彼此聚集、复合或缔合。例如,蛋白质同二聚体的两个单体可以经由来自所述两个单体中的每一个的界面氨基酸残基之间的相互作用而彼此缔合。
131.如本文所用,术语“实质上不包括”通常是指组合物(例如混合物)包括极少或几乎不包括某种物质。例如,所述物质以例如低于10%、低于9%、低于8%、低于7%、低于6%、低于5%、低于4%、低于3%、低于2%、低于1%、低于0.5%、低于0.1%或低于0.01%的百分比存在。
132.如本文所用,术语“药学上可接受的赋形剂”通常是指与药物施用相容的任何和所有溶剂、分散介质、包衣、等强吸收延迟剂等。
133.如本文所用,术语“富集”通常是指混合物或群体中靶成分的数目和/或浓度的增加。
134.如本文所用,术语“白介素10”通常是指il
‑
10,也称为人细胞因子合成抑制因子(csif),是一种抗炎细胞因子。人il
‑
10可以由基因il10编码。所述白介素10的结构可以是同二聚体,并且其每一个亚基的长度为178个氨基酸。
135.如本文所用,术语“不对称二聚体”通常是指其结构不对称的二聚体。例如,不对称二聚体可以是由两个不同单体成员形成的分子。两个单体成员可以经由共价和/或非共价相互作用彼此聚集、复合或缔合。中心线两侧的不对称二聚体可以是不同的。
136.蛋白质异二聚体、蛋白质混合物、分离的多核苷酸、载体及宿主细胞
137.一方面,本公开提供了一种蛋白质异二聚体。所述蛋白质异二聚体可以包括第一单体成员和不同于第一单体成员的第二单体成员。第一单体成员可以包括第一fc亚基。第二单体成员可以包括第二fc亚基。第一单体成员可以与第二单体成员缔合,以通过第一fc亚基与第二fc亚基的复合而形成异二聚体。
138.在一些实施方案中,第一单体成员的氨基酸序列不同于第二单体成员的氨基酸序列。
139.蛋白质异二聚体可以进一步包括一个或多个白介素。所述一个或多个白介素可以与第一fc亚基和/或第二fc亚基融合(例如框内融合)。例如,所述一个或多个白介素可以独立地与第一fc亚基和/或第二fc亚基在框内融合(例如框内融合)。在一些实施方案中,一个或多个白介素仅与第一fc亚基融合(例如框内融合)。在一些实施方案中,一个或多个白介素仅与第二fc亚基融合(例如框内融合)。在一些实施方案中,一个或多个白介素与第一fc亚基和第二fc亚基融合(例如框内融合)。
140.所述一个或多个白介素可以与第一fc亚基和/或第二fc亚基的氨基端氨基酸和/或羧基端氨基酸融合(例如框内融合)。在一些实施方案中,一个或多个白介素与第一fc亚基的氨基端氨基酸融合(例如在框内)。在一些实施方案中,一个或多个白介素仅与第二fc亚基的氨基端氨基酸融合(例如在框内)。在一些实施方案中,一个或多个白介素与第一fc亚基的氨基端氨基酸和第二fc亚基的氨基端氨基酸融合(例如在框内)。
141.在蛋白质异二聚体中,一个或多个(例如1、2、3、4、5、6、7、8、9、10个或更多个)白介
素中的至少一个可以是白介素10。
142.所述一个或多个白介素可以与第一fc亚基和/或第二fc亚基直接或间接地融合(例如在框内)。例如,所述一个或多个白介素可以经由接头(诸如肽接头)与第一fc亚基和/或第二fc亚基融合(例如在框内)。接头可以是例如经由肽键连接或链接两个多肽序列的合成氨基酸序列。在一些实施方案中,接头是包括例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25个或更多个氨基酸的肽。例如,接头可以包括1至10个氨基酸(例如1、2、3、4、5、6、7、8、9、10个或更多个氨基酸)、1至15个氨基酸(例如1至11、12、13、14、15个氨基酸)、1至20个氨基酸、1至30个氨基酸或更多个氨基酸。在一些实施方案中,接头包括seq id no:37中所示。
143.在一些实施方案中,蛋白质异二聚体包括两个或更多个白介素。所述两个或更多个白介素可以相同或可以不同。在一些实施方案中,所述两个或更多个白介素是相同的。在一些实施方案中,所述两个或更多个白介素为白介素10。
144.所述两个或更多个白介素可以形成一个或多个白介素二聚体,每一个白介素二聚体包括彼此融合(例如在框内)的两个白介素。每一个白介素二聚体可以包括两个相同或两个不同白介素。白介素可以直接或间接地融合(例如在框内)在一起。在一些实施方案中,一个或多个白介素二聚体包括至少一个白介素10二聚体,白介素10二聚体包括两个白介素10。
145.两个或更多个白介素(例如每一个白介素二聚体中的两个白介素)可以通过接头(诸如肽接头)融合(例如在框内)在一起。接头可以是例如经由肽键连接或链接两个多肽序列的合成氨基酸序列。在一些实施方案中,接头是包括1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25个或更多个氨基酸的肽。例如,接头可以包括1至10个氨基酸(例如1、2、3、4、5、6、7、8、9、10个或更多个氨基酸)、1至15个氨基酸(例如1至11、12、13、14、15个氨基酸)、1至20个氨基酸、1至30个氨基酸或更多个氨基酸。在一些实施方案中,接头包括seq id no:37中所示。在一些实施方案中,接头耐蛋白质水解或实质上耐蛋白质水解。
146.在一些情况下,两个以上白介素可以包括于蛋白质异二聚体中。所述两个以上白介素可以形成两个或更多个(例如2、3、4、5、6、7、8、9、10或更多个)白介素二聚体。例如,所述两个或更多个白介素二聚体可以包括至少一个白介素10二聚体,并且白介素10二聚体包括两个白介素10。在一些实施方案中,蛋白质异二聚体包括两个或更多个白介素10二聚体
147.融合的两个或更多个白介素(例如白介素二聚体)可以进一步与第一fc亚基和/或第二fc亚基的氨基端氨基酸和/或羧基端氨基酸融合(例如在框内)。在一些实施方案中,融合的两个或更多个白介素(例如白介素二聚体)可以进一步与第一fc亚基和/或第二fc亚基的氨基端氨基酸融合。在一些实施方案中,融合的两个或更多个白介素(例如白介素二聚体)可以进一步仅与第一fc亚基的氨基端氨基酸融合。在一些实施方案中,融合的两个或更多个白介素(例如白介素二聚体)可以进一步仅与第二fc亚基的氨基端氨基酸融合。在一些实施方案中,融合的两个或更多个白介素(例如白介素二聚体)可以进一步与第一fc亚基的氨基端氨基酸和第二fc亚基的氨基端氨基酸融合。
148.在一些实施方案中,融合的两个或更多个白介素(例如,白介素二聚体)进一步与第一fc亚基和/或第二fc亚基的羧基端氨基酸融合。在一些实施方案中,融合的两个或更多
个白介素(例如白介素二聚体)可以进一步仅与第一fc亚基的羧基端氨基酸融合。在一些实施方案中,融合的两个或更多个白介素(例如白介素二聚体)可以进一步仅与第二fc亚基的羧基端氨基酸融合。在一些实施方案中,融合的两个或更多个白介素(例如白介素二聚体)可以进一步与第一fc亚基的羧基端氨基酸和第二fc亚基的羧基端氨基酸融合。
149.当存在两个或更多个白介素二聚体时,每一个白介素二聚体可以独立地与第一fc亚基和/或第二fc亚基的氨基端氨基酸和/或羧基端氨基酸融合。例如,两个或更多个融合白介素(例如白介素10)可以进一步与第一fc亚基(例如与其氨基端氨基酸)融合(例如在框内),两个或更多个融合白介素(例如白介素10)可以进一步与第二fc亚基(例如与其氨基端氨基酸)融合(例如在框内)。又例如,两个或更多个融合白介素(例如白介素10)可以进一步与第一fc亚基(例如与其羧基端氨基酸)融合(例如在框内),两个或更多个融合白介素(例如白介素10)可以进一步与第二fc亚基(例如与其羧基端氨基酸)融合(例如在框内)。
150.融合的两个或更多个白介素(例如白介素二聚体)可以与第一fc亚基和/或第二fc亚基直接或间接融合。例如,融合的两个或更多个白介素(例如白介素二聚体)可以经由接头(诸如肽接头)与第一fc亚基和/或第二fc亚基融合。接头可以是例如经由肽键连接或链接两个多肽序列的合成氨基酸序列。在一些实施方案中,接头是包括1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25个或更多个氨基酸的肽。例如,接头可以包括1至10个氨基酸(例如1、2、3、4、5、6、7、8、9、10个或更多个氨基酸)、1至15个氨基酸(例如1至11、12、13、14、15个氨基酸)、1至20个氨基酸、1至30个氨基酸或更多个氨基酸。在一些实施方案中,接头包括seq id no:37中所示。在一些实施方案中,接头耐蛋白质水解或实质上耐蛋白质水解。
151.在一些实施方案中,一个或多个白介素中的至少一个与第二fc亚基融合(例如在框内)。例如,所述一个或多个白介素中的至少一个可以与第二fc亚基的氨基端氨基酸融合。
152.在一些实施方案中,在第二单体成员中,所述一个或多个白介素中的至少两个彼此融合(例如在框内)以形成白介素二聚体,所述白介素二聚体进一步与第二fc亚基的氨基端氨基酸融合(在框内)。
153.在一些实施方案中,第一单体成员不包括任何白介素。
154.在一些实施方案中,第一单体成员由第一fc亚基构成。
155.在一些实施方案中,所述一个或多个白介素中的至少一个与第一fc亚基融合(例如在框内)。
156.在一些实施方案中,所述一个或多个白介素中的至少一个与第一fc亚基的氨基端氨基酸融合(例如在框内)。
157.在一些实施方案中,在第一单体成员中,所述一个或多个白介素中的至少两个彼此融合(例如在框内)以形成白介素二聚体,所述白介素二聚体进一步与第一fc亚基的氨基端氨基酸融合(例如在框内)。
158.在一些实施方案中,第二单体成员不包括任何白介素。
159.在一些实施方案中,第二单体成员由第二fc亚基构成。
160.在一些实施方案中,第一单体成员不包括任何白介素,或第一单体成员由第一fc亚基构成,所述一个或多个白介素中的至少一个与第二fc亚基融合(例如在框内)。在一些
情况下,在第二单体成员中,所述一个或多个白介素中的至少两个彼此融合(例如在框内)以形成白介素二聚体,所述白介素二聚体进一步与第二fc亚基的氨基端氨基酸融合(在框内)。
161.在一些实施方案中,第二单体成员不包括任何白介素,或第二单体成员由第二fc亚基构成,所述一个或多个白介素中的至少一个与第一fc亚基融合(例如在框内)。在一些情况下,在第二单体成员中,所述一个或多个白介素中的至少两个彼此融合(例如在框内)以形成白介素二聚体,所述白介素二聚体进一步与第一fc亚基的氨基端氨基酸融合(在框内)。
162.在一些实施方案中,第一单体成员包括一个或多个与第一fc亚基融合的白介素,第二单体成员包括一个或多个与第二fc亚基融合的白介素。
163.在一些实施方案中,第一单体成员包括一个或多个与第一fc亚基融合的白介素二聚体,第二单体成员包括一个或多个与第二fc亚基融合的白介素二聚体。每一个白介素二聚体可以包括彼此直接或间接地(例如经由过接头,诸如肽接头)融合(例如在框内)的两个相同白介素。
164.本技术的蛋白质异二聚体不包括展现对肿瘤抗原的结合特异性的任何抗体重链可变区或任何抗体轻链可变区。在一些实施方案中,本技术的蛋白质异二聚体不包括展现对肿瘤抗原的结合特异性的任何抗体或其任何部分(例如抗原结合片段)。
165.在一些实施方案中,本技术的蛋白质异二聚体不包括任何抗体重链可变区或任何抗体轻链可变区。
166.在一些实施方案中,本技术的蛋白质异二聚体不包括任何抗体或其抗原结合片段。
167.在一些实施方案中,本技术的蛋白质异二聚体不包括展现对任何肿瘤抗原的结合特异性的任何靶向部分。例如,在一些情况下,本技术的蛋白质异二聚体不包括能够与肿瘤抗原特异性结合的任何抗体或其抗原结合片段。
168.在一些实施方案中,第一fc亚基和/或第二fc亚基独立地源自igg分子。所述igg可以选自由igg1、igg2、igg3和igg4构成的组。例如,igg可以是人igg1。
169.在一些实施方案中,第一fc亚基不同于第二fc亚基,并且第一和/或第二fc亚基包括促进第一fc亚基和第二fc亚基之间的异二聚体化的修饰。
170.在一些实施方案中,第一fc亚基可以包括第一修饰,第二fc亚基可以包括第二修饰。在一些实施方案中,第一修饰不同于第二修饰。
171.在一些实施方案中,第一修饰包括在t366位置处的氨基酸取代,以及在选自由以下各项构成的组的一个或多个位置处的氨基酸取代:y349、f405、k409、d399、k360、q347、k392和s354,其中,所述氨基酸的位置根据kabat编号的eu索引确定。例如,第一修饰所包括的氨基酸取代可以选自由以下各项构成的组:y349c、y349d、d399s、f405k、k360e、k409a、k409e、q347e、q347r、s354d、k392d和t366w。
172.在一些实施方案中,第一修饰包括2至5个氨基酸取代。
173.在一些实施方案中,第一修饰包括在选自以下任一组的一组位置处的氨基酸取代:1)y349和t366;2)y349、t366和f405;3)y349、t366和k409;4)y349、t366、f405、k360和q347;5)y349、t366、f405和q347;6)y349、t366、k409、k360和q347;7)y349、t366、k409和
q347;8)t366、k409和k392;9)t366和k409;10)t366、k409、y349和s354;11)t366和f405;12)t366、f405和d399;以及13)t366、f405、y349和s354;其中,所述氨基酸的位置根据kabat编号的eu索引确定。
174.在一些实施方案中,第一修饰包括选自以下任一组的一组氨基酸取代:1)y349c和t366w;2)y349c、t366w和f405k;3)y349c、t366w和k409e;4)y349c、t366w和k409a;5)y349c、t366w、f405k、k360e和q347e;6)y349c、t366w、f405k和q347r;7)y349c、t366w、k409a、k360e和q347e;8)y349c、t366w、k409a和q347r;9)t366w、k409a和k392d;10)t366w和k409a;11)t366w、k409a和y349d;12)t366w、k409a、y349d和s354d;13)t366w和f405k;14)t366w、f405k和d399s;15)t366w、f405k和y349d;以及16)t366w、f405k、y349d和s354d;其中,所述氨基酸的位置根据kabat编号的eu索引确定。
175.在一些实施方案中,第二修饰包括在t366、l368和y407位置处的氨基酸取代,以及在选自由d356、d399、e357、f405、k360、k392、k409和q347构成的组的一个或多个位置处的氨基酸取代,其中,氨基酸的位置根据kabat编号的eu索引确定。
176.在一些实施方案中,第二修饰所包括的氨基酸取代选自由以下各项构成的组:d356c、d399s、e357a、f405k、k360e、k392d、k409a、l368a,l368g、q347e、q347r、t366s、y407a和y407v。
177.在一些实施方案中,第二修饰包括4至6个位置处的氨基酸取代。
178.在一些实施方案中,第二修饰包括在选自以下任一组的一组位置处的氨基酸取代:1)d356、t366、l368、y407和f405;2)d356、t366、l368和y407;3)d356、t366、l368、y407和q347;4)d356、t366、l368、y407、k360和q347;5)d356、t366、l368、y407、f405和q347;6)d356、t366、l368、y407、f405、k360和q347;7)t366、l368、y407、d399和f405;8)t366、l368、y407和f405;9)t366、l368、y407、f405和e357;10)t366、l368、y407和k409;11)t366、l368、y407、k409和k392;和12)t366、l368、y407、k409和e357;其中,氨基酸的位置根据kabat编号的eu索引确定。
179.在一些实施方案中,第二修饰包括在选自以下任一组的一组位置处的氨基酸取代:1)d356c、t366s、l368a、y407v和f405k;2)d356c、t366s、l368a和y407v;3)d356c、t366s、l368a、y407v和q347r;4)d356c、t366s、l368a、y407v、k360e和q347e;5)d356c、t366s、l368a、y407v、f405k和q347r;6)d356c、t366s、l368a、y407v、f405k、k360e和q347e;7)t366s、l368a、y407v、d399s和f405k;8)t366s、l368g、y407a和f405k;9)t366s、l368a、y407v、f405k和e357a;10)t366s、l368a、y407v和k409a;11)t366s、l368a、y407v、k409a和k392d;12)t366s、l368g、y407a和k409a;13)t366s、l368a、y407v、k409a和e357a;其中,氨基酸的位置根据kabat编号的eu索引确定。
180.在一些实施方案中,第一fc亚基包括第一修饰,第二fc亚基包括第二修饰,并且第一修饰和第二修饰包括在选自以下任一组的一组位置处的氨基酸取代:1)第一修饰:y349和t366;和第二修饰:d356、t366、l368、y407和f405;2)第一修饰:y349、t366和f405;和第二修饰:d356、t366、l368和y407;3)第一修饰:y349、t366和k409;和第二修饰:d356、t366、l368、y407和f405;4)第一修饰:y349、t366、f405、k360和q347;和第二修饰:d356、t366、l368、y407和q347;5)第一修饰:y349、t366、f405和q347;和第二修饰:d356、t366、l368、y407、k360和q347;6)第一修饰:y349、t366、k409、k360和q347;和第二修饰:d356、t366、
l368、y407、f405和q347;7)第一修饰:y349、t366、k409和q347;和第二修饰:d356、t366、l368、y407、f405、k360和q347;8)第一修饰:t366、k409和k392;和第二修饰:t366、l368、y407、d399和f405;9)第一修饰:t366和k409;和第二修饰:t366、l368、y407和f405;10)第一修饰:t366、k409和y349;和第二修饰:t366、l368、y407、f405和e357;11)第一修饰:t366、k409、y349和s354;和第二修饰:t366、l368、y407、f405和e357;12)第一修饰:t366和f405;和第二修饰:t366、l368、y407和k409;13)第一修饰:t366、f405和d399;和第二修饰:t366、l368、y407、k409和k392;14)第一修饰:t366、f405和y349;和第二修饰:t366、l368、y407、k409和e357;15)第一修饰:t366、f405、y349和s354;和第二修饰:t366、l368、y407、k409和e357;其中,所述氨基酸的位置根据kabat编号的eu索引确定。
181.在一些实施方案中,第一fc亚基包括第一修饰,第二fc亚基包括第二修饰,其中,第一修饰和第二修饰包括选自以下任一组的一组氨基酸取代:1)第一修饰:y349c和t366w;和第二修饰:d356c、t366s、l368a、y407v和f405k;2)第一修饰:y349c、t366w和f405k;和第二修饰:d356c、t366s、l368a和y407v;3)第一修饰:y349c、t366w和k409e;和第二修饰:d356c、t366s、l368a、y407v和f405k;4)第一修饰:y349c、t366w和k409a;和第二修饰:d356c、t366s、l368a、y407v和f405k;5)第一修饰:y349c、t366w、f405k、k360e和q347e;和第二修饰:d356c、t366s、l368a、y407v和q347r;6)第一修饰:y349c、t366w、f405k和q347r;和第二修饰:d356c、t366s、l368a、y407v、k360e和q347e;7)第一修饰:y349c、t366w、k409a、k360e和q347e;和第二修饰:d356c、t366s、l368a、y407v、f405k和q347r;8)第一修饰:y349c、t366w、k409a和q347r;和第二修饰:d356c、t366s、l368a、y407v、f405k、k360e和q347e;9)第一修饰:t366w、k409a和k392d;和第二修饰:t366s、l368a、y407v、d399s和f405k;10)第一修饰:t366w和k409a;和第二修饰:t366s、l368g、y407a和f405k;11)第一修饰:t366w、k409a和y349d;和第二修饰:t366s、l368a、y407v、f405k和e357a;12)第一修饰:t366w、k409a、y349d和s354d;和第二修饰:t366s、l368a、y407v、f405k和e357a;13)第一修饰:t366w和f405k;和第二修饰:t366s、l368a、y407v和k409a;14)第一修饰:t366w、f405k和d399s;和第二修饰:t366s、l368a、y407v、k409a和k392d;15)第一修饰:t366w和f405k;和第二修饰:t366s、l368g、y407a和k409a;16)第一修饰:t366w、f405k和y349d;和第二修饰:t366s、l368a、y407v、k409a和e357a;17)第一修饰:t366w、f405k、y349d和s354d;和第二修饰:t366s、l368a、y407v、k409a和e357a;其中,所述氨基酸的位置根据kabat编号的eu索引确定。
182.在一些实施方案中,第一fc亚基包括第一修饰,第二fc亚基包括第二修饰,第一修饰包括氨基酸取代t366w和k409a,并且第二修饰包括氨基酸取代t366s、l368g、y407a和f405k,其中,氨基酸的位置根据kabat编号的eu索引确定。
183.在一些实施方案中,第一和第二fc亚基包括促进第一fc亚基与第二fc亚基之间的异二聚化的修饰,诸如杵臼修饰。例如,第一fc亚基可以包括杵修饰,第二fc亚基可以包括臼修饰。又例如,第一fc亚基可以包括臼修饰,第二fc亚基可以包括杵修饰。
184.杵修饰可以包括氨基酸取代y349c和t366w,臼修饰可以包括氨基酸取代d356c、t366s、l368a和y407v,其中氨基酸的位置根据kabat编号的eu索引确定。
185.在一些实施方案中,第一fc亚基的氨基酸序列选自由以下各项构成的组:seq id no:1、3、5,6、7、9、11、13、15、17、19、21、22、24、27、29和30。
186.在一些实施方案中,蛋白质异二聚体所包括的白介素的氨基酸序列选自由以下各项构成的组:seq id no:49和51。
187.在一些实施方案中,第二fc亚基的氨基酸序列选自由以下各项构成的组:seq id no:2、4、8、10、12、14、16、18、20、23、25、26、28和30。
188.一方面,本公开提供了一种或多种分离的核酸,其编码根据本公开的蛋白质异二聚体。在一些实施方案中,分离的核酸编码根据本公开的蛋白质异二聚体的单体成员(例如第一单体成员或第二单体成员)或片段。
189.核酸可以使用本领域已知的重组技术合成。例如,核酸可以使用自动化dna合成仪合成。
190.标准重组dna和分子克隆技术包含由sambrook,j.,fritsch,e.f.and maniatis,t.molecular cloning:a laboratory manual(《分子克隆:实验室手册》),冷泉港实验室出版社:冷泉港,(1989)(maniatis)和t.j.silhavy,m.l.bennan,and l.w.enquist,experiments with gene fusions(基因融合实验),冷泉港实验室出版社,冷泉港,纽约(1984)以及ausubel,f.m.等人,current protocols in molecular biology(《分子生物学实验指南》),格林出版协会和美国威力出版公司出版(1987)描述的那些标准重组dna和分子克隆技术。简言之,本公开核酸可以由基因组dna片段、cdna和rna制备,基因组dna片段、cdna和rna都可以直接从细胞提取或通过包含但不限于pcr和rt
‑
pcr的各种扩增工艺以重组方式产生。
191.核酸的直接化学合成通常涉及将3’封端和5’封端核苷酸单体依次添加到生长核苷酸聚合物链的5’羟基端,其中每一次添加均通过在所添加的单体的3’位上对生长链的5’羟基端进行亲核攻击来实现,所添加的单体通常为磷衍生物,诸如磷酸三酯、亚磷酰胺等。例如参见matteuci等人,tet.lett.521:719(1980);caruthers等人的美国专利第4,500,707号;和southern等人的美国专利第5,436,327号和第5,700,637号。
192.一方面,本公开提供了一种或多种载体,其包括根据本公开的一种或多种分离的核酸。
193.所述载体可以是任何直链核酸、质粒、噬菌粒、黏粒、rna载体、病毒载体等。病毒载体的非限制性实例可以包含逆转录病毒、腺病毒和腺相关病毒。在一些实施方案中,载体为表达载体,例如噬菌体呈现载体。
194.表达载体可以适用于特定类型的宿主细胞而不适用于其它类型。例如,表达载体可以引入到宿主生物体,接着监测载体内所含的任何基因/多核苷酸的活力和表达。
195.表达载体还可能含有一个或多个可选标记基因,所述可选标记基因在表达时赋予可用于选择或以其它方式识别携带表达载体的宿主细胞的一个或多个表型性状。适合于真核细胞的可选标记的非限制性实例包含二氢叶酸还原酶和新霉素抗性。
196.本公开载体可以通过各种已认可技术稳定地或暂时地引入宿主细胞中。例如,一个方法涉及氯化钙处理,其中经由钙沉淀来引入表达载体。还可以依循类似程序使用其它盐,例如磷酸钙。另外,可以使用电穿孔(即施加电流以增加细胞到核酸的渗透性)。转型方法的其它实例包含显微注射、deae葡聚糖介导的转型以及在醋酸锂的存在下的热休克。脂类复合物、脂质体和树状分子也可以用于转染宿主细胞。
197.在将异源序列引入到宿主细胞中时,可以实践各种方法以识别本公开载体已引入
到其中的宿主细胞。一个示例性选择方法涉及传代培养个别细胞以形成个别菌落,接着测试所需蛋白质产物的表达。另一种方法包含基于表型性状选择含有异源序列的宿主细胞,所述表型性状通过表达载体内所含的可选标记基因的表达来赋予。
198.例如,本公开的各种异源序列到宿主细胞的引入可以通过诸如pcr、southern印迹或northern印迹杂交的方法来确认。例如,核酸可以由所得宿主细胞制备,所关注的特定序列可以通过使用对所关注序列具有特异性的引物的pcr进行扩增。对扩增产物进行琼脂糖凝胶电泳、聚丙烯酰胺凝胶电泳或毛细管电泳,接着用溴化乙锭、sybr green溶液等染色或用uv检测来检测dna。或者,可以将对所关注序列具有特异性的核酸探针用于杂交反应中。特定基因序列的表达可以通过借助与pcr结合的反转录、northern印迹杂交检测对应mrna,或借助使用与编码基因产物反应的抗体的免疫分析而确定。示例性免疫分析包含但不限于elisa、放射性免疫分析和夹心免疫分析。
199.此外,本公开的各种异源序列到宿主细胞中的引入可以通过异源序列所编码的酶(例如酶标记)的酶活性来确定。所述酶可以通过本领域中已知的各种方法来分析。一般来说,酶活性可以通过产物的形成或研究中的酶反应的底物的转化进行确认。所述反应可以在体外或体内发生。
200.一方面,本公开提供了一种分离的宿主细胞,其包括根据本公开的一种或多种分离的核酸或一种或多种载体。
201.宿主细胞可以是真核细胞或原核细胞。适当的宿主细胞可以用本公开的多核苷酸或载体转型或转染,且用于异二聚体蛋白和/或蛋白质混合物的表达和/或分泌。例如,所述细胞可以是大肠杆菌细胞、其它细菌宿主细胞、酵母细胞或各种较高的真核细胞(例如永生杂交瘤细胞、ns0骨髓瘤细胞、hek293细胞、中国仓鼠卵巢细胞、hela细胞、cos细胞等)。在一些实施方案中,编码蛋白质异二聚体(例如异二聚体蛋白)的核酸可操作地连接到适合于在特定宿主细胞中表达的表达控制序列。
202.一方面,本公开提供了一种蛋白质混合物。所述蛋白质混合物可以包括:1)根据本公开的蛋白质异二聚体;2)由根据本公开的蛋白质异二聚体的第一单体成员的两个相同拷贝形成的第一同二聚体;以及3)由根据本公开的蛋白质异二聚体的第二单体成员的两个相同拷贝形成的第二同二聚体。所述蛋白质异二聚体在蛋白质混合物中的百分比可以为至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%或至少约99%。
203.在所述蛋白质混合物中,第二同二聚体的百分比可以小于第一同二聚体的百分比。例如,第二同二聚体的百分比可以为至多约10%、至多约9%、至多约8%、至多约7%、至多约6%、至多约5%、至多约4%、至多约3%、至多约2%、至多约1%或至多约0.5%。例如,所述蛋白质混合物基本上可以不包括第二同二聚体。
204.所述蛋白质混合物可以直接由本公开的宿主细胞产生,例如无需富集/纯化蛋白质异二聚体和/或去除第一或第二同二聚体。
205.药物组合物
206.一方面,本公开提供了一种药物组合物,其包括根据本公开的蛋白质异二聚体,或根据本公开的蛋白质混合物,以及可选的药学上可接受的赋形剂。
207.药学上可接受的赋形剂的实例包含但不限于惰性固体稀释剂和填充剂、稀释剂、
无菌水溶液以及各种有机溶剂、促渗剂、增溶剂和佐剂。
208.在一些实施方案中,所述蛋白质异二聚体被配制成用于经口施用、静脉内施用、肌肉内施用、肿瘤部位原位施用、吸入、直肠施用、阴道施用、透皮施用或经皮下贮库施用。
209.所述药物组合物可以用于抑制肿瘤生长。例如,所述药物组合物可以抑制或延迟疾病的发展或进展,可以减小肿瘤尺寸(以及甚至基本上消除肿瘤),且可以减轻和/或稳定疾病状况。
210.下文描述了非限制性示例性药物组合物及其制备方法。
211.本公开药物组合物可以例如呈适合于经口施用的形式,如片剂、胶囊、丸剂、粉剂、缓释制剂、溶液、悬浮液;呈适合于非经肠注射的形式,如无菌溶液、悬浮液或乳剂;呈适合于局部施用的形式,如药膏或乳膏;或呈适合于直肠施用的形式,如栓剂。所述药物组合物可以呈适合于单次施用精确剂量的单位剂型。所述药物组合物可以进一步包括根据本公开的蛋白质异二聚体(例如异二聚体蛋白)或蛋白质混合物来作为活性成分并且可以包含常规药物载剂或赋形剂。进一步地,所述药物组合物可以包含其它医药或药物试剂、载剂、佐剂等。
212.示例性非经肠施用形式包含但不限于活性蛋白质异二聚体(例如异二聚体蛋白)溶于无菌水溶液(例如丙二醇水溶液或葡萄糖溶液)中的溶液或悬浮液。在需要时,这些剂型可以适当地用诸如组氨酸和/或磷酸盐的盐缓冲。
213.在一些实施方案中,本公开提供了一种用于注射的药物组合物,其含有本公开的蛋白质异二聚体(异二聚体蛋白)或蛋白质混合物以及适合于注射的药物赋形剂。
214.可以合并本公开药物组合物以通过注射施用的形式包括水性或油性悬浮液或含有芝麻油、玉米油、棉籽油或花生油的乳剂,以及酏剂、甘露醇、葡萄糖或无菌水溶液和类似药物媒剂。
215.在一些实施方案中,本公开提供了一种用于经口施用的药物组合物,其含有本公开的蛋白质异二聚体(异二聚体蛋白)或蛋白质混合物以及适合于经口施用的药物赋形剂。
216.在一些实施方案中,本公开提供了一种用于经口施用的固体药物组合物,其含有:(i)一定量的本公开的蛋白质异二聚体(例如异二聚体蛋白)或蛋白质混合物;可选的(ii)一定量的第二药剂;以及(iii)适合于经口施用的药物赋形剂。在一些实施方案中,所述组合物进一步含有:(iv)一定量的第三药剂。在一些实施方案中,蛋白质异二聚体或蛋白质混合物、第二药剂以及可选的第三药剂的量为单独地或以组合方式有效治疗个体的病况的量。
217.在一些实施方案中,药物组合物可以是适合于口服的液体药物组合物。本公开的适合于经口施用的药物组合物可以以离散剂型形式存在,诸如胶囊、扁囊剂或片剂,或分别含有预定量的有效成分(如粉末)的液体或喷雾剂,或呈颗粒、溶液或溶于水溶液或非水溶液中的悬浮液、水包油乳剂或油包水液体乳剂。这些剂型可以通过任何制药方法制备,但所有方法通常均包含使有效成分与包含一个或多个其它成分的载剂缔合的步骤。一般来说,所述组合物通过使有效成分与液体载剂或细分固体载剂或两种载剂均匀且密切掺混,并接着(如有必要)将产物成型为所需型式来制备。
218.本公开进一步涵盖包括有效成分(例如本公开的蛋白质异二聚体或异二聚体蛋白)的无水药物组合物和剂型,因为水可以促进某些多肽降解。例如,在制药领域,水可以作
为模拟长期储存以便确定特性(诸如保存期或制剂随时间推移的稳定性)的手段而予以添加(例如5%)。本公开的无水药物组合物和剂型可以使用无水或低水分成分以及低水分或低湿度条件来制备。
219.本公开的蛋白质异二聚体(例如异二聚体蛋白)或蛋白质混合物可以根据常规药物复合技术以密切掺混物形式与药物载剂组合。载剂可以采取各种形式,具体取决于施用所需的制剂形式。在不采用乳糖的一些实施例中,在制备口服剂型的组合物时,就口服液体制剂(诸如悬浮液、溶液和酏剂)或气雾剂而言,任何常用药物介质都可以用作载剂,诸如像水、乙二醇、油、醇、芳香剂、防腐剂、着色剂等;或就口服固体制剂而言,可以使用诸如淀粉、糖、微晶纤维素、稀释剂、粒化剂、润滑剂、粘合剂和崩解剂等载剂。在需要时,可以通过标准水性技术或非水性技术给片剂包覆包衣。
220.当需要水性悬浮液和/或酏剂以供经口施用时,其中的活性成分可以与各种甜味剂或芳香剂、色素或染料以及(在需要时)乳化剂和/或悬浮剂,连同诸如水、乙醇、丙二醇、甘油和其各种组合的稀释剂组合在一起。
221.本公开的药物组合物可以包括治疗有效量的活性剂(例如本公开的蛋白质异二聚体或蛋白质混合物)。治疗有效量为本公开药物组合物的能够预防和/或治愈(至少部分)患有或有风险患上病况或病症(例如癌症)的受试者的所述病况或病症和/或其任何并发症的量。所含活性剂的具体量/浓度可以根据施用方法和患者的需求而变化,并且可以基于例如体积、粘稠度和/或患者体重等确定。例如,适当的剂量可以为约0.1毫克/千克/天或l毫克/千克/天至约50毫克/千克/天;有时,所述剂量可以更高。应理解,这些具体剂量可以由本领域的技术人员(例如医生或药剂师)基于特定患者、制剂和/或疾病的情况而适宜地调节。
222.医疗用途和治疗方法
223.一方面,本公开提供了一种根据本公开的蛋白质异二聚体或根据本公开的蛋白质混合物用于制备用于抑制肿瘤或肿瘤细胞生长的药物和/或试剂盒的用途。在一些实施方案中,所述药物和/或试剂盒用于特异性地和/或优先地抑制靶细胞(例如癌细胞)的生长或分化或杀死靶细胞(例如癌细胞)。
224.一方面,本公开提供了一种根据本公开的蛋白质异二聚体或根据本公开的蛋白质混合物用于制备用于治疗有需要的受试者的癌症的药物的用途。
225.一方面,本公开提供了一种用于治疗有需要的受试者的癌症的方法。所述方法可以包括向受试者施用有效量的根据本公开的蛋白质异二聚体或根据本公开的蛋白质混合物。
226.一方面,本公开提供了一种抑制肿瘤或肿瘤细胞生长的方法,其包括使肿瘤或肿瘤细胞与有效量的根据本公开的蛋白质异二聚体或根据本公开的蛋白质混合物接触。所述接触可以在体外或体内进行。
227.在一些实施方案中,所述接触包含向受试者(例如哺乳动物)全身性地或局部地施用本公开的蛋白质异二聚体(例如异二聚体蛋白)、蛋白质混合物、药物组合物或药物。在一些实施方案中,所述接触包含直接在肿瘤位点施用本公开的蛋白质异二聚体(例如异二聚体蛋白)、蛋白质混合物、药物组合物或药物。在一些实施方案中,所述施用通过经口施用、静脉内施用、肌肉内施用、肿瘤部位原位施用、吸入、直肠施用、阴道施用、透皮施用或经皮下贮库施用进行。
228.在一些实施方案中,肿瘤(例如癌症)或肿瘤细胞(例如癌细胞)是实体肿瘤或源自实体肿瘤。例如,癌症可以选自由以下各项构成的组:b细胞淋巴瘤、肺癌、支气管癌、结肠直肠癌、前列腺癌、乳腺癌、胰腺癌、胃癌、卵巢癌、膀胱癌、脑癌或中枢神经系统癌、外周神经系统癌、食道癌、宫颈癌、黑色素瘤、子宫或子宫内膜癌、口腔及咽喉癌、肝癌、肾癌、胆管癌、小肠或阑尾癌、唾液腺癌、甲状腺癌、肾上腺癌、骨肉瘤、软骨肉瘤、脂肪肉瘤、睾丸癌和恶性纤维组织细胞瘤。
229.在一些实施方案中,所述癌症或癌细胞在受试者体内,例如癌症或癌细胞在人类或非人类动物(例如哺乳动物)体内。
230.在一些实施例中,所述哺乳动物是人。在一些实施方案中,所述哺乳动物是小鼠、大鼠、猫、狗、兔、猪、绵羊、马、牛、山羊、沙鼠、仓鼠、豚鼠、猴或任何其它哺乳动物。许多这些哺乳动物可以是本领域已知作为某些疾病或病症(包含实体肿瘤和/或其它癌症)的临床前模型的个体(例如,talmadge等人,2007 am.j.pathol.(《美国病理学杂志》)170:793;kerbel,2003 canc.biol.therap.(《肿瘤生物治疗》)2(4suppl 1):s134;man等人,2007 canc.met.rev.26:737;cespedes等人,2006 clin.transl oncol.(《临床转化肿瘤学》)8:318)。
231.制备蛋白质异二聚体或蛋白质混合物的方法
232.一方面,本公开提供了一种产生根据本公开的蛋白质异二聚体或根据本公开的蛋白质混合物的方法。所述方法可以包括(i)在实现所述蛋白质异二聚体的表达的条件下培养根据本公开的宿主细胞,以及(ii)收获已表达的蛋白质异二聚体或包括所述蛋白质异二聚体的蛋白质混合物。
233.在一些实施方案中,所述方法不包括富集根据本公开的宿主细胞表达的产物中的蛋白质异二聚体。
234.在一些实施方案中,所述方法不包括从由根据本公开的宿主细胞产生的蛋白质混合物除去第一或第二同二聚体。
235.在一些实施方案中,所述方法进一步包括分离和/或纯化蛋白质异二聚体或蛋白质混合物的步骤。
236.在一些实施方案中,所述方法进一步包括用编码/表达本公开的异二聚体、其一个或多个成员或其片段的多核苷酸/载体转染/转化宿主细胞。
237.在一些实施方案中,本公开的蛋白质异二聚体或蛋白质混合物是通过在适合于蛋白质表达的条件下使载体在细胞中表达而产生的。在一些实施方案中,本公开的蛋白质异二聚体或蛋白质混合物是通过单细胞克隆产生的。
238.可以在适合于蛋白质表达的条件之间变化的因素包括诸如孵育时间、温度和介质,并且可以取决于细胞类型并且本领域的普通技术人员将容易确定。
239.在一些实施方案中,在产生本公开的蛋白质异二聚体或蛋白质混合物的过程期间,宿主细胞在培养物中或在可用于生长培养物的任何设备(包括发酵罐)中生长。细胞可以以单层形式生长或附着于表面。或者,宿主细胞可以在悬浮液中生长。细胞可以在无血清培养基中生长。所述培养基可以是市售培养基,诸如但不限于补充有谷氨酰胺(诸如8mm l
‑
谷氨酰胺)的opti
‑
cho(invitrogen,目录号#12681)、补充有10%胎牛血清、10.5ng/ml mil
‑
3和l
‑
谷氨酰胺的rpmi1640培养基,或5%fcs培养基。
240.本公开还包含以下实施方案:
241.1.一种蛋白质异二聚体,其包括第一单体成员和不同于所述第一单体成员的第二单体成员,其中:所述第一单体成员包括第一fc亚基,所述第二单体成员包括第二fc亚基,并且所述第一单体成员与所述第二单体成员缔合,以通过所述第一fc亚基与所述第二fc亚基的复合而形成所述异二聚体;其中所述蛋白质异二聚体进一步包括一个或多个与所述第一fc亚基和/或所述第二fc亚基融合的白介素;其中所述蛋白质异二聚体不包括展现对肿瘤抗原的结合特异性的任何抗体重链可变区或任何抗体轻链可变区。
242.2.根据实施方案1所述的蛋白质异二聚体,其中所述一个或多个白介素与所述第一fc亚基和/或所述第二fc亚基的氨基端氨基酸和/或羧基端氨基酸融合。
243.3.根据实施方案1至2中任一项所述的蛋白质异二聚体,其包括两个或更多个白介素。
244.4.根据实施方案3所述的蛋白质异二聚体,其中所述两个或更多个白介素形成一个或多个白介素二聚体,每一个白介素二聚体包括两个彼此融合的白介素。
245.5.根据实施方案4所述的蛋白质异二聚体,其中每一个白介素二聚体的所述两个白介素通过肽接头彼此融合。
246.6.根据实施方案4至5中任一项所述的蛋白质异二聚体,其中所述白介素二聚体与所述第一fc亚基和/或所述第二fc亚基的氨基端氨基酸和/或羧基端氨基酸融合。
247.7.根据实施方案1至6中任一项所述的蛋白质异二聚体,其中所述白介素中的一个或多个通过肽接头与所述第一fc亚基和/或所述第二fc亚基融合。
248.8.根据实施方案1至7中任一项所述的蛋白质异二聚体,其中所述一个或多个白介素中的至少一个为il10。
249.9.根据实施方案4至8中任一项所述的蛋白质异二聚体,其中所述一个或多个白介素二聚体包括至少一个il10二聚体,并且所述il10二聚体包括两个il10。
250.10.根据实施方案1至9中任一项所述的蛋白质异二聚体,其中所述第一fc亚基和/或所述第二fc亚基源自igg分子。
251.11.根据实施方案10所述的蛋白质异二聚体,其中所述igg选自由igg1、igg2、igg3和igg4构成的组。
252.12.根据实施方案11所述的蛋白质异二聚体,其中所述igg为人igg1。
253.13.根据实施方案1至12中任一项所述的蛋白质异二聚体,其中所述蛋白质异二聚体不包括展现对任何肿瘤抗原的结合特异性的任何靶向部分。
254.14.根据实施方案1至13中任一项所述的蛋白质异二聚体,其中所述第一fc亚基不同于所述第二fc亚基,并且所述第一和/或第二fc亚基包括促进所述第一fc亚基与所述第二fc亚基之间的异二聚体化的修饰。
255.15.根据实施方案14所述的蛋白质异二聚体,其中,所述第一fc亚基包括第一修饰,并且所述第二fc亚基包括第二修饰。
256.16.根据实施方案15所述的蛋白质异二聚体,其中,所述第一修饰包括在t366位置处的氨基酸取代,以及在选自由以下各项构成的组中的一个或多个位置处的氨基酸取代:y349、f405、k409、d399、k360、q347、k392和s354,其中,所述氨基酸的位置根据kabat编号的eu索引确定。
257.17.根据实施方案16所述的蛋白质异二聚体,其中所述第一修饰包括的氨基酸取代选自由以下各项构成的组:y349c、y349d、d399s、f405k、k360e、k409a、k409e、q347e、q347r、s354d、k392d和t366w。
258.18.根据实施方案15至17中任一项所述的蛋白质异二聚体,其中,所述第一修饰包括2至5个氨基酸取代。
259.19.根据实施方案15至18中任一项所述的蛋白质异二聚体,其中,所述第一修饰包括在选自以下任一组的一组位置处的氨基酸取代:1)y349和t366;2)y349、t366和f405;3)y349、t366和k409;4)y349、t366、f405、k360和q347;5)y349、t366、f405和q347;6)y349、t366、k409、k360和q347;7)y349、t366、k409和q347;8)t366、k409和k392;9)t366和k409;10)t366、k409、y349和s354;11)t366和f405;12)t366、f405和d399;以及13)t366、f405、y349和s354;其中,所述氨基酸的位置根据kabat编号的eu索引确定。
260.20.根据实施方案15至19中任一项所述的蛋白质异二聚体,其中,所述第一修饰包括选自以下任一组的一组氨基酸取代:1)y349c和t366w;2)y349c、t366w和f405k;3)y349c、t366w和k409e;4)y349c、t366w和k409a;5)y349c、t366w、f405k、k360e和q347e;6)y349c、t366w、f405k和q347r;7)y349c、t366w、k409a、k360e和q347e;8)y349c、t366w、k409a和q347r;9)t366w、k409a和k392d;10)t366w和k409a;11)t366w、k409a和y349d;12)t366w、k409a、y349d和s354d;13)t366w和f405k;14)t366w、f405k和d399s;15)t366w、f405k和y349d;以及16)t366w、f405k、y349d和s354d;其中,所述氨基酸的位置根据kabat编号的eu索引确定。
261.21.根据实施方案15至20中任一项所述的蛋白质异二聚体,其中,所述第二修饰包括在t366、l368和y407位置处的氨基酸取代,以及在选自由d356、d399、e357、f405、k360、k392、k409和q347构成的组的一个或多个位置处的氨基酸取代,其中,所述氨基酸的位置根据kabat编号的eu索引确定。
262.22.根据实施方案21所述的蛋白质异二聚体,其中,所述第二修饰所包括的氨基酸取代选自由以下各项构成的组:d356c、d399s、e357a、f405k、k360e、k392d、k409a、l368a,l368g、q347e、q347r、t366s、y407a和y407v。
263.23.根据实施方案15至22中任一项所述的蛋白质异二聚体,其中,所述第二修饰包括4至6个位置处的氨基酸取代。
264.24.根据实施方案15至23中任一项所述的蛋白质异二聚体,其中,所述第二修饰包括在选自以下任一组的一组位置处的氨基酸取代:1)d356、t366、l368、y407和f405;2)d356、t366、l368和y407;3)d356、t366、l368、y407和q347;4)d356、t366、l368、y407、k360和q347;5)d356、t366、l368、y407、f405和q347;6)d356、t366、l368、y407、f405、k360和q347;7)t366、l368、y407、d399和f405;8)t366、l368、y407和f405;9)t366、l368、y407、f405和e357;10)t366、l368、y407和k409;11)t366、l368、y407、k409和k392;and 12)t366、l368、y407、k409和e357;其中,所述氨基酸的位置根据kabat编号的eu索引确定。
265.25.根据实施方案15至24中任一项所述的蛋白质异二聚体,其中,所述第二修饰包括选自以下任一组的一组氨基酸取代:1)d356c、t366s、l368a、y407v和f405k;2)d356c、t366s、l368a和y407v;3)d356c、t366s、l368a、y407v和q347r;4)d356c、t366s、l368a、y407v、k360e和q347e;5)d356c、t366s、l368a、y407v、f405k和q347r;6)d356c、t366s、
l368a、y407v、f405k、k360e和q347e;7)t366s、l368a、y407v、d399s和f405k;8)t366s、l368g、y407a和f405k;9)t366s、l368a、y407v、f405k和e357a;10)t366s、l368a、y407v和k409a;11)t366s、l368a、y407v、k409a和k392d;12)t366s、l368g、y407a和k409a;13)t366s、l368a、y407v、k409a和e357a;其中,所述氨基酸的位置根据kabat编号的eu索引确定。
266.26.根据实施方案15至25中任一项所述的蛋白质异二聚体,其中,所述第一fc亚基包括所述第一修饰,所述第二fc亚基包括所述第二修饰,并且所述第一修饰和所述第二修饰包括在选自以下任一组的一组位置处的氨基酸取代:1)第一修饰:y349和t366;和第二修饰:d356、t366、l368、y407和f405;2)第一修饰:y349、t366和f405;和第二修饰:d356、t366、l368和y407;3)第一修饰:y349、t366和k409;和第二修饰:d356、t366、l368、y407和f405;4)第一修饰:y349、t366、f405、k360和q347;和第二修饰:d356、t366、l368、y407和q347;5)第一修饰:y349、t366、f405和q347;和第二修饰:d356、t366、l368、y407、k360和q347;6)第一修饰:y349、t366、k409、k360和q347;和第二修饰:d356、t366、l368、y407、f405和q347;7)第一修饰:y349、t366、k409和q347;和第二修饰:d356、t366、l368、y407、f405、k360和q347;8)第一修饰:t366、k409和k392;和第二修饰:t366、l368、y407、d399和f405;9)第一修饰:t366和k409;和第二修饰:t366、l368、y407和f405;10)第一修饰:t366、k409和y349;和第二修饰:t366、l368、y407、f405和e357;11)第一修饰:t366、k409、y349和s354;和第二修饰:t366、l368、y407、f405和e357;12)第一修饰:t366和f405;和第二修饰:t366、l368、y407和k409;13)第一修饰:t366、f405和d399;和第二修饰:t366、l368、y407、k409和k392;14)第一修饰:t366、f405和y349;和第二修饰:t366、l368、y407、k409和e357;15)第一修饰:t366、f405、y349和s354;和第二修饰:t366、l368、y407、k409和e357;其中,所述氨基酸的位置根据kabat编号的eu索引确定。
267.27.根据实施方案15至26中任一项所述的蛋白质异二聚体,其中,所述第一fc亚基包括所述第一修饰,所述第二fc亚基包括所述第二修饰,其中,所述第一修饰和所述第二修饰包括选自以下任一组的一组氨基酸取代:1)第一修饰:y349c和t366w;和第二修饰:d356c、t366s、l368a、y407v和f405k;2)第一修饰:y349c、t366w和f405k;和第二修饰:d356c、t366s、l368a和y407v;3)第一修饰:y349c、t366w和k409e;和第二修饰:d356c、t366s、l368a、y407v和f405k;4)第一修饰:y349c、t366w和k409a;和第二修饰:d356c、t366s、l368a、y407v和f405k;5)第一修饰:y349c、t366w、f405k、k360e和q347e;和第二修饰:d356c、t366s、l368a、y407v和q347r;6)第一修饰:y349c、t366w、f405k和q347r;和第二修饰:d356c、t366s、l368a、y407v、k360e和q347e;7)第一修饰:y349c、t366w、k409a、k360e和q347e;和第二修饰:d356c、t366s、l368a、y407v、f405k和q347r;8)第一修饰:y349c、t366w、k409a和q347r;和第二修饰:d356c、t366s、l368a、y407v、f405k、k360e和q347e;9)第一修饰:t366w、k409a和k392d;和第二修饰:t366s、l368a、y407v、d399s和f405k;10)第一修饰:t366w和k409a;和第二修饰:t366s、l368g、y407a和f405k;11)第一修饰:t366w、k409a和y349d;和第二修饰:t366s、l368a、y407v、f405k和e357a;12)第一修饰:t366w、k409a、y349d和s354d;和第二修饰:t366s、l368a、y407v、f405k和e357a;13)第一修饰:t366w和f405k;和第二修饰:t366s、l368a、y407v和k409a;14)第一修饰:t366w、f405k和d399s;和第二修饰:t366s、l368a、y407v、k409a和k392d;15)第一修饰:t366w和f405k;和第二修饰:t366s、l368g、y407a和k409a;16)第一修饰:t366w、f405k和y349d;和第二修饰:t366s、l368a、
y407v、k409a和e357a;17)第一修饰:t366w、f405k、y349d和s354d;和第二修饰:t366s、l368a、y407v、k409a和e357a;其中,所述氨基酸的位置根据kabat编号的eu索引确定。
268.28.根据实施方案27所述的蛋白质异二聚体,其中,所述第一fc亚基包括所述第一修饰,所述第二fc亚基包括所述第二修饰,所述第一修饰包括所述氨基酸取代t366w和k409a,并且所述第二修饰包括所述氨基酸取代t366s、l368g、y407a和f405k,其中,所述氨基酸的位置根据kabat编号的eu索引确定。
269.29.根据实施方案1至28中任一项所述的蛋白质异二聚体,其中,所述一个或多个白介素中的至少一个与所述第二fc亚基融合。
270.30.根据实施方案29所述的蛋白质异二聚体,其中,所述一个或多个白介素中的至少一个与所述第二fc亚基的氨基端氨基酸融合。
271.31.根据实施方案30所述的蛋白质异二聚体,其中,在所述第二单体成员中,所述一个或多个白介素中的至少两个彼此融合以形成白介素二聚体,并且所述白介素二聚体进一步与所述第二fc亚基的氨基端氨基酸融合。
272.32.根据实施方案1至31中任一项所述的蛋白质异二聚体,其中,所述第一单体成员不包括任何白介素。
273.33.根据实施方案1至32中任一项所述的蛋白质异二聚体,其中,所述第一单体成员由所述第一fc亚基构成。
274.34.根据实施方案1至31中任一项所述的蛋白质异二聚体,其中,所述一个或多个白介素中的至少一个与所述第一fc亚基融合。
275.35.根据实施方案34所述的蛋白质异二聚体,其中,所述一个或多个白介素中的至少一个与所述第一fc亚基的氨基端氨基酸融合。
276.36.根据实施方案35所述的蛋白质异二聚体,其中,在所述第一单体成员中,所述一个或多个白介素中的至少两个彼此融合以形成白介素二聚体,并且所述白介素二聚体进一步与所述第一fc亚基的氨基端氨基酸融合。
277.37.根据实施方案34至36中任一项所述的蛋白质异二聚体,其中,所述第二单体成员不包括任何白介素。
278.38.根据实施方案34至37中任一项所述的蛋白质异二聚体,其中,所述第二单体成员由第二fc亚基构成。
279.39.一种或多种分离的核酸,其编码根据实施方案1至38中任一项所述的蛋白质异二聚体。
280.40.一种或多种载体,其包括根据实施方案39所述的一种或多种分离的核酸。
281.41.一种分离的宿主细胞,其包括根据实施方案39所述的一种或多种分离的核酸或根据实施方案40所述的一种或多种载体。
282.42.一种蛋白质混合物,其包括:1)根据实施方案1至38中任一项所述的蛋白质异二聚体;2)由根据实施方案1至38中任一项所述的第一单体成员的两个相同拷贝形成的第一同二聚体;以及3)根据实施方案1至38中任一项所述的第二单体成员的两个相同拷贝形成的第二同二聚体;其中,所述蛋白质异二聚体在所述蛋白质混合物中的百分比为至少50%。
283.43.根据实施方案42所述的蛋白质混合物,其中,所述第二同二聚体的百分比小于
所述第一同二聚体的百分比。
284.44.根据实施方案42至43中任一项所述的蛋白质混合物,其中,所述第二同二聚体的百分比为至多10%。
285.45.根据实施方案42至44中任一项所述的蛋白质混合物,其中,所述蛋白质混合物基本上不包括所述第二同二聚体。
286.46.根据实施方案42至45中任一项所述的蛋白质混合物,其中,所述蛋白质混合物由宿主细胞直接产生,没有富集所述蛋白质异二聚体和/或去除所述第一或第二同二聚体。
287.47.一种药物组合物,其包括根据实施方案1至38中任一项所述的蛋白质异二聚体,或根据实施方案42至46中任一项所述的蛋白质混合物,以及可选的药学上可接受的赋形剂。
288.48.根据实施方案47所述的药物组合物,其中,所述蛋白质异二聚体被配制成用于经口施用、静脉内施用、肌肉内施用、肿瘤部位原位施用、吸入、直肠施用、阴道施用、透皮施用或经皮下贮库施用。
289.49.一种根据实施方案1至38中任一项所述的蛋白质异二聚体或根据实施方案42至46中任一项所述的蛋白质混合物用于制备用于抑制肿瘤或肿瘤细胞生长的药物和/或试剂盒的用途。
290.50.一种根据实施方案1至38中任一项所述的蛋白质异二聚体或根据实施方案42至46中任一项所述的蛋白质混合物用于制备用于治疗有需要的受试者的癌症的药物的用途。
291.51.一种抑制肿瘤或肿瘤细胞生长的方法,其包括使所述肿瘤或肿瘤细胞与有效量的根据实施方案1至38中任一项所述的蛋白质异二聚体或根据实施方案42至46中任一项所述的蛋白质混合物接触。
292.52.根据实施方案51所述的方法,其中,所述接触在体外或体内进行。
293.53.一种治疗有需要的受试者的癌症的方法,其包括向所述受试者施用有效量的根据实施方案1至38中任一项所述的蛋白质异二聚体或根据实施方案42至46中任一项所述的蛋白质混合物。
294.54.一种产生根据实施方案1至38中任一项所述的蛋白质异二聚体或根据实施方案42至46中任一项所述的蛋白质混合物的方法,其包括(i)在实现蛋白质异二聚体的表达的条件下培养实施方案41所述的宿主细胞,以及(ii)收获已表达的蛋白质异二聚体或包括所述蛋白质异二聚体的蛋白质混合物。
295.虽然本文已展示和描述本公开的优选实施例,但本领域的技术人员将显而易见,这些实施例仅仅通过示例的方式提供。本领域技术人员将会想到不脱离本公开的众多变化、改变和替换。应理解,本文所描述的本公开实施例的各种替代方案可以用于实践本公开。随附权利要求书旨在限定本公开的范围,并且借此涵盖这些权利要求范围内的方法和结构以及其等效物。
296.实施例
297.以下提供的实施例和制备进一步说明和例示本公开的蛋白质异二聚体及其使用和制备方法。应理解,本公开的范围不以任何方式受以下实施例和制备的范围限制。
298.实施例1核酸的修饰和制备
299.1.1 fc修饰
300.对人igg1 fc结构域的界面残基进行氨基酸修饰(例如氨基酸取代)以获得以下修饰组(如以下表1中所示),本公开中链a也称为fc9或第一fc亚基,并且链b也称为fc6或第二fc亚基:
301.[0302][0303]
表1.氨基酸修饰组
[0304]
随后,如下文所详细说明的,使用scfv
‑
fc/fc系统检查包括以上表1中列出的修饰组的异二聚体蛋白的形成。
[0305]
首先,从数据库uniprot中获得人免疫球蛋白γ1(igg1)恒定区氨基酸序列(p01857),以得到野生型人igg1
‑
fc区氨基酸序列(seq id no:30)。通过rt
‑
pcr从人pbmc总rna获得编码野生型人igg1
‑
fc的多核苷酸片段(seq id no:31,命名为fc基因片段)。通过重叠pcr将编码小鼠κiii信号肽的多核苷酸片段(seq id no:32)添加到fc基因的5’端,然后亚克隆到载体pcdna4(invitrogen,cat v86220)中,以获得在哺乳动物细胞中表达人igg1
‑
fc的重组表达载体。
[0306]
合成编码scfv
‑
fc融合蛋白的核酸分子(seq id no:33),其中scfv是指抗her2单链抗体,scfv
‑
fc融合蛋白的氨基酸序列如seq id no:34中所示。随后将scfv
‑
fc基因片段亚克隆到载体pcdna4(invitrogen,cat v86220)中,以获得用于在哺乳动物细胞中表达scfv
‑
fc融合蛋白的重组表达载体。
[0307]
在一些情况下,使编码骆驼单结构域抗体(vhh)的可变区的多肽与fc基因片段的n端融合,以获得编码融合蛋白vhh
‑
fc(如seq id no:36中所示)的融合基因片段(如seq id no:35中所示)。然后将其亚克隆到载体pcdna4(invitrogen,cat v86220)中,以获得用于在
哺乳动物细胞中表达融合蛋白vhh
‑
fc的重组表达载体。
[0308]
然后,通过重叠pcr分别将以上表1中列出的氨基酸修饰引入到scfv
‑
fc(第1至17组)、vhh
‑
fc(第9至12组、第14组、第15组和第17组)和fc基因片段(第1至8组),其中链a是指scfv
‑
fc中的fc亚基,并且链b是指单独的fc亚基或vhh
‑
fc中的fc亚基。将具有氨基酸修饰的基因片段分别亚克隆到载体pcdna4(invitrogen,cat v86220)中,以获得用于在哺乳动物细胞中表达经修饰的scfv
‑
fc融合蛋白、经修饰的fc蛋白和经修饰的vhh
‑
fc融合蛋白的重组表达载体。
[0309]
然后,通过pei用构筑的表达载体转染悬浮培养的hek293细胞(atcc crl
‑
1573
tm
)。对于每一组,以1:1的比率共转染表达a链(scfv
‑
fc融合蛋白)和表达b链(fc蛋白或vhh
‑
fc融合蛋白)的表达载体。在培养5至6天后,收集瞬时表达产物的上清液,并且使用proteina亲和色谱初步纯化包括对应蛋白质异二聚体的表达产物。每一种初步纯化的表达产物包括分别以各种百分比存在的同二聚体蛋白scfv
‑
fc/scfv
‑
fc、同二聚体蛋白fc/fc(或同二聚体蛋白vhh
‑
fc/vhh
‑
fc)和异二聚体蛋白scfv
‑
fc/fc(或异二聚体蛋白scfv
‑
fc/vhh
‑
fc)。由于这些蛋白质(即,同二聚体和异二聚体)的分子量不同,所以其对应百分比可以根据非还原性sds
‑
page凝胶上所反映的对应谱带强度来确定。所述强度经过量化,结果汇总在以下表2至表5中。
[0310]
分组scfv
‑
fc同二聚体(%)scfv
‑
fc/fc异二聚体(%)fc同二聚体(%)1245818210702032557184107713
[0311]
表2 同二聚体蛋白和异二聚体蛋白在表达产物中的百分比
[0312][0313][0314]
表3 同二聚体蛋白和异二聚体蛋白在表达产物中的百分比
[0315]
分组scfv
‑
fc同二聚体(%)scfv
‑
fc/vhh
‑
fc异二聚体(%)vhh
‑
fc同二聚体(%)4136819978013101585011148331210846
id no:17中所示,并且编码其的多核苷酸序列如seq id no:42中所示。
[0326]
1.5抗egfr(西妥昔单抗(cetuximab))的制备
[0327]
获得西妥昔单抗(也称为爱必妥或erb,其为抗表皮生长因子受体egfr的抗体)的重链和轻链的全长氨基酸序列,并使用在线工具dnaworks(helixweb.nih.gov/dnaworks/)获得编码这些氨基酸序列的对应dna序列。然后,合成编码西妥昔单抗的轻链(erb
‑
lc)的核酸分子。erb
‑
lc的氨基酸序列如seq id no:43中所示,并且编码其的多核苷酸序列如seq id no:44中所示。然后,将点突变(t366w和k409a)引入到编码西妥昔单抗重链基因的fc区的多核苷酸序列中,并合成编码经修饰的西妥昔单抗重链的核酸分子(在本文中称为erb
‑
fc9),编码其的对应多肽命名为erb
‑
fc9。erb
‑
fc9的氨基酸序列如seq id no:45中所示,并且编码其的多核苷酸序列如seq id no:46中所示。
[0328]
1.6(il10)2‑
铰链
‑
fc的制备
[0329]
首先,从美国国家生物技术信息中心(ncbi)获得人白介素10(il10)的序列信息(p22301),然后将接头序列“(ggggs)
3”添加在两个il10之间,以得到(il10)2,并获得编码其的全长多核苷酸序列。然后,根据来自蛋白质数据库uniprot的人免疫球蛋白γ1(igg1)恒定区的氨基酸序列(p01857)获得人igg1
‑
fc的氨基酸序列(即,p01857的残基104至残基330)。然后,将接头序列“(ggggs)
3”(seq id no:37)和铰链区序列(seq id no:66)添加到igg1
‑
fc的n端,以获得接头
‑
铰链
‑
fc。然后,使用在线工具dnaworks(helixweb.nih.gov/dnaworks/)设计编码其的对应dna序列。将编码(il10)2的多核苷酸序列添加到编码接头
‑
铰链
‑
fc的多核苷酸序列的5’端,从而获得并合成编码融合蛋白(il10)2‑
铰链
‑
fc的多核苷酸序列。(il10)2‑
铰链
‑
fc的氨基酸序列如seq id no:47中所示,并且编码其的多核苷酸序列如seq id no:48中所示。
[0330]
1.7铰链
‑
fc6
‑
(il10)2和fc6
‑
(il10)2的制备
[0331]
首先,从美国国家生物技术信息中心(ncbi)获得人白介素10(il10)的序列信息(p22301),并获得编码其的全长多核苷酸序列。然后,根据来自蛋白质数据库uniprot的人免疫球蛋白γ1(igg1)恒定区的氨基酸序列(p01857)获得人igg1
‑
fc的氨基酸序列(即,p01857的残基104至残基330)。之后,将点突变(t366s、l368g、y407a和f405k)引入到igg1
‑
fc片段,由此获得的多肽被称为fc6。
[0332]
然后,将接头序列“(ggggs)
3”(seq id no:37)添加到fc6的c端,以获得fc6
‑
接头。或者,将铰链区序列(seq id no:66)添加到fc6的n端并将接头序列“(ggggs)
3”(seq id no:37)添加到fc6的c端,以获得铰链
‑
fc6
‑
接头。然后,使用在线工具dnaworks(helixweb.nih.gov/dnaworks/)设计编码其的对应dna序列。然后,将接头序列“(ggggs)
3”(seq id no:37)添加在il10的两个拷贝之间,以获得(il10)2。然后,将编码(il10)2的多核苷酸序列添加到编码fc6
‑
接头的多核苷酸序列的3’端,从而获得并合成编码融合蛋白fc6
‑
(il10)2的多核苷酸序列。或者,将编码(il10)2的多核苷酸序列添加到编码铰链
‑
fc6
‑
接头的多核苷酸序列的3’端,从而获得并合成编码融合蛋白铰链
‑
fc6
‑
(il10)2的多核苷酸序列。铰链
‑
fc6
‑
(il10)2的氨基酸序列如seq id no:55中所示,并且编码其的多核苷酸序列如seq id no:56中所示。fc6
‑
(il10)2的氨基酸序列如seq id no:60中所示,并且编码其的多核苷酸序列如seq id no:61中所示。
[0333]
1.8 il10
‑
铰链
‑
fc6的制备
[0334]
首先,从美国国家生物技术信息中心(ncbi)获得人白介素10(il10)的序列信息(p22301),并获得编码其的全长多核苷酸序列。然后,根据来自蛋白质数据库uniprot的人免疫球蛋白γ1(igg1)恒定区的氨基酸序列(p01857)获得人igg1
‑
fc的氨基酸序列(即,p01857的残基104至残基330)。之后,将点突变(t366s、l368g、y407a和f405k)引入到igg1
‑
fc片段,由此获得的多肽被称为fc6。然后,将接头序列“(ggggs)
3”(seq id no:37)和铰链区序列(seq id no:66)添加到fc6的n端,以获得接头
‑
铰链
‑
fc6。然后,使用在线工具dnaworks(helixweb.nih.gov/dnaworks/)设计编码其的对应dna序列。将编码il10的多核苷酸序列添加到编码接头
‑
铰链
‑
fc6的多核苷酸序列的5’端,从而获得并合成编码融合蛋白il10
‑
铰链
‑
fc6的多核苷酸序列。il10
‑
铰链
‑
fc6的氨基酸序列如seq id no:53中所示,并且编码其的多核苷酸序列如seq id no:54中所示。
[0335]
1.9(il10)2‑
fc9的制备
[0336]
首先,从美国国家生物技术信息中心(ncbi)获得人白介素10(il10)的序列信息(p22301),并获得编码其的全长多核苷酸序列。然后,根据来自蛋白质数据库uniprot的人免疫球蛋白γ1(igg1)恒定区的氨基酸序列(p01857)获得即p01857的残基104至残基330。之后,将点突变(t366w和k409a)引入到igg1fc片段,由此获得的多肽被称为fc9。然后,将接头序列“(ggggs)
3”(seq id no:37)添加到fc9的n端,以获得接头
‑
fc9。然后,使用在线工具dnaworks(helixweb.nih.gov/dnaworks/)设计编码其的对应dna序列。然后,将接头序列“(ggggs)
3”(seq id no:37)添加在il10的两个拷贝之间,以获得(il10)2。然后,将编码(il10)2的多核苷酸序列添加到编码接头
‑
fc9的多核苷酸序列的5’端,从而获得并合成编码融合蛋白(il10)2‑
fc9的多核苷酸序列。(il10)2‑
fc9的氨基酸序列如seq id no:57中所示,并且编码其的多核苷酸序列如seq id no:58中所示。
[0337]
1.10 fc6的制备
[0338]
根据来自蛋白质数据库uniprot的人免疫球蛋白γ1(igg1)恒定区的氨基酸序列(p01857)获得人igg1
‑
fc的氨基酸序列(即,p01857的残基104至残基330)。之后,将点突变(t366s、l368g、y407a和f405k)引入到igg1fc片段,由此获得的多肽被称为fc6。fc6的氨基酸序列如seq id no:18中所示,并且编码其的多核苷酸序列如seq id no:59中所示。
[0339]
1.11 fc6
‑
il10的制备
[0340]
首先,从美国国家生物技术信息中心(ncbi)获得人白介素10(il10)的序列信息(p22301),并获得编码其的全长多核苷酸序列。然后,根据来自蛋白质数据库uniprot的人免疫球蛋白γ1(igg1)恒定区的氨基酸序列(p01857)获得人igg1
‑
fc的氨基酸序列(即,p01857的残基104至残基330)。之后,将点突变(t366s、l368g、y407a和f405k)引入到igg1
‑
fc片段,由此获得的多肽被称为fc6。
[0341]
然后,将接头序列“(ggggs)
3”(seq id no:37)添加到fc6的c端,以获得fc6
‑
接头。然后,使用在线工具dnaworks(helixweb.nih.gov/dnaworks/)设计编码其的对应dna序列。然后,将编码il10的多核苷酸序列添加到编码fc6
‑
接头的多核苷酸序列的3’端,从而获得并合成编码融合蛋白fc6
‑
il10的多核苷酸序列。fc6
‑
il10的氨基酸序列如seq id no:62中所示,并且编码其的多核苷酸序列如seq id no:63中所示。
[0342]
1.12fc
‑
il10的制备
[0343]
首先,从美国国家生物技术信息中心(ncbi)获得人白介素10(il10)的序列信息
(p22301),并获得编码其的全长多核苷酸序列。然后,根据来自蛋白质数据库uniprot的人免疫球蛋白γ1(igg1)恒定区的氨基酸序列(p01857)获得人igg1
‑
fc的氨基酸序列(即,p01857的残基104至残基330)。然后,将接头序列“(ggggs)
3”(seq id no:37)添加到igg1
‑
fc的c端,以获得fc
‑
接头。然后,使用在线工具dnaworks(helixweb.nih.gov/dnaworks/)设计编码其的对应dna序列。将编码il10的多核苷酸序列添加到编码fc
‑
接头的多核苷酸序列的3’端,从而获得并合成编码融合蛋白fc
‑
il10的多核苷酸序列。fc
‑
il10的氨基酸序列如seq id no:64中所示,并且编码其的多核苷酸序列如seq id no:65中所示。
[0344]
实施例2重组质粒的构建
[0345]
用hindiii和ecori(takara)消化根据实施例1获得的核酸分子(编码(il10)2‑
铰链
‑
fc6、il10
‑
铰链
‑
fc、fc9、erb
‑
fc9、erb
‑
lc、(il10)2‑
铰链
‑
fc、铰链
‑
fc6
‑
(il10)2、fc6
‑
(il10)2、il10
‑
铰链
‑
fc6、(il10)2‑
fc9、fc6、fc6
‑
il10和fc
‑
il10),然后分别亚克隆到载体pcdna4/myc
‑
hisa(invitrogen,v863
‑
20)中。通过测序验证所获得的质粒,并将正确的重组质粒分别命名为:pcdna4
‑
(il10)2‑
铰链
‑
fc6、pcdna4
‑
il10
‑
铰链
‑
fc、pcdna4
‑
fc9、pcdna4
‑
erb
‑
fc9、pcdna4
‑
erb
‑
lc、pcdna4
‑
(il10)2‑
铰链
‑
fc、pcdna4
‑
铰链
‑
fc6
‑
(il10)2、pcdna4
‑
fc6
‑
(il10)2、pcdna4
‑
il10
‑
铰链
‑
fc6、pcdna4
‑
(il10)2‑
fc9、pcdna4
‑
fc6、pcdna4
‑
fc6
‑
il10和pcdna4
‑
fc
‑
il10。
[0346]
实施例3蛋白质异二聚体的表达和纯化
[0347]
在转染前两天,准备12
×
600ml悬浮驯化的hek293(atcc,crl
‑
1573
tm
)细胞以供瞬时转染,以0.8
×
106个细胞/毫升的密度接种细胞。两天后,将三等份细胞悬浮液离心,然后在600ml freestyle293培养基中再次悬浮。
[0348]
将从实施例2中获得的重组表达载体分成以下各组:
[0349]
a组:pcdna4
‑
il10
‑
铰链
‑
fc6(200μg)+pcdna4
‑
fc9(200μg)
[0350]
b组:pcdna4
‑
(il10)2‑
铰链
‑
fc6(200μg)+pcdna4
‑
fc9(200μg)
[0351]
c组:pcdna4
‑
铰链
‑
fc6
‑
(il10)2(200μg)+pcdna4
‑
fc9(200μg)
[0352]
d组:pcdna4
‑
(il10)2‑
fc9(200μg)+pcdna4
‑
fc6(200μg)
[0353]
e组:pcdna4
‑
erb
‑
fc9(200μg)+pcdna4
‑
erb
‑
lc(200μg)+pcdna4
‑
(il10)2‑
铰链
‑
fc6(200μg)
[0354]
f组:pcdna4
‑
il10
‑
铰链
‑
fc(200μg)
[0355]
g组:pcdna4
‑
(il10)2‑
铰链
‑
fc(200μg)
[0356]
h组:pcdna4
‑
fc6
‑
il10(200μg)+pcdna4
‑
fc9(200μg)
[0357]
i组:pcdna4
‑
fc
‑
il10(200μg)
[0358]
j组:pcdna4
‑
fc6
‑
(il10)2(200μg)+pcdna4
‑
fc9(200μg)
[0359]
在瞬时转染的293f细胞中产生所有蛋白质。简而言之,使freestyle 293f细胞(invitrogen)在293f培养基(invitrogen)中生长,用非线性质粒dna和293fectin试剂(invitrogen)转染,并以80至100毫升/瓶的体积在37℃、5%co2下在摇瓶中分批生长6天。通过一步protein a色谱纯化所有蛋白质。通过sds
‑
page和sec
‑
hplc确定每种蛋白质的质量。类似地,用sds
‑
page验证并确认本技术的其它蛋白质异二聚体的表达和纯化结果。
[0360]
由此获得的蛋白质异二聚体被命名为(从a至d组、h组、e组和j组分别为):il10
‑
fc9、(il10)2‑
fc9、反向
‑
(il10)2‑
fc9
‑
a、(il10)2‑
fc6、反向
‑
il10
‑
fc9、erb
‑
(il10)2和反
向
‑
(il10)2‑
fc9
‑
b,从f至g组和i组获得的蛋白质异二聚体分别被命名为(il10
‑
fc)2、(il10)2‑
fc和(fc
‑
il10)2。图1a至1e分别示出了il10
‑
fc9、(il10)2‑
fc9、反向
‑
(il10)2‑
fc9
‑
a和反向
‑
(il10)2‑
fc9
‑
b、(il10)2‑
fc6、反向
‑
il10
‑
fc9。
[0361]
作为示例,图2a至2f显示了本公开蛋白质异二聚体已成功表达和纯化。表6显示了反向
‑
(il10)2
‑
fc9
‑
b、(il10)2
‑
fc9、反向
‑
il10
‑
fc9和(fc
‑
il10)2的产率。
[0362]
在图2a中,泳道1装载erb
‑
(il10)2(还原的);泳道2装载标记;泳道3装载erb
‑
(il10)2(非还原的)。
[0363]
在图2b中,泳道1装载(il10
‑
fc)2(原始样本);泳道2装载(il10
‑
fc)2(流通);泳道3装载(il10
‑
fc)2(洗脱);泳道4装载标记;泳道5装载(il10)2‑
fc(洗脱);泳道6装载(il10)2‑
fc(原始样本);泳道7装载(il10)2‑
fc(流通);泳道8装载bsa;泳道9装载空白缓冲剂;泳道10为空白;泳道11装载(il10)2‑
fc(洗脱;还原的);泳道12装载(il10)2‑
fc(洗脱;非还原的)。
[0364]
在图2c中,泳道1装载(il10)2‑
fc9(原始样本);泳道2装载(il10)2‑
fc9(流通);泳道3装载(il10)2‑
fc9(洗脱);泳道4装载标记;泳道5装载bsa;泳道6装载空白缓冲剂;泳道7为空白;泳道8装载(il10)2‑
fc9(洗脱;非还原的)。
[0365]
在图2d中,泳道1装载反向
‑
(il10)2‑
fc9
‑
b(洗脱);泳道2装在反向
‑
il10
‑
fc9(洗脱);泳道3装载(il10)2‑
fc9(洗脱);泳道4装在(fc
‑
il10)2(洗脱);泳道5装载标记;泳道6为空白的;泳道7装载反向
‑
(il10)2‑
fc9
‑
b(洗脱;非还原的);泳道8装载反向
‑
il10
‑
fc9(洗脱;非还原的);泳道9装载(il10)2‑
fc9(洗脱;非还原的);泳道10装载(fc
‑
il10)2(洗脱;非还原的)。表6显示了(il10)2‑
fc9
‑
b、(il10)2‑
fc9、反向
‑
il10
‑
fc9和(fc
‑
il10)2的产率。
[0366]
图2e显示了sec
‑
hplc结果,可以看出非期望的寡聚物在(il10
‑
fc)2的表达产物中的百分比为约27%。
[0367]
图2f显示了sec
‑
hplc结果,可以看出非期望的寡聚物在(il10)2‑
fc9的表达产物中的百分比为约3.3%。
[0368]
图2g显示了sec
‑
hplc结果,可以看出非期望的寡聚物在(il10)2‑
fc的表达产物中的百分比为约26%。
[0369]
根据这些结果,可以看出已成功产生本公开的蛋白质异二聚体。有趣的是,与同二聚体对照(il10
‑
fc)2和(il10)2‑
fc相比,(il10)2‑
fc9的表达产物含有少得多的非期望的寡聚物。
[0370]
异二聚体蛋白名称理论分子量(kd)产率(μg/ml)反向
‑
(il10)2‑
fc9
‑
b9080(il10)2‑
fc99059.85反向
‑
il10
‑
fc970.5196(fc
‑
il10)29037.44
[0371]
表6异二聚体蛋白的产率
[0372]
实施例4异二聚体蛋白的特性的识别
[0373]
4.1与人il10r1蛋白的结合(elisa)
[0374]
用包被缓冲液(50mm na2co3,nahco
3 ph 9.6)将人il10r1(r&d,9100
‑
r1
‑
050)稀释成5μg/ml,每孔100微升,在4℃下过夜。洗涤后,在37℃下用3%bsa
‑
pbs密封培养板1小时。
然后,将本公开的异二聚体蛋白分别从2000ng/ml进行稀释且稀释2倍至总共11个浓度,其中稀释剂(1%bsa
‑
pbs)作为对照,在37℃下培育2小时。添加山羊抗higg
‑
hrp(sigma,a0170)并在37℃下培育1小时。添加可溶单组分tmb底物显影液,并在室温下于暗处进行显影5至10分钟。以450微升/孔添加2n h2so4,以终止显色反应。在md spectramax plus 384酶标仪上读取od
450nm
值,并将softmax pro v5.4用于数据处理和作图分析,其中结果显示于图3和表7中。
[0375]
异二聚体蛋白名称ec
50
(ng/ml)erb
‑
(il10)22.940反向
‑
(il10)2‑
fc9
‑
a12.31(il10)2‑
fc67.166(il10)2‑
fc99.683
[0376]
表7异二聚体蛋白与人il10r1蛋白结合的ec
50
[0377]
如图3中所示,erb
‑
(il10)2和hil10r1之间的亲和力最高。反向
‑
(il10)2‑
fc9
‑
a、(il10)2‑
fc6和(il10)2‑
fc9与hil10r1的结合亲和力彼此类似。
[0378]
4.2mc/9细胞增殖的增强
[0379]
以100微升/孔将mc/9(atcc crl
‑
8306)细胞接种到96孔板中。mv/9细胞的量为5
×
104/孔。重组人白介素
‑
10(hil10)从primegene(101
‑
10)获得。将所有样本(待测蛋白质)稀释到最大浓度,即2
×
104pm。然后,将样本稀释4倍至总共9个浓度,100微升/孔。对于对照组,添加100μl的dmem培养基。每个样本一式两份进行测试,然后在37℃和5%co2下培育2天。然后,丢弃140微升/孔的上清液,并添加60微升/孔的celltiter
‑
glo细胞活力分析剂(promega g7571)。用定轨摇床在暗处培育样本15分钟(100rpm)。然后,将100微升/孔上清液转移到新的96孔白色板中,用md spectra max plus 384酶标仪测量发光,其中结果显示于图4a至4c中。
[0380]
如图4a中所示,(il10)2‑
fc9和(il10)2‑
fc6对细胞增殖的影响类似。然而,反向
‑
(il10)2‑
fc9
‑
a展示出明显更好的活性。
[0381]
如图4b中所示,反向
‑
(il10)2‑
fc9
‑
a促进细胞增殖的活性明显高于(il10)2‑
fc9、hil10或(il10
‑
fc)2。
[0382]
如图4c中所示,测试了两个不同批次的反向
‑
(il10)2‑
fc9
‑
b,二者均显示出最高活性,这明显比(fc
‑
il10)2或反向
‑
il10
‑
fc9的更优。
[0383]
实施例5对tnf
‑
α分泌的抑制
[0384]
以100微升/孔将人单核细胞接种到96孔板中。将所有样本(待测蛋白质)稀释到最大浓度,即2
×
104pm。然后,将样本稀释4倍至总共9个浓度,100微升/孔。对于对照组,添加100μl的rpmi
‑
1640培养基。每种样本一式两份进行测试。然后在37℃和5%co2下培育样本2天。使用人tnf
‑
αelisa试剂盒(thermo,88
‑
7346
‑
88)根据制造商的说明测量tnf
‑
α在细胞培养上清液中的浓度。
[0385]
il10抑制了脂多糖介导的单核细胞的tnf
‑
α释放。如图5中所示,与(il10)2‑
fc9相比,反向
‑
(il10)2‑
fc9
‑
b在抑制tnf
‑
α分泌方面的生物活性更佳。
[0386]
实施例6 5肿瘤抑制
[0387]
6.1动物和细胞培养
[0388]
从中国科学院实验动物中心(中国上海)获得8周大的雌性c57bl/6小鼠并保持在特定无病原体条件下。根据当地伦理委员会使用所有动物。这项研究受到《医学实验动物的护理与使用指南》(中华人民共和国卫生部,1998)中的推荐规范的认可。内部产生b16f10黑色素瘤细胞系并在补充有10%(v/v)胎牛血清(fbs)、100单位/毫升青霉素和100μg/ml链霉素(gibco invitrogen)的dmem培养基中生长。
[0389]
6.2肿瘤生长
[0390]
将b16f10细胞(5
×
106)皮下(s.c.)接种到小鼠侧腹并让其生长约7天。肿瘤体积记录为两个垂直直径(长度和宽度)并计算为v=ab2/2,其中a和b分别为最长和最短直径。7天后,测量到肿瘤体积为大约70mm3。
[0391]
6.3治疗
[0392]
植入b16f10细胞7天后,分别以0.5mg/kg和2.5mg/kg的剂量腹膜内(i.p.)或瘤内(i.t.)注射(il10)2‑
fc9或同种型对照(higg)。每星期实施给药两次,共计3次。每星期测量肿瘤尺寸两次,并计算肿瘤的体积以获得肿瘤生长曲线。结果展示于图6a至6b中。在图6a中,横坐标为植入b16f10细胞后的天数,纵坐标为平均肿瘤体积,可以看出,(il10)2‑
fc9在腹膜内或瘤内施用时可以在体内有效减小肿瘤体积,而对照的同种型不能。图6b显示了用不同剂量的(il10)2‑
fc9治疗(i.p.和i.t.)第22天的肿瘤体积。重复测量肿瘤尺寸5次。可以看出,(il10)2‑
fc9在以不同剂量i.p.和i.t.施用时在体内减小了肿瘤体积。
[0393]
实施例7肿瘤抑制
[0394]
7.1(il10)2‑
fc9在肿瘤抑制中的作用
[0395]
在第0天用b16f10
‑
egfr5细胞对c57bl/6小鼠进行s.c.接种。将小鼠分为两组,每组5只小鼠:同种型对照组,其中用0.65mg/kg人igg1处理;(il10)2‑
fc9组,其中用0.65mg/kg(il10)2‑
fc9处理。分别在第7天、第10天和第14天i.p.注射(il10)2‑
fc9或人igg1。
[0396]
如图7a中所示,(il10)2‑
fc9在体内有效减小了肿瘤体积,而同种型对照不能。
[0397]
7.2(il10)2‑
fc9在肿瘤抑制中的作用
[0398]
在第0天用b16f10
‑
egfr5细胞对c57bl/6小鼠进行s.c.接种。将小鼠分为两组,每组5只小鼠:同种型对照组,其中用0.5mg/kg人igg1处理;(il10)2‑
fc9组,其中用0.13mg/kg(il10)2‑
fc9处理。分别在第7天、第10天和第14天i.p.注射(il10)2‑
fc9或人igg1。
[0399]
如图7b中所示,(il10)2‑
fc9在体内有效减小了肿瘤体积,甚至在低至0.13mg/kg的剂量下仍可以减小肿瘤体积,而同种型对照不能。
[0400]
实施例8肿瘤抑制
[0401]
8.1肿瘤生长
[0402]
在第0天用b16f10
‑
egfr5细胞对c57bl/6小鼠进行s.c.接种。将小鼠分成不同的组,每组5只小鼠:pbs对照组,其中小鼠用pbs处理;反向
‑
(il10)2‑
fc9
‑
b 2mg/kg组,其中小鼠用2mg/kg反向
‑
(il10)2‑
fc9
‑
b处理;反向
‑
(il10)2‑
fc9
‑
b 0.5mg/kg组,其中小鼠用0.5mg/kg反向
‑
(il10)2‑
fc9
‑
b处理;反向
‑
(il10)2‑
fc9
‑
b 0.2mg/kg组,其中小鼠用0.2mg/kg反向
‑
(il10)2‑
fc9
‑
b处理;(il10)2‑
fc9 2mg/kg组,其中小鼠用2mg/kg(il10)2‑
fc9处理;(il10)2‑
fc9 0.5mg/kg组,其中小鼠用0.5mg/kg(il10)2‑
fc9处理;(il10)2‑
fc9 0.2mg/kg组,其中小鼠用0.2mg/kg(il10)2‑
fc9处理。分别在第7天、第11天和第14天i.p.注射pbs、(il10)2‑
fc9或反向
‑
(il10)2‑
fc9
‑
b。28天后,记录无肿瘤小鼠的数量。样本的平均肿瘤体积
和肿瘤消除量如图8a和8b所示。
[0403]
如图8a中所示,虽然0.2mg/kg(il10)2‑
fc9显示出一定的肿瘤抑制活性,但0.2mg/kg反向
‑
(il10)2‑
fc9
‑
b的效果明显更好,与用2mg/kg反向
‑
(il10)2‑
fc9
‑
b所获得的类似。
[0404]
8.2响应率
[0405]
如图8b中所示,反向
‑
(il10)2‑
fc9
‑
b比(il10)2‑
fc9具有明显更高的肿瘤抑制活性。
[0406]
虽然本文已展示和描述本发明的优选实施例,但本领域的技术人员将显而易见,这些实施例仅仅通过示例的方式提供。本发明不受说明书中提供的具体实施例的限制。虽然已参考前述说明书对本发明进行描述,但本文中对实施例的描述和说明并非是限制性。本领域技术人员将会想到不脱离本发明的众多变化、改变和替换。此外,将理解,本发明的所有方面不限于本文中所述的具体叙述、配置或相对比例,这些取决于各种条件和变量。应理解,本文所描述的本发明实施例的各种替代方案可以用于实践本发明。因此,设想本发明应同样涵盖任何这类替代方案、修改、变化或等效物。随附权利要求书旨在限定本发明的范围,并且借此涵盖这些权利要求范围内的方法和结构及其等效物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1