利用热量涂覆假体的方法与流程
1.本发明涉及利用热量涂覆假体的方法,具体地,涉及在保留假体的物理特性的情况下只在表面利用热量涂覆生物相容性高分子的方法。
背景技术:
2.随着社会高度发展和老龄化,正在兴起用于提供能够向体内移植的人造组织及器官的研究。尽管如此,虽然多方致力于生物材料的开发,但仍处于能够使用的生物相容性(biocompatibility)材料不足的现状,现在使用的材料在很多情况下伴随着副作用。在向体内插入用在乳房增大/再造术的整形假体时发生的球形挛缩是具有代表性的副作用的例子。广泛用于乳房整形的假体表面由称为聚二甲基硅氧烷(polydimethylsiloxane,pdms)的材料形成,由于具有与实际的乳房组织不同的化学性质,接受乳房增大/再造术的患者中约有17.5%伴有纤维组织非正常地包裹假体周边的称为球形挛缩(或者包膜痉挛;capsular contracture)的副作用。当发生上述副作用时,除通过外科手术去除以外,没有特别的治疗方法,而且,在组织细胞严重地附着于假体表面的情况下,即使通过外科手术去除也不易完全去除,而且还可能伴有严重的后遗症。这样的副作用不仅给患者带来痛苦,还在精神/经济方面降低患者的生活质量,治疗及管理费用的增加导致巨大的费用支出,会带来社会性的经济损失。
3.如上所述,无论何种假体,一旦插入体内,就会因活体要将外部物质(foreign body)从组织中分离出去的防御机制而形成包膜(capsule),过度的包膜挛缩会通过身体反应使胶原纤维包膜(collagen-fiber capsule)肥厚而诱发疼痛并引起假体的变形。从外部插入的人工假体在体内被识别为外部物质而吸附体液内的各种蛋白质,通过后续的各种生化过程伴随血栓形成、免疫反应、组织变形、坏死和/或退化。因此,在假体表面涂覆生物相容性物质来预防被识别为外部物质可以说是完成包括减少包膜痉挛的生物相容性假体的重要因素。为了减少因假体在体内的过度异物反应引起的包膜痉挛,进行了改变插入位置,或者使用抗生素洗涤,或者使用类固醇,或者将假体表面加工为质地不平(textured)等多种尝试,但至今没有能够从根本上防止将假体识别为异物的机制的方法。
4.用作用于插入体内的假体的代表性表面材料的基于聚二甲基硅氧烷的物质因其高度的透氧性、优秀的机械物性、光学透明度、自密封性(self-sealing)、便利的加工性及化学稳定性而应用于眼科生物材料、微流体器材、人造肺及人造手指关节之类的多种医疗器材。然而,因pdms的内在疏水性及活体附着倾向,例如对物质的非特异性蛋白质吸附引起血栓形成、异物反应、细菌感染及其他不期望出现的反应,因此大大制约了将pdms用作活体材料,需要能够对pdms的表面特性进行改质的方法。
5.仿生合成磷脂聚合物(biomimetic synthetic phospholipid polymer),尤其是作为2-甲基丙烯酰氧乙基磷酸胆碱(mpc,2-methaacryloyloxyethyl phosphorylcholine)的聚合物的pmpc((聚(甲基丙烯酰氧乙基磷酸胆碱)(poly(methacryloyloxyethyl phosphorylcholine)))具有与作为构成人体的生物膜的磷脂之一的磷脂酰胆碱
(phosphatidyl choline)的头部(head)部分相似的结构,表现出生物相容性、防止血栓形成等的血液相容性(hemocompatibility)及防止蛋白质或细胞吸附等效果,因此将其作为药物传递、组织工程学及其他多种活体物质的表面物质进行研究。
6.近来,正在进行利用紫外光(uv)将仿生高分子聚合后涂覆于假体的方法(goda,t.et al.,biomaterials;2006;vol.27)的研究,在照射紫外光来聚合高分子的方式受限于材料的透明性或者光直接照射的部分,具有在具有复杂的三维结构的材料中难以使用光照射的问题。
7.在这样的背景下,本发明人为了与材料外形无关地在表面有效导入坚固的高分子而多次研究努力的结果,确认到在利用能够三维地均匀应用热量的情况下,可以有效导入生物相容性高分子,可以克服照射光的空间限制,可以大量涂覆并且可以有用地用于制备涂覆的假体,从而完成本发明。
技术实现要素:
8.本发明一个目的在于提供涂覆假体的方法,包括:在假体吸附热引发剂的步骤;以及向吸附有热引发剂的假体中加入包含具有丙烯酸酯基团的两性离子单体及交联剂的溶液后加热的步骤。
9.作为用于实现上述目的一个实施方式,本发明提供涂覆假体的方法,包括:在假体吸附热引发剂的步骤;以及向吸附有热引发剂的假体中加入包含具有丙烯酸酯基团的两性离子单体及交联剂的溶液后加热的步骤。
10.在使用现有的向光引发剂照射紫外光的方法来涂覆假体的情况下,具有材料的三维形态受到很多影响的问题。相反,在利用热量来涂覆的本发明的情况下,与利用光涂覆的情况相比具有如下特征,即,在具有相似的抑制包膜挛缩的效果的同时,可以有效地向带有多种三维形态的材料表面导入生物相容性高分子,从而可以克服光照射的空间限制。
11.在本发明一具体实施例中,确认到使用利用光交联的pmpc涂覆的试片只在被光直接照射的试片的上面导入亲水性而显著减少水接触角,相反,在未被光直接照射的下面的水接触角不如上面减少的程度。相反,确认到使用利用热量交联的pmpc涂覆的试片的上面和下面的水接触角都均匀地减少了(图2)。由此可知,热处理的情况可以克服光照射时的空间限制,可以不受三维形态的限制并有效导入涂覆。
12.在本发明一具体实施例中,确认到使用利用光交联的pmpc涂覆的试片的表面只在最深35nm至40nm的深度检测到氮和磷,而在使用利用热量交联的pmpc涂覆的试片的表面则在最深75nm至85nm的深度检测到氮和磷,而且在更深的深度也可能检测到(图4)。由此可知,与利用光交联的pmpc涂覆的情况相比,利用热量交联的pmpc涂覆可以导入更厚的涂覆层。
13.本发明的涂覆假体的方法包括在假体吸附热引发剂的步骤。在如上所述的在假体表面物理性地吸附热引发剂的情况下,比单纯地在聚合溶液中包含引发剂并加热的情况更加促进假体表面上的聚合。
14.本发明的术语“热引发剂(thermalinitiator)”是指受热后能够生成自由基的物质。因此,可以通过加热上述热引发剂形成自由基来诱发自由基聚合反应(radical polymerization)。上述自由基聚合反应为通过连续添加自由基来形成高分子的方法,上述
自由基通常可以由单独的引发剂分子通过多种机制形成。
15.一旦反应开始,形成的自由基从包含双键的高分子单体利用一个π键电子形成稳定的单键,上述双键在转换为单键的过程中形成不与自由基结合的包含其他碳原子的冗余电子的新的自由基。可以通过上述形成的新的自由基反复上述过程来使高分子链生长。
16.在本发明中,上述热引发剂可以为选自由过氧化苯甲酰(benzoyl peroxide,bpo)、过氧化双十二酰(lauroyl peroxide)、叔丁基过氧化氢(tert-butyl hydroperoxide)、异丙苯过氧化氢(cumene hydroperoxide,chp)、二叔丁基过氧化物(di-tert-butyl peroxide,dtbp)、过氧化二异丙苯(dicumyl peroxide,dcp)、偶氮二异丁腈(azobisisobutyronitrile,aibn)、过硫酸钾(potassium persulfate,kps)、过硫酸铵(ammonium persulfate,aps)、va-044、v-50、va-057、va-061、va-086、v-501、v-70、v-65、v-601、v-59、v-40及vam-110组成的组中的一种,具体地,可以为过氧化苯甲酰,但不限定于此。
17.在本发明中,相对于具有丙烯酸酯基团的两性离子单体,可以使用10摩尔百分比至50摩尔百分比的上述热引发剂,具体地,可以使用15摩尔百分比至50摩尔百分比、20摩尔百分比至50摩尔百分比、30摩尔百分比至45摩尔百分比、35摩尔百分比至45摩尔百分比、38摩尔百分比至42摩尔百分比,更具体地,可以使用40摩尔百分比,但不限定于此。
18.若热引发剂的使用量低于上述范围的下限,即,小于10摩尔百分比,则表面生成的高分子的量,例如高分子链的数量和/或各高分子链的长度(分子量)显著减少,可能无法充分覆盖假体的表面。另一方面,若热引发剂的使用量高于上述范围的上限,即,大于50摩尔百分比,则引起不必要的试样的浪费。
19.本发明的术语“假体”也称为“用于插入体内的假体”,是指以重建或替代损伤或缺损的活体组织、用于美容的整形或者治疗的用途插入体内的结构物,具体地,可以为用于隆胸或重建乳房的假体,但不限定于此。并且,上述假体可以为固体形态的结构物或者具有流动性的密封的带状形态结构物的形态,但不限定于此。
20.本发明的涂覆是通过具有丙烯酸酯基团的两性离子单体的丙烯酸酯基团与假体外部表面的共价键形成的,可以利用本发明的涂覆方法涂覆的假体可以为包含能够提供能够通过热引发剂与包含上述丙烯酸酯的c=c键的末端形成键的自由基的官能团的物质,以使作为聚合溶液的一种成分的具有丙烯酸酯基团的两性离子单体通过包含丙烯酸酯基团的c=c键的末端与假体的外部表面形成共价键。可以不受限制地使用除金属或者亲水性乙烯类材料以外的本发明所属技术领域公知的材料。
21.在本发明中,上述假体可以具有选自由聚二甲基硅氧烷类、羟基磷灰石(hydroxyapatite,ha)、聚乳酸类(polylactic acid,pla)、聚乙醇酸类(polyglycolic acid,pga)、聚四氟乙烯类(polytetrafluoroethylene,ptfe)、聚对苯二甲酸乙二醇酯类(polyethylene terephthalate;pet)、聚丙烯类(polypropylene)、聚酰胺类(polyamides)、聚缩醛类(polyacetal)、聚酯纤维(polyester)或者聚甲基丙烯酸甲酯类(polymethyl metacrylate)组成的组中的一种表面材料,具体地,可以具有聚二甲基硅氧烷类表面材料,但不限定于此。
22.本发明的涂覆方法包括向吸附有热引发剂的假体中加入包含具有丙烯酸酯基团的两性离子单体及交联剂的溶液后加热的步骤。与照射光来聚合的情况相比,上述加热聚
合的情况可以在三维材料表面有效导入生物相容性高分子,可以克服光照射时的空间限制而大量涂覆。
23.上述包含具有丙烯酸酯基团的两性离子单体及交联剂的溶液也称为聚合溶液。
24.本发明的术语“具有丙烯酸酯基团的两性离子单体”是指在一个分子内显出阳离子和阴离子共存的两性离子特性的丙烯酸酯类单体。显出两性离子特性的物质通过阳离子、阴离子电荷与水分子形成很强的氢键,因此可以在周围形成水化层,因此可以有效防止非特异性的蛋白质或细胞的粘附。通过上述两性物质的非特异性吸附的抑制可以减少假体插入体内时发生的一系列的血栓形成、免疫反应、组织病变、纤维囊形成等。
25.在本发明中,上述具有丙烯酸酯基团的两性离子单体不限定于具体的化学式,可以不受限制地为包含选自由包含以任意形态连接的磷和氮的磷酸胆碱(phosphorylcholine,pc)、包含硫和氮的硫代甜菜碱(sulfobetaine,sb)及包含碳和氮的羧基甜菜碱(carboxybetaine,cb)组成的组中的一种以上的丙烯酸酯类单体。具体地,可以为选自由甲基丙烯酰氧乙基磷酸胆碱(methacryloyloxyethyl phosphorylcholine,mpc)或丙烯酰氧乙基磷酸胆碱(acryloyloxyethyl phosphorylcholine,apc)、硫代甜菜碱甲基丙烯酸酯(sulfobetaine methacrylate)、硫代甜菜碱丙烯酸酯(sulfobetaine acrylate)、羧基甜菜碱甲基丙烯酸酯(carboxybetaine methacrylate)及羧基甜菜碱丙烯酸酯(carboxybetaine acrylate)组成的组中的一种以上,具体地,可以为甲基丙烯酰氧乙基磷酸胆碱但不限定于此。
26.在本发明中,上述交联剂可以为选自由二季戊四醇五丙烯酸酯、二季戊四醇六丙烯酸酯、乙二醇二丙烯酸酯、乙二醇二甲基丙烯酸酯、甲基丙烯酸烯丙酯、乙酰乙酸甲基丙烯酸乙二醇酯、甲基丙烯酸异氰基乙酯、甲基丙烯酸异丁酯、甲基丙烯酸正丁酯及它们的组合组成的组中的一种,具体地,可以为二季戊四醇五丙烯酸酯或者二季戊四醇六丙烯酸酯,但不限定于此。
27.在本发明中,相对于包含丙烯酸酯基团的磷酸胆碱单体,可以使用0.01摩尔百分比至2.0摩尔百分比的上述交联剂,具体地,可以使用0.01摩尔百分比至2.0摩尔百分比、0.1摩尔百分比至1.8摩尔百分比、0.5摩尔百分比至1.5摩尔百分比、0.8摩尔百分比至1.2摩尔百分比、0.9摩尔百分比至1.1摩尔百分比,更具体地,可以使用1.0摩尔百分比,但不限定于此。
28.若交联剂的使用量低于上述范围的下限,即,小于0.01摩尔百分比,则会因无法进行充分的交联键合而无法显出所需的物性或者无法获得所需的涂覆强度,可能在洗涤过程中脱离。另一方面,若交联剂的使用量高于上述范围的上限,即,大于2.0摩尔百分比,则会因过度的交联键合使假体不具有所需的弹性而过度硬化,还会引起式样不必要的浪费。
29.在本发明中,加热可以不受限制地使用本发明所属技术领域公知的方法,具体地,可以利用预热的油浴(oil bath)来加热,但不限定于此。
30.在本发明中,加热的温度可以根据假体的种类、对热量的敏感度等的不同而不同,对此,普通技术人员可以适当选择。并且,加热的时间可以因加热假体的温度的不同而不同,对此,普通技术人员可以适当选择。
31.具体地,上述加热可以在60℃至100℃的温度下进行,具体地,可以在60℃至95℃、65℃至90℃、65℃至85℃、65℃至75℃、68℃至73℃、69℃至71℃、65℃至99℃、70℃至98℃、
75℃至97℃、80℃至96℃、85℃至95℃、90℃至94℃、91℃至93℃、65℃至95℃、70℃至92℃的温度下进行,更具体地,可以在70℃或者92℃的温度下进行,但不限定于此。
32.具体地,上述加热可以进行1小时至18小时,具体地,可以进行1小时至17小时、1小时至16小时、1小时至15小时、1小时至12小时、1小时至10小时、1小时至8小时、1小时至5小时、1小时至3小时、3小时至17小时、5小时至17小时、8小时至17小时、10小时至17小时、12小时至17小时、15小时至17小时,更具体地,可以进行1.5小时或者16小时,但不限定于此。
33.更具体地,本发明的在假体吸附热引发剂的步骤可以包括:将假体浸渍于包含热引发剂与交联剂的引发剂溶液中的步骤;以及干燥的步骤。
34.本发明的向吸附有热引发剂的假体中加入包含具有丙烯酸酯基团的两性离子单体及交联剂的溶液后加热的步骤可以包括:将吸附有热引发剂的假体浸渍于包含具有丙烯酸酯基团的磷酸胆碱单体及交联剂的溶液中的步骤;以及加热的步骤。
35.本发明的利用热量涂覆假体的方法可以在三维材料表面有效导入生物相容性高分子,可以克服照射光的空间限制,可以大量涂覆并且可以有用地用于制备由生物相容性高分子涂覆的假体。
附图说明
36.图1为示出未使用交联的pmpc涂覆的试片(noncoated)、使用利用光交联的pmpc涂覆的试片(uv coated)及使用利用热量交联的pmpc涂覆的试片(heat coated)表面的水接触角的图。
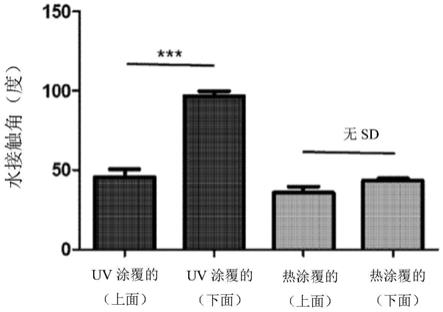
37.图2为示出利用光涂覆pmpc的试片(uv coated)及利用热量涂覆pmpc的试片(heat coated)的上面和下面表面的水接触角的图。
38.图3为示出未使用交联的pmpc涂覆的试片、使用利用光交联的pmpc涂覆的试片及使用利用热量交联的pmpc涂覆的试片表面的表面元素分析结果的图。
39.图4为示出未使用交联的pmpc涂覆的试片、使用利用光交联的pmpc涂覆的试片及使用利用热量交联的pmpc涂覆的试片中随着深度分析表面元素的结果的图。
40.图5为示出未使用交联的pmpc涂覆的假体、使用利用光交联的pmpc涂覆的假体及使用利用热量交联的pmpc涂覆的假体的抗压力变化的图。
41.图6为示出未使用交联的pmpc涂覆的试片、使用利用光交联的pmpc涂覆的试片及使用利用热量交联的pmpc涂覆的试片表面的牛血清白蛋白(bsa)吸附的图。
42.图7为示出未使用交联的pmpc涂覆的试片、使用利用光交联的pmpc涂覆的试片及使用利用热量交联的pmpc涂覆的试片表面的牛血浆纤维蛋白原(bpf)吸附的图。
43.图8为示出未使用交联的pmpc涂覆的试片、使用利用光交联的pmpc涂覆的试片及使用利用热量交联的pmpc涂覆的试片表面的成纤维细胞粘附的图。
44.图9为示出将未使用交联的pmpc涂覆的假体及使用利用热量交联的pmpc涂覆的假体插入猪体内2个月后表面的包膜厚度的图。
45.图10为示出将未使用交联的pmpc涂覆的假体及使用利用热量交联的pmpc涂覆的假体插入猪体内2个月后的细胞性(cellularity)及血管分布程度(vascularity)的图。.
46.图11为示出将未使用交联的pmpc涂覆的假体及使用利用热量交联的pmpc涂覆的假体插入猪体内2个月后的炎症相关因子的表达程度的图。
47.图12为示出将未使用交联的pmpc涂覆的假体及使用利用热量交联的pmpc涂覆的假体插入猪体内6个月后表面的包膜厚度的图。
48.图13为示出将未使用交联的pmpc涂覆的假体及使用利用热量交联的pmpc涂覆的假体插入猪体内6个月后的细胞性及血管分布程度的图。
49.图14为示出将未使用交联的pmpc涂覆的假体及使用利用热量交联的pmpc涂覆的假体插入猪体内6个月后的炎症相关因子的表达程度的图。
具体实施方式
50.以下,通过下述实施例更详细地说明本发明。但下述实施例仅用于例示本发明,本发明的范围并不限定于这些实施例。
51.实施例1.制备涂覆的假体
52.实施例1-1.制备利用光涂覆的假体(比较例)
53.将用作光引发剂的0.055m的二苯甲酮(benzophenone)及用作交联剂的2.5mm的二季戊四醇五(或六)丙烯酸酯(dipentaerythritol penta(or hexa)acrylate)溶解于丙酮(acetone)或乙醇(ethanol)溶剂来制备引发剂溶液。然后,将硅凝胶乳房假体(mentor公司,125cc)浸渍于上述引发剂溶液1分钟使其充分浸泡后干燥。将作为交联剂的5.0mm的乙二醇二甲基丙烯酸酯(ethylene glycol dimethacrylate,egdma)及作为单体的0.25m的甲基丙烯酰氧乙基磷酸胆碱溶解于蒸馏水来制备聚合溶液。将吸附有引发剂的假体浸渍于上述聚合溶液后,在距离18.4cm处照射紫外光10分钟以使假体可以通过自由基聚合反应被涂覆。为了将上述涂覆的假体用于随后的分析,使用超声波进行为时10分钟的一次处理来去除冗余的反应物。相比于通常使用的洗涤方法,上述利用超声波洗涤的方法为较为强力的方法,是为了模拟移植到体内后因活动等原因而使涂层脱离的情况而使用这种较为强力的洗涤方法的。
54.实施例1-2.制备利用热量涂覆的假体
55.将作为热引发剂的0.1m的过氧化苯甲酰及作为交联剂的以mpc为基准的0.5摩尔百分比的二季戊四醇五(或六)丙烯酸酯溶解于1∶1比例的甲基纤维素(mc)及丙酮混合溶剂来制备引发剂溶液。然后,将硅凝胶乳房假体(mentor公司,125cc)浸渍于上述引发剂溶液1分钟使其充分浸泡后干燥。将作为交联剂的以mpc为基准的1摩尔百分比的二季戊四醇五(或六)丙烯酸酯及作为单体的0.25m的甲基丙烯酰氧乙基磷酸胆碱溶解于蒸馏水来制备聚合溶液。将吸附有引发剂的假体浸渍于上述聚合溶液使其充分浸泡后,利用预热的油浴以92℃的温度加热90分钟或者以70℃的温度加热16小时,以使假体通过自由基聚合反应被涂覆。为了将上述涂覆的假体用于随后的分析,使用超声波进行为时10分钟的一次处理来去除冗余的反应物。相比于通常使用的洗涤方法,上述利用超声波洗涤的方法为较为强力的方法,是为了模拟移植到体内后因活动等原因而使涂层脱离的情况而使用这种较为强力的洗涤方法的。
56.实施例2.分析涂覆的表面性质
57.为了分析假体的被涂覆的表面性质,将由具有与假体的表面相同的化学结构的聚二甲基硅氧烷(polydimethylsiloxane,pdms)构成的184硅试片(dow corning公司)硬化后准备为15mm直径的试片,以与实施例1相同的方法涂覆。
58.实施例2-1.分析涂覆的表面的水接触角变化
59.通过测量水接触角来确认未使用交联的pmpc涂覆的试片(noncoated)、使用利用光交联的pmpc涂覆的试片(uv coated)及使用利用热量交联的pmpc涂覆的试片(heat coated)表面的亲水性变化。
60.具体地,利用动态水接触角测量法(dynamic water contact angle measurement)中的气泡捕获法(captive drop method)测量前进接触角(advancing contact angle)及后退接触角(receding contact angle)。前进接触角是通过测量利用针将表面上的去离子水的量从0μl增加至6μl时表面与水珠形成的角获得的,后退接触角是通过测量表面上的去离子水的量从6μl减少至3μl时表面与水珠形成的角获得的。上述前进接触角为较好显现表面的疏水性的数值,而后退接触角为较好显现表面的亲水性的数值,在本发明中,通过前进接触角和后退接触角的变化来获得有关表面的亲水性的信息。从获得的信息中确定的水接触角如图1所示。
61.如图1所示,确认到用作阴性对照组的未涂覆的试片带有很高很强的疏水性,在前进接触角和后退接触角中都显出很高的水接触角,而与未涂覆的试片相比,使用利用光交联的pmpc涂覆的试片或者使用利用热量交联的pmpc涂覆的试片的水接触角显著减少。即,可知通过交联的pmpc涂覆的表面带有亲水性,并且可知,利用热量涂覆的试片的表面得到与利用光涂覆的试片相似程度的改性。
62.实施例2-2.分析涂覆的表面上/下的水接触角
63.通过水接触角确认使用利用光交联的pmpc涂覆的试片(uv coated)及使用利用热量交联的pmpc涂覆的试片(heat coated)根据三维形态的涂覆效果的不同。
64.如图2所示,由于使用利用光交联的pmpc涂覆的试片受到被涂覆的物质的空间形态的制约,因此只在被光直接照射的试片的上面导入亲水性,因此水接触角显著减少,相反,未被光直接照射的下面的水接触角没有如上面一样减少。相反,使用利用热量交联的pmpc涂覆的试片的上面和下面的水接触角均匀减少,这表现出进行热处理的情况可以克服光照射时的空间限制,可以不受三维形态的限制而有效地导入涂覆。
65.实施例2-3.分析涂覆的表面的元素
66.为了确认通过实施例2-1确认到水接触角的变化,即,为了确认亲水性程度的变化是由磷酸胆碱基团的导入引起的,实施利用x射线光电子能谱分析(xps)的表面元素分析,其结果如图3所示。
67.如图3所示,相比于未涂覆的试片,使用利用光交联的pmpc涂覆的试片或者使用利用热量交联的pmpc涂覆的试片的表面保持了相同水平的氧含量,但碳和/或硅的比例显著减少。具体地,在碳峰值中,有关亚甲基和/或甲基的峰值大大减少,另外,开始形成有关-c-o-键及-c=o键的峰值。进而,在未涂覆的pdms中未检测出的氮及磷的含量大大增加。将此与通过实施例3-1确认的水接触角的变化分析结果相联系来看,与上述水接触角的减少一致,即,亲水性的增加与表面表现出电负性相对高的氧、氮和/或磷的含量增加相一致。这也表明包含这些元素的磷酸胆碱基团含量的增加。
68.同时,上述结果也表明根据本发明方法的交联的pmpc的涂覆在强刺激下也不易受损。
69.并且,如图4所示,在各表面中根据深度进行元素分析时,使用利用光交联的pmpc
涂覆的试片的表面仅至35nm至40nm的深度检测出氮和磷,而使用利用热量交联的pmpc涂覆的试片的表面至75nm至85nm的深度仍检测出氮和磷,在该深度以上的深度中仍有可能检测出氮和磷。这表明相比于使用利用光交联的pmpc涂覆的情况,使用利用热量交联的pmpc涂覆的情况可以导入更厚的涂覆层。
70.实施例3.分析涂覆的假体的抗压力变化
71.通过万能材料测试仪确认未使用交联的pmpc涂覆的假体(noncoated)、使用利用光交联的pmpc涂覆的假体(uv coated)及使用利用热量交联的pmpc涂覆的假体(heat coated)的机械强度的变化。利用5kn的负荷传感器(load cell)测量以5mm/min的速度从上压假体时产生的荷重。
72.如图5所示,所测量的使用利用光交联的pmpc涂覆的假体或使用利用热量交联的pmpc涂覆的假体的荷重值与未使用交联的pmpc涂覆的假体的荷重值相似。这表明即使使用交联的pmpc涂覆,仍可保持假体的物理、机械特性。
73.实施例4.分析防止蛋白质吸附的特性
74.通过bca蛋白浓度检测确认未使用交联的pmpc涂覆的试片(noncoated)、使用利用光交联的pmpc涂覆的试片(uv coated)及使用利用热量交联的pmpc涂覆的试片(heat coated)表面的防止蛋白质吸附的特性。使用牛血清白蛋白(bsa,bovine serum albumin)和牛血浆纤维蛋白原(bpf,bovine plasma fibrinogen)作为上述蛋白质。分别将未涂覆的试片、利用光涂覆的试片及利用热量涂覆的试片在4.5mg/ml浓度的牛血清白蛋白或0.3mg/ml浓度的牛血浆纤维蛋白原以37℃的条件培养1小时后,在各个条件下使用干净的杜氏磷酸盐缓冲溶液(dpbs)将pdms在37℃的温度下以200rpm的转速处理1分钟共处理2次后,轻柔地洗涤。然后,进行bca蛋白浓度检测来定量吸附于表面的蛋白质的量。具体地,使用thermo scientific公司的bca试剂盒,以25∶24∶1的体积比混合试剂盒中包含的试样a、试样b及试样c来制备检测溶液。将上述洗涤的各pdms装入新鲜的杜氏磷酸盐缓冲溶液,加入与缓冲溶液等量的检测溶液在60℃的温度下培养1小时后,在570nm的波长下测定吸光度来测定吸附于表面的蛋白质的量。其结果如图6和图7所示。
75.如图6和图7所示,与未涂覆的试片的表面相比,在使用利用光交联的pmpc涂覆的试片或者使用利用热量交联的pmpc涂覆的试片的表面上的牛血清白蛋白的吸附量减少,与未涂覆的试片的表面相比,在使用利用光交联的pmpc涂覆的试片或者使用利用热量交联的pmpc涂覆的试片的表面上的牛血浆纤维蛋白原吸附量减少。即,与未涂覆的试片的表面相比,在使用利用光交联的pmpc涂覆的试片或者使用利用热量交联的pmpc涂覆的试片的表面上的牛血清白蛋白和牛血浆纤维蛋白原的吸附量均显著减少。
76.实施例5.分析防止细胞吸附的特性
77.着眼于包膜挛缩与成纤维细胞过度增殖及因其形成胶原蛋白等现象密切相关,在未使用交联的pmpc涂覆的试片(noncoated)、使用利用光交联的pmpc涂覆的试片(uv coated)及使用利用热量交联的pmpc涂覆的试片(heat coated)培养作为成纤维细胞的nih-3t3细胞来确认细胞吸附程度。在含有5%的二氧化碳、37℃的环境下在包含10%的胎牛血清(fbs)的杜氏改良伊戈尔培养基(dmem)中培养上述nih-3t3细胞。在各个1.5cm直径的pdms上分株30000个细胞,在含有5%的二氧化碳、37℃的环境下培养40小时后,使用新鲜的杜氏改良伊戈尔培养基(包含10%的胎牛血清)轻轻洗涤后,进行细胞计数试剂盒(cck)
检测。细胞计数试剂盒溶液使用了日本同仁(dojindo)的产品,将洗涤的各个pdms放入新鲜的杜氏改良伊戈尔培养基(包含10%的胎牛血清),放入相当于培养基体积的10%的量的细胞计数试剂盒溶液后,在含有5%的二氧化碳、37℃的环境下培养4小时,在450nm的波长下测定吸光度来测定吸附于表面的细胞的相对的量,其结果如图8所示。
78.如图8所示,确认到与未涂覆的试片表面相比,在使用利用光交联的pmpc涂覆的试片或者使用利用热量交联的pmpc涂覆的试片表面中成纤维细胞的表面吸附显著减少。
79.实施例6.分析体内反应(2个月大动物实验)
80.将未使用交联的pmpc涂覆的假体(noncoated)和使用利用热量交联的pmpc涂覆的假体(heat coated)按照组别各准备4个,用乙醇消毒后插入猪的皮下肌肉层(panniculus carnosus muscle)下方。8周(2个月)后采取在插入的假体周围形成的包膜进行组织病理学观察。
81.实施例6-1.分析抑制体内包膜挛缩的活性
82.为了确认抑制体内包膜挛缩的活性,采取插入的假体上部和下部的包膜后,进行苏木精伊红(h&e,hematoxylin and eosin stain)染色后使用显微镜观察包膜的厚度。包膜的厚度是通过将各个包膜分为三部分后每部分测量3次的方式测量的,其结果如图9所示。
83.如图9所示,确认到在使用利用热量交联的pmpc涂覆的假体表面形成的包膜的平均厚度比在未涂覆的假体表面形成的包膜的平均厚度减少了。
84.实施例6-2.检测分析细胞性(cellularity)及血管分布程度(vascularity)
85.细胞性是采取假体周边组织进行苏木精伊红染色后合计淋巴细胞(lymphocytes)、浆细胞(plasma cells)、巨噬细胞(macrophages)、巨细胞(giant cells)等炎症相关细胞的不同分数(score)来检测的,血管分布程度是通过免疫组织化学(ihc,immunohistochemistry)染色后测定作为血管新生指标的cd34来测定血管数量的,其结果如图10所示。
86.如图10所示,确认到观察到相似的细胞性,而在使用利用热量交联的pmpc涂覆的假体中观察到比未涂覆的假体更低的血管分布程度。
87.实施例6-3.分析抑制炎症相关因子的活性
88.通过免疫组织化学染色检测作为炎症相关细胞因子的转化生长因子-β(tgf-β,transforming growth factor beta)、作为存在于骨髓细胞的颗粒中的酶的髓过氧化物酶(mpo,myeloperoxidase)及作为肌成纤维细胞的标记的α-平滑肌肌动蛋白(α-sma,alpha smooth muscle actin)的表达程度,其结果如图11所示。
89.如图11所示,确认观察到使用利用热量交联的pmpc涂覆的假体比未涂覆的假体表现出更低或相似的髓过氧化物酶、转化生长因子-β和α-平滑肌肌动蛋白的表达。
90.实施例7.分析体内反应(6个月大动物实验)
91.与实施例6相同地,将未使用交联的pmpc涂覆的假体(noncoated)和使用利用热量交联的pmpc涂覆的假体(heat coated)按照组别各准备4个,用乙醇消毒后插入猪的皮下肌肉层下方。24周(6个月)后采取在插入的假体周围形成的包膜进行组织病理学观察。
92.实施例7-1.分析抑制体内包膜挛缩的活性
93.为了确认抑制体内包膜挛缩的活性,采取插入的假体上部和下部的包膜后,进行
苏木精伊红染色后使用显微镜观察包膜的厚度。包膜的厚度是通过将各个包膜分为三部分后每部分测量3次的方式测量的,其结果如图12所示。
94.如图12所示,确认到在使用利用热量交联的pmpc涂覆的假体表面形成的包膜的平均厚度比在未涂覆的假体表面形成的包膜的平均厚度减少了。
95.实施例7-2.检测分析细胞性及血管分布程度
96.细胞性是采取假体周边组织进行苏木精伊红染色后合计淋巴细胞、浆细胞、巨噬细胞、巨细胞等炎症相关细胞的不同分数来检测的,血管分布程度是通过免疫组织化学染色后测定作为血管新生指标的cd34来测定血管数量的,其结果如图13所示。
97.如图13所示,确认到与8周(2个月)时测定的值相比,两个组的细胞性都减少了,而血管分股程度与8周(2个月)相比都增加了。
98.实施例7-3.分析抑制炎症相关因子的活性
99.通过免疫组织化学染色检测作为炎症相关细胞因子的转化生长因子-β、作为存在于骨髓细胞的颗粒中的酶的髓过氧化物酶及作为肌成纤维细胞的标记的α-平滑肌肌动蛋白的表达程度,其结果如图14所示。
100.如图14所示,在使用利用热量交联的pmpc涂覆的假体的情况下,与未涂覆的假体相比,作为炎症数值的指标值的髓过氧化物酶、作为炎症反应及纤维组织形成的尺度的转化生长因子-β和α-平滑肌肌动蛋白的表达都表现出显著降低的值。这与根据使用利用热量交联的pmpc涂覆的假体与未涂覆的假体相比时炎症反应减少的形成纤维组织的细胞因子的表达减少而形成薄的包膜厚度的结果相一致。
101.通过以上说明可以理解的是,本发明所属技术领域的普通技术人员本发明可以在不变更技术思想或必需特征的情况下实施为其他具体形式。与此相关地,应该理解的是,以上描述的实施例仅用于全面例示本发明,而非用于限制本发明。比起上述的详细说明,本发明的范围应解释为包括随附的发明要求保护范围的含义及范围还有由其等价概念导出的所有变更或变形的形式。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1