包含microRNA适应的shRNA(shRNAmiR)的遗传修饰的免疫细胞的制作方法
包含microrna适应的shrna(shrnamir)的遗传修饰的免疫细胞
技术领域
1.本发明涉及肿瘤学、癌症免疫治疗、分子生物学和重组核酸技术领域。特别地,本发明涉及遗传修饰的免疫细胞,其包含能够稳定敲低特定靶基因的microrna适应的shrna(shrnamir)分子。本发明还涉及此类遗传修饰的免疫细胞用于在受试者中降低内源性蛋白的表达和治疗疾病(包括癌症)的用途。
2.引用通过efs-web作为本文文件提交的序列表
3.本技术包含已通过efs-web以ascii格式提交且在此通过引用整体并入的序列表。在2020年4月3日创建的所述ascii副本被命名为pbio-037wo_seq_list_4-20,并且大小为58,911字节。
背景技术:
4.t细胞过继免疫治疗是用于癌症治疗的有前景的方法。本文公开的免疫疗法治疗方法利用经遗传修饰的分离的人t细胞以增强其对特定肿瘤相关抗原的特异性。遗传修饰可能涉及嵌合抗原受体或外源性t细胞受体的表达,以将抗原特异性移植到t细胞上。与外源性t细胞受体相比,嵌合抗原受体的特异性来源于单克隆抗体的可变结构域。因此,表达嵌合抗原受体的t细胞(car t细胞)以主要组织相容性复合体非限制的方式诱导肿瘤免疫反应性。t细胞过继免疫疗法已被用作许多癌症的临床疗法,包括b细胞恶性肿瘤(例如,急性淋巴母细胞白血病、b细胞非霍奇金淋巴瘤、急性髓性白血病和慢性淋巴细胞白血病)、多发性骨髓瘤、神经母细胞瘤、胶质母细胞瘤、晚期神经胶质瘤、卵巢癌、间皮瘤、黑色素瘤、前列腺癌和胰腺癌等。
5.尽管其具有作为癌症治疗的潜在有用性,但是用car t细胞的过继免疫疗法部分受到细胞表面上内源性t细胞受体的表达的限制。表达内源性t细胞受体的car t细胞在施用于同种异体患者后可识别主要和次要组织相容性抗原,这可以导致移植物抗宿主病(gvhd)的发展。因此,临床试验已主要集中在使用自体car t细胞,其中分离患者的t细胞,进行遗传修饰以并入嵌合抗原受体,然后重新输注至同一患者体内。自体方法提供对施用的car t细胞的免疫耐受性;然而,这种方法受到在患者已诊断为癌症之后产生患者特异性car t细胞所需的时间和费用两者的限制。
6.因此,开发使用来自第三方健康供体的t细胞制备的具有降低的内源性t细胞受体(例如,α/βt细胞受体)表达或不具有可检测的细胞表面表达且在施用后不引发gvhd的“现成的(off the shelf)”car t细胞将是有利的。这样的产品可以在诊断之前产生和验证,并且可以在一旦必要时可用于患者。因此,需要开发缺乏内源性t细胞受体以防止gvhd的发生的同种异体car t细胞。
7.为此,为了完全敲除β-2微球蛋白(b2m)蛋白表达,产生了对β-2微球蛋白基因具有特异性的工程化大范围核酸酶(参见,例如,国际公开号wo 2017/112859)。b2m是主要组织相容性复合体(mhc)i类分子的一个组成部分,如果没有b2m,其将不会在细胞表面组装。因
此,敲除b2m是一种消除mhc i类分子的方法,当将car t细胞施用于同种异体患者时,这会减少gvhd。
8.然而,完全消除car t细胞表面上的b2m和mhc i类分子表达的结果是,所述car t细胞变得更容易受到自然杀伤(nk)细胞的攻击,自然杀伤细胞将其视为非自身的。鉴于这种现象,开发了一种针对car t细胞的敲低方法,以产生不完全的b2m敲低(参见,例如,国际公开号wo 2018/208837)。本质上,包含b2m靶向shrna编码序列的盒通过核酸酶介导的靶向插入引入t细胞的t细胞受体α恒定区基因。shrna编码序列包含在盒中,该盒也包含car编码序列,允许产生tcr阴性、car阳性的car t细胞,并且具有细胞表面b2m的部分敲低。该项目中的数据表明,与完全敲除b2m的car t细胞相比,这些car t细胞确实更不容易被nk细胞杀死。
9.然而,如本文所述,进一步的实验表明,包含shrna编码序列的盒不稳定,并且b2m敲低是暂时性的。最终,细胞从基因组中去除shrna编码序列,导致b2m表达回归。因此,仍然需要产生能够稳定敲低内源性蛋白(如b2m)的car t细胞。在本领域中寻找该问题的答案时,本文发现了一种技术,该技术可用于在免疫细胞中产生不同程度的目标蛋白的基因敲低。
技术实现要素:
10.本发明提供了遗传修饰的免疫细胞(及其群体),其表达降低靶蛋白表达的microrna适应的shrna(shrnamir)。使用shrnamir敲低靶蛋白的表达可以稳定敲低蛋白表达,这对于那些首选敲低而不是敲除的靶蛋白来说是理想的。例如,通过表达b2m靶向shrnamir来以降低水平表达β-2微球蛋白(b2m)的免疫细胞对自然杀伤(nk)细胞的细胞溶解作用比那些b2m表达已被基因失活敲除的细胞更不敏感。因此,进一步提供了通过引入包含编码shrnamir的核酸序列的模板核酸来降低免疫细胞中内源性蛋白表达的方法,所述核酸序列被插入到所述细胞的基因组中并被表达以降低所述内源性蛋白的表达。
11.因此,在一个方面中,本发明提供了一种遗传修饰的免疫细胞,其在基因组中包含编码microrna适应的shrna(shrnamir)的核酸序列。所述shrnamir在所述遗传修饰的免疫细胞中表达,并且在所述遗传修饰的免疫细胞中降低靶蛋白的表达。靶蛋白表达的降低由shrnamir引导序列与编码所述靶蛋白的mrna的结合来介导。
12.在一些实施方式中,所述遗传修饰的免疫细胞是遗传修饰的t细胞,或由其衍生的细胞。在一些实施方式中,所述遗传修饰的免疫细胞是遗传修饰的自然杀伤(nk)细胞,或由其衍生的细胞。在其他实施方式中,所述遗传修饰的免疫细胞是遗传修饰的b细胞,或由其衍生的细胞。在各种实施方式中,所述遗传修饰的免疫细胞是遗传修饰的单核细胞或巨噬细胞,或由其衍生的细胞。
13.在一些实施方式中,所述shrnamir从5’至3’包含:(a)5’mir支架结构域;(b)5’mir基干结构域;(c)随从链;(d)mir环结构域;(e)引导链;(f)3’mir基干结构域;和(g)3’mir支架结构域。
14.在一些实施方式中,所述mir环结构域是mir-30a环结构域、mir-15环结构域、mir-16环结构域、mir-155环结构域、mir-22环结构域、mir-103环结构域或mir-107环结构域。在特定实施方式中,所述mir环结构域是mir-30a环结构域。
15.在一些实施方式中,所述mir-30a环结构域包含与seq id no:3具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。在特定实施方式中,所述mir-30a环结构域包含seq id no:3的核酸序列。
16.在一些实施方式中,所述shrnamir包含microrna-e(mir-e)支架、mir-30(例如mir-30a)支架、mir-15支架、mir-16支架、mir-155支架、mir-22支架、mir-103支架或mir-107支架。在一些实施方式中,所述shrnamir包含mir-e支架。
17.在一些实施方式中,所述shrnamir包含一种结构,其中:(a)所述5’mir支架结构域包含与seq id no:1具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列;(b)所述5’mir基干结构域包含与seq id no:2具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列;(c)所述3’mir基干结构域包含与seq id no:4具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列;和/或(d)所述3’mir支架结构域包含与seq id no:5具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。
18.在一些实施方式中,所述shrnamir包含一种结构,其中:(a)所述5’mir支架结构域包含seq id no:1的核酸序列;(b)所述5’mir基干结构域包含seq id no:2的核酸序列;(c)所述3’mir基干结构域包含seq id no:4的核酸序列;和(d)所述3’mir支架结构域包含seq id no:5的核酸序列。
19.在一些实施方式中,所述遗传修饰的免疫细胞在其基因组中包含编码嵌合抗原受体(car)或外源性t细胞受体(tcr)的核酸序列,其中所述car或所述外源性tcr由所述遗传修饰的免疫细胞表达。
20.在一些实施方式中,所述遗传修饰的免疫细胞在其基因组中包含编码hla i类组织相容性抗原α链e(hla-e)融合蛋白的核酸序列。在一些实施方式中,所述hla-e融合蛋白包含与seq id no:66具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的氨基酸序列。在一些实施方式中,所述hla-e融合蛋白包含seq id no:66的氨基酸序列。
21.在一些实施方式中,编码所述shrnamir的所述核酸序列位于与编码所述car或所述外源性tcr的所述核酸序列不同的基因内。在一些实施方式中,编码所述shrnamir的所述核酸序列、或者编码所述car或所述外源性tcr的所述核酸序列位于tcrα基因或tcrα恒定区基因内。在特定实施方式中,编码所述shrnamir的所述核酸序列、或者编码所述car或所述外源性tcr的所述核酸序列在包含seq id no:58的序列内位于tcrα恒定区基因内。
22.在一些实施方式中,编码所述shrnamir的所述核酸序列位于与编码所述car或所述外源性tcr的所述核酸序列相同的基因内。在一些实施方式中,所述基因是tcrα基因或tcrα恒定区基因。在特定实施方式中,编码所述shrnamir的所述核酸序列和编码所述car或所述外源性tcr的所述核酸序列在包含seq id no:58的序列内位于tcrα恒定区基因内。在一些实施方式中,编码shrnamir的核酸序列和编码car或外源性tcr的核酸序列在所述基因的盒内。在一些此类实施方式中,编码所述shrnamir的所述核酸序列和编码所述car或所述外源性tcr的所述核酸序列与相同启动子可操作地连接。在一些此类实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒从5’至3’包含:(a)编码所述car或所述外源性tcr的所述核酸序列;和(b)编码所述shrnamir的所述核酸序列。在其他此类实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒从5’至3’包含:(a)编码所述
shrnamir的所述核酸序列;和(b)编码所述car或所述外源性tcr的所述核酸序列。在一些此类实施方式中,编码所述car或所述外源性tcr的所述核酸序列和编码所述shrnamir的所述核酸序列被2a或ires序列所分隔。在某些此类实施方式中,编码所述shrnamir的所述核酸序列和编码所述car或所述外源性tcr的所述核酸序列具有相同定向。在其他此类实施方式中,编码所述shrnamir的所述核酸序列和编码所述car或所述外源性tcr的所述核酸序列具有相反定向。在一些此类实施方式中,所述内含子序列位于编码所述car或所述外源性tcr的所述核酸序列内,和编码所述shrnamir的所述核酸序列位于所述内含子序列内。在一些此类实施方式中,所述盒包含与编码所述shrnamir的所述核酸序列和编码所述car或所述外源性tcr的所述核酸序列可操作地连接的启动子。在一些此类实施方式中,所述盒包含终止信号。
23.在一些实施方式中,编码所述shrnamir的所述核酸序列和编码所述hla-e融合蛋白的所述核酸序列位于相同基因内。在一些实施方式中,所述基因是tcrα基因或tcrα恒定区基因。在一些实施方式中,编码所述shrnamir的所述核酸序列和编码所述hla-e融合蛋白的所述核酸序列在所述基因中的盒内。在一些此类实施方式中,编码所述shrnamir的所述核酸序列和编码所述hla-e融合蛋白的所述核酸序列与相同启动子可操作地连接。在一些此类实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒从5’至3’包含:(a)编码所述hla-e融合蛋白的所述核酸序列;和(b)编码所述shrnamir的所述核酸序列。在一些此类实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒从5’至3’包含:(a)编码所述shrnamir的所述核酸序列;和(b)编码所述hla-e融合蛋白的所述核酸序列。在一些此类实施方式中,编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列被2a或ires序列所分隔。在某些此类实施方式中,内含子序列位于编码所述hla-e融合蛋白的所述核酸序列内,其中编码所述shrnamir的所述核酸序列位于所述内含子序列内。在一些此类实施方式中,所述盒包含启动子,其中编码所述shrnamir的所述核酸序列和编码所述hla-e融合蛋白的所述核酸序列与所述启动子可操作地连接。在一些此类实施方式中,所述盒包含终止信号。
24.在一些实施方式中,编码所述shrnamir的所述核酸序列、编码所述car或所述外源性tcr的所述核酸序列和编码所述hla-e融合蛋白的所述核酸序列位于相同基因内。在一些实施方式中,所述基因是tcrα基因或tcrα恒定区基因。在一些实施方式中,编码所述shrnamir的所述核酸序列、编码所述car或所述外源性tcr的所述核酸序列和编码所述hla-e融合蛋白的所述核酸序列在所述基因中的盒内。在一些此类实施方式中,编码shrnamir的核酸序列、编码所述car或所述外源性tcr的所述核酸序列和编码所述hla-e融合蛋白的所述核酸序列与相同启动子可操作地连接。在一些此类实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒包含:(a)编码所述car或所述外源性tcr的所述核酸序列;(b)2a或ires序列;(c)编码所述hla-e融合蛋白的所述核酸序列;和(d)编码所述shrnamir的所述核酸序列。在一些此类实施方式中,内含子序列位于编码所述car或所述外源性tcr的所述核酸序列内,其中编码所述shrnamir的所述核酸序列位于所述内含子序列内。在其他此类实施方式中,内含子序列位于编码所述hla-e融合蛋白的所述核酸序列内,其中编码所述shrnamir的所述核酸序列位于所述内含子序列内。在一些此类实施方式中,所述盒包含与编码所述car或所述外源性tcr的核酸序列、编码所述hla-e融合蛋白的所述核酸序列
和编码所述shrnamir的所述核酸序列可操作地连接的启动子。在一些此类实施方式中,所述盒包含终止信号。
25.在一些此类实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒从5’至3’包含:(a)启动子;(b)编码所述car或所述外源性tcr的所述核酸序列;(c)2a或ires序列;(d)编码所述hla-e融合蛋白的所述核酸序列,其中内含子序列位于编码所述hla-e融合蛋白的所述核酸序列内,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;和(e)任选地,终止信号;其中编码所述car或所述外源性tcr的所述核酸序列、编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述启动子可操作地连接。
26.在一些此类实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒从5’至3’包含:(a)启动子;(b)编码所述hla-e融合蛋白的所述核酸序列,其中内含子序列位于编码所述hla-e融合蛋白的所述核酸序列,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;(c)2a或ires序列;(d)编码所述car或所述外源性tcr的所述核酸序列;和(e)任选地,终止信号;其中编码所述car或所述外源性tcr的所述核酸序列、编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述启动子可操作地连接。
27.在一些此类实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒从5’至3’包含:(a)启动子;(b)编码所述car或所述外源性tcr的所述核酸序列,其中内含子序列位于编码所述car或所述外源性tcr的所述核酸序列内,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;(c)2a或ires序列;(d)编码所述hla-e融合蛋白的所述核酸序列;和(e)任选地,终止信号;其中编码所述car或所述外源性tcr的所述核酸序列、编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述启动子可操作地连接。
28.在一些此类实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒从5’至3’包含:(a)启动子;(b)编码所述hla-e融合蛋白的所述核酸序列;(c)2a或ires序列;(d)编码所述car或所述外源性tcr的所述核酸序列,其中内含子序列位于编码所述car或所述外源性tcr的所述核酸序列内,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;和(e)任选地,终止信号;其中编码所述car或所述外源性tcr的所述核酸序列、编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述启动子可操作地连接。
29.在上文所述的一些实施方式中,所述内含子序列是合成内含子序列。在一些实施方式中,所述内含子序列包含与seq id no:69具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。在特定实施方式中,所述内含子序列包含seq id no:69的核酸序列。
30.在上文所述的一些实施方式中,所述终止信号是polya序列或牛生长激素(bgh)终止信号。在一些实施方式中,所述polya序列包含与seq id no:68具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。在特定实施方式中,所述polya序列包含seq id no:68的核酸序列。在一些实施方式中,所述bgh终止信号包含与seq id no:71具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。在特定实施方
式中,所述bgh终止信号包含seq id no:71的核酸序列。
31.在上文所述的一些实施方式中,所述启动子包含与seq id no:67具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。在特定实施方式中,所述启动子包含seq id no:67的核酸序列。
32.在上文所述的一些实施方式中,所述2a序列是包含与seq id no:70具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列的p2a/弗林蛋白酶位点。在特定实施方式中,所述2a序列是包含seq id no:70的核酸序列的p2a/弗林蛋白酶位点。
33.在上文所述的一些实施方式中,所述car包含信号肽,所述信号肽包含与seq id no:73具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的氨基酸序列。在特定实施方式中,所述car包含信号肽,所述信号肽包含seq id no:73的氨基酸序列。
34.在特定实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒从5’至3’包含:(a)包含与seq id no:67具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列的启动子;(b)编码所述car的所述核酸序列,其中所述car包含信号肽,所述信号肽包含与seq id no:73具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的氨基酸序列;(c)包含与seq id no:70具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列的p2a/弗林蛋白酶位点;(d)编码所述hla-e融合蛋白的所述核酸序列,其中所述hla-e融合蛋白包含与seq id no:66具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的氨基酸序列,并且其中内含子序列位于编码所述hla-e融合蛋白的所述核酸序列内,其中所述内含子序列包含与seq id no:69具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;和(e)任选地,包含与seq id no:68具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列的终止信号,其中编码所述car的所述核酸序列、编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述启动子可操作地连接。
35.在特定实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒从5’至3’包含:(a)包含seq id no:67的核酸序列的启动子;(b)编码所述car的所述核酸序列,其中所述car包含信号肽,所述信号肽包含seq id no:73的氨基酸序列;(c)包含seq id no:70的核酸序列的p2a/弗林蛋白酶位点;(d)编码所述hla-e融合蛋白的所述核酸序列,其中所述hla-e融合蛋白包含seq id no:66的氨基酸序列,并且其中内含子序列位于编码所述hla-e融合蛋白的所述核酸序列内,其中所述内含子序列包含seq id no:69的核酸序列,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;和(e)任选地,包含seq id no:68的核酸序列的终止信号;其中编码所述car的所述核酸序列、编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述启动子地连接。
36.在特定实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒包含与seq id no:74具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列,其中所述盒在基因组中位于tcrα恒定区基因内。在特定实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒包含seq id no:74的核酸序列,其中所述盒在基因组中位于tcrα恒定区基因内。
37.在上文所述的一些实施方式中,所述盒包含编码shrnamir的两个或更多个核酸。在一些实施方式中,所述两个或更多个核酸可以编码相同shrnamir。在一些实施方式中,所述两个或更多个核酸可以编码不同shrnamir,所述shrnamir降低相同靶蛋白的表达。在其他实施方式中,所述两个或更多个核酸可以编码不同shrnamir,所述shrnamir降低不同靶蛋白的表达。在一些实施方式中,所述盒可以包含编码本文所述的不同shrnamir的两个或更多个核酸。在特定实施方式中,所述盒可以包含编码降低b2m表达的shrnamir的核酸序列和编码降低cd52表达的shrnamir的核酸序列。
38.在一些实施方式中,编码shrnamir的核酸序列和编码car或外源性tcr的核酸序列位于相同基因中,并且与不同启动子可操作地连接。在一些此类实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒从5’至3’包含:(a)第一启动子;(b)编码car或外源性tcr的核酸序列,其与所述第一启动子可操作地连接;(c)第二启动子;和(d)编码shrnamir的核酸序列,其与所述第二启动子可操作地连接。在其他此类实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒从5’至3’包含:(a)第一启动子;(b)编码shrnamir的核酸序列,其与所述第一启动子可操作地连接;(c)第二启动子;和(d)编码car或外源性tcr的核酸序列,其与所述第二启动子可操作地连接。在一些此类实施方式中,编码所述shrnamir的所述核酸序列和编码所述car或所述外源性tcr的所述核酸序列具有相同定向。在其他此类实施方式中,编码所述shrnamir的所述核酸序列和编码所述car或所述外源性tcr的所述核酸序列具有相反定向。在某些此类实施方式中,所述第一启动子和所述第二启动子是相同的。在其他实施方式中,所述第一启动子和所述第二启动子是不同的。在一些此类实施方式中,盒包含一个或多个终止信号。
39.在一些实施方式中,编码shrnamir的核酸序列和编码所述hla-e融合蛋白的所述核酸序列与不同启动子可操作地连接。在一些此类实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒从5’至3’包含:(a)第一启动子;(b)编码hla-e融合蛋白的核酸序列,其与所述第一启动子可操作地连接;(c)第二启动子;和(d)编码shrnamir的核酸序列,其与所述第二启动子可操作地连接。在其他此类实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒从5’至3’包含:(a)第一启动子;(b)编码shrnamir的核酸序列,其与所述第一启动子可操作地连接;(c)第二启动子;和(d)编码hla-e融合蛋白的核酸序列,其与所述第二启动子可操作地连接。在某些此类实施方式中,所述第一启动子和所述第二启动子是相同的。在其他此类实施方式中,所述第一启动子和所述第二启动子是不同的。在一些此类实施方式中,盒包含一个或多个终止信号。
40.在一些实施方式中,所述遗传修饰的免疫细胞在其基因组内包含盒,所述盒包含:(a)编码car或外源性tcr的核酸序列;(b)编码hla-e融合蛋白的核酸序列;和(c)编码shrnamir的核酸序列;其中编码所述car或所述外源性tcr的所述核酸序列与第一启动子可操作地连接,并且其中编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述第二启动子可操作地连接。在一些此类实施方式中,所述内含子序列位于编码所述hla-e融合蛋白的所述核酸序列内,其中编码所述shrnamir的所述核酸序列位于所述内含子序列内。在一些实施方式中,所述遗传修饰的免疫细胞在其基因组内包含盒,所述盒包含:(a)编码car或外源性tcr的核酸序列;(b)编码hla-e融合蛋白的核酸序列;和(c)编码shrnamir的核酸序列;其中编码所述car或所述外源性tcr的所述核酸序列和编码
所述shrnamir的所述核酸序列与第一启动子可操作地连接,并且其中编码所述hla-e融合蛋白的所述核酸序列与所述第二启动子可操作地连接。在一些此类实施方式中,所述内含子序列位于编码car或外源性tcr的核酸序列,其中编码所述shrnamir的所述核酸序列位于所述内含子序列内。在一些此类实施方式中,所述盒包含能够终止所述car或所述外源性tcr的转录的第一终止信号,和能够终止所述hla-e融合蛋白的转录的第二终止信号。在其他此类实施方式中,所述盒包含能够终止所述hla-e融合蛋白的转录的第一终止信号,和能够终止所述car或所述外源性tcr的转录的第二终止信号。
41.在一些此类实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒从5’至3’包含:(a)第一启动子;(b)编码car或外源性tcr的核酸序列;(c)任选地,第一终止信号;(d)第二启动子;(e)编码hla-e融合蛋白的核酸序列,其中内含子序列位于编码hla-e融合蛋白的核酸序列内,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;和(f)任选地,第二终止信号;其中编码所述car或所述外源性tcr的所述核酸序列与所述第一启动子可操作地连接,并且其中编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述第二启动子可操作地连接。
42.在一些此类实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒从5’至3’包含:(a)第一启动子;(b)编码hla-e融合蛋白的核酸序列,其中内含子序列位于编码hla-e融合蛋白的核酸序列内,内并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;(c)任选地,第一终止信号;(d)第二启动子;(e)编码car或外源性tcr的核酸序列;和(f)任选地,第二终止信号;其中编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述第一启动子可操作地连接,并且其中编码所述car或所述外源性tcr的所述核酸序列与所述第二启动子可操作地连接。
43.在一些此类实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒从5’至3’包含:(a)第一启动子;(b)编码car或外源性tcr的核酸序列,其中内含子序列位于编码car或外源性tcr的核酸序列内,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;(c)任选地,第一终止信号;(d)第二启动子;(e)编码hla-e融合蛋白的核酸序列;和(f)任选地,第二终止信号;其中编码所述car或所述外源性tcr的所述核酸序列和编码所述shrnamir的所述核酸序列与所述第一启动子可操作地连接,并且其中编码所述hla-e融合蛋白的所述核酸序列与所述第二启动子可操作地连接。
44.在一些此类实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒从5’至3’包含:(a)第一启动子;(b)编码hla-e融合蛋白的核酸序列;(c)任选地,第一终止信号;(d)第二启动子;(e)编码car或外源性tcr的核酸序列,其中内含子序列位于编码所述car或所述外源性tcr的所述核酸序列内,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;和(f)任选地,第二终止信号;其中编码所述hla-e融合蛋白的所述核酸序列与所述第一启动子可操作地连接,并且其中编码所述car或所述外源性tcr的所述核酸序列和编码所述shrnamir的所述核酸序列与所述第二启动子可操作地连接。
45.在上文所述的一些实施方式中,所述内含子序列是合成内含子序列。在一些实施方式中,所述内含子序列包含与seq id no:69具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。在特定实施方式中,所述内含子序列包含seq id no:69的核酸序列。
46.在上文所述的一些实施方式中,一个或多个终止信号是polya序列或bgh终止信号。
47.在上文所述的一些实施方式中,所述第一终止信号和第二终止信号是相同的。在一些此类实施方式中,所述第一终止信号和所述第二终止信号是polya序列或bgh终止信号。
48.在上文所述的一些实施方式中,所述第一终止信号和所述第二终止信号是不同的。在一些实施方式中,第一终止信号是polya序列和第二终止信号是bgh终止信号。在一些实施方式中,第一终止信号是bgh终止信号和第二终止信号是polya序列。
49.在上文所述的一些实施方式中,polya序列包含与seq id no:68具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。在一些实施方式中,polya序列包含seq id no:68的核酸序列。在一些实施方式中,bgh终止信号包含与seq id no:71具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。在一些实施方式中,bgh终止信号包含seq id no:71的核酸序列。
50.在上文所述的一些实施方式中,所述第一启动子和所述第二启动子是相同的。在一些此类实施方式中,所述第一启动子和所述第二启动子是jet启动子或ef1α核心启动子。
51.在上文所述的一些实施方式中,所述第一启动子和所述第二启动子是不同的。在一些实施方式中,所述第一启动子是jet启动子,和所述第二启动子是ef1α核心启动子。在一些实施方式中,所述第一启动子是ef1α核心启动子,和所述第二启动子是jet启动子。
52.在上文所述的某些实施方式中,jet启动子包含与seq id no:67具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。在特定实施方式中,jet包含seq id no:67的核酸序列。在一些实施方式中,ef1α核心启动子包含与seq id no:72具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。在一些实施方式中,ef1α核心启动子包含seq id no:72的核酸序列。
53.在上文所述的一些实施方式中,所述car包含信号肽,所述信号肽包含与seq id no:73具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的氨基酸序列。在特定实施方式中,所述car包含信号肽,所述信号肽包含seq id no:73的氨基酸序列。
54.在一些实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒从5’至3’包含:(a)包含与seq id no:67具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列的第一启动子;(b)编码car的核酸序列,其中所述car包含信号肽,所述信号肽包含与seq id no:73具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的氨基酸序列;(c)任选地,包含与seq id no:70具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列的第一终止信号;(d)包含与seq id no:72具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列的第二启动子;(e)编码hla-e融合蛋白的核酸序列,其中所述hla-e融合蛋白包含与seq id no:66具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的氨基酸序列,并且其中内含子序列位于编码hla-e融合蛋白的核酸序列内,其中所述内含子序列包含与seq id no:69具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;和(f)任选地,包含与seq id no:71具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列的第二终止信
号;其中编码car的核酸序列与所述第一启动子可操作地连接,并且其中编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述第二启动子可操作地连接。
55.在特定实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒从5’至3’包含:(a)包含seq id no:67的核酸序列的第一启动子;(b)编码car的核酸序列,其中所述car包含信号肽,所述信号肽包含seq id no:73的氨基酸序列;(c)任选地,包含seq id no:70的核酸序列的第一终止信号;(d)包含seq id no:72的核酸序列的第二启动子;(e)编码hla-e融合蛋白的核酸序列,其中所述hla-e融合蛋白包含seq id no:66的氨基酸序列,并且其中内含子序列位于编码hla-e融合蛋白的核酸序列内,其中所述内含子序列包含seq id no:69的核酸序列,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;和(f)任选地,包含seq id no:71的核酸序列的第二终止信号;其中编码car的核酸序列与所述第一启动子可操作地连接,并且其中编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述第二启动子可操作地连接。
56.在特定实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒包含与seq id no:75具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列,其中所述盒在基因组中位于tcrα恒定区基因内。在特定实施方式中,所述遗传修饰的免疫细胞在其基因组中包含盒,所述盒包含seq id no:75的核酸序列,其中所述盒在基因组中位于tcrα恒定区基因内。
57.在上文所述的一些实施方式中,盒包含编码shrnamir的两个或更多个核酸。在一些实施方式中,所述两个或更多个核酸可以编码相同shrnamir。在一些实施方式中,所述两个或更多个核酸可以编码不同shrnamir,所述shrnamir降低相同靶蛋白的表达。在其他实施方式中,所述两个或更多个核酸编码不同shrnamir,所述shrnamir降低不同靶蛋白的表达。在一些实施方式中,所述盒可以包含编码本文所述的不同shrnamir的两个或更多个核酸。在特定实施方式中,所述盒可以包含编码降低b2m表达的shrnamir的核酸序列,和编码降低cd52表达的shrnamir的核酸序列。
58.在一些实施方式中,与对照细胞相比,所述靶蛋白的表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%
59.在一些实施方式中,所述靶蛋白是β-2微球蛋白、cs1、转化生长因子-β受体2(tgfbr2)、cbl原癌基因b(cbl-b)、cd52、tcrα基因、tcrα恒定区基因、cd7、糖皮质激素受体(gr)、脱氧胞苷激酶(dck)、核受体亚家族2组f成员6(nr2f6)、细胞毒性t淋巴细胞相关蛋白4(ctla-4)或c-c趋化因子受体5型(ccr5)。
60.在一些实施方式中,所述靶蛋白是β-2微球蛋白。在一些此类实施方式中,与对照细胞相比,β-2微球蛋白的细胞表面表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。在进一步的实施方式中,与对照细胞相比,在细胞表面上mhc i类分子的表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。在一些此类实施方式中,与对照细胞相比,所述遗传修饰的免疫细胞具有降低的同种异体性。
61.在一些此类实施方式中,shrnamir具有一种结构,其中:(a)随从链包含seq id no:17的核酸序列和引导链包含seq id no:18的核酸序列;(b)随从链包含seq id no:7的核酸序列和引导链包含seq id no:8的核酸序列;(c)随从链包含seq id no:19的核酸序列和引导链包含seq id no:10的核酸序列;(d)随从链包含seq id no:11的核酸序列和引导链包含seq id no:12的核酸序列;(e)随从链包含seq id no:13的核酸序列和引导链包含seq id no:14的核酸序列;或者(f)随从链包含seq id no:15的核酸序列和引导链包含seq id no:16的核酸序列。在某些此类实施方式中,随从链包含seq id no:17的核酸序列和引导链包含seq id no:18的核酸序列。在特定的此类实施方式中,编码shrnamir的核酸序列包含与seq id no:46具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的序列。在其他此类实施方式中,编码shrnamir的核酸序列包含seq id no:46的序列。
62.在一些实施方式中,所述靶蛋白是cs1。在一些此类实施方式中,与对照细胞相比,cs1的细胞表面表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。在一些此类实施方式中,所述遗传修饰的免疫细胞表达对cs1具有特异性的car。在其他此类实施方式中,与对照细胞相比,所述遗传修饰的免疫细胞较不容易被表达对cs1具有特异性的car的遗传修饰的免疫细胞误杀。
63.在一些此类实施方式中,shrnamir具有一种结构,其中:(a)随从链包含seq id no:21的核酸序列和引导链包含seq id no:22的核酸序列;(b)随从链包含seq id no:23的核酸序列和引导链包含seq id no:24的核酸序列;或者(c)随从链包含seq id no:25的核酸序列和引导链包含seq id no:26的核酸序列。在某些此类实施方式中,随从链包含seq id no:25的核酸序列和引导链包含seq id no:26的核酸序列。在特定的此类实施方式中,shrnamir包含与seq id no:50具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的序列。在其他此类实施方式中,shrnamir包含seq id no:50的序列。
64.在一些实施方式中,所述靶蛋白是tgfbr2。在一些此类实施方式中,与对照细胞相比,tgfbr2的细胞表面表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。在进一步的实施方式中,与对照细胞相比,所述遗传修饰的免疫细胞对转化生长因子b1(tgfb1)的免疫抑制较不敏感。
65.在一些此类实施方式中,shrnamir具有一种结构,其中:(a)随从链包含seq id no:27的核酸序列和引导链包含seq id no:28的核酸序列;(b)随从链包含seq id no:29的核酸序列和引导链包含seq id no:30的核酸序列;(c)随从链包含seq id no:31的核酸序列和引导链包含seq id no:32的核酸序列;(d)随从链包含seq id no:33的核酸序列和引导链包含seq id no:34的核酸序列;或者(e)随从链包含seq id no:35的核酸序列和引导链包含seq id no:36的核酸序列。在某些此类实施方式中,随从链包含seq id no:31的核酸序列和引导链包含seq id no:32的核酸序列。在特定的此类实施方式中,编码shrnamir的核酸序列包含与seq id no:53具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的序列。在其他此类实施方式中,编码shrnamir的核酸序列包含seq id no:53的序列。
66.在一些实施方式中,所述靶蛋白是cbl-b。在一些此类实施方式中,与对照细胞相
比,cbl-b的细胞表面表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。在其他此类实施方式中,与对照细胞相比,免疫细胞较不易受下游信号传导蛋白降解而导致的t细胞受体(tcr)信号传导抑制的影响。
67.在一些实施方式中,所述靶蛋白是cd52。在一些此类实施方式中,与对照细胞相比,cd52的细胞表面表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。在进一步的实施方式中,所述遗传修饰的免疫细胞对cd52抗体诱导的细胞死亡较不敏感。
68.在一些此类实施方式中,shrnamir具有一种结构,其中:(a)随从链包含seq id no:37的核酸序列和引导链包含seq id no:38的核酸序列;或者(b)随从链包含seq id no:39的核酸序列和引导链包含seq id no:40的核酸序列。在某些此类实施方式中,随从链包含seq id no:37的核酸序列和引导链包含seq id no:38的核酸序列。在特定的此类实施方式中,编码shrnamir的核酸序列包含与seq id no:56具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的序列。在其他此类实施方式中,编码shrnamir的核酸序列包含seq id no:56的序列。
69.在一些实施方式中,所述靶蛋白是dck。在一些此类实施方式中,与对照细胞相比,dck的细胞表面表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。在其他此类实施方式中,所述遗传修饰的免疫细胞对嘌呤核苷酸类似物(例如,氟达拉滨)在细胞增殖上的影响较不敏感。
70.在一些此类实施方式中,shrnamir具有一种结构,其中:(a)随从链包含seq id no:76的核酸序列和引导链包含seq id no:77的核酸序列;(b)随从链包含seq id no:78的核酸序列和引导链包含seq id no:79的核酸序列;(c)随从链包含seq id no:80的核酸序列和引导链包含seq id no:81的核酸序列;(d)随从链包含seq id no:82的核酸序列和引导链包含seq id no:83的核酸序列;或者(e)随从链包含seq id no:84的核酸序列和引导链包含seq id no:85的核酸序列。在特定的此类实施方式中,随从链包含seq id no:76的核酸序列和引导链包含seq id no:77的核酸序列。在特定的此类实施方式中,编码shrnamir的核酸序列包含与seq id no:86具有具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的序列。在其他此类实施方式中,编码shrnamir的核酸序列包含seq id no:86的序列。
71.在一些实施方式中,所述靶蛋白是gr。在一些此类实施方式中,与对照细胞相比,gr的细胞表面表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。在其他此类实施方式中,所述遗传修饰的免疫细胞对糖皮质激素(例如,地塞米松)的影响(如增殖减少)较不敏感。
72.在一些此类实施方式中,shrnamir具有一种结构,其中:(a)随从链包含seq id no:91的核酸序列和引导链包含seq id no:92的核酸序列;(b)随从链包含seq id no:93的核酸序列和引导链包含seq id no:94的核酸序列;(c)随从链包含seq id no:95的核酸序列和引导链包含seq id no:96的核酸序列;(d)随从链包含seq id no:97的核酸序列和引
导链包含seq id no:98的核酸序列;(e)随从链包含seq id no:99的核酸序列和引导链包含seq id no:100的核酸序列;(f)随从链包含seq id no:101的核酸序列和引导链包含seq id no:102的核酸序列;(g)随从链包含seq id no:103的核酸序列和引导链包含seq id no:104的核酸序列;(h)随从链包含seq id no:105的核酸序列和引导链包含seq id no:106的核酸序列;或者(i)随从链包含seq id no:107的核酸序列和引导链包含seq id no:108的核酸序列。在特定的此类实施方式中,随从链包含seq id no:95的核酸序列和引导链包含seq id no:96的核酸序列。在特定的此类实施方式中,编码shrnamir的核酸序列包含与seq id no:111具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的序列。在其他此类实施方式中,编码shrnamir的核酸序列包含seq id no:111的序列。
73.在另一个方面中,本发明提供了一种用于降低免疫细胞中内源性蛋白的表达的方法,所述方法包括将包含编码shrnamir的核酸序列的模板核酸引入所述免疫细胞中,其中将所述模板核酸插入所述免疫细胞的基因组中。在所述免疫细胞中所述shrnamir被表达,并且所述免疫细胞中内源性靶蛋白的表达降低。靶蛋白表达的降低是由shrnamir引导序列与编码靶蛋白的mrna结合介导的。
74.在所述方法的一些实施方式中,免疫细胞是t细胞,或由其衍生的细胞。在一些实施方式中,免疫细胞是自然杀伤(nk)细胞,或由其衍生的细胞。在其他实施方式中,免疫细胞是b细胞,或由其衍生的细胞。在各种实施方式中,免疫细胞是单核细胞或巨噬细胞,或由其衍生的细胞。
75.在所述方法的一些实施方式中,通过随机整合将所述模板核酸插入所述免疫细胞的所述基因组中。在所述方法的一些此类实施方式中,使用病毒载体(即,重组病毒)将所述模板核酸引入所述免疫细胞中,如慢病毒载体(即,重组慢病毒)。
76.在所述方法的一些实施方式中,所述免疫细胞表达car或外源性tcr。
77.在一些实施方式中,所述方法进一步包括将编码对免疫细胞基因组中的识别序列具有特异性的工程化核酸酶的第二核酸引入免疫细胞中。工程化核酸酶在免疫细胞中表达,并在识别序列处产生切割位点。包含编码shrnamir的核酸序列的模板核酸在切割位点处插入免疫细胞的基因组中。在所述方法的一些此类实施方式中,所述模板核酸的侧翼是与所述识别位点侧翼的序列具有同源性的同源臂,并且其中通过同源重组在所述切割位点处插入所述模板核酸。在所述方法的一些此类实施方式中,使用病毒载体(即,重组病毒)将模板核酸引入免疫细胞中。在一些此类实施方式中,病毒载体是重组aav载体(即,重组aav)。在特定实施方式中,重组aav载体具有血清型aav2或aav6。在所述方法的一些此类实施方式中,识别序列在靶基因内。在所述方法的一些此类实施方式中,在免疫细胞中由靶基因编码的蛋白的表达被破坏。在所述方法的某些此类实施方式中,靶基因是tcrα基因或tcrα恒定区基因,并且免疫细胞不具有可检测的内源性tcr(例如,α/βtcr)的细胞表面表达。在所述方法的一些此类实施方式中,工程化核酸酶是工程化大范围核酸酶、锌指核酸酶、talen、致密talen、crispr系统核酸酶或megatal。在所述方法的特定此类实施方式中,工程化核酸酶是工程化大范围核酸酶。在所述方法的某些此类实施方式中,编码工程化核酸酶的第二核酸是使用mrna引入的。
78.在所述方法的一些实施方式中,模板核酸被引入其中的免疫细胞在其基因组中进一步包含编码car或外源性tcr的核酸序列。在所述方法的某些实施方式中,模板核酸被引
入其中的免疫细胞在其基因组中进一步包含编码hla-e融合蛋白的核酸序列。
79.在所述方法的一些实施方式中,模板核酸进一步包含编码car或外源性tcr的核酸序列,其中所述car或所述外源性tcr由所述免疫细胞表达。在一些此类实施方式中,编码所述shrnamir的所述核酸序列和编码所述car或所述外源性tcr的所述核酸序列在所述切割位点处引入所述模板核酸后在所述免疫细胞中与相同启动子可操作地连接。在所述方法的一些此类实施方式中,模板核酸从5’至3’包含:(a)编码car或外源性tcr的核酸序列;和(b)编码shrnamir的核酸序列。在所述方法的其他此类实施方式中,模板核酸从5’至3’包含:(a)编码shrnamir的核酸序列;和(b)编码car或外源性tcr的核酸序列。在所述方法的某些此类实施方式中,编码所述car或所述外源性tcr的所述核酸序列和编码所述shrnamir的所述核酸序列被2a或ires序列分隔。在所述方法的一些此类实施方式中,编码所述shrnamir的所述核酸序列和编码所述car或所述外源性tcr的所述核酸序列具有相同定向。在所述方法的其他此类实施方式中,编码shrnamir的核酸序列和编码car或外源性tcr的核酸序列是不同的。在所述方法的一些此类实施方式中,所述内含子序列位于编码car或外源性tcr的核酸序列,其中编码所述shrnamir的所述核酸序列位于所述内含子序列内。在所述方法的某些此类实施方式中,所述模板核酸包含启动子,其中所述启动子与编码所述car或所述外源性tcr的所述核酸序列和与编码所述shrnamir的所述核酸序列可操作地连接。在所述方法的一些此类实施方式中,所述模板核酸包含终止信号。
80.在所述方法的一些实施方式中,所述模板核酸包含编码hla-e融合蛋白的核酸序列,其中所述hla-e融合蛋白由所述免疫细胞表达。在所述方法的一些此类实施方式中,shrnamir和编码所述hla-e融合蛋白的所述核酸序列在所述切割位点处引入后在所述免疫细胞中与相同启动子可操作地连接。在所述方法的某些此类实施方式中,模板核酸从5’至3’包含:(a)编码hla-e融合蛋白的核酸序列;和(b)编码shrnamir的核酸序列。在所述方法的其他此类实施方式中,模板核酸从5’至3’包含:(a)编码shrnamir的核酸序列;和(b)编码hla-e融合蛋白的核酸序列。在所述方法的一些此类实施方式中、编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列被2a或ires序列所分隔。在所述方法的某些此类实施方式中,所述内含子序列位于编码所述hla-e融合蛋白的所述核酸序列内,其中编码所述shrnamir的所述核酸序列位于所述内含子序列内。在所述方法的一些此类实施方式中,所述模板核酸包含启动子,其中所述启动子与编码所述hla-e融合蛋白的所述核酸序列和与编码所述shrnamir的所述核酸序列可操作地连接。在所述方法的某些此类实施方式中,所述模板核酸包含终止信号。
81.在所述方法的一些实施方式中,所述模板核酸包含编码car或外源性tcr的核酸序列和编码所述hla-e融合蛋白的所述核酸序列,其中car或外源性tcr和hla-e融合蛋白由所述免疫细胞表达。在所述方法的一些实施方式中,编码shrnamir的核酸序列,编码car或外源性tcr的核酸序列和编码所述hla-e融合蛋白的所述核酸序列在所述切割位点处引入后在所述免疫细胞中与相同启动子可操作地连接。在所述方法的一些此类实施方式中,所述模板核酸包含:(a)编码car或外源性tcr的核酸序列;(b)2a或ires序列;(c)编码hla-e融合蛋白的核酸序列;和(d)编码shrnamir的核酸序列。在所述方法的某些此类实施方式中,所述内含子序列位于编码所述hla-e融合蛋白的所述核酸序列内,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内。在所述方法的其他此类实施方式中,所
述内含子序列位于编码car或外源性tcr的核酸序列,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内。在所述方法的一些此类实施方式中,所述模板核酸包含与编码car或外源性tcr的核酸序列、编码hla-e融合蛋白的核酸序列和编码所述shrnamir的所述核酸序列可操作地连接的启动子。在所述方法的某些此类实施方式中,所述模板核酸包含终止信号。
82.在所述方法的一些此类实施方式中,模板核酸从5’至3’包含:(a)启动子;(b)编码car或外源性tcr的核酸序列;(c)2a或ires序列;(d)编码hla-e融合蛋白的核酸序列,其中内含子序列位于编码所述hla-e融合蛋白的所述核酸序列内,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;和(e)任选地,终止信号;其中编码所述car或所述外源性tcr的所述核酸序列、编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述启动子可操作地连接。
83.在所述方法的一些此类实施方式中,模板核酸从5’至3’包含:(a)启动子;(b)编码hla-e融合蛋白的核酸序列,其中内含子序列位于编码所述hla-e融合蛋白的所述核酸序列内,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;(c)2a或ires序列;(d)编码car或外源性tcr的核酸序列;和(e)任选地,终止信号;其中编码所述car或所述外源性tcr的所述核酸序列、编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述启动子可操作地连接。
84.在所述方法的一些此类实施方式中,模板核酸从5’至3’包含:(a)启动子;(b)编码car或外源性tcr的核酸序列,其中内含子序列位于编码所述car或所述外源性tcr的所述核酸序列内,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;(c)2a或ires序列;(d)编码hla-e融合蛋白的核酸序列;和(e)任选地,终止信号;其中编码所述car或所述外源性tcr的所述核酸序列、编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述启动子可操作地连接。
85.在所述方法的一些此类实施方式中,模板核酸从5’至3’包含:(a)启动子;(b)编码hla-e融合蛋白的核酸序列;(c)2a或ires序列;(d)编码car或外源性tcr的核酸序列,其中内含子序列位于编码所述car或所述外源性tcr的所述核酸序列内,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;和(e)任选地,终止信号;其中编码所述car或所述外源性tcr的所述核酸序列、编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述启动子可操作地连接。
86.在上文所述方法的一些实施方式中,所述内含子序列是合成内含子序列。在所述方法的某些实施方式中,所述内含子序列包含与seq id no:69具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。在所述方法的特定实施方式中,所述内含子序列包含seq id no:69的核酸序列。
87.在上文所述方法的一些实施方式中,所述终止信号是polya序列或牛生长激素(bgh)终止信号。在所述方法的某些实施方式中,polya序列包含与seq id no:68具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。在所述方法的特定实施方式中,polya序列包含seq id no:68的核酸序列。在所述方法的某些实施方式中,bgh终止信号包含与seq id no:71具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。在所述方法的特定实施方式中,bgh终止信号包含seq id no:71的核酸序
列。
88.在上述所述方法的某些实施方式中,所述启动子包含与seq id no:67具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。在所述方法的特定实施方式中,所述启动子包含seq id no:67的核酸序列。
89.在上述所述方法的某些实施方式中,所述2a序列是p2a/弗林蛋白酶位点包含与seq id no:70具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。在所述方法的特定实施方式中,所述2a序列是p2a/弗林蛋白酶位点包含seq id no:70的核酸序列。
90.在上述所述方法的某些实施方式中,hla-e融合蛋白包含与seq id no:66具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的氨基酸序列。在所述方法的特定实施方式中,hla-e融合蛋白包含seq id no:66的氨基酸序列。
91.在上述所述方法的某些实施方式中,所述car包含信号肽,所述信号肽包含与seq id no:73具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的氨基酸序列。在所述方法的特定实施方式中,所述car包含信号肽,所述信号肽包含seq id no:73的氨基酸序列。
92.在所述方法的特定实施方式中,模板核酸从5’至3’包含:(a)包含与seq id no:67具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列的启动子;(b)编码car的核酸序列,其中所述car包含信号肽,所述信号肽包含与seq id no:73具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的氨基酸序列;(c)包含与seq id no:70具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列的p2a/弗林蛋白酶位点;(d)编码hla-e融合蛋白的核酸序列,其中所述hla-e融合蛋白包含与seq id no:66具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的氨基酸序列,并且其中内含子序列位于编码hla-e融合蛋白的核酸序列内,其中所述内含子序列包含与seq id no:69具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;和(e)任选地,包含与seq id no:68具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列的终止信号;其中编码所述car的所述核酸序列、编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述启动子可操作地连接。
93.在所述方法的特定实施方式中,模板核酸从5’至3’包含:(a)包含seq id no:67的核酸序列的启动子;(b)编码car的核酸序列,其中所述car包含信号肽,所述信号肽包含seq id no:73的氨基酸序列;(c)包含seq id no:70的核酸序列的p2a/弗林蛋白酶位点;(d)编码hla-e融合蛋白的核酸序列,其中所述hla-e融合蛋白包含seq id no:66的氨基酸序列,并且其中内含子序列位于编码所述hla-e融合蛋白的所述核酸序列内,其中所述内含子序列包含seq id no:69的核酸序列,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;和(e)任选地,包含seq id no:68的核酸序列的终止信号;其中编码所述car的所述核酸序列、编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述启动子可操作地连接。
94.在所述方法的特定实施方式中,所述模板核酸包含与seq id no:74具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列,其中所述模板核酸插
入到基因组中tcrα恒定区基因内。在所述方法的特定实施方式中,所述模板核酸包含seq id no:74的核酸序列,其中所述模板核酸插入到基因组中tcrα恒定区基因内。
95.在上文所述方法的一些实施方式中,所述模板核酸包含编码shrnamir的两个或更多个核酸。在所述方法的某些实施方式中,所述两个或多个核酸可以编码相同shrnamir。在所述方法的一些实施方式中,所述两个或更多个核酸可以编码不同shrnamir,所述shrnamir降低相同靶蛋白的表达。在所述方法的其他实施方式中,两个或更多个核酸编码不同shrnamir,所述shrnamir降低不同靶蛋白的表达。在所述方法的某些实施方式中,模板核酸可以包含编码本文所述的不同shrnamir的两个或更多个核酸。在所述方法的特定实施方式中,模板核酸可以包含编码降低b2m表达的shrnamir的核酸序列,编码降低cd52表达的shrnamir的核酸序列。
96.在所述方法的一些实施方式中,编码所述shrnamir的所述核酸序列和编码所述car或所述外源性tcr的所述核酸序列在所述切割位点处引入后在所述免疫细胞中与不同启动子可操作地连接。在所述方法的一些此类实施方式中,模板核酸从5’至3’包含:(a)第一启动子;(b)编码car或外源性tcr的核酸序列,其与所述第一启动子可操作地连接;(c)第二启动子;和(d)编码shrnamir的核酸序列,其与所述第二启动子可操作地连接。在所述方法的其他此类实施方式中,模板核酸从5’至3’包含:(a)第一启动子;(b)编码shrnamir的核酸序列,其与所述第一启动子可操作地连接;(c)第二启动子;和(d)编码car或外源性tcr的核酸序列,其与所述第二启动子可操作地连接。在所述方法的某些此类实施方式中,编码所述shrnamir的所述核酸序列与编码所述car或所述外源性tcr的所述核酸序列具有相同定向。在所述方法的其他此类实施方式中,编码所述shrnamir的所述核酸序列和编码所述car或所述外源性tcr的所述核酸序列具有不同定向。在所述方法的特定此类实施方式中,所述第一启动子和所述第二启动子是相同的。在所述方法的其他此类实施方式中,所述第一启动子和所述第二启动子是不同的。在所述方法的一些此类实施方式中,所述模板核酸包含一个或多个终止信号。
97.在所述方法的一些实施方式中,编码shrnamir的核酸序列和编码所述hla-e融合蛋白的所述核酸序列在所述切割位点处引入后在所述免疫细胞中与不同启动子可操作地连接。在所述方法的某些此类实施方式中,模板核酸从5’至3’包含:(a)第一启动子;(b)编码hla-e融合蛋白的核酸序列,其与所述第一启动子可操作地连接;(c)第二启动子;和(d)编码shrnamir的核酸序列,其与所述第二启动子可操作地连接。在所述方法的一些此类实施方式中,模板核酸从5’至3’包含:(a)第一启动子;(b)编码shrnamir的核酸序列,其与所述第一启动子可操作地连接;(c)第二启动子;和(d)编码hla-e融合蛋白的核酸序列,其与所述第二启动子可操作地连接。在所述方法的某些此类实施方式中,所述第一启动子和所述第二启动子是相同的。在所述方法的其他此类实施方式中,所述第一启动子和所述第二启动子是不同的。在所述方法的一些此类实施方式中,所述模板核酸包含一个或多个终止信号。
98.在所述方法的一些实施方式中,所述模板核酸包含:(a)编码car或外源性tcr的核酸序列;(b)编码hla-e融合蛋白的核酸序列;和(c)编码shrnamir的核酸序列;其中编码所述car或所述外源性tcr的所述核酸序列与所述第一启动子可操作地连接,并且其中编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述第二启动子
可操作地连接。在所述方法的一些实施方式中,所述内含子序列位于编码所述hla-e融合蛋白的所述核酸序列内,其中编码所述shrnamir的所述核酸序列位于所述内含子序列内。在所述方法的一些实施方式中,所述模板核酸包含:(a)编码car或外源性tcr的核酸序列;(b)编码hla-e融合蛋白的核酸序列;和(c)编码shrnamir的核酸序列;其中编码所述car或所述外源性tcr的所述核酸序列和编码所述shrnamir的所述核酸序列与所述第一启动子可操作地连接,并且其中编码所述hla-e融合蛋白的所述核酸序列与所述第二启动子可操作地连接。在所述方法的一些实施方式中,所述内含子序列位于编码car或外源性tcr的核酸序列,其中编码所述shrnamir的所述核酸序列位于所述内含子序列内。
99.在所述方法的一些此类实施方式中,所述模板核酸包含能够终止所述car或所述外源性tcr的转录的第一终止信号,和能够终止所述hla-e融合蛋白的转录的第二终止信号。在所述方法的一些此类实施方式中,所述模板核酸包含能够终止所述hla-e融合蛋白的转录的第一终止信号,和能够终止所述car或所述外源性tcr的转录的第二终止信号。
100.在所述方法的一些此类实施方式中,模板核酸从5’至3’包含:(a)第一启动子;(b)编码car或外源性tcr的核酸序列;(c)任选地,第一终止信号;(d)第二启动子;(e)编码hla-e融合蛋白的核酸序列,其中内含子序列位于编码hla-e融合蛋白的核酸序列内,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;和(f)任选地,第二终止信号;其中编码所述car或所述外源性tcr的所述核酸序列与所述第一启动子可操作地连接,并且其中编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述第二启动子可操作地连接。
101.在所述方法的一些此类实施方式中,模板核酸从5’至3’包含:(a)第一启动子;(b)编码hla-e融合蛋白的核酸序列,其中内含子序列位于编码所述hla-e融合蛋白的所述核酸序列内,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;(c)任选地,第一终止信号;(d)第二启动子;(e)编码car或外源性tcr的核酸序列;和(f)任选地,第二终止信号;其中编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述第一启动子可操作地连接,并且其中编码所述car或所述外源性tcr的所述核酸序列与所述第二启动子可操作地连接。
102.在所述方法的一些此类实施方式中,模板核酸从5’至3’包含:(a)第一启动子;(b)编码car或外源性tcr的核酸序列,其中内含子序列位于编码所述car或所述外源性tcr的所述核酸序列内,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;(c)任选地,第一终止信号;(d)第二启动子;(e)编码hla-e融合蛋白的核酸序列;和(f)任选地,第二终止信号;其中编码所述car或所述外源性tcr的所述核酸序列和编码所述shrnamir的所述核酸序列与所述第一启动子可操作地连接,并且其中编码所述hla-e融合蛋白的所述核酸序列与所述第二启动子可操作地连接。
103.在所述方法的一些此类实施方式中,模板核酸从5’至3’包含:(a)第一启动子;(b)编码hla-e融合蛋白的核酸序列;(c)任选地,第一终止信号;(d)第二启动子;(e)编码car或外源性tcr的核酸序列,其中内含子序列位于编码所述car或所述外源性tcr的所述核酸序列内,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;和(f)任选地,第二终止信号;其中编码所述hla-e融合蛋白的所述核酸序列与所述第一启动子可操作地连接,并且其中编码所述car或所述外源性tcr的所述核酸序列和编码所述shrnamir的所述
核酸序列与所述第二启动子可操作地连接。
104.在上文所述方法的一些实施方式中,所述内含子序列是合成内含子序列。在所述方法的某些实施方式中,所述内含子序列包含与seq id no:69具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。在所述方法的特定实施方式中,所述内含子序列包含seq id no:69的核酸序列。
105.在上文所述方法的一些实施方式中,一种或多种末端信号是polya序列或bgh终止信号。
106.在上文所述方法的一些实施方式中,所述第一终止信号和所述第二终止信号是相同的。在所述方法的其他实施方式中,所述第一终止信号和所述第二终止信号是不同的。在所述方法的某些实施方式中,第一终止信号是polya序列和第二终止信号是bgh终止信号。在所述方法的某些实施方式中,第一终止信号是bgh终止信号和第二终止信号是polya序列。
107.在上述所述方法的某些实施方式中,polya序列包含与seq id no:68具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。在所述方法的特定实施方式中,polya序列包含seq id no:68的核酸序列。在所述方法的某些实施方式中,bgh终止信号包含与seq id no:71具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。在所述方法的特定实施方式中,bgh终止信号包含seq id no:71的核酸序列。
108.在上文所述方法的一些实施方式中,所述第一启动子和所述第二启动子是相同的。在所述方法的其他实施方式中,所述第一启动子和所述第二启动子是不同的。在所述方法的某些实施方式中,所述第一启动子是jet启动子,和所述第二启动子是ef1α核心启动子。在所述方法的某些实施方式中,所述第一启动子是ef1α核心启动子,和所述第二启动子是jet启动子。
109.在上述所述方法的某些实施方式中,jet启动子包含与seq id no:67具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。在所述方法的特定实施方式中,jet启动子包含seq id no:67的核酸序列。在所述方法的某些实施方式中,ef1α核心启动子包含与seq id no:72具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。在特定实施方式中,ef1α核心启动子包含seq id no:72的核酸序列。
110.在上文所述方法的一些实施方式中,hla-e融合蛋白包含与seq id no:66具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的氨基酸序列。在所述方法的特定实施方式中,hla-e融合蛋白包含seq id no:66的氨基酸序列。
111.在上文所述方法的一些实施方式中,所述car包含信号肽,所述信号肽包含与seq id no:73具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的氨基酸序列。在所述方法的特定实施方式中,所述car包含信号肽,所述信号肽包含seq id no:73的氨基酸序列。
112.在所述方法的特定实施方式中,模板核酸从5’至3’包含:(a)包含与seq id no:67具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列的第一启动子;(b)编码car的核酸序列,其中所述car包含信号肽,所述信号肽包含与seq id no:73具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的氨基酸序列;(c)任选地,
包含与seq id no:70具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列的第一终止信号;(d)包含与seq id no:72具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列的第二启动子;(e)编码hla-e融合蛋白的核酸序列,其中所述hla-e容恶化蛋白包含与seq id no:66具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的氨基酸序列,并且其中内含子序列位于编码hla-e融合蛋白的核酸序列内,其中所述内含子序列包含与seq id no:69具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;和(f)任选地,包含与seq id no:71具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列的第二终止信号;其中编码car的核酸序列与所述第一启动子可操作地连接,并且其中编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述第二启动子可操作地连接。
113.在所述方法的特定实施方式中,模板核酸从5’至3’包含:(a)包含seq id no:67的核酸序列的第一启动子;(b)编码所述car的所述核酸序列,其中所述car包含信号肽,所述信号肽包含seq id no:73的氨基酸序列;(c)任选地,包含seq id no:70的核酸序列的第一终止信号;(d)包含seq id no:72的核酸序列的第二启动子;(e)编码hla-e融合蛋白的核酸序列,其中所述hla-e融合蛋白包含seq id no:66的氨基酸序列,并且其中内含子序列位于编码hla-e融合蛋白的核酸序列内,其中所述内含子序列包含seq id no:69的核酸序列,并且其中编码所述shrnamir的所述核酸序列位于所述内含子序列内;和(f)任选地,包含seq id no:71的核酸序列的第二终止信号;其中编码car的核酸序列与所述第一启动子可操作地连接,并且其中编码所述hla-e融合蛋白的所述核酸序列和编码所述shrnamir的所述核酸序列与所述第二启动子可操作地连接。
114.在所述方法的特定实施方式中,所述模板核酸包含与seq id no:75具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列,其中所述盒插入到基因组中tcrα恒定区基因内。在所述方法的特定实施方式中,所述模板核酸包含seq id no:75的核酸序列,其中所述盒插入到基因组中tcrα恒定区基因内。
115.在上文所述方法的一些实施方式中,所述模板核酸包含编码shrnamir的两个或更多个核酸。在所述方法的某些实施方式中,所述两个或更多个核酸可以编码相同shrnamir。在所述方法的一些实施方式中,两个或更多个核酸可以编码不同shrnamir,所述shrnamir降低相同靶蛋白的表达。在所述方法的其他实施方式中,两个或更多个核酸可以编码不同shrnamir,所述shrnamir降低不同靶蛋白的表达。在所述方法的某些实施方式中,模板核酸可以包含编码本文所述的不同shrnamir的两个或更多个核酸。在所述方法的特定实施方式中,模板核酸可以包含编码降低b2m表达的shrnamir的核酸序列,和编码降低cd52表达的shrnamir的核酸序列。
116.在所述方法的一些实施方式中,shrnamir从5’至3’包含:(a)5’mir支架结构域;(b)5’mir基干结构域;(c)随从链;(d)mir环结构域;(e)引导链;(f)3’mir基干结构域;和(g)3’mir支架结构域。
117.在所述方法的一些实施方式中,mir环结构域是mir-30a环结构域、mir-15环结构域、mir-16环结构域、mir-155环结构域、mir-22环结构域、mir-103环结构域或mir-107环结构域。在所述方法的特定实施方式中,mir环结构域是mir-30a环结构域。
118.在所述方法的某些实施方式中,mir-30a环结构域包含与seq id no:3具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。在所述方法的特定实施方式中,mir-30a环结构域包含seq id no:3的核酸序列。
119.在所述方法的一些实施方式中,shrnamir包含microrna-e(mir-e)支架、mir-30(例如mir-30a)支架、mir-15支架、mir-16支架、mir-155支架、mir-22支架、mir-103支架或mir-107支架。在所述方法的某些实施方式中,shrnamir包含mir-e支架。
120.在所述方法的一些实施方式中,shrnamir包含一种结构,其中:(a)5’mir支架结构域包含与seq id no:1具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列;(b)5’mir基干结构域包含与seq id no:2具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列;(c)3’mir基干结构域包含与seq id no:4具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列;和/或(d)3’mir支架结构域包含与seq id no:5具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的核酸序列。
121.在所述方法的某些实施方式中,shrnamir包含一种结构,其中:(a)5’mir支架结构域包含seq id no:1的核酸序列;(b)5’mir基干结构域包含seq id no:2的核酸序列;(c)3’mir基干结构域包含seq id no:4的核酸序列;和(d)3’mir支架结构域包含seq id no:5的核酸序列。
122.在所述方法的一些实施方式中,与对照细胞相比,所述靶蛋白的表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。
123.在所述方法的一些实施方式中,所述靶蛋白是β-2微球蛋白、cs1、转化生长因子-β受体2(tgfbr2)、cbl原癌基因b(cbl-b)、cd52、tcrα基因、tcrα恒定区基因、cd7、糖皮质激素受体(gr)、脱氧胞苷激酶(dck)、核受体亚家族2组f成员6(nr2f6)、细胞毒性t淋巴细胞相关蛋白4(ctla-4)或c-c趋化因子受体5型(ccr5)。
124.在所述方法的一些实施方式中,所述靶蛋白是β-2微球蛋白。在所述方法的一些此类实施方式中,与对照细胞相比,β-2微球蛋白的细胞表面表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。在所述方法进一步的此类实施方式中,与对照细胞相比,在细胞表面上mhc i类分子的表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。在所述方法的一些此类实施方式中,与对照细胞相比,免疫细胞具有降低的同种异体性。
125.在所述方法的一些此类实施方式中,shrnamir具有一种结构,其中:(a)随从链包含seq id no:17的核酸序列和引导链包含seq id no:18的核酸序列;(b)随从链包含seq id no:7的核酸序列和引导链包含seq id no:8的核酸序列;(c)随从链包含seq id no:9的核酸序列和引导链包含seq id no:10的核酸序列;(d)随从链包含seq id no:11的核酸序列和引导链包含seq id no:12的核酸序列;(e)随从链包含seq id no:13的核酸序列和引导链包含seq id no:14的核酸序列;或者(f)随从链包含seq id no:15的核酸序列和引导链包含seq id no:16的核酸序列。在所述方法的某些此类实施方式中,随从链包含seq id no:17的核酸序列和引导链包含seq id no:18的核酸序列。在所述方法的特定此类实施方
式中,编码shrnamir的核酸序列包含与seq id no:46具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的序列。在所述方法进一步的此类实施方式中,编码shrnamir的核酸序列包含seq id no:46的序列。
126.在所述方法的一些实施方式中,所述靶蛋白是cs1。在所述方法的一些此类实施方式中,与对照细胞相比,cs1的细胞表面表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。在所述方法的一些此类实施方式中,免疫细胞表达对cs1具有特异性的car。在所述方法进一步的此类实施方式中,与对照细胞相比,免疫细胞较不容易被表达对cs1具有特异性的car的遗传修饰的免疫细胞误杀。
127.在所述方法的一些此类实施方式中,shrnamir具有一种结构,其中:(a)随从链包含seq id no:21的核酸序列和引导链包含seq id no:22的核酸序列;(b)随从链包含seq id no:23的核酸序列和引导链包含seq id no:24的核酸序列;或者(c)随从链包含seq id no:25的核酸序列和引导链包含seq id no:26的核酸序列。在所述方法的某些此类实施方式中,随从链包含seq id no:25的核酸序列和引导链包含seq id no:26的核酸序列。在所述方法的特定此类实施方式中,shrnamir包含与seq id no:50具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的序列。在所述方法进一步的此类实施方式中,shrnamir包含seq id no:50的序列。
128.在所述方法的一些实施方式中,所述靶蛋白是tgfbr2。在所述方法的一些此类实施方式中,与对照细胞相比,tgfbr2的细胞表面表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。在所述方法进一步的此类实施方式中,与对照细胞相比,免疫细胞对转化生长因子b1(tgfb1)的免疫抑制较不敏感。
129.在所述方法的一些此类实施方式中,shrnamir具有一种结构,其中:(a)随从链包含seq id no:27的核酸序列和引导链包含seq id no:28的核酸序列;(b)随从链包含seq id no:29的核酸序列和引导链包含seq id no:30的核酸序列;(c)随从链包含seq id no:31的核酸序列和引导链包含seq id no:32的核酸序列;(d)随从链包含seq id no:33的核酸序列和引导链包含seq id no:34的核酸序列;或者(e)随从链包含seq id no:35的核酸序列和引导链包含seq id no:36的核酸序列。在所述方法的某些此类实施方式中,随从链包含seq id no:31的核酸序列和引导链包含seq id no:32的核酸序列。在所述方法的特定此类实施方式中,编码shrnamir的核酸序列包含与seq id no:53具有至少80%、至少85%、至少90%、至少95%或更高同一性的序列。在所述方法进一步的此类实施方式中,编码shrnamir的核酸序列包含seq id no:53的序列。
130.在所述方法的一些实施方式中,所述靶蛋白是cbl-b。在所述方法的一些此类实施方式中,与对照细胞相比,cbl-b的细胞表面表达cbl-b降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。在所述方法进一步的此类实施方式中,与对照细胞相比,免疫细胞较不易受下游信号传导蛋白降解而导致的t细胞受体(tcr)信号传导抑制的影响。
131.在所述方法的一些实施方式中,所述靶蛋白是cd52。在所述方法的一些此类实施方式中,与对照细胞相比,cd52的细胞表面表达降低至少约10%、约20%、约30%、约40%、
约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。在所述方法进一步的此类实施方式中,免疫细胞对cd52抗体诱导的细胞死亡较不敏感。
132.在所述方法的一些此类实施方式中,shrnamir具有一种结构,其中:(a)随从链包含seq id no:37的核酸序列和引导链包含seq id no:38的核酸序列;或者(b)随从链包含seq id no:39的核酸序列和引导链包含seq id no:40的核酸序列。在所述方法的某些此类实施方式中,随从链包含seq id no:37的核酸序列和引导链包含seq id no:38的核酸序列。在所述方法的特定此类实施方式中,编码shrnamir的核酸序列包含与seq id no:56具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的序列。在所述方法进一步的此类实施方式中,编码shrnamir的核酸序列包含seq id no:56的序列。
133.在所述方法的一些实施方式中,所述靶蛋白是dck。在一些此类实施方式中,与对照细胞相比,dck的细胞表面表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。在所述方法进一步的此类实施方式中,免疫细胞对嘌呤核苷酸类似物(例如,氟达拉滨)在细胞增殖上的影响较不敏感。
134.在所述方法的一些此类实施方式中,shrnamir具有一种结构,其中:(a)随从链包含seq id no:76的核酸序列和引导链包含seq id no:77的核酸序列;(b)随从链包含seq id no:78的核酸序列和引导链包含seq id no:79的核酸序列;(c)随从链包含seq id no:80的核酸序列和引导链包含seq id no:81的核酸序列;(d)随从链包含seq id no:82的核酸序列和引导链包含seq id no:83的核酸序列;或者(e)随从链包含seq id no:84的核酸序列和引导链包含seq id no:85的核酸序列。在所述方法的特定此类实施方式中,随从链包含seq id no:76的核酸序列和引导链包含seq id no:77的核酸序列。在所述方法的特定此类实施方式中,编码shrnamir的核酸序列包含与seq id no:86具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的序列。在所述方法进一步的此类实施方式中,编码shrnamir的核酸序列包含seq id no:86的序列。
135.在所述方法的一些实施方式中,所述靶蛋白是gr。在所述方法的一些此类实施方式中,与对照细胞相比,gr的细胞表面表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。在其他此类实施方式中,免疫细胞对糖皮质激素(例如,地塞米松)在细胞增殖上的影响较不敏感。
136.在所述方法的一些此类实施方式中,shrnamir具有一种结构,其中:(a)随从链包含seq id no:91的核酸序列和引导链包含seq id no:92的核酸序列;(b)随从链包含seq id no:93的核酸序列和引导链包含seq id no:94的核酸序列;(c)随从链包含seq id no:95的核酸序列和引导链包含seq id no:96的核酸序列;(d)随从链包含seq id no:97的核酸序列和引导链包含seq id no:98的核酸序列;(e)随从链包含seq id no:99的核酸序列和引导链包含seq id no:100的核酸序列;(f)随从链包含seq id no:101的核酸序列和引导链包含seq id no:102的核酸序列;(g)随从链包含seq id no:103的核酸序列和引导链包含seq id no:104的核酸序列;(h)随从链包含seq id no:105的核酸序列和引导链包含seq id no:106的核酸序列;或者(i)随从链包含seq id no:107的核酸序列和引导链包含
seq id no:108的核酸序列。在所述方法的特定此类实施方式中,随从链包含seq id no:95的核酸序列和引导链包含seq id no:96的核酸序列。在所述方法的特定此类实施方式中,编码shrnamir的核酸序列包含与seq id no:111具有至少80%、至少85%、至少90%、至少95%或更高序列同一性的序列。在所述方法进一步的此类实施方式中,编码shrnamir的核酸序列包含seq id no:111的序列。
137.在另一个方面中,本发明提供了通过根据本文所述的任何方法制备的免疫细胞。在一些实施方式中,通过所述方法制备的靶蛋白是β-2微球蛋白和免疫细胞降低β-2微球蛋白和/或mhc i类蛋白的细胞表面表达。在一些实施方式中,所述靶蛋白是cs1,并且通过所述方法制备的免疫细胞具有降低的cs1细胞表面表达。在一些实施方式中,所述靶蛋白是tgfrb2,并且通过所述方法制备的免疫细胞具有降低的tgfrb2细胞表面表达。在一些实施方式中,所述靶蛋白是cbl-b,并且通过所述方法制备的免疫细胞具有降低的cbl-b细胞表面表达。在一些实施方式中,所述靶蛋白是cd52,并且通过所述方法制备的免疫细胞具有降低的cd52细胞表面表达。在一些实施方式中,所述靶蛋白是dck,并且通过所述方法制备的免疫细胞具有降低的dck细胞表面表达。在一些实施方式中,所述靶蛋白是gr,并且通过所述方法制备的免疫细胞具有降低的gr细胞表面表达。
138.在另一个方面中,本发明提供了一种细胞群体,所述细胞群体包含本文所述的多个遗传修饰的免疫细胞或多个免疫细胞。在一些实施方式中,在所述群体中至少约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多100%的细胞是本文所述的遗传修饰的免疫细胞或本文所述的免疫细胞。
139.在另一个方面中,本发明提供了一种药物组合物,其包含药学上可接受的载体以及本文所述的多种遗传修饰的免疫细胞或本文所述的多种免疫细胞。在一些实施方式中,药物组合物包含本文所述的细胞群体。
140.在另一个方面中,本发明提供了一种用于在有需要的受试者中治疗疾病的免疫疗法的方法,所述方法包括向受试者施用有效量的本文所述的药物组合物。在一些实施方式中,所述方法是用于在有需要的受试者中治疗癌症的免疫疗法,其中所述遗传修饰的免疫细胞或所述免疫细胞是遗传修饰的人t细胞或其衍生的细胞,或者遗传修饰的nk细胞或其衍生的细胞,并且其中所述遗传修饰的免疫细胞或所述免疫细胞包含car或外源性tcr,其中所述car或所述外源性tcr包含对肿瘤特异性抗原具有特异性的胞外配体结合结构域。在所述方法的一些实施方式中,所述遗传修饰的免疫细胞或免疫细胞包含失活的tcrα基因或失活的tcrα恒定区基因。在所述方法的其他实施方式中,所述遗传修饰的免疫细胞或免疫细胞不具有可检测的内源性tcr(例如,α/βtcr)的细胞表面表达。在所述方法的一些实施方式中,癌症是选自以下的癌症:癌瘤、淋巴瘤、母细胞瘤和白血病。在所述方法的某些实施方式中,癌症选自以下:b细胞起源的癌症、乳腺癌、胃癌、神经母细胞瘤、骨肉瘤、肺癌、黑色素瘤、前列腺癌、结肠癌、肾细胞癌、卵巢癌、横纹肌肉瘤、白血病和霍奇金淋巴瘤。在所述方法的特定实施方式中,b细胞起源的癌症选自以下:b谱系急性淋巴母细胞性白血病、b细胞慢性淋巴细胞性白血病、b细胞非霍奇金氏淋巴瘤和多发性骨髓瘤。
141.在所述方法的特定实施方式中,受试者可以是哺乳动物,如人。
142.在另一个方面中,本发明提供了一种用于在有需要的受试者中治疗疾病(如癌症)的方法,其中所述方法包括向所述受试者施用治疗有效量的本文所述的任何遗传修饰的免
疫细胞(例如,表达car或外源性tcr的遗传修饰的人t细胞或nk细胞)群体,所述免疫细胞群体在其基因组中包含编码shrnamir的核酸序列,所述shrnamir降低内源性脱氧胞苷激酶(dck)的表达,其中在施用嘌呤核苷之前、期间或之后,向所述受试者施用遗传修饰的免疫细胞群体。shrnamir对dck表达的降低降低了嘌呤核苷对遗传修饰免疫细胞的增殖或体内持久性的影响。
143.在所述方法的特定实施方式中,施用遗传修饰的免疫细胞群体和嘌呤核苷,以使得当施用嘌呤核苷时,或者当嘌呤核苷以有效水平在受试者中存在时,在所述受试者中存在遗传修饰的免疫细胞(即,未被宿主清除)。在所述方法的一些实施方式中,嘌呤核苷是氟达拉滨。在所述方法的一些此类实施方式中,氟达拉滨单独施用或与另一种化疗化合物联合施用,作为免疫疗法的淋巴清除方案的一部分。
144.在所述方法的特定实施方式中,所述遗传修饰的免疫细胞是表达对靶向的癌细胞上的抗原具有特异性的car或外源性tcr的遗传修饰的人t细胞或遗传修饰的nk细胞。
145.在另一个方面中,本发明提供了一种用于在有需要的受试者中治疗疾病(如癌症)的方法,其中所述方法包括向所述受试者施用治疗有效量的本文所述的任何遗传修饰的免疫细胞(例如,表达car或外源性tcr的遗传修饰的人t细胞或nk细胞)群体,所述免疫细胞群体在其基因组中包含编码shrnamir的核酸序列,所述shrnamir降低内源性糖皮质激素受体(gr)的表达,其中在施用皮质类固醇之前、期间或之后,向所述受试者施用遗传修饰的免疫细胞群体。shrnamir对gr表达的降低降低了糖皮质激素对遗传修饰免疫细胞的增殖或体内持久性的影响。
146.在所述方法的特定实施方式中,施用遗传修饰的免疫细胞群体和糖皮质激素,以使得当施用糖皮质激素时,或者当糖皮质激素以有效水平在受试者中存在时,在所述受试者中存在遗传修饰的免疫细胞(即,未被宿主清除)。在所述方法的一些实施方式中,糖皮质激素是地塞米松或甲泼尼龙。在所述方法的一些此类实施方式中,糖皮质激素单独施用或与另一种化合物联合施用,作为免疫疗法期间减少细胞因子释放综合征的治疗的一部分。
147.在所述方法的特定实施方式中,所述遗传修饰的免疫细胞是表达对靶向的癌细胞上的抗原具有特异性的car或外源性tcr的遗传修饰的人t细胞或遗传修饰的nk细胞。
148.在另一个方面中,本发明提供了如本文所述的遗传修饰的免疫细胞或其群体,或者如本文所述的免疫细胞或其群体用作药物的用途。本发明还提供了如本文所述的遗传修饰的免疫细胞或其群体或者如本文所述的免疫细胞或其群体在制备用于在有需要的受试者中治疗疾病的药物中的用途。在一个此类方法中,所述药物是用于治疗癌症的。
149.在另一个方面中,本发明提供了如本文所述的遗传修饰的细胞或其群体或者如本文所述的免疫细胞或其群体用于治疗疾病的用途,优选地用于治疗癌症。
附图说明
150.图1显示了用包含构建体7056的aav转到的t细胞上的β-2微球蛋白表达或hla-a、b和c表达(即,mhc i类分子表达),所述构建体7056表达单一拷贝的shrna472(3’到5’头到尾配置)和car。图1a显示了与来自对照培养物的不表达shrna的大范围核酸酶标记的细胞相比在cd3-/car+细胞中的b2m表面水平。图1b显示了在相同培养物中的cd3-/car+对比cd3+/car-群体上的b2m水平。图1c显示了与来自对照培养物的不表达shrna的大范围核酸酶标记
的细胞相比在cd3-/car+细胞中的hla-abc(即,mhc i类分子)表面水平。图1d显示了在相同培养物中的cd3-/car+对比cd3+/car-群体上的hla-abc水平。
151.图2显示了使用aav 7056产生的培养物中cd3-/car+细胞的频率和b2m的敲低。图2a显示了在第4天时cd3-/car+细胞的频率。图2b显示了在第4天时b2m的敲低。图2c显示了在第7天时cd3-/car+细胞的频率。图2d显示了在第7天时b2m的敲低。图2e显示了在第10天时cd3-/car+细胞的频率。图2f显示了在第10天时b2m的敲低。
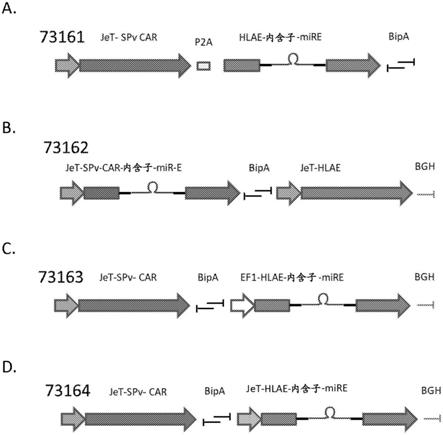
152.图3显示了转导后三天使用aav 7206、aav 7056或aav 7282产生的培养物中cd3-/car+细胞的频率和b2m的敲低。图3a显示了在7206转导的细胞中cd3-/car+细胞的频率。图3b显示了在7206转导的细胞中b2m的敲低。图3c显示了在7282转导的细胞中cd3-/car+细胞的频率。图3d显示了在7282转导的细胞中b2m的敲低。图3e显示了在7056转导的细胞中cd3-/car+细胞的频率。图3f显示了在7056转导的细胞中b2m的敲低。
153.图4显示了转导后七天使用aav 7206、aav 7056或aav 7282产生的培养物中cd3-/car+细胞的频率和b2m的敲低。图4a显示了在7206转导的细胞中cd3-/car+细胞的频率。图4b显示了在7206转导的细胞中b2m的敲低。图4c显示了在7282转导的细胞中cd3-/car+细胞的频率。图4d显示了在7282转导的细胞中b2m的敲低。图4e显示了在7056转导的细胞中cd3-/car+细胞的频率。图4f显示了在7056转导的细胞中b2m的敲低。
154.图5显示了转导后十一天使用aav 7206、aav 7056或aav 7282产生的培养物中cd3-/car+细胞的频率和b2m的敲低。图5a显示了在7206转导的细胞中cd3-/car+细胞的频率。图5b显示了在7206转导的细胞中b2m的敲低。图5c显示了在7282转导的细胞中cd3-/car+细胞的频率。图5d显示了在7282转导的细胞中b2m的敲低。图5e显示了在7056转导的细胞中cd3-/car+细胞的频率。图5f显示了在7056转导的细胞中b2m的敲低。
155.图6显示了b2m敲除或敲低对car t细胞对同种异体抗原特异性细胞毒性淋巴细胞(ctl)或nk细胞的细胞溶解敏感性的影响。图6a显示了激发的同种异体抗原特异性ctl对b2m敲除和b2m敲低car t细胞群体的细胞溶解活性。图6b显示了nk细胞对b2m敲除和b2m敲低car t细胞群体的细胞溶解活性。
156.图7显示了使用工程化大范围核酸酶敲除b2m并靶向插入包含hla-e多肽编码序列的供体模板。图7a显示了无靶向插入的b2m敲除。图7b显示了使用aav7346对供体模板进行b2m敲除和靶向插入。
157.图8显示了具有b2m敲除和由插入的供体模板编码的hla-e的细胞表面表达的t细胞群体的纯化。图8a显示了b2m阴性的细胞群体。图8b显示了纯化的b2m阴性群体。图8c显示了hla-e阳性的细胞群体。图8d显示了纯化的hla-e阳性细胞群体。
158.图9显示了由同种异体抗原激发的ctl的car t细胞杀伤作用和由自然杀伤(nk)细胞的细胞杀伤作用。图9a显示了以增加的效应物:靶点比率的同种异体抗原激发的ctl的b2m阳性、b2m敲除和b2m敲除/hla-e敲入的car t细胞的杀伤作用。图9b显示了以增加的效应物:靶点比率的b2m阳性、b2m敲除和b2m敲除/hla-e敲入的car t细胞的nk细胞杀伤作用。
159.图10显示了在car t细胞中shrnamir诱导的b2m敲低的体内有效性和稳定性。图10a显示了在移植nalm-6细胞并使用载剂治疗(显示为带有三角的黑线)的小鼠,用cd19导向的car t细胞治疗的小鼠(显示为带有圆圈的深灰色线)或者用cd19导向的car t细胞(该细胞具有整合的b2m靶向shrnamir)处理的小鼠(显示为带有三角的浅灰色线)中随着时间
的推移的总通量的生物发光图像。图10b显示了施用具有整合的b2m靶向shrnamir的cd19导向的car t细胞(显示为浅灰色直方图)或对照cd19导向的car t细胞(显示为深灰色直方图)后14天在人cd45+细胞上针对b2m表达的流式细胞术染色。
160.图11显示了在car t细胞中shrnamir诱导的cs1的稳定敲低。将针对cs1/slamf7 shrnamir的三个候选引导链和随从链序列构建到mir-e支架中,并且位于bcma特异性car的终止密码子之后。将构建体命名为aav72101-72103并用于供体t细胞的转导。图11a显示了在用编码bcma car而非shrnamir构建体的aav转导后7天的car和cs1染色。图11b显示了用aav 72101转导后7天的car和cs1染色。图11c显示了用aav 72102转导后7天的car和cs1染色。图11d显示了用aav 72103转导后7天的car和cs1染色。
161.图12显示了在car t细胞中shrnamir诱导的tgfrb2的稳定敲低。将针对tgfbr2 shrnamir的多个候选引导链和随从链序列构建到mir-e支架中,并且位于cd19特异性car的终止密码子之后。将构建体命名为aav 72110-72114并用于供体t细胞的转导。图12a显示了模拟转导后的car和tgfbr2染色。图12b显示了用aav 72110转导后第14天时的car和tgfbr2染色。图12c显示了用aav 72111转导后第14天时的car和tgfbr2染色。图12d显示了用aav 72112转导后第14天时的car和tgfbr2染色。图12e显示了用aav 72113转导后第14天时的car和tgfbr2染色。图12f显示了用aav 72114转导后第14天时的car和tgfbr2染色。
162.图13显示了检测使用两种工程化大范围核酸酶在t细胞中敲除tgfbr2的流式细胞术。图13a显示了阴性染色对照。图13b显示了模拟转染的t细胞。图13c显示了使用编码tgf 1-2x.5大范围核酸酶的mrna转染的t细胞。图13d显示了使用tgf 1-2l.296大范围核酸酶编码的mrna转染的t细胞。
163.图14显示了针对使用tgfb1处理的tgfbr2阳性和阴性t细胞中磷酸化的smad 2/3的流式细胞术染色。
164.图15显示了针对在tgfbr2阳性car t细胞、表达抗tgfbr2shrnamir以敲低蛋白表达的car t细胞和使用工程化大范围核酸酶处理以敲除tgfbr2表达的t细胞中磷酸化的smad 2/3的流式细胞术。
165.图16显示了针对在未处理的对照bcma car t细胞(a),使用tgfβ1处理的bcma car t细胞(b),使用tgfβ1处理的bcma car t细胞,其具有使用tgf 1-2l.296大范围核酸酶的tgfbr2敲除(c)或使用72112tgfbr2 shrnamir的tgfbr2敲低(d)中磷酸化的smad 2/3的流式细胞术。
166.图17显示了使用正常k562细胞,转染以稳定表达bcma(kbcma)的k562细胞或者稳定表达bcma并组成型分泌活性tgfβ1(kbcma-tgf)的k562细胞共培养后,随着时间的推移的bcma car t细胞数量。使用shrnamir对bcma car t细胞进行修饰以敲低tgfbr2(tgfbrkd)或使用shrnamir对bcma car t细胞进行修饰以敲低b2m(ctrlkd)。
167.图18显示了将bcma car t细胞与转染以稳定表达bcma(kbcma)的k562细胞或者稳定表达bcma并组成型分泌活性tgfβ1(kbcma-tgf)的k562细胞共培养后,随着时间的推移的靶细胞数量。使用shrnamir对bcma car t细胞进行修饰以敲低tgfbr2(tgfbrkd)或使用shrnamir对bcma car t细胞进行修饰以敲低b2m(ctrlkd)。
168.图19显示了使用正常k562细胞,转染以稳定表达bcma的k562细胞或者稳定表达bcma并组成型分泌活性tgfβ1的k562细胞共培养后,随着时间的推移的bcma car t细胞数
量。使用shrnamir对bcma car t细胞进行修饰以敲低tgfbr2(72154),使用shrnamir对bcma car t细胞进行修饰以敲低b2m(72155),或使用工程化大范围核酸酶对bcma car t细胞进行修饰以敲除tgfbr2(dko)。
169.图20显示了使用转染以稳定表达bcma的k562细胞或者稳定表达bcma并组成型分泌活性tgfβ1的k562细胞共培养后,随着时间的推移的bcma car t细胞的cd4:cd8比率。使用shrnamir对bcma car t细胞进行修饰以敲低tgfbr2(72154),使用shrnamir对bcma car t细胞进行修饰以敲低b2m(72155),或使用工程化大范围核酸酶对bcma car t细胞进行修饰以敲除tgfbr2(dko)。
170.图21显示了使用正常u266细胞或者组成型分泌活性tgfβ1的u266细胞共培养后,随着时间的推移的bcma car t细胞数量。使用shrnamir对bcma car t细胞进行修饰以敲低tgfbr2(72154),使用shrnamir对bcma car t细胞进行修饰以敲低b2m(72155),或使用工程化大范围核酸酶对bcma car t细胞进行修饰以敲除tgfbr2(dko)。
171.图22显示了使用u266细胞或者组成型分泌活性tgfβ1的u266细胞共培养后,随着时间的推移的bcma car t细胞数量。使用shrnamir对bcma car t细胞进行修饰以敲低tgfbr2(72154),使用shrnamir对bcma car t细胞进行修饰以敲低b2m(72155),或使用工程化大范围核酸酶对bcma car t细胞进行修饰以敲除tgfbr2(dko)。
172.图23显示了在与u266细胞的共培养中在不同时间点时cd4+ car t细胞数量的流式细胞术图。图23a显示了引入72154构建体的car t细胞。图23b显示了引入72155构建体的car t细胞。图23c显示了具有敲入b2m基因的hla-e融合蛋白的car t细胞。
173.图24显示了使用bcma car t细胞变体共培养16天后存活和死亡u266细胞的流式细胞术图。图24a显示了u266细胞与bcma car t细胞的共培养,所述bcma car t细胞使用shrnamir修饰以敲低tgfbr2(tgfbrkd)。图24b显示了u266细胞与bcma car t细胞的共培养,所述bcma car t细胞使用shrnamir修饰以敲低b2m(ctrl kd)。图24c显示了u266细胞与bcma car t细胞的共培养,所述bcma car t细胞使用工程化大范围核酸酶修饰以敲除tgfbr2(tgfbr ko)。图24d显示了分泌活性tgfβ1的u266细胞与bcma car t细胞的共培养,所述bcma car t细胞使用shrnamir修饰以敲低tgfbr2(tgfbrkd)。图24e显示了分泌活性tgfβ1的u266细胞与bcma car t细胞的共培养,所述bcma car t细胞使用shrnamir修饰以敲低b2m(ctrl kd)。图24f显示了分泌活性tgfβ1的u266细胞与bcma car t细胞的共培养,所述bcma car t细胞使用工程化大范围核酸酶修饰以敲除tgfbr2(tgfbr ko)。
174.图25显示了在car t细胞中shrnamir诱导的cd52的稳定敲低。将针对cd52 shrnamir的多个候选引导链和随从链序列构建到mir-e支架中,并且位于cd19特异性car的终止密码子之后。将构建体命名为aav 72123和aav 72124,并用于供体t细胞的转导。图25a显示了aav转导后cd3-/car+ t细胞群体的染色。图25b显示了aav 72123转导后10天cd3-/car+ t细胞中cd52的敲低。图25c显示了aav 72124转导后10天cd3-/car+ t细胞中cd52的敲低。
175.图26显示了在表达b2m靶向shrnamir和cd52靶向shrnamir的t细胞中针对b2m和cd52的流式细胞术染色。
176.图27显示了表达b2m靶向shrnamir和cd52靶向shrnamir的car t群体的cd52耗竭后恢复的car+ t细胞百分比。
177.图28显示了构建体73161、73162、73163和73164的示意图。图28a显示了构建体73161,其包含jet启动子、cd19 car基因、p2a/弗林蛋白酶位点、包含含有b2m靶向shrnamir的合成内含子的hla-e基因和sv40双向polya序列。图28b显示了构建体73162,其包含jet启动、包含含有b2m靶向shrnamir的合成内含子的cd19 car基因、sv40双向polya序列、第二jet启动子、hla e基因和牛生长激素(bgh)终止信号。图28c显示了构建体73163,其包含jet启动子、cd19 car基因、sv40双向polya序列、ef1α核心启动子、包含含有b2m靶向shrnamir的合成内含子的hla-e基因和bgh终止信号。图28d显示了73164构建体,其包含jet启动子、cd19 car基因、sv40双向polya序列、第二jet启动子、包含含有b2m靶向shrnamir的合成内含子的hla-e基因和bgh终止信号。
178.图29显示了总结t细胞或细胞的car表型的表格,在所述t细胞中将鉴定的构建体由aav引入并仅插入trac基因座(7206和73161-73164),或者在所述细胞中在trac基因座中插入car基因并且在b2m基因座中插入hla-e基因(dko dki)。该表格提供了cd3-/car+细胞的百分比、具有car敲入的cd3敲除细胞的百分比、表达的car的平均荧光强度(mfi),以及当与使用7206构建体引入的car比较时每种car的mfi的比较。
179.图30显示了总结t细胞或细胞的hla-abc和hla-e表型的表格,在所述t细胞中将鉴定的构建体由aav引入并仅插入trac基因座(7206和73161-73164),或者在所述细胞中在trac基因座中插入car基因并且在b2m基因座中插入hla-e基因(dko dki)。该表格提供了cd3-/car+群体中hla-abc表达与野生型相比的百分比、野生型门控后hla-abc敲低的百分比、cd3-/car+群体中表达hla-e的细胞的百分比、此类细胞中hla-e表达的mfi,以及car-群体中hla-e+的细胞百分比。
180.图31显示了总结car t细胞或细胞的特征的表格,在所述t细胞中将鉴定的构建体由aav引入并仅插入trac基因座(7206和73161-73164),或者在所述细胞中在trac基因座中插入car基因并且在b2m基因座中插入hla-e基因(dko dki)。
181.图32显示了用来自第一供体(hc6366)的t细胞制备的cd19car t变体在与来自两个不同供体(k3212或k2916)的同种异体抗原引发的ctl共培养时的细胞溶解作用。图32a显示了由k3212同种异体引发的ctl的car t细胞的杀伤作用。图32b显示了由k2916同种异体引发的ctl的car t细胞的杀伤作用。
182.图33显示了以1:1比率在多个时间点的共培养中cd19 car t变体的自然杀伤(nk)细胞的细胞溶解作用。图33a显示了在24小时的细胞溶解作用。图33b显示了在48小时的细胞溶解作用。图33c显示了在120小时的细胞溶解作用。
183.图34显示了发光测量结果,证明了cd19 car t变体在移植了nalm/6白血病细胞的免疫缺陷小鼠中的体内有效性。
184.图35显示了用cd19 car t变体处理的nalm/6白血病细胞移植的免疫缺陷小鼠的存活率。
185.图36显示了在与不同浓度氟达拉滨孵育后在cd3敲除t细胞中,在使用或不使用dck shrnamir条件下的cd19 car序列的敲入百分比的变化。
186.图37显示了使用包含或不包含dck shrnamir的cd19 car t细胞变体孵育的事件/ul的cd3-/car+群体对氟达拉滨浓度。
187.图38显示了在包含或不包含dck shrnamir的不同car t细胞变体和不同浓度氟达
拉滨处理后第4天时的活细胞数/ml。
188.图39显示了在包含或不包含dck shrnamir的不同car t细胞变体和不同浓度氟达拉滨处理后第8天时的活细胞数/ml。
189.图40显示了在存在不同浓度氟达拉滨的条件下与缺乏dck shrnamir的cd19 car t细胞(效应物)共培养的表达cd19的hek293细胞(靶点)的细胞溶解百分比。细胞以2:1、1:2和1:4的e:t比共培养。
190.图41显示了在存在不同浓度氟达拉滨的条件下与包含dck shrnamir的cd19 car t细胞(效应物)(72138)共培养的表达cd19的hek293细胞(靶点)的细胞溶解百分比。细胞以2:1、1:2和1:4的e:t比共培养。
191.图42显示了在存在不同浓度氟达拉滨的条件下与包含dck shrnamir的cd19 car t细胞(效应物)(721386)共培养的表达cd19的hek293细胞(靶点)的细胞溶解百分比。细胞以2:1、1:2和1:4的e:t比共培养。
192.图43显示了在使用不同浓度地塞米松孵育后在cd3敲除t细胞中在使用或不使用gr shrnamir条件下的cd19 car序列的敲入百分比的变化。
193.图44显示了使用包含或不包含gr shrnamir的cd19 car t细胞变体孵育的事件/ul的cd3-/car+群体对地塞米松浓度。
194.序列说明
195.seq id no:1显示了5’mir-e支架结构域编码序列的核酸序列。
196.seq id no:2显示了5’mir-e基干结构域编码序列的核酸序列。
197.seq id no:3显示了mir-30a环结构域编码序列的核酸序列。
198.seq id no:4显示了3’mir-e基干结构域编码序列的核酸序列。
199.seq id no:5显示了3’mir-e支架结构域编码序列的核酸序列。
200.seq id no:6显示了编码shrna 472的核酸序列。
201.seq id no:7显示了编码7282 β-2微球蛋白(b2m)shrnamir的随从链的核酸序列。
202.seq id no:8显示了编码7282 b2m shrnamir的引导链的核酸序列。
203.seq id no:9显示了编码7285 b2m shrnamir的随从链的核酸序列。
204.seq id no:10显示了编码7285 b2m shrnamir的引导链的核酸序列。
205.seq id no:11显示了编码7286 b2m shrnamir的随从链的核酸序列。
206.seq id no:12显示了编码7286 b2m shrnamir的引导链的核酸序列。
207.seq id no:13显示了编码7287 b2m shrnamir的随从链的核酸序列。
208.seq id no:14显示了编码7287 b2m shrnamir的引导链的核酸序列。
209.seq id no:15显示了编码7288 b2m shrnamir的随从链的核酸序列。
210.seq id no:16显示了编码7288 b2m shrnamir的引导链的核酸序列。
·
211.seq id no:17显示了编码7289 b2m shrnamir的随从链的核酸序列。
212.seq id no:18显示了编码7289 b2m shrnamir的引导链的核酸序列。
213.seq id no:19显示了编码7290 b2m shrnamir的随从链的核酸序列。
214.seq id no:20显示了编码7290 b2m shrnamir的引导链的核酸序列。
215.seq id no:21显示了编码72101 cs1 shrnamir的随从链的核酸序列。
216.seq id no:22显示了编码72101 cs1 shrnamir的引导链的核酸序列。
217.seq id no:23显示了编码72102 cs1 shrnamir的随从链的核酸序列。
218.seq id no:24显示了编码72102 cs1 shrnamir的引导链的核酸序列。
219.seq id no:25显示了编码72103 cs1 shrnamir的随从链的核酸序列。
220.seq id no:26显示了编码72103 cs1 shrnamir的引导链的核酸序列。
221.seq id no:27显示了编码72110转化生长因子β受体2(tgfbr2)shrnamir的随从链的核酸序列。
222.seq id no:28显示了编码72110 tgfbr2 shrnamir的引导链的核酸序列。
223.seq id no:29显示了编码72111 tgfbr2 shrnamir的随从链的核酸序列。
224.seq id no:30显示了编码72111 tgfbr2 shrnamir的引导链的核酸序列。
225.seq id no:31显示了编码72112 tgfbr2 shrnamir的随从链的核酸序列。
226.seq id no:32显示了编码72112 tgfbr2 shrnamir的引导链的核酸序列。
227.seq id no:33显示了编码72113 tgfbr2 shrnamir的随从链的核酸序列。
228.seq id no:34显示了编码72113 tgfbr2 shrnamir的引导链的核酸序列。
229.seq id no:35显示了编码72114 tgfbr2 shrnamir的随从链的核酸序列。
230.seq id no:36显示了编码72114 tgfbr2 shrnamir的引导链的核酸序列。
231.seq id no:37显示了编码72123 cd52 shrnamir的随从链的核酸序列。
232.seq id no:38显示了编码72123 cd52 shrnamir的引导链的核酸序列。
233.seq id no:39显示了编码72124 cd52 shrnamir的随从链的核酸序列。
234.seq id no:40显示了编码72124 cd52 shrnamir的引导链的核酸序列。
235.seq id no:41显示了编码7282 b2m shrnamir的核酸序列。
236.seq id no:42显示了编码7285 b2m shrnamir的核酸序列。
237.seq id no:43显示了编码7286 b2m shrnamir的核酸序列。
238.seq id no:44显示了编码7287 b2m shrnamir的核酸序列。
239.seq id no:45显示了编码7288 b2m shrnamir的核酸序列。
240.seq id no:46显示了编码7289 b2m shrnamir的核酸序列。
241.seq id no:47显示了编码7290 b2m shrnamir的核酸序列。
242.seq id no:48显示了编码72101 cs1 shrnamir的核酸序列。
243.seq id no:49显示了编码72102 cs1 shrnamir的核酸序列。
244.seq id no:50显示了编码72103 cs1 shrnamir的核酸序列。
245.seq id no:51显示了编码72110 tgfbr2 shrnamir的核酸序列。
246.seq id no:52显示了编码72111 tgfbr2 shrnamir的核酸序列。
247.seq id no:53显示了编码72112 tgfbr2 shrnamir的核酸序列。
248.seq id no:54显示了编码72113 tgfbr2 shrnamir的核酸序列。
249.seq id no:55显示了编码72114 tgfbr2 shrnamir的核酸序列。
250.seq id no:56显示了编码72123 cd52 shrnamir的核酸序列。
251.seq id no:57显示了编码72124 cd52 shrnamir的核酸序列。
252.seq id no:58显示了trc 1-2识别序列的核酸序列(正义)。
253.seq id no:59显示了trc 1-2识别序列的核酸序列(反义)。
254.seq id no:60显示了b2m 13-14识别序列的核酸序列(正义)。
255.seq id no:61显示了b2m 13-14识别序列的核酸序列(反义)。
256.seq id no:62显示了tgf 1-2识别序列的核酸序列(正义)。
257.seq id no:63显示了tgf 1-2识别序列的核酸序列(反义)。
258.seq id no:64显示了tgf 1-2x.5大范围核酸酶的氨基酸序列。
259.seq id no:65显示了tgf 1-2l.296大范围核酸酶的氨基酸序列。
260.seq id no:66显示了hla i类组织相容性抗原α链e(hla-e)融合多肽的氨基酸序列。
261.seq id no:67显示了jet启动子的核酸序列。
262.seq id no:68显示了双向sv40 polya信号的核酸序列。
263.seq id no:69显示了合成内含子的核酸序列。
264.seq id no:70显示了p2a/弗林蛋白酶位点的核酸序列。
265.seq id no:71显示了牛生长激素终止信号的核酸序列。
266.seq id no:72显示了ef1α核心启动子的核酸序列。
267.seq id no:73显示了信号肽的氨基酸序列。
268.seq id no:74显示了构建体73161所包含的盒的核酸序列。
269.seq id no:75显示了构建体73163所包含的盒的核酸序列。
270.seq id no:76显示编码了72136 dck shrnamir的随从链的核酸序列。
271.seq id no:77显示了编码72136 dck shrnamir的引导链的核酸序列。
272.seq id no:78显示了编码72137 dck shrnamir的随从链的核酸序列。
273.seq id no:79显示了编码72137 dck shrnamir的引导链的核酸序列。
274.seq id no:80显示了编码72138 dck shrnamir的随从链的核酸序列。
275.seq id no:81显示了编码72138 dck shrnamir的引导链的核酸序列。
276.seq id no:82显示了编码72139 dck shrnamir的随从链的核酸序列。
277.seq id no:83显示了编码72139 dck shrnamir的引导链的核酸序列。
278.seq id no:84显示了编码72140 dck shrnamir的随从链的核酸序列。
279.seq id no:85显示了72140 dck shrnamir的引导链的核酸序列。
280.seq id no:86显示了编码72136 dck shrnamir的核酸序列。
281.seq id no:87显示了编码72137 dck shrnamir的核酸序列。
282.seq id no:88显示了编码72138 dck shrnamir的核酸序列。
283.seq id no:89显示了编码72139 dck shrnamir的核酸序列。
284.seq id no:90显示了编码72140 dck shrnamir的核酸序列。
285.seq id no:91显示了编码72142 gr shrnamir的随从链的核酸序列。
286.seq id no:92显示了编码72142 gr shrnamir的引导链的核酸序列。
287.seq id no:93显示了编码72143 gr shrnamir的随从链的核酸序列。
288.seq id no:94显示了编码72143 gr shrnamir的引导链的核酸序列。
289.seq id no:95显示了编码72145 gr shrnamir的随从链的核酸序列。
290.seq id no:96显示了编码72145 gr shrnamir的引导链的核酸序列。
291.seq id no:97显示了编码72146 gr shrnamir的随从链的核酸序列。
292.seq id no:98显示了编码72146 gr shrnamir的引导链的核酸序列。
293.seq id no:99显示了编码72148 gr shrnamir的随从链的核酸序列。
294.seq id no:100显示了编码72148 gr shrnamir的引导链的核酸序列。
295.seq id no:101显示了编码72149 gr shrnamir的随从链的核酸序列。
296.seq id no:102显示了编码72149 gr shrnamir的引导链的核酸序列。
297.seq id no:103显示了编码72150 gr shrnamir的随从链的核酸序列。
298.seq id no:104显示了编码72150 gr shrnamir的引导链的核酸序列。
299.seq id no:105显示了编码72151 gr shrnamir的随从链的核酸序列。
300.seq id no:106显示了编码72151 gr shrnamir的引导链的核酸序列。
301.seq id no:107显示了编码72152 gr shrnamir的随从链的核酸序列。
302.seq id no:108显示了编码72152 gr shrnamir的引导链的核酸序列。
303.seq id no:109显示了编码72142 gr shrnamir的核酸序列。
304.seq id no:110显示了编码72143 gr shrnamir的核酸序列。
305.seq id no:111显示了编码72145 gr shrnamir的核酸序列。
306.seq id no:112显示了编码72146 gr shrnamir的核酸序列。
307.seq id no:113显示了编码72148 gr shrnamir的核酸序列。
308.seq id no:114显示了编码72149 gr shrnamir的核酸序列。
309.seq id no:115显示了编码72150 gr shrnamir的核酸序列。
310.seq id no:116显示了编码72151 gr shrnamir的核酸序列。
311.seq id no:117显示了编码72152 gr shrnamir的核酸序列。
312.seq id no:118显示了hla-e-01:03蛋白的氨基酸序列。
313.seq id no:119显示了β-2微球蛋白蛋白的氨基酸序列。
314.seq id no:120显示了hla-g前导肽的氨基酸序列。
315.seq id no:121显示了(ggggs)3接头肽的氨基酸序列。
316.seq id no:122显示了(ggggs)4接头肽的氨基酸序列。
317.seq id no:123显示了来自莱茵衣藻(chlamydomonas reinhardtii)的野生型i-crei归巢核酸内切酶的氨基酸序列。
具体实施方式
318.1.1引用和定义
319.本文引用的专利和科学文献建立了本领域技术人员可用的知识。本文引用的授权美国专利、授权申请、公开的外国申请和包括genbank数据库序列的参考文献通过引用并入本文,引用程度如同每一个被具体和单独地指出以通过引用并入。
320.本发明可以以不同的形式实施,并且不应该被解释为限于本文列出的实施方式。相反,提供这些实施方式以使本公开内容详细和完整,并将本发明的范围充分传达给本领域技术人员。例如,关于一个实施方式示出的特征可以被并入其他实施方式中,并且关于特定实施方式示出的特征可以从该实施方式中删除。此外,根据本公开内容,对本文提出的实施方式的许多变化和添加对于本领域技术人员将是明显的,其不脱离本发明。
321.除非另外定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。在本发明的说明书中使用的术语仅用于描述特定实施
方式的目的,而不旨在限制本发明。
322.本文提及的所有出版物、专利申请、专利和其他参考文献通过引用整体并入本文。
323.如本文所用,“一个(a)”、“一种(an)”或“该(the)”可以指一个或多于一个。例如,“一个”细胞可以指单个细胞或多个细胞。
324.如本文所用,除非另外特别指出,否则词语“或”以“和/或”的包含性含义使用,而不是“任一/或”的排他性含义。
325.如本文所用,与核苷酸序列或氨基酸序列相关的术语“外源的”或“异源的”旨在指纯合成的、源自外来物种的序列,或者,如果来自同一物种,则在组成和/或基因组基因座上通过故意的人工干预从其天然形式进行实质性修改。
326.如本文所用,涉及核苷酸序列或蛋白的术语“内源性”旨在指天然包含在细胞内或由细胞表达的序列或蛋白。
327.如本文所用,术语“核酸酶”和“核酸内切酶”可互换使用,指切割多核苷酸链内的磷酸二酯键的天然存在的或工程化的酶。
328.如本文所用,术语“shrna”或“短发夹rna”指包含发夹的人工rna分子,其可用于通过rna干扰使基因表达沉默。
329.如本文所用,术语“mirna”或“microrna”或“mir”是指成熟的microrna(mirna),其内源性编码约22nt长的rna,可在转录后降低靶基因的表达。mirna存在于植物、动物和一些病毒中,通常以高度组织或发育阶段特异性方式表达。
[0330]“茎-环结构”是指具有二级结构的核酸,所述二级结构包括已知或预测形成双链(茎部分)的核苷酸区域,该区域连接在主要为单链核苷酸区域(环部分)的一侧。在一些情况下,环也可能非常短,因此无法被dicer识别,导致产生独立于dicer的shrna(与内源性mir0431相比)。术语“发夹”在本文中也用于指代茎环结构。只要二级结构存在,茎环结构内核苷酸的实际一级序列对描述的实践并不重要。如本领域所公知的,二级结构不需要精确的碱基配对。因此,茎可以包含一个或多个碱基错配。或者,碱基配对可以是精确的(即,不包含任何错配)。
[0331]
如本文所用,术语“shrnamir”和“microrna适应的shrna”指嵌入在microrna支架内的shrna序列。shrnamir分子模拟天然存在的pri-mirna分子,因为其包含一个发夹,两侧是有效加工所需的序列,并且其可以被drosha酶加工成pre-mirna,输出到胞质中,并被dicer切割,然后成熟的mirna可以进入risc。microrna支架可以源自天然存在的microrna、pre-mirna或pri-mirna或者其变体。在一些实施方式中,shrnamir所基于的shrna序列与mirna(长度为22个核苷酸)的长度不同,因此必须修改mirna支架以适应更长或更短的shrna序列长度。
[0332]
如本文所用,术语“microrna侧翼序列”指包含microrna加工元件的核苷酸序列。microrna加工元件是有助于从初级microrna或前体microrna产生成熟microrna的最小核酸序列。通常,这些元件位于microrna茎环结构侧翼的40个核苷酸序列内。在一些情况下,microrna加工元件位于microrna茎环结构侧翼的长度在5至4,000个核苷酸之间的一段核苷酸序列内。shrnamir分子中使用的microrna侧翼序列可以是天然存在的序列侧翼天然存在的microrna或其变体。microrna侧翼序列包括mir支架结构域和mir基干结构域。
[0333]
用于本公开的组合物和方法的shrnamir分子可以在5’至3’定向包含:(a)5’mir支
架结构域;(b)5’mir基干结构域;(c)随从链;(d)mir环结构域;(e)引导链;(f)3’mir基干结构域;和(g)3’mir支架结构域。
[0334]
如本文所用,术语“mir支架结构域”是指与shrnamir相关的核苷酸序列,该核苷酸序列可以位于shrnamir分子中microrna或shrna的5’或3’末端的侧翼,并且可以衍生自天然存在的侧翼microrna序列或其变体。在通常情况下,mir基干结构域序列分隔shrna序列(随从链和引导链,以及mir环结构域)和支架结构域。5’mir支架结构域可以在或接近其3’末端包含限制性酶(例如,iis限制性酶)识别序列和3’mir支架结构域可以在或接近其5’末端包含限制性酶识别序列,从而便于shrna序列的插入。在一些实施方式中,mir支架结构域的二级结构比其实际序列更重要。
[0335]
如本文所用,与shrnamir相关的术语“mir基干结构域”指紧接随从链和引导链的包含随从:引导双螺旋下发夹茎的基部的序列。因此,5’和3’mir基干结构域的序列彼此之间是互补的(完全或部分)。在一些实施方式中,5’和3’mir基干结构域包含当杂交在一起时形成两个错配泡的序列,每个错配泡包含一个或两个错配碱基对。
[0336]
如本文所用,与shrnamir相关的术语“随从链”指与引导序列互补(完全或部分)的shrnamir序列。
[0337]
如本文所用,与shrnamir相关的术语“引导链”指与需要降低表达的靶mrna序列互补(完全或部分)的shrnamir序列。
[0338]
如本文所用,与shrnamir相关的“mir环结构域”指shrnamir的随从:引导双螺旋一端的单链环序列。mir环结构域可以来源于天然存在的前体microrna环序列或其变体。
[0339]
如本文所用,术语“切割”或“切割的”指靶序列内识别序列骨架内磷酸二酯键的水解,导致靶序列内的双链断裂,本文中称为“切割位点”。
[0340]
如本文所用,术语“大范围核酸酶”指在大于12个碱基对的识别序列处结合双链dna的核酸内切酶。在一些实施方式中,针对本公开内容的大范围核酸酶的识别序列是22个碱基对。大范围核酸酶可以是来源于i-crei(seq id no:123)的核酸内切酶,并且可以指相对于天然i-crei已被修饰的i-crei的工程化变体,例如,针对dna结合特异性、dna切割活性、dna结合亲和性或二聚化性质。生产此类修饰的i-crei变体的方法是本领域公知的(例如,wo2007/047859,通过引用整体并入)。如本文所用的大范围核酸酶作为异二聚体结合至双链dna。大范围核酸酶也可以是“单链大范围核酸酶”,其中一对dna结合结构域使用肽接头连接成单个多肽。术语“归巢核酸内切酶”与术语“大范围核酸酶”同义。本公开内容的大范围核酸酶当在细胞中表达时,尤其是在人免疫细胞中表达时,其基本上是无毒的,这样当使用本文所述的方法测量时,细胞可以被转染并维持在37℃而不会观察到对细胞活力的有害影响或大范围酶切割活性的显着降低。
[0341]
如本文所用,术语“单链大范围核酸酶”指包含通过接头连接的核酸酶亚基对。单链大范围核酸酶具有以下组织:n-末端亚基-接头-c-末端亚基。两个大范围核酸酶亚基的氨基酸序列通常将是不同的,并且将结合不同dna序列。因此,单链大范围核酸酶通常切割伪回文或非回文识别序列。可以将单链大范围核酸酶称为“单链异二聚体”或“单链异二聚体大范围核酸酶”,但其实际上不是二聚体。为清楚起见,除非另有说明,否则术语“大范围核酸酶”可以指二聚体或单链大范围核酸酶。
[0342]
如本文所用,术语“接头”指用于将两个核酸酶亚基连接成单个多肽的外源肽序
列。接头可具有在天然蛋白质中发现的序列,或者可以是在任何天然蛋白质中未发现的人工序列。接头可以是柔性的并且缺乏二级结构或者可能具有在生理条件下形成特定三维结构的倾向。接头可以包括但不限于美国专利号8,445,251、9,340,777、9,434,931和10,041,053所涵盖的那些,其每一个的全部内容通过引用并入。在一些实施方式中,接头可以与seq id no:65的残基154-195具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或更高序列同一性。在一些实施方式中,接头可以具有包含seq id no:65的残基154-195的氨基酸序列。
[0343]
如本文所用,术语“talen”指包含dna结合结构域的核酸内切酶,所述dna结合结构域包含融合到来自核酸内切酶或核酸外切酶的核酸酶结构域或其活性部分的多个tal结构域重复,包括但不限于限制性核酸内切酶、归巢核酸内切酶、s1核酸酶、绿豆核酸酶、胰腺dnase i、微球菌核酸酶和酵母ho核酸内切酶。参见,例如,christian等,(2010)genetics 186:757-761其全部内容通过引用并入本文。可用于设计talen的核酸酶结构域包括来自ii型限制性核酸内切酶的那些,包括但不限于foki、fom、stsi、hhai、hindiii、nod、bbvci、ecori、bgli和alwi。其他ii型限制性核酸内切酶描述在国际公开号wo 2007/014275中,其全部内容通过引用并入。在一些实施方式中,talen核酸酶结构域是foki核酸酶结构域或其活性部分。tal结构域重复序列可以源自黄单胞菌属植物病原体在感染过程中使用的tale(转录激活因子样效应物)家族。tal结构域重复序列是33-34个氨基酸序列,其具有不同的第12个和第13个氨基酸。这两个位置,称为重复可变二肽(rvd),是高度可变的,并显示出与特定核苷酸识别的强相关性。在dna靶序列中的每个碱基对都与单个tal重复序列接触,所述tal重复具有由rvd产生的特异性。在一些实施方式中,talen包含16-22个tal结构域重复序列。talen切割dna需要两个dna识别区域(即,“半位点”),其位于非特异性中心区域(即,“间隔序列”)侧翼。涉及talen的术语“间隔序列”指将构成talen的每个单体识别和结合的两个核酸序列分开的核酸序列。tal结构域重复序列可以是来自天然存在的tale蛋白的天然序列,也可以通过合理或实验手段重新设计以产生与预定dna序列结合的蛋白(参见,例如,boch等,(2009)science326(5959):1509-1512和moscou和bogdanove(2009)science326(5959):1501,其每一个的全部内容通过引用并入本文。工程化talen以识别和结合特定序列的方法以及rvd及其相应靶核苷酸的实例亦参见美国公开号20110145940和国际公开号wo 2010/079430。在一些实施方式中,每个核酸酶(例如,foki)单体都可以融合到tal效应物序列上,该序列识别并结合不同dna序列,并且只有当两个识别位点非常接近时,无活性的单体才会聚集在一起以产生功能性酶。应理解,术语“talen”可以指单个talen蛋白,或者,与邻近的上游和下游半位点结合的talen蛋白对(即,左talen蛋白和右talen蛋白),并协同工作以在间隔序列内产生切割位点。给定预定的dna基因座或间隔序列,可以使用本领域公知的多种程序鉴定上游和下游半位点(kornel labun;tessa g.montague;james a.gagnon;summer b.thyme;eivind valen.(2016).chopchop v2:a web tool for the next generation of crispr genome engineering.nucleic acids research;doi:10.1093/nar/gkw398;tessa g.montague;jose m.cruz;james a.gagnon;george m.church;eivind valen.(2014).chopchop:a crispr/cas9 and talen web tool for genome editing.nucleic acids res.42.w401-w407)。还应理解,talen识别序列可以定义为单个talen蛋白的dna结合序列(即,半位点),或者,包含上游半位点、间隔序列和下游半
位点的dna序列。
[0344]
如本文所用,术语“致密talen”指包含dna结合结构域的核酸内切酶,其中一个或多个tal结构域重复以任何定向与i-tevi归巢核酸内切酶的任何部分或美国申请号20130117869表2中所列的任何核酸内切酶融合(其全部内容通过引用并入),包括但不限于mmei、enda、end1、i-basi、i-tevii、i-teviii、i-twoi、mspi、mvai、nuca和nucm。致密talen不需要dna加工活性的二聚化,减轻了对插入dna间隔序列的双靶点位点的需求。在一些实施方式中,致密talen包含16-22个tal结构域重复序列。
[0345]
如本文所用,术语“megatal”指单链核酸内切酶,其包含具有工程化的序列特异性归巢核酸内切酶的转录激活因子样效应物(tale)dna结合结构域。
[0346]
如本文所用,术语“锌指核酸酶”或“zfn”指包含与来自核酸内切酶或核酸外切酶的核酸酶结构域融合的锌指dna结合结构域的嵌合蛋白,包括但不限于限制性核酸内切酶、归巢核酸内切酶、s1核酸酶、绿豆核酸酶、胰腺dnase i、微球菌核酸酶和酵母ho核酸内切酶。可用于设计锌指核酸酶的核酸酶结构域包括来自ii型限制性核酸内切酶的那些,包括但不限于foki、fom和stsi限制性酶。其他ii型限制性核酸内切酶描述在国际公开号wo 2007/014275中,其全部内容通过引用并入本文。锌指结构域的结构通过锌离子的配位稳定化。包含一个或多个锌指结构域的dna结合蛋白以序列特异性方式结合dna。锌指结构域可以是天然序列,也可以通过合理或实验手段重新设计以产生与预定dna序列结合的蛋白,所述预定dna序列的长度为约18个碱基对,包含通过2-10个碱基对所分隔的一对9个碱基对半位点。参见,例如,美国专利号5,789,538、5,925,523、6,007,988、6,013,453、6,200,759,和国际公开号wo 95/19431、wo 96/06166、wo 98/53057、wo 98/54311、wo 00/27878、wo 01/60970、wo 01/88197和wo 02/099084,其每一个的全部内容通过引用并入本文。通过将这种工程化蛋白结构域与核酸酶结构域(如foki核酸酶)融合,可以以基因组水平特异性靶向dna断裂。用于设计和构建锌指核酸酶的靶位点、锌指蛋白和方法的选择是本领域技术人员公知的,并且在美国公开号20030232410、20050208489、2005064474、20050026157、20060188987和国际公开号wo 07/014275中详细描述,其每一个的全部内容通过引用并入本文。在锌指的情况下,dna结合结构域通常识别18bp识别序列,该序列包含一对由2-10个碱基对“间隔序列”隔开的9个碱基对“半位点”,并且被核酸酶切割会产生一个平末端或一个长度可变的5’突出端(通常是4个碱基对)。应理解,术语“锌指核酸酶”可以指单个锌指蛋白,或者指结合到与锌指核酸酶间隔序列相邻的上游和下游半位点的锌指蛋白对(即左zfn蛋白和右zfn蛋白),并协同工作以在间隔序列内产生切割位点。给定预定的dna基因座或间隔序列,可以使用本领域公知的多种程序鉴定上游和下游半位点(mandell jg,barbas cf 3rd.zinc finger tools:custom dna-binding domains for transcription factors and nucleases.nucleic acids res.2006jul 1;34(web server issue):w516-23)还应理解,锌指核酸酶识别序列可以定义为单个锌指核酸酶蛋白的dna结合序列(即,半位点),或者,包含上游半位点、间隔序列和下游半位点的dna序列。
[0347]
如本文所用,术语“crispr核酸酶”或“crispr系统核酸酶”指crispr(成簇的规则间隔短回文重复序列)相关(cas)核酸内切酶或其变体,例如cas9,其与引导rna结合,通过与多核苷酸中的识别位点杂交,指导相关核酸内切酶切割核酸。在一些实施方式中,crispr核酸酶是2类crispr酶。在这些实施方式的一些中,crispr核酸酶是2类、ii型酶,如cas9。在
其他实施方式中,crispr核酸酶是2类、v型酶,如cpf1。引导rna包含同向重复和引导序列(在内源性crispr系统中通常称为间隔序列),其与靶识别位点互补。在一些实施方式中,crispr系统还包含与引导rna上存在的同向重复序列(有时称为tracr-mate序列)互补(完全或部分)的tracrrna(反式激活crispr rna)。在特定实施方式中,crispr核酸酶可以相对于相应的野生型酶发生突变,以使得该酶缺乏切割靶多核苷酸一条链的能力,作为切口酶发挥作用,仅切割靶dna单链。用作切口酶的crispr酶的非限制性实例包括在ruvci催化结构域内具有d10a突变或具有h840a、n854a或n863a突变的cas9酶。给定预定的dna基因座,可以使用本领域公知的很多程序来鉴定识别序列(kornel labun;tessa g.montague;james a.gagnon;summer b.thyme;eivind valen.(2016).chopchop v2:a web tool for the next generation of crispr genome engineering.nucleic acids research;doi:10.1093/nar/gkw398;tessa g.montague;jose m.cruz;james a.gagnon;george m.church;eivind valen.(2014).chopchop:a crispr/cas9 and talen web tool for genome editing.nucleic acids res.42.w401-w407)。
[0348]
如本文所用,“模板核酸”指希望插入细胞基因组内切割位点的核酸(即,多核苷酸)。
[0349]
如本文所用,关于蛋白质,术语“重组”或“工程化”指由于将基因工程技术应用于编码蛋白质的核酸以及表达蛋白质的细胞或生物体而具有改变的氨基酸序列。关于核酸,术语“重组”或“工程化”是指由于应用基因工程技术而具有改变的核酸序列。基因工程技术包括但不限于pcr和dna克隆技术;转染、转化和其他基因转移技术;同源重组;定点诱变;和基因融合。根据该定义,具有与天然存在的蛋白质相同的氨基酸序列但通过在异源宿主中克隆和表达产生的蛋白质并不被认为是重组或工程化的。
[0350]
如本文所用,术语“野生型”是指相同类型基因的等位基因群体中最常见的天然存在的等位基因(即,多核苷酸序列),其中由野生型等位基因编码的多肽具有其原始功能。术语“野生型”还指由野生型等位基因编码的多肽。野生型等位基因(即多核苷酸)和多肽可与相对于野生型序列包含一个或更多个突变和/或替换的突变体或变体等位基因和多肽区分开来。鉴于野生型等位基因或多肽可以赋予生物体正常表型,因此在一些情况下,突变体或变体等位基因或多肽可赋予改变的表型。野生型核酸酶与重组或非天然存在的核酸酶是可区分的。术语“野生型”还可以指具有特定基因的野生型等位基因的细胞、生物体和/或受试者,或用于比较目的的细胞、生物体和/或受试者。
[0351]
如本文所用,术语“遗传修饰的”指细胞或生物体,其中或其祖先的基因组dna序列已通过重组技术被有意修饰。如本文所用,术语“遗传修饰的”包含术语“转基因”。
[0352]
如本文所用,关于重组蛋白,术语“修饰”是指重组序列中的氨基酸残基相对于参照序列(例如,野生型或天然序列)的任何插入、缺失或取代。
[0353]
如本文所用,术语“识别序列”或“识别位点”是指被核酸酶结合并切割的dna序列。在大范围核酸酶的情况下,识别序列包含一对被4个碱基对分开的反向的9个碱基对的“半位点”。在单链大范围核酸酶的情况下,蛋白质的n末端结构域接触第一个半位点,并且蛋白质的c末端结构域接触第二个半位点。大范围核酸酶的切割产生4个碱基对的3
’“
单链突出端”。“单链突出端”或“黏端”是可以通过内切核酸酶切割双链dna序列产生的短的单链dna区段。在源于i-crei的大范围核酸酶和单链大范围核酸酶的情况下,单链突出端包含22个
碱基对识别序列的碱基10至13。在致密talen的情况下,识别序列包含被i-tevi结构域识别的第一cnnngn序列,其后是长度为4至16个碱基对的非特异性间隔区,其后是被tal效应物结构域(该序列通常具有5’t碱基)识别的长度为16至22bp的第二序列。致密talen的切割产生两个碱基对的3’单链突出端。在crispr的情况下,识别序列是指导rna结合以指导cas9切割的通常为16至24个碱基对的序列。引导序列和识别序列之间的完全互补性不一定需要有效切割。根据crispr核酸酶的不同,crispr核酸酶的切割可以产生平末端(如通过2类、ii型crispr核酸酶)或突出末端(如通过2类、v型crispr核酸酶)。在使用cpfi crispr核酸酶的那些实施方式中,由包含其的crispr复合物切割将导致5’突出端和在一些实施方式中导致5个核苷酸5’突出端。每个crispr核酸酶还需要识别与引导rna互补的识别序列附近的pam(原型间隔序列相邻基序)序列。pam的精确序列、长度要求以及与靶序列的距离因crispr核酸酶而异,但pam通常是与靶序列/识别序列相邻的2-5个碱基对序列。针对特定crispr核酸酶的pam序列是本领域公知的(参见,例如,美国专利号8,697,359和美国公开号20160208243,其每一个的全部内容通过引用并入本文),并且可以使用本领域公知的方法如pam耗竭测定鉴定新的或工程化的crispr核酸酶的pam序列(参见,例如,karvelis等,(2017)methods 121-122:3-8,其全部内容通过引用并入本文)。在锌指的情况下,dna结合结构域通常识别18bp识别序列,该序列包含一对由2-10个碱基对分隔的9个碱基对“半位点”,并被核酸酶切割产生平末端或长度可变的5’突出端(通常为4个碱基对)。
[0354]
如本文所用,术语“靶位点”或“靶序列”是指包含核酸酶识别序列的细胞的染色体dna区域。
[0355]
如本文所用,术语“dna结合亲和性”或“结合亲和性”是指核酸酶与参照dna分子(例如,识别序列或任意序列)非共价缔合的倾向。结合亲和性由解离常数kd度量。如本文所使用的,如果核酸酶对参照识别序列的kd相对于参照核酸酶增加或减少统计学上显著的百分比变化,则核酸酶具有“改变”的结合亲和性。
[0356]
如本文所用,术语“特异性”是指核酸酶仅在称为识别序列的特定碱基对序列处或仅在一组特定识别序列处结合和切割双链dna分子的能力。一组识别序列将共享某些保守位置或序列基序,但可能在一个或多个位置简并。高度特异性的核酸酶只能切割一个或极少数识别序列。可以通过本领域公知的任何方法确定特异性。
[0357]
如本文所用,术语“同源重组”或“hr”是指其中使用同源dna序列作为修复模板修复双链dna断裂的天然细胞过程(参见,例如,cahill等(2006),front.biosci.11:1958-1976)。同源dna序列可以是内源染色体序列或递送至细胞的外源核酸。
[0358]
如本文所用,术语“非同源末端连接”或“nhej”是指其中通过直接连接两个非同源dna区段来修复双链dna断裂的天然细胞过程(参见,例如,cahill等(2006),front.biosci.11:1958-1976)。通过非同源末端连接进行的dna修复容易出错并且经常导致在修复位点处dna序列的非模板添加或缺失。在一些情况下,靶识别序列处的切割导致靶识别位点的nhej。核酸酶诱导的基因编码序列中靶位点的切割然后通过nhej进行dna修复可将突变引入编码序列中,例如破坏基因功能的移码突变。因此,工程化的核酸酶可以用于有效敲除细胞群体中的基因。
[0359]
如本文所用,术语“破坏的”或“破坏”或“破坏表达”或“破坏靶序列”是指引入干扰基因功能并阻止多肽表达和/或功能的突变(例如,移码突变)/由此编码的表达产物。例如,
核酸酶介导的基因破坏可导致截短蛋白的表达和/或不保留其野生型功能的蛋白的表达。此外,将模板核酸引入基因中可导致编码蛋白不表达、截短蛋白表达和/或不保留其野生型功能的蛋白表达。
[0360]
如本文所用,“嵌合抗原受体”或“car”是指将抗原特异性赋予或转移至免疫效应细胞(例如,人t细胞)的经改造的受体。嵌合抗原受体至少包含胞外配体结合结构域或部分、跨膜结构域和包含一个或多个信号传导结构域和/或共刺激结构域的胞内结构域。
[0361]
在一些实施方式中,胞外配体结合结构域或部分是抗体或抗体片段。在该背景下,术语“抗体片段”可以指抗体的至少一部分,其保留与抗原的表位特异性相互作用(例如,通过结合、位阻、稳定/去稳定、空间分布)的能力。抗体片段的实例包括但不限于fab、fab’、f(ab’)2、fv片段、scfv抗体片段、二硫键连接的fvs(sdfv)、由vh和ch1结构域组成的fd片段、线性抗体、单域抗体,如sdab(vl或vh)、骆驼vhh结构域、由抗体片段形成的多特异性抗体,如包含通过铰链区二硫键连接的两个fab片段的二价片段,以及抗体的分离的cdr或其他表位结合片段。还可以将抗原结合片段引入单域抗体、大抗体、微抗体、纳米抗体、胞内抗体、双抗体、三抗体、四抗体、v-nar和bis-scfv(参见,例如,hollinger和hudson,nature biotechnology 23:1126-1136,2005)。抗原结合片段也可以移植到基于多肽的支架中,如纤连蛋白iii型(fn3)(参见美国专利号6,703,199,其描述了纤连蛋白多肽微抗体)。
[0362]
在一些实施方式中,细胞外配体结合结构域或部分是源自单克隆抗体的单链可变片段(scfv)的形式,其提供对特定表位或抗原的特异性(例如,优选存在于细胞表面的表位或抗原,如癌细胞或其他致病细胞或颗粒)。在一些实施方式中,scfv是通过接头序列附接的。在一些实施方式中,scfv是鼠源的、人源化或全人的。
[0363]
嵌合抗原受体的细胞外结构域也可包含自身抗原(参见,payne等,(2016),science 353(6295):179-184),其可被b淋巴细胞上的自身抗原特异性b细胞受体识别,从而指导t细胞特异性靶向并杀死抗体介导的自身免疫性疾病中的自体反应性b淋巴细胞。这样的car可以被称为嵌合自身抗体受体(caar),并且其用途涵盖在本发明中。嵌合抗原受体的胞外配体结合结构域还可包含天然存在的靶抗原配体,或保留结合靶抗原的能力的天然存在的配体的片段。
[0364]
细胞内刺激结构域可以包括一个或更多个胞质信号传导结构域,其在抗原结合后将激活信号向t细胞细胞的传递。这样的胞质信号传导结构域可以包括但不限于cd3-ζ锌信号传导结构域。
[0365]
细胞内刺激结构域还可以包括一个或多个细胞内共刺激结构域,其在配体结合后传递增殖和/或细胞存活信号。这样的细胞内共刺激结构域可以是本领域公知的那些中的任何一个,并且可以包括但不限于wo2018/067697中公开的那些共刺激结构域,例如,novel 6。共刺激结构域的其他实例可以包括4-1bb(cd137)、cd27、cd28、cd8、ox40、cd30、cd40、pd-1、icos、淋巴功能相关抗原-1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3、与cd83特异性结合的配体或者其任何组合。
[0366]
嵌合抗原受体还包含另外的结构元件,包括通过铰链或间隔序列与胞外配体结合结构域附接的跨膜结构域。跨膜结构域可以源自任何膜结合蛋白或跨膜蛋白。例如,跨膜多肽可以是t细胞受体的亚基(例如,α、β、γ或ζ,构成cd3复合物的多肽)、il2受体p55(α链)、(β链)或γ链、fc受体的亚基链(例如,fcγ受体iii)或cd蛋白,如cd8α链。在某些实例中,跨
膜结构域是cd8α结构域。或者,跨膜结构域可以是合成的并且可以主要包含疏水性残基,如亮氨酸和缬氨酸。
[0367]
铰链区指起到将跨膜结构域连接到胞外配体结合结构域的作用的任何寡核苷酸或多肽。例如,铰链区可包含多达300个氨基酸,优选10至100个氨基酸,最优选25至50个氨基酸。铰链区可源自天然存在的分子的全部或部分,如源自cd8、cd4或cd28的胞外区的全部或部分,或源自抗体恒定区的全部或部分。或者,铰链区可以是对应于天然存在的铰链序列的合成序列或可以是完全合成的铰链序列。在特定实例中,铰链结构域可以包含人cd8α链、fcyrllla受体或iggl的一部分。在某些实例中,铰链区可以是cd8α结构域。
[0368]
如本文所用,“外源t细胞受体”或“外源tcr”是指其序列被引入可以或可以不内源表达tcr的免疫效应细胞(例如,人t细胞)的基因组中的tcr。外源tcr在免疫效应细胞上的表达可赋予对特定表位或抗原(例如,优先存在于癌细胞或其他致病细胞或颗粒表面上的表位或抗原)的特异性。这种外源t细胞受体可以包含α链和β链,或者可包含γ链和δ链。可用于本发明的外源性tcr可对任何目标抗原或表位具有特异性。
[0369]
如本文所用,术语“hla i类组织相容性抗原、α链e融合蛋白”或“hla-e融合蛋白”是指包含融合至至少一种另外的蛋白的hla-e蛋白的蛋白,该另外的蛋白能够使hla-e蛋白在细胞表面表达。hla-e蛋白可以包括例如hla-e-01:01或hla-e-01:03蛋白(例如,seq id no:118)。hla-e融合蛋白可以包含例如与β-2微球蛋白(例如,seq id no:119)融合的hla-e蛋白,所述β-2微球蛋白能够使hla-e蛋白在细胞表面上表达。在其他实例中,hla-e融合蛋白可以包含与β-2微球蛋白和负载到hla-e蛋白中用于呈递的附加蛋白(例如,hla-g前导肽)(例如,seq id no:120)融合的hla-e蛋白和本领域公知的其他hla-e蛋白。hla-e融合蛋白的蛋白可以通过多肽接头融合,例如,包含seq id no:121(即,(ggggs)3接头)或seq id no:122(即,(ggggs)4接头)的接头。
[0370]
如本文所用,与靶蛋白(即,内源性表达的蛋白)有关的术语“表达降低”是指当与对照细胞相比时,遗传修饰细胞的内源蛋白表达的任何降低。术语降低还可以指当与对照细胞群体相比时,表达本公开内容的shrnamir靶向的内源性蛋白的野生型水平的细胞群体中细胞百分比的降低。群体中完全表达靶向内源蛋白的细胞百分比的这种降低可以高达5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、96%、97%、98%、99%或者高达100%。在本公开内容的上下文中应理解,术语“减少的”包括靶点或内源性蛋白的部分或不完全敲低,并且区别于完全敲低,如通过核酸酶的基因失活实现的敲低。
[0371]
如本文关于氨基酸序列和核酸序列两者所使用的,术语“百分比同一性”、“序列同一性”、“百分比相似性”、“序列相似性”等是指基于使比对的氨基酸残基或核苷酸之间的相似性最大化的序列比对的两个序列的相似性程度的度量,并且其为相同或相似残基或核苷酸的数目、总残基或核苷酸的数目、以及序列比对中缺口的存在和长度的函数。多种算法和计算机程序可用于使用标准参数确定序列相似性。如本文所使用的,序列相似性是使用用于氨基酸序列的blastp程序和用于核酸序列的blastn程序测量的,两者均可通过国家生物技术信息中心(www.ncbi.nlm.nih.gov/)获得,并且在例如在以下中描述:altschul等,(1990),j.mol.biol.215:403-410;gish和states(1993),nature genet.3:266-272;madden等,(1996),meth.enzymol.266:131-141;altschul等,(1997),nucleic acids res.25:3389-3402);zhang等,(2000),j.comput.biol.7(1-2):203-14。如本文所用,两个
氨基酸序列的百分比相似性是基于blastp算法的以下参数的得分:字长=3;缺口空位罚分=-11;缺口延伸罚分=-1;和评分矩阵=blosum62。如本文所用的,两个核酸序列的百分比相似性是基于blastn算法的以下参数的得分:字长=11;缺口空位罚分=-5;缺口延伸罚分=-2;匹配奖励=1;和错配罚分=-3。
[0372]
如本文关于两个蛋白质或氨基酸序列的修饰所使用的,术语“对应于”用于表示第一蛋白质中的指定修饰是与第二蛋白质的修饰中相同氨基酸残基的替换,并且当两种蛋白质进行标准序列比对(例如使用blastp程序)时,第一蛋白质中的修饰氨基酸位置与第二蛋白质中的修饰氨基酸位置对应或对齐。因此,如果在序列比对中残基x和y彼此对应,则尽管x和y可能是不同的数字,但第一蛋白质中残基“x”修饰成氨基酸“a”将对应于在第二蛋白质中残基“y”修饰成氨基酸“a”。
[0373]
如本文所用,术语“t细胞受体α基因”或“tcrα基因”是指t细胞中编码t细胞受体α亚基的基因座。t细胞受体α基因可参考ncbi基因id编号6955,重排前或重排后。重排后,t细胞受体α基因包含内源启动子、重排的v和j区段、内源剪接供体位点、内含子、内源剪接受体位点和t细胞受体α恒定区基因座,其包含亚基编码外显子。
[0374]
如本文所用,术语“t细胞受体α恒定区”或“tcrα恒定区”是指t细胞受体α基因的编码序列。tcrα恒定区包括野生型序列或其功能型片段,由ncbi基因id no.28755标识。
[0375]
如本文所用,术语“t细胞受体β基因”或“tcrβ基因”是指t细胞中编码t细胞受体β亚基的基因座。t细胞受体β基因可以指ncbi基因id编号6957。
[0376]
如本文所用,术语“重组dna构建体”、“重组构建体”、“盒”、“表达构建体”、“嵌合构建体”、“构建体”和“重组dna片段”在本文中可互换地使用,并且是单链或双链多核苷酸。重组构建体包含单链或双链多核苷酸的人工组合,包括但不限于没有在自然界中发现的调控序列和编码序列。例如,重组dna构建体可包含源自不同来源的调控序列和编码序列,或源自相同来源并以不同于自然界中发现的方式排列的调控序列和编码序列。这样的构建体可以单独使用或者可以与载体一起使用。
[0377]
如本文所用,“载体”或“重组dna载体”可以是包含能够在给定宿主细胞中转录和翻译多肽编码序列的复制系统和序列的构建体。如果使用载体,则载体的选择取决于将用于转化宿主细胞的方法,这是本领域技术人员公知的。载体可以包括但不限于质粒载体和重组aav载体,或本领域已知的适合将编码本发明的大范围核酸酶的基因递送至靶细胞的任何其他载体。本领域技术人员熟知载体上必须存在以便成功转化、选择和繁殖包含本发明的任何分离的核苷酸或核酸序列的宿主细胞的遗传元件。
[0378]
如本文所用,“载体”也可以指病毒载体(即,重组病毒)。病毒载体可以包括但不限于逆转录病毒载体(即,重组逆转录病毒)、慢病毒载体(即,重组慢病毒)、腺病毒载体(即,重组腺病毒)和腺相关病毒载体(aav)(即,重组aav)。
[0379]
如本文所用,术语“免疫细胞”是指属于免疫系统(先天性和/或适应性)的一部分并且是造血来源的任何细胞。免疫细胞的非限制性实例包括淋巴细胞、b细胞、t细胞、单核细胞、巨噬细胞、树突状细胞、粒细胞、巨核细胞、单核细胞、巨噬细胞、自然杀伤细胞、髓系来源的抑制细胞、先天淋巴细胞、血小板、红细胞、胸腺细胞、白细胞、中性粒细胞、肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞和粒细胞。
[0380]
如本文所用,“人t细胞”或“t细胞”是指从供体(特别是人供体)分离的t细胞。t细
胞和由其衍生的细胞包括未在培养中传代的分离的t细胞、已经在细胞培养条件下传代并维持而没有永生化的t细胞、以及已被永生化且可在细胞培养条件下无限维持的t细胞。
[0381]
如本文所用,“人nk细胞”或“nk细胞”是指从供体(特别是人供体)分离的nk细胞。nk细胞及其衍生的细胞包括未在培养中传代的分离的nk细胞、已在细胞培养条件下传代并维持但未永生化的nk细胞,以及已经永生化并且可以无限期地保持在细胞培养条件下的nk细胞。
[0382]
如本文所用,“人b细胞”或“b细胞”是指从供体(特别是人供体)分离的b细胞。b细胞及其衍生的细胞包括未在培养中传代的分离的b细胞、已在细胞培养条件下传代并维持但未永生化的b细胞,以及已经永生化并且可以无限期地保持在细胞培养条件下的b细胞。
[0383]
如本文所用,术语“对照”或“对照细胞”是指为测量遗传修饰细胞的基因型或表型变化提供参照点的细胞。对照细胞可包括,例如:(a)野生型细胞,即与导致遗传修饰细胞的基因改变的起始材料相同的基因型;(b)与遗传修饰细胞具有相同基因型但已用无效构建体(即,具有对目标性状没有已知影响的构建体)转化的细胞;或(c)基因上与遗传修饰细胞相同但未暴露于会诱导表达改变的基因型或表型的条件或刺激或进一步遗传修饰的细胞。
[0384]
如本文所用,术语“治疗”或“治疗受试者”指向患有疾病的受试者施用本发明的基因免疫细胞或遗传修饰的免疫细胞群体。例如,受试者可能患有诸如癌症的疾病,并且治疗可以代表用于治疗该疾病的免疫疗法。治疗的所需作用包括但不限于预防疾病的发生或复发、减轻症状、减轻疾病的任何直接或间接病理后果、降低疾病进展的速度、缓解或改善疾病状态以及缓解或改善预后。在一些方面中,在治疗期间以本发明的药物组合物的形式施用本文所述的遗传修饰的免疫细胞或遗传修饰的免疫细胞群体。
[0385]
术语“有效量”或“治疗有效量”是指足以产生有益或所需的生物学和/或临床结果的量。治疗有效量将根据所使用的制剂或组合物、疾病及其严重程度以及待治疗受试者的年龄、体重、身体状况和反应性而变化。在特定实施方式中,有效量的本发明的遗传修饰的免疫细或遗传修饰的免疫细胞群体,或本文公开的药物组合物,减少受试者疾病的至少一种症状。在其中疾病是癌症的那些实施方式中,有效量的本文公开的药物组合物降低癌症的增殖或转移水平,引起癌症的部分或完全应答或缓解,或减轻受试者的至少一种癌症症状。
[0386]
如本文所用,术语“癌症”应理解为包括任何以引起恶性生长或肿瘤的异常和不受控制的细胞分裂为特征的肿瘤性疾病(无论是侵袭性还是转移性)。
[0387]
如本文所用,术语“癌瘤”指由上皮细胞组成的恶性生长。
[0388]
如本文所用,术语“白血病”是指造血器官/系统的恶性肿瘤,通常以血液和骨髓中白细胞及其前体的异常增殖和发育为特征。
[0389]
如本文所用,术语“肉瘤”是指由胚胎结缔组织等物质组成的肿瘤,通常由嵌入纤维状、异质或同质物质中的紧密堆积的细胞组成。
[0390]
如本文所用,术语“黑色素瘤”是指源自皮肤和其他器官的黑色素细胞系统的肿瘤。
[0391]
如本文所用,术语“淋巴瘤”是指由淋巴细胞发展而来的一组血细胞肿瘤。
[0392]
如本文所用,术语“母细胞瘤”是指由前体细胞或原始细胞(未成熟或胚胎组织)中的恶性肿瘤引起的一种癌症。
[0393]
如本文所用,对变量的数值范围的叙述旨在传达可以用等于该范围内的任何值的变量来实践本发明。因此,对于固有离散的变量,变量可以等于该数值范围内的任何整数值,包括范围的终点。类似地,对于固有连续的变量,变量可以等于数值范围内的任何实数值,包括范围的终点。作为示例而非限制,如果变量是固有离散的,则被描述为具有在0和2之间的值的变量可以取值0、1或2;而如果变量固有连续,则可以取值0.0、0.1、0.01、0.001或≥0且≤2的任何其他实数值。
[0394]
2.1本发明的原理
[0395]
本发明部分基于以下发现:microrna适应的shrna(shrnamir)分子可用于产生内源性蛋白表达稳定减少的遗传修饰的免疫细胞。在本文中证明,将编码shrnamir的核酸序列插入t细胞提供了一系列内源性蛋白的稳定敲低,包括例如,β-2微球蛋白(b2m)、cs1、转化生长因子β受体ii(tgfbr2)、cbl原癌基因b(cbl-b)、脱氧胞苷激酶(dck)、糖皮质激素和分化簇52(cd52)的稳定和有效敲低。在一些情况下,敲低内源性蛋白可以赋予与基因失活敲除相比更有利的性质。例如,与完全敲除b2m的car t细胞相比,shrnamir敲低b2m产生的car t细胞同种异体更少,对自然杀伤(nk)细胞杀伤的敏感性更低。此外,已证明将shrnamir分子并入免疫细胞的基因组解决了在插入编码shrna分子的盒时观察到的稳定性和毒性问题。
[0396]
鉴于shrnamir分子可用于减少多种内源性蛋白的表达的证明,目前公开的组合物和方法可用于稳定地敲低免疫细胞内的不同程度的表达,不仅是b2m蛋白,而且是任何感兴趣的内源蛋白。
[0397]
2.2 microrna适应的shrna(shrnamir)
[0398]
rna干扰(rnai)或rna沉默是指基因表达受到非编码rna(如microrna)负调控的过程。负调控可由三种可能机制中的一种或多种引起:(1)通过抑制靶mrna的翻译,(2)通过转录物的去腺苷酸化和去稳定化,和(3)通过mrna的切割和降解。rnai通常由双链rna(dsrna)或内源性microrna前体(pri-mirna/pre-mirna)触发。
[0399]
内源性microrna分子的产生始于从rna聚合酶ii(pol ii)启动子转录初级mirna(pri-mrna)。每个pri-mirna可以包含1至6个pre-mirna。pre-mirna是由大约70个核苷酸组成的发夹环结构,每个发夹两侧都有有效加工所需的序列。drosha酶通过从发夹碱基上切割大约11个核苷酸的rna,从pri-mirna中释放出发夹。通过drosha切割产生的pre-mirna在3’端包含2核苷酸的突出端。该2核苷酸的突出端与输出蛋白-5蛋白结合,该蛋白介导pre-mirna从细胞核向细胞质的输出。在胞质中,pre-mirna发夹通过与发夹5’和3’末端的相互作用被dicer切割。dicer切割环区域中的pre-mirna发夹以产生不完美的mirna:mirna双螺旋,其长度约为22个核苷酸。mirna:mirna双螺旋(成熟mirna)的单链被整合到rna诱导的沉默复合体(risc)中,在那里mirna与其mrna靶点相互作用。
[0400]
自发现以来,rnai已成为抑制哺乳动物细胞基因表达的强大遗传工具。基因敲低可以通过合成短发夹rna(shrna)的表达来实现,这些短发夹rna(shrna)模拟pre-mirna,由dicer加工并送入risc。然而,如本文所述,shrna可能不允许长期降低免疫细胞中的蛋白表达。而相比之下,本发明的microrna适应的shrna(shrnamir)分子的表达导致蛋白表达的持续降低和毒性作用的降低。shrnamir分子模拟pri-mirna分子,因为其包含一个发夹,两侧是有效加工所需的序列,并且可以被drosha酶加工成pri-mirna,输出到细胞质中,并被
dicer切割,然后成熟的mirna可以进入risc。
[0401]
本发明提供了表达shrnamir分子的遗传修饰的免疫细胞,所述shrnamir分子降低内源性蛋白的丰度。
[0402]
shrnamir分子可包含microrna支架,因为shrnamir分子的结构可模拟天然存在的microrna(或pri-mirna或pre-mirna)或其变体的结构。microrna(和pri-mirna和pre-mirna)的序列是本领域公知的。当前公开的shrnamir的适宜mir支架的非限制性实例包括mir-e、mir-30(例如mir-30a)、mir-15、mir-16、mir-155、mir-22、mir-103和mir-107。在特定实施方式中,用于本公开的组合物和方法中的shrnamir包含mir-e支架。mir-e支架是mir-30a的合成衍生变体,其来源描述于国际公开号wo 2014/117050,其全部内容通过引用并入本文。
[0403]
本公开的shrnamir分子可以在5’至3’定向包含以下结构域:(a)5’mir支架结构域;(b)5’mir基干结构域;(c)随从链;(d)mir环结构域;(e)引导链;(f)3’mir基干结构域;和(g)3’mir支架结构域。mir结构支架结构域和基干结构域位于mirna茎环的侧翼,在本文中称为microrna侧翼序列,其包含microrna加工元件(有助于从初级microrna或前体microrna产生成熟microrna的最小核酸序列)。通常,这些元件位于microrna茎环结构侧翼的40个核苷酸序列内。在一些情况下,microrna加工元件位于microrna茎环结构侧翼的一段长度为5到4,000个核苷酸的核苷酸序列中。
[0404]
在一些实施方式中,mirna侧翼序列的长度约为3至4,000nt,可存在于shrnamir分子的5’和3’末端之一或两者上。在其他实施方式中,shrnamir分子的microrna侧翼序列的最小长度为约10、约20、约30、约40、约50、约60、约70、约80、约90、约100、约125、约126、约127、约128、约129、约130、约131、约132、约133、约134、约135、约136、约137、约138、约139、约140、约150、约200以及其间的任何整数。在其他实施方式中,shrnamir分子的microrna侧翼序列的最大长度为约2,000、约2,100、约2,200、约2,300、约2,400、约2,500、约2,600、约2,700、约2,800、约2,900、约3,000、约3,100、约3,200、约3,300、约3,400、约3,500、约3,600、约3,700、约3,800、约3,900、约4,000以及其间的任何整数。
[0405]
microrna侧翼序列可以是天然microrna侧翼序列或人工microrna侧翼序列。天然microrna侧翼序列是通常包含在具有microrna序列的天然存在系统内的核苷酸序列(即,这些序列在体内最小microrna发夹周围的基因组序列中发现)。人工microrna侧翼序列是在天然存在的系统中未发现是microrna序列侧翼的核苷酸序列。人工microrna侧翼序列可以是在其他microrna序列的上下文中天然发现的侧翼序列。或者,其可以由最小的microrna加工元件组成,这些元件在天然存在的侧翼序列中发现并插入到其他随机核酸序列中,这些序列不是作为侧翼序列天然存在的或仅部分作为天然侧翼序列出现的。
[0406]
在一些实施方式中,5’mir支架结构域的长度约10至约150个核苷酸,包括但不限于约10、约20、约30、约40、约50、约60、约70、约80、约90、约100、约110、约120、约130、约140和约150个核苷酸长。在这些实施方式的一些中,5’mir支架结构域的长度为约111个核苷酸。5’mir支架结构域可以包含作为iis型限制性酶识别序列的3’序列。在这些实施方式的一些中,5’mir支架结构域在其3’末端包含xhoi识别序列。在特定实施方式中,5’mir支架结构域与seq id no:1所示的序列具有至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约91%、至少约92%、至
少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或更高序列同一性。在一些实施方式中,5’mir支架结构域具有seq id no:1所示的序列。
[0407]
在一些实施方式中,shrnamir的5’mir基干结构域的长度可以是约5至约30个核苷酸,包括但不限于约5、约6、约7、约8、约9、约10、约11、约12、约13、约14、约15、约16、约17、约18、约19、约20、约21、约22、约23、约24、约25、约26、约27、约28、约29和约30个核苷酸长。在这些实施方式的一些中,5’mir基干结构域的长度是约20个核苷酸。在特定实施方式中,5’mir基干结构域与seq id no:2所示的序列具有至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或更高序列同一性。在一些实施方式中,5’mir基干结构域具有seq id no:2所示的序列。
[0408]
本公开的组合物和方法的shrnamir分子包含茎环结构,其中茎由杂交的随从链和引导链组成,环是单链的。mir环结构域可以来源于天然存在的pre-microrna或pri-microrna环序列或其变体。在一些实施方式中,mir环结构域具有来自mir-30(例如mir-30a)、mir-15、mir-16、mir-155、mir-22、mir-103和mir-107中任一种的环结构域的序列。在特定实施方式中,shrnamir包含mir-30a环结构域,其序列如seq id no:3所示。
[0409]
在一些实施方式中,mir环结构域的长度为约5至约30个核苷酸,包括但不限于约5、约6、约7、约8、约9、约10、约11、约12、约13、约14、约15、约16、约17、约18、约19、约20、约21、约22、约23、约24、约25、约26、约27、约28、约29和约30个核苷酸长。在这些实施方式的一些中,mir环结构域的长度为约15个核苷酸。在特定实施方式中,mir环结构域与seq id no:3所示的序列具有至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或更高序列同一性。在一些实施方式中,mir环结构域具有如seq id no:3所示的序列。
[0410]
在一些实施方式中,shrnamir的3’mir基干结构域的长度可以是约5至约30个核苷酸,包括但不限于约5、约6、约7、约8、约9、约10、约11、约12、约13、约14、约15、约16、约17、约18、约19、约20、约21、约22、约23、约24、约25、约26、约27、约28、约29和约30个核苷酸长。在这些实施方式的一些中,3’mir基干结构域的长度是约18个核苷酸。在特定实施方式中,3’mir基干结构域与seq id no:4所示的序列具有至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或更高序列同一性。在一些实施方式中,3’mir基干结构域具有如seq id no:4所示的序列。
[0411]
在一些实施方式中,3’mir支架结构域的长度是约50至约150个核苷酸,包括但不限于约10、约20、约30、约40、约50、约60、约70、约80、约90、约100、约110、约120、约130、约140或约150个核苷酸长。在这些实施方式的一些中,3’mir支架结构域的长度是约116个核苷酸。在特定实施方式中,3’mir支架结构域包含与seq id no:5所示的序列具有至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约
96%、至少约97%、至少约98%、至少约99%或更高序列同一性。在一些实施方式中,3’mir支架结构域具有如seq id no:5所示的序列。
[0412]
shrnamir的引导链是靶向mrna的序列,导致mrna编码的蛋白丰度减少。在引导链与其靶mrna结合后,risc会降解靶转录物和/或阻止靶转录物加载到核体中进行翻译。引导链与靶mrna具有足够的互补性,从而导致靶mrna的表达降低。在一些实施方式中,引导链与靶mrna序列是至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、至少约97%、至少约98%、至少约99%或100%互补。在一些实施方式中,引导链与编码序列内的靶mrna杂交。引导链可以包含1、2、3、4、5或更多个与靶mrna序列错配的核苷酸。在其他实施方式中,引导链与靶mrna在非编码区杂交,如5’或3’非翻译区(utr)。在一些实施方式中,引导链的长度是约15至约25个核苷酸,包括但不限于约15、约16、约17、约18、约19、约20、约21、约22、约23、约24和约25个核苷酸长。在这些实施方式的一些中,引导链的长度是约22个核苷酸。在其中衍生shrnamir的shrna序列长度小于22个核苷酸的特定实施方式中,这是大多数天然存在的microrna的长度,在shrna序列中添加一个另外的核苷酸,并且在一些实施方式中,这个另外的核苷酸与靶mrna内的相应位置互补。
[0413]
shrnamir的随从链是与引导链序列完全或部分互补的序列。在一些实施方式中,随从链的长度是约15至约25个核苷酸,包括但不限于长度是约15至约25个核苷酸,包括但不限于约15、约16、约17、约18、约19、约20、约21、约22、约23、约24和约25个核苷酸长。在这些实施方式的一些中,随从链的长度是约22个核苷酸。随从链可以与引导链序列至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、至少约97%、至少约98%、至少约99%或100%互补。随从链可以包含1、2、3、4、5个或更多个与引导链错配的核苷酸。然而,在一些实施方式中,引导链:随从链双螺旋不包含任何错配核苷酸。在通常情况下,应该选择在其内部不形成任何二级结构的引导链/随从链序列。此外,应避免使用靶向mrna内包含单核苷酸多态性的位点的引导/随从链序列。优选对靶mrna具有特异性的引导/随从链序列,以避免任何脱靶效应(即,非靶mrna的表达减少)。
[0414]
为了帮助选择适宜的shrnamir引导链/随从链,或其他shrnamir结构域的序列,可以使用本领域公知的对rna分子的预测二级结构进行建模的任何程序,包括但不限于mfold、rnafold和unafold。可以使用本领域公知的任何可以预测shrna或mirna引导/随从序列靶向特定mrna的效率的程序来选择合适的引导/随从链序列,包括但不限于在agarwal等,(2015)elife 4:e05005;和knott等,(2014)mol cell 56(6):796-807中描述的那些,其每一个的全部内容通过引用并入本文。
[0415]
2.3遗传修饰的免疫细胞
[0416]
本发明提供了遗传修饰的免疫细胞及其群体以及用于生产其的方法。在一些实施方式中,本公开的组合物和方法的遗传修饰的免疫细胞是人免疫细胞。在一些实施方式中,免疫细胞是t细胞,或由其衍生的细胞。在其他实施方式中,免疫细胞是自然杀伤(nk)细胞,或由其衍生的细胞。在另外其他实施方式中,免疫细胞是b细胞,或由其衍生的细胞。在另外其他实施方式中,免疫细胞是单核细胞或巨噬细胞,或由其衍生的细胞。
[0417]
免疫细胞(例如,t细胞)可以从多种来源获得,包括外周血单核细胞、骨髓、淋巴结组织、脐带血、胸腺组织、感染部位的组织、腹水、胸腔积液、脾组织和肿瘤。在本公开内容的某些实施方式中,可以使用任何数量的本领域可用的t细胞系、nk细胞系、b细胞系、单核细
胞系或巨噬细胞系。在本公开内容的一些实施方式中,免疫细胞(例如,t细胞)是使用本领域技术人员公知的很多技术从从受试者收集的血液单位中获得的。在一个实施方式中,来自个体循环血液的细胞是通过单采获得的。本发明的免疫细胞还可以是诱导多能干细胞(ipsc)衍生的细胞,其已经分化为功能性免疫细胞(例如,t细胞、nk细胞、b细胞)。
[0418]
本公开的组合物和方法的遗传修饰的免疫细胞在细胞的基因组中包含编码shrnamir的核酸序列,导致靶蛋白表达的减少。
[0419]
在其中内源性蛋白的表达被shrnamir降低的那些实施方式的一些中,与对照细胞(例如,不表达shrnamir的细胞)相比,内源性蛋白的表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。可以使用本领域公知的任何方法来确定shrnamir靶向的内源蛋白的表达水平,包括但不限于elisa、流式细胞术、western印迹、免疫细胞化学和免疫沉淀。
[0420]
与对照细胞群体相比,群体内的细胞表达shrnamir可导致细胞群体中完全表达shrnamir靶向的内源性蛋白的细胞百分比降低。在群体中,这种减少可以高达5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、96%、97%、98%、99%或高达100%的细胞。
[0421]
编码shrnamir的核酸序列可以存在于遗传修饰的免疫细胞的基因组中,例如,在盒中。此类盒可以插入到基因组中,例如,通过随机整合(例如,慢病毒转导)或通过靶向插入到选定位点(例如,通过核酸酶介导的靶向插入)引入本发明的模板核酸。包含shrnamir编码序列的盒可以包括,例如,编码另外的蛋白的核酸序列,例如本文所述的那些(例如,car、外源性tcr、融合蛋白),并且还可以包含控制序列,如启动子和终止序列。编码shrnamir的序列可以位于允许shrnamir表达的盒或模板核酸内的任何数量的位置。在一些实例中,编码shrnamir的核酸序列位于另一个转基因的终止密码子(例如,编码car、外源性tcr或融合蛋白的核酸序列)和终止信号之间。在其他实例中,存在于盒或模板核酸(例如,编码car、外源性tcr或融合蛋白的核酸序列)中的另一种转基因包含位于转基因序列内的内含子。此处,“位于”是指将内含子序列插入到转基因序列中,使得所得序列包含转基因的5’部分、内含子序列和转基因的3’部分。在一些此类实例中,编码shrnamir的核酸序列可以位于此类内含子内。此处,“位于”是指将shrnamir编码序列插入到内含子序列中,使得所得序列包含内含子序列的5’部分、shrnamir编码序列和内含子序列的3’部分。在此类情况下,shrnamir被表达,内含子序列在转基因表达时被细胞剪掉。可以以这种方式包含的内含子可以是天然存在的内含子,或者,替代地,合成内含子。可用于本发明的合成内含子的一个特定实例由seq id no:69编码。
[0422]
在一些实施方式中,所述遗传修饰的免疫细胞在其基因组中还可以包含编码car或外源性tcr的核酸序列。在一些实施方式中,所述遗传修饰的免疫细胞在其基因组中还可以包含编码能够在免疫细胞表面上表达的hla-e融合蛋白的核酸序列。
[0423]
编码car/tcr的核酸序列和/或编码所述hla-e融合蛋白的所述核酸序列可以与编码shrnamir的序列位于相同基因内。或者,编码car/tcr的核酸序列和/或编码所述hla-e融合蛋白的所述核酸序列可以与编码shrnamir的序列位于不同基因内。
[0424]
每个编码序列可以与不同启动子可操作地连接。在其他实施方式中,编码所述shrnamir的所述核酸序列和编码所述car或所述外源性tcr的所述核酸序列和/或编码所述
hla-e融合蛋白的所述核酸序列与相同启动子可操作地连接。在一些特定实例中,其中编码所述shrnamir的所述核酸序列,编码car或外源性tcr的核酸序列和编码所述hla-e融合蛋白的所述核酸序列均位于相同基因内,两个核酸序列与所述第一启动子可操作地连接,第三个核酸序列与所述第二启动子可操作地连接。在其他特定实例中,其中编码shrnami的核酸序列,编码car或外源性tcr的核酸序列和编码所述hla-e融合蛋白的所述核酸序列均位于相同基因内,全部三个核酸序列与相同启动子可操作地连接。在各种实施方式中,在插入基因组后,核酸序列可以与内源启动子可操作地连接。在一些这样的情况下,本发明的盒或模板核酸可能不需要外源性启动子来表达编码序列。此外,在此类情况下,盒或模板核酸可以包含核酸与内源性启动子可操作地连接所必需的元件(例如,剪接受体序列、2a或ires序列等)。在其他实施方式中,本发明的盒或模板核酸包含一种或多种外源启动子,其与核酸序列可操作地连接并驱动shrnamir、car或外源tcr和/或hla-e融合蛋白的表达。
[0425]
每个编码序列可以以相同的定向或彼此不同的定向存在于基因组中。例如,一个编码序列可以在双链dna的正链上,另一个编码序列在负链上。在一些实施方式中,shrnamir编码核酸序列是编码所述car或所述外源性tcr的所述核酸序列和/或编码所述hla-e融合蛋白的所述核酸序列的3’下游。在替代实施方式中,shrnamir编码序列是car/tcr编码序列和/或编码所述hla-e融合蛋白的所述核酸序列的5’上游。
[0426]
在一些实施方式中,核酸序列,如编码car或外源性tcr、shrnamir和/或hla-e融合蛋白的那些,与相同的启动子可操作地连接并被本领域已知的任何元件分隔以允许翻译来自同一核酸分子的两个或更多个基因(即,顺反子)。此类元件可以包括但不限于ires元件、t2a元件、p2a元件(例如,p2a/弗林蛋白酶)、e2a元件和f2a元件。
[0427]
在一些实施方式中,所述遗传修饰的免疫细胞包含编码细胞表面蛋白的核酸序列,该蛋白保护免疫细胞免受nk细胞杀伤。在一些实例中,核酸序列编码非经典mhc i类蛋白。非经典mhc i类蛋白可以包括但不限于hla-e、hla-f、hla-g和hla-h。在特定实例中,核酸序列编码hla-e蛋白。hla-e蛋白的实例包括但不限于hla-e-01:01蛋白或hla-e-01:03蛋白(例如,seq id no:118)。在本发明的特定实例中,核酸序列编码融合蛋白,该融合蛋白包含非经典的mhc i类蛋白(例如,hla-e)和至少一种能够在免疫细胞的细胞表面上表达mhc i类蛋白的另外的蛋白。融合蛋白可以包括,例如,与β-2微球蛋白蛋白(例如,seq id no:119)融合的mhc i类蛋白(例如,hla-e),其能够在细胞表面上表达mhc i类蛋白。为了抑制内源性β-2微球蛋白的表达,以及不表达包含β-2微球蛋白的融合蛋白,可以改变(例如,密码子优化)融合蛋白中的β-2微球蛋白编码序列,以使得shrnamir对改变的序列不具有特异性。在其他实例中,融合蛋白包含与β-2微蛋白和由非经典mhc在细胞外呈递的另外的蛋白融合的非经典mhc i类蛋白(例如,hla-e)。此类另外的蛋白可以包括例如hla-g前导肽(例如,seq id no:120)。融合蛋白的各个蛋白可以通过多肽接头融合,例如,包含seq id no:121(即,(ggggs)3接头)或seq id no:122(即,(ggggs)4接头)的接头。
[0428]
在特定实施方式中,融合蛋白是hla-e融合蛋白,所述hla-e融合蛋白包含hla-e蛋白、β-2微球蛋白蛋白和hla-g前导肽。在一些此类实施方式中,hla-e蛋白是hla-e-01:01蛋白或hla-e-01:03蛋白,并且特定实施方式中,hla-e蛋白是hla-e-01:03蛋白,其具有seq id no:118的氨基酸序列。在一些此类实施方式中,β-2微球蛋白具有seq id no:119的氨基酸序列,和hla-g前导肽具有seq id no:120的氨基酸序列。在其他此类实施方式中,hla-e
蛋白、β-2微球蛋白蛋白和hla-g前导蛋白通过多肽接头融合,所述多肽接头包含seq id no:121(即,(ggggs)3接头)或seq id no:122(即,(ggggs)4接头)。在一个特定实施方式中,融合蛋白包含与seq id no:66具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至多99%序列同一性的氨基酸序列。在一个特定实施方式中,融合蛋白包含seq id no:66的氨基酸序列。
[0429]
在一些实施方式中,所述遗传修饰的免疫细胞包含编码嵌合抗原受体(car)的核酸序列。通常地,本公开内容的car将至少包含胞外域、跨膜结构域和胞内结构域。在一些实施方式中,胞外域包含靶特异性结合元件,也称为胞外配体结合域或部分。在一些实施方式中,胞内域或胞质结构域至少包含至少一个共刺激结构域和一个或多个信号传导结构域。
[0430]
在一些实施方式中,在本发明中使用的car包含胞外配体结合结构域。配体结合结构域的选择取决于定义靶细胞表面的配体的类型和数量。例如,可以选择配体结合结构域来识别在与特定疾病状态相关的靶细胞上充当细胞表面标志物的配体。因此,可以作为car中配体结合结构域的配体的细胞表面标志物的一些例子可以包括与病毒、细菌和寄生虫感染、自身免疫性疾病和癌细胞相关的那些标志物。在一些实施方式中,car被设计成通过工程化期望的配体结合部分来靶向感兴趣的癌症特异性抗原,该配体结合部分与癌症(即,肿瘤)细胞上的抗原特异性结合。在本公开内容的上下文中,“癌抗原”、肿瘤抗原、“癌特异性抗原”或“肿瘤特异性抗原”是指特定的过度增殖性疾病如癌症所共有的抗原。
[0431]
在一些实施方式中,car的细胞外配体结合结构域对任何感兴趣的抗原或表位,特别是任何肿瘤抗原或感兴趣的表位具有特异性。作为非限制性实例,在一些实施方式中,靶点抗原是肿瘤相关抗原,如erbb2(her2/neu)、癌胚抗原(cea)、上皮细胞粘附分子(epcam)、表皮生长因子受体(egfr)、egfr变体iii(egfrviii)、cd19、cd20、cd22、cd30、cd40、cd79b、il1rap、蛋白多糖3(gpc3)、cll-1、双唾液酸神经节苷脂gd2、导管上皮粘蛋白、gp36、tag-72、鞘糖脂、胶质瘤相关抗原、b人绒毛促性腺激素、甲胎蛋白(afp)、凝集素反应性afp、甲状腺球蛋白、rage-1、mn-ca ix、人端粒酶逆转录酶、ru1、ru2(as)、肠羧基酯酶、mut hsp70-2、m-csf、前列腺酶、前列腺酶特异性抗原(psa)、pap、ny-eso-1、laga-la、p53、prostein、psma、存活和端粒酶、前列腺癌肿瘤抗原-1(pcta-1)、mage、elf2m、中性粒细胞弹性蛋白酶、肝配蛋白b2、胰岛素生长因子(igfl)-l、igf-ii、igfi受体、间皮素、主要组织相容性复合物(mhc)分子呈递肿瘤特异性肽表位、5t4、ror1、nkp30、nkg2d、肿瘤基质抗原、纤连蛋白的额外结构域a(eda)和额外结构域b(edb)以及生腱蛋白-c(tnc al)和成纤维细胞相关蛋白(fap)的a1结构域;谱系特异性或组织特异性抗原,如cd3、cd4、cd8、cd24、cd25、cd33、cd34、cd38、cd123、cd133、cd138、ctla-4、b7-1(cd80)、b7-2(cd86)、内皮糖蛋白、主要组织相容性复合物(mhc)分子、bcma(cd269、tnfrsf 17)、cs1或病毒特异性表面抗原,如hiv特异性抗原(如hiv gpl20);ebv特异性抗原、cmv特异性抗原、hpv特异性抗原,如e6或e7癌蛋白、lasse病毒特异性抗原、流感病毒特异性抗原以及这些表面标志物的任何衍生物或变体。
[0432]
在一些实例中,胞外配体结合结构域或部分是抗体或抗体片段。例如,抗体片段可以是抗体的至少一部分,其保留与抗原表位特异性相互作用(例如,通过结合、空间位阻、稳定/去稳定、空间分布)的能力。抗体片段的实例包括但不限于fab、fab’、f(ab’)2、fv片段、scfv抗体片段、二硫键连接的fvs(sdfv)、由vh和ch1结构域组成的fd片段、线性抗体、单域抗体,如sdab(vl或vh)、骆驼vhh结构域、由抗体片段形成的多特异性抗体,如包含通过铰链
区二硫键连接的两个fab片段的二价片段,以及抗体的分离的cdr或其他表位结合片段。还可以将抗原结合片段引入单域抗体、大抗体、微抗体、纳米抗体、胞内抗体、双抗体、三抗体、四抗体、v-nar和bis-scfv(参见,例如,hollinger和hudson,nature biotechnology23:1126-1136,2005)。抗原结合片段也可以移植到基于多肽的支架中,如纤连蛋白iii型(fn3)(参见美国专利号6,703,199,其描述了纤连蛋白多肽微抗体)。
[0433]
在一些实施方式中,细胞外配体结合结构域或部分是源自单克隆抗体的单链可变片段(scfv)的形式,其提供对特定表位或抗原的特异性(例如,优选存在于细胞表面的表位或抗原,如癌细胞或其他致病细胞或颗粒)。在一些此类实施方式中,scfv可以包含来自对抗原具有特异性的单克隆抗体的重链可变(vh)结构域和轻链可变结构(vl)域。在一些实施方式中,scfv是通过接头序列附接的。在一些实施方式中,scfv是鼠源的、人源化或全人的。
[0434]
嵌合抗原受体的胞外配体结合结构域也可包含自身抗原(参见,payne等,(2016),science 353(6295):179-184),其可被b淋巴细胞上的自身抗原特异性b细胞受体识别,从而指导t细胞特异性靶向并杀死抗体介导的自身免疫性疾病中的自体反应性b淋巴细胞。这样的car可以被称为嵌合自身抗体受体(caar),并且其用途涵盖在本发明中。
[0435]
在一些实施方式中,嵌合抗原受体的胞外结构域可以包含目标抗原的天然存在的配体,或保留结合目标抗原的能力的天然存在的配体的片段。
[0436]
car可以包含跨膜结构域,其通过铰链区或间隔区序列将细胞外配体结合结构域与细胞内信号传导和共刺激结构域连接起来。跨膜结构域可以源自任何膜结合蛋白或跨膜蛋白。例如,跨膜多肽可以是t细胞受体的亚基(例如,α、β、γ或ζ,构成cd3复合物的多肽)、il2受体p55(α链)、p75(β链)或γ链,fc受体(例如,fcγ受体iii)或cd蛋白的亚基链,如cd8α链。在某些实例中,跨膜结构域是cd8α结构域。或者,跨膜结构域可以是合成的并且可以主要包含疏水性残基,如亮氨酸和缬氨酸。
[0437]
铰链区指起到将跨膜结构域连接到胞外配体结合结构域的作用的任何寡核苷酸或多肽。例如,铰链区可包含多达300个氨基酸,优选10至100个氨基酸,最优选25至50个氨基酸。铰链区可源自天然存在的分子的全部或部分,如源自cd8、cd4或cd28的胞外区的全部或部分,或源自抗体恒定区的全部或部分。或者,铰链区可以是对应于天然存在的铰链序列的合成序列或可以是完全合成的铰链序列。在特定实例中,铰链结构域可以包含人cd8α链、fcyrllla受体或iggl的一部分。在某些实例中,铰链区可以是cd8α结构域。
[0438]
car的胞内信号传导结构域负责激活已放置car的细胞的至少一种正常效应功能和/或激活增殖和细胞存活途径。术语“效应功能”指细胞的特定功能。例如,t细胞的效应功能可以是细胞溶解活性或辅助活性,包括细胞因子的分泌。细胞内刺激结构域可以包括一个或更多个胞质信号传导结构域,其在抗原结合后将激活信号向t细胞细胞的传递。这样的胞质信号传导结构域可以包括但不限于cd3-ζ锌信号传导结构域。
[0439]
细胞内刺激结构域还可以包括一个或多个细胞内共刺激结构域,其在配体结合后传递增殖和/或细胞存活信号。在一些情况下,共刺激结构域可以包含一个或多个traf结合结构域。这样的细胞内共刺激结构域可以是本领域公知的那些中的任何一个,并且可以包括但不限于wo2018/067697中公开的那些共刺激结构域,包括例如,novel 6(“n6”)。共刺激结构域的其他实例可以包括4-1bb(cd137)、cd27、cd28、cd8、ox40、cd30、cd40、pd-1、icos、淋巴功能相关抗原-1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3、与cd83特异性结合的配体或
者其任何组合。在一个特定实施方式中,共刺激结构域是n6结构域。在另一个特定实施方式中,共刺激结构域是4-1bb共刺激结构域。
[0440]
在其他实施方式中,所述遗传修饰的免疫细胞包含编码外源性t细胞受体(tcr)的核酸序列。此类外源性t细胞受体可以包含α链和β链,或者,替代地,可以包含γ链和δ链。可用于本发明的外源性tcr可对任何目标抗原或表位具有特异性,例如但不限于本文公开的任何抗原或表位。
[0441]
在特定实施方式中,car或外源性tcr可以对任何类型的癌细胞是特异性的。此类癌症包括但不限于癌瘤、淋巴瘤、肉瘤、母细胞瘤、白血病、b细胞起源的癌症、乳腺癌、胃癌、神经母细胞瘤、骨肉瘤、肺癌、黑色素瘤、前列腺癌、结肠癌、肾细胞癌、卵巢癌、横纹肌肉瘤、白血病和霍奇金氏淋巴瘤。在特定实施方式中,癌症和病证包括但不限于pre-b all(儿科适应症)、成人all、套细胞淋巴瘤、弥漫性大b细胞淋巴瘤、同种异体骨髓移植后的挽救等。可以使用靶向例如cd19、cd20、cd22和/或ror1的car的组合治疗这些癌症。在一些非限制性实例中,本公开内容的遗传修饰的免疫细胞或其群体靶向癌瘤、淋巴瘤、肉瘤、黑色素瘤、母细胞瘤、白血病和生殖细胞肿瘤,包括但不限于b细胞起源的癌症、神经母细胞瘤、骨肉瘤、前列腺癌、肾细胞癌、肝癌、胃癌、骨癌、胰腺癌、皮肤癌、头颈癌、乳腺癌、肺癌、皮肤或眼内恶性黑色素瘤、肾癌、子宫癌、卵巢癌、结直肠癌、结肠癌、直肠癌、肛门来源的癌症、胃癌、睾丸癌、子宫癌、输卵管癌、子宫内膜癌、宫颈癌、阴道癌、外阴癌、非霍奇金氏淋巴瘤、食道癌、小肠癌、内分泌系统癌症、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、儿童实体瘤、淋巴细胞淋巴瘤、膀胱癌、肾癌或输尿管癌、肾盂癌、中枢神经系统(cns)赘生物、原发性cns淋巴瘤、肿瘤血管生成、脊髓轴肿瘤、脑干胶质瘤、垂体腺瘤、卡波西氏肉瘤、表皮样癌、鳞状细胞癌、环境诱发的癌症,包括石棉诱发的癌症、多发性骨髓瘤、霍奇金氏淋巴瘤、非霍奇金氏淋巴瘤、急性髓性淋巴瘤、慢性髓性白血病、慢性淋巴性白血病、免疫母细胞性大细胞淋巴瘤、急性淋巴细胞性白血病、蕈样真菌病、间变性大细胞淋巴瘤和t细胞淋巴瘤,以及所述癌症的任何组合。在一些实施方式中,b细胞起源的癌症包括但不限于b谱系急性淋巴母细胞性白血病、b细胞慢性淋巴细胞性白血病、b细胞淋巴瘤、弥漫性大b细胞淋巴瘤、pre-b all(儿科适应症)、套细胞淋巴瘤、滤泡性淋巴瘤、边缘区淋巴瘤、伯基特氏淋巴瘤、多发性骨髓瘤和b细胞非霍奇金氏淋巴瘤。在一些实例中,癌症可以包括但不限于b细胞起源的癌症或多发性骨髓瘤。在一些实例中,b细胞起源的癌症是急性淋巴母细胞白血病(all)、慢性淋巴细胞白血病(cll)、小淋巴细胞淋巴瘤(sll)或非霍奇金氏淋巴瘤(nhl)。在一些实例中,b细胞起源的癌症是套细胞淋巴瘤(mcl)或弥漫性大b细胞淋巴瘤(dlbcl)。
[0442]
在一些实施方式中,本发明的遗传修饰的免疫细胞包含失活的tcrα基因和/或灭活的tcrβ基因。tcrα基因和/或tcrβ基因失活以产生本发明的遗传修饰细胞发生在表达tcrα基因和/或tcrβ基因的至少一个或两个等位基因中。因此,一种或两种基因失活会阻止内源性tcrα链或内源性tcrβ链蛋白的表达。这些蛋白的表达是在细胞表面组装内源性α/βtcr所必需的。因此,tcrα基因和/或tcrβ基因的失活导致遗传修饰的免疫,其没有可检测的细胞表面表达的内源性α/βtcr。内源性α/βtcr引入cd3。因此,具有失活的tcrα基因和/或tcrβ链的细胞无法检测到cd3的细胞表面表达。在特定实施方式中,失活的基因是tcrα恒定区(trac)基因。
[0443]
在一些实例中,tcrα基因、trac基因或tcrβ基因通过将模板核酸插入基因的切割
位点而失活。模板核酸的插入破坏了内源性tcrα链或tcrβ链的表达,从而阻止了内源性α/βtcr在t细胞表面的组装。在一些实例中,将模板核酸插入到trac基因中。在特定实例中,模板核酸在包含seq id no:58(即trc 1-2识别序列)的工程化大范围酶基因识别序列处插入到trac中。在特定实例中,car转基因插入到seq id no:58的核苷酸位置13和14之间。
[0444]
在其中遗传修饰的免疫细胞表达car或外源性tcr的那些实施方式的一些中,此类细胞没有可检测的内源性t细胞受体(例如,α/βt细胞受体)的细胞表面表达。因此,本发明还提供了表达shrnamir并且没有可检测的内源性t细胞受体(例如,α/βt细胞受体)的细胞表面表达的遗传修饰的免疫细胞群体,并且在一些实施方式中还表达car或外源性tcr。例如,所述群体可以包含表达car(即,car+)或外源t细胞受体(即,exotcr+)且不具有内源性t细胞受体的细胞表面表达(即,tcr-)的多个本发明的遗传修饰的免疫细胞。
[0445]
如本文所用,“内源性tcr的可检测细胞表面表达”是指使用标准实验方法检测免疫细胞细胞表面上tcr复合物(例如,α/βtcr复合物)的一种或多种成分的能力。此类方法可以包括例如对tcr本身的成分(如tcrα或tcrβ链)或组装的细胞表面tcr复合物的成分(如cd3)特异的免疫染色和/或流式细胞术。用于检测免疫细胞上内源性tcr(例如,α/βtcr)的细胞表面表达的方法包括本文实施例中描述的那些,以及例如macleod等,(2017)molecular therapy25(4):949-961中描述的那些。
[0446]
2.4 shrnamir靶蛋白
[0447]
本公开的组合物和方法的遗传修饰的免疫细胞可以包含并表达降低任何内源性蛋白表达的shrnamir。可以使用shrnamir降低其内源性表达的内源性蛋白的非限制性实例包括β-2微球蛋白(b2m)、转化生长因子β受体2(tgfbr2)、cbl原癌基因b(cbl-b)、cs1、cd52、脱氧胞苷激酶(dck)、糖皮质激素受体(gr)、t细胞受体α基因和t细胞受体α恒定区基因。
[0448]
a.β-2微球蛋白
[0449]
在一些实施方式中,由于shrnamir分子的表达,表达水平降低的内源性蛋白是b2m。b2m是主要组织相容性复合体(mhc)i类分子的组成部分,如果没有b2m,其不会在细胞表面组装。除了b2m外,mhc i类分子还包含α1、α2和α3蛋白。在mhc i类分子中,b2m蛋白位于细胞表面的α3蛋白旁边和α1蛋白下方。b2m缺乏跨膜区,其是mhc i类分子肽结合沟稳定性所必需的。
[0450]
shrnamir分子可以靶向b2m mrna的任何区域。代表性b2m mrna和蛋白序列是本领域公知的。b2m mrna序列的非限制性实例是ncbi acc.no.nm_004048.3和b2m蛋白序列是ncbi acc.no.np_004039.1。
[0451]
在其中b2m的表达被shrnamir降低的那些实施方式的一些中,与对照细胞相比(例如,不表达b2m靶向shrnamir的细胞),b2m的表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。
[0452]
鉴于b2m是mhc i类分子在细胞表面组装所必需的,b2m表达降低的细胞也表现出细胞表面mhc i类分子的减少。在这些实施方式的一些中,与对照细胞相比(例如,不表达b2m靶向shrnamir的细胞),在细胞表面上mhc i类分子的表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。
[0453]
靶向b2m的shrnamir分子可以包含与b2m基因内的序列互补(完全或部分)的任何随从序列和相应的引导序列。在一些实施方式中,shrnamir的随从序列和引导序列分别包含如seq id no:17和18所示的序列(例如,b2m 7289shrnamir)。在特定实施方式中,shrnamir的随从序列和引导序列分别包含如seq id no:7和8所示的序列(例如,b2m 7282shrnamir)。在其他实施方式中,shrnamir的随从序列和引导序列分别包含如seq id no:9和10所示的序列(例如,b2m 7285shrnamir)。在另外其他实施方式中,shrnamir的随从序列和引导序列分别包含如seq id no:11和12所示的序列(例如,b2m 7286shrnamir)。在另外其他实施方式中,shrnamir的随从序列和引导序列分别包含如seq id no:13和14所示的序列(例如,b2m 7287shrnamir)。在特定实施方式中,shrnamir的随从序列和引导序列分别包含如seq id no:15和16所示的序列(例如,b2m 7288shrnamir)。在一些实施方式中,shrnamir的随从序列和引导序列分别包含如seq id no:19和20所示的序列(例如,b2m 7290shrnamir)。
[0454]
b2m靶向shrnamir可以包含与seq id no:41-47的任一项中所示的核酸序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或更高序列同一性的序列。在一些实施方式中,shrnamir包含seq id no:41中所示的序列。在一些实施方式中,shrnamir包含seq id no:42中所示的序列。在一些实施方式中,shrnamir包含seq id no:43中所示的序列。在一些实施方式中,shrnamir包含seq id no:44中所示的序列。在一些实施方式中,shrnamir包含seq id no:45中所示的序列。在一些实施方式中,shrnamir包含seq id no:46中所示的序列。在一些实施方式中,shrnamir包含seq id no:47中所示的序列。
[0455]
与对照细胞(例如,不表达b2m靶向shrnamir的细胞)相比,b2m和mhc i类分子水平降低的细胞可以表现出降低的同种异体性。如本文所用,术语“同种异体性”是指细胞被免疫系统识别并作用于“其他”或非自体细胞的能力。可以使用本领域公知的任何方法测量同种异体性,包括在本文别处描述的那些方法,其中在与引发的同种异体抗原特异性ctl或nk细胞孵育之后定量活细胞的百分比。
[0456]
b.cs1
[0457]
在一些实施方式中,由于shrnamir分子的表达,表达水平降低的内源性蛋白是cs1(也称为ccnd3子集1、cracc、cd319和slamf7)。cs1是信号传导淋巴细胞激活分子(slam)相关受体家族的成员,在正常nk细胞、b细胞、t细胞、树突状细胞、nk-t细胞和单核细胞的表面表达。cs1被多发性骨髓瘤细胞过度表达,可作为多发性骨髓瘤的免疫治疗靶点。
[0458]
shrnamir可以靶向cs1 mrna的任何区域。代表性cs1 mrna和蛋白序列是本领域公知的。cs1 mrna序列的非限制性实例是ncbi acc.no.nm_021181和cs1蛋白序列是ncbi acc.no.np_067004.3。
[0459]
在其中cs1的表达被shrnamir降低的那些实施方式的一些中,与对照细胞相比(例如,不表达cs1靶向shrnamir的细胞),cs1的细胞表面表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。
[0460]
靶向cs1的shrnamir分子可以包含与cs1基因内的序列互补(完全或部分)的任何
随从序列和相应的引导序列。在一些实施方式中,shrnamir的随从序列和引导序列分别包含如seq id no:21和22所示的序列。在一些实施方式中,shrnamir的随从序列和引导序列分别包含如seq id no:23和24所示的序列。在一些实施方式中,shrnamir的随从序列和引导序列分别包含如seq id no:25和26所示的序列。
[0461]
cs1靶向shrnamir可以包含与seq id no:48-50的任一项中所示的核酸序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或更高序列同一性的序列。在特定实施方式中,shrnamir包含seq id no:48-50的任一项中所示的序列。在一些实施方式中,shrnamir包含seq id no:48中所示的序列。在一些实施方式中,shrnamir包含seq id no:49中所示的序列。在一些实施方式中,shrnamir包含seq id no:50中所示的序列。
[0462]
在其中遗传修饰细胞表达降低cs1表达的shrnamir的一些实施方式中,所述遗传修饰的免疫细胞包含对cs1具有特异性的car。对cs1具有特异性的car的非限制性实例包括但不限于wo2014/179759、wo2015121454和wo 2016/090369中描述的那些。
[0463]
与对照细胞(例如,不表达cs1靶向shrnamir的细胞)相比,通过shrnamir表达敲低cs1表达的细胞对表达对cs1具有特异性的car的遗传修饰的免疫细胞的杀伤力较低。这在使用对cs1具有特异性的car表达细胞治疗疾病(如多发性骨髓瘤)时很有用,其中car表达细胞长期存在以及因此杀死患病细胞(例如,多发性骨髓瘤细胞)是所需的。如本文所用,术语“自相残杀(fratricide)”指类似基因型和/或表型的细胞杀死细胞。可以使用本领域公知的任何方法测量表达cs1特异性car的遗传修饰的免疫细胞造成的自相残杀,包括但不限于将表达cs1特异性shrnamir的免疫细胞与表达cs1特异性car的免疫细胞孵育并定量表达shrnamir的活细胞的数量。
[0464]
c.tgfbr2
[0465]
在一些实施方式中,由于shrnamir分子的表达,表达水平降低的内源性蛋白是转化生长因子β受体2(tgfbr2)。tgfbr2是结合转化生长因子-β(tgfb)的跨膜受体。tgfbr2包含丝氨酸/苏氨酸蛋白激酶结构域并与其他tgfb受体异二聚化。
[0466]
shrnamir分子可以靶向tgfbr2 mrna的任何区域。代表性b2m mrna和蛋白序列是本领域公知的。tgfbr2 mrna序列的非限制性实例是nm_001024847.2和tgfbr2蛋白序列是ncbi acc.no.np_001020018.1。
[0467]
在其中tgfbr2的表达被shrnamir降低的那些实施方式的一些中,与对照细胞相比(例如,不表达tgfbr2靶向shrnamir的细胞),tgfbr2的细胞表面表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。
[0468]
靶向tgfbr2的shrnamir分子可以包含与tgfbr2基因内的序列互补(完全或部分)的任何随从序列和相应的引导序列。在一些实施方式中,shrnamir的随从序列和引导序列分别包含如seq id no:27和28所示的序列(例如,tgfbr2 721110shrnamir)。在其他实施方式中,shrnamir的随从序列和引导序列分别包含如seq id no:29和30所示的序列(例如,tgfbr2 721111shrnamir)。在另外其他实施方式中,shrnamir的随从序列和引导序列分别包含如seq id no:31和32所示的序列(例如,tgfbr2 721112shrnamir)。在另外其他实施方
式中,shrnamir的随从序列和引导序列分别包含如seq id no:33和34所示的序列(例如,tgfbr2721113shrnamir)。在特定实施方式中,shrnamir的随从序列和引导序列分别包含如seq id no:35和30所示的序列(例如,tgfbr2721114shrnamir)。
[0469]
tgfbr2靶向shrnamir可以包含与seq id no:51-55的任一项中所示的核酸序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或更高序列同一性的序列。在特定实施方式中,shrnamir包含seq id no:51-55的任一项中所示的序列。在一些实施方式中,shrnamir包含seq id no:51中所示的序列。在一些实施方式中,shrnamir包含seq id no:52中所示的序列。在一些实施方式中,shrnamir包含seq id no:53中所示的序列。在一些实施方式中,shrnamir包含seq id no:54中所示的序列。在一些实施方式中,shrnamir包含seq id no:55中所示的序列。
[0470]
在其中遗传修饰免疫细胞表达降低tgfbr2表达的shrnamir的一些实施方式中,与对照细胞相比(例如,不表达tgfbr2靶向shrnamir的免疫细胞),所述遗传修饰的免疫细胞对转化生长因子b1(tgfb1)的免疫抑制较不敏感。如本文所用,术语“免疫抑制”是指免疫系统的激活或功效的降低。可以使用本领域公知的任何方法测量tgfb1的免疫抑制,包括但不限于测量tgfb1对t细胞分化和/或细胞因子产生的影响。
[0471]
d.cbl-b
[0472]
在一些实施方式中,由于shrnamir分子的表达,表达水平降低的内源性蛋白是cbl原癌基因b(cbl-b)。cbl-b是一种e3泛素连接酶,可催化泛素与蛋白的连接,从而靶向蛋白进行降解。
[0473]
shrnamir分子可以靶向cbl-b mrna的任何区域。代表性cbl-b mrna和蛋白序列是本领域公知的。cbl-b mrna序列的非限制性实例是ncbi acc.no.nm_170662.5和cbl-b蛋白序列是ncbi acc.no.np_733762.2。
[0474]
在其中cbl-b的表达被shrnamir降低的那些实施方式的一些中,与对照细胞相比(例如,不表达cbl-b靶向shrnamir的细胞),cbl-b的细胞表面表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。
[0475]
靶向cbl-b的cbl-b shrnamir分子可以包含与cbl-b基因内的序列互补(完全或部分)的任何随从序列和相应的引导序列。
[0476]
在其中遗传修饰的免疫细胞表达降低cbl-b表达的shrnamir的一些实施方式中,与对照细胞(例如,不表达cbl-b靶向shrna的免疫细胞)相比,所述遗传修饰的免疫细胞较不易受下游信号传导蛋白降解而导致的t细胞受体(tcr)信号传导抑制的影响。cbl蛋白调节p85(pi3k的调节亚基)、磷脂酶c-g和酪氨酸激酶(如lck、fyn和zap70)的周转(turnover),所有这些都参与tcr信号传导(lee等,(2003)science 302:1218-1222)。可以使用本领域公知的任何方法,包括但不限于elisa、流式细胞术、western印迹、免疫细胞化学和免疫沉淀来测量对通过下游信号传导蛋白降解而抑制tcr信号传导的敏感性。
[0477]
e.cd52
[0478]
在一些实施方式中,由于shrnamir分子的表达,表达水平降低的内源性蛋白是cd52(分化簇52),其也称为campath-1抗原。cd52是一种存在于成熟淋巴细胞表面以及单核
细胞和树突细胞上的糖蛋白。可溶性cd52分子与唾液酸结合免疫球蛋白样凝集素10(siglec10)相互作用以抑制t细胞增殖和活化(zhao等,(2017)inflamm res 66(7):571-578)。
[0479]
shrnamir分子可以靶向cd52 mrna的任何区域。代表性cd52mrna和蛋白序列是本领域公知的。cd52 mrna序列的非限制性实例是ncbi acc.no.nm_001803.3和cd52蛋白序列是ncbi acc.no.np_001794.2。
[0480]
在其中cd52的表达被shrnamir降低的那些实施方式的一些中,与对照细胞相比(例如,不表达cd52靶向shrnamir的细胞),cd52的细胞表面表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。
[0481]
靶向cd52的shrnamir分子可以包含与cd52基因内的序列互补(完全或部分)的任何随从序列和相应的引导序列。在一些实施方式中,shrnamir的随从序列和引导序列分别包含如seq id no:37和38所示的序列(例如,cd52 72123shrnamir)。在其他实施方式中,shrnamir的随从序列和引导序列分别包含如seq id no:39和40所示的序列(例如,cd52 72124shrnamir)。
[0482]
cd52靶向shrnamir可以包含与seq id no:56或57所示的核酸序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或更高序列同一性的序列。在特定实施方式中,shrnamir包含如seq id no:56或57所示的序列。在一些实施方式中,shrnamir包含seq id no:56中所示的序列。在一些实施方式中,shrnamir包含seq id no:57中所示的序列。
[0483]
在其中遗传修饰免疫细胞表达降低cd52表达的shrnamir的一些实施方式中,所述遗传修饰的免疫细胞对cd52抗体诱导的细胞死亡较不敏感。
[0484]
f.脱氧胞苷激酶(dck)
[0485]
在一些实施方式中,由于shrnamir分子的表达,表达水平降低的内源性蛋白是脱氧胞苷激酶(dck)。dck主要磷酸化脱氧胞苷并将其转化为脱氧胞苷单磷酸。
[0486]
shrnamir分子可以靶向dck mrna的任何区域。代表性dck mrna和蛋白序列是本领域公知的。dck mrna序列的非限制性实例是ncbi acc.no.nm_000788.3和dck蛋白序列是ncbi acc.no.np_000779.1。
[0487]
在其中dck的表达被shrnamir降低的那些实施方式的一些中,与对照细胞相比(例如,不表达dck靶向shrnamir的细胞),dck的细胞表面表达降低至少约10%、约20%、约30%、约40%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或至多约99%。
[0488]
靶向dck的shrnamir分子可以包含与dck基因内的序列互补(完全或部分)的任何随从序列和相应的引导序列。在一些实施方式中,shrnamir的随从序列和引导序列分别包含如seq id no:76和77所示的序列(例如,dck 72136shrnamir)。在其他实施方式中,shrnamir的随从序列和引导序列分别包含如seq id no:78和79所示的序列(例如,dck 72137shrnamir)。在其他实施方式中,shrnamir的随从序列和引导序列分别包含如seq id no:80和81所示的序列(例如,dck 72138shrnamir)。在其他实施方式中,shrnamir的随从序
no:105和106所示的序列(例如,gr 72151shrnamir)。在其他实施方式中,shrnamir的随从序列和引导序列分别包含如seq id no:107和108所示的序列(例如,gr 72152shrnamir)。
[0496]
gr靶向shrnamir可以包含与seq id no:109-117的任一项中所示的核酸序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或更高序列同一性的序列。在特定实施方式中,shrnamir包含与seq id no:109-117的任一项中所示的序列。在一些实施方式中,shrnamir包含seq id no:109中所示的序列。在一些实施方式中,shrnamir包含seq id no:110中所示的序列。在一些实施方式中,shrnamir包含seq id no:111中所示的序列。在一些实施方式中,shrnamir包含seq id no:112中所示的序列。在一些实施方式中,shrnamir包含seq id no:113中所示的序列。在一些实施方式中,shrnamir包含seq id no:114中所示的序列。在一些实施方式中,shrnamir包含seq id no:115中所示的序列。在一些实施方式中,shrnamir包含seq id no:116中所示的序列。在一些实施方式中,shrnamir包含seq id no:117中所示的序列。
[0497]
在其中遗传修饰免疫细胞表达降低gr表达的shrnamir的一些实施方式中,所述遗传修饰的免疫细胞对糖皮质激素(如皮质醇或地塞米松)的影响(如增殖减少)较不敏感。实际上,可以通过将细胞群体与糖皮质激素一起孵育来富集具有降低的gr表达的遗传修饰的免疫细胞。此外,当在治疗过程中给予糖皮质激素(例如,类固醇)时,具有降低的gr表达的遗传修饰的免疫细胞(例如,car t细胞)在免疫治疗期间可能在体内具有更大的持久性。
[0498]
2.5降低内源性蛋白表达的方法
[0499]
本发明提供了通过将包含编码shrnamir的核酸序列的模板核酸引入细胞中,从而将模板核酸插入基因组并表达来降低免疫细胞中内源性蛋白表达的方法。
[0500]
可以通过随机整合将模板核酸插入到免疫细胞的基因组中。或者,可以通过核酸酶介导的靶向插入将模板核酸插入靶基因中,其中工程化核酸酶对免疫细胞基因组中的识别序列具有特异性,并在识别序列处产生切割位点,允许模板核酸在切割位点处插入免疫细胞的基因组中。
[0501]
任何工程化核酸酶均可用于靶向插入模板核酸,包括工程化大范围核酸酶、锌指核酸酶、talen、致密talen、crispr系统核酸酶或megatal。
[0502]
例如,可以将锌指核酸酶(zfn)工程化为识别和切割基因组中的预定位点。zfn是嵌合蛋白,包含与来自核酸内切酶或核酸外切酶(例如,ii型限制性内切核酸酶,如foki限制性内切酶)的核酸酶结构域融合的锌指dna结合结构域。锌指结构域可以是天然序列,也可以通过合理或实验手段重新设计,以产生与预定dna序列约18个碱基对长度结合的蛋白。通过将这个工程化的蛋白结构域与核酸酶结构域融合,有可能以基因组水平的特异性靶向dna断裂。zfn已广泛用于靶向多种真核生物中的基因添加、去除和替换(s.durai等综述,nucleic acids res 33,5978(2005))。
[0503]
同样,可以产生tal效应核酸酶(talen)来切割基因组dna中的特定位点。与zfn一样,talen包含与核酸内切酶或核酸外切酶(例如,ii型限制性核酸内切酶,如foki限制性内切酶)融合的工程化、位点特异性dna结合结构域(mak,等综述,(2013)curr opin struct biol.23:93-9)。然而,在这种情况下,dna结合结构域包含tal效应结构域的串联阵列,其每一个特异性识别单个dna碱基对。
[0504]
致密talen是替代的核酸内切酶结构,其可避免二聚化的需要(beurdeley,等,(2013)nat commun.4:1762)。致密talen与来自i-tevi归巢核酸内切酶或美国申请号20130117869表2中所列任何核酸内切酶的核酸酶结构域融合的工程化、位点特异性tal效应dna结合结构域。致密talen针对dna加工活动不需要二聚化,所以致密talen作为单体发挥功能。
[0505]
基于crispr/cas系统的工程化核酸内切酶也是本领域公知的(ran,等,(2013)nat protoc.8:2281-2308;mali等,(2013)nat methods.10:957-63)。crispr系统包含两个组分:(1)crispr核酸酶;和(2)短“引导rna”,其包含约20个核苷酸的靶向序列,可将核酸酶引导至基因组中的目标位置。crispr系统还包含tracrrna。通过在同一细胞中表达多个引导rna,每个都具有不同的靶向序列,可以将dna断裂同时靶向基因组中的多个位点。
[0506]
在大于12个碱基对的识别序列处结合双链dna的工程化大范围核酸酶可用于目前公开的方法。大范围核酸酶可以是源自i-crei的核酸内切酶,并且可以指针对例如dna结合特异性、dna切割活性、dna结合亲和性或二聚化性质相对于天然i-crei已被修饰的i-crei的工程化变体。用于生产此类修饰的i-crei变体的方法是本领域公知的(例如,wo 2007/047859,其全部内容通过引用并入)。如本文所用,大范围核酸酶结合至双链dna作为异二聚体。大范围核酸酶还可以是“单链大范围核酸酶”,其中使用肽接头将dna结合结构域对连接成单个多肽。
[0507]
称为megatal的核酸酶是单链核酸内切酶,其包含转录激活因子样效应(tale)dna结合结构域和工程化的序列特异性归巢核酸内切酶。
[0508]
在特定实施方式中,工程化核酸酶的识别序列在靶基因内。靶基因可以是其中需要改变序列的任何基因(例如,添加或减去核苷酸、替换核苷酸或者插入异源或外源序列)。例如,通过基因失活敲除靶基因可能是所需的。在一些实施方式中,靶基因是tcrα基因或tcrβ基因。在特定实施方式中,靶基因可以是tcrα恒定区(trac)基因。在一些特定实施方式中,靶基因是trac基因和识别序列是seq id no:58中所示的trc 1-2识别序列。
[0509]
在这些实施方式的一些中,模板核酸插入靶基因导致靶基因编码的全长内源性蛋白的表达中断。因此,在其中靶基因是tcrα基因、trac基因或tcrβ基因的那些实施方式的一些中,所述遗传修饰的免疫细胞不具有可检测的内源性tcr(如α/βtcr)的细胞表面表达,因为在缺乏这些基因编码的内源性蛋白的情况下,内源性tcr将无法在细胞表面正确组装。
[0510]
在特定实施方式中,其中由于编码α/βtcr组分的基因失活,所述遗传修饰的免疫细胞不能检测到内源性tcr(例如,α/βtcr)的细胞表面表达,所述遗传修饰的免疫细胞进一步表达car或外源性tcr和/或hla-e融合蛋白。car或外源性tcr和/或hla-e融合蛋白可由包含在模板核酸内的序列编码。在这些实施方式的一些中,car/tcr编码序列和/或hla-e融合蛋白编码序列与同shrnamir编码序列不同的启动子可操作地连接。在替代实施方式中,car/tcr编码序列和/或hla-e融合蛋白编码需要与shrnamir编码序列与相同启动子可操作地连接,或不同启动子。car/tcr编码序列和/或hla-e融合蛋白编码序列可以在shrnamir编码序列的5’或3’,编码序列可以是相同或不同定向,如5’至3’或3’到5’。此外,编码序列可以由本领域公知的元件分隔以允许翻译来自相同核酸分子的两个或更多个基因(即,顺反子),包括但不限于ires元件、t2a元件、p2a元素(例如,p2a/弗林蛋白酶)、e2a元素和f2a元素。
[0511]
已经公开了使用核酸酶破坏内源性tcr的表达,包括使用锌指核酸酶(zfn)、转录激活因子样效应核酸酶(talen)、megatal和crispr系统(例如,osborn等,(2016),molecular therapy 24(3):570-581;eyquem等,(2017),nature 543:113-117;美国专利号8,956,828;美国公开号us2014/0301990;美国公开号us2012/0321667)。此前也公开了工程化大范围核酸酶用于切割人trac基因中的dna靶点的特定用途。例如,国际公开号wo2014/191527,其中公开了针对tcrα恒定区基因外显子1内的识别序列设计的i-onui大范围核酸酶变体。
[0512]
此外,在国际公开号wo 2017/062439和wo 2017/062451中,申请人公开了对tcrα恒定区(trac)基因的外显子1中的识别序列具有特异性的工程化大范围核酸酶。这些包括对trac基因外显子1中的trc 1-2识别序列(seq id no:58)具有特异性的“trc 1-2大范围核酸酶”。439号核451号公开文件还公开了将car编码序列或外源性tcr编码序列靶向插入tcr 1-2大范围核酸酶切割位点的方法。
[0513]
在特定实施方式中,用于实践本发明的核酸酶是单链大范围核酸酶。单链大范围核酸酶包含通过接头肽连接的n末端亚基核c末端亚基。两个结构域中的每一个都识别识别序列的一半(即,识别半位点),dna切割位点位于识别序列的中间,靠近两个亚基的界面。dna链断裂被四个碱基对抵消,使得dna被大范围核酸酶切割产生四碱基对,3’单链突出端。
[0514]
工程化核酸酶可以蛋白的形式或优选地作为编码工程化核酸酶的核酸递送到细胞中。此类核酸可以是dna(例如,环状或线性化的质粒dna或pcr产物)或rna(例如,mrna)。对于工程化核酸酶编码序列以dna形式递送的实施方式,其应该可操作地连接到启动子以促进核酸酶基因的转录。适用于本发明的哺乳动物启动子包括组成型启动子,如巨细胞病毒早期(cmv)启动子(thomsen等,(1984),proc natl acad sci usa.81(3):659-63)或sv40早期启动子(benoist和chambon(1981),nature.290(5804):304-10)以及诱导型启动子,如四环素诱导型启动子(dingermann等,(1992),mol cell biol.12(9):4038-45)。编码工程化核酸酶的核酸也可以与合成启动子可操作地连接。合成启动子可以包括但不限于jet启动子(wo2002/012514)。
[0515]
在一些实施方式中,将编码工程化核酸酶的核酸序列递送到重组dna构建体或盒上。例如,重组dna构建体可包含盒(即,“盒表达”),该盒包含启动子和编码本文所述的工程化核酸酶的核酸序列。
[0516]
在一些实施方式中,编码工程化核酸酶的mrna被递送至细胞,因为这降低了编码工程化核酸酶的基因整合到细胞基因组中的可能性。
[0517]
可以使用本领域公知的方法如体外转录来产生编码工程化核酸酶的mrna。在一些实施方式中,mrna包含修饰的5’帽。此类修饰的5’帽是本领域公知的,并且可以包括但不限于反向帽类似物(arca)(us7074596)、7-甲基-鸟苷、类似物,如帽1类似物(trilink;san diego,ca),或者使用例如牛痘加帽酶等的酶促加帽。在一些实施方式中,mrna可以被聚腺苷酸化。mrna可包含各种5’和3’非翻译序列元件以增强编码的工程化核酸酶的表达和/或mrna本身的稳定性。此类元件可以包括例如翻译后调控元件,如土拨鼠肝炎病毒翻译后调控元件。
[0518]
mrna可以含有核苷类似物或天然存在的核苷,如假尿苷、5-甲基胞苷、n6-甲基腺苷、5-甲基尿苷或2-硫尿苷。其他核苷类似物包括例如在us 8,278,036中描述的那些。
[0519]
在另一个特定实施方式中,可以使用单链dna模板将编码工程化核酸酶的核酸引入细胞。单链dna还可包含编码工程化核酸酶的序列上游和/或下游的5’和/或3’aav反向末端重复序列(itr)。在其他实施方式中,单链dna还可包含编码工程化核酸酶的序列上游和/或下游的5’和/或3’同源臂。
[0520]
在另一个特定实施方式中,可以使用线性化的dna模板将编码核酸酶的基因引入细胞。在一些实例中,编码核酸酶的质粒dna可以被一种或多种限制性酶消化,使得环状质粒dna在引入细胞之前线性化。
[0521]
纯化的核酸酶蛋白可以被递送到细胞中以切割基因组dna,这允许在切割位点与目标序列进行同源重组或非同源末端连接,通过本领域公知的多种不同机制,包括下文进一步详述的那些机制。
[0522]
在一些实施方式中,核酸酶蛋白或编码核酸酶的dna/mrna与细胞穿透肽或靶向配体偶联以促进细胞摄取。本领域公知的细胞穿透肽的实例包括多聚精氨酸(jearawiriyapaisarn,等,(2008)mol ther.16:1624-9)、来自hiv病毒的tat肽(hudecz等,(2005),med.res.rev.25:679-736)、mpg(simeoni,等,(2003)nucleic acids res.31:2717
–
2724)、pep-1(deshayes等,(2004)biochemistry 43:7698
–
7706)和hsv-1vp-22(deshayes等,(2005)cell mol life sci.62:1839-49)。在一个替代实施方式中,核酸酶蛋白或编码核酸酶的dna/mrna与抗体共价或非共价偶联,该抗体可识别靶细胞上表达的特定细胞表面受体,从而使核酸酶蛋白/dna/mrna与靶细胞结合并被其内化。或者,核酸酶蛋白/dna/mrna可以共价或非共价偶联到这种细胞表面受体的天然配体(或天然配体的一部分)上。(mccall,等,(2014)tissue barriers.2(4):e944449;dinda,等,(2013)curr pharm biotechnol.14:1264-74;kang,等,(2014)curr pharm biotechnol.15(3):220-30;qian等,(2014)expert opin drug metab toxicol.10(11):1491-508)。
[0523]
在一些实施方式中,使用本领域公知的方法将核酸酶蛋白或dna/mrna编码核酸酶共价地或优选地非共价地偶联至纳米颗粒或封装在此类纳米颗粒中(sharma,等,(2014)biomed res int.2014)。纳米颗粒是一种纳米级递送系统,其长度尺寸《1μm,优选《100nm。可以使用由金属、脂质、聚合物或生物大分子组成的核心来设计此类纳米粒子,并且核酸酶蛋白、mrna或dna的多个拷贝可以连接到或封装在纳米粒子核心上。这增加了递送到每个细胞的蛋白/mrna/dna的拷贝数,因此,增加了每种核酸酶的细胞内表达,以最大限度地增加靶识别序列被切割的可能性。此类纳米颗粒的表面可以用聚合物或脂质(例如,壳聚糖、阳离子聚合物或阳离子脂质)进一步修饰以形成核壳纳米颗粒,其表面赋予额外的功能以增强有效载荷的细胞递送和摄取(jian等,(2012)biomaterials.33(30):7621-30)。纳米颗粒还可有利地与靶向分子偶联以将纳米颗粒引导至合适的细胞类型和/或增加细胞摄取的可能性。此类靶向分子的实例包括对细胞表面受体特异的抗体和细胞表面受体的天然配体(或天然配体的一部分)。
[0524]
在一些实施方式中,核酸酶蛋白或编码核酸酶的dna/mrna被包裹在脂质体中或使用阳离子脂质复合(参见,例如,lipofectamine
tm
,life technologies corp.,carlsbad,ca;zuris等,(2015)nat biotechnol.33:73-80;mishra等,(2011)j drug deliv.2011:863734)。脂质体和脂质复合物制剂可以保护有效载荷免于降解,并通过与靶细胞的细胞膜融合和/或破坏来促进细胞摄取和递送效率。
[0525]
在一些实施方式中,核酸酶蛋白或编码核酸酶的dna/mrna被包裹在聚合物支架(例如,plga)中或使用阳离子聚合物(例如,pei、pll)复合(tamboli等,(2011)ther deliv.2(4):523-536)。聚合物载体可以设计为通过控制聚合物溶蚀和药物扩散来提供可调的药物释放速率,高药物包封效率可以保护治疗有效载荷,直到细胞内递送到所需的靶细胞群体。
[0526]
在一些实施方式中,核酸酶蛋白,或编码重组核酸酶的dna/mrna,与自组装成胶束的两亲性分子结合(tong等,(2007)j gene med.9(11):956-66)。聚合物胶束可以包含由亲水性聚合物(例如,聚乙二醇)形成的胶束壳,其可以防止聚集、掩盖电荷相互作用并减少非特异性相互作用。
[0527]
在一些实施方式中,将核酸酶蛋白或编码大范围酶的dna/mrna配制成乳剂或纳米乳剂(即,平均粒径《1nm),用于施用和/或递送至靶细胞。术语“乳液”是指但不限于任何水包油、油包水、水包油包水或油包水包油分散体或液滴,包括脂质结构,当与水不混溶的相与水相混合时,由于疏水力驱使非极性残基(例如,长烃链)远离水和极性头部基团而形成的脂质结构。这些其他脂质结构包括但不限于单层、少层和多层脂质囊泡、胶束和层状相。乳液由水相和亲脂相(通常含有油和有机溶剂)组成。乳液还经常含有一种或多种表面活性剂。纳米乳剂配方是众所周知的,例如,如在美国专利申请号2002/0045667和2004/0043041,以及美国专利号6,015,832、6,506,803、6,635,676和6,559,189中所描述的,其每一个的全部内容通过引用并入本文。
[0528]
在一些实施方式中,核酸酶蛋白或编码核酸酶的dna/mrna与多功能聚合物缀合物、dna树枝状聚合物和聚合物树枝状聚合物共价连接或非共价结合(mastorakos等,(2015)nanoscale.7(9):3845-56;cheng等,(2008)j pharm sci.97(1):123-43)。树枝状聚合物生成可以控制有效载荷容量和大小,并且可以提供高药物有效载荷容量。此外,可以利用多个表面基团的展示来提高稳定性,减少非特异性相互作用,并增强细胞特异性靶向和药物释放。
[0529]
在一些实施方式中,使用病毒载体(即,重组病毒)递送编码核酸酶的基因。此类载体是本领域公知的,并且包括逆转录病毒载体、慢病毒载体、腺病毒载体和腺相关病毒(avv)载体(vannucci,等综述,2013new microbiol.36:1-22)。可用于本发明的重组aav载体可以具有允许将病毒转导到细胞中并将核酸酶基因插入到细胞基因组中的任何血清型。在特定实施方式中,重组aav载体具有血清型aav2或aav6。aav载体也可以是自我互补的,这样其就不需要在宿主细胞中合成第二链dna(mccarty,等,(2001)gene ther.8:1248-54)。由重组aav载体递送的多核苷酸,包括递送本文公开的模板核酸的那些,可包含左(5’)和右(3’)反向末端重复。
[0530]
如果核酸酶基因以dna形式(例如,质粒)和/或通过病毒载体(例如,aav)递送,其必须与启动子可操作地连接。在一些实施方式中,这可以是病毒启动子,如来自病毒载体的内源性启动子(例如,慢病毒载体的ltr)或众所周知的巨细胞病毒或sv40病毒早期启动子。在一个优选实施方式中,核酸酶基因与启动子可操作地连接,该启动子优选在靶细胞(例如,t细胞)中驱动基因表达。
[0531]
car/tcr编码序列和/或hla-e融合蛋白编码序列还可以包含另外的控制序列。例如,该序列可以包括同源重组增强子序列、kozak序列、聚腺苷酸化序列、转录终止序列、选
择标记序列(例如,抗生素抗性基因)、复制原点等。编码工程化核酸酶的序列还可以包含至少一种核定位信号。核定位信号的实例是本领域公知的(参见,例如,lange等,j.biol.chem.,2007,282:5101-5105)。
[0532]
本发明还提供了将模板核酸引入靶基因中。在一些实施方式中,所述模板核酸包含位于插入元件侧翼的5’同源臂核3’同源臂。这种同源臂与产生切割位点的核酸酶识别序列的5’上游和3’下游的相应序列具有序列同源性。在通常情况下,同源臂的长度可以是至少50个碱基对,优选至少100个碱基对和最多2000个碱基对或更多,并且可以与其在基因组中的相应序列具有至少90%,优选至少95%或更高的序列同源性。
[0533]
本文公开的模板核酸(例如,编码shrnamir、编码car或外源性tcr的核酸和/或hla-e融合蛋白)可以通过先前讨论的任何方式引入细胞中。在一个特定实施方式中,模板核酸通过病毒(即,重组病毒)引入,如重组慢病毒、重组逆转录病毒、重组腺病毒或优选重组aav载体(即,重组aav)。可用于引入外源核酸(例如,模板核酸)的重组aav载体可以具有允许病毒转导至细胞并将外源核酸序列插入细胞基因组的任何血清型。在特定实施方式中,重组aav载体具有血清型aav2或aav6。重组aav载体也可以是自我互补的,这样其就不需要在宿主细胞中合成第二链dna。
[0534]
在另一个特定实施方式中,可以使用单链dna模板将本文公开的模板核酸(例如,编码shrnamir、编码car或外源tcr和/或hla-e融合蛋白的核酸)引入细胞中。单链dna可以包含目标外源序列,并且在优选的实施方式中,可以包含5’和3’同源臂以促进通过同源重组将核酸序列插入到大范围核酸酶切割位点中。单链dna还可包含5’同源臂5’上游的5’aav反向末端重复(itr)序列和3’同源臂下游3’的3’aav itr序列。
[0535]
在另一个特定实施方式中,可以通过用线性化的dna模板转染将本文公开的模板核酸(例如,编码shrnamir、编码car或外源性tcr的核酸和/或hla-e融合蛋白)引入细胞。在一些实例中,质粒dna可以被一种或多种限制性酶消化,使得环状质粒dna在转染到细胞之前线性化。
[0536]
通过本发明修饰的免疫细胞(例如,t细胞)在引入核酸酶和/或外源性目的序列之前可能需要活化。例如,t细胞可以与抗cd3和抗cd28抗体接触,这些抗体是可溶的或缀合到支持物(即,小珠)上的时间足以激活细胞。
[0537]
本发明的遗传修饰的免疫细胞可以被进一步修饰以表达一种或多种诱导性自杀基因,其诱导引起细胞死亡并允许体外或体内细胞的选择性破坏。在一些实例中,自杀基因可以编码细胞毒性多肽、具有将无毒前药转化为细胞毒性药物的能力的多肽和/或激活细胞内细胞毒性基因途径的多肽。也就是说,自杀基因是一种编码产物的核酸,该产物可通过自身或在其他化合物的存在下导致细胞死亡。这种自杀基因的代表性实例是编码单纯疱疹病毒胸苷激酶的基因。其他例实例是编码水痘带状疱疹病毒胸苷激酶的基因和可将5-氟胞嘧啶转化为剧毒化合物5-氟尿嘧啶的细菌基因胞嘧啶脱氨酶。自杀基因还包括作为非限制性实例的编码caspase-9、caspase-8或胞嘧啶脱氨酶的基因。在一些实例中,caspase-9可以使用特定的二聚化化学诱导剂(cid)激活。自杀基因还可以编码在细胞表面表达的多肽,使细胞对治疗性和/或细胞毒性单克隆抗体敏感。在其他实例中,自杀基因可以编码重组抗原多肽,其包含被抗-cd20 mab利妥昔单抗识别的抗原基序和允许选择表达自杀基因的细胞的表位。参见,例如,在wo2013153391中描述的rqr8多肽,其包含两个利妥昔单抗结合表
pharmacy(21st ed.2005)。在制造根据本发明的药物制剂时,通常将细胞与药学上可接受的载体混合,并将所得的组合物施用于受试者。当然,在与制剂中的任何其他成分相容的意义上,载体必须是可接受的,并且必须不对受试者有害。在一些实施方式中,本发明的药物组合物可进一步包含一种或多种可用于治疗受试者的疾病的另外的药剂。在另外的实施方式中,本发明的药物组合物可以进一步包含生物分子,如细胞因子(例如,il-2、il-7、il-15和/或il-21),其促进体内细胞增殖和遗传修饰的t细胞的植入。包含本发明的遗传修饰的免疫细胞的药物组合物可以与另外的药剂或生物分子在相同的组合物中施用,或者可以在分开的组合物中共同施用。
[0544]
本公开内容还提供了用作药物的本文所述的遗传修饰的免疫细胞或其群体。本公开内容还提供了本文所述的遗传修饰的免疫细胞或其群体在制备用于治疗有此需要的受试者的疾病的药物中的用途。在一个这样的方面,该药物可用于有需要的受试者的癌症免疫治疗。
[0545]
本发明的药物组合物可用于治疗可通过过继免疫疗法,特别是t细胞过继免疫疗法靶向的任何疾病状态。在一个特定实施方式中,本发明的药物组合物和药物用于治疗癌症。可以用本公开内容的药物组合物和药物治疗的癌症的非限制性实例包括但不限于本文所述的可以被car或外源性tcr靶向的各种类型的癌症。
[0546]
在其中使用本公开的遗传修饰的免疫细胞或其群体治疗癌症的这些实施方式的一些中,向被施用遗传修饰的免疫细胞或其群体的受试者进一步施用另外的治疗剂,如放射、手术或化学治疗剂。
[0547]
本发明还提供了包含多个本文所述的遗传修饰免疫细胞的遗传修饰免疫细胞群体,所述遗传修饰免疫细胞在其基因组中包含编码shrnamir的核酸序列,其中编码shrnamir的外源核酸分子可插入靶基因,如tcrα基因或trac基因,使得细胞没有可检测的内源性tcr(例如,α/βtcr)的细胞表面表达。因此,在本发明的各种实施方式中,提供了免疫细胞群体,其中在群体中至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或至多100%的细胞是本文所述的遗传修饰的免疫细胞。在本发明的一些实施方式中,提供了免疫细胞群体,其中在群体中约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、约96%、约97%、约98%、约99%或至多100%的细胞是本文所述的遗传修饰的免疫细胞。在本发明进一步的实施方式中,提供了免疫细胞群体,其中在群体中至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或至多100%的细胞是本文所述的遗传修饰的免疫细胞,所述遗传修饰的免疫细胞还表达car或外源性tcr和/或还表达hla-e融合蛋白。在本发明的某些实施方式中,提供了免疫细胞群体,其中在群体中约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、约96%、约97%、约98%、约99%或至多100%的细胞是本文所述的遗传修饰的免疫细胞,所述遗传修饰的免疫细胞还表达car或外源性tcr和/或还表达hla-e融合蛋白。
id no:58),并用带有构建体7056的aav以25,000个病毒基因组/细胞的moi进行转导。aav 7056编码与trac开放阅读框架定向相反的car(由抗cd19 fmc63 scfv、cd8铰链和跨膜结构域、novel 6(n6)共刺激结构域和cd3ζ胞内信号传导结构域组成)。转录由jet启动子启动,由双向poly-a序列终止。控制car表达的jet启动子的上游位于也与trac orf转录定向相反的shrna盒。shrna的转录由u6启动子启动,由中央聚嘧啶束终止。评价了几个shrna序列的b2m表达的敲低效力。aav 7056包含shrna序列trcn0000381472,缩写为shrna472,其序列如seq id no:6所示。
[0559]
将细胞培养物在补充有5%fbs和30ng/ml il-2的x-vivo
tm 15培养基中再维持10天。在核转染后第4、7和/或10天,对培养物取样并分析cd3(抗cd3-pe,biolegend)、car(抗fmc63抗car,克隆vm16缀合至alexafluor488)、b2m(抗b2m-apc或pe,克隆tu-99bd biosciences)和hla-a、b和c(克隆w6/32,bv605,biolegend)的表面表达。在beckman-coulter cytoflex-lx上获取流式细胞术数据。细胞表面cd3的检测是细胞表面内源性t细胞受体的指示。因此,应当理解,cd3+或cd3-的遗传修饰细胞分别是tcr+和tcr-。
[0560]
在表达构建体7056和对照群体的样品中测量了b2m和hla-abc水平。图1a显示了与来自对照培养物的不表达shrna的trac编辑细胞相比在cd3-/car+细胞中b2m的表面水平。图1b显示了在相同培养物中cd3-/car+与cd3+/car-群体的b2m水平。图1c和图1d在hla-abc表面水平的显示中分别进行了相同的比较。用aav-7056转导的细胞的cd3-/car+部分显示的b2m和hla-abc水平与对照群体相比降低了90%以上。
[0561]
在转基因递送后的最早时间点,car+细胞显示hla-abc和b2m的表面水平降低了90-95%,这取决于标志物和比较。随着培养时间的延长,car+事件的频率降低,b2m表面表达恢复到接近正常水平(图2a-2f)。
[0562]
为了确定这种敲低效力丧失的根本原因,在转导后10天(d10)对存活的car+细胞基因组中的转基因插入片段进行测序。使用在7056序列中的trac同源臂中杂交的寡核苷酸引发测序反应。旨在靶向b2m转录物的自互补发夹结构的序列在d10基因组中未恢复。然而,该序列是从aav制剂或包装质粒用作模板的反应中恢复的。序列丢失似乎仅限于发夹序列,因为包括u6启动子和cppt在内的相邻序列没有受到干扰。
[0563]
这些研究表明,预筛选的b2m靶向shrna可以降低已递送构建体的细胞表面的b2m表达水平(通过靶向插入t细胞受体α恒定区基因座)。这种效应特定于car+群体(即,已发生靶向整合到trac基因座的细胞)。该实验表明,使用与同一aav模板上的car基因共同递送至trac基因座的单拷贝shrna472可以有效地敲除b2m。虽然结果在早期时间点看起来很有希望,但敲低效应被确定为是短暂的,并且与car+群体的毒性或生长停滞有关。随着敲低作用减弱,观察到存活t细胞基因组中shrna序列的丢失。这表明shrna472是从基因组中切除的,不适用于b2m或其他潜在内源性蛋白的单一整合复制介导的敲低。
[0564]
实施例2
[0565]
β-2微球蛋白shrnamir的设计、构建和表征
[0566]
使用shrna靶向b2m表达受到car t产品的瞬时敲低作用和毒性的阻碍,这可能是由于基因组中发夹序列的丢失。包含短发夹的引导链和随从链序列被改造成更大、更高度结构化的microrna支架(mir)。shrna和mirna技术的这种结合在本文中称为microrna适应的shrna或shrnamir。
[0567]
选择用于生成shrnamir的mir支架称为mir-e,其是人类基因组中天然存在的mir(称为mir-30)的工程化衍生物(参见国际公开号wo 2014/117050,其全部内容通过引用并入本文)。micro-rna在细胞核中进入细胞的rnai通路,在那里其被drosha加工并在与dicer和argonaut相互作用之前通过输出蛋白复合物输出到细胞质中,并加载到rna诱导的沉默复合物(risc)中。
[0568]
在本研究中使用的mir-e支架的序列如seq id no:1(5’mir-e支架结构域)、seq id no:2(5’mir-e基干结构域)、seq id no:3(mir-30a环结构域)、seq id no:4(3’mir-e基干结构域)和seq id no:5(3’mir-e支架结构域)所示。将b2m靶向随从链和引导链序列(其分别如seq id no:7和8所示)克隆到抗cd19 car(与实施例1中所描述的相同)载体中,所述载体在终止密码子下游,但在poly-a转录终止子上游。将该载体(7282)包装到aav6衣壳中,并用于一项研究以确定b2m敲低的幅度和持续时间。
[0569]
在该研究中,从健康供体中抽取血液分离样品,并根据生产厂商的说明书(stem cell technologies)使用cd3阳性选择试剂盒ii富集t细胞。使用immunocult
tm t细胞刺激剂(抗cd2/cd3/cd28,stem cell technologies)在x-vivo
tm 15培养基(lonza)中激活t细胞,所述培养基中添加了5%胎牛血清和10ng/ml il-2(gibco)。刺激3天后,收集细胞,并用1μg编码trc 1-2l.1592大范围核酸酶的rna对1x106个细胞样品进行电穿孔,所述大范围核酸酶识别和切割trac基因中的trc 1-2识别序列,并用带有构建体7282的aav以25,000个病毒基因组/细胞的moi进行转导。包括没有rnai特征(7206)或具有shrna-472(7056)的car t细胞作为对照。
[0570]
在编辑和aav转导后3、7和11天,分析来自这些培养物的细胞的tcr敲除(使用抗cd3-bb515克隆sk7,bd biosciences)、car转基因敲入(使用抗fmc63-alexafluor647,克隆vm16,内部生产)和b2m敲低,使用抗b2m-pe(克隆tu-99,bd biosciences)。比较来自相同培养物的细胞的cd3-/car+群体和cd3+/car-群体之间的b2m水平(通过pe通道中的平均荧光强度测量)。
[0571]
在编辑/转导后3天,就car+频率而言,使用aav 7282产生的car t细胞优于aav 7206,而使用aav 7056产生的培养物含有较少频率的car+细胞。cd3-/car+细胞的频率在用aav 7206或aav7282产生的培养物中增加或保持不变,但在用aav 7056转导的培养物中减少到总细胞数的5%以下。
[0572]
表达shrna(aav 7056)的car t细胞在第3天迅速将b2m的表面水平下调了91.9%。b2m shrnamir在这个时间点将b2m表面水平下调了77.4%(图3)。随着培养物进行额外的天数,shrna介导的敲低幅度在第7天和第11天分别下降到84.3%和65.1%(图4和图5)。此外,在这些时间点,在aav 7056转导的培养物中存在car+事件,这些事件开始重新表达正常或接近正常水平的b2m。相比之下,shrnamir介导的敲低幅度在第7天和第11天在两个时间点都令人惊讶地增加到大约85%,没有观察到b2m表达的上调。
[0573]
因此,使用shrnamir干扰b2m表达有利地导致较慢的敲低动力学和略低的敲低幅度,但与此前评价的实施例1中描述的shrna相比,具有更稳定的表型和大大降低的毒性。本研究中观察到的优异结果为使用shrnamirs下调car t细胞中的内源性蛋白表达提供了初步概念验证,这在某些情况下可能优于基因敲除。
[0574]
实施例3
[0575]
其他b2m shrnamir构建体的设计和表征
[0576]
鉴定了六个另外的b2m引导链和随从链序列并将其克隆到mir-e骨架中,并插入到实施例2中描述的抗cd19 car构建体中,其位于car的终止密码子和poly-a转录终止子之间。b2m 7285shrnamir的随从链和引导链分别如seq id no:9和10所示。b2m 7286 shrnamir的随从链和引导链分别如seq id no:11和12所示。b2m 7287 shrnamir的随从链和引导链分别如seq id no:13和14所示。b2m 7288 shrnamir的随从链和引导链分别如seq id no:15和16所示。b2m 7289 shrnamir的随从链和引导链分别如seq id no:17和18所示。b2m 7290 shrnamir的随从链和引导链分别如seq id no:19和20所示。针对其敲低b2m表达的能力对这些另外的b2m shrnamir序列进行检测。
[0577]
在该研究中,从供体中抽取血液分离样品,并根据生产厂商的说明书(stem cell technologies)使用cd3阳性选择试剂盒ii富集t细胞。使用immunocult
tm t细胞刺激剂(抗cd2/cd3/cd28,stem cell technologies)在x-vivo
tm 15培养基(lonza)中激活t细胞,所述培养基中添加了5%胎牛血清和10ng/ml il-2(gibco)。刺激3天后,收集细胞,并用1μg编码trc 1-2l.1592大范围核酸酶的rna对1x106个细胞样品进行电穿孔,所述大范围核酸酶识别和切割t细胞受体α恒定基因座中的trc 1-2识别序列。将六个car-shrnamir构建体(构建体7285-7290)作为线性化dna(2μg/样品)与trc1-2rna在核转染过程中同时递送至t细胞。或者,用b2m 13-14x.479核酸酶对t细胞进行核转染,该核酸酶识别并切割人b2m基因中的b2m 13-14识别序列(seq id no:60)(参见,wo 2017112859)。这包括通过定义b2m敲除细胞上存在的背景信号来确定shrnamir敲低中存在的b2m表面信号量。
[0578]
在核转染后4天和11天,使用抗cd3-bb515(克隆sk7,bd biosciences)、抗fmc63-alexafluor647(克隆vm16,内部生产)、抗b2m-pe(使用克隆tu-99,bd biosciences)对培养物的样品染色。比较来自相同培养物的细胞的cd3-/car+群体和cd3+/car-群体之间的b2m水平(通过pe通道中的平均荧光强度测量)。
[0579]
cd3-/car+群体以及cd3+car-群体的平均荧光强度(mfi)列在下表1中相应的shrnamir旁边。敲低百分比定义为:(shrnamir+群体的mfi/参照群体的mfi)x100。在核转染后第11天获取列表数据。构建体7289和7290在测试的7个构建体中表现出最高的b2m干扰量级。b2m敲除细胞上存在的背景信号小于参照群体(未列出)的2%。
[0580]
表1:通过候选序列的b2m敲低
[0581][0582]
本研究中测试的所有七种构建体都表现出一定程度的稳定b2m敲低和car表达。有趣的是,这项研究表明,内源性蛋白敲低的程度可以通过选择不同的引导链和随从链来调
节。当不同程度的内源性蛋白敲低可能比几乎完全敲除更可取时,shrnamir方法提供的这种灵活性可能是有利的。在进一步的实验中研究了在7282、7288、7289和7290中编码的候选序列。
[0583]
实施例4
[0584]
shrnamir b2m car t细胞的同种异体性和对自然杀伤(nk)细胞杀伤的敏感性
[0585]
这些研究评估了通过基因消融敲除b2m与使用shrnamir进行的不完全但稳定的敲低对细胞对同种异体抗原特异性细胞毒性淋巴细胞(ctl)或nk细胞的细胞溶解敏感性的影响。使用来自无关健康供体的单核细胞衍生的树突状细胞激发ctl,以活化和扩增同种异体抗原特异性cd8+ t细胞群体。
[0586]
从两个无关的健康供体中抽取血液分离样品,并根据生产厂商的说明书(stem cell technologies)使用cd3阳性选择试剂盒ii富集t细胞。为了制备树突状细胞,将来自单采样品的未分级单核细胞接种在聚苯乙烯细胞培养瓶中并使其贴壁1-2小时。弃去未贴壁细胞并将贴壁细胞在细胞因子混合物中培养6天,该细胞因子混合物可将单核细胞分化为树突状细胞样细胞(800u/ml gm-csf和500u/ml il-4,均来自peprotech)。收集树突状细胞(dc),并以不同比率与来自无关供体的t细胞一起接种。在不存在外源性细胞因子的情况下进行前24h共培养。随后以10ng/ml将il-2添加到培养物中。
[0587]
共培养进行5天,通过使用miltenyi clinimacs cd4微珠和ls柱去除cd4+ t细胞来富集cd8+ t细胞。使用cd3-pe(克隆ucht1,biolegend)和cd8-bv421(克隆rpa-t8,biolegend)评估纯度。然后将激发的ctl与来自制备dc的同一供体的靶t细胞共培养。使用immunocult
tm t细胞刺激剂(抗cd2/cd3/cd28,stem cell technologies)在x-vivo
tm 15培养基(lonza)中激活靶t细胞,所述培养基中添加了5%胎牛血清和10ng/ml il-2(gibco)。刺激3天后,使用大范围核酸酶b2m13-14x.479在b2m基因座(b2m ko)编辑或者使用trc1-2l.1592在trac基因座编辑靶t细胞。使用aav 7206(对照car t)或aav 7289(b2m shrnamir)以25,000个病毒基因组/细胞的moi转导trac编辑的靶t细胞。
[0588]
使用facsmelody细胞分选仪(becton-dickinson)以及抗b2m-pe(克隆tu-99,bd biosciences)、cd3-pe(克隆ucht1,biolegend)和抗fmc63-bv421(克隆vm16,内部生产)将b2m-或car+级分facs分选至纯度》99%。分选的靶细胞用1μm cell trace violet(thermofisher)标记,并与同种异体抗原敏化的ctl以1:5到5:1的效应物:靶点(e:t)比率置于培养物中。培养设置18小时后,分析样品中的活染料阳性靶细胞,并通过将存活靶细胞数与“无效应”对照进行比较来计算杀伤百分比。
[0589]
还测量了自然杀伤(nk)应答。使用cd56阳性选择试剂盒(stem cell technologies)从pbmc样品中磁性富集nk细胞。富集的nk细胞与cell trace violet标记的car-t细胞(使用aav6-7206产生)、b2m敲低car-t细胞(使用包含b2m shrnamir的aav6-7289产生)或b2m敲除t细胞共培养18h。共培养18h后,计数存活的染料阳性靶细胞并计算杀伤百分比。
[0590]
具有正常b2m表面表达水平的car t细胞被激发的同种异体抗原特异性ctl杀伤(图6a)。随着e:t比率的增加,杀伤百分比相应增加,在e:t比率为2:1时,杀伤率最高至多74%。在b2m基因座进行基因编辑且完全缺乏b2m蛋白表面表达的t细胞在每个e:t比率下的杀伤效率低于b2m+对照。在编码b2m shrnamir的car t细胞中观察到的杀伤水平,表达正常
b2m表面水平的5-10%,同样被激发的ctl低效杀死,并且比b2m ko观察到的百分比更低。
[0591]
进一步观察到,b2m敲除细胞被nk细胞杀死,与e:t比率相关,在e:t比率为5:1时达到最高50%的杀伤率(图6b)。尽管在最高e:t比率下观察到了一些背景杀伤,但具有未受控制的b2m表达水平的car t细胞并未被nk细胞有效杀死。值得注意的是,b2m敲低细胞被nk细胞无效地杀死,尽管在最高e:t比率下观察到一些杀伤(28%)。
[0592]
b2m表达的基因消融与大范围核酸酶导致细胞对激发的同种异体抗原特异性ctl具有高度抗性;然而,其很容易被nk细胞杀死。使用shrnamir方法将内源性b2m稳定敲低至正常水平的5-10%,导致细胞对ctl具有类似的抗性,但对nk细胞溶解的敏感性大大降低。这表明这些细胞比完全敲除b2m的同种异体car t细胞更有可能逃避体内nk细胞的杀伤。
[0593]
除了shrnamir介导的b2m敲低外,还评价了第二种基因编辑方法的nk细胞逃避。第二种方法涉及使用工程化的大范围核酸酶来生成带有b2m基因的切割位点,并将供体模板引入切割位点。该供体模板编码hla i类组织相容性抗原α链e(hla-e)多肽(seq id no:66)。当在细胞表面上表达时,已知hla-e可与nk细胞上的cd94/nkg2a抑制性受体结合,并且已显示可保护hla-e+细胞免受nk细胞介导的裂解。在这里,研究了将hla-e编码序列靶向插入b2m基因是否可以同时敲除b2m表达,从而降低car t细胞同种异体性,并表达hla-e以抑制nk细胞杀伤。
[0594]
在该研究中,从健康、知情和有偿的供体中抽取血液分离样品,并按照生产厂商的说明书(stem cell technologies)使用cd3阳性选择试剂盒ii富集t细胞。使用immunocult t细胞刺激剂(抗cd2/cd3/cd28-stem cell technologies)在x-viv 15培养基(lonza)中激活t细胞,所述培养基中添加了5%胎牛血清和10ng/ml il-2(gibco)。刺激3天后,收集细胞,并用1μg编码b2m13-14x.479大范围核酸酶的rna对1e6个细胞样品进行电穿孔,所述大范围核酸酶识别和切割b2m基因座中的b2m 13-14识别序列(seq id no:60)。
[0595]
电穿孔后立即用aav7346转导细胞,aav7346编码hla-e融合蛋白,包含通过甘氨酸-丝氨酸接头连接的三个多肽(seq id no:66)。第一多肽是包含hla-g前导肽(seq id no:120)和(ggggs)3接头(seq id no:121)的九聚体。第二多肽是全长密码子优化的人b2m基因(编码seq id no:119),随后是(ggggs)4接头(seq id no:122)。第三多肽是人hla-e-01:03序列(seq id no:118)。转基因受jet启动子的控制,并由双向poly-a序列终止。转基因的两侧是同源臂,引导转基因插入b2m13-14切割位点。
[0596]
在30ng/ml il-2的完全x-vivo15培养基中培养至少6天后,使用抗hla-abc-pe(biolegend,克隆w6/32-以检测b2m编辑细胞)和抗-hla-e-bv421(biolegend克隆3d12)将细胞染色。使用beckman-coulter cytoflex-s或lx分析细胞的敲除/敲入频率。hla-abc-hlae+细胞通过facs使用beckton-dickinson facsmelody进行纯化。分选未转导hla-abc-(b2m编辑,无aav)作为对照。如本实施例此前所述,测量分选细胞对ctl和nk细胞杀伤的敏感性。
[0597]
用b2m13-14x.479rna转染的t细胞形成了一个缺乏典型mhc i蛋白hla-a、b和c以及hla-e展示的群体(图7a)。当用aav7346转导b2m编辑的细胞时,可以看到表达高水平hla-e转基因的hla-abc-细胞群体(图7b)。将这些群体分选为纯度》99%(图8)。
[0598]
如图9a中所示,不具有b2m编辑的car t细胞被同种异体抗原引发的ctl杀死,随着e:t比率的增加,观察到car t杀伤增加(达到最大约75%)。而相比之下,b2m敲除细胞和表
达hla-e转基因的b2m敲除细胞都没有被有效杀死(10%或更少),并且随着e:t比率的增加,观察到的杀死没有增加。
[0599]
如图9b中所示,当测量被nk细胞杀死时,b2m充足的car t细胞没有被nk细胞有效靶向,但b2m敲除t细胞被有效杀死(最多约50%)。尽管缺乏hla-abc表达,但hla-e+细胞免受nk细胞溶解的保护程度与在b2m充足细胞中观察到的程度相当。这些数据表明内源性b2m基因的基因破坏保护t细胞免受同种异体抗原引发的ctl的细胞溶解,并且hla-e转基因阻止nk细胞溶解的缺失自我机制。
[0600]
实施例5
[0601]
具有通过shrnamir的b2m敲低的car t细胞的体内有效性和b2m敲低的稳定性
[0602]
进行这些研究是为了评价通过shrnamir敲低b2m的cd19car t细胞的有效性,并确定在细胞暴露于靶细胞并在体内激活后,与对照cd19 car t细胞相比,体内b2m敲低的稳定性。
[0603]
如此前所述,将冻存的cd3+ t细胞解冻、静置和活化。在活化后第3天,细胞用编码trac特异性核酸酶(trc1-2l.1592)的mrna电穿孔,并立即用携带cd19导向car序列的7206aav载体或携带cd19 car的7289aav载体转导,其中b2m靶向shrnamir编码在car的终止密码子和聚腺苷酸化序列之间。使用cd3磁性富集试剂盒去除来自两组的残留cd3+(未编辑)car t细胞并弃去,并且来自这两组的细胞在如前所述的耗竭后扩增后冷冻保存。
[0604]
雌性nsg小鼠用表达萤火虫荧光素酶的nalm-6人急性淋巴母细胞白血病细胞系接种一周后,静脉注射(iv)载剂对照、cd19导向的car t细胞或cd19 car-b2m shrnamir细胞,剂量为每只小鼠5e6个car t细胞(每组n=5只动物)。
[0605]
使用装有安装在不透光样品室上的ccd相机的ivis光谱(perkin elmer,ma)成像系统测量活体动物的荧光素酶活性。在成像当天,向动物注射荧光素底物并置于麻醉诱导室中。镇静后,将动物置于成像室的背侧位置,配备在生理温度下加热的载物台,用于在给予荧光素底物后定期进行图像采集。采集时间由livingimage软件自动确定。在每只小鼠周围绘制目标区域,并且对通量进行量化并报告为每秒光子(p/s)。分析数据并使用living image软件4.5.2(perkin elmer,ma)输出。
[0606]
为了分析小鼠血液中存在的人t细胞的b2m表达,在施用car t细胞后第14天从个体小鼠中采集血液样品。裂解红细胞,然后洗涤样品并染色以检测人cd45和b2m的存在情况,并通过流式细胞术进行分析,如前所述。
[0607]
如图10a中所述,植入nalm-6细胞并用载剂(带三角形的黑线)处理的小鼠在研究过程中表现出增加的肿瘤生长,通过生物发光成像测量的总通量随时间稳定增加。而相比之下,用cd19导向的car t细胞(带圆圈的深灰色线)或具有整合的b2m靶向shrnamir的cd19导向的car t细胞处理的小鼠(浅灰色带三角形线)在研究过程中介导快速和持久的抗肿瘤活性,如与载剂处理的动物相比总通量降低所观察到的。
[0608]
在cat t施用后14天,采集血液样品以评价在任cd45+细胞上b2m的表达。如图10b中所示,与对照cd19导向的car t细胞相比,具有整合的b2m靶向shrnamir的cd19导向的car t细胞的b2m表达的mfi降低90%以上,表明与没有将b2m shrnamir整合到基因组中的对照细胞相比,带有b2m shrnamir的细胞(已被激活并介导了靶细胞的清除)仍然具有降低的b2m表达水平。
[0609]
产生了两组cd19导向的car t细胞,不同之处仅在于在其中一个构建体中包含shrnamir载体,从而能够靶向敲低表达car的细胞中的b2m表达。来自两组的car t细胞都能够减少白血病异种移植模型中的肿瘤负荷。从小鼠中采集的血液样品证实,包含b2m shrnamir的人t细胞在细胞表面的b2m表达水平低于来自对照cd19 car t细胞组小鼠血液中的t细胞,表明b2m的敲低即使在已被激活并介导人白血病相关小鼠模型中靶细胞杀伤的细胞中也是稳定的。
[0610]
实施例6
[0611]
在car t细胞中cs1的稳定敲低
[0612]
启动这些研究是为了确定是否可以使用shrnamir序列稳定敲低cs1。cs1/slamf7 shrnamir的三个候选引导链和随从链序列被构建到mir-e支架中,并位于bcma特异性car(包括bcma特异性scfv、cd8铰链和跨膜结构域、n6共刺激结构域和cd3ζ细胞内信号传导结构域)的终止密码子之后。将这些命名为构建体72101、72102和72103。
[0613]
在该研究中,从健康、知情和有偿的供体中抽取血液分离样品,并按照生产厂商的说明书(stem cell technologies)使用cd3阳性选择试剂盒ii富集t细胞。使用immunocult t细胞刺激剂(抗cd2/cd3/cd28
–
stem cell technologies)在x-vivo 15培养基(lonza)中激活t细胞,所述培养基补充有5%胎牛血清和10ng/ml il-2(gibco)。刺激3天后,收集细胞并用1ug编码trc 1-2l.1592大范围核酸酶的rna电穿孔1e6个细胞的样品,其识别并切割trac基因中的trc 1-2识别序列。在编码car的线性化dna的2ug/1e6个细胞和候选cs1/slamf7 shrnamir之一存在下进行核转染。在该实验中,单独的样品用上述trc1-2l.1592和不编码rnai特征的bcma car构建体进行核转染。核转染后7天,使用抗cd3(克隆ucht1,bd biosciences)、抗cs1(克隆162.1,biolegend)和生物素化bcma(acro biosystems)对培养物染色,以检测car(使用链霉亲和素-apc或bv421复染,biolegend)。
[0614]
通过比较car+细胞上的cs1表面表达水平与相同培养物中car-细胞上显示的水平,可以测量相对敲低幅度。构建体72101和72102没有明显改变cs1的表达,尽管平均荧光强度表明分别敲低了26%和30%。使用72103产生的car t细胞确实显示出明显较低的cs-1水平,几乎没有高表达子,并且计算出36%的敲低(图11)。
[0615]
这些实验表明,在car t细胞中能够稳定降低内源性cs1的表达。将进一步考察72103候选物,目的是在cs1特异性car t细胞上敲低cs1,以防止生产过程中的自相残杀活动。
[0616]
实施例7
[0617]
在car t细胞中转化生长因子b受体2(tgfbr2)的稳定敲低
[0618]
启动这些研究以确定使用shrnamir序列是否能够稳定敲低另外的内源性基因tgfbr2。鉴定了tgfbr2 shrnamir的候选引导链和随从链序列并将其整合到mir-e支架中,并且其位于基于fmc63的抗cd19 car的终止密码子之后(如实施例1中所述)。tgfbr2 72110 shrnamir的随从链和引导链分别如seq id no:27和28所示。tgfbr2 72111 shrnamir的随从链和引导链分别如seq id no:29和30所示。tgfbr2 72112 shrnamir的随从链和引导链分别如seq id no:31和32所示。tgfbr2 72113 shrnamir的随从链和引导链分别如seq id no:33和34所示。tgfbr2 72114 shrnamir的随从链和引导链分别如seq id no:35和36所示。
[0619]
从健康供体中抽取血液分离样品,并根据生产厂商的说明书(stem cell technologies)使用cd3阳性选择试剂盒ii富集t细胞。使用immunocult
tm t细胞刺激剂(抗cd2/cd3/cd28,stem cell technologies)在x-vivo
tm 15培养基(lonza)中激活t细胞,所述培养基补充有5%胎牛血清和10ng/ml il-2(gibco)。
[0620]
刺激3天后,收集细胞并用1μg编码trc 1-2l.1592大范围核酸酶的rna电穿孔1x106个细胞的样品,其识别并切割trac基因中的trc 1-2识别序列。在编码car的线性化dna的2μg/1x106个细胞和候选tgfbr2 shrnamir之一存在下进行核转染。在该实验中,单独的样品用上述trc1-2l.1592进行核转染,并用aav 7206转导,aav 7206编码fmc63抗cd19 car,但不包含rnai特征。
[0621]
在核转染后d7、10和14,针对tgfbr2表达对细胞进行分析,使用抗tgfbr2抗体mm0056-4f14(abcam)和与pe缀合的抗小鼠κ轻链二抗(biolegend)。使用内部生产的抗fmc63-alx647鉴定car+细胞。将car+上tgfbr2信号的平均荧光强度(mfi)与car-细胞上的信号进行比较,并计算出敲低百分比。car+事件的频率在不同的构建体中是一致的,范围从4.9%到6.7%(图12)。
[0622]
tgfbr2表面水平在car+群体中因样品而异,但在car-群体中相对一致,其没有将car-shrnamir构建体整合到trac基因座中。序列72111、72112和72113似乎支持整个实验中最强烈的敲低(通过tgfbr2 mfi测量并总结在下表2中)。选择这三个序列进行进一步研究。
[0623]
表2:通过候选序列的tgfbr2敲低
[0624]
构建体敲低%(d7)敲低%(d14)720600721105563721116467721126475721136563721141052
[0625]
这种tgfbr2特异性shrnamir序列的筛选表明,可以制备具有不同水平的tgfbr2稳定敲低的car t细胞。特别是,构建体72111、72112和72113支持在成功引入car-shrnamir序列的细胞中强烈减少表面tgfbr2。
[0626]
进行了另外的研究以比较本文所述的shrnamir介导的敲低方法与核酸酶介导的tgfbr2基因敲除。
[0627]
在该研究中,从健康、知情和有偿的供体中抽取血液分离样品,并按照生产厂商的说明书(stem cell technologies)使用cd3阳性选择试剂盒ii富集t细胞。使用immunocult t细胞刺激剂(抗cd2/cd3/cd28,stem cell technologies)在x-vivo 15培养基(lonza)中激活t细胞,所述培养基补充有5%胎牛血清和10ng/ml il-2(gibco)。刺激3天后,收集细胞并用1ug编码trc1-2l.1592的rna或两种靶向tgfbr2基因的候选核酸酶之一:tgf1-2x.5(seq id no:64)或tgf1-2l.296(seq id no:65)对1e6个细胞样品进行电穿孔。在分析编辑效率之前,将电穿孔细胞在补充有30ng/ml il-2的完全x-vivo15培养基中培养6天。这是通过用抗tgfβrii抗体(abcam克隆mm0056-4f14)染色细胞,然后用与pe缀合的抗小鼠iggκ轻链(biolegend克隆rmk45)来实现的。在beckman-coulter cytoflex-s或lx上采集数据。
[0628]
用trc1-2l.1592电穿孔的t细胞立即用aav72112(编码实施例1中描述的抗cd19 fmc63 car和插入car终止密码子之后和polya序列之前的tgfbr2特异性shrnamir)或aav7206(编码无rnai的对照fmc63 car)转导。培养6天后,使用上文所述的方法,通过facs纯化cd3-car+细胞。此外,来自tgf1-2l.296编辑的培养物的tgfβrii细胞以这种方式分选。分选的细胞在无血清培养基中静置过夜,然后用500ng/ml的重组人tgfβ1(tgfbr2的配体(peprotech)刺激)。tgfβ1添加三十分钟后,收获细胞并立即准备使用phos-flow lyse-fix缓冲液和phos-flow fix-perm缓冲液iii(bd biosciences)根据生产厂商的说明书进行染色。固定细胞用抗psmad2/3-pe(bd biosciences)染色,数据在beckman-coulter cytoflex-lx上采集。
[0629]
模拟核转染的t细胞用抗tgfβrii抗体和二抗或单独的二抗染色,分别作为阳性和阴性对照,用于tgfβrii的表面检测。
[0630]
与模拟核转染细胞相比,tgf1-2x.5的引入导致培养物中38.6%的细胞敲除tgfbr2,而tgf1-2l.296的引入导致更高的敲除频率,为69%(图13)。
[0631]
将tgfβrii表达破坏的t细胞(大范围核酸酶对比rnai)分选并用tgfβ1刺激以评估smad2/3的磷酸化,smad2/3是tgfβr的下游信号转物器。与trac编辑的t细胞相比,tgfβ1缺失时psmad2/3信号较低,tgfβ1暴露后psmad信号较高,tgfbr2 ko细胞在很大程度上对配体暴露无应答(图14)。tgfbr2编辑样品中的一小部分事件在细胞因子暴露后表现出smad2/3磷酸化,尽管这可能代表一种杂质。与分选的tgfβrii充足的t细胞(7206car t)相比,其会响应于tgfβ1磷酸化smad2/3,并且与分选的tgfbr2ko细胞(不会)相比,表达tgfbr2导向的shrnamir的car t细胞将smad2/3磷酸化至跨阳性和阴性对照所描绘范围的水平(图15)。
[0632]
进行进一步实验以确定大范围核酸酶介导的敲除和shrnamir介导的tgfbr2敲除是否可以减少bcma特异性car t细胞(表达实施例6中描述的bcma特异性car)中的psmad 2/3信号传导。制备了四个实验组的bcma car t细胞并测试了psmad2/3水平。第一组和第二组分别包括未处理的对照和tgfβ1处理的bcma car t细胞。第三组和第四组包括用tgfβ1处理的bcma car t细胞,其中分别为tgfbr2被tgf 1-2l.296大范围核酸酶敲除或tgfbr2被72112 tgfbr2 shrnamir敲低。
[0633]
每组car t细胞均使用trc1-2l1592大范围核酸酶制备,其识别并切割trc 1-2识别序列,并且如上所述,将编码bcma特异性car的dna构建体插入到该识别序列中。用tgfbr2敲除的bcma car t细胞用tgf 1-2l.296大范围核酸酶制备,并且用72112tgfbr2 shrnamir制备tgfbr2敲低的细胞,如上所述。用tgfβ1(500ng/ml)处理各个bcma car t细胞组,并且如上所述收集和分析所有细胞组。对于tgfbr2敲除细胞,流式细胞术对tgfbr2阴性细胞群体进行门控。
[0634]
如图16中所示,未经处理的bcma car t细胞具有低水平的psmad2/3,而用tgfβ1处理增加了这些水平。用tgf 1-2l.296大范围核酸酶敲除bcma car t细胞中的tgfbr2,将psmad2/3降低至与未处理的bcma car t细胞对照相当或更低的水平。用72112tgfbr2 shrnamir敲低bcma car t细胞中的tgfbr2也将psmad2/3降低到与未处理的bcma car t细胞对照相当的水平。
[0635]
因此,这些研究表明,通过基因编辑或shrnamir破坏tgfbr2会导致car t细胞磷酸化smad2/3的能力降低。在具有禁用的tgfbr2基因的car t细胞中未检测到smad磷酸化,而
表达shrnamir的细胞是异质的,细胞不同程度地磷酸化smad2/3。
[0636]
实施例8
[0637]
在car t细胞中tgfbr2敲低与敲除的比较
[0638]
进行了进一步的研究,其中在tgfβ途径的各种改变后评估了car t细胞的活性。使用插入到trac基因中的trc 1-2位点(如别处所述)的bcma特异性car(如实施例6中所述)从健康有偿供体t细胞产生car t细胞。在一些变体中,还在与car相同的盒中的trc 1-2位点处引入编码shrnamir的序列(位于car终止密码子和polya序列之间)。在一个变体中,shrnamir是tgfbr2特异性shrnamir(构建体72154),而在另一个变体中,引入了与tgfβ功能无关的shrnamir(靶向b2m-构建体72155)。car t细胞的第三个变体是使用构建体72155产生的,但其使用上述tgf1-2l296核酸酶在tgfbr2基因座处进行编辑,以敲除tgfbr2基因。在tgfbr2 ko组中的car t细胞含有60%ko。
[0639]
每组car t细胞都用多种肿瘤靶点进行攻击:k562阴性对照细胞、转染以稳定表达bcma的k562细胞和稳定表达bcma并持续分泌活性tgfβ1的k562细胞(c223s c225s点突变)。在一项实验中,car t细胞和靶点以1:1比率铺板。在图17中所示的时间点,计数t细胞和任何存活的靶点,并将新鲜的靶点添加到培养物中,以便在每个时间点重新建立1:1比率。随着时间的推移,培养的t细胞数量如图17中所示。未观察到car t细胞响应于阴性对照k562细胞而扩增。
[0640]
当用bcma+靶点攻击时,具有正常tgfbr2表达水平的car t细胞在共培养的第6天扩增》15倍,但在分泌tgfb的靶细胞存在时仅扩增5倍。相比之下,tgfbr2敲低细胞对bcma+靶点的应答类似,但受tgfb分泌靶点的抑制较少(15倍对比10倍)。在一项单独的实验中,car t细胞与靶点以1:9e:t比率铺板,并在第5天和第7天计数存活靶细胞。到第7天,无论tgfb分泌能力如何,tgfbr2敲低细胞实际上已根除bcma+靶细胞。对照car t细胞仅根除对照bcma+靶点,并未消除分泌tgfb的bcma+靶点(图18)。
[0641]
用tgf1-2l296核酸酶编辑以敲除tgfbr2的car t细胞显示出优于对照或敲低tgbfrii的car t细胞的功能优势,这与靶细胞的tgfb分泌无关。如在图19中所示,含有tgfbr2敲除car t细胞的培养物在17天的实验期间表现出持续扩增。这与含有tgfbr2敲除car t细胞的培养物中cd4:cd8比率升高和持续有关(图20)。
[0642]
总之,这些数据表明,用tgf1-2l296进行编辑,或包含tgfbr2特异性shrnamir,允许car t细胞在存在抑制量的tgfb1的情况下维持和执行效应功能。
[0643]
实施例9
[0644]
在car t细胞中tgfbr2敲低和敲除的比较
[0645]
在实施例8中描述的car t变体也用多发性骨髓瘤细胞系u266或用工程化以分泌活性tgfb1的u266细胞反复攻击(如上所述)。与k562实验的结果一致,与对照u266靶点相比,对照car t细胞的峰值扩增响应于分泌tgfb的u266靶点降低了约50%(图21)。表达tgfbr2特异性shrnamir的car t细胞不受分泌tgfb1的u266靶点的抑制。用tgf1-2l296核酸酶编辑以敲除tgfbr2的car t细胞扩增到比其他car t变体更高的数量,并在该实验的19天持续时间内保持高数量(图22)。这也伴随着cd4+ t细胞频率的升高(图23)。图23中的直方图是在共培养第16天获得的,表明相对于对照car t培养物(72154,cd4+约为16%),tgfbr2敲低car t培养物的cd4频率略微升高(23%),而培养的双重编辑car t含有63%的cd4+细
cell technologies)使用cd3阳性选择试剂盒ii富集t细胞。使用immunocult
tm t细胞刺激剂(抗cd2/cd3/cd28,stem cell technologies)在x-vivo
tm 15培养基(lonza)中激活靶t细胞,所述培养基中添加了5%胎牛血清和10ng/ml il-2(gibco)。刺激3天后,收集细胞,并用1μg编码trc 1-2l.1592大范围核酸酶的rna对1x106个细胞样品进行电穿孔,该酶识别并切割trac基因中的trc 1-2识别序列。
[0659]
在进行核转染时,还将线性化dna样品添加到细胞中,最终浓度为1μg/1x106个细胞。在该实验中使用了三种不同的线性化构建体,每一种都是7206的变体,表达jet驱动的抗cd19 car。一种称为克隆7290的序列在car的3’非翻译区(utr)中包含b2m特异性shrnamir。称为72124的第二构建体在同一位置包含cd52特异性shrnamir,称为72156的第三构建体包含cd52 shrnamir,其后是car 3’utr中的b2m shrnamir。
[0660]
电穿孔后,将细胞在补充有30ng/ml il-2的完全x-vivo15中孵育7天。此时,分析t细胞的trac编辑和car插入,以及cd52和b2m表达,如上文详述的。
[0661]
将每个样品中car+cd3-细胞群体与未编辑的cd3+car-细胞群体进行cd52和b2m表达的比较。在接受7290dna的样品中,与cd3+car-细胞相比,car t细胞的b2m表面水平(通过平均荧光强度测量)降低了91%。这两个群体显示出相当的表面cd52水平。在接受72124dna的样品中,与未经编辑的群体相比,car+群体的cd52水平降低了90%,但b2m水平并未降低。包含72156dna的car+细胞表现出相对于参照群体的cd52(89%)和b2m(88%)水平降低(图26)。此外,还证明生物素化抗cd52试剂可用于负选择方法,以耗竭仍表达高水平cd52的car-细胞,并富集已降低cd52表达的car+细胞群体(图27)。
[0662]
这些发现表明,针对两种不同转录物的两种工程化shrnamir可以通过单拷贝靶向插入递送至t细胞,并且两种shrnamir基因可以同时发挥作用,与仅表达一种shrnamir基因的对照相比,其性能几乎没有差异。
[0663]
实施例12
[0664]
将编码car、hla-e和shrnamir的构建体靶向插入单个基因组基因座
[0665]
进行研究以进一步评价shrnamir构建体在改善同种异体car t细胞持久性和降低其对潜在nk细胞杀伤的敏感性的方法中的用途。在这些研究中,使用此前描述的trc 1-2l.1592大范围核酸酶将四个候选构建体插入t细胞中的trc 12识别位点。每个构建体都包含用于肿瘤抗原靶向的cd19特异性car基因(如实施例1中所述,但经修饰以包含seq id no:73的信号肽)、b2m特异性shrnamir(与之前描述的7289构建体中使用的相同),经优化以减少mhc i表达并逃避同种异体反应性t细胞,以及用于抑制nk细胞溶解的hla-e融合蛋白基因。如图28中所示,构建体73161-73164将这三个元件以不同构造引入,这些构造在启动子使用和转录终止方面有所不同。
[0666]
构建体73161(图28a)使用jet启动子(seq id no:67)驱动car、hla-e融合蛋白(seq id no:66)和shrnamir基因的表达,作为以双向序列终止的带有sv40 polya信号(标记为bipa;seq id no:68)的单一转录物。shrnamir已在合成内含子(seq id no:69)中编码,该内含子插入hla-e 03-01等位基因的外显子连接处。内含子将被剪接并由核microrna生物发生机制处理,而car-hla-e转录物的其余部分将被输出到细胞质并翻译成蛋白。p2a/弗林蛋白酶位点(seq id no:70)能够分离car和hla-e融合多肽。
[0667]
构建体73162164(图28b-28d)不使用p2a/弗林蛋白酶切割位点,而是依靠单独的
启动子来驱动car和hla-e表达。在73162中,shrnamir内含子已移入car基因,两者均由jet启动子控制并由bipa终止,而hla-e由单独的jet启动子控制并由牛生长激素(bgh)polya信号(seq id no:71)终止。在73163和73164构建体中,shrnamir内含子再次在hla-e中编码,car和hla-e表达由不同的启动子和终止子控制。在73163中,car基因受jet启动子控制并被bipa终止,而hla-e表达受ef1α核心启动子(seq id no:72)和bgh终止子控制。在73164中,两个基因都由单独的jet启动子和bipa(car)或bgh(hla-e)终止子控制。在所有四种构建体中,car基因都包含一个信号肽(seq id no:73),该肽经过优化以增加编辑的t细胞表面的car密度。
[0668]
如此前所述,将冻存的cd3+ t细胞解冻、静置和活化。在活化后第3天,用编码trac特异性核酸酶(trc 1-2l.1592)的mrna对细胞进行电穿孔,并立即以25000个病毒基因组/细胞的moi转导aav载体。细胞接受aav7206,或73161-73164之一。此外,用编码trc 1-2l.1592和核酸酶b2m 13-14x.479(靶向内源性b2m基因座)的mrna对其他受刺激的t细胞样品进行电穿孔。这些细胞用aav7206和aav7346(此前描述过)进行转导,其编码jet驱动的hla-e基因,并将同源性插入到b2m13-14位点侧翼的区域。将这些细胞称为双敲除,双敲入(dko dki)。
[0669]
编辑和aav转导后6天,使用此前描述的试剂、硬件、软件和程序,通过流式细胞术分析细胞的car、hla-abc、hla-e和cd3的表面表达。
[0670]
评估了trac编辑的car t细胞的频率,以及car染色的强度,并在图29的表中列出。与仅表达cd19特异性car的7206对照相比,构建体73161和73163比较有利,而构建体73162和73164产生cd3-/car+群体但效率不高。所有实验构建体都支持比7206更高的表面car表达水平(mfi以任意荧光单位以及7206信号的百分比列出)。这可能归因于对前导肽序列的改进。
[0671]
所有实验构建体都支持同样有效的hla-abc敲低(89-90%,图30),这是由b2m shrnamir的表达和可变水平的hla-e表达引起的。值得注意的是,73162和73164构建体产生了表达hla-e的cd3-/car-群体。这一观察结果,加上这些样品中cd3-/car+细胞的较低相对频率,表明产生了缺少载体左半部分(编码car)或右半部分(hla-e)的不完整插入片段并包装到aav衣壳中。序列分析(未显示)证实重组事件是由可能存在于载体中的相同序列驱动的。在包含两个jet启动子的载体73162和73164中观察到片段化,而从类似大小的载体(如不包含任何重复的相同序列的73163)中仅检测到完整的插入片段。hla-abc的有效敲低还表明将shrnamir定位在内含子中是允许的,并且不会损害rnai功能。
[0672]
总之,这些研究证明了几种构建体的有消息,这些构建体支持car t细胞中的三种不同功能(即,car的高表达、hla-e的高表达和hla-abc的有效敲低)。hla-e的表达和b2m(以及hla-abc)的敲低都可能起到保护car t细胞免受nk细胞杀伤的作用。重要的是,这些多组分构建体中的每一个都可以使用单个核酸酶插入基因组中的单个基因座中,并且避免了使用第一核酸酶将car基因插入到trac基因座中的多重基因编辑的需要,以及使用第二核酸酶将hla-e基因单独插入b2m基因座中。此外,发现多基因实验样品(构建体73161-73164)中hla-e染色的信号强度比我们之前描述的dko dki细胞更大,其中hla-e基因插入到b2m13-14位点(参见图30第5列表格中报告的mfi)。知道我们可以通过在dko/dki细胞中观察到的hla-e表达水平实现对nk细胞溶解的保护,我们预计构建体73161和73163支持的hla-e表达
technologies)从来自同一供体(hc6366)和无关供体(k799)的pbmc中磁性富集nk细胞,并在10ng/ml il-15(gibco)中培养48h。car t靶细胞用cell trace violet(如上)标记,并以图33中指定的比率接种nk细胞。在xvivo15+5%fbs和10ng/ml il-2中共培养4到5天。铺板后四到五天,培养物用1ug/ml碘化丙啶标记,存活的car t靶点如上列举。b2m ko细胞和7289car t细胞(仅shrnamir)几乎被供体匹配和不匹配的nk细胞消灭(杀伤》90%),这将杀伤与缺乏正常的hla-abc水平或hla-e转基因相关联。具有正常hla-abc表达(7206)的car t细胞的nk杀伤非常低(《10%)或未检测到。缺乏hla-abc但表达hla-e转基因的car t变体对nk细胞溶解的易感性各不相同。当与自体nk细胞一起培养时,73163car t细胞和b2mko/hla-e+细胞受到中度保护(杀伤30-40%),而73161car t细胞受到强力保护(杀伤《10%)。在用同种异体nk细胞进行的实验中,未检测到对b2mko/hla-e+细胞和73161细胞的杀伤。
[0684]
这些观察结果表明,构建体73161和73163可提供针对同种异体抗原特异性ctl的保护,而不会使细胞对nk杀伤敏感。此外,这种保护可以通过使用单个基因编辑插入到trac基因座的单个重组aav载体来提供。
[0685]
实施例15
[0686]
b2m shrnamir/hla-e car t细胞的体内活性
[0687]
为了证明包含shrnamir和hla-e转基因不会削弱car t细胞的杀瘤活性,我们进行了一项体内实验,其中在移植了nalm/6白血病细胞的免疫缺陷小鼠中随时间监测肿瘤杀伤。nod.cg-prkdc
scid il2rg
tm1wjl
/szj小鼠(nod.scid.γ链ko或nsg)小鼠购自jackson laboratory,并通过尾静脉注射5x105个表达萤火虫荧光素酶的nalm/6细胞(imanis)。肿瘤植入后6天,给动物注射d-荧光素并使用ivis成像仪(perkin-elmer)测量发光。确认肿瘤植入后,用携带7206对照转基因(仅cd19 car)、7289转基因、73161转基因或73163转基因的1x106个或5x106个car t细胞(如其他地方所述生产)治疗小鼠。一组动物接受载剂对照(补充有2%人血清白蛋白的盐水)。纵向监测小鼠的发光和体重。iacuc批准的人道终点用于确定生存时间。发光测量值参见图34,存活率绘制在图35中。
[0688]
接受载剂对照的动物在治疗后表现出增加的发光,直到在nalm/6植入后大约第27天达到终点。接受car t干预的小鼠表现出暂时降低的发光,其持续时间和幅度与car t剂量成正比。这伴随着生存获益,接受1x106个car t细胞的小鼠可存活35-42天,接受5x106个细胞的小鼠可存活52天至60天以上。除了剂量大小之外,没有观察到对治疗组之间的发光或存活率的显着贡献。该研究表明,使用构建体73161和73163产生的car t细胞具有与7206car t细胞相当的有效性。
[0689]
实施例16
[0690]
使用car/shrnamir构建体的非病毒dna转染筛选dck shrnamir
[0691]
启动这些研究是为了评价不同的引导序列和随从序列作为shrnamir以稳定敲低dck。目标是确定在存在嘌呤核苷类似物(如氟达拉滨)的情况下,car t细胞中dck的敲低是否能够富集cd3-/car+群体,氟达拉滨常用于car t淋巴细胞清除方案。
[0692]
本研究中使用的转基因包含驱动cd19 car表达的jet启动子(之前在实施例1中描述)和作为单个转录物的shrnamir基因,其以双向sv40 polya信号终止。转基因的两侧是同源臂,引导转基因插入trac基因中的trc1-2切割位点。对于shrnamir,鉴定了五个dck引导链和随从链序列并将其克隆到mir-e骨架中,并插入到cd19-car构建体中,其位于car的终
止密码子和双向sv40 polya转录终止子之间。在单独的实验中,与表达不包含靶向dck的shrnamir(7206)的cd19 car的对照细胞的内源性dck水平相比,本研究中评价的dck shrnamir表现出减少70%(72136)、40%(72137)、35%(72138)、60%(72140)。测试了这些dck shrnamir序列在用氟达拉滨处理时富集cd3-/car+群体的能力。
[0693]
将冻存的cd3+ t细胞解冻、静置。使用immunocult
tm t细胞刺激剂(抗cd2/cd3/cd28,stem cell technologies)在x-vivo
tm 15培养基(lonza)中激活靶t细胞,所述培养基中添加了5%胎牛血清和10ng/ml il-2(gibco)。刺激3天后,收集细胞,并用1μg编码trc 1-2l.1592大范围核酸酶的rna对1x106个细胞样品进行电穿孔,该酶识别并切割trac基因中的trc 1-2识别序列。五个car-shrnamir构建体(构建体72136-72140)作为线性化dna(1μg/1x106个细胞)与trc 1-2核酸酶rna在核转染过程中同时递送至t细胞。电穿孔的细胞在添加了5%胎牛血清和30ng/ml il-2的x-vivo
tm
15培养基中培养。
[0694]
核转染后第4天,2.5e5个活细胞在96孔圆底板中用大范围剂量的氟达拉滨处理;分别为50um、5um、0.5um、0.05um、0.005um和未处理的对照在补充有10ng/ml il-15、il-21的完整xvivo
tm
15培养基中(gibco)。未处理的对照接受体积等于最高剂量氟达拉滨的dmso。处理后2天,将96孔板离心,弃去含有药物的培养基,将细胞从96孔板移至48孔板,并用新鲜的完全xvivo
tm
15培养基、细胞因子和氟达拉滨处理(未接受任何药物的未处理对照除外)。在用氟达拉滨处理后的第6天,从每个孔中取出200ul样品进行染色,将剩余的细胞离心并用新鲜的完全xvivo
tm 15培养基处理,该培养基补充有10ng/ml的il-15、il-21(gibco)和氟达拉滨(未接受任何药物的未处理对照除外)。用氟达拉滨处理后第6天和第10天,将200ul培养物样品用抗cd3-pe(biolegend clone ucht1)、抗fmc63-alexafluor647(克隆vm16,内部生产)染色。
[0695]
图36显示了通过流式细胞术测试的不同剂量氟达拉滨下ko的ki百分比,也列在表3中相应的shrnamir下方。ko的ki百分比定义为:(cd3-/car+%)/(总cd3-%)x 100。在用氟达拉滨处理后第10天获得列表数据。对于表达dck shrnamir的car,用增加剂量的氟达拉滨进行处理导致cd3-/car+群体的富集,并且可以通过ko的ki百分比的增加在表3中观察到。除72139外,所有dck敲低构建体在5um氟达拉滨剂量下均显示出超过70%的ko的ki。
[0696]
图37显示了cd3-/car+群体的事件/ul对氟达拉滨的浓度(以um计)且与ko的ki百分比相关。在5um氟达拉滨剂量下观察到最高的ko的ki百分比和事件/ul。
[0697]
表3:使用氟达拉滨处理后,通过候选序列dck敲低所见的ko的ki百分比
[0698]
氟达拉滨的剂量(um)72067213672137721387213972140未处理(dmso)23.0617.7118.4016.5815.7214.460.00523.3220.6021.9319.1517.3417.610.0522.7121.1223.4318.6917.7216.850.527.6039.0341.2541.1327.5733.94533.2770.7072.8780.7043.6970.02504.3543.147.698.337.494.76
[0699]
在使用aav的进一步实验中研究了在72136、72138中编码的候选序列。
[0700]
该实验表明,在氟达拉滨存在的情况下,使用shrnamir敲低dck可以富集cd3-/car+细胞。通过这种非病毒方法测试的五个dck shrnamir构建体中有四个表明,用5um剂量的
氟达拉滨处理10天导致ko的ki高于70%。氟达拉滨通常与环磷酰胺一起用于在使用car t之前对患者进行淋巴细胞清除。该研究提供了一个概念验证,即用shrnamir敲低dck使car t细胞对氟达拉滨产生抗性,从而使其富集。在临床上,包含dck shrnamir可以允许在给予同种异体氟达拉滨耐药car t后继续给予患者氟达拉滨,从而抑制宿主免疫应答并使这些耐药car t细胞在体内具有更大的增殖和持久性。因此,敲除dck的潜在临床获益可以延长同种异体耐药car t细胞活性的治疗窗口,同时还可能使氟达拉滨和car t疗法具有协同抗肿瘤活性。
[0701]
实施例17
[0702]
shrnamir敲低dck对cart细胞表型和抗肿瘤活性的影响
[0703]
启动这些研究是为了评价不同的引导序列和随从序列作为shrnamir(构建体72136和72138)在aav转导后稳定敲低dck。目标是确定dck敲低对car t细胞表型和抗肿瘤活性的影响。
[0704]
如此前所述,将冻存的cd3+ t细胞解冻、静置和活化。在活化后第3天,细胞用编码trac特异性核酸酶trc 1-2l.1592的mrna电穿孔,并立即以20000个病毒基因组/细胞的moi转导aav载体。细胞接受aav7206、72136或72138或不接受aav(仅接受trc1-2l.1592)。转导后3天,通过使用抗cd3-pe(biolegend,克隆ucht1)、抗fmc63-alexfluor647(克隆vm16,内部生产)、抗cd4-bv711(biolegend,克隆okt4)、抗cd8a-bv785(biolegend,克隆sk1)、抗cd62l-bs515(bd pharmingen,克隆dreg-56)、抗cd45ro-pe/青色素7(biolegend,克隆uchl1)、抗cd27-bv421(biolegend,克隆o323)。染色研究car t表型。通过流式细胞术测试样品,并在cytoflex-s上获取数据。
[0705]
在48孔板中用以下剂量的氟达拉滨处理2.5e5个活细胞;分别为12um、6um、3um和未处理的对照在补充有10ng/ml il-15、il-21的完全xuri培养基中(gibco)。注意:未处理的对照接受体积等于最高剂量氟达拉滨的dmso。处理后第4天,进行细胞计数(如图38所示),离心1e6个活细胞,弃上清(除了用6um和12um氟达拉滨处理的样品trc和7206以外),将细胞移至新的48孔板,并用新鲜的完全xuri培养基、细胞因子、+/-氟达拉滨处理。在使用氟达拉滨处理后第8天,如上文所述,采集样品进行car t表型染色。使用easysep human release cd3阳性选择试剂盒去除剩余细胞的cd3。cd3-级分在补充有10ng/ml il-15、il-21(gibco)且未进一步用氟达拉滨处理的完全xuri培养基中保持和培养。转导后第14天,在建立acea测定之前,采集样品进行car t表型染色(如上所述参照嵌板)。这是因为需要cd3-car+%来确定作为效应物添加的car t的确切数量。转导后第15天,acea杀伤测定使用未经处理或用3或6um氟达拉滨处理的72136或72138(dck敲低cd19-car t)或7206(cd19 car t)作为效应细胞和表达cd19的hek 293作为靶细胞进行设置。triton x-100用作细胞溶解的阳性对照,trc用作阴性对照。实验设置为效应物:靶点(e:t)比率为2:1、1:2和1:4。
[0706]
通过流式细胞术测试转导后第3天(用氟达拉滨预处理)的car t表型,并总结在下表4中。ko的ki百分比定义为:(cd3-/car+%)/(总cd3-%)*100。表4报告了t幼稚(tn)、t中央记忆(tcm)/t转换记忆(ttm)、t效应记忆(tem)的cd4:cd8比率和频率。tn是cd62l+cd45ro-(低),而tcm是cd62l+、cd45ro+(中),ttm是cd62l+、cd45ro+(高),tem是cd62l-、cd45ro+。如下所示,氟达拉滨治疗前的car t表型在7206(cd19-car)和72136、72138(表达cd19-car的dck shrnamir)之间保持不变。
[0707]
表4:基于cd45ro和cd62l门控的car t表型(使用氟达拉滨处理前)
[0708][0709]
图38显示了在使用氟达拉滨处理后第4天时的活细胞计数/ml。与72136和72138(表达dck shrnamir的cd19-car aav)相比,仅使用trc(无aav)或7206(cd19-car aav),随着氟达拉滨剂量的增加,细胞计数减少50%或更多。
[0710]
用氟达拉滨处理后第8天的car t表型通过流式细胞术测试,并在下表5中报告。图39显示了在使用氟达拉滨处理后第8天时的活细胞计数/ml。由于dck敲低,与仅使用trc核酸酶(无aav)和7206(cd19-car aav)相比,在氟达拉滨存在下表达dck shrnamir的car t细胞更具活力。对于表达dck shrnamir的car t,用增加剂量的氟达拉滨进行处理导致cd3-/car+群体的富集,并且可以通过ko的ki百分比的增加在表5中观察到。还报告了t幼稚(tn)、t中央记忆(tcm)/t转换记忆(ttm)、t效应记忆(tem)的cd4:cd8比率和频率。在未处理或用氟达拉滨处理的样品之间,未观察到表达dck shrnamir的cd19-car的car t表型存在显着差异。然而,对于cd19 car(7206),氟达拉滨处理后的cd4和cd8表型从中央记忆转变为转换记忆和效应记忆表型。这表明dck敲低和氟达拉滨处理对car t细胞表型没有任何显着影响。
[0711]
表5:基于cd45ro和cd62l门控的car t表型(使用氟达拉滨处理后d8)
[0712][0713]
图40显示了使用7206(cd19-car)(未经处理或用3和6um氟达拉滨处理)作为acea测定中的效应细胞的细胞溶解百分比(标准化为trc)。将表达cd19的hek 293作为靶细胞。
实验设置为e:t比为2:1、1:2和1:4。triton用作细胞溶解的阳性对照,trc用作阴性对照。不考虑氟达拉滨的+/-处理,在e:t比为2:1时可见最有效的杀伤。在e:t比率为1:2、1:4时,与未处理组相比,在增加剂量的氟达拉滨的情况下观察到较低的杀伤效率。
[0714]
图41显示了使用72138(表达dck shrnamir的cd19-car)(未经处理或用3um或6um氟达拉滨处理)作为acea测定中的效应细胞的细胞溶解百分比(标准化为trc)。将表达cd19的hek 293作为靶细胞。实验设置为e:t比为2:1、1:2和1:4。triton用作细胞溶解的阳性对照,trc用作阴性对照。观察到,无论使用或不使用氟达拉滨处理,最有效的杀伤出现在e:t比为2:1,然后是1:2,然后是1:4。图42显示了使用72136(表达dck shrnamir的cd19-car)(未经处理或用3um或6um氟达拉滨处理)作为acea测定中的效应细胞的细胞溶解百分比(标准化为trc)。将表达cd19的hek 293作为靶细胞。实验设置为e:t比为2:1、1:2和1:4。triton用作细胞溶解的阳性对照,trc用作阴性对照。观察到,无论使用或不使用氟达拉滨处理,最有效的杀伤出现在e:t比为2:1,然后是1:2,然后是1:4。
[0715]
最后,当用氟达拉滨处理时,表达dck shrnamir的cd19-car(72136、72138)在e:t比为1:2时表现出比cd19 car更有效的杀伤。这表明使用shrnamir和氟达拉滨处理的dck敲低对cd19-car的抗肿瘤活性具有协同作用。
[0716]
实施例18
[0717]
用car/shrnamir构建体的非病毒dna转染筛选糖皮质激素受体shrnamir
[0718]
启动这些研究以评价不同引导序列和随从序列作为shrnamir,以稳定敲低糖皮质激素受体(gr)。目标是确定在糖皮质激素(如地塞米松)存在的情况下,car t细胞中gr的敲低是否能够富集cd3-/car+群体,地塞米松通常用于治疗可能与car t细胞疗法相关的细胞因子释放综合征。
[0719]
本研究中使用的转基因包括驱动cd19-car表达的jet启动子和作为单个转录本的shrnamir基因,以双向sv40 polya信号终止。转基因的两侧是同源臂,引导转基因插入trac基因中的trc1-2切割位点。对于shrnamir,鉴定了9个gr引导链和随从链序列并将其克隆到mir-e骨架中,并插入到cd19-car构建体中的car终止密码子和双向sv40 polya转录终止子之间。在单独的实验中,与表达cd19 car但不包含靶向gr的shrnamir(7206)的对照细胞的内源性gr水平相比,本研究中评估的gr shrnamir表现出37%(72142)、45%(72143)、50%(72145)和56%(72149)的减少。测试了这些gr shrnamir序列在用地塞米松处理时富集cd3-/car+群体的能力。
[0720]
将冻存的cd3+ t细胞解冻、静置。使用immunocult
tm t细胞刺激剂(抗cd2/cd3/cd28,stem cell technologies)在x-vivo
tm 15培养基(lonza)中激活靶t细胞,所述培养基中添加了5%胎牛血清和10ng/ml il-2(gibco)。刺激3天后,收集细胞,并用1μg编码trc 1-2l.1592大范围核酸酶的rna对1x106个细胞样品进行电穿孔,该酶识别并切割t细胞受体α恒定基因中的trc 1-2识别序列。将九个car-shrnamir构建体(构建体72142、72143、72145、72146、72148-72152)作为线性化dna(1μg/1x106个细胞)与trc1-2核酸酶rna在核转染过程中同时递送至t细胞。电穿孔的细胞在添加了5%胎牛血清和30ng/ml il-2的x-vivo
tm
15培养基中培养。
[0721]
在核转染后第8天,在96孔圆底板中用大范围剂量的地塞米松处理2.5e5活细胞;分别为100um、10um、1um、0.1um、0.01um和未处理的对照在补充有10ng/ml il-15、il-21的
完全xvivo
tm
15培养基(gibco)中。注意:未处理对照接受体积等于最高剂量地塞米松的95%乙醇。处理后3天,将96孔板离心,弃去含有药物的培养基,将细胞从96孔板移至48孔板并用新鲜的完全xvivo
tm
15培养基、细胞因子和地塞米松处理(未接受任何药物的未处理对照除外)。在使用地塞米松处理后第7天,从各孔中取200ul样品染色。使用抗cd3-pe(biolegend,clone ucht1)、抗fmc63-alexafluor647(克隆vm16,内部制备)对样品染色,并通过流式细胞术在cytoflex-lx上检测。
[0722]
图43显示了通过流式细胞术测试的不同剂量地塞米松的ko的ki百分比,并列在表6中相应的shrnamir下方。ko的ki百分比定义为:(cd3-/car+%)/(总cd3-%)x 100。在用地塞米松处理后第7天获得列表数据。对于表达gr shrnamir的car,用增加剂量的地塞米松处理导致cd3-/car+群体的富集,并且可以通过ko的ki百分比增加在表6中观察到。除72148外,所有gr敲低构建体在剂量为1、10um的地塞米松时均显示出35-50%的ko的ki百分比。图44显示了cd3-/car+的事件/ul对地塞米松浓度(以um计)的曲线。ko的ki百分比与事件/ul相关。
[0723]
表6:使用地塞米松处理后,通过候选序列gr敲低所见的ko的ki百分比
[0724][0725]
该实验表明,在地塞米松等皮质类固醇存在的情况下,使用shrnamir敲低gr可以富集cd3-/car+细胞。通过非病毒方法测试的九个gr shrnamir中有八个显示用剂量1um或10um的地塞米松处理7天导致ko的35-50%ki。
[0726]
因此,这些实验证实,用shrnamir敲低gr使car t细胞对地塞米松产生抗性,并允许其富集。临床上,皮质类固醇通常与托珠单抗一起用于治疗细胞因子释放综合征(crs),crs是一种潜在的危及生命的毒性,在对癌症进行过继t细胞疗法后有时会出现。细胞因子释放综合征与几种细胞因子的循环水平升高有关。然而,高剂量皮质类固醇的施用可能会降低car t治疗的临床有效性。通过使car t细胞对皮质类固醇具有抗性,可以在不影响car t功能的情况下抑制针对car t细胞的hvg应答,从而增加潜在活性窗口并提高安全性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1