催化剂
1.本发明总体涉及包含二胺配体的有机金属催化剂。更具体地,尽管并非排他性地,本发明涉及甲苯磺酰化-1,2-二苯基-乙烷-1,2-二胺(tsdpen)配体、含有甲苯磺酰化-1,2-二苯基-乙烷-1,2-二胺(tsdpen)配体的金属配合物,以及所述金属配合物作为有机金属催化剂的用途,例如用于不对称转移氢化反应的用途。
背景技术:
2.不对称催化,即手性催化剂引导形成手性化合物,从而有利于形成一种特定立体异构体的催化,是一个活跃的研究领域,特别应用于药物及其前体的合成。
3.n-(对甲苯磺酰基)-1,2-二苯乙烯-1,2-二胺(tsdpen)是一种广泛应用的手性二胺衍生物,在不对称催化中用于合成应用。tsdpen最成功和最成熟的催化应用之一是作为[η
6-芳烃)ru(ii)tsdpen(cl)]配合物中的配体,这种配合物目前作为有效的选择性催化剂用于酮和亚胺的不对称转移氢化(ath)(例如,参见r.noyori and s.hashiguchi,acc.chem.res.,1997,30,97-102)。
[0004]
在大多数报道的[η
6-芳烃)ru(ii)tsdpen(cl)]催化剂实例中,tsdpen配体包含伯胺。据了解,例如通过烷基化将伯胺官能化,并不会显著降低相应催化剂的反应性或选择性(例如,参见wills et.al.tetrahedron:asymmetry 2010,21,2258-2264和wills et.al.org.lett.,2009,11(4),pp 847
–
850。
[0005]
另外据了解,采用适当的部分将tsdpen的伯胺官能化,从而在金属配合物中形成三齿结构。通常,所述部分是三唑或吡啶基团,除了配体的两个仲胺之外,它们还充当“第三供体基团”向金属中心提供电子密度。但是,在一个未发表的研究项目过程中发现,包含此类配体的[η
6-芳烃)ru(ii)tsdpen(cl)]催化剂是比较差的催化剂,因为第三个供体基团可能强烈配位到金属中心,抑制催化活性。
[0006]
人们已经证明,尽管存在这个问题,但当与ru3(co)
12
一起使用原位形成配合物时,此类配体可以形成活性催化剂(例如,参见wills et.al.org.lett.,2012,14(20),pp 5230-5233)。
[0007]
尽管已经提出了用于不对称催化的许多配体和相应的金属配合物,但为具有广泛结构和官能的底物的不对称还原提供具有高对映选择性(ee)和产率的催化剂仍然是一个挑战。例如,为邻位取代苯基酮的不对称转移氢化提供催化剂是一项特殊的挑战(参见wills et.al.org.lett.,2012,14(20),pp 5230-5233)。因此,为更复杂底物的还原提供高ee值的不对称催化剂将是有利的。
[0008]
提供具有第三供体基团的三齿tsdpen配体用于常规系统,即用于[η
6-芳烃)ru(ii)tsdpen(cl)]配合物也是有利的。尽管已经证明使用ru3(co)
12
与此类配体可以中等对映选择性有效地还原底物,但为不对称转移氢化提供以高对映体过量还原具有更复杂结构和/或官能的底物的单一试剂将是有利的。
技术实现要素:
[0009]
因此,本发明的第一个非排他性目的是提供用于有机金属不对称催化剂的tsdpen配体,其中所述催化剂用于包含配合物官能性的底物的不对称还原。
[0010]
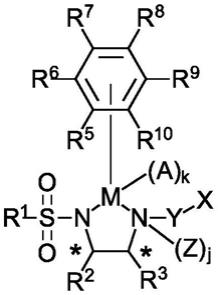
因此,本发明的第一方面提供一种由以下通式(1)表示的化合物,例如二胺配体:
[0011]
(1)
[0012][0013]
其中每个
*
代表不对称碳原子;
[0014]
x代表选自以下之一的基团:酯(例如叔丁酯);硫酯;酰胺;包含o、s、se和/或p中的一个或多个的杂环部分(例如五元杂环)(例如呋喃、四氢呋喃、噻吩、异恶唑、溴呋喃或噻唑);包含氮原子的部分(例如五元杂环),其中氮原子采用包含吸电子基团的保护基团保护,优选保护基团选自氨基甲酸酯保护基团、酰胺保护基团、芳基磺酰胺保护基团或烷基磺酰胺保护基团;并且任选x可以另外包含载体,例如聚合物或二氧化硅颗粒;y代表或是c
t
t’t”,其中
‘
t’为0或1且当t为1时,t’和t”可单独代表取代基,例如如果t是1,t’和/或t”可以各自是氢或氘原子,或卤素原子,例如y可以代表或是ch2,并且例如如果t是0,则y不存在;
[0015]
z代表氢原子或氘原子;
[0016]
r1代表优选具有1至100个碳原子,例如1至30个碳原子(例如1至20个碳原子,或1至10个碳原子)的烷基(例如官能化烷基);优选具有1至100个碳原子(例如cf3),例如1至30个碳原子(例如1至20个碳原子,或1至10个碳原子)的卤代烷基;优选具有5至100个碳原子,例如6至30个碳原子的芳基,并且所述芳基任选具有一个或多个取代基,所述取代基选自优选具有1至100个碳原子,例如1至10个碳原子的烷基,优选具有1至100个碳原子,例如1至10个碳原子的卤代烷基,和/或卤素原子;或r1表示具有式c
2nh4n+2on+1
的聚乙二醇(peg)部分,其中n是1和100之间的整数;或r1代表载体,例如二氧化硅颗粒或聚合物颗粒;
[0017]
r2和r3每个独立地代表选自优选具有1至100个碳原子,例如1至20个碳原子(例如1至10个碳原子)的烷基、芳基(例如苯基),和优选具有3至8个碳原子的环烷基的基团,所述芳基或苯基任选具有一个或多个取代基,所述取代基选自优选具有1至100个碳原子,例如1至20个碳原子(例如1至10个碳原子)的烷基、优选具有1至100个碳原子,例如1至20个碳原子(例如1至10个碳原子)的烷氧基,及卤素原子,并且环烷基的每个氢原子任选被优选具有1至100个碳原子,例如1至20个碳原子(例如1至10个碳原子)的烷基取代,或r2和r3与r2和r3键合的碳原子一起形成环;
[0018]
r4代表氢原子或氘原子。
[0019]
本发明的另一方面提供一种由以下通式(1)表示的化合物,例如二胺配体:
[0020]
(1)
[0021][0022]
其中
[0023]
每个*代表不对称碳原子;
[0024]
x代表c=o、c-s、c-o中的一种,或包含o、s、se和/或p中的一种或多种的杂环部分;
[0025]
y代表包含两个其它取代基的碳原子,例如y代表ch2;
[0026]
z代表氢原子或氘原子;
[0027]
r1表示具有1至20个碳原子(例如1至10个碳原子)的烷基(例如官能化烷基)、具有1至20个碳原子(例如1至10个碳原子)的卤代烷基、具有6至30个碳原子的芳基,所述芳基任选具有一个或多个取代基,所述取代基选自具有1至10个碳原子的烷基、具有1至10个碳原子的卤代烷基和/或卤素原子;
[0028]
r2和r3每个独立地代表选自具有1至20个碳原子(例如1至10个碳原子)的烷基、芳基(例如苯基)和具有3至8个碳原子的环烷基的基团,所述苯基任选具有一个或多个取代基,所述取代基选自具有1至20个碳原子(例如1至10个碳原子)的烷基、具有1至20个碳原子(例如1至10个碳原子)的烷氧基,及卤素原子,并且环烷基的每个氢原子任选被具有1至20个碳原子(例如1至10个碳原子)的烷基取代,或r2和r3与r2和r3键合的碳原子一起形成环;
[0029]
r4代表氢原子或氘原子。
[0030]
惊讶地发现,通式(1)的化合物可作为二胺配体,形成金属配合物用作不对称转移氢化的催化剂。不希望受任何特定理论的束缚,本发明人发现其中x如上定义的化合物是“弱供体”,其包含不能在(芳烃ru)配合物中形成三齿配体的原子。与具有“强”供体(例如,其中x包含吡啶基团或三唑基团)而形成无活性催化剂的那些配体相比,这些配体具有催化活性。这是令人惊讶的,因为本发明人最初预测通式(1)的化合物也将形成无活性的三齿催化剂。然而,已经证明,本发明的配体和配合物可用于不对称氢化反应,以高产率和对映选择性还原底物。
[0031]
在实施方案中,x代表包含o、s、se和/或p中的一个或多个的杂环部分。在实施方案中,x代表包含o、s、se和/或p中的一个或多个的五元杂环基团或部分,例如呋喃、四氢呋喃、噻吩、异恶唑、溴呋喃或噻唑。
[0032]
在实施方案中,x代表包含o、s、se和/或p中的一个或多个的芳族五元杂环基团或部分。在实施方案中,x代表包含o、s、se和/或p中的一个或多个的非芳族五元杂环基团或部分(即不遵守休克尔(h
ü
ckel)规则的部分)。
[0033]
在实施方案中,x代表包含o、s、se和/或p中的一个或多个的杂环部分,其中杂环部分包含一个或多个其它取代基(例如,一个、两个、三个或四个或更多个相同或不同的其它取代基)。例如,x可以代表包含一个或多个其它取代基的五元杂环部分,例如进一步取代的呋喃、噻吩、异恶唑、溴呋喃或噻唑。在实施方案中,取代的杂环部分可以被其它脂肪族或芳族部分单取代。在实施方案中,取代的杂环部分可以被相同或不同的其它取代基二取代、三
取代、四取代,每个取代基可以是脂肪族或芳族部分。
[0034]
在实施方案中,x不代表噻唑。
[0035]
在实施方案中,x不代表布朗斯特酸(acid)。在实施方案中,x不包含和/或代表cooh部分。
[0036]
在实施方案中,x代表含有一个或多个氮原子的部分。在实施方案中,x不代表含有氮原子的部分。
[0037]
在实施方案中,x代表酯,例如叔丁酯。x代表酯是指x代表包含-(c=o)-o-r
x
的部分,其中r
x
是包含1至10个碳原子,例如1、2、3、4、5、6、7、8、9个碳原子至10、9、8、7、6、5、4、3、2个碳原子的烷基部分,例如r
x
是叔丁基。
[0038]
在实施方案中,x代表硫酯,例如,-(c=o)-sr
x
,其中r
x
是包含1至10个碳原子,例如1、2、3、4、5、6、7、8、9个碳原子至10、9、8、7、6、5、4、3、2个碳原子的烷基部分,例如r
x
是叔丁基。
[0039]
在实施方案中,x代表酰胺,例如,-(c=o)-nr
xry
或-n(r
x
)-(c=o)ry,其中r
x
和/或ry独立地代表包含1至10个碳原子,例如1、2、3、4、5、6、7、8、9个碳原子至10、9、8、7、6、5、4、3、2个碳原子的烷基部分,例如r
x
是叔丁基。
[0040]
在实施方案中,x代表包含氮原子的部分(例如五元杂环),其中氮原子采用选自氨基甲酸酯保护基团、酰胺保护基团、芳基磺酰胺保护基团或烷基磺酰胺保护基团中的一个保护基团保护。
[0041]
在实施方案中,x代表包含氮原子的烷基部分,其中氮原子采用选自氨基甲酸酯保护基团、酰胺保护基团、芳基磺酰胺保护基团或烷基磺酰胺保护基团中的一个保护基团保护。也就是说,x代表包含1至10个碳原子,例如,1、2、3、4、5、6、7、8或9个碳原子至10、9、8、7、6、5、4、3或2个碳原子,例如1、2、3、4、5、6、7、8、9或10个碳原子的烷基部分。烷基部分可以是直链、支链或环状的。烷基部分可以包含一个或多个取代基,例如包含1至10个碳原子的烷基取代基;或卤化物取代基。
[0042]
在实施方案中,x代表包含氮原子的芳基部分,其中氮原子采用选自氨基甲酸酯保护基团、酰胺保护基团、芳基磺酰胺保护基团或烷基磺酰胺保护基团中的一个保护基团保护。也就是说,x代表包含4至18个碳原子,例如,4、5、6、7、8、9、10、11、12、13、14、15、16或17个碳原子至18、17、16、15、14、12、10、9、8、7、6或5个碳原子,例如4、5、6、7、8、9、10、11、12、13、14、15、16、17或18个碳原子的芳基部分。芳基部分可以包含一个或多个取代基,例如包含1至10个碳原子的烷基取代基;和/或卤化物取代基。
[0043]
在实施方案中,x代表包含氮原子的烷基杂环部分(例如五元杂环),其中氮原子采用选自氨基甲酸酯保护基团、酰胺保护基团、芳基磺酰胺保护基团或烷基磺酰胺保护基团中的一个保护基团保护。
[0044]
在实施方案中,x代表包含叔丁氧羰基保护基团(boc基团)的吡咯烷部分。
[0045]
在实施方案中,x代表包含酰胺保护基团n-(c=o)r
x
的吡咯烷部分,其中r
x
代表包含1至20个碳原子,例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19个碳原子至20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2个碳原子的烷基部分。
[0046]
在实施方案中,x代表包含芳基磺酰胺保护基团n-s(o)2ry的吡咯烷部分,其中ry代表包含5至18个碳原子,例如,5、6、7、8、9、10、11、12、13、14、15、16或17个碳原子至18、17、
16、15、14、13、12、11、10、9、8、7或6个碳原子,例如,5、6、7、8、9、10、11、12、13、14、15、16、17或18个碳原子的芳基部分。芳基部分可以包含一个或多个取代基,例如包含1至10个碳原子的烷基取代基;和/或卤化物取代基。
[0047]
在实施方案中,x代表包含烷基磺酰胺保护基团n-s(o)2rz的吡咯烷部分,其中rz代表包含1至20个碳原子,例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19个碳原子至20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2个碳原子的烷基部分。
[0048]
在实施方案中,y不存在指的是化合物具有以下通式:
[0049][0050]
在实施方案中,y是包含两个氢取代基的碳原子,即ch2。在替代实施方案中,y是包含两个取代基的碳原子,一个或两个取代基可以是氢原子、氘原子、卤素原子(例如氟、氯、溴、碘)。在实施方案中,y代表进一步包含烷基和/或芳基的碳原子。
[0051]
在实施方案中,y代表ch2部分且x代表选自酯(例如叔丁酯);硫酯;酰胺;包含o、s、se和/或p中一个或多个的杂环部分(例如五元杂环)(例如呋喃、四氢呋喃、噻吩、异恶唑、溴呋喃或噻唑)的基团。
[0052]
在实施方案中,r1代表烷基(例如,官能化烷基)或卤代烷基,其中烷基或卤代烷基具有1至100个碳原子(例如,cf3),例如,1至90个碳原子,1至80个碳原子,1至70个碳原子,1至60个碳原子,1至50个碳原子,1至40个碳原子,1至30个碳原子,1至20个碳原子,或1至10个碳原子。
[0053]
在实施方案中,r1代表具有5至100个碳原子,例如,5至90个碳原子,5至80个碳原子,5至70个碳原子,5至60个碳原子,5至50个碳原子,5至40个碳原子或5至30个碳原子,例如6至30个碳原子的芳基。任选其中r1代表芳基,所述芳基具有一个或多个取代基,所述取代基选自具有1至100个碳原子,例如,1至90个碳原子,1至80个碳原子,1至70个碳原子,1至60个碳原子,1至50个碳原子,1至40个碳原子,1至30个碳原子,1至20个碳原子,或1至10个碳原子的烷基;或具有1至100个碳原子,例如,1至90个碳原子,1至80个碳原子,1至70个碳原子,1至60个碳原子,1至50个碳原子,1至40个碳原子,1至30个碳原子,1至20个碳原子或1至10个碳原子的卤代烷基。
[0054]
在实施方案中,r2和r3每个独立地代表选自优选具有1至100个碳原子,例如1至90个碳原子,1至80个碳原子,1至70个碳原子,1至60个碳原子,1至50个碳原子,1至40个碳原子,1至30个碳原子,1至20个碳原子或1至10个碳原子的烷基基团。
[0055]
在实施方案中,r2和r3每个独立地代表芳基或苯基,所述芳基或苯基任选具有一个或多个选自烷基的取代基,所述烷基优选具有1至100个碳原子、1至90个碳原子、1至80个碳原子、1至70个碳原子、1至60个碳原子、1至50个碳原子、1至40个碳原子、1至30个碳原子、1至20个碳原子或1至10个碳原子。
[0056]
在实施方案中,r2和r3每个独立地代表烷氧基,所述烷氧基优选具有1至100个碳原子,例如1至90个碳原子,1至80个碳原子,1至70个碳原子,1至60个碳原子,1至50个碳原子,1至40个碳原子,1至30个碳原子,1至20个碳原子或1至10个碳原子。
[0057]
在实施方案中,其中环烷基的每个氢原子任选被烷基取代,所述烷基优选具有1至100个碳原子,例如1至90个碳原子,1至80个碳原子,1至70个碳原子,1至60个碳原子,1至50个碳原子,1至40个碳原子,1至30个碳原子,1至20个碳原子或1至10个碳原子。
[0058]
在实施方案中,r1代表具有式c
2nh4n+2on+1
的聚乙二醇(peg)部分,其中n是1至100,例如1至90、1至80、1至70、1至60、1至50、1至40、1至30、1至20、1至10的整数,例如1、2、3、4、5、6、7、8、9或10。
[0059]
在实施方案中,r1代表c6h4ch3部分。在实施方案中,r1代表cf3部分。在实施方案中,r1代表聚合物颗粒或二氧化硅颗粒。在实施方案中,r2和r3每个代表苯基部分。
[0060]
因此,本发明的另一方面提供一种由以下通式(1a、1b、1c、1d)表示的化合物,例如二胺配体:
[0061]
(1a)
[0062][0063]
(1b)
[0064][0065]
(1c)
[0066][0067]
(1d)
[0068][0069]
其中x、y、z、r1、r2、r3和r4如上所定义。
[0070]
在实施方案中,r1代表4-甲基苯或ch3或cf3或2,4,6-三异丙苯。在实施方案中,r1代表载体,例如二氧化硅颗粒或聚合物颗粒。
[0071]
在实施方案中,通式(1e)中r2和r3各自代表取代或未取代的苯基:
[0072]
(1e)
[0073][0074]
其中每个
*
代表不对称碳原子;及
[0075]
x、y、z、r1和r4的定义如上。
[0076]
在实施方案中,不对称碳原子由通式(1f)、(1g)、(1h)或(1j)表示:
[0077]
(1f)
[0078][0079]
(1g)
[0080][0081]
(1h)
[0082][0083]
(1j)
[0084][0085]
其中x、y、z、r1和r4如上所定义。
[0086]
本发明的另一方面提供一种金属-二胺配合物,例如由通式(2)表示的过渡金属-二胺配合物。
[0087][0088]
其中
[0089]
m代表过渡金属催化剂,和/或钌、铱、铑或锇中的一种;
[0090]
每个
*
代表不对称碳原子;
[0091]
x代表选自以下之一的基团:酯(例如叔丁酯);硫酯;酰胺;包含o、s、se和/或p中的一个或多个的杂环部分(例如五元杂环)(例如呋喃、四氢呋喃、噻吩、异恶唑、溴呋喃或噻唑);包含氮原子的部分(例如五元杂环),其中氮原子采用包含吸电子基团的保护基团保护,优选保护基团选自氨基甲酸酯保护基团、酰胺保护基团、芳基磺酰胺保护基团或烷基磺酰胺保护基团中的一个保护基团;并且任选x可以另外包含载体,例如聚合物或二氧化硅颗粒;
[0092]
y代表或是c
t
t’t”,其中
‘
t’为0或1且当
‘
t’为1时,t’和t”可单独代表取代基,例如如果t是1,t’和/或t”可以各自是氢或氘原子,或卤素原子,例如y可以代表或是ch2;
[0093]
z代表氢原子或氘原子;
[0094]
r1代表优选具有1至100个碳原子,例如1至30个碳原子(例如1至20个碳原子,或1至10个碳原子)的烷基(例如官能化烷基);优选具有1至100个碳原子(例如cf3),例如1至30
个碳原子(例如1至20个碳原子,或1至10个碳原子)的卤代烷基;优选具有5至100个碳原子,例如6至30个碳原子的芳基,并且所述芳基任选具有一个或多个取代基,所述取代基选自优选具有1至100个碳原子,例如1至10个碳原子的烷基,优选具有1至100个碳原子,例如1至10个碳原子的卤代烷基,和/或卤素原子;或r1表示具有式c
2nh4n+2on+1
的聚乙二醇(peg)部分,其中n是1和100之间的整数;或r1代表载体,例如二氧化硅颗粒或聚合物颗粒;
[0095]
r2和r3每个独立地代表选自优选具有1至100个碳原子,例如1至20个碳原子(例如1至10个碳原子)的烷基、芳基(例如苯基)和优选具有3至8个碳原子的环烷基的基团,所述芳基或苯基任选具有一个或多个取代基,所述取代基选自优选具有1至100个碳原子,例如如1至20个碳原子(例如1至10个碳原子)的烷基、优选具有1至100个碳原子,例如1至20个碳原子(例如1至10个碳原子)的烷氧基,及卤素原子,并且环烷基的每个氢原子任选被优选具有1至100个碳原子,例如1至20个碳原子(例如1至10个碳原子)的烷基取代,或r2和r3与r2和r3键合的碳原子一起形成环;
[0096]
r5、r6、r7、r8、r9和r
10
每个独立地代表选自以下基团:氢原子,氘原子,优选具有1至100个碳原子(例如1至10个碳原子)的烷基,具有1至3个烷基的甲硅烷基,其中所述烷基优选具有1至100个碳原子,例如1至10个碳原子,优选具有1至100个碳原子,例如1至10个碳原子的烷氧基,及c(=o)-or
11
,其中r
11
代表优选具有1至100个碳原子,例如,1至10个碳原子的烷基,优选具有4至100个碳原子,例如4至10个碳原子的杂芳基,或优选具有6至100个碳原子,例如6至10个碳原子的芳基;
[0097]
a代表选自三氟甲磺酰氧基、对甲苯磺酰氧基、甲磺酰氧基、苯磺酰氧基、氢原子、卤素原子、乙酸酯、六氟磷酸酯和四氟硼酸酯的基团;
[0098]
j和k各自代表0或1,但j+k不是1。
[0099]
在实施方案中,r5、r6、r7、r8、r9和/或r
10
中的一个或多个每个独立地代表具有1至100个碳原子,例如1至90个碳原子,1至80个碳原子,1至70个碳原子,1至60个碳原子,1至50个碳原子,1至40个碳原子,1至30个碳原子,1至20个碳原子,或1至10个碳原子的烷基。
[0100]
在实施方案中,r5、r6、r7、r8、r9和/或r
10
中的一个或多个每个独立地代表具有1至100个碳原子,例如1至90个碳原子,1至80个碳原子,1至70个碳原子,1至60个碳原子,1至50个碳原子,1至40个碳原子,1至30个碳原子,1至20个碳原子,或1至10个碳原子的甲硅烷基。
[0101]
在实施方案中,r5、r6、r7、r8、r9和/或r
10
中的一个或多个每个独立地代表c(=o)-or
11
,其中r
11
代表具有1至100个碳原子,1至90个碳原子,1至80个碳原子,1至70个碳原子,1至60个碳原子,1至50个碳原子,1至40个碳原子,1至30个碳原子,1至20个碳原子,或1至10个碳原子的烷基。
[0102]
在实施方案中,r5、r6、r7、r8、r9和/或r
10
中的一个或多个每个独立地代表具有4至100个碳原子,例如4至90、4至80、4至70、4至60、4至50、4至40、4至30、4至20或4至10个碳原子的杂芳基;或具有6至100个碳原子,例如6至90、6至80、6至70、6至60、6至50、6至40、4至30、6至20,或6至10个碳原子的芳基。
[0103]
在实施方案中,r1代表具有1至10个碳原子的烷基、具有1至10个碳原子的卤代烷基、具有6至30个碳原子的芳基,所述芳基任选具有一个或多个取代基,所述取代基选自具有1至10个碳原子的烷基、具有1至10个碳原子的卤代烷基和/或卤素原子;或r1代表载体,例如二氧化硅颗粒或聚合物颗粒;
[0104]
r2和r3每个独立地代表选自具有1至10个碳原子的烷基、苯基和具有3至8个碳原子的环烷基的基团,所述苯基任选具有一个或多个取代基,所述取代基选自具有1至10个碳原子的烷基、具有1至10个碳原子的烷氧基,及卤素原子,并且环烷基的每个氢原子任选被具有1至10个碳原子的烷基取代,或r2和r3与r2和r3键合的碳原子一起形成环;
[0105]
r5、r6、r7、r8、r9和r
10
各自独立地代表选自以下基团:氢原子、氘原子、具有1至10个碳原子的烷基、具有1至3个包含1至10个碳原子的烷基的甲硅烷基、具有1至10个碳原子的烷氧基及c(=o)-or
11
,其中r
11
代表具有1至10个碳原子的烷基、具有4至10个碳原子的杂芳基或具有6至10个碳原子的芳基;
[0106]
a代表选自三氟甲磺酰氧基、对甲苯磺酰氧基、甲磺酰氧基、苯磺酰氧基、氢原子、卤素原子、乙酸酯、六氟磷酸酯和四氟硼酸酯的基团;
[0107]
j和k各自是0或1,但j+k不是1。
[0108]
本发明的另一方面提供一种金属-二胺配合物,例如由通式(3)表示的过渡金属-二胺配合物:
[0109]
(3)
[0110][0111]
其中每个
*
代表不对称碳原子;
[0112]
其中m、x、y、z、r1、r2、r3、r5、r6、r7、r8、r9、r
10
如上所定义;及
[0113]
q代表抗衡阴离子。
[0114]
本发明的另一方面提供一种金属-二胺配合物,例如由通式(4)表示的过渡金属-二胺配合物:
[0115]
(4)
[0116][0117]
其中每个
*
代表不对称碳原子;
[0118]
m、x、y、z、j、k、r1、r2、r3如上所定义;及
[0119]
l代表环戊二烯基或五甲基环戊二烯基配体。
[0120]
本发明的另一方面提供一种金属-二胺配合物,例如由通式(5)表示的过渡金属-二胺配合物:
[0121]
(5)
[0122][0123]
其中每个
*
代表不对称碳原子;
[0124]
m、x、y、z、r1、r2、r3如上所定义;及
[0125]
q代表抗衡阴离子;
[0126]
l代表环戊二烯基或五甲基环戊二烯基配体。
[0127]
在实施方案中,任何上述确定通式中的r1代表烷基。由r1表示的具有1至10个碳原子的烷基优选是具有1至5个碳原子的直链或支链烷基。具有1至10个碳原子的烷基的具体实例包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、正己基、正庚基、正辛基、正壬基、正癸基等。烷基优选是甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基或正戊基。
[0128]
在实施方案中,任何上述确定通式中的r1代表卤代烷基。除其一个或多个氢原子被一个或多个卤素原子取代外,r1表示的具有1至10个碳原子的卤代烷基与上述具有1至10个碳原子的烷基相同。具有1至10个碳原子的卤代烷基优选是具有1至5个碳原子的直链或支链卤代烷基。卤素原子的实例包括氯原子、溴原子、氟原子和碘原子。具有1至10个碳原子的卤代烷基的具体实例包括三氟甲基、三氯甲基、三溴甲基等。
[0129]
在实施方案中,任何上述确定通式中的r1代表芳基。具有6至30个碳原子的芳基可以是具有6至30个碳原子的芳族单环基团、芳族多环基团或芳族稠环基团,并且优选是具有6至15个碳原子的芳族单环基团、芳族多环基团或芳族稠环基团,特别优选是具有6至12个碳原子的芳族单环基团。具有6至30个碳原子的芳基的具体实例包括苯基、萘基、蒽基、菲基、茚基等。最优选的是苯基。此外,芳基任选具有一个或多个选自具有1至10个碳原子的烷基、具有1至10个碳原子的卤代烷基和卤素原子的取代基。
[0130]
作为取代基的烷基和卤代烷基可以选自任何上述通式中r1表示的烷基或卤代烷基定义的上述基团。在这些基团中,特别优选具有1至5个碳原子的直链烷基。
[0131]
卤素原子的实例包括氯原子、溴原子、氟原子和碘原子。
[0132]
在任何上述通式中由r1表示并被取代基取代的芳基的具体实例包括对甲苯基、2,4,6-三甲基苯基、4-三氟甲基苯基、五氟苯基等。
[0133]
本发明的另一方面提供一种制备由通式(2)、(3)、(4)或(5)之一表示的金属配合物的方法,所述方法包括使由通式(1),例如(1a)或(1b)表示的配体与金属化合物,例如钌化合物、铱化合物或铑化合物反应。
[0134]
在实施方案中,上述确定通式中的r2和/或r3每个独立地代表选自具有1至10个碳原子的烷基、芳基(例如苯基)和具有3至8个碳原子的环烷基的基团,其中所述苯基任选具有一个或多个取代基,所述取代基选自具有1至10个碳原子的烷基、具有1至10个碳原子的烷氧基,及卤素原子,并且环烷基的每个氢原子任选被具有1至10个碳原子的烷基取代。或者,任何上述通式中的r2和r3可以与r2和r3键合的碳原子一起形成环,优选与r2和r3键合的
碳原子一起形成环烷烃。在上述确定的任一通式中,r2和r3各自独立地优选是苯基(条件是苯基任选具有一个或多个选自具有1至10个碳原子的烷基、具有1至10个碳原子的烷氧基和卤素原子的取代基)。
[0135]
由任何上述确定的通式的r2和r3中的每一个表示的具有1至10个碳原子的烷基可以选自由r1表示的具有1至10个碳原子的烷基定义的基团。
[0136]
此外,由任何上述确定的通式的r2和r3中的每一个表示的芳基(例如苯基)任选具有一个或多个选自具有1至10个碳原子的烷基、具有1至10个碳原子的烷氧基和卤素原子的取代基。
[0137]
作为取代基的烷基可选自由任何上述确定通式的r1表示的烷基定义的基团。
[0138]
作为取代基的具有1至10个碳原子的每个烷氧基优选是具有1至5个碳原子的直链或支链烷氧基。烷氧基的具体实例包括甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、仲丁氧基、叔丁氧基、正戊氧基、正己氧基、正庚氧基、正辛氧基、正壬氧基、正癸氧基等。烷氧基优选是甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、仲丁氧基、叔丁氧基或正戊氧基。
[0139]
作为取代基的卤素原子的实例包括氯原子、溴原子、氟原子等。
[0140]
被任何上述确定通式的r2和r3表示的取代基取代的芳基的具体实例包括2,4,6-三甲基苯基、4-甲氧基苯基、2,4,6-三甲氧基苯基、4-氟苯基、2-氯苯基、4-氯苯基、2,4-二氯苯基等。
[0141]
由任何上述确定通式的r2和r3中的每一个表示的具有3至8个碳原子的环烷基优选是具有5至8个碳原子,特别优选具有5至7个碳原子的单环、多环或桥连环烷基。具有3至8个碳原子的环烷基的具体实例包括环丙基、环丁基、环戊基、环己基、环庚基、环辛基等。
[0142]
在由任何上述确定通式的r2和r3中的每一个表示的环烷基中,每个氢原子任选被具有1至10个碳原子的烷基取代。作为取代基的烷基的具体实例包括甲基、异丙基、叔丁基等。
[0143]
当任何上述确定通式的r2和r3与任何上述确定通式的r2和r3键合的碳原子一起形成环烷烃时,任何上述确定通式的r2和r3一起形成具有2至10个,优选3至10个碳原子的直链或支链亚烷基,及与相邻的碳原子一起形成优选4至8元及更优选5至8元环烷烃环。环烷烃环的优选实例包括环戊烷环、环己烷环和环庚烷环。在环烷烃环中,每个氢原子任选被具有1至10个碳原子的烷基取代。作为取代基的烷基的具体实例包括甲基、异丙基、叔丁基等。
[0144]
在实施方案中,y代表ch2部分且x代表选自酯(例如叔丁酯);硫酯;酰胺;包含o、s、se和/或p中一个或多个的杂环部分(例如五元杂环)(例如呋喃、四氢呋喃、噻吩、异恶唑、溴呋喃或噻唑)的基团。
[0145]
本发明的另一方面提供使用一种或多种所述金属-二胺配合物(2)、(3)、(4)或(5)作为催化剂选择性制备旋光化合物的方法,所述方法包括在一种或多种配合物(2)、(3)、(4)或(5)和氢源或氢供体存在下还原底物的官能团。
[0146]
氢源可以是氢气和/或甲酸,和/或醇和/或甲酸盐。
[0147]
官能团可以是亚胺或亚氨基,被还原为胺。官能团可以是酮或酮基,被还原为醇。官能团可以是不饱和键,被还原为饱和键。
[0148]
本发明方法制备的旋光化合物可以用作合成药物材料和/或其他功能材料的前
体。
[0149]
在本技术的范围内,明确表明前面各段落、权利要求和/或以下说明和附图中陈述的各个方面、实施方案、实施例和替代方案,特别是其各个特征,可以是独立的或任意组合。也就是说,所有实施方案和/或任何实施方案的特征可以以任何方式和/或组合进行组合,除非这些特征不兼容。为免生疑问,此处使用的术语“可以”、“和/或”、“例如”和任何类似的术语应被解释为非限制性的,因此并不需要存在所述的任何特征。实际上,在不背离本发明范围的情况下,明确设想了任选特征的任何组合,无论这些组合是否明确要求保护。申请人保留相应地更改任何最初提交的权利要求或提交任何新权利要求的权利,包括修改任何最初提交的权利要求,以从属和/或合并任何其他权利要求的任何特征的权利,尽管最初并未以这种方式提出权利要求。
附图说明
[0150]
现在,将通过实施例,并参考附图对本发明的实施方案进行说明,其中:
[0151]
图1是[η
6-芳烃)ru(ii)tsdpen(cl)]催化剂的现有技术实施例;
[0152]
图2是包含三齿配体的无活性[η
6-芳烃)ru(ii)tsdpen(cl)]催化剂的现有技术实施例;
[0153]
图3a是示出本发明实施例各种配体的表格;
[0154]
图3b是示出本发明实施例各种催化剂的表格。
[0155]
现在参考图1,图1示出了现有技术的不对称催化剂1。催化剂1是rucl(对-伞花烃)[(r,r)-ts-dpen],其包含具有伯胺的tsdpen配体。
[0156]
现在参考图2,图中示出了包含三齿配体2的无活性[η
6-芳烃)ru(ii)tsdpen(cl)]催化剂。图中示出了包含配体2c的催化剂2a,配体2c包含三唑部分。图中还示出了包含配体2d的催化剂2b,配体2d包含吡啶部分。催化剂2a和2b均以其无活性形式示出,其中供电子三唑部分(催化剂2a)或吡啶部分(催化剂2b)与钌中心形成抑制催化剂活性的六元环。已经表明,催化剂2a和催化剂2b仅在与ru3(co)
12
一起使用时才具有活性。
[0157]
现在参考图3a和图3b,图中示出了本发明实施例的配体1至6(图3a)和催化剂1至5(图3b)。令人惊讶地发现,配体1至5可用于形成催化剂1至5,它们是用于不对称转移氢化反应的有效催化剂,具有高产率和高对映选择性(》90%ee)。与此相反,图2所示的现有技术催化剂没有活性。
具体实施方式
[0158]
本发明现在将通过以下非限制性实施例进行说明。
[0159]
实施例1:配体1的合成
[0160]
(1r,2r)-n-{1,2-二苯基-2-[(呋喃-2-基甲基)氨基]乙基}-4-甲基苯磺酰胺
151.4
–
152.1℃[α]
d22-31.0(c 0.05,chcl3中),
v max 3336,3299,3031,2930,2841,1598,1492,1440,1424,1347,1328,1304cm-1
;δh(500mhz,cdcl3)7.42(2h,d,j 8.1,ts-arh),7.25(1h,d,j 5.0,arh),7.21
–
7.16(3h,m,arh)7.10
–
7.01(5h,m,arh),6.99
–
6.95(2h,m,arh),6.95
–
6.90(3h,m,arh),6.75(1h,d,j 2.5,arh),6.11(1h,d j 2.5,nhso2),4.33(1h,dd,j 7.9,2.6,chnhso2),3.85(1h,d,j
ab 14.0,chahbnh),3.75(1h,d,j 7.9,chnhch2),3.64(1h,d,j 14.0,chahbnh),2.35(3h,s,ts-ch3);δc(125mhz,cdcl3)143.18,142.76,138.54,138.14,136.99,129.13,128.46,127.95,127.71,127.59,127.53,127.33,127.14,126.63,124.97,124.71,66.37,62.97,45.57,21.45;ms(esi
+
):m/z,463.3[m+h]
+
;hrms计算c
26h27
n2o2s2[m+h]
+
计算值463.1508,实测值463.1511(0.5ppm误差)。
[0167]
实施例3:配体3的合成
[0168]
n-((r,r)-1,2-二苯基-2-(((3-苯基异恶唑-5-基)甲基)氨基)乙基)-4-甲基苯磺酰胺
[0169][0170]
将炔丙基/tsdpen(405mg,1.00mmol)加入到具有分子筛的n-羟基亚胺苄基氯(156mg,1.00mmol)的dmf(2ml)溶液中。搅拌96小时后,滤出分子筛并加入水(15ml)。将混合物用etoac(3x15 ml)萃取,汇合的有机萃取物采用水(3x15 ml)洗涤。然后有机层采用mgso4干燥,过滤并减压脱除溶剂,得到粗产物。通过柱色谱法(0-30%etoac的石油醚溶液)纯化,得到呈灰白色固体状的纯产物(416mg,0.794mmol,79%);[α]
d20-43.3(c 0.05,chcl3中);
v max 3244,3030,2920,1727,1599,1579,1494,1453,1442,1407,1323cm-1
;δh(500mhz,cdcl3)7.76(2h,m,arh),7.49
–
7.44(3h,m,arh),7.37(2h,d,j 8.2,ts-arh),7.19
–
7.15(3h,m,arh),7.11
–
7.02(5h,m,arh),7.00(2h,d,j 8.2,ts-arh)6.94(2h,d,j 7.2,arh),6.24(1h,s,异恶唑-h),5.82(1h,d,j 5.3,nhso2),4.40(1h,t,j 6.3,chnhso2),3.87
–
3.77(2h,m,chahbnh+chnhch2),3.65(1h,d,j
ab
=15.5hz,chahbnh),2.31(3h,s,ts-ch3);δc(126mhz,cdcl3)171.38,162.31,142.91,138.01,136.84,130.02,129.19,128.98,128.92,128.56,128.17,127.92,127.64,127.53,127.27,127.03,126.82,99.93,66.83,63.11,42.38,21.42;ms(esi
+
):m/z 524.3[m+h]
+
;hrms计算c
31h30
n3o3s[m+h]
+
计算值524.2002,实测值524.2003(0.1ppm误差)。
[0171]
实施例4:配体4的合成
[0172]
((r,r)-2-((4-甲基苯基)亚磺酰氨基)-1,2-二苯乙基)甘氨酸叔丁酯
[0173][0174]
将溴乙酸-叔丁酯(205mg,1.05mmol,155μl)滴加到tsdpen(366mg,1.00mmol)和k2co3(207mg,1.5mmol)的mecn(4ml)搅拌混合物中。搅拌1个晚上后,减压脱除溶剂,并将残余物溶解在etoac(15ml)和水(15ml)中。分离有机层,水层采用etoac(2x 15ml)萃取。将有机萃取物汇合,采用mgso4干燥,过滤并减压脱除溶剂,得到粗产物。通过柱色谱法(0
–
30%etoac的石油醚溶液)纯化,得到呈白色固体状的纯产物(340mg,0.708mmol,71%);v
max 3250,3030,2979,2929,1721,1599,1494,1454,1368,1346,1324cm-1
;δh(500mhz,cdcl3)7.40(2h,d,j 8.1,ts-arh),7.16
–
7.09(3h,m,arh),7.08
–
7.01(5h,m,arh),6.98-6.94(2h,m,arh),6.92(2h,d,j 6.9,arh),6.21(1h,m,nhso2),4.32(1h,dd,j 7.5,3.5,chnhso2),3.72(1h,d,j 7.5,chnhch2),3.14(1h,d,j 17.2,chahbnh),3.03(1h,d,j 17.2,chahbnh),2.34(3h,s,ts-ch3),2.06(1h,br.s,nh),1.41(9h,s,3x ch3);δc(126mhz,cdcl3)δppm 171.14,142.67,138.47,138.28,137.17,129.12,128.31,127.97,127.78,127.68,127.44,127.29,127.08,81.46,67.26,63.13,49.04,28.05,21.44;ms(esi
+
):m/z 481.3[m+h]
+
;hrms计算c
27h33
n2o4s[m+h]
+
计算值481.2156,实测值481.2155(0.1ppm误差)。
[0175]
实施例5:配体5的合成
[0176]
(r,r)-2-((5-溴呋喃-2-基)甲基)氨基-1,2-二苯乙基-4-甲基苯磺酰胺
[0177][0178]
向(r,r)tsdpen(500mg,1.36mmol)具有分子筛的无水二氯甲烷(20ml)溶液中滴加5-溴-2-糠醛(238mg,1.36mmol)的无水二氯甲烷(10ml)溶液。搅拌1个晚上后滤出分子筛,减压脱除溶剂。将残余物溶解在meoh(15ml)中,并分批加入nabh4(103mg,2.72mmol)。将反应在室温下搅拌,直至亚胺完全反应。反应结束后,减压脱除溶剂,并将残余物在etoac(10ml)和水(10ml)之间分配。收集有机部分,并再次用etoac(2x10ml)萃取。将有机萃取物汇合,采用mgso4干燥,过滤并减压浓缩,得到粗产物。在二氯甲烷中通过柱色谱纯化,得到呈橙色固体状的纯产物(368mg,0.701mmol,52%),[α]
d22-41.7(c 0.1,chcl3中),v
max 3062,3031,1597,1494,1454,1326,1205,1185,1155,1122cm-1
;1h nmr(500mhz,cdcl3)δ7.37(2h,d,j 8.1,ts-arh),7.18-7.13(3h,m,arh),7.11-7.04(3h,m,arh),7.02(2h,d,j 8.1,ts-arh),6.99-6.92(4h,m,arh),6.16(1h,d,j 3.1,呋喃-2
’‑
h),5.95(1h,d,j 3.1,呋喃-3
’‑
h),5.93(1h,d,j 4.4,nhso2),4.33(1h,dd,j 7.2,4.4,chnhso2),3.71(1h,d,j 7.2,chnhch2),3.59(1h,d,j 14.8,chahbnh)3.41(1h,d,j 14.8,chahbnh)2.34(3h,s,ts-ch3),
1.78(1h,br.s,nhch2);
13
c nmr(126mhz,cdcl3)δ155.07,142.76,138.41,138.17,136.95,129.14,128.44,128.06,127.68,127.54,127.42,127.30,127.06,120.77,111.68,109.94,66.48,62.95,43.57,21.44;ms(esi
+
):m/z 525.2[m+h]
+
;hrms计算c
26h26
brn2o3s[m+h]
+
计算值525.0842,实测值525.0847(1.0ppm误差)。
[0179]
实施例6:配体6的合成
[0180]
(1r,2r)-n-{1,2-二苯基-2-[(噻唑-4-基甲基)氨基]乙基}-4-甲基苯磺酰胺
[0181][0182]
向(r,r)tsdpen(366mg,1.00mmol)具有分子筛的无水二氯甲烷(15ml)溶液中滴加噻唑-4-甲醛(113mg,1.00mmol)的无水二氯甲烷(5ml)溶液。搅拌1个晚上后滤出分子筛,减压脱除溶剂。将残余物溶解在无水thf(8ml)中并冷却至0℃,然后滴加lialh
4(
2m thf溶液,0.5ml,1.00mmol)。室温搅拌5小时后,将反应混合物冷却至0℃,并通过缓慢加入etoac淬灭。加入饱和罗谢尔盐溶液(12ml)并在室温搅拌30分钟。采用etoac(3
×
10ml)萃取后,将有机萃取物汇合,采用mgso4干燥,过滤并减压浓缩,得到粗产物。通过柱色谱法(3%meoh的二氯甲烷溶液)纯化,得到呈黄色固体状的纯产物(120mg,0.259mmol,26%),mp 67.8
–
72.4℃,[α]
d22-29.3(c 0.05,chcl3中),
v max 3243,3062,3029,2919,1598,1493,1453,1409,1322,1184,1153,1090,1027;δh(500mhz,cdcl3)8.75(1h,s,2
’‑
噻唑-h),7.40(2h,d,j 8.2,arh),7.18
–
7.13(3h,m,arh),7.11-6.98(9h,m,arh),6.95(2h,d,j 7.0,arh),),6.28(1h,br.s,ch2nh),4.38(1h,d,j 7.5phchnh),3.82(1h,d,j
ab
14.2,chahbnh),3.78(1h,d,j 7.5,phchnhso2),3.68(1h,d,j
ab 14.2,chahbnh),2.35(3h,s,ts-ch3);δc(125mhz,cdcl3)155.80,153.01,142.71,138.73,138.31,137.06,129.12,128.39,127.97,127.63,127.45,127.32,127.08,114.46,67.12,63.08,46.80,21.44;ms(esi
+
):m/z,464.2[m+h]
+
;hrms计算c
25h26
n3o2s2[m+h]
+
计算值464.1461,实测值464.1463(0.4ppm误差)。
[0183]
实施例7:使用实施例1的配体合成有机金属催化剂1
[0184][0185]
向装有二氯苯基钌二聚体(56mg,0.112mmol)和配体1(100mg,0.224mmol)的无水2-丙醇(6ml)溶液的希丁克管(schlenk tube)中加入三乙胺(89mg,0.880mmol,123μl)。在80℃搅拌1小时后,使溶液冷却至室温,并减压脱除溶剂。将残余物溶解在chcl3(10ml)中,
并用水(10ml)洗涤。有机层采用mgso4干燥,过滤并减压脱除溶剂,得到粗混合物。通过柱色谱法(15%etoac的二氯甲烷溶液,然后采用1-3%meoh的二氯甲烷溶液)纯化,得到呈棕色固体状的催化剂1(75mg,0.114mmol,51%);mp 191.2
–
194.5℃,[α]
d22
+100.0(c 0.05,chcl3),
v max 3295,3197,3061,3028,2922,2871,1599,1493,1453,1435,1367,1329,1268,1193,1148cm-1
;主要非对映异构体:δh(500mhz,cdcl3)7.41(1h,s,arh),7.33
–
7.27(2h,m,arh),7.12
–
7.02(3h,m,arh)6.92
–
6.82(3h,m,arh),6.77
–
6.72(4h,m,arh),6.6(2h,d,j 7.3arh),6.37(2h,s,arh),5.70(6h,s,苯),4.45(1h,br,nh),4.32
–
4.24(1h,m,chahbnh),4.13(1h,d j 13.7,chahbnh),4.05(1h,m,phchnso2),3.84(1h,t,j 11.6,phchnh),2.25(3h,s,ts-ch3);δc(125mhz,cdcl3)149.38,141.92,141.68,139.49,139.41,136.55,129.86,128.93,128.65,128.02,127.56,126.93,126.71,126.48,111.32,109.39,84.01,80.49,69.66,51.52,21.26;次要非对映异构体:δh(500mhz,cdcl3)7.49(1h,s,arh),7.36(1h,m,arh),7.33
–
7.27(2h,m,arh)7.12
–
7.02(3h,m,arh)6.82
–
6.80(3h,m,arh),6.72
–
6.69(4h,m,arh),6.58
–
6.53(1h,m,arh),6.41(1h,s,arh),6.17(1h,s,arh),5.64(6h,s,苯),5.44(1h,m,nh),4.71(1h,m,chahbnh),4.39(1h,m,phchnso2),4.05(1h,m,phchnh),3.72(1h,d j 14.6,chahbnh),2.23(3h,s,ts-ch3));δc(125mhz,cdcl3)150.46,143.08,142.21,139.39,138.44,136.85,128.60,128.35,128.10,127.53,126.71,126.48,126.41,125.96,111.74,109.16,83.72,74.44,71.86,50.02,21.24;ms(esi
+
):m/z,625.2[m
–
cl]
+
;hrms计算c
32h31
n2o3sru[m
–
cl]
+
计算值625.1093,实测值625.1095(1.0ppm误差)。
[0186]
实施例8:使用实施例2的配体合成有机金属催化剂2
[0187][0188]
向装有二氯苯基钌二聚体(56mg,0.112mmol)和配体2(100mg,0.216mmol)的无水2-丙醇(6ml)溶液的希丁克管(schlenk tube)中加入三乙胺(89mg,0.880mmol,123μl)。在80℃搅拌1小时后,使溶液冷却至室温,并减压脱除溶剂。将残余物溶解在chcl3(10ml)中,并用水(10ml)洗涤。有机层采用mgso4干燥,过滤并减压脱除溶剂,得到粗混合物。通过柱色谱法(20%etoac的二氯甲烷溶液,然后采用1-4%meoh的二氯甲烷溶液)纯化,得到呈棕色固体状的催化剂2(38mg,0.056mmol,26%);[α]
d22
+72.2(c 0.003,chcl3中),
v max 3293,3062,3027,2923,2868,1599,1493,1453,1433,1379,1328,1270,1197cm-1
;δh(500mhz,cdcl3),主要非对映异构体:7.27(1h,s,arh),7.22(1h,m,arh),7.14(1h,arh),7.10
–
7.04(2h,m,arh),7.03
–
6.99(2h,m,arh),6.95
–
6.89(1h,m,arh),6.87-6.79(3h,m,arh),6.76(2h,d,j 7.32,arh),6.73-6.69(2h,m,arh),6.60(2h,d,j 7.5,arh),5.66(6h,s,苯),4.54
–
4.40(2h,m,chahbnh+chahbnh),4.31(1h,d,j 13.7,chahbnh),4.10(1h,d,j 10.8,phchnso2),3.91-3.80(1h,m,phchnh),2.25(3h,s,ts-ch3);δc(125mhz,cdcl3)141.94,139.43,139.17,137.93,136.70,129.89,129.05,128.67,128.40,128.01,127.57,127.46,
127.05,126.89,126.39,125.09,84.08,81.00,69.59,54.47,21.25;ms(esi
+
):m/z,641.2[m
–
cl]
+
;hrms计算c
32h31
n2o2s2ru[m
–
cl]
+
计算值641.0865,实测值641.0868(0.7ppm误差)。
[0189]
实施例9:使用实施例3的配体合成有机金属催化剂3
[0190][0191]
向装有二氯苯基钌二聚体(58mg,0.116mmol)和配体3(120mg,0.229mmol)的phcl(1.8ml)溶液的希丁克管(schlenk tube)中加入三乙胺(93mg,0.92mmol,128μl)。在80℃搅拌1小时后,使溶液冷却至室温,并减压脱除溶剂。将残余物溶解在chcl3(15ml)中,并用水(15ml)洗涤。有机层采用mgso4干燥,过滤并减压脱除溶剂,得到粗混合物。通过柱色谱法(15%etoac的二氯甲烷溶液,然后采用0-3%meoh的二氯甲烷溶液)纯化,得到呈深棕色固体状的催化剂3(77mg,0.104mmol,46%);[α]
d22
+50.0(c 0.002,chcl3),
v max 3056,3029,1598,1558,1493,1437,1405,1374,1269,1156,1127cm-1
;主要非对映异构体:1h nmr(500mhz,cdcl3)δ7.84
–
7.77(2h,m arh),7.51-7.43(4h,m,arh),7.33
–
7.27(2h,m,arh),7.11
–
7.06(3h,m,arh),6.95
–
6.91(1h,m,异恶唑-h),6.86(2h,d,j 7.8,arh),6.83
–
6.78(2h,m,arh),6.74(2h,t,j 7.3,arh),6.72
–
6.67(1h,m,arh),6.64(1h,d,j 7.3,arh),5.74(6h,s,苯),4.58-4.41(2h,m,chahbnh+chnso2),4.12(1h,d,j 10.68,chahbnh),4.05
–
3.90(1h,m,chnhch2),2.26(3h,s,ts-ch3);
13
c nmr(126mhz,cdcl3)δ167.24,163.04,141.65,139.65,139.19,135.97,130.53,129.79,129.12,128.94,128.82,128.14,128.09,127.48,127.08,126.99,126.82,126.57,102.60,84.19,80.83,69.36,50.80,21.27。ms(esi
+
):m/z 702.3[m
–
cl]
+
;hrms计算c
37h33
n3nao3rus[m
–
hcl+na]
+
计算值724.1178,实测值724.1188(0.0ppm误差)。
[0192]
实施例10:使用实施例4的配体合成有机金属催化剂4
[0193][0194]
向装有二氯苯基钌二聚体(52mg,0.104mmol)和配体4(100mg,0.208mmol)的phcl(1.5ml)溶液的希丁克管(schlenk tube)中加入三乙胺(84mg,0.832mmol,116μl)。在80℃搅拌1小时后,使溶液冷却至室温,并减压脱除溶剂。将残余物溶解在chcl3(10ml)中,并用水(15ml)洗涤。有机层采用mgso4干燥,过滤并减压脱除溶剂,得到粗混合物。通过柱色谱法(10%etoac的二氯甲烷溶液,然后采用0-3%meoh的二氯甲烷溶液)纯化,得到呈深棕色固
体状的催化剂4(87mg,0.125mmol,60%);[α]
d22
+631.3(c 0.002,chcl3中);v
max 3060,3029,2978,2931,1731,1636,1600,1494,1454,1436,1393cm-1
;主要非对映异构体:1h nmr(500mhz,cdcl3)δppm 7.32(2h,d,j 8.1,ts-arh),7.16
–
7.05(4h,m,arh),6.82(2h,d,j 7.9,arh),6.79-6.75(1h,m,arh),6.74-6.68(3h,m,arh),6.64-6.54(2h,m,arh),6.06
–
5.94(1h,dd,j 11.4,6.6,nh),5.83(6h,s,苯),4.41(1h,dd,j 18.4,6.6,chahbnh),4.32(1h,d,j 10.8,chnso2),4.13(1h,t,j 11.6,chnhch2),3.27(1h,d,j 18.4,chahbnh),2.23(3h,s,ts-ch3),1.44(9h,s,3x ch3)。
13
c nmr(126mhz,cdcl3)δppm 170.65,143.13,139.40,138.66,135.46,129.82,128.55,128.47,128.44,128.08,126.51,126.49,125.92,84.08,84.03,73.79,71.53,56.57,27.85,21.23;ms(esi
+
):m/z 659.3[m
–
cl]
+
;hrms计算c
33h37
n2o4rus[m
–
cl]
+
计算值659.1512,实测值659.1526(0.8ppm误差)。
[0195]
实施例11:使用实施例5的配体合成有机金属催化剂5
[0196][0197]
向装有二氯苯基钌二聚体(40mg,0.081mmol)和配体5(85mg,0.162mmol)的phcl(1.2ml)溶液的希丁克管(schlenk tube)中加入三乙胺(66mg,0.65mmol,90μl)。在85℃搅拌1小时后,使溶液冷却至室温,并减压脱除溶剂。将残余物溶解在chcl3(10ml)中,并用水(12ml)洗涤。有机层采用mgso4干燥,过滤并减压脱除溶剂,得到粗混合物。通过柱色谱法(15%etoac的二氯甲烷溶液,然后采用0-3%meoh的二氯甲烷溶液)纯化,得到呈棕色固体状的催化剂5(85mg,0.115mmol,71%);[α]
d22
+100.0(c 0.05在chcl3中),
v max 3062,3027,2919,2871,1599,1494,1454,1436,1398,1374cm-1
;主要非对映异构体:1h nmr(500mhz,cdcl3)δppm 7.34
–
7.28(2h,m,arh),7.13
–
7.03(4h,m,arh),6.90
–
6.79(3h,m,arh),6.78
–
6.66(3h,m,arh),6.60(2h,d,j 7.9ts-arh),6.36(1h,m,3’呋喃-h),6.25(1h,d,j 3.20,2’呋喃-h),5.78(6h,s,苯-h),4.38
–
4.33(1h,m,chahbnh),4.16
–
4.11(1h,m,chahbnh),4.04(1h,d,j 10.8,chnhch2),3.86
–
3.81(1h,m,chnso2),2.25(3h,s,ts-arh);
13
c nmr(126mhz,cdcl3)δppm151.24,141.57,139.57,139.36,136.30,129.79,128.83,128.63,128.43,128.04,127.55,126.98,126.49,121.33,112.82,112.44,84.17,80.56,69.67,51.60,21.25;ms(esi
+
):m/z 703.1[m+h]
+
;hrms计算c
32h30
brn2o3rus[m
–
cl]
+
计算值703.0199,实测值703.0202(0.1ppm误差)。
[0198]
实施例12:配体7的合成
[0199]
n-((1r,2r)-1,2-二苯基-2-(((四氢呋喃-2-基)甲基)氨基)乙基)-4-甲基苯磺酰胺
[0200][0201]
dr 1:1
[0202]
向r,r-tsdpen(366mg,1.0mmol)和分子筛在dcm(8ml)内的混合物中滴加四氢呋喃-2-甲醛(100mg,1.0mmol)的dcm(5ml)溶液。搅拌1个晚上后滤出分子筛,并减压脱除溶剂。将残余物溶解在meoh(10ml)中并加入乙酸(6滴),然后缓慢加入nabh3cn(76mg,1.2mmol)。搅拌1个晚上后,减压脱除溶剂,并将残余物在etoac(15ml)和h2o(15ml)中分配。收集有机层,并用etoac(2x 15ml)进一步萃取。将有机萃取物汇合,采用mgso4干燥,过滤并减压脱除溶剂。通过柱色谱法(0
–
20%etoac的石油醚溶液)纯化,得到呈白色固体状的配体7(265mg,0.59mmol,59%);[α]
d-12.0(c 0.2,chcl3中);1h nmr(500mhz,cdcl3)δ7.41
–
7.35(4h,m,arh),7.14
–
7.10(6h,m,arh),7.07
–
6.99(12h,m,arh),6.97
–
6.92(5h,m,arh),6.91
–
6.87(4h,m,arh),4.29(1h,d,j 7.6),4.20(1h,d,j 8.3),4.01
–
3.93(1h,m),3.90
–
3.84(1h,m),3.80
–
3.74(1h,m),3.73
–
3.67(4h,m),3.62(1h,d,j 8.3),2.53(1h,d,j 12.1),2.39(2h,d,j 5.8),2.34(3h,s,ts-ch3),2.33(3h,s,ts-ch3),1.95
–
1.88(2h,m),1.87
–
1.76(6h,m),1.59
–
1.50(1h,m),1.48
–
1.39(1h,m);
13
c nmr(126mhz,cdcl3)δ142.66,142.65,139.21,139.11,138.43,138.18,137.17,137.07,129.09,129.08,128.31,128.27,127.92,127.81,127.72,127.55,127.50,127.45,127.25,127.24,127.19,127.09,78.46,78.12,68.11,68.06,68.01,67.79,63.25,63.07,51.54,51.02,29.04,29.02,25.88,25.72,21.44;ms(esi
+
)m/z 451.3[m+h]
+
;hrms计算c
26h31
n2o3s[m+h]
+
计算值451.2050,实测值451.2053(0.7ppm误差)。
[0203]
实施例13:配体8的合成
[0204]
n-((1r,2r)-2-((呋喃-2-基甲基)氨基)-1,2-二苯乙基)-三氟甲磺酰胺
[0205][0206]
向r,r-tsdpen(424mg,2.0mmol)和分子筛在dcm(20ml)内的混合物中滴加2-糠醛(192mg,2.0mmol)的dcm(10ml)溶液。搅拌1个晚上后滤出分子筛,并减压脱除溶剂。将残余物溶解在meoh(15ml)中并加入乙酸(6滴),然后缓慢加入nabh3cn(190mg,3mmol)。搅拌1个晚上后,减压脱除溶剂,并将残余物在etoac(15ml)和h2o(15ml)中分配。收集有机层,并用etoac(2x 15ml)进一步萃取。将有机萃取物汇合,采用mgso4干燥,过滤并减压脱除溶剂。通过柱色谱法(0
–
100%etoac的石油醚溶液)纯化,得到呈橙色油状的前体(1r,2r)-n1-(呋喃-2-基甲基)-1,2-二苯乙烷-1,2-二胺(290mg,1.0mmol,50%);ν
max 3060,3027,2828,1681,1600,1493,1452,1346cm-1
;1h nmr(500mhz,cdcl3)δ7.33
–
7.29(1h,m,arh),7.25
–
7.19(4h,m,arh),7.18
–
7.13(5h,m,arh),7.13
–
7.08(2h,d,j 7.1hz,arh),6.31
–
6.23(1h,m,arh),6.00(1h,d,j 2.8hz,arh),3.99(1h,d,j 7.2hz,chph),3.74(1h,d,j 7.2hz,chph),3.67(1h,d,j 14.7hz,chahb),3.51
–
3.42(1h,m,chahb),1.85(2h,b.s,nh2);
13
c nmr(126mhz,cdcl3)δ154.16,143.58,141.81,140.89,128.43,128.25,128.23,128.12,127.26,127.07,110.11,106.85,68.56,61.89,44.06;ms(esi
+
)m/z 293.2[m+h]
+
[0207]
向(1r,2r)-n1-(呋喃-2-基甲基)-1,2-二苯乙烷-1,2-二胺(50mg,0.17mmol)的dcm(3ml)溶液中加入三乙胺(100μl,0.17mmol)。将混合物冷却至0℃,并滴加tf2o(1mdcm溶液,0.17ml,0.17mmol)。搅拌1个晚上后,混合物用dcm(10ml)稀释,并用饱和nahco3溶液(10ml)淬灭。采用dcm(2x 10ml)萃取后,将有机萃取物汇合,采用mgso4干燥,过滤并减压脱除溶剂。通过柱色谱法(10-30%etoac)纯化,得到呈橙色半固体状的配体8(43mg,0.10mmol,59%);[α]
d-17.3(c 0.1,chcl3中);ν
max
3064,3034,2970,1603,1496,1456,1380cm-1
;1h nmr(500mhz,cdcl3)δ7.39
–
7.30(5h,m,arh),7.30
–
7.26(2h,m,arh),7.26
–
7.17(4h,m,arh),6.29
–
6.23(1h,m,呋喃-h),5.96(1h,d,j 3.0,呋喃-h),4.70(1h,d,j 5.1,phchntf),3.94(1h,d,j 5.1,nchph),3.68(d,j 14.8,chahb),3.47(1h,d,j 14.8,chahb);
13
c nmr(126mhz,cdcl3)δ152.56,142.26,138.28,138.09,128.95,128.85,128.42,128.32,127.64,126.54,119.31(q,j 321,cf3),110.23,107.53,66.21,64.02,43.55。
19
f nmr(282mhz,cdcl3)δ-77.45;ms(esi
+
)m/z 425.2[m+h]
+
;hrms计算c
20h20
f3n2o3s[m+h]
+
计算值425.1141,实测值425.1143(0.4ppm误差)。
[0208]
实施例14:配体9的合成
[0209][0210]
向聚合物键合型磺酰氯(85mg,1.5-2.0mmol/g)和三乙胺(0.1ml,0.17mmol)的dcm(3ml)悬浮液中加入(1r,2r)-n1-(呋喃-2-基甲基)-1,2-二苯乙烷-1,2-二胺(配体8的前体)(50mg,0.17mmol)。轻柔地搅拌过夜后,滤出产物并用dcm(3x3 ml)和水(3x3 ml)洗涤。干燥沉淀物得到呈灰白色固体状的配体9a(103mg)。
[0211]
也可以使用二氧化硅载体制备负载型催化剂,在这种情况下,程序将是:向3-氯丙基二氧化硅(100mg,1.3-2.1mmol/g)的甲醇(10ml)悬浮液中加入(1r,2r)-n1-(呋喃-2-基甲基)-1,2-二苯乙烷-1,2-二胺(配体8的前体)(50mg,0.17mmol)。轻柔地搅拌过夜后,滤出产物并用甲醇(5x10 ml)和水(5x10 ml)洗涤。干燥固体,得到呈灰白色颗粒状的配体9b。注:这种结构不包含磺酰基。
[0212]
实施例15:配体10的合成
[0213]
n-苄基-4-(5-((((1r,2r)-2-((4-甲基苯基)亚磺酰氨基)-1,2-二苯乙基)氨基)甲基)呋喃-2-基)苯甲酰胺
[0214][0215]
向(r,r)-tsdpen(50mg,0.14mmol)和4-(5-甲酰基呋喃-2-基)苯甲酸(30mg,0.14mmol)在etoh(5ml)内的混合物中加入4滴乙酸。回流4小时后,使溶液冷却至室温,并减压脱除溶剂。向残余物中加入dcm(5ml),并将溶液过滤。将沉淀物再次采用dcm(2x5 ml)洗涤。合并滤液,减压除去溶剂,得到粗产物。通过柱色谱法(50%etoac的石油醚溶液)纯化,得到呈橙色固体状的4-(5-((4r,5r)-4,5-二苯基-1-甲苯磺酰基咪唑啉-2-基)呋喃-2-基)苯甲酸(52mg,0.092mmol,66%);1h nmr(400mhz,cdcl3)δ8.12(2h,d,j 8.4,arh),7.67(2h,d,j 8.4,arh),7.46(2h,d,j 8.2,arh),7.30
–
7.27(4h,m,arh),7.25
–
7.20(3h,m,arh),7.17
–
7.12(3h,m,arh),7.10(2h,d,j 8.2,arh),6.84(1h,d,j 3.4,呋喃-h),6.68(1h,d,j 3.4,呋喃-h),6.19(1h,s,nchn),4.88(1h,d,j 6.8,chph),4.55(1h,d,j 6.8,chph),2.33(3h,s,ts-ch3);ms(esi+):m/z 565.3[m+h]+;hrms计算c
33h29
n2o5s[m
–
cl]+计算值565.1792,实测值565.1794(0.4ppm误差)。
[0216]
向4-(5-((4r,5r)-4,5-二苯基-1-甲苯磺酰基咪唑啉-2-基)呋喃-2-基)苯甲酸(100mg,177μmol)、苄胺(21mg,195μmol)和dmap(32mg,266μmol)在dcm(5ml)中的混合物中添加edcl(44mg,230μmol)。室温搅拌72小时后,将反应混合物用水(10ml)淬灭。采用dcm(3x10 ml)萃取后,将有机组分汇合,采用mgso4干燥,过滤并减压脱除溶剂。通过柱色谱法(0
–
50%etoac的石油醚溶液)纯化,得到呈黄色固体状的n-苄基-4-(5-((4r,5r)-4,5-二苯基-1-甲苯磺酰基咪唑啉-2-基)呋喃-2-基)苯甲酰胺(83mg,127μmol,72%);ν
max 3290,3034,2921,1639,1535,1494,1453cm-1
;1h nmr(300mhz,cdcl3)δ7.88(2h,s,arh),7.84
–
7.78(2h,m,arh),7.64(2h,d,j 8.3,arh),7.45(1h,d,j 8.2,arh),7.41
–
7.36(6h,m,arh),7.35
–
7.31(2h,m,arh),7.24
–
7.18(4h,m,arh),7.15
–
7.11(2h,m,arh),7.08(2h,j 8.3,arh),6.76(1h,d,j 3.3,呋喃-h),6.65(1h,d,j 3.3,呋喃-h),6.43(2h,b.s,nh x 2),6.16(1h,s,nchnts),4.85(1h,d,j 6.7,chph),4.71
–
4.63(2h,m,nch2ph),4.54(1h,d,j 6.7,chph),2.32(3h,s,ts-ch3);ms(esi)[m-h]-652.2,[m+h]
+
654.3。
[0217]
n-苄基-4-(5-((4r,5r)-4,5-二苯基-1-甲苯磺酰基咪唑啉-2-基)呋喃-2-基)苯甲酰胺:
[0218][0219]
将n-苄基-4-(5-((4r,5r)-4,5-二苯基-1-甲苯磺酰基咪唑啉-2-基)呋喃-2-基)苯甲酰胺(jb382)(50mg,76μmol)溶于meoh(1.5ml),加入乙酸(3滴),然后缓慢加入nabh3cn(8mg,129μmol)。搅拌1个晚上后,减压脱除溶剂,并将残余物在etoac(10ml)和h2o(10ml)中
分配。收集有机层,并用etoac(2x 15ml)进一步萃取。将有机萃取物汇合,采用mgso4干燥,过滤并减压脱除溶剂。通过柱色谱法(0
–
50%etoac的石油醚溶液)纯化,得到呈橙色固体状的配体10(32mg,49μmol,64%);[α]
d-63.1(c 0.2,chcl3中);ν
max 2986,2926,2870,2030,1680,1667cm-1
;1h nmr(500mhz,cdcl3)δ7.81(2h,d,j 8.4,arh),7.61(2h,d,j 7.7,arh),7.40
–
7.34(5h,m,arh),7.32(3h,d,j 8.2,arh),7.17
–
7.13(3h,m,arh),7.06
–
6.98(5h,m,arh),6.96(2h,d,j 8.2,arh),6.93(2h,d,j 7.2,arh+nhso2),6.61(1h,d,j 3.2,呋喃-h),6.49
–
6.42(1h,m,c(o)nh),6.09(1h,d,j 3.2,呋喃-h),4.67(2h,d,j 5.5,c(o)nhch2),4.35(1h,d,j 7.3,chph),3.77
–
3.70(2h,m,chph+chachb),3.51(1h,d,j 14.8,chachb),2.30(3h,s,ts-ch3),1.85(1h,bs,nh);
13
c nmr(126mhz,cdcl3)δ166.99,153.74,152.42,142.85,138.60,138.32,137.07,133.68,132.64,129.23,128.96,128.59,128.19,128.15,127.82,127.73,127.61,127.52,127.40,127.15,123.65,109.81,107.45,66.54,63.11,44.33,43.74,21.54.;ms(esi
+
)m/z 656.4[m+h]
+
;hrms计算c
40h38
n3o4s[m+h]
+
计算值656.2578,实测值656.2574(0.5ppm误差)。
[0220]
该配体可以进一步反应以通过酰胺部分结合载体,例如聚合物颗粒或二氧化硅颗粒。
[0221]
实施例16:使用实施例12的配体7合成有机金属催化剂6
[0222][0223]
向装有二氯苯基钌二聚体(56mg,0.11mmol)和实施例12的配体7(100mg,0.22mmol)的phcl(1ml)溶液的希丁克管(schlenk tube)中加入三乙胺(90mg,0.89mmol,120μl)。在85℃搅拌1小时后,使溶液冷却至室温,并减压脱除溶剂。将残余物溶解在chcl3(10ml)中,并用水(10ml)洗涤。有机层采用mgso4干燥,过滤并减压脱除溶剂,得到粗混合物。通过柱色谱法(15%etoac的二氯甲烷溶液,然后采用0-3%meoh的二氯甲烷溶液)纯化,得到呈棕色固体状的催化剂6(19mg,0.029mmol,13%);ms(esi+):m/z 629.3[m
–
cl]+;hrms计算c
32h35
n2o3rus[m
–
cl]+计算值629.1406,实测值629.1417(0.4ppm误差)。
[0224]
实施例17:使用实施例1的配体1合成有机金属催化剂7
[0225][0226]
dr 3:2
[0227]
向rucl3xh2o(91mg,0.44mmol)的etoh(4ml)溶液中加入环己-1,4-二烯-1-基甲醇(132mg,0.96mmol)的etoh(1ml)溶液。回流16小时后,将混合物冷却至室温,并过滤沉淀物。沉淀物用冰冷的etoh(3x2 ml)洗涤,然后干燥,得到呈黑色固体状的钌二聚体(58mg,
0.19mmol,43%);ν
max 3064,3057,2967,2922,2863,1443,1397cm-1
;1h nmr(400mhz,cdcl3)δ5.77
–
5.51(5h,m,arh,4.46(2h,s,arch2),3.67(2h,m,2h),1.23(3h,t,6.5hz,ch3)。向装有钌二聚体(25mg,41μmol)和配体1(36mg,81μmol)的phcl(1ml)溶液的希丁克管(schlenk tube)中加入三乙胺(32mg,81μmol,45μl)。在80℃搅拌1小时后,使溶液冷却至室温,并减压脱除溶剂。将残余物溶解在chcl3(10ml)中,并用水(10ml)洗涤。有机层采用mgso4干燥,过滤并减压脱除溶剂,得到粗混合物。通过柱色谱法(10%etoac的dcm溶液,然后采用0-3%meoh的dcm溶液)纯化,得到呈棕色固体状的催化剂7(17mg,24μmol,30%);ν
max 3675,2973,2901,1494,1453,1394,1381cm-1
;1h nmr(500mhz,cdcl3)δ7.42(1h,s,arh),7.18(2h,d,j 8.0,arh),7.12-7.00(3h,m,arh),6.83(2h,d,j 7.7,arh),6.75
–
6.69(4h,m,arh),6.59
–
6.56(2h,m,arh),6.47(2h,t,j 7.7,arh),6.38
–
6.35(1h,m,arh),6.12(1h,d,j 3.0,arh),6.06(1h,t,j 5.7,芳烃-h),5.90
–
5.86(1h,m,芳烃-h),5.77
–
5.71(1h,m,芳烃-h),5.26(1h,t,j 5.7,芳烃-h),5.15
–
5.10(1h,m,芳烃-h),4.73
–
4.67(2h,m,arch2o),4.54(1h,d,j 11.5,phchnts),4.30(1h,d,j 11.5,phchnh),3.90
–
3.85(1h,m,och2),3.83
–
3.77(1h,m,och2),3.74(1h,t,j 11.5,nhch2),3.66(1h,d,j 14.5,nhch2),2.20(3h,s,ts-ch3),1.47(3h,t,j 7.0,och2ch3);
13
c nmr(126mhz,cdcl3)δ150.82,143.47,142.15,139.08,137.56,137.40,130.21,129.13,128.73,128.39,128.18,128.05,126.87,126.45,111.45,110.30,93.23,89.14,87.16,86.42,82.86,79.92,77.96,75.19,72.23,70.60,68.21,49.57,21.32,15.18;ms(esi
+
)m/z 683.3[m-cl]
+
;hrms计算c
35h37
n2o4rus[m-cl]
+
计算值683.1512,实测值683.1517(0.7ppm误差)。
[0228]
实施例18:使用实施例1的配体1合成有机金属催化剂8
[0229][0230]
dr 2:1
[0231]
向装有对伞花烃二氯化钌二聚体(55mg,0.09mmol)和配体1(80mg,0.18mmol)的phcl(1.25ml)溶液的希丁克管(schlenk tube)中加入三乙胺(73mg,0.72mmol,0.1ml)。在80℃搅拌1小时后,使溶液冷却至室温,并减压脱除溶剂。将残余物溶解在chcl3(10ml)中,并用水(10ml)洗涤。有机层采用mgso4干燥,过滤并减压脱除溶剂,得到粗混合物。通过柱色谱法(15%etoac的dcm溶液,然后采用0-3%meoh的dcm溶液)纯化,得到呈棕色固体状的催化剂8(74mg,0.103mmol,57%);ν
max
3194,3062,3029,2961,2922,2867,1599,1494,1452,1383cm-1
;1h nmr(500mhz,cdcl3)δ7.41(1h,s,arh),7.21
–
7.17(2h,m,arh),7.10
–
7.05(3h,m,arh),6.78(2h,d,j8.0,arh),6.74(1h,d,j 8.0,arh),6.67(2h,t,j 7.6,arh),6.61(1h,d,j 7.6,arh),6.53(2h,d,j 7.2,arh),6.48(1h,t,j 7.6,arh),6.42
–
6.38(2h,m,arh),5.54(1h,b.s,对伞花烃arh),5.41(2h,t,j 5.7,对伞花烃arh),5.18(1h,b.s,对伞花烃arh),4.56(1h,t,j 10.2,nh),4.20(1h,dd,j 14.8,10.2,chahbn),4.08(1h,d,j 11.5,phchnts),4.03(1h,d,j 14.8,chahbn),3.63(1h,t,j 11.5,phchnh),3.28
–
3.17(1h,m,对伞花烃ch(ch3)2,2.32(3h,s,对伞花烃arch3),2.22(3h,s,ts-ch3),1.40(3h,d,j 7.0,对伞花
烃ch(ch3)2),1.33(3h,d,j 7.0,对伞花烃ch(ch3)2);
13
c nmr(126mhz,cdcl3)δ149.72,142.41,141.77,139.23,138.96,136.89,129.23,128.72,128.34,127.96,127.48,127.03,126.53,126.37,111.46,109.02,81.50,79.73,78.89,75.25,72.21,70.23,60.53,53.57,51.44,30.62,22.59,22.38,21.33,19.19;ms(esi
+
):m/z 681.3[m-cl]
+
;hrms计算c
36h39
n2o3rus[m-cl]
+
计算值681.1719,实测值681.1728(0.1ppm误差)。
[0232]
实施例19:配体11的合成
[0233]
(s)-2-((((1r,2r)-2-((4-甲基苯基)亚磺酰氨基)-1,2-二苯乙基)氨基)甲基)吡咯烷-1-羧酸叔-丁酯
[0234][0235]
向r,r-tsdpen(366mg,1.0mmol)和分子筛在dcm(10ml)内的混合物中滴加(s)-boc-脯氨醛(199mg,1.0mmol)的dcm(5ml)溶液。搅拌1个晚上后滤出分子筛,并减压脱除溶剂。将残余物溶解在meoh(10ml)中并加入乙酸(6滴),然后缓慢加入nabh3cn(76mg,1.2mmol)。搅拌1个晚上后,减压脱除溶剂,并将残余物在etoac(15ml)和h2o(15ml)中分配。收集有机层,并用etoac(2x 15ml)进一步萃取。将有机萃取物汇合,采用mgso4干燥,过滤并减压脱除溶剂。通过柱色谱法(0-30%etoac的石油醚溶液)纯化,得到形成旋转异构体的呈白色固体状的配体11(471mg,0.86mmol,86%);[α]
d-41.2(c 0.3在chcl3中);ν
max 3262,3064,3030,2973,2929,2874,1687,1600,1494,1477cm-1
:1h nmr(500mhz,cdcl3)δ7.36(2h,d,j 7.6,arh),7.12(3h,b.s.,arh),7.02(5h,b.s.,arh),6.91(4h,b.s,arh),4.35
–
4.16(1h,m,phchnts),3.93
–
3.63(1h,m,phchnh),3.64
–
3.33(1h,m,吡咯烷-ch),3.32
–
3.12(1h,m,吡咯烷-nch2),2.61
–
2.36(2h,m,ch2n),2.33(3h,s,ts-ch3),2.00
–
1.86(1h,m,吡咯烷-nch2),1.85
–
1.63(3h,m,吡咯烷-ch2),1.63
–
1.49(1h,m,吡咯烷-ch2),1.43(5h,b.s,boc-ch3),1.26(4h,s,boc-ch3);
13
c nmr(126mhz,cdcl3)δ155.02,142.99,139.43,138.30,137.47,129.26,129.18,128.51,128.41,128.02,127.71,127.56,127.23,79.38,68.00,63.24,57.36,50.06,46.95,29.30,28.62,23.96,21.56;ms(esi
+
)m/z 550.4[m+h]
+
;hrms计算c
31h40
n3o4s[m+h]
+
计算值550.2734,实测值550.2732(0.3ppm误差)。
[0236]
实施例20:配体12的合成
[0237]
(s)-2-((((1s,2s)2-((4-甲基苯基)亚磺酰氨基)-1,2-二苯乙基)氨基)甲基)吡咯烷-1-羧酸叔-丁酯
[0238][0239]
向s,s-tsdpen(183mg,0.5mmol)和分子筛在dcm(5ml)内的混合物中滴加(s)-boc-脯氨醛(100mg,0.5mmol)的dcm(2.5ml)溶液。搅拌1个晚上后滤出分子筛,并减压脱除
溶剂。将残余物溶解在meoh(5ml)中并加入乙酸(6滴),然后缓慢加入nabh3cn(38mg,0.6mmol)。搅拌1个晚上后,减压脱除溶剂,并将残余物在etoac(10ml)和h2o(10ml)中分配。收集有机层,并用etoac(2x 10ml)进一步萃取。将有机萃取物汇合,采用mgso4干燥,过滤并减压脱除溶剂。通过柱色谱法(0-30%etoac的石油醚溶液)纯化,得到形成旋转异构体的呈白色固体状的配体12(173mg,0.32mmol,63%);1h nmr(500mhz,cdcl3)δ7.42
–
7.29(2h,m,arh),7.16
–
7.06(3h,m,arh),7.05
–
6.98(4h,m,arh),6.98
–
6.93(2h,m,arh),6.93
–
6.86(3h,m,arh),6.86
–
6.79(1h,m,arh),4.36
–
4.15(1h,m,chph),4.05
–
3.73(1h,m,chph),3.72
–
3.51(1h,m,吡咯烷-ch),3.41
–
3.33(1h,m,吡咯烷-nchahb),3.26
–
3.18(1h,m,吡咯烷-nchahb),2.64
–
2.46(1h,m,nhchahb),2.42
–
2.34(1h,m,nhchahb),2.31(3h,s,ts-ch3),1.97
–
1.85(1h,m,吡咯烷-ch2),1.84
–
1.70(3h,m,吡咯烷-ch2ch2),1.50(6h,s,boc-ch3),1.27(3h,s,boc-ch3);
13
c nmr(126mhz,cdcl3)δ156.08,142.50,139.45,138.59,137.57,129.18,128.51,128.21,128.04,127.83,127.64,127.46,127.21,79.70,67.03,63.71,56.34,51.63,47.20,29.89,28.74,24.11,21.54;ms(esi
+
)m/z 550.4[m+h]
+
[0240]
实施例21:催化剂9的合成
[0241][0242]
d.r.5:1
[0243]
向装有二氯苯基钌二聚体(50mg,0.1mmol)和配体11(110mg,0.2mmol)的phcl(1.5ml)溶液的希丁克管(schlenk tube)中加入三乙胺(81mg,0.8mmol,0.1ml)。在80℃搅拌1小时后,使溶液冷却至室温,并减压脱除溶剂。将残余物溶解在chcl3(10ml)中,并用水(10ml)洗涤。有机层采用mgso4干燥,过滤并减压脱除溶剂,得到粗混合物。通过柱色谱法(10%etoac的dcm溶液,然后采用0-3%meoh的dcm溶液)纯化,得到呈棕色固体状的催化剂9(136mg,0.18mmol,89%);ν
max
3482,3192,3060,3027,2971,2924,2875,1681,1600,1494,1478,1454cm-1
;1h nmr(500mhz,cdcl3)δ7.33(2h,d,j 8.1,arh),7.16
–
7.07(3h,m,arh),7.06
–
6.98(1h,m,arh),6.87
–
6.82(3h,m,arh),6.80
–
6.73(3h,m arh),6.59(2h,d,j 7.4,arh),6.10(6h,s,苯),4.50
–
4.43(1h,m,chph),4.01(1h,d,j 10.5,chph),3.84(1h,t,j 11.4,ch2chn),3.70
–
3.63(1h,m,chahbnboc),3.53(1h,t,j 12.1,nh),3.24
–
3.16(1h,m,nchahbpyr),3.06
–
2.99(1h,m,nchahbpyr),2.32(1h,t,j 11.4,chahbnboc),2.23(3h,s,ts-ch3),2.17
–
2.08(1h,m,吡咯烷-ch2),1.67
–
1.62(1h,m,吡咯烷-ch2),1.46
–
1.43(1h,m,吡咯烷-ch2),1.42(9h,s,(ch3)3,1.25
–
1.11(1h,m,吡咯烷-ch2);
13
c nmr(126mhz,cdcl3)δ154.92,141.31,140.20,139.62,137.27,128.82,128.61,128.50,128.13,128.01,127.96,127.24,126.52,84.68,81.66,79.74,69.37,55.79,55.17,46.95,29.92,28.56,23.43,21.37;ms(esi
+
):m/z 728.3[m-cl]
+
;hrms计算c
37h44
n3o4rus[m-cl]
+
计算值728.2091,实测值728.2104(0.6ppm误差)。
[0244]
实施例22:催化剂10的合成
[0245][0246]
向装有二氯苯基钌二聚体(32mg,64μmol)和配体12(70mg,0.13mmol)的phcl(1.2ml)溶液的希丁克管(schlenk tube)中加入三乙胺(52mg,0.5mmol,70μl)。在80℃搅拌1小时后,使溶液冷却至室温,并减压脱除溶剂。将残余物溶解在chcl3(10ml)中,并用水(10ml)洗涤。有机层采用mgso4干燥,过滤并减压脱除溶剂,得到粗混合物。通过柱色谱法(10%etoac的dcm溶液,然后采用0-3%meoh的dcm溶液)纯化,得到呈棕色固体状的催化剂10(71mg,93μmol,73%);1h nmr(500mhz,cdcl3)δ7.32(2h,d,j 8.1,arh),7.09
–
7.01(3h,m,arh),6.91(1h,dd,j 10.4,6.8,arh),6.84(2h,d,j 6.8hz,arh),6.80(2h,d,j 8.1,arh),6.67(2h,d,j 7.6,arh),6.66
–
6.61(1h,m,arh),6.52(2h,t,j 7.6,arh),6.03(6h,s,苯),4.42(1h,d,j 10.8,ntschph),4.39
–
4.31(1h,m,吡咯烷-chnboc),3.87(1h,ddd,j=13.1,6.5,2.5,nhchahb),3.76(1h,t,j 10.8,nhchph),3.05
–
2.96(1h,m,吡咯烷-nbocchahb),2.61(1h,t,j 13.1,nhchahb),2.22(3h,s,ts-ch3),2.21
–
2.15(1h,m,吡咯烷-nbocchahb),1.95
–
1.85(1h,m,吡咯烷-ch2),1.62(9h,s,(ch3)3),1.60
–
1.53(1h,m,吡咯烷-ch2),1.45
–
1.36(1h,m,吡咯烷-ch2),1.26
–
1.15(m,1h,吡咯烷-ch2);
13
c nmr(126mhz,cdcl3)δ157.84,143.86,139.13,138.98,137.48,129.96,128.90,128.19,128.11,127.88,126.68,126.41,125.79,83.84,81.06,76.13,71.42,61.15,56.55,46.29,29.75,28.78,23.83,21.35;ms(esi
+
)m/z 728.3[m-cl]
+
;hrms计算c
37h44
n3o4rus[m-cl]
+
计算值728.2091,实测值728.2094(0.8ppm误差)。
[0247]
实施例7至11、16至18的有机金属催化剂在不对称转移氢化中的用途
[0248]
将实施例7至11以及比较例1和2的有机金属催化剂用于酮的不对称转移氢化反应。
[0249]
比较例1:配体ce1
[0250]
与比较例1ce1的有机金属催化剂一起使用的配体具有下式:
[0251]
(ce1)
[0252][0253]
ce1按照johnson,t.c.;totty,w.g.;wills,m.organic letters,2012,14,5230
–
5233所述的程序合成。
[0254]
比较例2:配体ce2
[0255]
与比较例2ce2的有机金属催化剂一起使用的配体具有下式:
[0256]
(ce2)
[0257][0258]
ce2按照moftah o.darwish,alistair wallace,guy j.clarkson and martin wills,tetrahedron lett.2013,54,4250-4253所述的程序合成。
[0259]
比较例3:配体ce3的合成
[0260]
n-((1r,2r)-1,2-二苯基-2-((((s)-吡咯烷-2-基)甲基)氨基)乙基)-4-甲基苯磺酰胺
[0261][0262]
向配体11(100mg,0.18mmol)的dcm(2ml)溶液中滴加三氟乙酸(0.14ml)。搅拌1个晚上后,将混合物减压浓缩,并将残余物在dcm(10ml)和饱和nahco3溶液(10ml)中分配。采用dcm(3x10 ml)萃取后,将有机萃取物汇合,采用mgso4干燥,过滤并减压脱除溶剂。通过柱色谱法(50%etoac的石油醚溶液)纯化,得到呈白色固体状的配体ce3(80mg,0.18mmol,98%);[α]d+27.5(c 0.1,chcl3中);1h nmr(500mhz,cdcl3)δ7.40(2h,d,j 8.2,arh),7.13
–
7.07(3h,m,arh),7.04
–
7.00(3h,m,arh),6.97(2h,t,j 7.2,arh),6.94
–
6.90(2h,m,arh),6.88(2h,d,j 7.2,arh),4.32(1h,d,j 8.5,nhchph),3.65(1h,d,j 8.5,ntschph),3.28
–
3.19(1h,m,吡咯烷-ch),3.03
–
2.91(2h,m,吡咯烷-nhch2),2.47(1h,dd,j 11.8,4.5,nhchahb),2.32(3h,s,ts-ch3),2.28(1h,dd,j 11.8,8.4,nhchahb),1.86
–
1.67(3h,m,吡咯烷-ch2ch2),1.34
–
1.23(1h,m,吡咯烷-ch2)。
13
c nmr(126mhz,cdcl3)δ142.69,139.68,138.49,137.53,129.18,128.37,127.90,127.84,127.68,127.49,127.23,68.45,63.48,58.65,52.12,46.39,29.43,25.41,21.55;ms(esi
+
)m/z 450.3[m+h]
+
;hrms计算c
26h32
n3o2s[m+h]
+
计算值450.2210,实测值450.2213(0.8ppm误差)。
[0263]
比较例4:配体ce4的合成
[0264]
s,s-l2(jb461)-n-((1s,2s)-1,2-二苯基-2-((((s)-吡咯烷-2-基)甲基)氨基)乙基)-4-甲基苯磺酰胺
[0265][0266]
向配体12(45mg,82μmol)的dcm(1.5ml)溶液中滴加三氟乙酸(94mg,820μmol)。搅拌1个晚上后,将混合物减压浓缩,并将残余物在dcm(10ml)和饱和nahco3溶液(10ml)中分配。采用dcm(3x10 ml)萃取后,将有机萃取物汇合,采用mgso4干燥,过滤并减压脱除溶剂。
通过柱色谱法(50%etoac的石油醚溶液)纯化,得到呈白色固体状的配体ce4(36mg,80μmol,98%);[α]d+28.1(c 0.1,chcl3中);1h nmr(500mhz,cdcl3)δ7.37(2h,d,j 8.2,arh),7.14
–
7.07(3h,m,arh),7.00(3h,d,j 8.2,arh),6.96(2h,t,j 7.5,arh),6.94
–
6.90(2h,m,arh),6.88(2h,d,j 7.5,arh),4.36(1h,d,j 8.5,ntschph),3.65(1h,d,j 8.5,nhchph),3.25(1h,b.s,吡咯烷-ch),3.04
–
2.90(2h,m,吡咯烷-nhch2),2.47(1h,dd,j 11.8,4.5,nhchahb),2.32(3h,s,ts-ch3),2.31
–
2.25(1h,m,nhchahb),1.86
–
1.67(3h,m,吡咯烷-ch2ch2),1.36
–
1.28(1h,m,吡咯烷-ch2ch2);
13
c nmr(126mhz,cdcl3)δ142.62,139.72,138.39,137.67,129.12,128.37,127.88,127.68,127.48,127.20,68.41,63.41,58.74,52.03,46.44,29.39,25.39,21.54;ms(esi
+
)m/z 450.3[m+h]
+
;hrms计算c
26h32
n3o2s[m+h]
+
计算值450.2210,实测值450.2205(1.1ppm误差)。
[0267]
比较例5:配体ce5的合成
[0268]
n-((1r,2r)-2-((((s)-1-甲基吡咯烷-2-基)甲基)氨基)-1,2-二苯乙基)-4-甲基苯磺酰胺
[0269][0270]
将配体11(100mg,0.18mmol)的thf(4ml)溶液冷却到0℃,并加入lialh4(2m己烷溶液,0.18ml,0.36mmol)。回流3小时后,让混合物冷却,并用etoac淬灭反应。加入罗谢尔盐溶液(10ml)并搅拌30分钟。采用etoac(3x10 ml)萃取后,将有机萃取物汇合,采用mgso4干燥,过滤并减压脱除溶剂。采用柱色谱法(0-10%meoh的dcm溶液)纯化,得到呈白色固体状的配体ce5(23mg,50μmol,28%);1h nmr(500mhz,meod)δ7.38(2h,d,j 8.2,arh),7.14
–
7.07(5h,m,arh),7.03(2h,d,j 8.2,ar),6.95
–
6.90(1h,m,j 7.2,arh),6.87(2h,t,j 7.4,arh),6.74(2h,d,j 7.4,arh),4.42(1h,d,j 9.7,ntschph),3.82(1h,d,j 9.7,nhchph),3.68
–
3.60(1h,m,nmechahb),3.29
–
3.21(1h,m,chnme),3.10
–
3.01(1h,m,nmechahb),2.80(1h,dd,j 13.4,6.4,nhchahb),2.72(3h,s,nch3),2.66(1h,dd,j 13.4,5.0,nhchahb),2.27(3h,s,tsch3),2.24
–
2.17(1h,m,吡咯烷-ch2),2.14
–
1.96(2h,m,吡咯烷-ch2),1.82
–
1.72(1h,m,吡咯烷-ch2);
13
c nmr(126mhz,meod)δ144.22,140.93,139.37,139.33,130.20,129.45,129.37,128.83,128.80,128.72,128.05,127.94,69.67,69.37,65.26,57.60,47.76,41.27,28.60,23.12,21.31;ms(esi
+
)m/z 464.3[m+h]
+
;hrms计算c
27h34
n3o2s[m+h]
+
计算值464.2366,实测值464.2369(0.5ppm误差)。
[0271]
使用本发明的配体和/或催化剂,按照以下通用程序1至3开展酮的不对称转移氢化反应。按照通常程序4制备外消旋醇用于比较分析。
[0272]
通用程序1:ru(芳烃)/配体还原
[0273][0274]
将(例如实施例7至11中的)催化剂(1mol%)在fa/tea 5:2复合物(0.5ml)中的溶液在惰性气氛下在室温搅拌15分钟。然后将酮(1mmol)的二氯甲烷(0.5ml)溶液加入到混合物中,并在室温下搅拌直至反应结束。加入饱和nahco3(10ml),并且产物采用etoac(10ml)
萃取。水层进一步采用etoac(2x10 ml)萃取。将有机组分汇合,采用mgso4干燥,过滤并减压脱除溶剂。粗产物通过柱色谱法纯化(0
–
50%etoac的石油醚溶液)。对映体过量采用手性gc或hplc测定。
[0275]
通用程序2:分别使用配体和[rucl2(苯)]2的原位程序
[0276][0277]
向装有[rucl2(苯)]2(2.50mg,0.5mmol)和配体(1mmol)的希丁克管(schlenk tube)中加入甲酸/三乙胺5:2复合物(0.5ml)。搅拌30分钟后,加入酮(1mmol)并搅拌。反应结束后,加入nahco3(10ml),产物采用etoac(3x10 ml)萃取。将有机萃取物汇合,采用mgso4干燥,过滤并减压脱除溶剂。粗产物通过柱色谱法纯化(0
–
50%etoac的石油醚溶液)。对映体过量采用手性gc或hplc测定。
[0278]
通用程序3:分别使用配体和ru3(co)
12
的原位程序
[0279][0280]
将配体(5mol%)和ru3(co)
12
(5/3mol%)在iproh(10ml)中的混合物在惰性气氛下于80℃在希丁克管(schlenk tube)中搅拌30分钟。然后将酮(1mmol)加入到溶液中,并将所得混合物在80℃下搅拌72小时。减压除去溶剂,粗产物通过柱色谱法纯化(0-50%etoac的石油醚溶液)。对映体过量采用gc或手性hplc测定。
[0281]
通用程序4:用于比较分析的外消旋醇程序
[0282][0283]
向酮(1当量(eq.))的meoh(0.1m)溶液中分批加入nabh4(2当量)。将所得溶液在室温搅拌,直到酮消耗完。然后减压除去溶剂,将残余物在水和etoac之间分配。收集有机萃取物,水层采用etoac进一步萃取2次。将有机层汇合,采用mgso4干燥,过滤并减压脱除溶剂。产物通过柱色谱梯度洗脱(0-40%etoac的石油醚溶液)纯化。
[0284]
通用程序5:环亚胺的还原
[0285][0286]
向装有催化剂(5μmol)的希丁克管(schlenk tube)中加入5:2甲酸/三乙胺(0.25ml),并在n2气氛下搅拌15分钟。将亚胺(0.5mmol)的dcm(0.25ml)溶液加入到上述混合物中,并在室温搅拌过夜。反应采用饱和nahco3(5ml)淬灭,并用etoac(3
×
5ml)萃取。将有机层汇合,采用mgso4干燥,过滤并减压脱除溶剂。产物通过柱色谱梯度洗脱(0-60%etoac的石油醚溶液)纯化。
[0287]
首先参见表1,表中示出了使用本发明的催化剂1至4,按照还原酮的通用程序1开展不对称转移氢化的结果。
[0288]
还参见表2,表中示出了使用本发明的配体1至4原位形成催化剂,按照还原酮的通用程序2开展不对称转移氢化的结果。
[0289]
还参见表3,表中示出了使用本发明的催化剂1,按照还原亚胺的通用程序5开展不对称转移氢化的结果。
[0290]
[0291]
[0292][0293]
表1a在通用程序1中使用实施例7的催化剂1从酮前体的不对称还原获得的醇产物
[0294][0295]
表2根据本发明,使用配体原位形成催化剂,按照通用程序2开展还原酮的不对称转移氢化的结果
[0296]
[0297][0298]j使用实施例10的催化剂4及通用程序1,获得以下结果:72小时,47%转化率,85%ee。
[0299]k使用实施例7的催化剂1及通用程序1,获得以下结果:72小时,98%转化率,64%ee;使用实施例9的催化剂3及通用程序1,获得以下结果:72小时,97%转化率,72%ee。
[0300]
表3使用本发明的催化剂1和使用通用程序5开展还原酮的不对称转移氢化的结果
[0301]
[0302]
[0303]
[0304][0305]m(i)在通用程序5中使用催化剂1,使用mecn代替dcm,对映体过量是90%ee;(ii)在通用程序5中使用催化剂2,获得以下结果:48小时,86%转化率,91%ee;(iii)在通用程序5使用催化剂4,获得以下结果:96小时,77%转化率,49%ee;(iv)使用比较例的催化剂,其中催化剂具有包含苯环代替呋喃的催化剂1的结构,得到以下结果:12%转化率,0%ee。
[0306]n根据tlc,亚胺被完全还原。然而,形成了产物的(甲酰化和非甲酰化)混合物,其中甲酰产物是主要产物,将其分离。
[0307]
结果表明,对于类似的亚胺还原,与现有技术的催化剂相比,对映选择性得到改善(例如marc perez,zi wu,michelangelo scalone,tahar ayad,and virginie ratovelomanana-vidal,eur.j.org.chem.2015,6503
–
6514中所述)。产物3,论文(12a)中的结果是29%ee,产物6,论文(12l)中的结果39%ee,产物7,论文(12f)中的结果是79%ee,产物8,论文(12k)中的结果是36%ee,产物9,论文(12i)中的结果是36%ee,产物17,论文(11i)中的结果是82%ee,我们的产物20,论文(11j)中的结果是75%ee。
[0308]
表4a、4b、4c还原苯乙酮的不对称转移氢化
[0309][0310]
本发明旨在通过重新设计用作催化剂的配体和金属配合物来改善不对称氢化反应的对映选择性。为了改善对映选择性,能够向配体的x基团增加额外的官能性将是有利的。然而,先前已经表明,其中x包含能够充当第三供体基团的氮原子的三齿配体因为第三供体基团与金属中心配位而抑制催化作用,从而形成无活性的催化剂。已经表明,这些配体能够与ru3(co)
12
形成催化活性配合物。然而,提供具有能够在tsdpen/ru/芳烃/cl-类型配合物中形成活性催化剂的第三供体基团的配体,提高不对称氢化反应的对映选择性是有利的。
[0311]
从表4a中的结果可以看出,杂环基团的性质会影响催化剂的有效性,因此含有强n-供体基团作为第三配体的配体适合使用ru3(co)
12
作为金属源进行催化,而那些在与tsdpen相邻位置含氧的杂环或酯等弱供体形成[tsdpen/ru/芳烃/cl]类型的有效配合物,如表4b和4c的结果所示。
[0312][0313]
p
(i)使用配体9和[ru(苯)cl2]2的水/甲酸钠溶液得到以下结果:120小时,30%转化率,78%ee;(ii)使用配体9和[ru(c6h5ch2oet)cl2]2–
fa/tea,dcm,[1m],得到以下结果:264小时,82%转化率,85%ee。
[0314][0315][0316]
令人惊讶地发现,预期以三齿方式结合的本发明的配体可用于形成有机金属配合物,例如在不对称转移氢化的不对称合成中用作“单一试剂”催化剂。
[0317]
这是令人惊讶的,因为据现有技术教导,三齿配体与金属中心形成无活性的配合物,抑制了催化活性。
[0318]
本发明的配体是有利的,因为它们将三齿配体的给电子效应与形成“单一试剂”[η
6-芳烃)ru(ii)tsdpen(cl)]催化剂的能力相结合,从而以高对映体过量和高转化率还原底物。
[0319]
已经证明,使用本发明的催化剂7至11能够在不对称转移氢化中以高产率和高对映体过量制备手性醇,其结果显示在上面的表1和表2中。使用底物2、4和13的结果尤其引人注目,因为使用催化剂ce1和ce2未观察到还原反应,但是本发明的催化剂7至11中的每一种催化剂均以中等至较高产率和对映体过量制备手性醇产物(ee)。
[0320]
本领域技术人员将理解的是,可以设想上述实施方案的各种变化,但并不背离本发明的范围。
[0321]
本领域技术人员还应理解的是,上述特征和/或附图中所示特征的任意数量的组合提供了比现有技术明显的优势,因此属于此处所述的本发明的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1