用于治疗CMV感染相关疾病的融合毒素蛋白
用于治疗cmv感染相关疾病的融合毒素蛋白
技术领域
1.本发明涉及用于治疗cmv感染相关疾病的免疫毒素。本发明还涉及所述免疫毒素和包含所述免疫毒素的药物组合物作为药物的用途,以及包含所述免疫毒素的用于治疗或预防cmv感染的试剂盒。
背景技术:
2.巨细胞病毒
3.巨细胞病毒(cmv)是一种重要的人类病原体和主要的机会主义者,它会在免疫不足的主体中引起疾病,例如艾滋病(aids)患者、新生儿和接受过免疫抑制药物(例如作为移植方案的一部分)的个体。在这些个体中,cmv在重现的和/或急性的感染中的后果可能是极其严重的,包括视网膜炎、脑炎和肺囊虫病及其他病理。此外,在有免疫能力的宿主中,cmv建立了一种持续的终生感染,它通过这种感染与各种炎症状况相联系,包括心脏移植和斑块旋切术后的冠状动脉闭塞和血管成型术后的再狭窄。cmv在宿主的急性感染期间以及在终生潜伏期间与白细胞相互作用。因此,白细胞是cmv诱导的疾病的重要参与者,已经作为病毒传播的载体参与感染的急性期并作为驻留位点参与终生潜伏期。
4.目前尚无法治愈cmv感染。病毒抑制剂已被用于抑制cmv复制,但它们具有强烈的副作用并且仅用于抑制感染。用于治疗移植患者和hiv/aids患者中的cmv感染的最常见药物是仿制药更昔洛韦(ganciclovir)和阿昔洛韦(acyclovir),它们最初是为单纯疱疹病毒(hsv)开发的。更昔洛韦和阿昔洛韦对cmv和hsv具有抑制作用。膦甲酸钠(foscavir)也被用于抑制cmv感染,但已被证明会引起无法忍受的恶心。prevymis,一种小分子终止酶抑制剂,也能抑制病毒复制。莱特莫韦(letermovir)抑制cmv dna终止酶复合物(pul51、pul56和pul89),这是病毒dna加工和包装所必需的。
5.总之,现有的药物都不能根除感染,而只能阻止免疫不足或免疫抑制患者的cmv疾病进展。因此,在功效和毒性水平上都有改进的余地。
6.免疫毒素
7.免疫毒素是与毒素结合的配体,可用于杀死表达该配体的受体的细胞。免疫毒素治疗也称为配体靶向疗法。因此,免疫毒素包括用于递送的靶向部分(配体)和用于细胞毒性的毒性部分。目前使用的配体是单克隆抗体、细胞因子/生长因子和可溶性受体。免疫毒素相比传统化疗药物等的优势在于,细胞不需要分裂就可以被杀死。此外,如果免疫毒素被有效且选择性地内化,则抗原阴性细胞中将不会出现副作用。
8.然而,一般而言,免疫毒素并未显示出令人印象深刻的功效水平。一个常见的问题是它们对患病细胞的特异性不够,而且往往不能有效地进入患病细胞以发挥其细胞毒作用。免疫毒素还导致比其他疗法更高水平的全身毒性,可能是因为免疫毒素的非特异性摄取。
9.目前,正在探索免疫毒素的新方法,以克服抗原表达的毒性、免疫原性和异质性问题。这些方法包括使用基因工程将毒素的易位和催化结构域与人单链抗体融合,并使用噬
菌体展示来选择高亲和力、肿瘤选择性配体。二价构建体的使用还可以增加亲和力和效力。其他方法主要围绕选择靶向肿瘤血管内皮的配体和靶向癌基因产物或分化抗原。尽管在过去的三十年中一直在进行对免疫毒素的研究,但市场上还没有针对病毒相关疾病的免疫毒素。
10.免疫毒素内化
11.大多数免疫毒素是针对已发生恶性转化并且作为这种转化的一部分因此过表达某种抗原或某组抗原的细胞而开发的。尽管这些抗原在转化细胞上过度表达,但它们很少对转化细胞具有特异性,而是通常也在正常细胞上表达。因此,只有少数细胞抗原在转化细胞上过表达。因此,为了通过杀死表达靶抗原的正常细胞来避免不希望的毒性,药物开发人员仅限于靶向极少数候选疾病抗原,因此药物开发人员传统上仅限于根据细胞类型分布来选择靶抗原。因此,许多免疫毒素即使以高亲和力结合靶抗原,也无法有效进入靶细胞,导致效力不足。
12.用于治疗cmv感染相关疾病的免疫毒素
13.之前使用免疫毒素策略治疗cmv感染相关疾病的尝试尚未成功。
14.与多克隆和单克隆抗体相关的两种毒素均已用于靶向cmv感染的细胞。然而,针对gpcr的抗体并不容易开发,它们通常无法识别出具有识别位点可变性的gpcr。因此,抗体结合将对与受体功能无关的受体变异高度敏感,从而增加逃逸变异(产生抗性)的风险。因此,基于抗体的策略没有产生令人信服的体内数据,可能是由于免疫毒素的(选择性)靶向和/或内化不足。
15.或者,免疫毒素的靶向部分可以是肽而不是抗体。在wo2008/003327中,使用包含肽的免疫毒素靶向cmv感染的细胞,所述肽设计用于靶向组成型内化cmv编码的受体。选择的受体之一是名为us28的cmv特异性受体,它是一种g蛋白偶联受体,由人类巨细胞病毒开放阅读框us28编码。设计靶向us28受体的有效免疫毒素的一个挑战是存在名为cx3cr1的人同源受体。因此,对us28的选择性优于cx3cr1是获得具有最小脱靶问题的安全免疫毒素的关键特征。在wo2008/003327中,将趋化因子cx3cl1的突变版本(fractalkine),即cx3cr1的天然配体,用作靶向部分。使用此策略,实现了对us28的选择性优于cx3cr1。
16.由于存在脱靶的人同源受体cx3cr1,开发对表达us28的细胞具有高亲和力和效力的免疫毒素是不够的。相反,免疫毒素应该具有(i)高特异性,即在竞争性结合环境中,与表达cx3cr1的细胞相比,对表达us28的细胞具有高亲和力,和(ii)高杀伤特异性,即与表达cx3cr1的细胞相比,对表达us28的细胞具有高效力。为了将免疫毒素推向临床,重要的是提高us28选择性和杀伤特异性,以限制不良副作用并降低生产成本。
17.因此,改进的免疫毒素将是有益的,特别是与表达cx3cr1的细胞相比,对表达us28的细胞具有高选择性和杀伤特异性的安全免疫毒素将是有益的。
技术实现要素:
18.通过设计对组成型内化cmv编码受体具有高亲和力的免疫毒素,免疫毒素被感染细胞有效吸收,从而实现了感染细胞的死亡。由于免疫毒素的内化被认为是免疫毒素介导的细胞毒性中的限速步骤,靶向组成型内化受体将解决基于免疫毒素的药物利用中的核心问题。此外,本文提出的免疫毒素旨在区分健康细胞和感染细胞。
19.因此,本发明的一个目的涉及靶向组成型内化受体的免疫毒素,确保免疫毒素将被转运到靶细胞中,在那里它可以发挥其功能,即杀死该细胞。此外,本发明的免疫毒素仅以高准确度靶向cmv感染的细胞,并可用于治疗或预防cmv感染或cmv相关疾病。
20.特别地,本发明的一个目的是提供一种具有改进的选择性和杀伤特异性的免疫毒素,其可用作具有高效能的安全药物。
21.因此,本发明的一个方面涉及一种免疫毒素,包括:
22.i)靶向部分,包括选自以下的氨基酸序列:
23.a)seq id no:1,或
24.b)与seq id no:1具有至少80%序列同一性的氨基酸序列,和
25.ii)毒素,
26.其中第49位的氨基酸残基被丙氨酸(a)残基代替,在n末端第1-6位的氨基酸残基被氨基酸序列ildngvs代替。
27.本发明的另一方面涉及一种包含本发明的免疫毒素或其药学上可接受的盐的药物组合物。
28.本发明的又一方面是提供本发明的免疫毒素或药物组合物作为药物使用。
29.本发明的再一方面是提供本发明的免疫毒素或药物组合物,用于治疗或预防cmv感染或cmv相关疾病。
30.本发明的再一方面是提供一种药盒,包括:
31.i)本发明的免疫毒素或药物组合物,
32.ii)一种或多种额外的治疗剂,和
33.iii)可选地,使用说明,
34.其中i)和ii)用于同时、分开或顺序给药。
35.本发明的另一方面是提供一种核酸序列,其包含编码本发明的免疫毒素的序列。
36.本发明的另一方面是提供一种重组表达载体,其包含本发明的核苷酸序列可操作地连接一个或多个适于指导在适合的宿主中产生免疫毒素的控制序列。
37.本发明的另一方面是提供一种包含本发明的表达载体的重组宿主细胞。
38.本发明的另一方面涉及一种生产本发明的免疫毒素的方法,包括步骤:
39.a)提供本发明的宿主细胞,
40.b)在适于表达所述免疫毒素的条件下培养所述宿主细胞;和
41.c)分离所述免疫毒素。
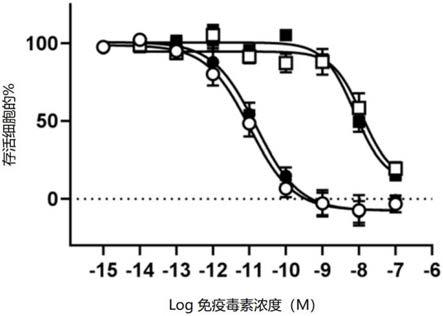
42.附图简要说明
43.图1显示了在表达us28的hek293细胞(圆圈)的稳定可诱导型克隆中,使用
125
i-ccl2作为放射性配体,比较syn001(黑色符号)和syn004(白色符号)的竞争结合实验。
44.图2显示了在表达cx3cr1的hek293细胞(正方形)的稳定可诱导型克隆中,使用
125
i-cx3cl1作为放射性配体,比较syn001(黑色符号)和syn004(白色符号)的竞争结合实验。
45.图3显示了在表达us28的hek293细胞(圆圈)的稳定可诱导型克隆中使用
125
i-ccl2作为放射性配体,比较yn000(黑色符号)和syn003(白色符号)的竞争结合实验。
46.图4显示了在表达cx3cr1的hek293细胞(正方形)的稳定可诱导型克隆中,使用
125
i-cx3cl1作为放射性配体,比较syn000(黑色符号)和syn003(白色符号)的竞争结合实验。
47.图5显示了在表达us28的hek293细胞(圆圈)和表达cx3cr1的hek293细胞(正方形)的稳定可诱导型克隆中,比较syn001(黑色符号)和syn004(白色符号)的杀伤实验。
48.图6显示了在表达us28的hek293细胞(圆圈)和表达cx3cr1的hek293细胞(正方形)的稳定可诱导型克隆中,比较syn000(黑色符号)和syn003(白色符号)的杀伤实验。
49.图7为域结构的示意图;(i)人cx3cl1(ss=信号序列,cx3cl1=趋化因子域,茎区域(stalk)=黏蛋白样茎区域,m=跨膜部分,c=胞质域),以及(ii)铜绿假单胞菌(pseudomonas aeruginosa)外毒素a(ss=信号序列,域i=受体结合域,域ii=易位域,ib=功能未知的域ib,以及域iii=酶活性域)。在每种蛋白质上方显示出前体蛋白质的氨基酸编号。在每种蛋白质下方用方括号以及所涉及的氨基酸编号表示出二硫键。弗林蛋白酶(furin)在外毒素a的域ii的氨基酸304和305之间断裂。
50.图8显示了候选药物的示意图。所给定域中的突变是以所涉及的氨基酸的单字母代码及其在免疫毒素所基于的天然蛋白质(即人cx3cl1或铜绿假单胞菌外毒素a)中对应的氨基酸位置的编号来记录。例如,c312s表示第312位的半胱氨酸被丝氨酸代替。单字母代码也用在构建体的n末端和c末端以及域之间。两个域之间的虚线表示氨基酸是相连的。
51.下面将更详细地描述本发明。
具体实施方式
52.定义
53.在进一步详细讨论本发明之前,首先定义以下术语和约定:
54.免疫毒素
55.在本文中,术语“免疫毒素”指包含用于递送的靶向部分(配体)和用于细胞毒性的毒性部分(毒素)的双功能分子。免疫毒素可用于杀死表达配体受体的细胞。
56.免疫毒素也可称为融合毒素蛋白(ftp)。因此,在本文中,术语“免疫毒素”和“融合毒素蛋白(ftp)”互换使用。
57.配体或靶向部分(targeting moiety)
58.在本文中,术语“配体”指对(例如,源于病毒的)受体或抗原具有特异性结合亲和力的任何氨基酸、肽、多肽或蛋白质。
59.在本文中,配体用于将免疫毒素特异性靶向到所需位置。因此,配体也称为“靶向部分”。因此,在本文中,术语“配体”和“靶向部分”互换使用。
60.本文所述的免疫毒素的靶向部分优选地是肽或多肽的形式。
61.肽或多肽
62.在本文中,术语“肽”或“多肽”指由氨基酸残基、相关的天然存在的结构变体及其合成的非天然存在的类似物通过肽键连接组成的聚合物。在本文中,术语“肽”和“多肽”互换使用。
63.多肽可以重组或合成产生。多肽的重组产生可以如本领域技术人员已知的那样,通过在已知表达系统中引入包含编码目标多肽的核酸的表达载体来完成。合成的多肽可以用例如自动多肽合成仪来合成。
64.本文使用常规符号来描述多肽序列:多肽序列的左手端是氨基末端(n-末端);多肽序列的右手端是羧基末端(c-末端)。
65.毒素
66.在本文中,术语“毒素”指任何物质,是蛋白质或非肽,其具有细胞毒性或细胞抑制作用,或诱导细胞凋亡或坏死,或直接抑制病原体的复制、生长或传播,或使受感染的细胞容易受到受感染宿主免疫反应的影响。
67.毒素的实例包括但不限于外毒素、内毒素、酶毒素、成孔毒素、超抗原和核糖体灭活蛋白(rip)。
68.酶毒素的实例包括但不限于假单胞菌外毒素a、霍乱毒素、白喉毒素、百日咳毒素、志贺毒素、肉毒杆菌毒素、破伤风毒素、炭疽毒素和金黄色葡萄球菌剥脱毒素b。
69.成孔毒素的实例包括但不限于溶血素、李斯特菌溶血素、炭疽ef、α毒素、肺炎球菌溶血素、链球菌溶血素o、杀白细胞素和穿孔素溶血素o。
70.核糖体灭活蛋白(rip)的实例包括但不限于假单胞菌外毒素a、白树毒素、布加宁、皂草素、蓖麻毒素、蓖麻毒素a链、异株泻根毒蛋白、白喉、局限曲霉素和白喉毒素。
71.cx3cl1和cx3cr1
72.在本文中,术语“cx3cl1”指趋化因子,它是cx3c趋化因子家族的成员。趋化因子是调节细胞迁移的低分子量蛋白质。许多趋化因子还具有诱导免疫系统的细胞成熟、活化、增殖和分化的能力。cx3cl1也称为神经趋化因子(fractalkine)和神经趋化蛋白(neurotactin),因此,在本文中,术语“cx3cl1”、“神经趋化因子”和“神经趋化蛋白”互换使用。
73.cx3cl1包含一个趋化因子域,负责与相应的趋化因子受体相互作用。趋化因子域由作为seq id no:1所示的氨基酸序列定义。该氨基酸序列对应uniprot数据库中条目p78423下给出的天然人cx3cl1的第25位至第99位。
74.cx3cl1可根据本发明进行修饰(即通过删除、插入和/或替换、缀合等进行突变)。
75.cx3cl1通过与称为“cx3cr1”的相应受体相互作用来发挥其功能。因此,在本文中,术语“cx3cr1”指神经趋化因子受体并具有seq id no:4所示的氨基酸序列。该氨基酸序列对应uniprot数据库中条目p49238下的天然人神经趋化因子受体。
76.内化
77.在本文中,术语“内化”指实体从细胞外环境转移到细胞的细胞内区室。因此,如本文所述的免疫毒素的内化指免疫毒素进入靶细胞(例如,表达与免疫毒素靶向部分相互作用的抗原的细胞)的细胞内区室。
78.免疫毒素的内化可通过组成型内化受体(例如us28)来介导。组成型内化指在质膜上表达的任何抗原,在没有事先刺激的情况下,从细胞质膜内化到细胞质或细胞内区室中。抗原内化可由配体来调节,内化的抗原可再循环到质膜或者可在内化后降解。
79.us28
80.在本文中,术语“us28”指由人巨细胞病毒开放阅读框us28编码的g蛋白偶联受体。us28是一种组成型内化受体,因此结合us28的趋化因子或其他化合物被内化到表达该受体的细胞中。在本文中,us28具有seq id no:3所示的氨基酸序列。该氨基酸序列对应uniprot数据库中q9ip69条目下的cx3cr1同源物。然而,us28存在于不同的变体中,并且如本文所述
的免疫毒素的靶标不限于us28的一种特定变体,即氨基酸序列。
81.亲和力
82.在本文中,术语“亲和力”指结合亲和力,即免疫毒素与受体之间的结合相互作用的强度。在异源结合实验中,亲和力被测量并报告为平衡解离常数(ki)。ki值越小,配体对其靶标的结合亲和力越大。ki值越大,靶标分子与配体之间的相互吸引和结合就越弱。
83.ki可通过多种方法测量,包括但不限于等温滴定量热法(itc)、elisa、凝胶迁移实验、拉下实验、平衡透析、分析超速离心、spr和光谱实验、饱和结合实验以及同源和异源竞争结合实验。
84.选择性
85.在本文中,术语“选择性”指免疫毒素对us28的亲和力对比(vs.)免疫毒素对cx3cr1的亲和力。这可以由公式ki(us28)/ki(cx3cr1)表示。解离常数的标志表示为“i”,因为这是异源结合的情况。
86.效力
87.在本文中,术语“效力”指在施用免疫毒素后细胞活力的降低。因此,效力被定义为抑制效力,并通过ic50值量化。因此,针对表达us28的细胞的效力在本文中表示为ic50(us28),而针对表达cx3cr1的细胞的效力表示为ic50(cx3cr1)。通常,ic50值以nm来报告,较低浓度的免疫毒素对应高效力,而较高浓度的免疫毒素对应低效力。
88.杀伤特异性
89.在本文中,术语“杀伤特异性”指免疫毒素特异性杀伤表达us28的细胞超过表达cx3cr1的细胞的能力。杀伤特异性被量化为针对表达cx3cr1的细胞的(抑制)效力与针对表达us28的细胞的(抑制)效力之间的比率。因此,杀伤特异性可以计算为ic50(cx3cr1)/ic50(us28),高数值表明对表达us28的细胞具有高杀伤特异性。
90.在某些情况下,本文定义的杀伤特异性也称为选择性指数。因此,在本文中,术语“杀伤特异性”和“选择性指数”互换使用。
91.巨细胞病毒(cmv)
92.在本文中,术语“巨细胞病毒”或“cmv”指疱疹病毒科家族的病毒。人cmv(hcmv)也称为“人疱疹病毒5”或“hhv-5”,指能够感染人类的cmv。
93.cmv感染和cmv相关疾病
94.在本文中,术语“cmv感染”或“cmv相关疾病”指由患病个体中cmv的存在引起的、或与之相关的、或从患病个体的血清学调查中明显看出的疾病、综合征、病症或死亡。
95.cmv引起急性和慢性疾病。急性疾病,其最常与高水平病毒复制相关并以影响多个器官为特征,有单核细胞增多症样综合征、早产儿围产期感染、同种异体移植受者的cmv综合征以及免疫不足患者(例如艾滋病患者)的播散性感染。慢性感染,其最常与低水平病毒复制相关,有先天性感染、移植患者的血管疾病、正常宿主的血管疾病,以及炎症疾病,尤其是胃肠道疾病。
96.此外,通过分子或血清学方法确定,cmv的存在与移植受者的发病率和死亡率增加有关。事实上,已显示预防cmv可降低移植后的全因死亡率。此外,cmv感染与实体器官移植受者的器官排斥和造血干细胞受者的移植物抗宿主病有关。
97.氨基酸序列
98.在本文中,术语“氨基酸序列”指一系列连续氨基酸,包括天然存在的氨基酸和/或人工氨基酸类似物。氨基酸序列可以是氨基酸的聚合物,例如蛋白质、多肽、肽等。鉴于遗传密码的简并性,编码特定多肽序列的一种或多种核酸或其互补核酸可以从该多肽序列确定。
99.变体
100.在本文中,术语“变体”指包含某一序列的多肽,该序列在一个或多个氨基酸位置与天然多肽序列不同(通过氨基酸的缺失、氨基酸的插入和/或氨基酸替换为不同的氨基酸)。变体序列可以是非天然存在的序列,即在自然界中未发现的序列。优选地,“变体”保留与天然多肽相同的功能。因此,“变体”产生与天然多肽具有相同或增强的亲和力、选择性、效力或杀伤特异性的免疫毒素。
101.片段
102.在本文中,术语“片段”指包含某一序列的多肽,该序列是较大亲本多肽的一段。因此,片段序列与亲本序列共享一段连续的氨基酸,但长度减少。优选地,“片段”保留与亲本多肽相同的功能。因此,“片段”产生与天然多肽具有相同或增强的亲和力、选择性、效力或杀伤特异性的免疫毒素。
103.药物组合物
104.在本文中,术语“药物组合物”指适合用于个体的药物用途的组合物。药物组合物通常包含有效量的活性剂,例如免疫毒素;以及载体,包括但不限于药学上可接受的载体。
105.有效量
106.在本文中,术语“有效量”指足以产生所需效果的剂量或用量。期望的效果可包括所述剂量或用量的受者的客观或主观改善,例如个体的预防性或治疗性处理。
107.预防性/预防性治疗
108.在本文中,术语“预防性治疗”指对不显示疾病、病理学或医学病症的体征或症状,或仅显示疾病、病理学或病症的早期体征或症状的个体施用的治疗,施用这种治疗的目的是减少、预防或降低所述疾病、病理学或医学病症发展的风险。预防性治疗的作用是针对疾病或病症的预防性治疗,因此在本文中术语“预防性治疗(prophylactic treatment)”和“预防性治疗(preventive treatment)”互换使用。
109.治疗性治疗
110.在本文中,术语“治疗性治疗”是指对表现出病理、疾病或病症的症状或体征的个体施用的治疗,其中对个体施用治疗的目的是减少或消除病理、疾病或病症的那些体征或症状。
111.核苷酸序列
112.在本文中,术语“核苷酸序列”(例如核酸、多核苷酸、寡核苷酸等)指核苷酸的聚合物,所述核苷酸包括核苷酸a、c、t、u、g或其他天然存在的核苷酸或人造核苷酸类似物。给定的核酸或互补的核酸可以由任意特定的多核苷酸序列确定。除非另有说明,具体的核酸序列也隐含地包括其保守修饰的变体(例如简并密码子替换)和互补序列以及明确指出的序列。具体而言,简并密码子替换可通过生成某些序列来实现,这些序列中一个或多个所选择的(或所有)密码子的第三位置被混合碱基和/或脱氧肌苷残基替换。在本文中,术语“核酸”与“基因”、“cdna”和“基因编码的mrna”互换使用。
113.源自基因的核酸
114.在本文中,短语“源自基因的核酸”指那些从根本上将基因或其子序列作为模板用于其合成的核酸。因此,mrna、从mrna逆转录的cdna、从该cdna转录的rna、从cdna扩增的dna、从扩增的dna转录的rna等,都是源自基因。
115.在一些实施方式中,免疫毒素的蛋白质靶标可通过它们的遗传起源(即核酸序列)而不是它们的氨基酸序列来描述。
116.可操作地连接
117.在本文中,术语“可操作地连接”指两个或多个核苷酸序列通过酶促连接或其他方式以相对于彼此的构型共价连接,以便可以执行序列的正常功能。例如,如果编码前序列或分泌性前导的核苷酸序列表达为参与多肽分泌的前蛋白,那么编码前序列或分泌性前导的核苷酸序列可操作地连接至多肽的核苷酸序列;如果启动子或增强子影响编码序列的转录,那么启动子或增强子可操作地连接至该编码序列;如果核糖体结合位点的位置被定位为促进翻译,那么该核糖体结合位点可操作地连接至编码序列。通常,“可操作地连接”意味着连接的核苷酸序列是邻接的,并且在分泌性前导的情况下是邻接的且处于阅读相(reading phase)中。连接可以通过在方便的限制性位点处的连接来实现。如果没有此类位点,那么结合标准的重组dna方法,使用合成的寡核苷酸衔接头或接头。
118.控制序列
119.在本文中,术语“控制序列”指包括对本发明多肽的表达必需的或有利的所有组分的序列。对于编码多肽的核苷酸序列来说,每个控制序列可以是天然的或外来的。此类控制序列包括但不限于前导、聚腺苷酸化序列、前肽序列、启动子、信号肽序列和转录终止子。通常,控制序列包括至少一个启动子,以及转录和翻译终止信号。控制序列可设置有接头,目的是引入特异性限制位点,促进控制序列与编码多肽的核苷酸序列的编码区相连接。
120.表达载体
121.在本文中,术语“表达载体”指线性或环状的dna分子,其包含编码多肽的区段,与设置用于其转录的附加区段可操作地连接。
122.宿主细胞
123.在本文中,术语“宿主细胞”指带有核酸构建体,对转化敏感的任何细胞类型。宿主细胞可以是真核的或原核的。
124.重组
125.在本文中,术语“重组”指通过引入异源(或外来)核酸或改变天然核酸而修饰的细胞、病毒、核苷酸或载体,或通过引入异源氨基酸而修饰的蛋白质或多肽,或通过对细胞进行所述修饰而获得的细胞。重组细胞表达那些在细胞的天然(非重组)形式中不存在的核酸序列(例如基因),或表达那些异常表达、低表达或根本不表达的天然核酸序列(例如基因)。
126.序列同一性
127.在本文中,术语“序列同一性”在此定义为基因或蛋白质之间分别在核苷酸、碱基或氨基酸水平上的序列同一性。具体而言,如果dna序列的转录物可以转录为相同的rna序列,则认为dna和rna序列是相同的。
128.因此,在本文中,“序列同一性”是氨基酸水平上蛋白质之间同一性的度量和核苷酸水平上核酸之间同一性的度量。当序列比对时,可通过比较每个序列中给定位置的氨基
酸序列来确定蛋白质序列同一性。类似地,当序列比对时,可通过比较每个序列中给定位置的核苷酸序列来确定核酸序列同一性。
129.为确定两个氨基酸序列或两个核酸的同一性百分比,将序列进行比对以达到最佳比较目的(例如,可在第一个氨基酸序列或核酸序列中引入空位(gap)以与第二个氨基酸或核酸序列进行最佳比对)。然后比较相应氨基酸位置或核苷酸位置处的氨基酸残基或核苷酸。当第一个序列中的一个位置被与第二个序列中相应位置的相同氨基酸残基或核苷酸占据时,则该位置的分子是相同的。两个序列之间的同一性百分比是这些序列共享的相同位置数量的函数(即,%同一性=#相同位置数/#总位置数(例如,重叠位置)
×
100)。在一种实施方式中,两个序列的长度相同。
130.在另一种实施方式中,两个序列具有不同的长度并且空位被视为不同的位置。人们可以手动比对序列并计数相同氨基酸的数量。或者,比对两个序列以确定同一性百分比可用数学算法来实现。这种算法被并入(altschul等人,1990)的nblast和xblast程序中。blast核苷酸搜索可用nblast程序进行,得分=100,字长=12,以获得与本发明的核酸分子同源的核苷酸序列。blast蛋白质搜索可用xblast程序进行,得分=50,字长=3,以获得与本发明的蛋白质分子同源的氨基酸序列。
131.为了获得用于比较目的而引入空位的序列比对,可使用gappedblast。或者,可用psi-blast进行迭代搜索,以检测分子间的远近关系。当使用blast、xblast和gappedblast程序时,可使用各程序的缺省参数。见http://www.ncbi.nlm.nih.gov。或者,可在序列比对后,例如通过embl数据库中的blast程序比对后(www.ncbi.nlm.gov/cgi-bin/blast),计算序列同一性。通常,可使用关于例如“评分矩阵”和“空位罚分”的默认设置来进行比对。在本发明的上下文中,blastn和psiblast缺省设置可能是有利的。
132.两个序列之间的同一性百分比可使用与上述类似的技术来确定,允许或不允许有空位。在计算同一性百分比时,只计数完全匹配处。因此,本发明的一种实施方式涉及具有一定程度的序列变异的本发明的序列。
133.基本同源/相同
134.在本文中,在两个核酸或多肽部分的术语“基本同源”或“基本相同”一般指当使用比较算法或目视检查进行测量,比较和比对以获得最大对应时,两个或更多个序列或子序列具有至少40%、60%、80%、90%、95%、96%、97%、98%或99%的核苷酸或氨基酸残基同一性。
135.融合毒素蛋白
136.巨细胞病毒(cmv)是一种临床上重要的机会性病毒病原体,存在于免疫功能不成熟或不足的个体中。所有用于预防、抢先治疗(pre-emptive)或治疗hcmv感染或疾病的针对人cmv(hcmv)的已批准药物疗法均针对病毒复制机制。尽管这种策略在某些情况下是有效的,但目前批准的核苷类似物药物在其他情况下,例如肺-、心脏-、肺-、胰腺-和同种异体造血干细胞移植等,无法预防hcmv疾病。prevymis是一种小分子终止酶抑制剂,也抑制病毒复制。莱特莫韦(letermovir)抑制cmv dna终止酶复合物(pul51、pul56和pul89),该复合物是病毒dna加工和包装所必需的。prevymis预防疗法抑制造血干细胞受者的cmv感染和疾病。重要的是,已批准的核苷类似药物具有治疗限制性副作用,包括严重的肾、神经和血液学毒性,并且容易出现耐药菌株的频繁发展,单个突变通常会导致对该类别的多种药物的耐药
性。虽然prevymis通常被认为可以安全使用,但prevymis预防疗法仍然与高频率(约30%)的突破性再激活有关。总之,这些限制突显了更好策略的必要性,基于新作用机制来改善或补充现有疗法,并治疗因耐药性而对dna聚合酶抑制剂无效的疾病。
137.本文提出了一种hcmv抗病毒策略,该策略的依据是通过hcmv感染的细胞对病毒编码的七次跨膜(7tm)趋化因子受体us28的表达来靶向所述hcmv感染的细胞。hcmv抗病毒策略受免疫毒素的影响,免疫毒素是包括毒素和靶向部分的嵌合分子。
138.当细胞被cmv感染后,us28在被感染细胞的表面表达并变得能够对环境中的趋化因子作出反应。us28受体结合多种人类、鼠和病毒编码的cc趋化因子。有趣的是,cx3c趋化因子fractalkine(也称为cx3cl1)以非常高的亲和力与us28结合,但仅靶向一种额外的受体,即其同类受体cx3cr1,从而降低了基于cx3cl1的免疫毒素策略产生不需要的脱靶效应的可能性。
139.此外,大多数us28受体位于远离细胞表面的核内体内。这种分布是快速的、组成型的、不依赖配体的受体内化的结果。因此,结合us28的趋化因子或其他化合物被内化到表达该受体的细胞中。不受理论束缚,预期本文所述的免疫毒素受益于该特征并且在与us28结合后被转运到cmv感染的细胞中,在那里毒素可以发挥其细胞毒功能。
140.由于存在脱靶人同源受体cx3cr1的情况,因此与表达cx3cr1的细胞相比,免疫毒素对us28表达细胞具有高亲和力和效力是很重要的。本发明提供了免疫毒素,其中us28的靶向部分是基于天然配体fractalkine的肽,但具有修饰和改进的氨基酸序列,从而产生用于治疗或预防cmv感染或cmv相关疾病的强效免疫毒素。
141.因此,本发明的一个方面涉及一种免疫毒素,包括:
142.i)靶向部分,包括选自以下的氨基酸序列:
143.a)seq id no:1,或
144.b)与seq id no:1具有至少80%序列同一性的氨基酸序列,和ii)毒素,
145.其中第49位的氨基酸残基被丙氨酸(a)残基代替,并且在n末端第1-6位的氨基酸残基被氨基酸序列ildngvs代替。
146.us28的天然配体cx3cl1(fractalkine),由趋化因子域、粘蛋白茎区域和将cx3cl1固定到细胞膜上的跨膜域组成。cx3cl1的趋化因子域对us28具有高亲和力。本文中,趋化因子域由seq id no:1所示的氨基酸序列定义,对应于天然人cx3cl1的第25位至99位。seq id no:1的核心突变产生了令人惊讶的强效免疫毒素。不受理论的束缚,认为苯丙氨酸替换为丙氨酸以及靶向部分修饰的n-末端(ildngvs,seq id no:13)产生如本文所述的改进的免疫毒素。因此,通过改变靶向部分的非关键单个氨基酸或氨基酸的非关键区域,可以预期许多不同的具有相似功能特征的免疫毒素。因此,本发明的一种实施方式涉及如本文所述的免疫毒素,其中(b)的氨基酸序列与seq id no:1具有至少90%的序列同一性,例如与seq id no:1有至少95%,例如至少96%,例如至少97%,例如至少98%,例如至少99%的序列同一性。本发明的另一种实施方式涉及如本文所述的免疫毒素,其中靶向部分的n-末端序列不是qhhgvt(seq id no:14)。
147.在其他情况下,可优选的是,靶向部分与fractalkine的趋化因子域非常相似,仅以核心突变进行修饰。因此,本发明的一种实施方式涉及如本文所述的免疫毒素,其中靶向部分是seq id no:1,其中第49位的氨基酸残基被丙氨酸(a)残基代替,在n末端第1-6位的
氨基酸残基被氨基酸序列ildngvs代替。该靶向部分包括两个核心突变,也能用seq id no:2表示。因此,本发明的一种优选实施方式涉及如本文所述的免疫毒素,其中靶向部分包括seq id no:2。
148.免疫毒素可通过重组或合成来产生。在重组产生的情况下,翻译从与起始trna结合的蛋氨酸开始。因此,本发明的一种实施方式涉及如本文所述的免疫毒素,其中所述靶向部分的氨基酸进一步包括甲硫氨酸(m)残基作为从n末端开始的第一个氨基酸。包括具有起始甲硫氨酸(m)的靶向部分的免疫毒素由seq id no:11表示。因此,本发明的一种实施方式涉及如本文所述的免疫毒素,其中靶向部分包括seq id no:11。
149.如本文所述的免疫毒素通过靶向us28受体,对hcmv感染的细胞特异性地发挥它们的细胞毒作用。因此,本发明的一种实施方式涉及如本文所述的免疫毒素,其中靶向部分与us28受体结合。本发明的另一种实施方式涉及如本文所述的免疫毒素,其中免疫毒素在结合us28之后被内化。
150.us28受体是由人巨细胞病毒开放阅读框us28编码的g蛋白偶联受体。在本文中,us28受体具有由seq id no:3表示的氨基酸序列。然而,us28存在于不同的变体中,并且本文所述的免疫毒素的靶标不限于一种特定变体,而且还延伸至基本同源或基本相同的变体。
151.因此,本发明的一种实施方式涉及如本文所述的免疫毒素,其中us28受体包括选自以下的氨基酸序列:
152.i)seq id no:3,或
153.ii)与seq id no:3具有至少80%序列同一性的氨基酸序列。
154.本发明的另一种实施方式涉及如本文所述的免疫毒素,其中us28受体包括选自以下的氨基酸序列:
155.i)seq id no:3,或
156.ii)与seq id no:3具有至少90%序列同一性的氨基酸序列,例如与seq id no:3有至少95%,例如至少96%,例如至少97%,例如至少98%,例如至少99%的序列同一性。
157.us28受体也可以在基因水平上定义。因此,在本文中,us28受体由seq id no:12表示的核酸序列编码。由于us28受体存在于不同的变体中,且遗传密码发生简并,因此其遗传密码所定义的us28受体不限于单一核酸,而且还延伸至基本同源或基本相同的变体。
158.因此,本发明的一种实施方式涉及如本文所述的免疫毒素,其中us28受体由选自以下的核酸序列编码:
159.i)seq id no:12,或
160.ii)与seq id no:12具有至少80%序列同一性的核酸序列。
161.本发明的另一种实施方式涉及如本文所述的免疫毒素,其中us28受体由选自以下的核酸序列编码:
162.i)seq id no:12,或
163.ii)与seq id no:12具有至少90%序列同一性的核酸序列,例如与seq id no:12有至少95%,例如至少96%,例如至少97%,例如至少98%,例如具有至少99%的序列同一性。
164.如本文所述的免疫毒素被设计用于以强亲和力(ki)结合us28。因此,本发明的一
种实施方式涉及如本文所述的免疫毒素,其中免疫毒素结合us28的ki为10-7
m或更小,例如10-8
m或更小,例如10-9
m或更小,例如10-10
m或更小,例如10-11
m或更小。在与
125
i-ccl2或
125
i-cx3cl1作为放射性配体测定竞争条件下的结合亲和力。在实施例中进一步描述了确切的实验。
165.由于人同源受体cx3cr1代表着不希望的脱靶,如果免疫毒素对cx3cr1的亲和力相对较低,则是有利的。这不仅增加了免疫毒素的功效,而且降低了副作用,因为健康细胞受免疫毒素给药的影响较小。因此,本发明的一种实施方式涉及如本文所述的免疫毒素,其中与cx3cl1(seq id no:1)对cx3cr1的亲和力相比,免疫毒素对人同源受体cx3cr1的亲和力降低,例如降低到至少1/100,例如至少1/150,例如1/200,或例如至少1/250。本发明的另一种实施方式涉及如本文所述的免疫毒素,其中所述免疫毒素结合cx3cr1的ki为10-6
或更高。本发明的另一种实施方式涉及如本文所述的免疫毒素,其中与对cx3cr1的亲和力相比,免疫毒素对us28的亲和力增加,例如亲和力增加到至少75倍,例如至少100倍,例如至少150倍,例如200倍,或例如至少250倍。
166.不受理论束缚,认为主要是免疫毒素的靶向部分负责结合us28受体。因此,本发明的一种实施方式涉及如本文所述的免疫毒素,其中靶向部分结合us28的ki为10-7
m或更小,例如10-8
m或更小,例如10-9
m或更小,例如10-10
m或更小,例如10-11
m或更小。本发明的另一种实施方式涉及如本文所述的免疫毒素,其中与cx3cl1(seq id no:1)对cx3cr1的亲和力相比,靶向部分对人同源受体cx3cr1的亲和力降低,例如降低到至少1/100,例如至少1/150,例如1/200,或例如至少1/250。本发明的另一种实施方式涉及如本文所述的免疫毒素,其中靶向部分结合cx3cr1的ki为10-6
或更高。本发明的另一种实施方式涉及如本文所述的免疫毒素,其中与对cx3cr1的亲和力相比,靶向部分对us28的亲和力增加,例如亲和力增加到至少75倍,例如至少100倍,例如至少150倍,例如200倍,或例如至少250倍。
167.在本文中,人同源受体cx3cr1可由seq id no:4所示的氨基酸序列表示。然而,如本文所述的cx3cr1不限于一种特定变体,而且还延伸至基本同源或基本相同的变体。因此,本发明的一种实施方式涉及如本文所述的免疫毒素,其中cx3cr1受体包括seq id no:4所示的氨基酸序列。
168.本发明的另一种实施方式涉及如本文所述的免疫毒素,其中cx3cr1受体包括选自以下的氨基酸序列:
169.i)seq id no:4,或
170.ii)与seq id no:4具有至少80%序列同一性的氨基酸序列,例如与seq id no:3有至少90%,例如至少95%,例如至少96%,例如至少97%,例如至少98%,例如至少99%的序列同一性。
171.不受理论束缚,免疫毒素中的毒素对免疫毒素结合并内化到cmv感染的细胞中不具有贡献。因此,免疫毒素可功能性使用范围广泛的毒素。因此,本发明的一种实施方式涉及如本文所述的免疫毒素,其中所述毒素选自外毒素、内毒素、酶毒素、成孔毒素、超抗原和核糖体灭活蛋白(rip)中的一种或多种。本发明的另一种实施方式涉及如本文所述的免疫毒素,其中所述毒素是核糖体灭活蛋白(rip)。本发明的另一种实施方式涉及如本文所述的免疫毒素,其中所述毒素选自假单胞菌外毒素a、白树毒素、布加宁、皂草素、蓖麻毒素、蓖麻毒素a链、异株泻根毒蛋白、白喉、局限曲霉素和白喉毒素,及其片段或变体的一种或多种。
172.假单胞菌外毒素a是一种非常有效的毒素,能够通过其二磷酸腺苷-核糖基化域来杀死细胞,该域修饰延伸因子2,从而阻止蛋白质合成并启动细胞凋亡。因此,本发明的一种实施方式涉及如本文所述的免疫毒素,其中该毒素是假单胞菌外毒素a(seq id no:5)或其片段。
173.假单胞菌外毒素a包括分别与易位(域ii)和细胞毒性(域ib和iii)相关的结构域。因此,本发明的一种实施方式涉及如本文所述的免疫毒素,其中该毒素包含一个或多个片段,其选自假单胞菌外毒素a的结合域(域ii,seq id no:6)、中间域(域ib、seq id no:7)和adp-核糖基化域(域iii,seq id no:8)。本发明的一种优选实施方式涉及如本文所述的免疫毒素,其中所述毒素包含假单胞菌外毒素a的结合域(域ii,seq id no:6)和adp-核糖基化域(域iii,seq id no:8)。
174.在假单胞菌外毒素a的变体中,c末端被修饰以增加细胞毒性。因此,本发明的一种实施方式涉及如本文所述的免疫毒素,其中adp-核糖基化域的c-末端氨基酸序列redlk(seq id no:15)被氨基酸序列kdel(seq id no:16)代替。本发明的一种优选实施方式涉及如本文所述的免疫毒素,其中所述毒素是pe38kdel(seq id no:9)。
175.本发明的另一种优选实施方式涉及如本文所述的免疫毒素,其中所述免疫毒素包括seq id no:9和seq id no:2。一种免疫毒素,包括以下部分的组合:(i)靶向部分,为seq id no:1,其中第49位的氨基酸残基被丙氨酸(a)残基代替,n-末端第1-6位的氨基酸残基被氨基酸序列ilndgvs代替,以及(ii)毒素,为pe38kdel,如seq id no:10所示。因此,本发明的另一种优选实施方式涉及如本文所述的免疫毒素,其中所述免疫毒素包括seq id no:10。
176.如本文实施例中所证明的,与表达cx3cr1的细胞相比,本文描述的免疫毒素对表达us28的细胞显示出惊人的高效力。因此,本发明的一种实施方式涉及如本文所述的免疫毒素,其中与针对表达cx3cr1的细胞的效力相比,免疫毒素针对表达us28的细胞具有增加的效力,例如效力增加到至少150倍,例如175倍,或例如至少200倍,例如至少225倍,例如至少250倍。
177.本文所述的免疫毒素旨在用于医疗用途,因此可形成药物组合物的一部分。出于医疗用途的目的,免疫毒素可配制成药学上可接受的盐。药物组合物可包含用于医疗用途的标准成分且是本领域技术人员已知的成分。因此,本发明的一个方面涉及包含如本文所述的免疫毒素或其药学上可接受的盐的药物组合物。本发明的另一种实施方式涉及如本文所述的药物组合物,其中所述组合物包含药学上可接受的载体、稀释剂和/或赋形剂。
178.本发明的一个方面涉及本文所述的免疫毒素或本文所述的药物组合物作为药物使用。优选地,本文所述的免疫毒素用于治疗或预防cmv感染。免疫毒素以有效量施用于有需要的个体。所述个体是指任何感染cmv的人或任何有感染cmv风险的人。
179.因此,本发明的另一方面涉及本文所述的免疫毒素或本文所述的药物组合物用于治疗或预防cmv感染或cmv相关疾病。本发明的一种实施方式涉及本文所述的免疫毒素的用途,其中cmv感染或cmv相关疾病的治疗或预防是(i)在患者体内或(ii)在离体的细胞或器官中。
180.免疫毒素也可以是药物制剂中的成分。因此,本发明的一种实施方式涉及本文所述的免疫毒素在制备用于治疗或预防cmv感染或cmv相关疾病的药物中的用途。
181.cmv感染可能发生在身体内的各个部位,两个总体的分组是组织和体液。因此,本发明的一种实施方式涉及如本文所述使用的免疫毒素或药物组合物,其中cmv感染存在于:
182.i)组织,选自视网膜、角膜、心脏、肝脏、肾脏、肺、胃肠组织、胸腺、脾脏、皮肤和肌肉中的一种或多种,和/或
183.ii)体液,选自唾液、血液、尿液、精液和母乳中的一种或多种。
184.cmv是一种非常常见的大多数个体在一生中都感染过的病毒。因此,世界上的大多数人口很可能已经产生了针对该病毒的抗体,并且在大多数情况下未出现初次感染后的症状。然而,病毒在宿主体内处于休眠状态,一旦免疫系统减弱,病毒就有可能从潜伏期苏醒。因此,cmv是一种对免疫系统较弱的个体构成巨大风险的病毒。因此,本发明的一种实施方式涉及如本文所述使用的免疫毒素或药物组合物,其中cmv感染是免疫不足患者的感染。本发明的另一种实施方式涉及如本文所述使用的免疫毒素或药物组合物,其中cmv感染是选自以下免疫不足患者的感染:hiv患者、新生儿和免疫抑制患者、骨髓移植患者、实体器官移植患者、免疫治疗患者、癌症患者、重症监护患者、创伤患者、干细胞患者、基因治疗患者、细胞治疗患者、老年患者和多病患者。本发明的另一种实施方式涉及如本文所述使用的免疫毒素或药物组合物,其中cmv感染是处于风险/或预计成为免疫不足的个体中的感染。本发明的另一种实施方式涉及如本文所述使用的免疫毒素或药物组合物,其中cmv感染是患有冠状动脉疾病和/或血管疾病的患者的感染。本发明的另一种实施方式涉及如本文所述使用的免疫毒素或药物组合物,其中cmv感染是潜伏的cmv感染。
185.免疫毒素可以通过任何常规途径给药。因此,本发明的一种实施方式涉及如本文所述使用的免疫毒素或药物组合物,其中免疫毒素或药物组合物通过选自以下一种或多种途径给药:口服、肠胃外、静脉内、皮内、皮下和局部给药。本发明的另一种实施方式涉及如本文所述使用的免疫毒素或药物组合物,其中将免疫毒素或药物组合物施用于离体的细胞或器官。
186.免疫毒素可以是联合治疗的一部分,其中施用一种或多种额外的治疗剂。因此,本发明的一种实施方式涉及如本文所述使用的免疫毒素或药物组合物,其中免疫毒素或药物组合物用于与一种或多种额外的治疗剂同时、分开或顺序给药。本发明的另一种实施方式涉及如本文所述使用的免疫毒素或药物组合物,其中所述治疗剂选自抗病毒剂、免疫抑制剂和调节剂。
187.免疫毒素可以与其他治疗剂包装在一起,以便于作为联合疗法给药。因此,本发明的一个方面涉及一种药盒,包括:
188.i)如本文所述的免疫毒素或如本文所述的药物组合物,
189.ii)一种或多种额外的治疗剂,和
190.iii)可选地,使用说明,
191.其中i)和ii)用于同时、分开或顺序给药。
192.优选使用重组表达系统产生免疫毒素。适宜的重组表达系统是本领域技术人员已知的。对于重组表达需要:编码目标肽序列的核酸、表达载体和表达系统(用于重组表达的细胞系)。因此,本发明的一个方面涉及包含编码如本文所述的免疫毒素的序列的核酸序列。本发明的一种实施方式涉及一种核酸,其中所述核酸序列选自:
193.i)seq id no:20,或
194.ii)与seq id no:20具有至少90%序列同一性的核酸序列,例如与seq id no:20有至少95%,例如至少96%,例如至少97%,例如至少98%,例如至少99%的序列同一性。
195.将编码免疫毒素各个部分的核酸在表达载体中组装以引入到表达系统,即细胞中。因此,本发明的另一方面涉及一种重组表达载体,其包含如本文所述的核苷酸序列,该序列可操作地连接至一个或多个适于指导在适合的宿主中产生免疫毒素的控制序列。
196.使用任何常规方法将表达载体引入宿主细胞,并调整条件以利于目标肽序列的重组表达。因此,本发明的一个方面涉及一种包含如本文所述的表达载体的重组宿主细胞。本发明的另一方面涉及产生如本文所述的免疫毒素的方法,包括步骤:
197.i)提供如本文所述的宿主细胞,
198.ii)在适宜表达所述免疫毒素的条件下培养所述宿主细胞;和
199.iii)分离所述免疫毒素。
200.本发明的一种实施方式涉及如本文所述的方法,其中宿主细胞是真核的或原核的。
201.应当注意,在本发明的一个方面的上下文中描述的实施方式和特征也适用于本发明的其他方面。本发明的实施例方式和特征在以下项目中也进行了概述。
202.项目
203.1、一种免疫毒素,包括:
204.i)靶向部分,包括选自以下的氨基酸序列:
205.a)seq id no:1,或
206.b)与seq id no:1具有至少80%序列同一性的氨基酸序列,和ii)毒素,
207.其中第49位的氨基酸残基被丙氨酸(a)残基代替,在n末端第1-6位的氨基酸残基被氨基酸序列ildngvs代替。
208.2、根据项目1所述的免疫毒素,其中(b)的氨基酸序列与seq id no:1具有至少90%的序列同一性,例如与seq id no:1有至少95%,例如至少96%,例如至少97%,例如至少98%,例如至少99%的序列同一性。
209.3、根据前述任一项目所述的免疫毒素,其中靶向部分包括seq id no:2。
210.4、根据前述任一项目所述的免疫毒素,其中所述靶向部分的氨基酸还包括甲硫氨酸(m)残基作为从n末端开始的第一个氨基酸。
211.5、根据前述任一项目所述的免疫毒素,其中所述靶向部分与us28受体结合。
212.6、根据项目5所述的免疫毒素,其中所述us28受体包括选自以下的氨基酸序列:
213.i)seq id no:3,或
214.ii)与seq id no:3具有至少80%序列同一性的氨基酸序列。
215.7、根据前述任一项目所述的免疫毒素,其中所述免疫毒素结合us28的ki为10-7
m或更小,例如10-8
m或更小,例如10-9
m或更小,例如10-10
m或更小,例如10-11
m或更小。
216.8、根据前述任一项目所述的免疫毒素,其中与cx3cl1(seq id no:1)对cx3cr1的亲和力相比,所述免疫毒素对人同源受体cx3cr1的亲和力降低,例如降低到至少1/100,例如至少1/150,例如1/200,或例如至少1/250。
217.9、根据前述任一项目所述的免疫毒素,其中所述免疫毒素结合cx3cr1的ki为10-6
或更高。
218.10、根据前述任一项目所述的免疫毒素,其中与对cx3cr1的亲和力相比,所述免疫毒素对us28的亲和力增加,例如亲和力增加到至少75倍,例如至少100倍,例如至少150倍,例如200倍,或例如至少250倍。
219.11、根据前述项目8-10任一项所述的免疫毒素,其中所述cx3cr1受体包括seq id no:4所示的氨基酸序列。
220.12、根据前述任一项目所述的免疫毒素,其中所述免疫毒素在结合us28之后被内化。
221.13、根据前述任一项目所述的免疫毒素,其中所述毒素选自假单胞菌外毒素a、白树毒素、布加宁、皂草素、蓖麻毒素、蓖麻毒素a链、异株泻根毒蛋白、白喉、局限曲霉素和白喉毒素,及其片段或变体的一种或多种。
222.14、根据前述任一项目所述的免疫毒素,其中所述毒素是假单胞菌外毒素a(seq id no:5)或其片段。
223.15、根据项目14所述的免疫毒素,其中所述毒素包括选自假单胞菌外毒素a的结合域(域ii,seq id no:6)、中间域(域ib,seq id no:7)和adp-核糖基化域(域iii,seq id no:8)的一个或多个片段。
224.16、根据项目15所述的免疫毒素,其中所述adp-核糖基化域的c末端氨基酸序列redlk(seq id no:15)被氨基酸序列kdel(seq id no:16)代替。
225.17、根据项目16所述的免疫毒素,其中所述毒素是pe38kdel(seq id no:9)。
226.18、根据前述任一项目所述的免疫毒素,其中所述免疫毒素包括seq id no:9和seq id no:2。
227.19、根据前述任一项目所述的免疫毒素,其中所述免疫毒素包括seq id no:10。
228.20、根据前述任一项目所述的免疫毒素,其中与针对表达cx3cr1的细胞的效力相比,所述免疫毒素针对表达us28的细胞具有增加的效力,例如效力增加到至少150倍,例如175倍,或例如至少200倍,例如至少225倍,例如至少250倍。
229.21、一种药物组合物,包括前述任一项目所述的免疫毒素或其药学上可接受的盐。
230.22、根据项目21所述的免疫毒素,其中所述组合物包括药学上可接受的载体、稀释剂和/或赋形剂。
231.23、根据项目1-20任一项所述的免疫毒素或根据项目21或22任一项所述的药物组合物用作药物。
232.24、根据项目1-20任一项所述的免疫毒素或根据项目21或22任一项所述的药物组合物用于治疗或预防cmv感染或cmv相关疾病。
233.25、根据项目24使用的免疫毒素或药物组合物,其中所述cmv感染存在于:
234.i)组织,选自视网膜、角膜、心脏、肝脏、肾脏、肺、胃肠组织、胸腺、脾脏、皮肤和肌肉中的一种或多种,和/或
235.ii)体液,选自唾液、血液、尿液、精液和母乳中的一种或多种。
236.26、根据项目24或25任一项使用的免疫毒素或药物组合物,其中所述cmv感染是免疫不足患者的感染,其选自hiv患者、新生儿和免疫抑制患者、骨髓移植患者、实体器官移植患者、免疫治疗患者、癌症患者、重症监护患者、创伤患者、干细胞患者、基因治疗患者、细胞治疗患者、老年患者和多病患者。
237.27、根据项目24或25任一项使用的免疫毒素或药物组合物,其中所述cmv感染是患有冠状动脉疾病和/或血管疾病的患者的感染。
238.28、根据项目24-27任一项使用的免疫毒素或药物组合物,其中所述cmv感染是潜伏的cmv感染。
239.29、根据项目23-28任一项使用的免疫毒素或药物组合物,其中所述免疫毒素或药物组合物通过选自口服、肠胃外、静脉内、皮内、皮下和局部给药的一种或多种途径给药。
240.30、根据项目23-29任一项使用的免疫毒素或药物组合物,其中所述免疫毒素或药物组合物用于与一种或多种额外的治疗剂同时、分开或顺序给药。
241.31、根据项目30使用的免疫毒素或药物组合物,其中所述治疗剂选自抗病毒剂、免疫抑制剂和调节剂。
242.32、一种药盒,包括:
243.i)根据项目1-20任一项所述的免疫毒素或根据项目21或22所述的药物组合物,
244.ii)一种或多种额外的治疗剂,和
245.iii)可选地,使用说明,
246.其中i)和ii)用于同时、分开或顺序给药。
247.33、一种核酸序列,包括编码项目1-20任一项所述的免疫毒素的序列。
248.34、一种重组表达载体,包括项目33所述的核苷酸序列,该序列可操作地连接一个或多个适于指导在适合的宿主中产生免疫毒素的控制序列。
249.35、一种重组宿主细胞,包括项目34所述的表达载体。
250.36、一种产生项目1-20任一项所述的免疫毒素的方法,包括步骤:
251.i)提供项目35所述的宿主细胞,
252.ii)在适合表达所述免疫毒素的条件下培养所述宿主细胞;和
253.iii)分离所述免疫毒素。
254.本技术中引用的所有专利和非专利参考文献均将其全部内容作为参考引入本文。
255.现在将在以下非限制性实施例中更详细地描述本发明。
256.实施例
257.实施例1-融合蛋白syn000、syn001、syn003和syn004的制备
258.免疫毒素的结构
259.本文公开了一系列旨在特异性靶向us28的免疫毒素。它们基于趋化因子cx3cl1(fractalkine)和铜绿假单胞菌(pseudomonas aeruginosa)的外毒素a(二者均如图7所示)。候选药物syn000(seq id no:17)、syn001(seq id no:18)、syn003(seq id no:19)和syn004(seq id no:10)都是由大约400个氨基酸和域结构组成的单多肽链,如图8所示。
260.免疫毒素的生产
261.免疫毒素在大肠杆菌(e.coli)中以不溶性蛋白聚集体(包涵体,ib)的形式生产。药物物质制造过程包括三个加工阶段:细胞培养和收获、回收和纯化。e.coli培养步骤是产生含有高水平药物物质的ib。通过一系列洗涤和离心来回收ib。纯化过程包括ib溶解、通过对含有氧化还原对的磷酸盐缓冲液进行透析来重折叠,然后进行aex和gf色谱方法,以获得纯的药物物质。
262.实施例2-syn000、syn001、syn003和syn004对us28和cx3cr1的亲和力(ki值)
8.36)与syn000(log k
i-8.67)相比,降低到1/2;syn004(log k
i-7.36)与syn001(log k
i-7.96)相比,降低到1/4。相比之下,n末端氨基酸序列适度增加了对cx3cr1的亲和力,syn003(log k
i-7.72)与syn000(log k
i-6.86)相比,增加到7倍;syn004(log k
i-5.22)与syn001(log k
i-5.00)相比,增加到1.7倍。
272.结论
273.总的来说,在免疫毒素中引入n末端氨基酸序列(f1突变)降低了对us28的亲和力并增加了对cx3cr1的亲和力。因此,在偏好us28超过cx3cr1方面,syn003和syn004的选择性低于syn000和syn001(倍数变化小于1,见表1)。
274.实施例3-syn000、syn001、syn003和syn004对诱导的us28 hek293细胞和诱导的cx3cr1 hek293细胞的效力
275.体外效力
276.us28-hek293细胞和cx3cr1-hek293细胞的稳定可诱导型克隆在10%co2和37℃的加湿培养箱中,在含有10%胎牛血清和180单位/ml青霉素和45μg/ml链霉素的dulbecco改良的eagle培养基(dmem)glutamax(gibcor)中生长。将细胞以每孔11,000个细胞接种在聚d-赖氨酸(invitrogen)包被的96孔组织培养板(nunc)中的100μl生长培养基中。接种24h后,用0.125μg/ml(us28)和0.5μg/ml(cx3cr1)诱导受体表达。受体诱导后1天,将不同浓度的指定免疫毒素(0.01μm
–
0.1pm)和缓冲液(模拟处理)加入终体积为100μl的生长培养基中,并在37℃孵育24小时。为了估计细胞活力,将alamarblue(invitrogen)与生长培养基以1:10混合用于孵育细胞,每孔100μl,在37℃孵育4小时。使用flexstation3(molecular devices)读板器收集数据,其中通过在540nm波长激发并在585nm波长读取发射来测量荧光。测定不同浓度的免疫毒素下的细胞活力,并在50%细胞活力时提取ic50值。相应的参考值是在存在放线菌酮(0%细胞活力)和不存在免疫毒素或放线菌酮(100%细胞活力)的情况下获得的。
277.结果
278.图5和6以及表2显示了syn000、syn001、syn003和syn004的效力。在us28上,效力相似,syn000、syn003和syn004在us28上的效力略高于syn001。在cx3cr1上,效力差异很大,syn003和syn000的效力高于syn001和syn004,而syn004对cx3cr1的效力略低于syn001。
279.效力可用于计算每种免疫毒素的杀伤特异性,即免疫毒素特异性杀伤表达us28的细胞超过表达cx3cr1的细胞的能力。杀伤特异性报告为表中的倍数变化,并且显示syn000为8.91倍变化、syn003为7.08倍变化、syn001为501倍变化和syn004为1175倍变化。
280.表2.免疫毒素的效力
281.[0282][0283]
结论
[0284]
结果表明,将f1序列加到syn000(产生syn003)不会增加杀伤特异性(比率小于1,见表2),而将f1序列加到syn001(产生syn004)会使杀伤特异性增加到2.35倍。因此,尽管具有降低的选择性(参见实施例2),但syn004令人惊讶地代表了显著改进的免疫毒素,即具有增加的杀伤特异性。
[0285]
参考文献:
[0286]
wo2008/003327
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1