猪圆环病毒2型VLP疫苗的制作方法
猪圆环病毒2型vlp疫苗
技术领域
1.本发明涉及一种融合蛋白、含该融合蛋白的病毒样颗粒(vlp:virus-like particles)以及含该vlp的疫苗。本发明还涉及一种上述融合蛋白的制造方法。
背景技术:
2.由于猪圆环病毒2型(pcv2:porcine circovirus 2)感染猪时,会诱发免疫缺陷并提高对其他传染病的易感性,因此pcv2传染病对策对养猪户很重要。被pcv2感染的猪会出现猪圆环病毒相关疾病(pcvad:porcine circovirus associated diseases)病症,作为其主要症状的断奶后多系统消耗综合征(pmws:postweaning multisystemic wasting syndrome)好发于5~6周龄的猪,临床特征为消瘦、皮肤苍白、发育不全、呼吸困难、腹泻和黄疸(非专利文献2)。作为该致病病毒的pcv2首次从加拿大西部出现pmws病症的猪中被分离出来(非专利文献3)。
3.pcv2是一种在基因组中具有单链环状dna且直径约20nm的无包膜病毒。pcv2具有三个开放阅读框(orfs(open reading frames):orf1、orf2、orf3),orf2编码衣壳蛋白(cap(capsid protein))。已知cap通过将该单体60个缔合而形成作为正二十面体的多聚体分子的病毒样颗粒(非专利文献1)。由于vlp不含病毒基因组dna因此不能够增殖,能够应用于用于预防感染pcv2的疫苗。
4.作为用于预防感染pcv2的疫苗,pcv2灭活疫苗“circovac(注册商标)”、pcv1/pcv2嵌合病毒灭活疫苗“subakisin(注册商标)pcv2”已上市。另外,除了这些灭活疫苗以外,在基因重组杆状病毒/昆虫细胞表达系统中产生cap的vlp疫苗“porcilis(注册商标)pcv”(非专利文献4)和“ingelvac circoflex(注册商标)”(专利文献1)等已实用化。
5.此外,尝试作为表达系统,使用毕赤酵母(pichia pastoris)、芽殖酵母(saccharomyces cerevisiae)和大肠杆菌(escherichia coli)等,来产生pcv2的cap(非专利文献1、5~13)。
6.此外,在非专利文献16中,报告了与免疫球蛋白结合域(ibd:immunoglobulin-binding domain)融合的抗原,被高效转运至淋巴滤泡,并提高该抗原的免疫原性。
7.另外,在非专利文献17中,作为ibd,记载有z域。z域是来自黄色葡萄球菌的蛋白a的ibd,具有被称作3-螺旋束(three-helix bundle)的将3根α-螺旋折叠成束(bundled)的蛋白质三维结构。需要说明的是,蛋白a是黄色葡萄球菌的病原因子之一,是存在于菌体外膜上的42kda的蛋白质。另外,蛋白a具有一级序列相似性高的5个ibds(e、d、a、b和c域)。需要说明的是,z域是在b域中的两处导入氨基酸取代而制作的人工序列。
8.现有技术文献
9.专利文献
10.专利文献1:日本公开专利公报“日本特表2008-526212号公报”。
11.非专利文献
12.非专利文献1:khayat r.et al.,j.virol.2011,85,7856-7862。
13.非专利文献2:harding j.c.s.et al.,swine health prod.1997,5,201-203。
14.非专利文献3:ellis j.et al.,can.vet.j.1998,39,44-51。
15.非专利文献4:liu l.-j.et al.,arch.virol.2008,153,2291-2295。
16.非专利文献5:tu y.et al.,appl.microbiol.biotechnol.2013,97,2867-2875。
17.非专利文献6:zaveckas m.et al.,j.chromatogr.b 2015,991,21-28。
18.非专利文献7:marcekova z.et al.,j.virol.methods 2009,162,133-141。
19.非专利文献8:liu q.et al.,protein expr.purif.2001,21,115-120。
20.非专利文献9:yin s.et al.,virol.j.2010,7,166。
21.非专利文献10:wu pc et al.,appl.microbiol.biotechnol.2012,95,1501-1507。
22.非专利文献11:wu pc et al.,j.biotechnol.2016,220,78-85。
23.非专利文献12:zhang y.et al.,arch.virol.2016,161,1485-1491。
24.非专利文献13:xi x.et al.,j.biotechnol.2016,223,8-12。
25.非专利文献14:wang n.et al.,j.virol.methods 2017,243,146-150。
26.非专利文献15:burroughs a.m.et al.,biol.direct 2007,2,18。
27.非专利文献16:miyata t.et al.,infect.immun.2011,79,4260-4275。
28.非专利文献17:bjorn n.et al.,protein eng.1987,1,107-113。
技术实现要素:
29.发明要解决的课题
30.如上所述,作为pcv2的预防感染药,几种疫苗已经上市,但存在pcv2即使感染培养细胞也难以获得高病毒滴度的问题。
31.另外,在作为用于产生pcv2的cap的表达系统使用基因重组杆状病毒/昆虫细胞表达系统的情况下,在成本和操作繁杂方面存在课题。除此之外,由该表达系统中产生的cap形成的vlp,还存在对物理化学负荷的分子稳定性方面的课题,存在难以长期稳定地保存的问题。
32.此外,在作为用于产生pcv2的cap的表达系统使用大肠杆菌表达系统的情况下,由于表达蛋白质成为不溶性凝集体(包涵体:inclusion bodies)并积累在菌体内,因此未报告vlp在大肠杆菌细胞质内自发重建(自然缔合),并作为可溶性vlp蛋白质被回收的例子。
33.因此,需要进一步开发pcv2疫苗。
34.本发明是鉴于上述问题点而完成的,其目的是提供一种能用作畜产领域中使用的疫苗,并且对物理化学负荷具有高分子稳定性的pcv2的vlp及其利用技术。
35.用于解决课题的手段
36.本发明人潜心研究上述课题的结果,发现了(i)pcv2的cap与ibd的融合蛋白(cap-ibd融合蛋白)在大肠杆菌表达宿主的细胞质内自然缔合,不经过体外的人工缔合工序就能够形成vlp;(ii)这样形成的vlp对加热处理或长时间低温/冷冻保存等物理化学负荷具有分子稳定性;以及(iii)获得的vlp能够用作疫苗等新的见解,从而完成本发明。
37.即,本发明的一方案涉及一种融合蛋白,其具有猪圆环病毒2型的衣壳蛋白和免疫球蛋白结合域。
38.另外,本发明的另一方案涉及一种制造方法,其是具有猪圆环病毒2型的衣壳蛋白和免疫球蛋白结合域的融合蛋白的制造方法,其中,包含:制备包含编码上述猪圆环病毒2型的衣壳蛋白与免疫球蛋白结合域的融合蛋白的核酸的表达载体的工序;以及将上述表达载体导入大肠杆菌以表达上述融合蛋白的工序。
39.发明的效果
40.根据本发明的一方案,能够提供一种能用作畜产领域中使用的疫苗,并且对物理化学负荷具有高分子稳定性的pcv2的vlp及其利用技术。
附图说明
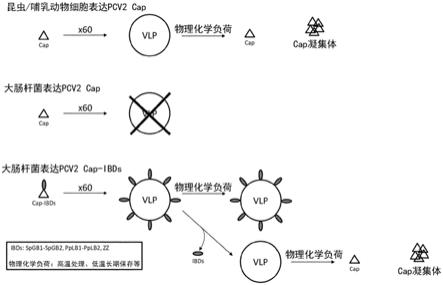
41.图1是说明由pcv2的cap形成vlp中的现有技术的问题点和本发明的特征点的示意图。
42.图2是增溶标签(sumo)和ibds(spgb、pplb、z)的蛋白质结构,以及β-抓握折叠结构和3-螺旋束结构的示意图。
43.图3是表示实施例中回收的融合蛋白中的cap和ibds(spgb1-b2、pplb1-b2、zz)或增溶标签(sumo)配置的示意图。
44.图4是pcv2的cap-spgb1-b2的vlp的电子显微镜照片。
45.图5是pcv2的cap-pplb1-b2的vlp的电子显微镜照片。
46.图6是pcv2的cap-zz的vlp的电子显微镜照片。
47.图7是pcv2的cap-sumo的vlp的电子显微镜照片。
48.图8是表示在对pcv2的cap-zz的vlp进行加热处理前后的凝胶过滤色谱的分析结果的色谱图。
49.图9是表示在对zz从pcv2的cap-zz的vlp表层解离后的vlp进行加热处理前后的凝胶过滤色谱的分析结果的色谱图。
50.图10是在pbs溶液(磷酸缓冲盐溶液)中于4℃保存1年后的pcv2的cap-zz的vlp的电子显微镜照片。
51.图11是在pbs溶液中于-30℃保存1年后的pcv2的cap-zz的vlp的电子显微镜照片。
52.图12是在pbs溶液中于-80℃保存1年后的pcv2的cap-zz的vlp的电子显微镜照片。
53.图13是表示血清中的病毒拷贝数测定结果的图表。
54.图14是表示淋巴结中的病毒拷贝数测定结果的图表。
具体实施方式
55.〔现有技术的问题点和本发明的内容〕
56.如上所述,关于pcv2疫苗的现有技术中存在各种问题。
57.例如,如在非专利文献14中报告所示,在使用大肠杆菌表达系统的情况下,由该表达系统中产生的cap形成的vlp,存在分子对于物理化学负荷不稳定的问题。根据该文献,在将pcv2的cap的vlp在pbs溶液中于4℃保存时,其粒子形状连仅仅1个月都无法保持,为了长时间保存,需要使用混合了含15%海藻糖等的多种化合物的特殊溶液。
58.另外,在非专利文献5中记载的毕赤酵母表达系统中,没有由产生的cap形成vlp的证据。另外,在非专利文献6中记载的芽殖酵母表达系统中,由产生的cap形成的vlp的形状
有变形。
59.此外,非专利文献1、7~13中记载的大肠杆菌表达系统,在成本方面和操作简便性方面具有魅力,但在vlp等结构复杂的多聚体分子的表达中仍存在很多课题。
60.具体而言,大肠杆菌表达系统中表达的外源蛋白的大部分,大多成为不溶性凝集体(包涵体:inclusion bodies)并积累在菌体内。另外,由于成为包涵体的外源蛋白不具有天然三维结构,因此其大多数无法作为有效的疫苗发挥功能。作为将成为包涵体的外源蛋白重绕成天然三维结构的方法,已知重折叠法,在上述几个大肠杆菌表达系统中,尝试用胍盐酸盐等变性剂使从包涵体回收的pcv2的cap溶解,并通过透析法等重折叠。
61.另一方面,作为将外源蛋白作为可溶性蛋白质表达的方法,通常使用将目的蛋白质与增溶标签融合的方法。作为这样的增溶标签,已知gst(谷胱甘肽s转移酶,glutathione s-transferase)和mbp(麦芽糖结合蛋白,maltose-binding protein),以及具有β-抓握折叠结构(将1根α-螺旋被1个β-折叠抓握(grasped)成的蛋白质结构)的sumo(小泛素样修饰物,small ubiquitin-like modifier)(非专利文献15)等。在将这些增溶标签主要与目的蛋白质的n末端融合并表达时,存在能够从大肠杆菌表达宿主的可溶性级分回收该融合蛋白的情况。在上述几个大肠杆菌表达系统中,尝试在pcv2的cap的n末端融合增溶标签,并作为可溶性蛋白质回收。但是,由回收的可溶性cap形成能够作为疫苗发挥功能的vlp中存在很多问题。
62.例如,在非专利文献1中记载的大肠杆菌表达系统中,为了由作为可溶性蛋白质表达的pcv2的cap形成vlp,需要镍亲和纯化或此后在体外更换缓冲液等繁杂的操作工序。
63.另外,在非专利文献7中记载的大肠杆菌表达系统中,相同地,虽然表达出作为可溶性蛋白质的pcv2的cap,但即使对获得的cap实施离子交换色谱等后处理,也不形成vlp。
64.在非专利文献8中记载的大肠杆菌表达系统中,在pcv2的cap的n末端融合作为增溶标签的gst或mbp。但是,gst-cap融合蛋白仅被检测为分解产物。另外,mbp-cap融合蛋白虽然作为可溶性蛋白质表达,但即使经过此后的亲和纯化工序,也未在体外形成vlp。
65.在非专利文献9中记载的大肠杆菌表达系统中,在pcv2的cap的n末端融合作为增溶标签的sumo。其结果是,虽然表达了可溶性的sumo-cap融合蛋白,但该融合蛋白通过自然(自身)缔合未形成vlp。因此,尝试通过sumo蛋白酶切割/除去sumo标签,对获得的cap实施透析处理等繁杂的后处理,以在体外形成vlp。但是,形成的vlp在形态上与天然pcv2粒子不同,具有粒子形状变形和粒径不均匀性等问题。
66.在非专利文献10和11中记载的大肠杆菌表达系统中,尝试仅使用完全不包含融合标签等的天然cap序列来形成vlp。但是,获得的vlp非常少量,且需要蔗糖密度梯度离心法(非专利文献10)或凝胶过滤色谱法(非专利文献11)等纯化处理等。另外,形成的vlp与非专利文献9的vlp相同地,在形态上存在问题。
67.在非专利文献12中记载的大肠杆菌表达系统中,尝试由表达的可溶性cap形成vlp,但与上述相同地,需要各种繁杂的操作工序。
68.非专利文献13中记载的大肠杆菌表达系统是仅限于特定基因型pcv2的方法,另外,为了促进由表达的可溶性cap在体外形成vlp,必须有缓冲液更换等操作工序。
69.即,上述非专利文献1和7~13的大肠杆菌表达系统,尝试通过增溶标签的融合或其他操作在体外重建vlp。但是,在任一项中,都必须有缓冲液更换等各种繁杂的操作工序。
另外,形成的vlp大多存在粒子形状变形、粒径不均匀性、形成凝集块等问题。
70.为了制造畜产领域中使用的疫苗,需要开发一种大肠杆菌表达系统,其不需要繁杂的操作工序,就能够制造不发生粒子形状变形等且具有良好形态的vlp。作为省略繁杂的操作工序的方法,考虑通过在大肠杆菌表达宿主的细胞内使可溶性cap自然(自身)缔合,在大肠杆菌表达宿主中自发形成vlp。由此,不经过体外的人工缔合工序就能够回收具有良好形态的vlp。
71.据报告,天然pcv2的vlp中,cap的n末端位于粒子的内腔侧,c末端位于表层侧(非专利文献1)。但是,由于已经报告的增溶标签与cap的n末端融合,因此使cap自然缔合存在物理限制。因此,在使用这样的增溶标签的大肠杆菌表达系统中,难以使cap自然缔合。
72.本发明人为解决上述问题而潜心研究期间获得新的见解,基于此,成功开发了新的pcv2疫苗。
73.使用图1一边与现有技术比较一边说明本发明内容。
74.图1的上段和中段示出由pcv2的cap形成vlp的现有技术,图1的下段示出由pcv2的cap形成vlp的本发明的特征点。
75.如图1的上段所示,在以昆虫细胞或哺乳动物细胞为宿主的pcv2的cap表达系统中,可溶性cap被表达,在表达宿主的细胞内自然(自身)缔合并形成vlp。但是,当赋予低温长期保存等物理化学负荷时,该vlp不能够保持原来的粒子形状,引发崩解成cap单体或形成凝集体(cap aggregates)。
76.另外,如图1的中段所示,在以大肠杆菌为宿主的pcv2的cap表达系统中,例如即使cap作为可溶性蛋白质表达,在其细胞内自然(自身)缔合本身就非常困难,并且在体外没有繁杂的操作工序就不能够形成vlp。
77.另一方面,如图1的下段所示,可知在本发明中,在以大肠杆菌为宿主的pcv2的cap表达系统中,在表达cap-ibd融合蛋白时,与昆虫/哺乳动物细胞表达系统相同地,在表达宿主的细胞内,cap自然(自身)缔合并形成vlp。此外,还可知形成的vlp与上述昆虫/哺乳动物细胞表达系统中形成的vlp不同,对物理化学负荷具有良好的分子稳定性(长期低温保存稳定性等)。但是,可知当ibds从这样形成的vlp的表层解离时,与上述昆虫/哺乳动物细胞表达系统中形成的vlp相同地,vlp会因施加物理化学负荷而崩解。即,可知通过使cap与ibd融合,新赋予了(1)“vlp形成促进功能”和(2)“vlp崩解抑制功能”。
78.〔融合蛋白和病毒样颗粒(vlp)〕
79.本发明的一实施方式的融合蛋白是具有pcv2的cap和ibd的融合蛋白(也称作“cap-ibd融合蛋白”)。
80.另外,本发明的一实施方式的pcv2的vlp是通过缔合复数个cap-ibd融合蛋白而形成的多聚体分子。
81.cap-ibd融合蛋白通过大肠杆菌表达系统作为可溶性蛋白质表达,能够在大肠杆菌表达宿主的细胞内自然(自身)缔合并自发地形成vlp。
82.在本说明书中,“vlp”是指具有与天然病毒相似的形状的粒子,且是非感染性的粒子。如上所述,由于vlp是具有与天然病毒相似形状的粒子,因此示出与天然病毒的免疫学上的交叉反应性,并作为有效的疫苗发挥功能。需要说明的是,由于vlp缺乏病毒基因组,因此是非增殖性/非感染性的,安全性非常高。
83.在本说明书中,“cap”是指pcv2的衣壳蛋白。
84.在本发明的一实施方式中,cap能够是由以下(1)~(3)所示的蛋白质、以下(4)或(5)所示的多聚核苷酸构成的基因编码的蛋白质。
85.(1)由序列号1表示的氨基酸序列构成的蛋白质。
86.(2)由序列号1表示的氨基酸序列中的一个或几个氨基酸缺失、取代或加成的氨基酸序列构成,且具有形成vlp的功能的蛋白质。
87.(3)由与序列号1表示的氨基酸序列具有90%以上的序列同一性的氨基酸序列构成,且具有形成vlp的功能的蛋白质。
88.(4)由序列号2表示的碱基序列构成的多聚核苷酸。
89.或者,(5)在严格的条件下与由与序列号2表示的碱基序列构成的多聚核苷酸互补的碱基序列构成的dna杂交,且编码具有形成vlp的功能的蛋白质的多聚核苷酸。
90.关于pcv2的cap是否是具有形成vlp的功能的蛋白质,如果将该蛋白质与本发明的一实施方式中的ibd形成融合蛋白,并在大肠杆菌中表达该融合蛋白时形成vlp,那么就能够判定是具有形成vlp的功能的蛋白质。
91.关于上述(3)的蛋白质,序列同一性越高越优选,例如,可以为91%以上、92%以上、93%以上、94%以上、95%以上、96%以上、97%以上、98%以上或99%以上。需要说明的是,例如,能够根据该商品的产品手册使用genetyx ver.14(基因技术株式会社(genetyx)制的商品名)并算出氨基酸序列的序列同一性。需要说明的是,后述的下述(8)、(13)和(18)的蛋白质的同一性也相同。
92.本说明书中的“一个或几个氨基酸缺失、取代或加成的氨基酸”中,发生缺失、取代或加成的位置没有特别限定。
93.另外,“一个或几个氨基酸”指的氨基酸的数量没有特别限定,但氨基酸能够为50个以内、40个以内、30个以内、20个以内、19个以内、18个以内、17个以内、16个以内、15个以内、14个以内、13个以内、12个以内、11个以内、10个以内、9个以内、8个以内、7个以内、6个以内、5个以内、4个以内、3个以内、2个以内或1个。
94.氨基酸的取代优选保守取代。需要说明的是,保守取代是指特定的氨基酸被具有与该氨基酸相同的化学性质和/或结构的其他氨基酸取代。作为化学性质,例如,可举出疏水性度(疏水性和亲水性)、电荷(中性、酸性和碱性)。作为结构,例如,可举出侧链或作为侧链的官能团存在的芳香环、脂肪烃基和羧基。
95.作为保守取代的例子,例如,可举出丝氨酸与苏氨酸的取代、赖氨酸与精氨酸的取代以及苯丙氨酸与色氨酸氨基的取代。当然,本发明不限定于这些取代。
96.在本说明书中使用的情况下,术语“严格的条件”是指在所谓的碱基序列中形成特异性的双链多聚核苷酸且不形成非特异性的双链多聚核苷酸的条件。换言之,相同性高的核酸之间,例如在完美匹配的杂交的溶解温度(tm值)至低15℃,优选低10℃,进一步优选低5℃的温度范围的温度条件下杂交的条件。
97.例如,举出一个例子,可举出在由0.25m na2hpo4、ph7.2、7%sds、1mm edta、1
×
登哈特溶液(denhardt)构成的缓冲液中,在温度为60~68℃,优选为65℃,进一步优选为68℃的条件下杂交16~24小时,进一步在由20mm na2hpo4、ph7.2、1%sds、1mm edta构成的缓冲液中,在温度为60~68℃,优选为65℃,进一步优选为68℃的条件下进行2次15分钟的洗涤
的条件。
98.作为其他例子,通过在含有25%甲酰胺更严格的条件为50%甲酰胺、4
×
ssc(氯化钠/柠檬酸钠)、50mm hepes(羟乙基哌嗪乙磺酸)ph7.0、10
×
登哈特溶液(denhardt)、20μg/ml变性鲑鱼精子dna的杂交溶液中,于42℃进行一晩预杂交后,添加标记的探针,于42℃保温一晩来进行杂交。能够在此后的洗涤中的洗涤液和温度条件约为“1
×
ssc、0.1%sds、37℃”,更严格的条件约为“0.5
×
ssc、0.1%sds、42℃”,进一步严格的条件约为“0.2
×
ssc、0.1%sds、65℃”的条件下实施。像这样杂交的洗涤条件越严格,杂交的特异性就越高。但是,上述ssc、sds和温度条件的组合是示例,只要是本领域技术人员,就能够通过适当组合确定杂交的严格性的上述或其他要素(例如,探针浓度、探针长度、杂交反应时间等),实现与上述相同的严格性。例如,这记载于sambrook等,molecular cloning,a laboratory manual,3rd ed.,cold spring harbor laboratory(2001)等中。
99.在本说明书中,“ibd”是指具有免疫球蛋白结合能力的多肽功能单元。作为本发明中优选使用的ibd,可举出具有β-抓握折叠结构的ibd和具有3-螺旋束结构的ibd。
100.作为具有β-抓握折叠结构的ibd,可举出蛋白g的b域(spgb)和蛋白l的b域(pplb)。
101.作为spgb,可举出蛋白g的b1域和b2域。在本发明的一实施方式中,能够尤其优选地使用b1域与b2域连接的spgb。
102.在本发明的一实施方式中,spgb能够是由以下(6)~(8)所示的蛋白质、以下(9)或(10)所示的多聚核苷酸构成的基因编码的蛋白质。
103.(6)由序列号3或5表示的氨基酸序列构成的蛋白质。
104.(7)由序列号3或5表示的氨基酸序列中的一个或几个氨基酸缺失、取代或加成的氨基酸序列构成,且具有形成vlp的功能的蛋白质。
105.(8)由与序列号3或5表示的氨基酸序列具有90%以上的序列同一性的氨基酸序列构成,且具有形成vlp的功能的蛋白质。
106.(9)由序列号4或6表示的碱基序列构成的多聚核苷酸。
107.或者,(10)在严格的条件下与由与序列号4或6表示的碱基序列构成的多聚核苷酸互补的碱基序列构成的dna杂交,且编码具有形成vlp的功能的蛋白质的多聚核苷酸。
108.关于spgb是否是具有形成vlp的功能的蛋白质,如果将该蛋白质与本发明的一实施方式中的pcv2的cap形成融合蛋白,并在大肠杆菌中表达该融合蛋白时形成vlp,那么就能够判定是具有形成vlp的功能的蛋白质。
109.作为pplb,可举出蛋白l的b1域和b2域。在本发明的一实施方式中,能够尤其优选地使用b1域与b2域连接的pplb。
110.在本发明的一实施方式中,pplb能够是由以下(11)~(13)所示的蛋白质、以下(14)或(15)所示的多聚核苷酸构成的基因编码的蛋白质。
111.(11)由序列号7或9表示的氨基酸序列构成的蛋白质。
112.(12)由序列号7或9表示的氨基酸序列中的一个或几个氨基酸缺失、取代或加成的氨基酸序列构成,且具有形成vlp的功能的蛋白质。
113.(13)由与序列号7或9表示的氨基酸序列具有90%以上的序列同一性的氨基酸序列构成,且具有形成vlp的功能的蛋白质。
114.(14)由序列号8或10表示的碱基序列构成的多聚核苷酸。
115.或者,(15)在严格的条件下与由与序列号8或10表示的碱基序列构成的多聚核苷酸互补的碱基序列构成的dna杂交,且编码具有形成vlp的功能的蛋白质的多聚核苷酸。
116.关于pplb是否是具有形成vlp的功能的蛋白质,如果将该蛋白质与本发明的一实施方式中的pcv2的cap形成融合蛋白,并在大肠杆菌中表达该融合蛋白时形成vlp,那么就能够判定是具有形成vlp的功能的蛋白质。
117.作为具有3-螺旋束结构的ibd,可举出蛋白a的z域(z)。z是在非专利文献17等中记载的,蛋白a的b域中的两处导入氨基酸取代而制作的人工多肽。
118.在本发明的一实施方式中,z能够是由以下(16)~(18)所示的蛋白质、以下(19)或(20)所示的多聚核苷酸构成的基因编码的蛋白质。
119.(16)由序列号11表示的氨基酸序列构成的蛋白质。
120.(17)由序列号11表示的氨基酸序列中的一个或几个氨基酸缺失、取代或加成的氨基酸序列构成,且具有形成vlp的功能的蛋白质。
121.(18)由与序列号11表示的氨基酸序列具有90%以上的序列同一性的氨基酸序列构成,且具有形成vlp的功能的蛋白质。
122.(19)由序列号12表示的碱基序列构成的多聚核苷酸。
123.或者,(20)在严格的条件下与由与序列号12表示的碱基序列构成的多聚核苷酸互补的碱基序列构成的dna杂交,且编码具有形成vlp的功能的蛋白质的多聚核苷酸。
124.关于z是否是具有形成vlp的功能的蛋白质,如果将该蛋白质与本发明的一实施方式中的pcv2的cap形成融合蛋白,并在大肠杆菌中表达该融合蛋白时形成vlp,那么就能够判定是具有形成vlp的功能的蛋白质。
125.在本发明的一实施方式中,与cap融合的ibd优选含有从spgb、pplb和z所组成的组中选择的域,尤其优选含有z。
126.图2示出增溶标签(sumo)和ibds(spgb、pplb、z)的蛋白质结构,以及β-抓握折叠结构和3-螺旋束结构的示意图。如图2所示,作为公知的增溶标签的sumo(96氨基酸残基)与spgb和pplb相同地具有β-抓握折叠结构。spgb、pplb和z由55~60个氨基酸残基构成,一级结构为sumo一半左右的大小。
127.由本发明可知,上述ibd具有通过与cap融合而使其成熟化这样的与原来的抗体结合能力完全不同的功能。需要说明的是,此处所说的cap的“成熟化”是指通过使cap在大肠杆菌表达宿主的细胞质内自然(自身)缔合,形成形态上与天然pcv2粒子极其相似的vlp。这样的vlp能够适宜用作用于预防感染pcv2的疫苗。另外,通过对对象动物给药或接种含该vlp的疫苗,能够诱导对感染性pcv2具有高抗原特异性的免疫,以获得病毒中和抗体诱导能力。其结果是,通过pcv2的vlp的疫苗接种,能够有效地抑制对象动物感染pcv2。
128.在本发明的一优选实施方式中,构成上述cap-ibd融合蛋白的ibd具有连接了2个同类的域的结构。作为这样的结构,例如,可举出连接了2个spgb的结构(spgb1-b2:序列号13(氨基酸序列)、序列号14(碱基序列))、连接了2个pplb的结构(pplb1-b2:序列号15(氨基酸序列)、序列号16(碱基序列))和连接了2个z的结构(zz:序列号17(氨基酸序列)、序列号18(碱基序列))等。作为构成cap-ibd融合蛋白的ibd,通过使用spgb1-b2、pplb1-b2或zz,能够进一步提高该融合蛋白作为可溶性蛋白质的稳定性。推测通过使连接2个spgb、pplb或z而成的ibd具有与可溶性促进标签(sumo)同等的分子量,来获得与sumo匹敌的增溶功能。需
要说明的是,ibd中连接复数个同类的域的情况下,其数量不限定于2个,例如,可以为3个、4个或5个以上。
129.在本发明的一实施方式中,cap-ibd融合蛋白中的ibd优选与cap的c末端结合。通过使ibd与cap的c末端结合,进一步提高ibd的vlp形成促进功能和vlp崩解抑制功能。即,在大肠杆菌表达宿主的细胞内,cap-ibd融合蛋白通过使n末端在粒子的内腔侧并使c末端在粒子的表层侧自然(自身)缔合以形成vlp。形成的vlp在表层具有ibds,对物理化学负荷具有良好的分子稳定性。
130.在本发明的一实施方式中,cap与ibd的连接以及域之间的连接,可以经由适当的氨基酸序列构成的接头。
131.作为本发明的一实施方式中使用的接头,没有特别限定,可举出优选由4~十几个氨基酸残基构成的任意肽。作为这样的肽,可举出gpgp(4氨基酸残基、序列号19)、(g4s)3(15氨基酸残基、序列号20)及这些的组合等常用的肽。
132.另外,在接头内插入凝血酶识别序列(lvprgs)等,可以设计成能够在所期望的时刻切割/解离cap和ibd。通过这样设计,例如,能够在cap-ibd融合蛋白形成vlp后,从vlp的表层切割/解离ibd。
133.另外,如本说明书的实施例所述,gpgpglvprgsgpgpg(序列号21)、从该序列中除去凝血酶识别序列(lvprgs)的gpgpggsgpgpg(序列号22)等也能够用作接头。
134.需要说明的是,在将上述除去凝血酶识别序列的gpgpggsgpgpg用作接头的情况下,例如,能够制作由序列号29表示的氨基酸序列构成的(或,由序列号30表示的碱基序列构成的多聚核苷酸构成的基因编码的)cap-ibd(这种情况下为cap-zz)。
135.〔cap-ibd融合蛋白的制造方法〕
136.本发明的一实施方式的pcv2的vlp的制造方法包含:制备包含编码上述cap-ibd融合蛋白的核酸的表达载体的工序;以及将该表达载体导入大肠杆菌以表达该cap-ibd融合蛋白的工序。
137.编码cap的核酸和编码ibd(例如,spgb、pplb和z)的核酸,例如,能够基于公知的碱基序列(序列号2、4、6、8、10和12),通过常规方法,例如,通过pcr克隆、化学合成等制备。
138.另外,编码cap-ibd融合蛋白的核酸,能够通过常规方法,例如,通过pcr亚克隆、化学合成等制备。
139.用于制造cap-ibd融合蛋白的表达载体,能够通过使用公知的手法的重组dna技术来构建,包含编码cap-ibd融合蛋白的核酸以及与该核酸可操作地连接的调节序列。
140.能够通过将上述表达载体导入作为宿主细胞的大肠杆菌中,以制作转化细胞。大肠杆菌的转化法没有特别限定,能够使用磷酸钙法、电穿孔法等公知的方法。
141.通过将制作的转化细胞在能表达cap-ibd融合蛋白的条件下培养,表达出作为可溶性蛋白质的cap-ibd融合蛋白。可溶性表达的cap-ibd融合蛋白,通过在大肠杆菌表达宿主的细胞内自然(自身)缔合,自发地形成vlp。
142.〔疫苗〕
143.本发明的一实施方式的疫苗,作为有效成分含上述vlp。需要说明的是,疫苗中的有效成分的含量没有特别限定,能够适当设定。
144.在本发明的一实施方式中,除了vlp之外,疫苗还可以包含药学上允许的添加剂,
例如,载体、润滑剂、防腐剂、稳定剂、润湿剂、乳化剂等。
145.疫苗的形态没有特别限定,例如,可举出注射剂、液体剂、混悬剂、乳剂、散剂、颗粒剂和胶囊剂等。疫苗的给药形态也没有特别限定,可以是经口给药,也可以是非经口给药(例如,皮下给药、肌肉内给药、皮内给药、经鼻给药、静脉内给药、腹腔内给药等)。
146.作为被注射疫苗的对象动物,只要是能够感染pcv2的非人动物就没有特别限定,优选为猪。
147.本发明的一方案包含以下发明。
148.<1>一种融合蛋白,其中,具有猪圆环病毒2型的衣壳蛋白和免疫球蛋白结合域。
149.<2>如上述<1>所述的融合蛋白,其中,上述免疫球蛋白结合域包含从蛋白g的b域、蛋白l的b域和蛋白a的z域所组成的组中选择的任一种域。
150.<3>如上述<1>或<2>所述的融合蛋白,其中,上述免疫球蛋白结合域与上述衣壳蛋白的c末端结合。
151.<4>如上述<1>~<3>中任一项所述的融合蛋白,其中,上述免疫球蛋白结合域具有连接了2个从蛋白g的b域、蛋白l的b域和蛋白a的z域所组成的组中选择的任一种域的结构。
152.<5>如上述<1>~<4>中任一项所述的融合蛋白,其中,上述衣壳蛋白和上述免疫球蛋白结合域经由接头结合。
153.<6>一种病毒样颗粒,其中,由上述<1>~<5>中任一项所述的融合蛋白形成。
154.<7>一种疫苗,其中,包含上述<6>所述的病毒样颗粒。
155.<8>一种制造方法,其是具有猪圆环病毒2型的衣壳蛋白和免疫球蛋白结合域的融合蛋白的制造方法,其中,包含:制备包含编码上述猪圆环病毒2型的衣壳蛋白与免疫球蛋白结合域的融合蛋白的核酸的表达载体的工序;以及将上述表达载体导入大肠杆菌以表达上述融合蛋白的工序。
156.<9>如上述<8>所述的制造方法,其中,上述免疫球蛋白结合域包含从蛋白g的b域、蛋白l的b域和蛋白a的z域所组成的组中选择的任一种域。
157.<10>如上述<8>或<9>所述的制造方法,其中,上述免疫球蛋白结合域与上述衣壳蛋白的c末端结合。
158.<11>如上述<8>~<10>中任一项所述的制造方法,其中,上述免疫球蛋白结合域具有连接了2个从蛋白g的b域、蛋白l的b域和蛋白a的z域所组成的组中选择的任一种域的结构。
159.<12>如上述<8>~<11>中任一项所述的制造方法,其中,上述衣壳蛋白与上述免疫球蛋白结合域经由接头结合。
160.本发明不限定于上述各实施方式,能在权利要求所示的范围内进行各种变更,适当组合不同实施方式中分别公开的技术方案而获得的实施方式也包含在本发明的技术范围内。
161.[实施例]
[0162]
举出以下实施例更具体地说明本发明,本发明不限定于这些示例。
[0163]
〔1.cap与增溶标签(gst、sumo)的融合化〕
[0164]
对于cap-gst以外的全部基因结构体,使用大肠杆菌表达系统中最佳化的碱基序列(密码子最佳化序列)进行全基因合成。需要说明的是,cap-gst融合基因的构建方法如下。
[0165]
通过pcr亚克隆,制备编码在cap(序列号41)的c末端经由肽接头融合了可溶性促进标签(gst)的融合蛋白(cap-gst)的核酸。具体而言,以cap-zz为模板,使用primestar(注册商标)(宝生物株式会社制)和引物组(cap f(序列号37:5
’‑
tatacatatgacctatccgcgtcgccgcta-3’);cap接头r(序列号38:5
’‑
gtataggggaacccggacccggaccagagc-3’))通过pcr扩增cap-接头序列。另外,以pet-41a(默克株式会社(
メルク
株式会社)制)为模板,使用primestar(注册商标)和引物组(gst f(序列号39:5
’‑
gggtccgggttcccctatactaggttattg-3’);gst r(序列号40:5
’‑
agcgagctcttaatccgattttggaggatg-3’))通过pcr扩增gst序列。接着,以扩增的cap-接头序列和gst序列为模板,使用primestar(注册商标)和引物组(cap f;gst r)通过重叠pcr扩增cap-接头-gst序列。使用将用限制酶ndei(宝生物株式会社制)与saci(宝生物株式会社制)处理的pjexpress441-01(阿特姆公司(atum)制)和同样用限制酶ndei和saci处理的cap-接头-gst序列连接的物质,并转化大肠杆菌dh5α株(宝生物株式会社制)。通过碱性sds法从转化的大肠杆菌dh5α株中回收pj4-capgst,并转化大肠杆菌bl21株(宝生物株式会社制)。
[0166]
尝试通过将获得的转化细胞在含氨苄青霉素的lb培养基(纳卡拉株式会社(
ナカライテスク
株式会社)制)中于37℃振动培养至浊度(od
600
)为0.4~0.6后,添加异丙基-β-硫代半乳糖苷(iptg)(西格玛奥德里奇社制)至终浓度1mm,进一步于37℃振动培养4小时,来表达cap-gst时,cap-gst完全不表达可溶性,全部变为包涵体。
[0167]
接着,与上述相同地,尝试将增溶标签(sumo)与cap的c末端侧融合的融合蛋白(cap-sumo)的表达。通过离心分离回收菌体,将其用bugbuster(注册商标)(默克株式会社制)破碎的可溶级分中,以3.2mg/l程度的培养浓度包含cap-sumo。
[0168]
另外,对上述破碎液使用凝胶过滤色谱(sephacryl s-300,通用医疗公司(ge healthcare)制)进行分析。回收与期待的vlp的位置(约40ml附近)相当的级分,将其用电子显微镜拍摄。观察的vlp在形态上与天然pcv2粒子不同,粒子形状变形且粒径非常不均匀(图7)。
[0169]
需要说明的是,gst是通常广泛使用的分子量25.6kda的增溶标签,不具有β-抓握折叠结构和3-螺旋束结构中的任一结构。另一方面,sumo是近年来广泛利用的分子量11.0kda的增溶标签,具有β-抓握折叠结构。
[0170]
由这些结果可知,gst不具有cap增溶功能和vlp形成促进功能中的任一个。因此,可知仅通过将cap与增溶标签融合,在大肠杆菌表达宿主中,cap不能够作为可溶性蛋白质表达。另外,sumo与gst不同,具有cap增溶功能但不具有vlp形成促进功能。尽管同样是增溶标签,但gst和sumo对cap的可溶性赋予的影响不同的理由,认为是两者的分子量(gst:25.6kda;sumo:11.0kda)和三维结构等的影响。
[0171]
〔2.cap与ibds(spgb1-b2、pplb1-b2)的融合化〕
[0172]
基于具有β-抓握折叠结构的sumo具有cap增溶功能的上述结果,作为同样具有β-抓握折叠结构的其他蛋白质,使用蛋白g的b域(spgb)和蛋白l的b域(pplb),并验证它们的cap增溶功能和vlp形成促进功能。
[0173]
制备编码在cap的c末端经由肽接头与具有连接了2个spgb的结构的ibd融合的融合蛋白(cap-spgb1-b2:序列号23)的核酸(序列号24),通过与上述1.相同的方法,尝试在大肠杆菌bl21(de3)株中表达cap-spgb1-b2。通过离心分离回收菌体,将其用bugbuster(注册商标)(默克株式会社制)破碎的可溶级分中,以1.5mg/l程度的培养浓度包含cap-spgb1-b2。
[0174]
另外,对上述破碎液使用凝胶过滤色谱(sephacryl s-300,通用医疗公司(ge healthcare)制)进行分析的结果,由于在期待的vlp的位置(约40ml附近)发现峰,因此回收该级分。用电子显微镜拍摄回收的级分的结果,发现vlp均匀分散于水溶液中的图像(图4)。观察到的vlp具有与天然pcv2粒子极其相似的粒子形状和粒径,且具有高均匀性。
[0175]
在对编码与具有连接了2个pplb的结构的ibd融合的融合蛋白(cap-pplb1-b2:序列号25)的核酸(序列号26)进行相同操作时,破碎液的可溶级分中,以1.5mg/l程度的培养浓度包含cap-pplb1-b2。另外,破碎液通过凝胶过滤色谱分析和电子显微镜拍摄,发现vlp均匀分散于水溶液中的图像(图5)。观察到的vlp具有与天然pcv2粒子极其相似的粒子形状和粒径,且具有高均匀性。
[0176]
由这些结果可知,具有与sumo相同的β-抓握折叠结构的spgb和pplb,与sumo不同,除了cap增溶功能之外,还具有优异的vlp形成促进功能。
[0177]
〔3.cap与ibd(zz)的融合化〕
[0178]
考虑具有β-抓握折叠结构的ibds具有优异的vlp形成促进功能这一上述2.的结果,对具有β-抓握折叠结构以外的结构的ibd,验证cap增溶功能和vlp形成促进功能。具体而言,作为上述ibd,使用具有3-螺旋束结构的蛋白a的z域(z),验证其cap增溶功能和vlp形成促进功能。
[0179]
制备编码在cap的c末端经由肽接头与具有连接了2个z的结构的ibd融合的融合蛋白(cap-zz:序列号27)的核酸(序列号28),通过与上述1.相同的方法,尝试在大肠杆菌bl21(de3)株中表达cap-zz。通过离心分离回收菌体,将其用bugbuster(注册商标)(默克株式会社制)破碎的可溶级分中,表达出超过cap-spgb1-b2和cap-pplb1-b2的浓度的cap-zz(6.0mg/l培养)。
[0180]
另外,对上述破碎液进行凝胶过滤色谱分析,回收示出与vlp相当的峰的级分。用电子显微镜拍摄回收的级分的结果,发现vlp均匀分散于水溶液中的图像(图6)。
[0181]
观察到的vlp具有与天然pcv2粒子极其相似的粒子形状和粒径,且具有高均匀性。
[0182]
由这些结果可知,具有3-螺旋束结构的z具有非常优异的cap增溶功能和vlp形成促进功能。
[0183]
需要说明的是,图3示意性示出在上述回收的融合蛋白(cap-sumo、cap-spgb1-b2、cap-pplb1-b2、cap-zz)中的cap和ibds(spgb1-b2、pplb1-b2、zz)或增溶标签(sumo)以及存在于这些之间的接头(l)的配置。
[0184]
〔4.ibd融合分子数对cap溶解和vlp形成的影响的验证〕
[0185]
为了验证ibd融合分子数的影响,制备编码仅1分子蛋白a的z域(z)与cap融合的融合蛋白(cap-z:序列号31)的核酸(序列号32),通过与上述1.相同的方法,使用大肠杆菌bl21(de3)株表达cap-z的结果,其表达等级为1.3mg/l程度的培养浓度,与cap-zz比较,发现可溶性表达等级降低。
[0186]
由该结果推测,通过连接两分子z,融合蛋白作为可溶性蛋白质的稳定性提高。
[0187]
〔5.ibd融合位置对vlp形成的影响的验证〕
[0188]
为了验证在形成vlp中ibd融合位置的影响,制备编码经由肽接头将zz或z与cap的n末端融合的融合蛋白(zz-cap:序列号33,z-cap:序列号35)的核酸(分别为序列号34和36),通过与上述1.相同的方法,尝试在大肠杆菌bl21(de3)株中表达zz-cap和z-cap。
[0189]
将zz-cap和z-cap的转化细胞破碎液在非变形环境下进行电泳(bn-page(美国英杰生命技术有限公司(invitrogen,
インビトロジェン
社)制))时,在cap-zz或cap-z中检测的vlp的条带显著变薄。推测这是由于,zz-cap或z-cap为了形成vlp,需要在vlp的内腔包含位于n末端侧的zz或z,而在物理上受限。
[0190]
〔6.高温处理稳定性试验:高温处理对vlp保持的影响的验证〕
[0191]
通过以下方法对上述2.和3.中获得的融合蛋白(cap-spgb1-b2、cap-zz)的vlp进行高温处理稳定性试验,研究高温处理对vlp的形状的影响。
[0192]
将cap-zz的vlp水溶液在52℃和97℃下分别加热处理30分钟,此后,由凝胶过滤色谱(sephacryl s-300、通用医疗公司(ge healthcare)制)进行分析。
[0193]
将表示在对cap-zz的vlp进行加热处理前后的凝胶过滤色谱的分析结果的色谱图示于图8。
[0194]
如图8所示,cap-zz的vlp即使在52℃和97℃的任一温度下加热处理30分钟后,色谱图的形状也不发生很大变化,确认vlp对高温处理具有高分子稳定性。另外,cap-spgb1-b2的vlp也获得相同的结果。
[0195]
接着,为了评价ibds的存在对vlp的高温处理稳定性赋予的影响,通过凝血酶处理在肽接头(l)内存在的凝血酶识别序列(lvpr
↓
gs(
↓
:凝血酶特异的切割部位))的部位切割cap-ibds(cap-spgb1-b2和cap-zz),以使ibds从vlp解离。
[0196]
在切割/解离暴露于vlp表层的ibds后,vlp也保持其形状。
[0197]
对于将ibds切割/解离的vlp,与上述相同地实施高温处理稳定性试验。将表示在对zz从cap-zz的vlp表层解离后的vlp进行加热处理前后的凝胶过滤色谱的分析结果的色谱图示于图9。
[0198]
如图9所示,在于52℃进行30分钟加热处理后的色谱图中,与vlp相当的峰完全消失。因此,认为解离zz后的vlp因该加热处理而崩解。spgb1-b2从cap-spgb1-b2的vlp表层解离后的vlp也获得了相同的结果。
[0199]
由这些结果确认了,上述ibds具有赋予对高温处理的分子稳定性的vlp崩解抑制功能。
[0200]
〔7.低温处理稳定性试验:低温处理对vlp保持的影响的验证〕
[0201]
通过以下方法对上述3.中获得的融合蛋白(cap-zz)的vlp进行低温处理稳定性试验,研究低温处理对vlp的形状保持的影响。
[0202]
将分散有cap-zz的vlp的pbs溶液,在4℃、-30℃和-80℃的不同温度条件下保存1年。将保存后的pbs溶液返回室温,并用电子显微镜观察。将在各温度保存1年后的cap-zz的vlp的电子显微镜照片示于图10(4℃)、图11(-30℃)和图12(-80℃)。
[0203]
如图10~12所示,cap-zz的vlp即使在低温保存后也保持其形状和均匀性,在任意温度条件下均未发现因vlp的凝集、形状变化、崩解等导致的粒子数减少的现象。
[0204]
由这些结果确认了,上述ibd具有赋予对低温处理的分子稳定性的vlp崩解抑制功能。
[0205]
〔8.疫苗抗原制备以及对猪的免疫和攻击试验〕
[0206]
将含有上述3.中获得的融合蛋白(cap-zz)的vlp的水溶液与油佐剂混合,以制备疫苗抗原。该疫苗抗原1ml包含相当于20μg的cap抗原。
[0207]
另外,将pbs与油佐剂混合,以制备模拟疫苗(mock)(模拟对照)。
[0208]
对从野外农场购入的4周龄的猪,隔2周将cap-zz疫苗抗原1ml或模拟疫苗向颈部肌肉内给药2次(1群3~4头)。在第2次给药后的第2周,将含105faid
50
/ml的感染性pcv2的攻击用乳剂向鼻腔内和臀部肌肉内接种以进行攻击。
[0209]
在攻击后第7天、第10天和第14天采血,在血清分离后使用qiaamp(注册商标)dna血液迷你试剂盒(美国凯杰公司(qiagen)制)提取pcv2的dna。另外,在攻击后第14天尸检,收集扁桃体、腹股沟淋巴结和肠系膜淋巴结制作10%乳剂,用与血清相同的方法提取dna。
[0210]
使用sybr premix taq(宝生物株式会社制)和pcv2特异性引物组(circodf;circodr),由实时pcr法(伯乐公司(bio-rad,
バイオラッド
社)制chromo4系统)测定pcv2的病毒拷贝数(copies/ml或copies/g)。
[0211]
需要说明的是,作为校正曲线制作用的标准,使用嵌入了cap基因的拷贝数已知的质粒。本实时pcr中的pcv2的病毒拷贝数的定量极限是在血清中为2000拷贝/ml,组织中为20000拷贝/g。
[0212]
分别将血清中的病毒拷贝数测定结果示于图13,淋巴结中的病毒拷贝数测定结果示于图14。
[0213]
如图13和图14所示,cap-zz免疫组与模拟组相比较,血清中(图13)和各淋巴结中(图14)的病毒拷贝数减少。该结果示出cap-zz融合蛋白的vlp能用作对pcv2感染有效的疫苗。
[0214]
(总结)
[0215]
对于上述实施例中使用的ibds(spgb、pplb和z)以及增溶标签(gst、sumo),将其公知的功能、三维结构以及由本发明发现的各种功能的评价试验结果(cap增溶功能、vlp形成促进功能、vlp崩解抑制功能(分子稳定性赋予功能)、疫苗功能)一并示于以下的表1。
[0216]
[表1]
[0217][0218]
由上述结果可知,能够通过将ibds而不是作为增溶标签周知的gst或sumo,与pcv2的cap融合,而使该蛋白质作为疫苗抗原成熟化。另外,更有趣的是,确认了这些ibds具有vlp崩解抑制功能,即,赋予对物理化学负荷的分子稳定性的功能。
[0219]
工业实用性
[0220]
本发明在医药品领域,尤其是在疫苗领域中是有用的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1