模拟肺组织的微流控系统
1.本发明提供了一种模拟肺组织的微流控系统、其制造方法以及利用该微流控系统的微流体控制方法,该微流控系统包括分离自人体肺脏的肺上皮细胞、肺纤维母细胞和人脐静脉血管内皮细胞,并且其内部灌流有微流体。
2.【支持本发明的国家研究开发项目】
3.【课题唯一编号】16c1787
4.【部门名】保健福祉部
5.【研究管理专门机构】韩国保健产业振兴院
6.【研究项目名】疾病治疗相关技术开发
7.【研究课题名】基于仿生芯片的急性肺损伤新药候选物质的临床效果研究
8.【贡献率】1/1
9.【主管机构】盆唐首尔大学医院
10.【研究期】2016.07.01~2019.08.31。
背景技术:
11.肺(lung)是进行呼吸运动必需的器官,通过吸气和呼气来吸入氧气并呼出二氧化碳。肺泡(alveoli)实现了在肺内部进行的气体交换,在肺泡毛细血管的血液中流经的红细胞将体内生成的二氧化碳运输至肺脏后,通过肺泡将这些二氧化碳排出至体外,并从空气中吸入氧气以运输至人体各部位。因此,与其他人体器官不同,肺会发生气体交换。
12.一方面,目前用于肺疾病研究的体内(in vivo)及体外(in vitro)模型受限于肺脏的特性,尚未得到充分的开发。例如,动物模型不会出现经常在人体中发现的气管及肺相关病理性异常(pathological abnormality),大多数体外模型无法模拟实际分化成各种气管上皮细胞的组织成分及结构复杂性。进一步地,如上所述,模拟肺的体外模型必须暴露在包括氧气的气体中以用于进行研究,但目前市场上销售的利用细胞来制造的体外模型在暴露于气体中时,会发生诸如其细胞会在3日内死亡,因此不适于进行至少需要7日以上的模型制造、药物效果探索、药物毒性筛查等一系列的步骤。
13.为了解决上述问题,本发明人对微流控系统进行了研究并完成了本发明,该微流控系统的特征在于,由于即使在灌流气体和包括培养液的流体的步骤中,细胞也可长时间存活,因此可实现对各种肺疾病模型的模拟及治疗药物的效果测试、其他有害物质的测试、体外诊断以及定制药物处方。
技术实现要素:
14.要解决的技术问题
15.一方面,本发明旨在提供一种模拟肺组织的微流控系统,该微流控系统包括分离自人体肺脏的肺上皮细胞、肺纤维母细胞和人脐静脉血管内皮细胞,并且该系统内部灌流有气体和包括培养液的流体,并且包括ph测定传感器和针对气体分压中的氧气分压(po2)
的测定传感器。
16.另一方面,本发明旨在提供一种制造该模拟肺组织的微流控系统的方法。
17.又一方面,本发明旨在提供一种监测该模拟肺组织的微流控系统内的细胞培养环境的方法,该方法包括向该模拟肺组织的微流控系统灌流微流体和测定ph和po2的步骤。
18.解决问题的方案
19.一方面,本发明提供了一种模拟肺组织的微流控系统,该微流控系统包括:第一层、第二层、第三层;和在该第一层和该第二层之间的用于灌流(perfusion)气体的第一腔室(chamber)和在该第二层和该第三层之间的用于灌流包括培养液的流体的第二腔室;其中,该第二层包括多孔性膜(membrane),该多孔性膜包括肺上皮细胞(epithelial cell)、肺纤维母细胞(fibroblast)和人脐静脉血管内皮细胞(human umbilical vein endothelial cell);该肺上皮细胞朝向该第一腔室,该血管内皮细胞朝向该第二腔室,该肺纤维母细胞存在于该血管内皮细胞和该肺上皮细胞之间,并且该肺上皮细胞、肺纤维母细胞分离自人体的肺脏,该第一层和该第三层分别包括至少一个以上的ph测定传感器和至少一个以上的po2测定传感器。
20.另一方面,本发明提供了一种制造该模拟肺组织的微流控系统的方法,该方法包括:(1)用细胞外基质来涂覆该第二层的多孔性膜的步骤;(2)在所涂覆的多孔性膜上接种(seeding)并培养分离自人体的肺上皮细胞(epithelial cell)的步骤;(3)在接种该肺上皮细胞的多孔性膜的另一面上接种并培养分离自人体的肺纤维母细胞(fibroblast)和人脐静脉血管内皮细胞(human umbilical vein endothelial cell)的步骤。
21.又一方面,本发明提供了一种监测该模拟肺组织的微流控系统内的细胞培养环境的方法,该方法包括:向该模拟肺组织的微流控系统的该第一腔室灌流气体并且向该第二腔室灌流包括培养液的流体的微流体灌流的步骤;以及利用该系统的ph测定传感器来测定ph并且利用该po2测定传感器来测定po2的步骤。
22.发明的效果
23.本发明涉及一种模拟肺组织的微流控系统,该微流控系统包括直接分离自人体肺脏的肺上皮细胞和肺纤维母细胞;其中,可向系统内部的腔室中分别灌流气体和包括培养液的流体,灌流该气体和该流体后经过一周以上,系统内部的这三种细胞也均可存活。另外,利用该系统内部的ph测定传感器和po2测定传感器,可实现氧气运输和ph监测,由此确定系统内部的该三种细胞是否在与活体肺脏相同的环境下生长。因此,经由利用人体的肺脏(尤其是肺损伤患者的肺脏)的根据本发明的一方面的模拟肺组织的微流控系统,可实现包括肺疾病模型的实现、治疗用药物的效果测试以及其他有害物质的测试的广泛领域的研究,进一步可实现体外诊断和定制药物处方等。
附图说明
24.图1为用于制造根据本发明的一个实施例的模拟肺组织的微流控系统的10种正常肺组织样品和2种肺癌组织样品的照片。
25.图2a为利用根据本发明的一个实施例的方法而解离的正常肺组织的肺上皮细胞(normal-epi)的照片,图2b为利用根据本发明的一个实施例的方法而解离的肺癌组织的肺癌细胞(cancer-epi)的照片。
26.图3a为利用根据本发明的一个实施例的方法而分离的正常肺组织的肺上皮细胞(n-epi-s1)的facs分析结果图,图3b为利用根据本发明的一个实施例的方法而分离的肺癌组织的肺癌细胞(c-epi-s1)的facs分析结果图。就从第一个患者样品中获得的s1而言,epi-s1利用cd326-pe抗体进行实验,指示细胞从正常组织和癌组织中均顺利地分离。
27.图4为利用根据本发明的一个实施例的方法而分离的正常肺组织的肺上皮细胞(n-epi-s2)、肺纤维母细胞(n-fibroblast-s2)的facs分析结果图。从第二个患者样品中获得的s2也按照上述方法进行实验并确定。
28.图5为利用根据本发明的一个实施例的方法而分离的正常肺组织的肺上皮细胞(n-epi-s3)、肺纤维母细胞(n-fibroblast-s3)的facs分析结果图。从第三个患者样品中获得的s3也按照上述方法进行分析并确定。
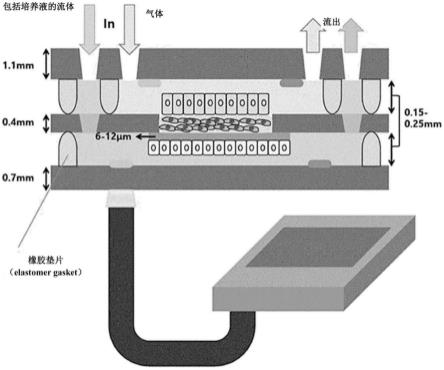
29.图6为利用根据本发明的一个实施例的方法而分离的正常肺组织的肺上皮细胞(n-epi-s5)、肺纤维母细胞(n-fibroblast-s5)的facs分析结果图。
30.图7a和图7b为利用根据本发明的一个实施例的方法而分离的正常肺组织的肺上皮细胞(n-epi-s1和n-epi-s2)的免疫荧光分析结果图,图7c为作为对照组的人小气道上皮细胞(saec)的免疫荧光分析结果图。
31.图8为利用根据本发明的一个实施例的方法而分离的正常肺组织的肺纤维母细胞(n-fibroblast-s3)的免疫荧光分析结果图。
32.图9a至图9c为在制造根据本发明的一个实施例的模拟肺组织的微流控系统的步骤中,在该系统的中间层多孔性膜上接种(seeding)分离自人体的肺上皮细胞、肺纤维母细胞和人脐静脉血管内皮细胞的简要示意图。图9a为示出了接种肺纤维母细胞和血管内皮细胞后的培养结果的简要示意图,图9b为示出了接种肺上皮细胞后的培养结果的简要示意图,图9c为示出了接种并培养这三种细胞后,该三种细胞附着(attachment)于中间层的多孔性膜的结果的简要示意图。
33.图10a为示出了向根据本发明的一个实施例的模拟肺组织的微流控系统注入流体的步骤的简要示意图,图10b为该系统中的包括该三种细胞的中间层多孔性膜的部分的更详细示意图。
34.图11为在安装了根据本发明的一个实施例的ph测定传感器和po2测定传感器的模拟肺组织的微流控系统中读取实际的传感器值的步骤示意图。
35.图12a至图12d为向根据本发明的一个实施例的模拟肺组织的微流控系统内部灌流包括培养液的流体后经过4天的免疫荧光分析结果图。
36.图12a至图12d中,红色(epi)表示肺上皮细胞,绿色(endo)表示血管内皮细胞。图12a为对上皮细胞和内皮细胞进行共培养,然后将上皮细胞染色为红色,内皮细胞染色为绿色后确定的结果。图12b为进行共培养后利用共聚焦显微镜以ortho形式观察细胞侧面样貌的结果。图12c为利用imaris程序将共聚焦显微镜拍摄的照片重构成三次元视频后从中截选的结果,指示共培养发展情况良好。图12d为从侧面确定图12c的视频而得到的照片。
37.图13a和图13b为向根据本发明的一个实施例的模拟肺组织的微流控系统内部灌流气体和包括培养液的流体后经过2天的免疫荧光分析结果图。图13a和图13b中,绿色(fibroblast)表示肺纤维母细胞,红色(epi)表示肺上皮细胞。
38.图14a至图14d为向根据本发明的一个实施例的模拟肺组织的微流控系统内部灌
流气体和包括培养液的流体后经过4天的免疫荧光分析结果图。图14a至图14c中,红色(epi)表示肺上皮细胞,绿色(endo)表示血管内皮细胞。图14a为对上皮细胞(calu3)和内皮细胞(endo)进行共培养,然后将上皮细胞染色为红色,内皮细胞染色为绿色后确定的结果。图14b为进行共培养后利用共聚焦显微镜以ortho形式观察细胞侧面样貌的结果。图14c为利用imaris程序将共聚焦显微镜拍摄的照片重构成三次元视频后从中截选的结果,指示共培养发展情况良好。图14d为从侧面确定图14c的视频而得到的照片。图14e为实际灌流气体时模拟呼吸运动的曲线图,图14f为用于模拟并测定该呼吸运动的设备。
39.图15a和图15b为在根据本发明的一个实施例的模拟肺组织的微流控系统中灌流流体后,利用内部的ph测定传感器和po2测定传感器来测定ph(图15a)和po2(图15b)的结果图。
具体实施方式
40.下面,详细说明本发明。
41.本发明书中,“微流体”是指个体内部中灌流的微细流体,具体可以是人体肺脏中灌流的流体,更具体地,可以是人体肺脏中灌流的气体(例如,氧气或二氧化碳),也可以是构成人体肺脏的血管中灌流的血液、淋巴液等,其中,非气体性流体(诸如上文所述的血液)在体外可被替换为包括培养液的流体。
42.一方面,本发明提供了一种模拟肺组织的微流控系统,该微流控系统包括:第一层、第二层、第三层;在该第一层和该第二层之间的用于灌流(perfusion)气体的第一腔室(chamber)和在该第二层和该第三层之间的用于灌流包括培养液的流体的第二腔室;其中,该第二层包括多孔性膜(membrane),该多孔性膜包括肺上皮细胞(epithelial cell)、肺纤维母细胞(fibroblast)和血管内皮细胞(human umbilical vein endothelial cell);该肺上皮细胞朝向该第一腔室,该血管内皮细胞朝向该第二腔室,该肺纤维母细胞存在于该血管内皮细胞和该肺上皮细胞之间,该肺上皮细胞和该肺纤维母细胞分离自人体的肺脏,该第一层和该第三层分别包括至少一个以上的ph测定传感器和至少一个以上的气体分压测定传感器。
43.根据本发明的一方面,该模拟肺组织的微流控系统可包括第一层、第二层和第三层,该第一层和该第二层之间可包括第一腔室(chamber),该第二层和该第三层之间可包括第二腔室。该第一腔室不包括构成第一腔室的附加结构,而是指因该第一层和该第二层的存在而形成的空间,其中,该第一腔室用于灌流气体。同样地,该第二腔室也不包括构成第二腔室的附加结构,而是指因该第二层和该第三层的存在而形成的空间,其中,该第二腔室用于灌流包括培养液的流体。
44.根据本发明的一方面,该第一层、该第二层和该第三层可包括选自由硅酸盐(silicate)、硼硅酸盐(borosilicate)、磷酸盐(phosphate)组成的组中的一种以上的玻璃(glass),具体地,第一层、第二层和第三层各自可为硼硅酸盐玻璃(borosilicate glass),但不限于此。组成该第一层、该第二层和该第三层的物质可彼此相同或不同。
45.根据本发明的一方面,该第一层、该第二层和该第三层的厚度分别可为0.1mm至2mm,具体地,可≥0.1mm、≥0.2mm、≥0.3mm、≥0.4mm、≥0.5mm、≥0.6mm、≥0.7mm、≥0.8mm、≥0.9mm、≥1.0mm、≥1.1mm、≥1.2mm、≥1.3mm、≥1.4mm、≥1.5mm、≥1.6mm、≥1.7mm、≥
1.8mm或≥1.9mm,也可≤2.0mm、≤1.9mm、≤1.8mm、≤1.7mm、≤1.6mm、≤1.5mm、≤1.4mm、≤1.3mm、≤1.2mm、≤1.1mm、≤1.0mm、≤0.9mm、≤0.8mm、≤0.7mm、≤0.6mm、≤0.5mm、≤0.4mm、≤0.3mm或≤0.2mm,但不限于此。该第一层、该第二层和该第三层的厚度可彼此相同或不同。
46.根据本发明的一方面,该第二层可包括多孔性膜(porous membrane)。组成该多孔性膜的物质可为聚合物(polymer),所述聚合物可选自由聚对苯二甲酸乙二醇酯(polyethylene terephthalate,pet)、聚二甲基硅氧烷(polydimethylsiloxane,pdms)、聚己内酯(polycarprolactone,pcl)、纳米纤维(nanofiber)组成的组中的一种以上,但不限于此。该多孔性膜的厚度可为3μm至24μm,具体地,可≥3μm、≥4μm、≥6μm、≥7μm、≥8μm、≥9μm、≥10μm、≥11μm、≥12μm、≥14μm、≥16μm、≥18μm、≥20μm或≥22μm,也可≤24μm、≤22μm、≤20μm、≤18μm、≤16μm、≤14μm、≤12μm、≤11μm、≤10μm、≤9μm、≤8μm、≤7μm、≤6μm或≤4μm,但不限于此,可随着模拟肺组织的微流控系统、第二层或多孔性膜的大小而变化。该多孔性膜的孔间隙可为1μm至16μm,具体地,可≥1μm、≥2μm、≥3μm、≥4μm、≥5μm、≥6μm、≥7μm、≥8μm、≥9μm、≥10μm、≥11μm、≥12μm、≥13μm、≥14μm或≥15μm,也可≤16μm、≤15μm、≤14μm、≤13μm、≤12μm、≤11μm、≤10μm、≤9μm、≤8μm、≤7μm、≤6μm、≤5μm、≤4μm、≤3μm或≤2μm,但不限于此,可随着模拟肺组织的微流控系统、第二层或多孔性膜的大小而变化。为使肺上皮细胞、肺纤维母细胞或血管内皮细胞附着(attachment)于多孔性膜,可用细胞外基质(extracellular matrix,ecm)来涂覆该多孔性膜,其中,该细胞外基质可选自由层粘连蛋白、i型胶原蛋白、ⅱ型胶原蛋白、ⅲ型胶原蛋白、ⅳ型胶原蛋白、
ⅴ
型胶原蛋白、ⅵ型胶原蛋白、整联蛋白、巢蛋白、纤维粘连蛋白、弹性蛋白、蛋白聚糖、玻璃粘连蛋白、多聚-d-赖氨酸、多糖类、明胶组成的组中的一种以上,但不限于此(只要可使肺上皮细胞、肺纤维母细胞或血管内皮细胞附着于多孔性膜的物质均可)。
47.根据本发明的一方面,该多孔性膜可包括肺上皮细胞(epithelial cell)、肺纤维母细胞(fibroblast)和血管内皮细胞(human umbilical vein endothelial cell),其中,该肺上皮细胞和该肺纤维母细胞可分离自人体的肺脏。该肺上皮细胞和肺纤维母细胞可通过以下分离方法获得,该分离方法包括:对分离自人体的肺组织样品进行解离;将与该肺上皮细胞特异结合的微珠(microbead)和与该肺纤维母细胞特异结合的微珠加入到该已解离的肺组织样品中;以及对与所添加的微珠相结合的肺组织样品进行培养。在该分离方法中,与该肺上皮细胞特异结合的微珠可包括分化簇326(cluster of differentiation 326,cd326),与该肺纤维母细胞特异结合的微珠可包括抗纤维母细胞微珠。在这种情况下,可从混合各种细胞的人体肺组织样品中按种类分别分离出肺上皮细胞和肺纤维母细胞。另外,当向包括分离自人体肺脏的肺上皮细胞、肺纤维母细胞和血管内皮细胞的模拟肺组织的微流控系统中灌流气体和包括培养液的流体时,与现有技术使用的单细胞培养不同,即使经过4天、7天或13天,这些细胞也可存活(实验例1),因此可实现对肺疾病治疗药物的药效测试和对其他有害物质的测试等广泛领域的研究,进一步也可用于体外诊断和定制药物处方等。
48.根据本发明的一方面,该肺上皮细胞可朝向该第一腔室,该血管内皮细胞可朝向该第二腔室,该肺纤维母细胞可存在于该肺上皮细胞和该血管内皮细胞之间。根据如上所述的肺上皮细胞和血管内皮细胞的位置,该肺上皮细胞可与灌流在第一腔室中的气体连通
(connection),该血管内皮细胞可与灌流在第二腔室中的包括培养液的流体连通,以存在于与实际的人体肺脏类似的微环境中。
49.根据本发明的一方面,该肺上皮细胞可为肺泡上皮细胞,该肺泡上皮细胞可包括i型肺泡上皮细胞和ⅱ型肺泡上皮细胞。该i型肺泡上皮细胞和该ⅱ型肺泡上皮细胞的比例可为7:3至9:1,但不限于此。
50.根据本发明的一方面,该第一层可包括注入气体的第一注入口、排出该气体的第一排出口、注入包括培养液的流体的第二注入口和排出该流体的第二排出口,并且该第二层可包括使包括培养液的流体从第一腔室灌流入第二腔室的2个以上的通道。这些第一注入口、第一排出口、第二注入口、第二排出口可分别为一个以上。
51.根据本发明的一方面,该第一层和该第三层分别包括至少一个以上的ph测定传感器和至少一个以上的气体分压测定传感器。具体地,该第一层可包括至少一个以上的ph测定传感器或至少一个以上的气体分压测定传感器,并且该第三层可包括至少一个以上的ph测定传感器或至少一个以上的气体分压测定传感器,并且更具体地,该第一层可包括至少一个以上的气体分压测定传感器,该第三层可包括至少一个以上的ph测定传感器。这些ph测定传感器可以是测定该模拟肺组织的微流控系统内部的ph的传感器,也可以是测定灌流有从该第二注入口注入的包括培养液的流体的第二腔室内的ph的传感器。这些气体分压测定传感器可以是测定氧气分压(po2)的传感器,也可以是测定灌流有从该第一注入口注入的气体的第一腔室内的氧气分压的传感器。这些ph测定传感器可以是实时(real-time)测定ph的传感器,并且这些气体分压测定传感器可以是实时测定气体分压的传感器。
52.根据本发明的一方面,可利用该模拟肺组织的微流控系统来实时测定氧气分压和ph,从而可调节向该系统内部运输的氧气量及该系统内部的ph(实验例3)。
53.另一方面,本发明提供了一种制造该模拟肺组织的微流控系统的方法,制造该模拟肺组织的微流控系统的该方法包括:(1)用细胞外基质来涂覆该第二层的多孔性膜;(2)在所涂覆的多孔性膜上接种(seeding)并培养分离自人体的肺纤维母细胞(fibroblast)和血管内皮细胞(endothelial cell);(3)在接种该肺纤维母细胞和该血管内皮细胞的多孔性膜的另一面上接种并培养分离自人体的肺上皮细胞(epithelial cell)。对该模拟肺组织的微流控系统、第二层、多孔性膜、细胞外基质、肺上皮细胞、肺纤维母细胞、血管内皮细胞的说明如上文所述。
54.根据本发明的一方面,上文所述的(1)步骤中的细胞外基质可选自由层粘连蛋白、i型胶原蛋白、ⅱ型胶原蛋白、ⅲ型胶原蛋白、ⅳ型胶原蛋白、
ⅴ
型胶原蛋白、ⅵ型胶原蛋白、整联蛋白、巢蛋白、纤维粘连蛋白、弹性蛋白、蛋白聚糖、玻璃粘连蛋白、多聚-d-赖氨酸、多糖类、明胶组成的组中的一种以上,但不限于此(只要可使肺上皮细胞、肺纤维母细胞或血管内皮细胞附着于多孔性膜的物质均可)。
55.根据本发明的一方面,该肺上皮细胞、该肺纤维母细胞可分离自人体的肺脏,具体可通过以下分离方法获得,该分离方法包括:对分离自人体的肺组织样品进行解离;将与该肺上皮细胞的微珠(microbead)特异结合的微珠和与该肺纤维母细胞特异结合的微珠加入到该已解离的肺组织样品中;以及对与所添加的微珠相结合的肺组织样品进行培养。在该分离方法中,与该肺上皮细胞特异结合的微珠可包括分化簇326(cluster of differentiation 326,cd326),与该肺纤维母细胞特异结合的微珠可包括抗纤维母细胞微
珠。在这种情况下,可从混合各种细胞的人体肺组织样品中按种类分别分离出肺上皮细胞和肺纤维母细胞。可在4℃至37℃的环境下培养与这些微珠相结合的肺组织样品,具体地,可为≥4℃、≥5℃、≥10℃、≥15℃、≥20℃、≥25℃、≥30℃或≥35℃,也可为≤37℃、≤35℃、≤30℃、≤25℃、≤20℃、≤15℃、≤10℃、≤5℃、≤4℃,但不限于此范围(肺上皮细胞和肺纤维母细胞根据其种类的不同培养温度可能不同)。另外,当向包括分离自人体肺脏的肺上皮细胞、肺纤维母细胞和血管内皮细胞的模拟肺组织的微流控系统中灌流气体和包括培养液的流体时,与现有技术使用的单细胞培养不同,即使经过4天、7天或13天,这些细胞也可存活(实验例1),因此可实现对肺疾病治疗药物的药效测试和对其他有害物质的测试等广泛领域的研究,进一步也可用于体外诊断和定制药物处方等。
56.根据本发明的一方面,上文所述的(3)步骤中的肺纤维母细胞和血管内皮细胞的混合比例可为1:1至1:25,具体地,可为≥1:1、≥1:2、≥1:3、≥1:4、≥1:5、≥1:6、≥1:8、≥1:10、≥1:15或≥1:20,也可为≤1:25、≤1:20、≤1:15、≤1:10、≤1:8、≤1:6、≤1:5、≤1:4、≤1:3或≤1:2,但不限于此。
57.又一方面,本发明提供了一种控制该模拟肺组织的微流控系统内的微流体的方法,该方法包括:向该模拟肺组织的微流控系统的该第一腔室灌流气体并且向该第二腔室灌流包括培养液的流体的微流体灌流步骤;以及利用该系统的ph测定传感器来测定ph并且利用该气体分压测定传感器来测定气体分压的测定步骤。对该模拟肺组织的微流控系统、第一腔室、第二腔室、气体、包括培养液的流体、ph测定、气体分压测定的说明如上文所述。
58.根据本发明的一方面,该控制方法还包括:当ph和气体分压测定步骤中测定的ph或气体分压与人体肺组织中的ph或者气体分压不同时,对该模拟肺组织的微流控系统中注入的气体和包括培养液的流体的每小时注入量进行调整。
59.根据本发明的一方面,该气体分压可为氧气分压(po2)。
60.下面,将结合实施例和实验例,更具体地说明本发明的构成及效果。但以下实施例和实验例仅仅是出于示例性目的,为了帮助更好地理解本发明而提供,并不旨在限制本发明的范畴及范围。
61.实施例1从人体肺组织分离肺上皮细胞和肺纤维母细胞
62.为了制造模拟活体内肺组织的微流控系统,通过如下方法从人体肺组织分离出肺上皮细胞和肺纤维母细胞。
63.实施例1-1解离人体肺组织
64.将从已接受手术的肺癌患者的已切除肺组织中的正常肺组织获得的下文表1中0.39g至1.37g的10种正常肺组织样品(n-1至n-10),以及从肺癌患者的已切除肺组织中的癌组织获得的下文表1中共0.41g的2种肺癌组织样品(c-1和c-2),在存储缓冲液(miltenyi biotec,tissue storage solution)中以4℃保存1日至2日,然后将这些组织样品分为每份0.4g至0.5g,分别放入每个c管(c试管)中。
65.【表1】
66.组织样品编号重量(g)组织样品编号重量(g)n-10.54n-71.37n-20.52n-80.64n-30.66n-91.00
n-40.70n-100.39n-51.02c-1
*
0.28n-61.17c-2
*
0.13
67.*肺癌组织样品c-1和c-2的总重量为0.41g,利用这些肺癌组织样品,通过如下方法来分离肺癌组织的肺癌细胞。
68.然后,向每个c管分株加入2.35ml的无血清培养液—rpmi培养液(welgene,rpmi 1640),并且按照说明书向每个c管加入酵素试剂盒(miltenyi biotec,multi tissue dissociation kitⅰ)的酵素后,清洗(washing)并去除经过清洗的组织样品的水分,并将其分别放入c试管中。然后,将剪刀放入每个c试管内部以将组织尽可能地剪碎,并且盖上盖子,然后将插入冰块的每个c试管按顺序插入macs(magnetically activated cell sorting)设备(miltenyi biotec,gentlemacs
tm octo dissociator),并且运行程序。此时,如果发生错误,拿出这些c试管将其混合后重新运行程序,程序结束后,将这些c试管以插入冰块的状态取出。
69.在15ml或50ml的试管上安装过滤网,用约2ml的无血清rpmi培养液浸润过滤网,然后在程序结束时,将每个c试管中包括的肺组织样品倒入这些过滤网中,并且用5ml的该无血清rpmi培养液再次对c试管进行清洗后,倒入过滤网。然后,以300xg的离心力离心分离10分钟,去除上层液,加入1ml红细胞裂解液(red blood cell lysis buffer;lonza,red blood cell lysis buffer)后静置约2分钟,然后用5ml的无血清rpmi培养液使其再次进行悬浮。然后,以300xg的离心力离心分离10分钟,去除上层液,用5ml至10ml的细胞培养液(lonza,egm-2)再次进行悬浮后计算细胞数,再次将其放入含有内皮细胞培养液(lonza,egm-2)或上皮细胞培养液(lonza,sagm)的t-175烧瓶中进行培养,从而解离人体肺组织。此时,每一个c试管被放入一个t-175烧瓶进行培养。
70.在已解离的肺组织中,通过与相机连接的光学显微镜来观察培养各细胞的t-175烧瓶后,拍摄了肺上皮细胞和肺纤维母细胞的照片,结果如图2a(从正常肺组织样品中解离的肺上皮细胞(normal-epi))和图2b(从肺癌组织样品中解离的肺癌细胞(cancer-epi))所示。
71.实施例1-2分离肺上皮细胞和肺纤维母细胞
72.实施例1-1中解离的人体肺组织通过如下所述的步骤来分离肺上皮细胞和肺纤维母细胞。
73.具体地,计算实施例1-1中t-175烧瓶内含有的细胞数,准备5x106至1x107的细胞后,在常温下以300xg的离心力离心分离10分钟,以制备三种细胞团块的悬浮液,即总计300ul的肺上皮细胞悬浮液和总计80ul的肺纤维母细胞悬浮液。此时,将automacs冲洗(rinsing)溶液(miltenyi biotec,#130-091-222)和macs bsa储备(stock)溶液(miltenyi biotec,#130-091-376)按20:1的体积比,即利用将47.5ml的automacs冲洗溶液和2.5ml的macs bsa储备溶液混合而得到的peb缓冲液来制备该三种悬浮液。
74.然后,为了提高所分离的细胞的纯度(purity),向该肺上皮细胞悬浮液中加入100ul的fcr阻断试剂(fcr blocking reagent)(miltenyi biotec,#130-059-901),并且不向该肺纤维母细胞悬浮液中加入fcr阻断试剂。
75.然后,分别向该肺上皮细胞悬浮液中加入100ul的cd326微珠(miltenyi biotec,#
130-061-101),向该肺纤维母细胞悬浮液中加入20ul的抗纤维母细胞微珠(miltenyi biotec,#130-050-601),随后分别用vertex振荡悬浮液并使其充分混合后,在4℃下培养cd326微珠和肺上皮细胞悬浮液的混合物约30分钟,在常温下培养抗纤维母细胞微珠和肺纤维母细胞悬浮液的混合物约30分钟。在维持着各自温度的冷藏库中进行培养。进行上述培养后,向cd326微珠和肺上皮细胞悬浮液的混合物中加入1ml的peb缓冲液进行清洗,然后分别以300xg的离心力离心分离10分钟,并且也向抗纤维母细胞微珠和肺纤维母细胞悬浮液的混合物中加入1ml的peb缓冲液进行清洗,然后以300xg的离心力离心分离3分钟。然后,向两种混合物中分别加入1ml的peb缓冲液,以制备cd326微珠结合的肺上皮细胞悬浮液和抗纤维母细胞微珠结合的肺纤维母细胞悬浮液这两种悬浮液。
76.在这些悬浮液中,为了利用微珠的磁性来使细胞分离(magnetic separation),将ls分选柱(ls column)放入细胞分离器(mitenyi biotec,midimacs
tm separator)的磁性体中,用3ml的peb缓冲液来冲洗该分选柱。然后,在分选柱下端放置15ml试管,随后使cd326微珠结合的肺上皮细胞悬浮液流入该分选柱中,收集该15ml试管中未标记的阴性细胞(unlabeled cell,negative cell),在冰块上将3ml的peb缓冲液加入分选柱中,如果缓冲液全部流出,则再次加入3ml的peb缓冲液,重复该步骤3次以进行清洗。为了收集微珠标记的细胞,将该分选柱从细胞分离器卸下,在上端放置新的15ml试管。然后,在该分选柱中加入5ml的peb缓冲液,按压柱塞(plunger)直到出现气泡为止,收集放置在分选柱下端的15ml试管中的与cd326微珠结合并被标记的肺上皮细胞(labeled cell,positive cell)。将其以300xg的离心力离心分离10分钟后,去除上层液,将10ml的细胞培养液再次悬浮后,计算肺上皮细胞数,经由上文利用微珠磁性的细胞分离法从抗纤维母细胞微珠结合的肺纤维母细胞悬浮液分别收集被标记的肺纤维母细胞,并且按照同样的方法,分别对细胞进行离心分离、再悬浮和计数操作。
77.实施例1-3通过facs分析来确定肺上皮细胞和肺纤维母细胞的分离情况
78.为了确定从实施例1-2分离获得的肺上皮细胞、肺纤维母细胞是否按种类被分离,利用荧光活化细胞分选仪(fluorescence activated cell sorter,facs)来进行分析。
79.具体地,将automacs冲洗(rinsing)溶液(miltenyi biotec,#130-091-222)和macs bsa储备(stock)溶液(miltenyi biotec,#130-091-376)按照20:1的体积比,即将47.5ml的automacs冲洗液和2.5ml的macs bsa储备溶液进行混合来制备peb缓冲液,利用trysin/edta(welgene,ls015-01)按照获得患者样品的顺序,将实施例1-2中分离获得的肺上皮细胞、肺纤维母细胞记为s1(第一个)、s2(第二个)。正常细胞标记为n,癌细胞标记为c。n1至c2是将两种组织剪成0.5克的单位后分类的数字。分别对这两种细胞进行计数,各细胞取2x105后,以300xg的离心力离心分离10分钟。facs分析结果如图3至图6所示。
80.如图3至图6所示,根据facs histogram结果,黑色线条表示没有附着抗体的对照组,除黑色外其他颜色的线条表示附着有抗体的试验组的细胞量,通过确认到试验组与对照组的黑色线条具有明显差异,可确定分离情况良好。
81.实施例1-4通过免疫荧光分析(immuno fluorescence assay)来确定肺上皮细胞和肺纤维母细胞的分离情况
82.为了确定从实施例1-2分离获得的肺上皮细胞、肺纤维母细胞是否按种类被分离,进行了免疫荧光分析(immuno fluorescence assay)。
serum albumin,bsa)(miltenyi biotec,macs bsastock#130-091-376,75ml)的混合物,在4℃下涂覆器官芯片平台(organ-on-a-chip platform(micronit公司,荷兰))的中间层(middle layer)的多孔性膜(孔间隙大小为0.45μm时,孔间隙密度为2.006cm2,孔间隙大小为3μm时,孔间隙密度为8.005cm2)一晚上后,使其干燥。然后,将实施例1中获取的分离自人体的2x105/100μl的肺上皮细胞(n-epi-s2(p3:传代培养3次)或calu-3)在37℃下接种(seeding)于该多孔性膜下端面上约2小时后,在37℃下培养1天(图9a)。然后,将2x105/50μl的人脐静脉血管内皮细胞(huvec(p2),lonza)和实施例1中获取的分离自人体的0.4x105/50μl的肺纤维母细胞(n-fibroblast-s5(p8))的混合物接种于该多孔性膜上接种有肺上皮细胞的面的另一面,在37℃下培养4天(图9b)。图9c为肺上皮细胞、血管内皮细胞和肺纤维母细胞附着(attachment)于多孔性膜的状态简要示意图。
94.根据器官芯片平台的说明书,将模拟肺组织的微流控系统制造为包括中间层,该中间层包括肺上皮细胞、血管内皮细胞和肺纤维母细胞,图10a为该模拟肺组织的微流控系统的简要示意图,图10b为该系统中包括这三种细胞的中间层的多孔性膜的简要示意图。
95.另外,在朝向该系统的第一层(或者上层)的第一腔室(用于灌流气体的腔室)的一面安装作为气体分压测定传感器的po2传感器(presens,microox4),在朝向第三层(或者下层)的第二腔室(用于灌流包括培养液的流体的腔室)的一面安装ph测定传感器(presens,ph-1mini v2)。图11为安装了上述传感器的模拟肺组织的微流控系统的简要示意图。
96.实施例3在模拟肺组织的微流控系统中灌流流体
97.向实施例2中制造的模拟肺组织的微流控系统的第一层(或者上层)的第一注入口(inlet)中注入气体(该气体为与气泵、气体传感器和管道连接而流经的空气,并且在室温下由实际大气中的空气组成),向第二注入口(inlet)中注入培养液(stemcell,pneumacult
tm-ali#05001,500ml)后,以5μl/min的速度灌流4天,以制造与活体内肺组织类似的微流控系统。另外,通步骤序来调节压力范围,使灌流气体的周期为10-12次/分钟,模拟实际的呼吸运动(图14e和14f)。
98.实验例1确定模拟肺组织的微流控系统中的细胞是否存活
99.确定在根据实施例2制造的模拟肺组织的微流控系统中,如实施例3所述灌流流体并经过数日后,该系统中的肺上皮细胞、肺纤维母细胞、血管内皮细胞是否存活。本实验为确定细胞培养后是否存活,使用live/dead
tm
生存能力/细胞毒性试剂盒(invitrogen,#l3224),在37℃下分别将存活的细胞和死亡的细胞染色30分钟后,用共聚焦显微镜(carl zeiss,lsm710)来确定存活情况。
100.图12a至图12d为灌流流体经过4天后的免疫荧光分析结果,可确定经过4天后模拟肺组织的微流控系统中的肺上皮细胞、肺纤维母细胞和血管内皮细胞均存活。
101.另外,图13a至图13b为灌流流体经过2天后以及图14a至图14d为灌流流体经过4天后的免疫荧光分析结果,可确定经过2天和4天后,模拟肺组织的微流控系统中的肺上皮细胞、肺纤维母细胞和血管内皮细胞也均存活。
102.特此说明,以上的图12a至图12d、图13a和图13b为利用从实施例1中获取的肺上皮细胞的情况,图14a至图14d为利用calu-3的情况。
103.实验例2确定模拟肺组织的微流控系统中的氧气运输和ph调节
104.氧气运输和ph调节是肺最重要且最基本的功能,为了对其进行确定,在实施例2中
制造的模拟肺组织的微流控系统中,在按照实施例3所述灌流流体后测定氧气分压和ph。ph传感器的测定步骤如下。在上端和下端的玻璃芯片内侧安装ph传感器,在细胞培养步骤中,使与用于监测的电脑连接的ph-1微型v2变送器(ph-1mini v2 transmeter)的光纤电缆从外部与传感器接触,以实时测定ph。o2传感器的测定步骤如下。在上端和下端的玻璃芯片内侧安装o2传感器,在细胞培养步骤中,使po
2 microox4变送器的光纤电缆从外部与传感器接触,以实时测定po2。
105.图15a和图15b为在根据本发明的一个实施例的模拟肺组织的微流控系统中灌流流体后,利用内部的ph测定传感器和po2测定传感器来测定ph(图15a)和po2(图15b)的结果图。
106.如图15a和图15b所示,可确定系统内部的氧气分压相当于大气中的氧气分压的20%,ph也与注入的细胞培养液的ph相同,为7.0至8.0。
107.即,利用实施例2中制造的模拟肺组织的微流控系统,可实时测定氧气分压和ph,由此可调节向该系统内部运输的氧气量及该系统内部的ph。
108.产业利用性
109.根据本发明的一方面提供的模拟肺组织的微流控系统,可实现包括肺疾病模型的实现、治疗药物的药效测试以及其他有害物质的测试等广泛领域的研究,进一步也可适用于体外诊断和定制药物处方等。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1