靶向CD7的工程化免疫细胞、嵌合抗原受体、CD7阻断分子及应用的制作方法
本发明涉及细胞免疫治疗技术领域,具体地,涉及靶向cd7的免疫治疗方法,尤其是一种靶向cd7的工程化免疫细胞、嵌合抗原受体、cd7阻断分子及应用。
背景技术:
t细胞恶性肿瘤是一组异质性很强的克隆性生长和t细胞功能障碍性疾病,主要分为t细胞淋巴瘤(t-celllymphomas,tcls)和t细胞白血病,具有成熟和前体亚型。这类疾病代表了一类极其恶性的血液系统癌症,在儿童和成人中复发率和死亡率都很高,目前还没有有效或针对性的治疗方法。尽管现有技术中已经有多种的化疗方案,在患有t细胞急性淋巴细胞白血病(t-cellacutelymphoblasticleukemia,t-all)的病患中,只有不到50%的成人和75%的儿童能够存活5年以上。对于初次治疗后复发的患者,挽救性化疗方案只是对20%-40%的病例能够起到诱导缓解效果。在复发或化疗难治性t细胞恶性肿瘤患者中,治疗预后较差,而有效且可耐受的治疗方法有限。对于10-50%在挽救性化疗后获得完全缓解(cr)的患者,唯一的治疗选择仍然是异基因干细胞移植(allogeneicstemcelltransplantation,asct)。然而,asct的治愈率仍保持在30%或更低,而且并非所有cr患者都有资格接受移植。其他t细胞恶性肿瘤,包括皮肤和外周t细胞淋巴瘤(分别为ctcl和ptcl)对化疗的初始反应率更低,即使在有反应的患者中,无进展生存率仍保持在40–50%。因此,尽管在治疗t细胞恶性肿瘤方面取得了进展,但是仍然需要新的、有针对性的治疗方案来改善预后,特别是对于复发和难治的患者。除了t细胞恶性肿瘤,如t-all和t-nhl,必须认识到还有其他cd7+血液恶性肿瘤仍然缺乏有效治疗和靶向治疗方案,如20%-30%的急性髓性白血病(aml),以及绝大部分的nk和nkt淋巴瘤。
嵌合抗原受体t(car-t)细胞是最有前途的肿瘤免疫治疗方法之一,对b淋巴细胞恶性肿瘤患者能够产生显著的应答率。因此,以cd19(一种在b细胞白血病和淋巴瘤中广泛表达的抗原)为靶点的car-t细胞已成为首个获得许可的癌症t细胞疗法。cd19car-t细胞在治疗复发性和难治性b细胞恶性肿瘤方面的成功使其在其他肿瘤中的应用更加广泛。鉴于b淋巴细胞和t淋巴细胞恶性肿瘤之间的相似性,将car-t细胞治疗扩展到这些疾病似乎很简单。然而,针对t细胞恶性肿瘤的car-t细胞治疗已被证明很难开发和实施。这主要是由于在工程化t细胞上同时表达靶抗原可导致car-t细胞在制备过程中自相残杀;同时,car-t细胞回输后正常外周血t细胞的清除可导致严重的免疫缺陷。
cd7是一种跨膜糖蛋白,通常表达在大多数外周血t细胞和nk细胞(nk细胞即自然杀伤细胞,来源于骨髓淋巴样干细胞,其分化发育依赖于骨髓及胸腺微环境,主要分布于骨髓、外周血、肝、脾、肺和淋巴结;nk细胞不同于t、b细胞,是一类无需预先致敏就能非特异性杀伤肿瘤细胞和病毒感染细胞的淋巴细胞)及其前体细胞上,作为一种辅助t细胞活化和与其他免疫亚群相互作用的共刺激蛋白。95%以上的淋巴母细胞性白血病和淋巴瘤以及部分外周t细胞淋巴瘤表达cd7。在小鼠动物模型中,缺乏cd7的t细胞在很大程度上表现出不受干扰的发育、稳态和保护功能。由于cd7对外周血t细胞功能没有显著的影响,因此它是一个很有前途的car-t细胞治疗靶标。cd7曾被作为单克隆抗体(mab)的靶标采用免疫毒素治疗t细胞恶性肿瘤患者进行过评估。这种单克隆抗体的偶联物没有产生严重的cd7相关的毒副作用,但抗肿瘤反应不显著,这可能是由于鼠源抗体在患者治疗上的有限活性所致。
现有技术中,关于靶向cd7的治疗研究进展如下:
i)cd7-car-t细胞治疗;表达嵌合抗原受体(car)的t细胞是一种很有前途的肿瘤免疫治疗方法。这种靶向治疗在获得b细胞白血病和淋巴瘤患者缓解甚至长期无复发生存方面显示出巨大的潜力。最近已有几个研究小组报告了cd7特异性car-t细胞治疗在t细胞恶性肿瘤的临床前模型中的研究进展。在所有这些研究中,cd7-car在t细胞上的表达导致严重的自杀现象,造成car-t细胞无法在体外扩增。
靶标特异性的car在所转导t细胞上的表达可以造成因持续的配体结合引起的car受体激活,可导致转导t细胞的自杀和加速细胞的终末分化使其在体内不能长期存活。由于cd7是一种泛t细胞抗原,在大部分t细胞上均有表达。因此cd7抗原特异性的car-t细胞在制备过程中可产生严重的自杀现象,从而造成car-t细胞无法有效地扩增。现有两种策略来减少这种自杀现象:1)使用基因组编辑工具敲除cd7靶抗原的基因;2)通过cd7结合域在内质网锚定的方法阻止cd7蛋白在细胞内表达过程中转运到细胞表面。这两种方法都可以有效地降低cd7在细胞表面的表达,并最大限度地减少了靶向cd7-car-t细胞的自杀现象。重要的是,cd7的缺失并不影响car-t细胞的增殖和短期效应功能,使具有高抗肿瘤活性的功能性car-t细胞得以扩增。
从细胞表面上去除cd7后,cd7-car-t细胞在体外和体内对原发性cd7阳性t-all和淋巴瘤具有较强的抗肿瘤活性。cd7-car-t细胞对外周血cd7阳性t细胞和nk细胞也具有杀伤性,这表明这些细胞亚群也将成为cd7-car-t细胞的靶点。
使用自体细胞进行过继性细胞治疗的一个风险是无意中将外周血的恶性肿瘤细胞也同时进行基因修饰。用car基因修饰的恶性t细胞,在某些情况下,允许它们进行基因编辑以降低目标分子的表达可能是一个真实存在的风险,因此需要在使用这些治疗的知情同意书中加以说明。然而,考虑到在制造过程中恶性肿瘤细胞的存活率和扩增性较差,这些不必要的恶性细胞基因修饰应该以较低的频率发生。此外,在缺乏基因编辑以降低靶抗原表达的情况下,表达靶抗原的恶性肿瘤细胞在转导后和输注到患者体内之前可能会被car-t细胞自相残杀而清除。同时,可以采用健康供者生产的异基因cd7-car-t细胞用于治疗复发性和难治性t细胞恶性肿瘤,以达到将患者桥接造血干细胞移植的目的,或用于治疗造血干细胞移植后复发的t细胞恶性肿瘤。如果移植物抗宿主的副作用能够得到适当的控制,异基因cd7-car-t细胞治疗的优势是除了可以由健康供者提供t细胞外,还可以产生移植物抗白血病的效应。利用现成的同种异体t细胞或nk细胞作为运载工具,可以完全避免基因修饰恶性细胞的风险。由于这些细胞产物将由健康的供者产生,这样可以避免使用患者来源的t细胞,这些t细胞往往由于长期处于抑制性肿瘤微环境或因经受过先前的强化治疗而功能低下。
ii)靶向cd7的免疫毒素;cd7在t细胞上以高密度(约60000mol/cell)表达,即使被单价抗体片段结合,cd7也被迅速内化。因此,它是免疫毒素介导治疗t细胞肿瘤的理想靶抗原。目前,抗cd7免疫毒素主要由抗cd7单克隆抗体与毒素偶联而成。采用鼠抗人cd7单克隆抗体(wti)与蓖麻毒素a结合的抗cd7免疫毒素曾被用来在体外清除肿瘤细胞以用于t细胞恶性肿瘤患者的自体骨髓移植。免疫毒素da7通过化学的方法连接小鼠igg2b抗cd7(3ale)单克隆抗体与去糖基化蓖麻毒蛋白a链而构建,曾被用于scid动物模型中治疗人的t-all,提示其对预后不良的t细胞白血病具有潜在的治疗作用。在da7的i期临床试验中,尽管受到不稳定性和血管毒性的限制,在其最大耐受剂量下实现了客观的临床反应。抗人cd7的单克隆抗体th69也曾被用来构建重组免疫毒素,该抗体通过基因重组的方法将单链抗体片段(scfv)与截短的假单胞菌外毒素a片段相连。
iii)基因敲除;靶向基因编辑t细胞在过继免疫治疗的临床可行性已经得到了很好的证明。使用锌指核酸酶对cd4阳性t细胞中的hiv共受体ccr5进行基因敲除,使这些细胞对hiv感染具有抵抗力,并使ccr5阴性的t细胞能够在hiv感染患者中植入并持续存在。采用talens对cd19car-t细胞中的t细胞受体(tcr)基因进行敲除,使第三方t细胞可以成功治疗b细胞白血病患者,这是“通用”现成t细胞产品的一个令人鼓舞的里程碑,极大地降低了移植物抗宿主病的风险。在此项研究中,cd52基因也在回输的car-t细胞中进行了敲除,从而使其对阿来单抗产生抗药性。最近,crispr/cas9系统被用来敲除cd7或在敲除cd7的同时也敲除了t细胞受体α链,这一新的基因编辑系统可以快速有效地敲除t细胞中的靶基因。
iv)细胞内蛋白表达阻断技术;在许多生化和免疫系统中,通常很难判定某些特定分子的作用,但有一种方法是抑制基因表达并寻找其功能效应。通过同源重组或近年来发展的基因编辑技术,如zincefinger核酸酶、talens和crispr/cas9进行基因敲除。虽然这些技术十分强大,但在实践中有很多不足或技术上的困难。因此非常需要发展一种简单有效、可控地去除分子的技术。
已有大量研究表明采用细胞内抗体可以靶向灭活细胞内的重要分子。通过构建抗体的重链和轻链转染哺乳动物细胞,并对其先导序列进行简单的修改,就可以把抗体序列锚定在三个主要细胞内区域:内质网(er)/高尔基体、胞浆和细胞核。最初的细胞内抗体研究使用全igg,但近来的研究集中在fab'和单链抗体(scfv)上。单链抗体分子很小(约30kda),通过短肽序列连接重链和轻链的可变区来构建。这些构建产物作为细胞内抗体有许多优点,主要是它们无需将两个独立的抗体链结合形成抗原结合位点。
到目前为止,已有研究表明细胞内抗体可用来防止hivgp160到gp130在细胞内质网中的处理;阻断il-2受体α链的表达;抑制酵母、非洲爪蟾卵母细胞及人源t细胞株中的胞浆酶和抑制转基因植物中的病毒活性。marasco及其同事的研究表明,单链抗体可以在er中起作用。greenman等人的研究表明,细胞内单链抗体可以用来防止细胞膜蛋白的表达,他们采用的是一种可以结合t淋巴细胞表面抗原cd2的高亲和力单克隆抗体和一个er滞留信号(kdel)。
抗原识别域是car结构的重要组成部分,负责与肿瘤细胞表面抗原结合。目前,cd7特异性car-t细胞治疗的抗原识别域大多由小鼠或羊驼源性抗体的可变区组成。一旦回输至患者体内,这些携带异种抗原识别域的car-t细胞可诱导很强的宿主细胞和体液反应,回输的car-t细胞被宿主免疫迅速清除,严重影响car-t细胞在体内的持久性,最终导致疾病的难治和复发。本发明采用天然的人源cd7配体作为car的抗原识别域,其优势在于,由此构建的靶向cd7-car-t不会诱导产生宿主的免疫反应,可以在体内长期存活,从而达到更好的疗效。
技术实现要素:
针对现有技术中的缺陷,本发明的目的是提供一种靶向cd7的工程化免疫细胞、嵌合抗原受体、cd7阻断分子及应用。
本发明的目的是通过以下方案实现的:
本发明的第一方面提供一种工程化免疫细胞,其中包括编码嵌合抗原受体的多核苷酸序列,所述嵌合抗原受体包括靶向cd7的抗原识别域。
在另一优选例中,所述嵌合抗原受体还包括铰链跨膜域、细胞内共刺激域和细胞内主要刺激域。
在另一优选例中,所述嵌合抗原受体中铰链跨膜域选自以下至少一组的氨基酸序列:来源于t细胞受体的α链、β链,cd3δ,cd3ε,cd3γ,cd3ζ链,cd4,cd5,cd8α,cd8β,cd9,cd16,cd22,cd28,cd32,cd33,cd34,cd35,cd37,cd45,cd64,cd80,cd86,cd137,icos,cd154,fas,fgfr2b,ox40或vegfr2的氨基酸序列。
在另一优选例中,所述嵌合抗原受体中铰链跨膜域来源于cd8α。
在另一优选例中,所述嵌合抗原受体中铰链跨膜域cd8α的氨基酸序列如seqidno.1所示。
在另一优选例中,所述嵌合抗原受体中细胞内共刺激域选自以下至少一种:为cd2,cd4,cd5,cd8α,cd8β,cd27,cd28,cd30,cd40,4-1bb(cd137),icos,ox40,light(cd258)或nkg2c。
在另一优选例中,所述嵌合抗原受体中细胞内共刺激域来源于4-1bb。
在另一优选例中,所述嵌合抗原受体中细胞内共刺激域4-1bb的氨基酸序列如seqidno.2所示。
在另一优选例中,所述嵌合抗原受体中铰链跨膜域和细胞内共刺激域来源于cd28。
在另一优选例中,所述嵌合抗原受体中铰链跨膜域和细胞内共刺激域cd28的氨基酸序列如seqidno.3所示。
在另一优选例中,所述嵌合抗原受体中细胞内主要刺激域选自以下至少一种:cd3δ,cd3ε,cd3γ,cd3ζ,fcrβ,fcrγ,cd5,cd66,cd22,cd79a或cd79b。
在另一优选例中,所述嵌合抗原受体中细胞内主要刺激域来源于cd3ζ。
在另一优选例中,所述嵌合抗原受体中细胞内主要刺激域cd3ζ的氨基酸序列如seqidno.4所示。
在另一优选例中,所述嵌合抗原受体中靶向cd7的抗原识别域为人源cd7-l细胞外结构域的部分或全部序列,或者与人源cd7-l细胞外结构域至少具有90%的序列一致性,所述人源cd7-l细胞外结构域的氨基酸序列如seqidno.5所示。
在另一优选例中,所述工程化免疫细胞内还包括cd7阻断分子,cd7阻断分子包括cd7结合域和胞内锚定域,cd7阻断分子能够阻止cd7蛋白在细胞表面的转运与表达。
在另一优选例中,所述cd7阻断分子具体为通过cd7结合域连接胞内锚定域阻止cd7蛋白向细胞表面转运。
在另一优选例中,所述胞内锚定域为内质网滞留域、高尔基体滞留域或蛋白酶体定位域的氨基酸序列。
在另一优选例中,所述胞内锚定域为内质网滞留域。
在另一优选例中,所述胞内锚定域内质网滞留域的氨基酸序列如seqidno.6或seqidno.7所示。
在另一优选例中,所述cd7结合域为人源cd7-l细胞外结构域的部分或全部序列,或者与人源cd7-l细胞外结构域至少具有90%的序列一致性,所述人源cd7-l细胞外结构域的氨基酸序列如seqidno.5所示。
在另一优选例中,所述cd7结合域为抗cd7的单克隆抗体th69的scfv。
在另一优选例中,所述嵌合抗原受体中靶向cd7的抗原识别域为抗cd7的单克隆抗体th69的scfv,或者与抗cd7的单克隆抗体th69的scfv至少具有90%的序列一致性,所述抗cd7的单克隆抗体th69的scfv的氨基酸序列如seqidno.8所示。
在另一优选例中,所述工程化免疫细胞内还包括cd7阻断分子,cd7阻断分子能够阻止cd7蛋白在细胞表面的转运与表达。
在另一优选例中,所述cd7阻断分子为通过cd7结合域连接胞内锚定域阻止cd7蛋白向细胞表面转运。
在另一优选例中,所述胞内锚定域为内质网滞留域、高尔基体滞留域或蛋白酶体定位域的氨基酸序列。
在另一优选例中,所述cd7结合域为人源cd7-l细胞外结构域的部分或全部序列,或者与人源cd7-l细胞外结构域至少具有90%的序列一致性,所述人源cd7-l细胞外结构域的氨基酸序列如seqidno.5所示。
在另一优选例中,所述工程化免疫细胞通过基因敲除技术去除cd7的基因表达。
在另一优选例中,所述敲除技术采用的基因组编辑工具为talens或crispr/cas9。
在另一优选例中,所述细胞为t细胞、γδt细胞、nk或nkt细胞及诱导多能干细胞(ipsc)分化的t细胞、γδt细胞、nk或nkt细胞。
本发明的第二方面提供一种嵌合抗原受体中靶向cd7的抗原识别域,所述抗原识别域的序列包括部分或全部序列的人源cd7-l细胞外结构域,或者与人源cd7-l细胞外结构域至少具有90%序列一致性;所述人源cd7-l细胞外结构域的氨基酸序列如seqidno.5所示。
本发明的第三方面提供一种上述所述的靶向cd7的抗原识别域在制备抗cd7阳性血液恶性肿瘤的免疫毒素中的应用。
本发明的第四方面提供一种编码上述所述的嵌合抗原受体中靶向cd7的抗原识别域的核酸分子。
在另一优选例中,所述编码嵌合抗原受体中靶向cd7的抗原识别域的核酸分子为cd7bb-002;所述cd7bb-002的核苷酸序列如seqidno.9所示。
本发明的第五方面提供一种重组载体,包含上述所述的编码嵌合抗原受体中靶向cd7的抗原识别域的核酸分子。
在另一优选例中,载体选自逆转录病毒、慢病毒或转座子。
本发明的第六方面提供一种上述所述的重组载体在制备工程化免疫细胞中的用途。
本发明的第七方面提供一种用于制备上述所述的工程化免疫细胞的cd7阻断分子,所述cd7阻断分子的cd7结合域包括部分或全部序列的人源cd7-l细胞外结构域,或与人源cd7-l细胞外结构域至少具有90%序列一致性的蛋白质。
本发明的第八方面提供一种编码上述所述的cd7阻断分子的核酸序列。
在另一优选例中,所述cd7阻断分子的核酸序列为cd7-l-er2.1;所述cd7-l-er2.1的核苷酸序列如seqidno.10所示。
本发明的第九方面还提供一种用于制备上述第一方面所述的工程化免疫细胞的cd7阻断分子,所述cd7阻断分子的cd7结合域为抗cd7的单克隆抗体th69的scfv,或者与抗cd7的单克隆抗体th69的scfv至少具有90%的序列一致性的蛋白质。
本发明的第十方面提供一种编码第九方面所述的cd7阻断分子的核酸序列。所述cd7阻断分子的核酸分子的编码序列为th69-er2.1;所述th69-er2.1的核苷酸序列如seqidno.11所示。
本发明的第十一方面提供一种重组载体,包括第八方面或第十方面提供的编码cd7阻断分子的核酸序列。
在另一优选例中,所述载体选自逆转录病毒、慢病毒或转座子。
本发明的第十二方面提供一种上述第十一方面提供的重组载体在制备工程化免疫细胞中的用途。
本发明的第十三方面提供一种编码同时含有第二方面所述的嵌合抗原受体中靶向cd7的抗原识别域以及cd7阻断分子(第七方面或第九方面提供的cd7阻断分子)的核酸分子。
本发明的第十四方面提供一种重组载体,包括第十三方面所述的核酸分子。
在另一优选例中,所述载体选自逆转录病毒、慢病毒、转座子。
在另一优选例中,所述重组载体包含如下序列:cd7bb-bl4-002或cd7bb-bl6-002,所述重组载体cd7bb-bl4-002或cd7bb-bl6-002的载体序列示意图分别如图5中a和b所示。
在另一优选例中,所述重组载体cd7bb-bl4-002由cd7bb-002和th69-er2.1通过t2a连接,所述重组载体的序列结构示意图如图5中a的(1)和(2)所示,所述t2a的氨基酸序列如seqidno.16所示。
在另一优选例中,所述重组载体cd7bb-bl6-002由th69bb-002和cd7-l-er2.1通过t2a连接,所述重组载体的序列结构示意图如图5中b的(3)和(4)所示,所述t2a的氨基酸序列如seqidno.16所示。
在另一优选例中,所述载体的信号肽来源于cd8α。
在另一优选例中,所述载体的cd8α信号肽的氨基酸序列如seqidno.12所示。
在另一优选例中,所述载体的信号肽来源于gm-csf-r。
在另一优选例中,所述载体的gm-csf-r信号肽的氨基酸序列如seqidno.13所示
在另一优选例中,所述载体的scfv的轻链和重链通过(ggggs)3连接肽相连,所述连接肽的氨基酸序列如seqidno.14所示。
在另一优选例中,所述载体的scfv的轻链和重链通过whitlow连接肽相连,所述连接肽的氨基酸序列如seqidno.15所示。
在另一优选例中,所述载体中编码嵌合抗原受体的核酸分子和编码cd7阻断分子的核酸分子由内部核糖体进入位点(internalribosomeentrysite,ires)or或核糖体密码子跳过位点(aribosomalcodonskippingsite)连接。
在另一优选例中,所述载体的内部核糖体进入位点(internalribosomeentrysite,ires)来源于脑心肌炎病毒(encephalomyocarditisvirus,emcv)或肠病毒(enterovirus)。
在另一优选例中,所述载体的核糖体密码子跳过位点包含2a自裂解肽,2a自裂解肽可以选自口蹄疫病毒f2a肽(foot-and-mouthdiseasevirus2apeptide),马甲鼻炎病毒e2a肽(equinerhinitisavirus2apeptide),猪破伤风病毒p2a肽(porcineteschovirus-12apeptide)或t2a肽(thoseaasignavirus2a)。
在另一优选例中,所述载体的2a自裂解肽来源于t2a。
在另一优选例中,所述载体的t2a自裂解肽的氨基酸序列如seqidno.16所示。
在另一优选例中,所述载体的2a自裂解肽来源于f2a。
在另一优选例中,所述载体的f2a自裂解肽的氨基酸序列如seqidno.17所示。
本发明的第十五方面提供一种第十四方面所述的重组载体在制备工程化免疫细胞中的用途。
本发明的第十六方面提供一种试剂组合,所述组合包括:(1)上述第五方面所述的重组载体,以及(2)上述第十一方面所述的载体。
本发明的第十七方面提供第十六方面所述的试剂组合在制备治疗cd7阳性血液恶性肿瘤的car-t或car-nk细胞中的用途。
本发明的第十八方面提供一种试剂组合,所述组合包括:(1)上述第五方面所述的载体,以及(2)能够敲除细胞中的cd7基因的基因编辑工具。
在另一优选例中,所述基因编辑工具为talens或crispr/cas9。
本发明的第十九方面提供一种嵌合抗原受体中靶向cd7的抗原识别域序列,所述序列为抗cd7的单克隆抗体th69的scfv,或者与抗cd7的单克隆抗体th69的scfv至少具有90%的序列一致性,所述抗cd7的单克隆抗体th69的scfv的氨基酸序列如seqidno.8所示。
本发明的第二十方面提供一种编码第十九方面所述的嵌合抗原受体中靶向cd7的抗原识别域序列的核酸分子。
在另一优选例中,第二十方面所述核酸分子编码序列为th69bb-002,所述th69bb-002的核酸分子序列如seqidno.18所示。
本发明的第二十一方面提供一种重组载体,包含第二十方面所述的核酸分子的序列。
在另一优选例中,载体选自逆转录病毒、慢病毒、转座子。
本发明的第二十二方面提供一种试剂组合,所述组合包括:
(1)第二十一方面所述的重组载体,
以及(2)选择以下组合中的一种:含有第八方面所述核酸序列的重组载体,或能够敲除细胞中的cd7基因的基因编辑工具。
本发明的第二十三方面提供一种第二十二方面所述的试剂组合在制备治疗cd7阳性血液恶性肿瘤的car-t或car-nk细胞中的用途。
与现有技术相比,本发明具有如下的有益效果:本发明是利用人源cd7-l取代抗体序列作为cd7特异性car-t细胞的抗原识别域,在靶向cd7car中使用人源cd7-l作为抗原识别域的优点是可以防止宿主产生的细胞和体液反应,从而实现回输后car-t细胞在体内的长期生存和更好的疗效。
cd7是一种跨膜糖蛋白,通常在大多数外周t细胞和nk细胞及其前体表达。病变的t细胞和nk细胞本身会高密度表达cd7;缺乏cd7的t细胞在很大程度上表现出不受干扰的发育、稳态和保护功能;由于cd7对外周血t细胞功能的影响不明显,因此cd7是一个很有前途的car-t细胞治疗靶点。由于正常和病变的t细胞本身都会表达cd7,所以在进行嵌合抗原受体(chimericantigenreceptor,car)t细胞制备时,需要同时考虑两方面的因素:1、对正常t细胞进行基因修饰,使t细胞表达靶向cd7的嵌合抗原受体(car-t),以杀伤cd7阳性的病变t细胞;2、为避免car-t细胞发生因互相识别产生的自杀现象,需要阻断car-t细胞本身的cd7表达。因此,本发明的技术方案既对正常t细胞进行基因修饰使t细胞表达cd7特异性car,同时又兼顾了对正常t细胞内部的cd7表达进行阻断。本发明的申请人经过大量的实验,不断修正验证实验参数,最终获得本发明之技术方案,本发明的技术方案能够对正常t细胞进行基因修饰使t细胞表达cd7特异性car,同时能够对正常t细胞的cd7表达进行阻断,实现了意想不到的技术效果。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
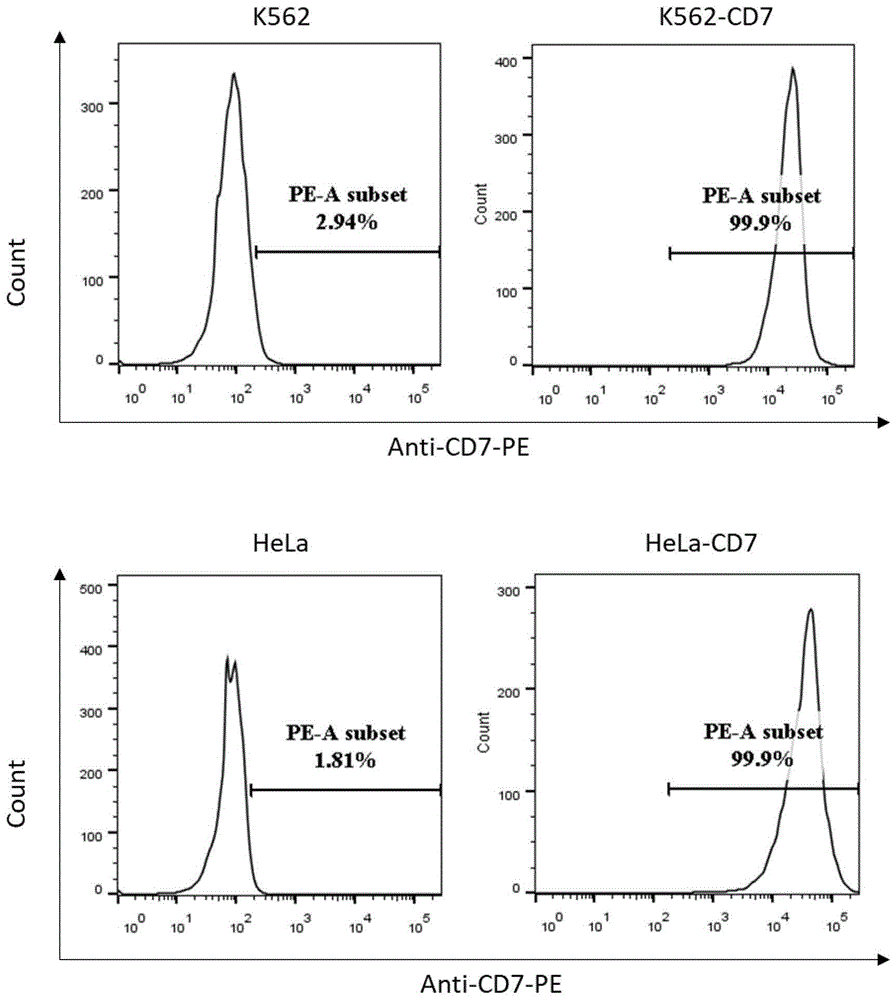
图1为建立表达cd7的k562和hela细胞株。采用携带cd7cdna的慢病毒载体转导k562和hela细胞株,并通过流式分选获得k562-cd7和hela-cd7。图示为流式检测cd7在k562和hela细胞株上的表达。
图2为cd7-car和cd7阻断分子的载体结构示意图。a和b为两种第二代cd7特异性car。其中,a、cd7bb-002的抗原识别区为cd7-l;b、th69bb-002的抗原识别区为单克隆抗体th69的scfv;两种car载体具有相同的cd8a铰链跨膜区,4-1bb共刺激域和cd3ζ为t细胞刺激域。单克隆抗体th69的scfv采用了cd8α信号肽,其轻链(vl)和重链(vh)可变区的连接肽为(ggggs)3。c和d为两种cd7阻断分子。其中,c、cd7-l-er2.1的cd7结合域为cd7-l;d、th69-er2.1的cd7结合域为th69的scfv,其采用了cd8α信号肽,其轻链(vl)和重链(vh)可变区的连接肽为(ggggs)3;两种cd7阻断分子具有相同的er内质网滞留域。
图3为cd7-car-t细胞的流式检测和体外杀伤实验结果示意图。a、流式检测cd7bb-002和th69bb-002两种靶向cd7的car在t细胞上的表达;b、采用icelligencetm实时细胞分析仪(agilentbiosciences,inc.)进行体外杀伤实验;“tcellcontrol”为未转导的t细胞对照,“cd7bb-002”为表达cd7bb-002的car-t细胞,“th69bb-002”为表达th69bb-002的car-t细胞。结果表明这两种car-t细胞都能够靶向cd7进行肿瘤细胞杀伤。cd7-car-t细胞的流式检测试剂为cd7-car-green;细胞体外杀伤实验采用的靶细胞为hela-cd7。
图4为采用intrablocktmcd7表达阻断技术阻断cd7在细胞膜上的表达结果示意图。采用携带可与cd7结合的配体cd7-l或th69scfvcdna,并连接er滞留域的慢病毒载体cd7-l-er2.1和th69-er2.1转导k562-cd7细胞株(a)或t细胞(b),并进行cd7的流式检测。结果表明这两种cd7表达阻断分子都能够有效减少cd7在细胞表面的表达。
图5为采用intrablocktmcd7表达阻断技术构建靶向cd7car的慢病毒载体结构示意图。a和b为两种采用intrablocktmcd7表达阻断技术构建的cd7-car慢病毒载体。其中,a、cd7bb-bl4-002,(1)为靶向cd7的嵌合抗原受体示意图,其抗原识别区为cd7-l;(2)为cd7阻断分子示意图,起到cd7表达阻断作用的cd7结合域为单克隆抗体th69的scfv;b、cd7bb-bl6-002,(3)为靶向cd7的嵌合抗原受体示意图,其抗原识别区为单克隆抗体th69的scfv;(4)为cd7阻断分子示意图,起到cd7表达阻断作用的cd7结合域为cd7-l;两种car载体具有相同的cd8α铰链跨膜区,4-1bb共刺激域、cd3ζt细胞刺激域和er内质网滞留域。单克隆抗体th69的scfv采用了cd8α信号肽,其轻链和重链可变区的连接肽为(ggggs)3。
图6、采用intrablocktmcd7表达阻断技术后cd7-car-t细胞可以克服自杀现象有效地杀伤靶细胞。(a)中,a、流式检测靶向cd7的四种不同car在t细胞上的表达;b、流式检测cd7在上述四种不同car-t细胞上的表达;所用载体分别为:cd7bb-002、th69bb-002和采用intrablocktmcd7表达阻断技术构建的cd7bb-bl4-002和cd7bb-bl6-002;虚线为未转导的t细胞对照,实线为靶向cd7的car转导过的t细胞。(b)中,c、上述四种不同car-t细胞在体外培养的增殖观察;d、采用icelligencetm实时细胞分析仪(agilentbiosciences,inc.)进行体外杀伤实验。tcellcontrol为未转导的t细胞对照,cd7bb-002、th69bb-002、cd7bb-bl4-002和cd7bb-bl6-002均为靶向cd7的car-t细胞,其中cd7bb-bl4-002和cd7bb-bl6-002为采用intrablocktmcd7表达阻断技术的cd7-car-t细胞。cd7-car-t细胞的流式检测试剂为cd7-car-green;细胞体外杀伤实验采用的靶细胞为hela-cd7。
图7、采用intrablocktmcd7表达阻断技术的cd7-car-t细胞体内肿瘤杀伤实验结果图。采用雌性nsg小鼠,d0天注射肿瘤细胞(携带荧光素酶的肿瘤细胞株,ccrf-cem-luc,5x10e5/mouse,i.v.)。a、1.阴性对照组;2和3.分别为回输t细胞对照组和靶向cd7的cd7bb-bl4-002car-t细胞治疗组。在注射肿瘤细胞后d3天,分别静脉注射t细胞或cd7bb-bl4-002car-t细胞(8x10e6/mouse),之后每7天进行小鼠活体荧光素酶成像观察。b、回输t细胞对照组(controlgroup)和cd7bb-bl4-002car-t细胞治疗组(treatmentgroup)小鼠的生存曲线。
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变化和改进。这些都属于本发明的保护范围。
本发明将sectm1(k12)的胞外域作为cd7的抗原识别域,用于开发针对cd7阳性血液恶性肿瘤的car-t细胞治疗和免疫毒素。在此专利申请中,使用cd7-l代替sectm1或k12。cd7-l基因最初被鉴定为在人类17号染色体上cd7基因的5′端。人类cd7-l蛋白主要表达于脾脏、前列腺、睾丸、小肠和外周血白细胞,cd7-l的一个特点是编码一种跨膜蛋白,细胞外结构域类似于免疫球蛋白样的结构域。cd7-l于2000年被克隆,并发现它是cd7的结合蛋白。
为了确定cd7-l蛋白的结合作用,之前的研究采用了cd7-l的细胞外域(氨基酸1-145)与人igg1的fc部分的融合蛋白。流式细胞术实验表明,cd7-l-fc融合蛋白可在人源t细胞和nk细胞上检测到高水平结合。几种靶向cd7的抗体不同程度地阻断了cd7-l-fc融合蛋白与细胞的结合。反之亦然,cd7-l-fc融合蛋白可以阻断这些cd7单克隆抗体与cd7的结合,表明cd7-l-fc可与细胞上的cd7受体结合。将cd7-l-fc融合蛋白进行放射标记并用于结合实验,以确定其与jurkat细胞(人类t细胞白血病细胞系)或kg-1细胞(人类粒细胞白血病细胞系)的亲和力,这两种细胞都表达cd7。cd7-l-fc对人cd7的结合亲和力(ka)约在1x108m-1范围内。由于cd7被认为是t细胞恶性肿瘤的良好标记物,已有研究通过抗人cd7单克隆抗体偶联蓖麻毒素或皂甙制造免疫毒素。
因此,本专利申请在构建靶向cd7的嵌合抗原受体及其cd7的阻断分子中使用cd7-l的胞外结构域,用于发展cd7-car-t或car-nk细胞治疗t细胞恶性肿瘤。同时,本专利申请还将cd7-l的胞外区域与毒素相结合,并将这些结合物用作抗t细胞恶性肿瘤的免疫毒素,因其免疫原性低于基于抗体的结合物,因此可能具有更长的半衰期。
实施例1、采用cd7-l为抗原识别域的car-t细胞可以有效地识别cd7肿瘤抗原;
本实施例首先构建了以cd7-l或cd7特异性单克隆抗体th69的scfv为抗原识别区的两种第二代car慢病毒载体,cd7bb-002和th69bb-002(图2a、b)。通过car慢病毒载体转导获得car-t细胞,并采用cd7和报告基因egfp融合蛋白生产的cd7-car-t细胞的流式检测试剂(cd7-car-green)进行流式检测(图3a)。结果证明cd7-car-green可以有效地用来检测这两种靶向cd7的car-t细胞,说明cd7-l与单克隆抗体th69的scfv均可作为car-t细胞的cd7特异性抗原识别区。
实施例2、靶向cd7的car-t细胞可以有效地杀伤表达cd7阳性的肿瘤细胞;
本实施例首先采用携带cd7cdna的慢病毒载体转导k562和hela细胞株,并通过流式分选获得表达cd7的k562-cd7和hela-cd7细胞株(图1)。通过car慢病毒载体转导获得cd7bb-002和th69bb-002两种靶向cd7的car-t细胞,并采用icelligencetm实时细胞分析仪(agilentbiosciences,inc.)进行体外杀伤实验(图3b)。结果证明采用cd7-l为抗原识别区的cd7bb-002与采用单克隆抗体th69scfv为抗原识别区的th69bb-002均可有效地识别cd7抗原,并在cd7阳性的hela-cd7靶细胞杀伤上具有同等效果。
实施例3、intrablocktmcd7表达阻断技术可以有效地阻断cd7在细胞膜上的表达;
本实施例首先构建了以cd7-l或cd7特异性单克隆抗体th69的scfv为cd7结合域,并连接er滞留域的慢病毒载体,cd7-l-er2.1和th69-er2.1(图2c、d)。通过慢病毒载体转导k562-cd7细胞株或原代t细胞,并进行流式检测对cd7表达阻断技术进行评估。结果表明th69-er2.1和cd7-l-er2.1均可有效地阻断cd7在k562-cd7细胞株(图4a)或t细胞(图4b)上的表达,说明th69-er2.1和cd7-l-er2.1均可在细胞内与cd7结合并将其滞留在内质网。因此,这一intrablocktmcd7表达阻断技术可用来阻断cd7在细胞上的表达、防止靶向cd7car-t细胞的自杀现象。
实施例4、intrablocktmcd7表达阻断技术可用来克服cd7-car-t细胞的自杀现象和有效地杀伤cd7阳性的靶细胞;
本实施例首先构建了具有intrablocktmcd7表达阻断功能,同时靶向cd7的car慢病毒载体,cd7bb-bl4-002和cd7bb-bl6-002(图5a、b)。由于用作car-t细胞制备的t细胞上本身就表达cd7,所以在靶向cd7的car-t细胞制备时会发生自杀现象,造成car-t细胞的制备困难。如图6所示,靶向cd7的两种car-t细胞,cd7bb-002和th69bb-002均可有效地被cd7-car-green所识别(图6a),并能有效地杀伤cd7阳性的hela-cd7靶细胞(图6d)。但是,这两种靶向cd7的car-t细胞在体外培养过程中均会发生严重的自杀现象,造成car-t细胞在体外扩增和制备上的困难(图6c)。采用实施例3所描述的intrablocktmcd7表达阻断技术,进行靶向cd7的cd7bb-bl4-002和cd7bb-bl6-002慢病毒载体构建,并用来制备car-t细胞。这两种采用intrablocktmcd7表达阻断技术制备的car-t细胞,cd7bb-bl4-002和cd7bb-bl6-002均可有效地被cd7-car-green所识别(图6a)、保持hela-cd7靶细胞的杀伤能力(图6d),同时能够阻断cd7的表达(图6b)、克服在car-t细胞制备中的自杀现象(图6c),使靶向cd7特异性car-t细胞的体外扩增和制备成为可能。
实施例5、在动物模型上验证采用intrablocktmcd7表达阻断技术的cd7-car-t细胞在体内的肿瘤杀伤功能;
本实施例采用intrablocktmcd7表达阻断技术的cd7bb-bl4-002car-t细胞进行了体内肿瘤杀伤实验(图7)。采用6-8周的雌性nsg小鼠,d0天尾静脉注射携带荧光素酶的肿瘤细胞株,ccrf-cem-luc,5x10e5/mouse,i.v.。在注射肿瘤细胞后d3天,分别静脉注射t细胞(回输t细胞对照组)或cd7bb-bl4-002car-t细胞(8x10e6/mouse)(car-t细胞治疗组)。d0天后每7天进行小鼠活体荧光素酶成像观察。结果证明采用intrablocktmcd7表达阻断技术的cd7bb-bl4-002car-t细胞可以有效地在这一小鼠肿瘤模型上杀伤肿瘤,并延长了car-t细胞治疗组小鼠的生存期(如图7中a、b所示)。
与现有技术相比,本发明具有如下的有益效果:本发明是利用人源cd7-l取代抗体序列作为cd7特异性car-t细胞的抗原识别域,在靶向cd7car中使用人源cd7-l作为抗原识别域的优点是可以防止宿主产生的细胞和体液反应,从而实现回输后car-t细胞在体内的长期生存和更好的疗效。cd7是一种跨膜糖蛋白,通常在大多数外周t细胞和nk细胞及其前体表达。病变的t细胞和nk细胞本身会高密度表达cd7;缺乏cd7的t细胞在很大程度上表现出不受干扰的发育、稳态和保护功能;由于cd7对外周血t细胞功能的影响不明显,因此cd7是一个很有前途的car-t细胞治疗靶点。由于正常和病变的t细胞本身都会表达cd7,所以在进行嵌合抗原受体(chimericantigenreceptor,car)t细胞制备时,需要同时考虑两方面的因素:1、对正常t细胞进行基因修饰,使t细胞表达靶向cd7的嵌合抗原受体(car-t),以杀伤cd7阳性的病变t细胞;2、为避免car-t细胞发生因相互识别产生的自杀现象,需要阻断car-t细胞本身的cd7表达。因此,本发明的技术方案既对正常t细胞进行基因修饰使t细胞表达cd7特异性car,同时又兼顾了对正常t细胞内部的cd7表达进行阻断。本发明的申请人经过大量的实验,不断修正验证实验参数,最终获得本发明之技术方案,本发明的技术方案能够对正常t细胞进行基因修饰使t细胞表达cd7特异性car,同时能够对正常t细胞的cd7表达进行阻断,实现了意想不到的技术效果。
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变化或修改,这并不影响本发明的实质内容。intrablock系商标标识,也不构成对本发明技术方案的任何限制或缩限。在不冲突的情况下,本申请的实施例和实施例中的特征可以任意相互组合。
序列表
<110>上海雅科生物科技有限公司
<120>靶向cd7的工程化免疫细胞、嵌合抗原受体、cd7阻断分子及应用
<130>dd12447
<160>18
<170>siposequencelisting1.0
<210>1
<211>69
<212>prt
<213>人工序列(artificialsequence)
<400>1
thrthrthrproalaproargproprothrproalaprothrileala
151015
serglnproleuserleuargproglualacysargproalaalagly
202530
glyalavalhisthrargglyleuaspphealacysaspiletyrile
354045
trpalaproleualaglythrcysglyvalleuleuleuserleuval
505560
ilethrleutyrcys
65
<210>2
<211>42
<212>prt
<213>人工序列(artificialsequence)
<400>2
lysargglyarglyslysleuleutyrilephelysglnprophemet
151015
argprovalglnthrthrglnglugluaspglycyssercysargphe
202530
proglugluglugluglyglycysgluleu
3540
<210>3
<211>107
<212>prt
<213>人工序列(artificialsequence)
<400>3
ilegluvalmettyrproproprotyrleuaspasnglulysserasn
151015
glythrileilehisvallysglylyshisleucysproserproleu
202530
pheproglyproserlysprophetrpvalleuvalvalvalglygly
354045
valleualacystyrserleuleuvalthrvalalapheileilephe
505560
trpvalargserlysargserargleuleuhisserasptyrmetasn
65707580
metthrproargargproglyprothrarglyshistyrglnprotyr
859095
alaproproargaspphealaalatyrargser
100105
<210>4
<211>112
<212>prt
<213>人工序列(artificialsequence)
<400>4
argvallyspheserargseralaaspalaproalatyrglnglngly
151015
glnasnglnleutyrasngluleuasnleuglyargarggluglutyr
202530
aspvalleuasplysargargglyargaspproglumetglyglylys
354045
proargarglysasnproglngluglyleutyrasngluleuglnlys
505560
asplysmetalaglualatyrsergluileglymetlysglygluarg
65707580
argargglylysglyhisaspglyleutyrglnglyleuserthrala
859095
thrlysaspthrtyraspalaleuhismetglnalaleuproproarg
100105110
<210>5
<211>145
<212>prt
<213>人工序列(artificialsequence)
<400>5
metglnthrcysproleualapheproglyhisvalserglnalaleu
151015
glythrleuleupheleualaalaserleuseralaglnasnglugly
202530
trpaspserproilecysthrgluglyvalvalservalsertrpgly
354045
gluasnthrvalmetsercysasnileserasnalapheserhisval
505560
asnilelysleuargalahisglyglngluseralailepheasnglu
65707580
valalaproglytyrpheserargaspglytrpglnleuglnvalgln
859095
glyglyvalalaglnleuvalilelysglyalaargaspserhisala
100105110
glyleutyrmettrphisleuvalglyhisglnargasnasnarggln
115120125
valthrleugluvalserglyalagluproglnseralaproaspthr
130135140
gly
145
<210>6
<211>4
<212>prt
<213>人工序列(artificialsequence)
<400>6
lysaspgluleu
1
<210>7
<211>6
<212>prt
<213>人工序列(artificialsequence)
<400>7
serglulysaspgluleu
15
<210>8
<211>240
<212>prt
<213>人工序列(artificialsequence)
<400>8
aspileglnmetthrglnthrthrserserleuseralaserleugly
151015
aspargvalthrilesercysseralaserglnglyileserasntyr
202530
leuasntrptyrglnglnlysproaspglythrvallysleuleuile
354045
tyrtyrthrserserleuhisserglyvalproserargphesergly
505560
serglyserglythrasptyrserleuthrileserasnleuglupro
65707580
gluaspilealathrtyrtyrcysglnglntyrserlysleuprotyr
859095
thrpheglyglyglythrlysleugluilelysargglyglyglygly
100105110
serglyglyglyglyserglyglyglyglysergluvalglnleuval
115120125
gluserglyglyglyleuvallysproglyglyserleulysleuser
130135140
cysalaalaserglyleuthrphesersertyralametsertrpval
145150155160
argglnthrproglulysargleuglutrpvalalaserileserser
165170175
glyglyphethrtyrtyrproaspservallysglyargphethrile
180185190
serargaspasnalaargasnileleutyrleuglnmetserserleu
195200205
argsergluaspthralamettyrtyrcysalaargaspgluvalarg
210215220
glytyrleuaspvaltrpglyalaglythrthrvalthrvalserser
225230235240
<210>9
<211>1116
<212>dna
<213>人工序列(artificialsequence)
<400>9
atgcagacctgccccctggcattccctggccacgtttcccaggcccttgggaccctcctg60
tttttggctgcctccttgagtgctcagaatgaaggctgggacagccccatctgcacagag120
ggggtagtctctgtgtcttggggcgagaacaccgtcatgtcctgcaacatctccaacgcc180
ttctcccatgtcaacatcaagctgcgtgcccacgggcaggagagcgccatcttcaatgag240
gtggctccaggctacttctcccgggacggctggcagctccaggttcagggaggcgtggca300
cagctggtgatcaaaggcgcccgggactcccatgctgggctgtacatgtggcacctcgtg360
ggacaccagagaaataacagacaagtcacgctggaggtttcaggtgcagaaccccagtcc420
gcccccgacactggggcggccgcaacaactaccccagcacctcgaccaccaacaccagca480
cccactattgctagtcagccactgtcactgcgaccagaagcatgccgacctgcagctgga540
ggcgctgtgcacacccggggcctggactttgcctgcgacatctatatttgggctcctctg600
gcaggaacctgtggagtgctgctgctgagcctggtcatcacactgtattgtaagcgaggg660
cggaagaaactgctctacattttcaaacagccttttatgagaccagtgcagacaactcag720
gaggaagacggctgctcctgtaggttcccagaggaagaggaagggggatgcgagctgaga780
gtgaagttcagcaggagcgcagacgcccccgcgtaccagcagggccagaaccagctctat840
aacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgg900
gaccctgagatggggggaaagccgagaaggaagaaccctcaggaaggcctgtacaatgaa960
ctgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccgg1020
aggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctac1080
gacgcccttcacatgcaggccctgccccctcgctaa1116
<210>10
<211>462
<212>dna
<213>人工序列(artificialsequence)
<400>10
atgcagacctgccccctggcattccctggccacgtttcccaggcccttgggaccctcctg60
tttttggctgcctccttgagtgctcagaatgaaggctgggacagccccatctgcacagag120
ggggtagtctctgtgtcttggggcgagaacaccgtcatgtcctgcaacatctccaacgcc180
ttctcccatgtcaacatcaagctgcgtgcccacgggcaggagagcgccatcttcaatgag240
gtggctccaggctacttctcccgggacggctggcagctccaggttcagggaggcgtggca300
cagctggtgatcaaaggcgcccgggactcccatgctgggctgtacatgtggcacctcgtg360
ggacaccagagaaataacagacaagtcacgctggaggtttcaggtgcagaaccccagtcc420
gcccccgacactggggatatcagcgaaaaggacgagctgtaa462
<210>11
<211>810
<212>dna
<213>人工序列(artificialsequence)
<400>11
atggccttaccagtgaccgccttgctcctgccgctggccttgctgctccacgccgccagg60
ccggacatccagatgacacagactacatcctccctgtctgcctctctgggagacagagtc120
accatcagttgcagtgcaagtcagggcattagcaattatttaaactggtatcagcagaaa180
ccagatggaactgttaaactcctgatctattacacatcaagtttacactcaggagtccca240
tcaaggttcagtggcagtgggtctgggacagattattctctcaccatcagcaacctggaa300
cctgaagatattgccacttattattgtcagcagtatagcaagcttccgtacacgttcgga360
ggggggaccaagctggaaataaaacgtggaggaggaggaagcggaggaggaggatctgga420
ggaggcgggtctgaggtgcagctggtcgaatctggaggaggactggtgaagccaggagga480
tctctgaaactgagttgtgccgcttcaggcctgaccttctcaagctacgccatgagctgg540
gtgcgacagacacctgagaagcggctggaatgggtcgctagcatctcctctggcgggttc600
acatactatccagactccgtgaaaggcagatttactatctctcgggataacgcaagaaat660
attctgtacctgcagatgagttcactgaggagcgaggacaccgcaatgtactattgtgcc720
agggacgaagtgcgcggctatctggatgtctggggagctggcactaccgtcaccgtctcc780
agcgatatcagcgaaaaggacgagctgtaa810
<210>12
<211>21
<212>prt
<213>人工序列(artificialsequence)
<400>12
metalaleuprovalthralaleuleuleuproleualaleuleuleu
151015
hisalaalaargpro
20
<210>13
<211>22
<212>prt
<213>人工序列(artificialsequence)
<400>13
metleuleuleuvalthrserleuleuleucysgluleuprohispro
151015
alapheleuleuilepro
20
<210>14
<211>15
<212>prt
<213>人工序列(artificialsequence)
<400>14
glyglyglyglyserglyglyglyglyserglyglyglyglyser
151015
<210>15
<211>18
<212>prt
<213>人工序列(artificialsequence)
<400>15
glyserthrserglyserglylysproglyserglygluglyserthr
151015
lysgly
<210>16
<211>18
<212>prt
<213>人工序列(artificialsequence)
<400>16
gluglyargglyserleuleuthrcysglyaspvalglugluasnpro
151015
glypro
<210>17
<211>24
<212>prt
<213>人工序列(artificialsequence)
<400>17
alaprovallysglnthrleuasnpheaspleuleulysleualagly
151015
aspvalgluserasnproglypro
20
<210>18
<211>1464
<212>dna
<213>人工序列(artificialsequence)
<400>18
atggctctgcccgtcaccgctctgctgctgcctctggctctgctgctgcacgccgcaaga60
cccgacatccagatgacacagactacatcctccctgtctgcctctctgggagacagagtc120
accatcagttgcagtgcaagtcagggcattagcaattatttaaactggtatcagcagaaa180
ccagatggaactgttaaactcctgatctattacacatcaagtttacactcaggagtccca240
tcaaggttcagtggcagtgggtctgggacagattattctctcaccatcagcaacctggaa300
cctgaagatattgccacttattattgtcagcagtatagcaagcttccgtacacgttcgga360
ggggggaccaagctggaaataaaacgtggaggaggaggaagcggaggaggaggatctgga420
ggaggcgggtctgaggtgcagctggtcgaatctggaggaggactggtgaagccaggagga480
tctctgaaactgagttgtgccgcttcaggcctgaccttctcaagctacgccatgagctgg540
gtgcgacagacacctgagaagcggctggaatgggtcgctagcatctcctctggcgggttc600
acatactatccagactccgtgaaaggcagatttactatctctcgggataacgcaagaaat660
attctgtacctgcagatgagttcactgaggagcgaggacaccgcaatgtactattgtgcc720
agggacgaagtgcgcggctatctggatgtctggggagctggcactaccgtcaccgtctcc780
agcgcggccgcaacaactaccccagcacctcgaccaccaacaccagcacccactattgct840
agtcagccactgtcactgcgaccagaagcatgccgacctgcagctggaggcgctgtgcac900
acccggggcctggactttgcctgcgacatctatatttgggctcctctggcaggaacctgt960
ggagtgctgctgctgagcctggtcatcacactgtattgtaagcgagggcggaagaaactg1020
ctctacattttcaaacagccttttatgagaccagtgcagacaactcaggaggaagacggc1080
tgctcctgtaggttcccagaggaagaggaagggggatgcgagctgagagtgaagttcagc1140
aggagcgcagacgcccccgcgtaccagcagggccagaaccagctctataacgagctcaat1200
ctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatg1260
gggggaaagccgagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagat1320
aagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaagggg1380
cacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcac1440
atgcaggccctgccccctcgctaa1464
- 还没有人留言评论。精彩留言会获得点赞!