小鼠肺类器官培养方法
本发明属于细胞生物学技术领域,具体涉及小鼠肺类器官培养方法。
背景技术:
目前,二维(2d)底物(如聚苯乙烯或玻璃)上的单层贴壁细胞培养已成为传统细胞培养体系的主要研究方法,但2d培养中细胞的形态特征、生长方式、生理功能等与体内真实环境下存在明显差异,生理相关性不强。近年来,大量3d细胞培养模型的开发显著促进了肿瘤生物学、组织工程和再生医学的研究和发展。3d细胞培养模型可通过悬浮培养自组装形成微球体或基于生物学支架(如细胞外基质)诱导分化形成类器官(organoid),细胞—细胞和细胞—细胞外基质的相互作用可模拟体内特定的细胞行为和天然组织的特异性,明显缩短了2d培养与活体组织间的差距,可精准预测细胞分化、器官发育和药物毒性筛选试验中相关基因型或表型对化合物的反应。
在3d细胞培养模型中,类器官因其独特的实验优势(如稳定的表型和遗传学特征、细胞通讯更加紧密、可体外长期培养等),已应用于多项基础和临床研究中。类器官是将具有干性潜能的细胞体外进行3d培养,形成多种特异性细胞类型集合的微器官团,其具有自我更新和自我组织能力,能够高度模拟来源器官的三维构造、组织学特征及生理病理状态,可作为多种疾病的体外模型,在遗传发育、再生医学、疾病研究、药物开发和精准医疗等多个方面拥有广阔的应用前景。
在干细胞与再生医学领域,目前学术界对于类器官的研究主要集中在消化系统(肠道、肝脏、胰腺)和神经系统(大脑),而呼吸系统(肺脏)类器官的研究报道相对较少,可能与目前尚缺乏成熟的肺上皮干细胞体外培养方法有关。肺类器官被视为体外重现肺上皮干细胞功能的重要途径,再现了体内肺脏发生的两个关键事件,即同类细胞以黏附的方式分类聚集和空间特异性的细胞谱系定型。
现有技术方法中,肺类器官主要来源于胚胎干细胞或诱导多能干细胞,其发育需要在合适时间以可控的方式激活相关信号传导通路,诱导细胞命运分化及空间分离以形成不同的细胞类型,指导自我组织形成(干细胞生成内胚层,内胚层再形成三维组织),但这种微环境的操纵不易调控,培养过程繁琐、耗时,肺类器官形成率不高、活性较差,且在尺寸、结构组织、功能和基因表达上都存在较大可变性。
技术实现要素:
本发明的目的在于提供一种小鼠肺类器官培养方法。
为实现上述技术目的,本发明采用如下技术方案:
一种小鼠肺类器官培养方法,包括如下步骤:
(1)收集50-80μm的小鼠肺球体,离心弃上清后,加入dmem/f12培养基重悬肺球体,离心弃上清;
(2)重复步骤(1)1-2次;
(3)根据肺球体数量加入基质胶;基质胶的用量为每200-300个肺球体/50μl基质胶;
(4)孵育肺球体和matrigel基底膜基质胶的混合物使基质胶固化;
(5)加入肺类器官培养基,转移至二氧化碳细胞培养箱进行培养。
其中,所述肺球体为小鼠肺组织原代上皮干细胞球。
进一步的,所述小鼠肺球体的制备方式如下:
a.取小鼠肺叶组织块,置于预热的胶原酶消化溶液中消化;
b.加入等量的含fbs的dmem/f12培养基终止消化,吹打混匀后细胞筛过滤;过滤液离心后弃除上清;
c.加入红细胞裂解液重悬细胞沉淀,室温孵育后加入dmem/f12培养基混匀,离心后弃除上清;
d.重复步骤c直至细胞沉淀变白;
e.加入dna酶溶液重悬细胞沉淀,加入dmem/f12培养基混匀,离心后弃除上清;
f.加入dmem/f12培养基重悬细胞沉淀,吹打混匀,细胞筛过滤,离心后弃除上清;
g.加入肺球体培养基重悬,调整细胞密度后悬浮培养。
进一步的,所述肺球体培养基为含1×b-27添加剂(不含维生素a),1×青霉素/链霉素溶液,4μg/ml肝素,20ng/mlegf,10ng/mlfgf2,10μmy-27632的dmem/f12培养基。
进一步的,所述小鼠肺球体的制备过程中离心条件为700-900g。
进一步的,离心条件为:200-300g,5-10分钟。
进一步的,所述基质胶选用matrigel基底膜基质胶。matrigel基底膜基质胶由小鼠ehs肉瘤提取,其所含成分更有利于小鼠来源的肺球体的后续培养和类器官形成。
进一步的,添加基质胶时,使用预冷的移液枪头充分混匀。
进一步的,采用多孔板进行孵育。
进一步的,37℃下孵育30-45分钟使基质胶固化。
进一步的,所述肺类器官培养基为含0.48μg/ml氢化可的松溶液、100u/ml青霉素溶液、100μg/ml链霉素溶液、4μg/ml肝素、20ng/mlegf的pneumaculttm-ali培养基。
进一步的,类器官培养过程中,每两天更换肺类器官培养基。
本发明具有如下有益效果:
(1)目前肺类器官主要由人来源的干细胞或祖细胞培养形成,人体组织/细胞来源有限且样本珍贵,本发明技术方案中使用小鼠来源的肺上皮干细胞球,易于制备并可实现量产,来源样本所受限制较小,可重复多次进行类器官的相关研究;
(2)在同一培养体系下可同时诱导分化形成两种不同形态的肺类器官(肺泡类器官和肺芽类器官),简化了实验步骤,缩短了类器官体外培养周期(10-15天),且类器官形成率较高。
(3)使用商品化的pneumaculttm-ali培养基,组分稳定不含牛脑垂体提取物或胎牛血清,培养条件均一可控,不同批次间差异性较小,整个培养过程不需要添加额外的细胞生长调节因子,且类器官培养周期较短、产率较高、形态更具有代表性;可更好地保持遗传稳定性和生理功能。
(4)类器官培养过程中只需定期更换培养基,无需在特定时间添加激活相关信号通路的细胞因子,显著降低了研究人员的技术操作难度。
(5)可精确操控培养基的成分,特别适合于研究相关因子及不同微环境在调节肺上皮干细胞功能中的作用。
(6)前期培养形成的小鼠肺组织原代上皮干细胞球可在matrigel基底膜基质胶中稳定扩增、分化成类器官,体外重建了肺脏的复杂结构,且肺泡类器官和肺芽类器官可进行后续传代培养及长期冷冻保存。
附图说明
图1是小鼠肺泡类器官和肺芽类器官的肉眼观察结果。
图2是小鼠肺泡类器官和肺芽类器官的显微镜下观察结果。
图3是小鼠肺芽类器官培养过程中不同阶段的显微镜下观察结果。
图4是小鼠肺泡类器官和肺芽类器官的冰冻切片h&e染色结果。
图5是小鼠肺泡类器官和肺芽类器官的冰冻切片免疫荧光染色结果。
图6是不同直径肺球体用于肺类器官培养的效果。
具体实施方式
实施例使用的主要材料及来源如下:
matrigel基底膜基质胶:美国康宁(corning)公司,货号354230。
24孔细胞培养板:美国康宁(corning)公司,货号3524。
200μl移液枪头:上海科进生物技术有限公司,货号kg1212。
dmem/f12培养基:赛默飞世尔科技(中国)有限公司,货号11039021。
小鼠肺类器官培养基:[含0.48μg/ml氢化可的松溶液,100u/ml青霉素溶液,100μg/ml链霉素溶液,4μg/ml肝素,20ng/mlegf的pneumaculttm-ali培养基]:氢化可的松溶液:加拿大stemcell有限公司,货号07925;青霉素、链霉素溶液:美国sciencell有限公司,货号0503;肝素:美国apexbio有限公司,货号b3602;egf:美国peprotech有限公司,货号315-09;pneumaculttm-ali培养基:加拿大stemcell有限公司,货号05001。
实施例1
首先采用cn111534477a所示方法培养出小鼠肺组织原代上皮干细胞球(即下述步骤1~步骤10)。
(1)将小鼠用75%酒精彻底消毒皮肤,无菌分离肺组织并置于预冷的无菌pbs(磷酸盐缓冲溶液)中漂洗,清除结缔组织及肺内主支气管,同时分离肺叶,清洗2-3次去血。
(2)无菌镊子转移清洗后的肺叶于新的细胞培养皿中,吸除残留的pbs,用眼科手术剪将肺组织均匀剪成约1mm3的组织块,转移至预热的胶原酶消化溶液中,37℃恒温摇床(100转/分钟)消化45-60分钟;
(3)加入等量的含有10%fbs的dmem/f12培养基终止消化,吹打混匀后100μm细胞筛过滤;过滤液4℃700-900g离心10分钟,弃上清;
(4)加入2-3ml红细胞裂解液重悬细胞沉淀,室温孵育1-2分钟,加入6mldmem/f12培养基混匀,4℃700-900g离心10分钟,弃上清;
(5)重复步骤(4)1-2次直至细胞沉淀变白;
(6)加入4mldna酶溶液(20u/ml)重悬细胞沉淀,室温手摇3-5分钟,加入6mldmem/f12培养基混匀,4℃700-900g离心10分钟,弃上清;
(7)加入6mldmem/f12培养基重悬细胞沉淀,充分吹打混匀,40μm细胞筛过滤,4℃700-900g离心10分钟,弃上清;
(8)肺球体培养基重悬,调整细胞密度为2×106-3×106/ml;
(9)置于poly-hema包被的t25细胞培养瓶中培养,3-5ml肺球体培养基/瓶;
(10)转移至二氧化碳细胞培养箱(37℃,5%co2),每三天更换培养基;
(11)培养3-4天后收集直径50-80μm的肺球体,4℃200-300g离心5-10分钟,弃上清;
(12)加入5mldmem/f12培养基重悬肺球体,4℃200-300g离心5-10分钟,弃上清;
(13)重复步骤(12)1-2次;
(14)根据肺球体数量加入matrigel基底膜基质胶(200-300个肺球体/50μlmatrigel基底膜基质胶),使用预冷的200μl移液枪头充分混匀,避免产生气泡(冰上操作);
(15)吸取50μl肺球体和matrigel基底膜基质胶的混合物于24孔板每孔中央,37℃孵育30-45分钟使matrigel基底膜基质胶固化;
(16)每孔加入肺类器官培养基1-1.5ml,转移至二氧化碳细胞培养箱(37℃,5%co2),每两天更换培养基,动态观察小鼠肺类器官形成和形态变化。
图1小鼠肺组织原代上皮干细胞球包被于matrigel基底膜基质胶中行3d—浸没式培养,诱导分化15天后肉眼可见大量肺泡类器官和肺芽类器官形成。
图2显微镜下(100×)可见两种不同形态的肺类器官:中空圆形的肺泡类器官和自发实现肺脏形态发育及分化、重现肺脏分支结构的肺芽类器官。
图3显微镜下(100×)动态观察肺芽类器官形成及形态变化(第5、10和15天),培养过程中肺芽类器官体积逐渐增大,形态渐变复杂,分支结构也更加明显。
图4对小鼠肺泡类器官和肺芽类器官的冰冻切片行苏木精—伊红(h&e)染色实验,可见肺泡类器官和肺芽类器官内部的中空及分支结构,且类器官表面细胞紧密排列。
图5对小鼠肺泡类器官和肺芽类器官的冰冻切片行免疫荧光染色实验,可见肺泡类器官和肺芽类器官大量表达上皮细胞(krt14、epcam、p63)、干细胞(sox2)、增殖(ki67)、分化的标记物(acetylatedtubulin,即act)。
实施例2
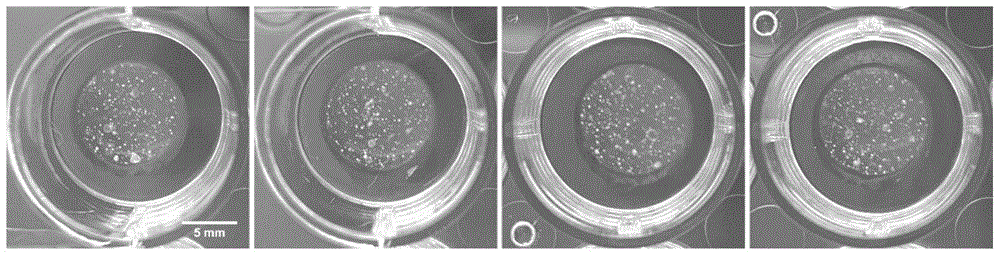
本实施例试验了不同直径的肺球体在类器官培养时的效果。
如图6所示,选用<50μm的肺球体进行后续类器官培养,培养周期较长、类器官产率较低且最终得到的类器官形态特征不明显(图6左);选用>80μm的肺球体进行后续类器官培养,无法形成明显的中空及分支结构的类器官(图6右)。只有选用50-80μm的肺球体,才可形成中空圆形的肺泡类器官和自发实现肺脏形态发育及分化的肺芽类器官。
- 还没有人留言评论。精彩留言会获得点赞!