埃利希氏体病和莱姆病双重荧光定量PCR引物及试剂盒
本发明涉及生物医学技术领域,具体涉及一种埃利希氏体病和莱姆病双重荧光定量pcr引物及试剂盒。
背景技术:
多重荧光pcr方法具有检测效率高,即多重荧光pcr可以实现一管多检,简化操作流程;节省试剂成本和人员操作时间,尤其在开展大量样品检测时,显著地降低检测成本和操作时间等优势。sybrgreeni染料法荧光定量pcr的性价比较高,可利用sybrgreen染料的荧光信号强度与双链dna的数量之间的线性关系对pcr体系存在的双链dna数量进行监测并利用熔解曲线进行鉴别诊断。熔解曲线是反应dna的双螺旋结构随温度升高产生降解程度的曲线,其总的dna双螺旋结构降解一半时的熔解温度称为tm值,tm值与基因序列中的g-c值相关,所以,当扩增产物由于g-c值的不同而出现相对应的不同tm峰值时,可以通过这个特征峰将特异产物与其它产物区分开,达到鉴别诊断的目的。
蜱虫是专性吸血的体外寄生虫,是仅次于蚊子的第二大媒介,可传播细菌、病毒和原生动物等,对公共卫生和畜牧业发展造成严重危害。新兴细菌感染性疾病中的很大一部分是由蜱虫等人畜共患病媒介传播的。这些疾病中最突出的是莱姆病、埃里希体病和巴尔通体病。
伯氏疏螺旋体(borreliaburgdorferi,b.g)是引起莱姆病的病原体。莱姆病(lymedisease,ld)是一种机体多系统多器官炎症性反应的人兽共患病,现已广泛分布于欧洲、亚洲,是美国最常见的蜱虫传播疾病,具有分布广、传播快、致残率高的特点。1986年在黑龙江省林海县首次分离到伯氏疏螺旋体,证明了我国存在伯氏疏螺旋体。目前已证实我国30多个省(自治区、直辖市)存在伯氏疏螺旋体感染,20个省、市、自治区存在自然疫源地。
无形体科埃里希氏体属的成员在人类和动物中引发埃里希氏体病。埃里希氏体是一种专性的胞内寄生菌,除野生动物宿主外,家畜、伴侣动物和人类也均为其易感宿主。自1935年在阿尔及利亚发现第一株埃里希氏体后各地不断出现埃里希氏体病例,目前已有研究人员从我国犬、鼠、羊、蜱及人体内检测到埃里希氏体核酸及抗体,显示我国可能存在该病的自然疫源地。
随着经济水平的提高,人与自然接触逐渐增多,以蜱虫为媒介的传染病如莱姆病和埃里希氏体病的诊断与防控引起人们的关注。目前主要通过将血细胞进行吉姆萨染色,镜下观察是否存在桑葚体来确诊埃里希氏体病,而莱姆病的诊断虽有现行有效的国家标准,但其推荐的病原分离及血清学检测操作难度大、周期长、对操作人员要求较高,且目前缺少同时诊断这两种疾病的方法及标准。聚合酶链式反应(pcr)由于特异性好,操作简单成为一种广泛应用的实验室检测,因此建立一种同时诊断莱姆病及埃里希体病的分子生物学诊断方法成为亟待解决的科学问题,也为国家标准的制定提供理论基础和技术支持。
技术实现要素:
针对现有技术的不足,本发明旨在提供一种埃利希氏体病和莱姆病双重荧光定量pcr引物及试剂盒。
为了实现上述目的,本发明采用如下技术方案:
一种埃利希氏体病和莱姆病双重荧光定量pcr引物,包括有用于检测埃里希氏体的引物和用于检测伯氏疏螺旋体的引物;
所述用于检测埃里希氏体的引物序列如下:
groel-ygf:5’-agctgaattgggtactgctaagaa-3’;
groel-ygr:5’-tacagcaacaccaccagaaagt-3’;
所述用于检测伯氏疏螺旋体的引物序列如下:
ospa-ygf:5’-gagcagacggaaccagac-3’;
ospa-ygr:5’-ccttctttaaccaccaat-3’。
本发明还提供一种同时诊断埃利希氏体病和莱姆病的双重荧光定量pcr检测试剂盒,含有上述埃利希氏体病和莱姆病双重荧光定量pcr引物。
进一步地,在上述双重荧光定量pcr检测试剂盒中,还含有标准阳性模板和阴性对照样品,所述标准阳性模板包括埃利希氏体阳性样品dna模板和伯氏疏螺旋体体阳性样品dna模板;阴性对照样品包括depch2o。
本发明的有益效果在于:
1、利用本发明可同时检测埃里希氏体和伯氏疏螺旋体。
2、利用本发明检测快速、高效,无需进行常规琼脂糖凝胶电泳检测,反应结束后即可通过荧光定量pcr仪自带的程序进行结果判定。
3、利用本发明,通过制备标准品、绘制标准曲线,可根据检测待检样品中埃里希氏体和伯氏疏螺旋体的ct值,可对待测样品感染埃里希氏体和伯氏疏螺旋体进行准确定量。
4、利用本发明,埃里希氏体和伯氏疏螺旋体最低检测限均为1×101copies/μl。
5、利用本发明对埃里希氏体、伯氏疏螺旋体、钩端螺旋体、立克次体、大肠杆菌和绿脓杆菌基因组检测均无反应信号,仅对埃里希氏体和伯氏疏螺旋体检测出现荧光信号,且存在特异性溶解曲线峰值(tm值)差异。
附图说明
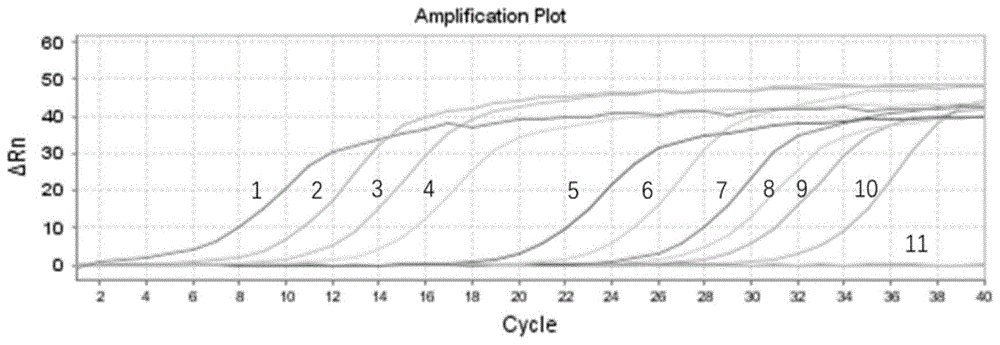
图1为本发明实施例荧光定量pcr反应条件及体系优化中得到的埃里希氏体实时荧光定量pcr的扩增曲线;
图2为本发明实施例中埃里希氏体实时荧光定量pcr的标准曲线;
图3为本发明实施例荧光定量pcr反应条件及体系优化中得到的埃里希氏体实时荧光定量pcr的熔解曲线;
图4为本发明实施例荧光定量pcr反应条件及体系优化中得到的伯氏疏螺旋体实时荧光定量pcr的扩增曲线;
图5为本发明实施例中伯氏疏螺旋体实时荧光定量pcr的标准曲线;
图6为本发明实施例荧光定量pcr反应条件及体系优化中得到的伯氏疏螺旋体实时荧光定量pcr的熔解曲线;
图7为本发明实施例中双重实时荧光定量pcr的熔解曲线;
图8为本发明实施例中双重荧光定量pcr特异性检验结果;
图9为本发明实施例中敏感性检测中得到的双重荧光定量pcr的扩增曲线;
图10为本发明实施例中敏感性检测中得到的双重实时荧光定量pcr的熔解曲线;
图11为本发明实施例的临床应用中双重荧光定量pcr部分临床样品检测阳性结果;
图12为本发明实施例的临床应用中部分临床样品普通pcr检测阳性结果。
具体实施方式
以下将结合附图对本发明作进一步的描述,需要说明的是,本实施例以本技术方案为前提,给出了详细的实施方式和具体的操作过程,但本发明的保护范围并不限于本实施例。
1、相关实验菌株
试验用埃里希氏体、伯氏疏螺旋体、钩端螺旋体、立克次体、大肠杆菌和绿脓杆菌基因组由吉林大学动物医学学院传染病实验室鉴定和保存。
2、引物设计
选取埃里希氏体groel基因及伯氏疏螺旋体ospa基因基因保守序列设计埃利希氏体病和莱姆病双重荧光定量pcr引物。
用于检测埃里希氏体的引物序列如下:
groel-ygf:5’-agctgaattgggtactgctaagaa-3’;如seqidno.1所示;
groel-ygr:5’-tacagcaacaccaccagaaagt-3’;如seqidno.2所示;
目的片段大小为196bp。
用于检测伯氏疏螺旋体的引物序列如下:
ospa-ygf:5’-gagcagacggaaccagac-3’;如seqidno.3所示;
ospa-ygr:5’-ccttctttaaccaccaat-3’;如seqidno.4所示;
目的片段大小为133bp。
上述引物送至生工生物工程(上海)股份有限公司合成。
3、提取并纯化待测样品基因组dna
参照
4、埃利希氏体病和莱姆病双重实时荧光定量pcr诊断方法建立
4.1、阳性标准质粒的构建
通过普通pcr方法扩增埃里希氏体基因组样品中热休克蛋白groel保守区域(使用ehr-groel-f5’-gttgaaaaractgatggtatgca-3’(seqidno.5)和ehr-groel-r5’-acacgrtctttac-gytcyttaac-3’(seqidno.6)引物,反应程序:94℃5min;94℃30s,53℃1min,72℃1.min,40个循环;72℃10min)及伯氏疏螺旋体表面a蛋白ospa全长(使用ospaf5’-gacgagaaaaacagcgtttcag-3’(seqidno.7)和ospar5’-ttattttaaagcgtttttaatttcatcaa-3’(seqidno.8)引物,反应程序:94℃5min;94℃30s,55℃30s,72℃1.5min,30个循环;72℃10min)。
扩增产物经1%琼脂糖凝胶电泳鉴定正确后,凝胶回收,连接至
利用微量核酸测定仪测定阳性标准品pt-groel及pt-ospa的浓度,计算其拷贝数并稀释为1×1010copies/μl,对其进行10倍连续稀释,质粒含量分别为1×109-1×101copies/μl,分装后置于-20℃保存备用。
4.2、荧光定量pcr反应条件及体系优化
以阳性标准品(质粒pt-groel及pt-ospa)为模板,在不同退火温度(46~62℃)、引物(groel-ygf、groel-ygr、ospa-ygf、ospa-ygr)、浓度0.2-1μm下进行实时荧光定量pcr反应,对反应条件进行优化。
优化出最佳反应体系(20μl)为perfectstarttmgreenqpcrsupermix10μl、ddh2o4μl、groel和ospa上下游引物的工作浓度均为1μm(体积共为4μl)、两种阳性标准质粒各1μl。以depc水为模板设置阴性对照。
优化后的最佳反应条件为94℃预变性30s,94℃变性5s,50℃退火15s,72℃延伸30s,40个循环,反应结束后,收集熔解曲线。
结果判定:在一条平滑的熔解曲线上产生了2个特异性的峰值,分别为埃里希氏体和伯氏疏螺旋体的tm值,分别为与单引物荧光定量产生的熔解曲线tm值相吻合。
用优化后的反应条件,以稀释度为1×1010~1×101copies/μl的两种阳性标准质粒分别为模板,获得扩增动力学曲线(见图1、4)及特异性熔解曲线(如图3、6)。图1为埃里希氏体实时荧光定量pcr的扩增曲线,其中1-10分别为标准质粒浓度1×1010-1×101copies/μl的扩增曲线,11为阴性对照的扩增曲线,图3为埃里希氏体实时荧光定量pcr的熔解曲线;图4为伯氏疏螺旋体实时荧光定量pcr的扩增曲线,其中,1-10分别为标准质粒浓度1×1010-1×101copies/μl的扩增曲线,11为阴性对照的扩增曲线,图6为伯氏疏螺旋体实时荧光定量pcr的熔解曲线。
4.3、标准曲线的建立
以每个浓度标准品模板中拷贝数的常用对数(lgx)为横坐标,以循环数阈值(ct值)为纵坐标,获得埃里希氏体实时荧光定量pcr标准曲线(如图2所示)的线性方程为y=-3.1085x+37.99,r2=0.9833,伯氏疏螺旋体实时荧光定量pcr标准曲线(如图5所示)线性方程为y=y=-3.1142lx+35.367,r2=0.9931,表明建立的实时荧光定量pcr方法的标准曲线具有良好的线性关系。
4.4、熔解曲线分析
如前所述,在一条平滑的熔解曲线上产生了2个特异性的峰值,分别为埃里希氏体和伯氏疏螺旋体的tm值,分别与单引物荧光定量产生的熔解曲线tm值相吻合,如图7所示,其中1代表埃里希氏体阳性,2代表伯氏疏螺旋体阳性,3代表埃里希氏体和伯氏疏螺旋体混合阳性,4代表阴性样品。结果判断:实时荧光定量pcr反应结束后,观察熔解曲线峰值(tm值)分析试验结果:若检测样品出现阳性扩增信号且在tm=(78.12±0.40)℃出现单一的特异性峰判为埃里希氏体阳性;若检测样品出现阳性扩增信号且在tm=(80.2±0.14)℃出现单一的特异性峰判为伯氏疏螺旋体阳性;若tm=(76.61±0.34)℃和tm=(80.2±0.14)℃均出现峰值,表明埃里希氏体和伯氏疏螺旋体混合感染。
4.5、特异性检测
运用前述双重实时荧光定量pcr诊断方法对埃里希氏、伯氏疏螺旋体、体钩端螺旋体、立克次体、大肠杆菌、绿脓杆菌基因组进行检测,仅实验组出现特异性扩增,其他组均无交叉反应,如图8所示,其中1为埃里希氏体及伯氏疏螺旋体阳性检测结果曲线,2-4代表钩端螺旋体、立克次体、大肠杆菌和绿脓杆菌基因组检测结果曲线。
4.6、敏感性检测
用双重荧光定量pcr检测方法对梯度倍比稀释的标准质粒进行检测,得出埃里希氏体和伯氏疏螺旋体检测下限均为1×101copies/μl,如图9-10所示。图9为双重荧光定量pcr的扩增曲线,其中1-10分别为标准质粒浓度1×1010-1×101copies/μl的扩增曲线,11为阴性对照的扩增曲线。图10为双重实时荧光定量pcr的熔解曲线。
4.7、重复性试验
熔解曲线重合度较高,对应tm值较为稳定,标准差均小于0.1,变异系数均小于0.1%,说明运用所述双重荧光定量pcr引物的双重荧光定量pcr检测方法扩增重复性好,有良好的稳定性,见表1。
表1双重荧光定量pcr的不同浓度重复性分析
4.8、双重荧光定量pcr检测方法结果判断
实时荧光定量pcr反应结束后,观察溶解曲线峰值(tm值)分析试验结果:若检测样品出现阳性扩增信号且在tm=(83.09±0.10)℃出现单一的特异性峰判为埃里希氏体阳性;若检测样品出现阳性扩增信号且在tm=(86.95±0.08)℃出现单一的特异性峰判为伯氏疏螺旋体阳性;若tm=(83.09±0.10)℃和tm=(86.95±0.08)℃均出现峰值,表明埃里希氏体和伯氏疏螺旋体混合感染。
5、临床应用
对25份全沟硬蜱基因组dna样品进行检测,检测结果见表2,其中阳性样品ct值为11.08-20.49,利用前述双重荧光定量pcr检测方法的埃里希氏体检出率为28%,伯氏疏螺旋体检出率为60%(如图11),与普通pcr方法样品检出率高12%(如图12)。图12中,a为埃里希氏体阳性样品dsb基因鉴定结果,b为伯氏疏螺旋体5s-23s间隔序列鉴定结果。a中,m代表trans2000dnamarker,1代表阴性对照,2-6均代表埃里希氏体阳性样品。b中,m代表trans2000dnamarker,1-10代表部分伯氏疏螺旋体阳性样品,11代表阴性对照。
表3临床样品检测结果
对于本领域的技术人员来说,可以根据以上的技术方案和构思,给出各种相应的改变和变形,而所有的这些改变和变形,都应该包括在本发明权利要求的保护范围之内。
序列表
<110>吉林大学
<120>埃利希氏体病和莱姆病双重荧光定量pcr引物及试剂盒
<130>123
<141>2021-02-04
<160>8
<170>siposequencelisting1.0
<210>1
<211>24
<212>dna
<213>人工序列()
<400>1
agctgaattgggtactgctaagaa24
<210>2
<211>22
<212>dna
<213>人工序列()
<400>2
tacagcaacaccaccagaaagt22
<210>3
<211>18
<212>dna
<213>人工序列()
<400>3
gagcagacggaaccagac18
<210>4
<211>18
<212>dna
<213>人工序列()
<400>4
ccttctttaaccaccaat18
<210>5
<211>23
<212>dna
<213>人工序列()
<400>5
gttgaaaaractgatggtatgca23
<210>6
<211>23
<212>dna
<213>人工序列()
<400>6
acacgrtctttacgytcyttaac23
<210>7
<211>22
<212>dna
<213>人工序列()
<400>7
gacgagaaaaacagcgtttcag22
<210>8
<211>29
<212>dna
<213>人工序列()
<400>8
ttattttaaagcgtttttaatttcatcaa29
- 还没有人留言评论。精彩留言会获得点赞!