多糖的臭氧降解方法与流程
本申请涉及申请日为2017年12月29日、申请号为201711482873.0、名称为“多糖的臭氧降解方法”的专利申请的分案申请。
本发明涉及食品医药和化工领域的多糖降解,具体为使多糖在臭氧存在下发生氧化降解,生成分子量更小的多糖、低聚糖或者寡糖。本发明的方法既适用于天然提取多糖,也适用于化学修饰后的多糖,包括硫酸化多糖、磷酸化多糖、甲酰化多糖或乙酰化多糖。
背景技术:
多糖和蛋白质、核酸、脂肪一起都是构成生命的基本物质。多糖是植物和微生物细胞壁以及动物甲壳的结构物质之一,比如植物细胞壁的纤维素、海藻细胞壁的海藻多糖、微生物细胞壁的n-乙酰氨基葡聚糖。在动物细胞和体液中有大量的活性多糖存在,最常见的为糖胺聚糖。这些多糖是由单糖分子以糖苷键结合形成的聚合物,该聚合物的形状可以是线性、分支状或者网状结构。在体内,多糖往往与氨基酸、脂肪等结合,形成糖蛋白、糖脂共同发挥多种生物学功能。
天然提取的多糖在食品、医药、日化行业广泛使用。比如食品中的淀粉,保健品中的香菇多糖、灵芝多糖,抗凝血药肝素,果冻和牙膏中的增稠剂海藻酸钠等等。天然来源的多糖经过化学修饰可以改变物理化学性质,比如酸性的海藻酸经过硫酸化修饰以后,其在酸性条件下的水溶性得到明显改善,而与乙酸形成乙酰化海藻酸以后,水溶性变小,而粘度大大增强。通过化学改性,多糖的药理活性也发生变化,比如聚古洛糖醛酸经过硫酸化修饰后形成具有抗肿瘤活性的硫酸化聚古洛糖醛酸。另外,多糖的降解也是常用的多糖改性策略,即把分子量大的多糖降解成低分子量的多糖或者寡糖,使得多糖的粘度降低,或者改善在体内的药理活性。前者如低聚壳多糖,后者如低分子量肝素。
多糖的降解方法最常用的有酸降解,即在加热条件下,糖苷键在酸水中水解,糖链被打断。酸水解的方法并不适合所有的多糖降解,比如由肝素制备低分子量肝素的生产工艺中,就不能采用酸水解,这是因为肝素结构中含有硫酸根,直接在水中酸解硫酸根容易被破坏。制备低分子量肝素已有的生产工艺有亚硝酸、beta-消除和双氧水降解法,另外,肝素酶、高碘酸和次氯酸降解肝素也有报道。
臭氧作为一种强氧化剂用于彻底氧化降解有机物,从而除去该有机物。例如,臭氧广泛用于污水处理,特别适合含有芳香环类和不饱和双键烯烃类化合物的污水处理。例如可参见cn1182047c和cn1135117c。另外,臭氧也用于食品、医疗器械、药品和环境的消毒杀菌。为了提高臭氧的污水处理能力以及杀菌消毒的效果,工业上采用的臭氧氧化法在催化剂的存在下进行,例如cn104310534b、cn1275883c,cn102151567b、cn102897895b、cn104192981b等。但是,臭氧用在多糖的可控降解方面还未见报道。
如前所述,多糖降解的现有工艺最常见的为酸降解,这个工艺需要消耗比较多的酸,反应过程往往需要高温高压以促进反应的进行,反应完成后需要加入大量的碱中和,生产过程中会产生大量的盐,污水处理比较困难。对于像肝素那样的对酸敏感的多糖则不适合用酸降解。已有的方法中,酶解法专一性强,但反应效率低,成本高,不合适工业化大规模生产。双氧水降解工艺中,双氧水高浓度下不稳定,存储条件要求高,多余的双氧水需要加入过量的碱或者硫代硫酸钠去除。高碘酸或者次氯酸降解工艺会产生大量的卤族元素污染。亚硝酸法和beta-消除法只适合特定结构的多糖,适应范围窄,且对环境造成的污染大,生产成本高。
技术实现要素:
本发明提供了一种基于臭氧降解多糖生产低分子量多糖或者寡糖的生产工艺,对现有的降解多糖的生产技术体系提供了一个重要的新工艺,该工艺大大减少了酸碱的使用量,反应过程可控,效率高,特别适合水中溶解度大的硫酸多糖的降解,避免了硫酸根的丢失。
本发明的一个方面涉及水溶性多糖的可控降解方法,其特征在于使所述多糖的水溶液与臭氧相接触,以使得所述多糖的糖链发生氧化降解反应。本发明人发现,通过控制反应条件和臭氧发生的通量,可以高效、可控地进行多糖的氧化反应,以高收率获得期望分子量范围的降解的多糖甚至寡糖。本发明特别适合用于获得分子量在1kda–100kda范围内的降解的多糖。
本发明的优势在于,1)臭氧降解多糖的新工艺反应条件温和,不需要酸降解的高温高压反应条件;2)新工艺在酸性和碱性条件下都可以反应,对于酸性条件下不溶的多糖可以在碱性条件下溶解后反应;3)新工艺对糖结构中的酸碱敏感型基团不影响,最大程度保留了这些关键官能团,这一点对制备具有生物活性的低分子量糖类药物尤为重要;4)臭氧来源简单易得,在工业生产中可以通过工业级的臭氧发生器制备得到,操作简单;5)臭氧会自动分解为氧气,在环境中存在的时间短,不会在产品中残留,未反应的臭氧可以通过尾气收集装置处理,不会对环境造成污染。
附图说明
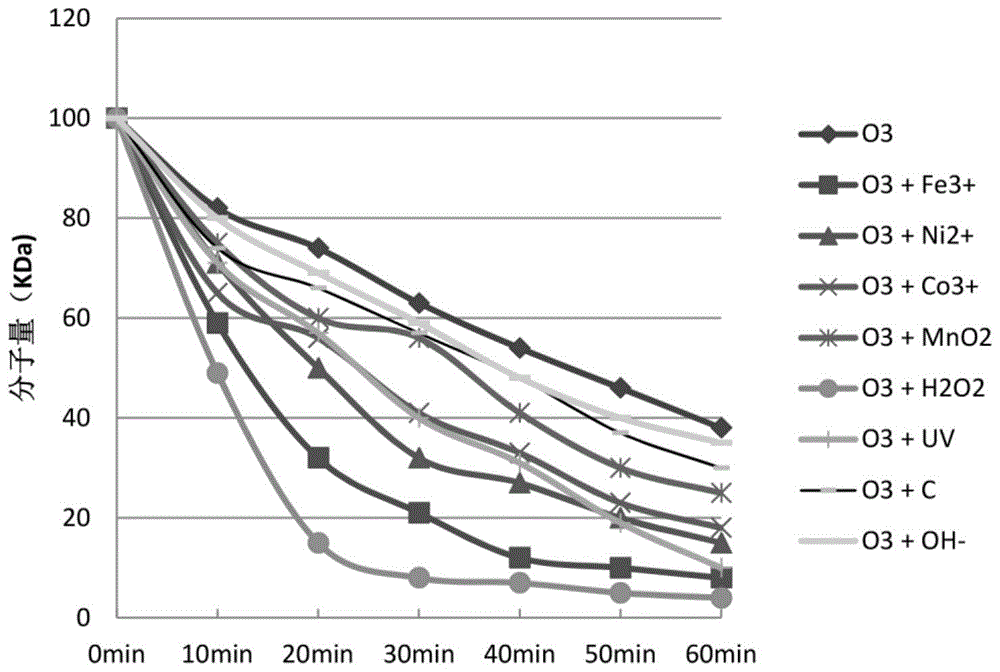
图1是催化剂对多糖降解速率的影响图。
图2是臭氧化降解多糖产物对神经细胞的保护作用。
具体实施方式
下文将对本发明的各个方面进行具体说明,但本发明并不限于这些具体的实施方式。本领域技术人员可以根据下文公开内容的实质对本发明进行一些修改和调整,这些调整也属于本发明的范围。
本发明涉及一种使用臭氧作为氧化剂对多糖进行氧化的方法。可用于本发明中的多糖包括从植物、中药材、动物或者微生物中提取得到的天然来源的多糖及其化学修饰后的产物,包括但不限于:
1)植物和中药材提取的多糖,例如猴头菇多糖、茯苓多糖、银耳多糖、香菇多糖、灵芝多糖、枸杞多糖、黄芪多糖、褐藻胶、聚甘露糖醛酸、聚古洛糖醛酸;
2)动物多糖,例如肝素、硫酸乙酰肝素、硫酸软骨素、硫酸皮肤素、透明质酸、壳聚糖;
3)从微生物提取的多糖,例如黄原胶;
4)上述第1)、2)和3)中所述的多糖的化学修饰产物,包括硫酸化多糖、磷酸化多糖、甲酰化多糖、乙酰化多糖。
在本发明的一些实施方案中,多糖原料从中药材中提取得到,例如猴头菇多糖、茯苓多糖、银耳多糖、香菇多糖、灵芝多糖、枸杞多糖、黄芪多糖等。
在本发明的另一些实施方案中,多糖原料可以市售获得,例如褐藻胶、肝素、硫酸乙酰肝素、硫酸软骨素、硫酸皮肤素、透明质酸、壳聚糖、黄原胶等。
在本发明的又一些实施方案中,已经历部分降解的多糖可以通过已知的提取技术获得,例如聚甘露糖醛酸(pm)、聚古洛糖醛酸(pg)、硫酸化聚甘露糖醛酸(s-pm),硫酸化聚古洛糖醛酸(s-pg)。
除特殊说明外,本发明从中药材中提取多糖均遵从如下操作步骤:1)将药材干燥后粉碎,称5.0kg药材粉末,加50l的蒸馏水浸泡12hr;2)加热回流提取8hr,冷却,滤布过滤;3)滤液加100l乙醇(95%)沉淀,静置12hr,移除上清,离心收集沉淀,真空减压干燥,粉碎称重,即得多糖产品。示例性的提取获得的多糖重量可参见实施例1-7。
聚甘露糖醛酸(pm)和聚古洛糖醛酸(pg)的制备方法可以简述为:聚甘露糖醛酸(pm)和聚古洛糖醛酸(pg)分别是海藻酸钠分子中的聚甘露糖醛酸片段和聚古洛糖醛酸片段,制备方法是将海藻酸钠降解后,经酸沉淀分级,分别收集得到聚甘露糖醛酸(pm)和聚古洛糖醛酸(pg)。示例性的提取方法可参见专利cn100467492c。一个示例的提取方法参见实施例9。
硫酸化聚甘露糖醛酸(s-pm)和硫酸化聚古洛糖醛酸(s-pg)的制备方法可以简述为:将上述得到的聚甘露糖醛酸(pm)和聚古洛糖醛酸(pg)粉末分别分散于吡啶中,以氯磺酸为磺酸化试剂进行反应。反应完成后纯化干燥,分别得到硫酸化聚甘露糖醛酸(s-pm)和硫酸化聚古洛糖醛酸(s-pg)。示例性的提取方法可参见专利cn1213071c。示例的提取方法还可参见实施例12和实施例13。
为进行多糖氧化反应,首先将多糖溶解于水中,任选地进行加热以促进溶解,调节ph值至所需范围,加热搅拌,打开臭氧发生器,将产生的臭氧通入反应容器中,优选伴随搅拌,反应过程中未反应完全的臭氧可以通过尾气收集装置处理。反应完成以后,停止通入臭氧,待反应溶液冷却至室温后,进行后续的纯化步骤和浓缩干燥过程。
臭氧对多糖的氧化作用于糖环的c-c键上,或者作用于糖苷键上。
本发明的申请人还发现,臭氧对于多糖末端还具有开环作用,可以将多糖的末端氧化使其丢失一个或多个ch-oh结构单元,这种对于多糖末端结构的改性可以提高降解多糖的生物学活性。
用于进行氧化反应的多糖的浓度通常为1%-40%的水溶液,优选4%-30%,更优选8-25%。多糖的浓度不宜过高,过高的浓度使得反应体系的粘度过大,不利于氧化剂的分散,也不能过低,不利于氧化反应的效率。申请人发现,多糖溶液的浓度为1-20%,并且粘度在1~10mpa·s时,有利于氧化反应的顺利进行。本文中提及的粘度通过乌氏粘度计或者旋转粘度计测定法测定,例如,可以参见《中国药典》关于粘度的测试方法。
臭氧可以采用臭氧发生器提供,工业上常用的臭氧发生器是将氧气通过高压放电制得。臭氧发生量可通过臭氧浓度计测定输出口的臭氧浓度,再结合气体流速和产气时间来确定。本发明中通过调节臭氧发生器的工作功率和氧气钢瓶的出口气流量,控制臭氧发生器的臭氧产气速率在1g/hr–10g/hr之间。对于加压反应,氧气钢瓶除了提供制备臭氧所需的氧气外,还可以提供压力,本发明中反应体系的压力范围在0.1mpa–1.0mpa之间。在常温常压下,纯的臭氧气体在1l的水中可溶解大约1g的重量,增加压力时,臭氧溶解度会增加,使得溶液中臭氧的浓度变大,增加了臭氧与反应底物的碰撞几率,加速反应的发生。常温常压下,溶液中臭氧浓度的测量可以参考中国标准gb/t5750.11-2006《生活饮用水标准检验方法》中规定的碘量法进行臭氧含量测定。本发明中臭氧消耗量基于多糖固体计为10mg-500mg/g多糖。未反应完全的臭氧依次接入含有氢氧化钠和硫代硫酸钠的尾气收集装置中。在本发明的一些实施方案中,结束反应前维持臭氧的浓度不超过4小时,优选不超过3小时。
在氧化反应的进行期间,加热和ph值对多糖的溶解度及反应速率都有影响。大多数多糖在热水中的溶解度要大于冷水中的溶解度,且升温能够加速反应的进行。一般而言,反应期间的温度保持在约20-60℃,优选20-50℃。对于一些含有羧基的弱酸性多糖,其在酸性条件下难溶,可以调节ph值至碱性。反应的ph值通常保持在3-10,对于含羧基的多糖,例如海藻酸钠、聚古洛糖糖醛酸、聚甘露糖醛酸等,可调节ph值至7-11之间,优选8-10之间,更优选8-9。
在一个优选的实施方案中,本发明的方法在升高的压力下进行,本发明人发现,在升高的反应压力和持续的搅拌下,控制臭氧消耗量基于多糖固体计为10mg-500mg/g多糖时,可以获得80%以上的整体产率,甚至达到90%或95%以上,并且降解产物的分子量分布均匀。优选地,反应进行4小时左右即可反应完全,这是在酸降解法以及双氧水降解法中均难以实现的。不囿于任何理论,申请人认为,本发明的方法采用了氧化性较强的氧化剂,通过控制反应压力和反应时间,以及溶液浓度、氧化剂的量等参数,共同作用实现了非常高的多糖产率,并且产品分布均一,具有重要的工业应用价值,可以降低生产成本,减少对环境的污染。
更重要的是,通过本发明的方法制备的寡糖显示对人或动物体和正常细胞很低的毒性、甚至没有毒性,可以获得高剂量耐受的生物活性产品。例如,按照本发明的方法在实施例17中获得了甘露糖醛二酸寡糖产品,其显示显著的保护神经细胞的生物活性,但没有检测到其任何毒性。
在更优选的实施方案中,本发明的方法在如下条件下以高产率获得生物活性的降解多糖:氧化反应容器内的压力为0.1mpa-1.0mpa,多糖水溶液的浓度为8%-25%,控制臭氧消耗量基于多糖固体计为100mg-300mg/g多糖。特别地,本发明的方法适用于含羧基的多糖的降解,例如海藻酸钠、聚古洛糖糖醛酸、聚甘露糖醛酸等。对于从天然药材中提取的多糖,包括但不限于猴头菇、茯苓、银耳、香菇、灵芝、枸杞、黄芪等,本发明特别适用于将其降解为分子量约20-100kda以内,更优选20-80kda以内。对于本身分子量较小的多糖,可以将其降解为分子量为约0.5kda-20kda之内的降解产物。并且,无论多糖的来源如何,本发明的可控降解方法均能够实现产品的均匀降解,且操作方法稳定。
反应过程中,持续监控多糖的降解程度,当多糖的分子量降低到所需的范围时停止通入臭氧。待溶液冷却至室温后,进行后续的处理,具体为:1)直接浓缩干燥得到固体产物;或者2)加入一定体积的95%乙醇,使得乙醇的终体积浓度达到10%-90%之间,静置得到沉淀,有必要时可以在冷库中冷却至4℃,使沉淀更完全,之后分离,获得目标产物。另外,如有需要,可以将反应后的溶液装入超滤膜浓缩装置,使用期望截留分子量范围的超滤膜的过滤浓缩,膜浓缩过程可以去除一部分未降解的多糖或者分子量过小的寡糖碎片,得到分子量及其分布适中的多糖降解产品。
本发明的方法反应条件温和,对于不耐酸碱的多糖,比如肝素、硫酸乙酰肝素、硫酸化聚古洛糖醛酸等,可以在近中性和室温条件下反应,避免了由于硫酸根的丢失而导致的生物活性降低。臭氧自由基的产生速率可以通过碱、金属离子、双氧水、紫外光照射等途径加速,从而加速多糖降解反应的进行。催化剂可以在反应开始时加入,也可以在反应进行一段时间后加入。在一个优选的实施方案中,氧化反应在进行至完全转化的约50-80%时加入催化剂,可以提高多糖的降解速率和降解程度,获得尺寸分布均一的低聚寡糖(分子量为约1-8kda,优选2-6kda,更优选2.5-5kda)。
在一个示例性的实施方案中,本发明的方法包括如下几个步骤:
(1)多糖溶液的配制:称取多糖粉末,加水配制成1%-20%的浓度,有的多糖需要加热促进溶解,或者加氢氧化钠调节ph值至碱性以使得多糖完全溶解。加热搅拌,调节温度和ph值。
(2)臭氧的导入和氧化降解反应过程:当多糖溶液配制好以后,开启臭氧发生器,同时调节氧气钢瓶的出气口气流量和臭氧发生器的放电功率,使得臭氧的浓度在10%左右,这个浓度下放电产生的臭氧效率最佳,氧气流量的调节范围在1l/min-10l/min之间,相应的放电功率在10w-100w之间。当臭氧发生器稳定供应臭氧之后,将臭氧导入多糖溶液底部,溶液持续快速搅拌,在密闭的反应容器顶部开一细孔,将尾气接入尾气处理装置。
(3)多糖降解产物处理:当降解反应进行到预设时间以后,停止通入臭氧,移除加热装置,继续搅拌待冷却到室温以后,1)将多糖降解产物直接转移至浓缩装置,浓缩以后真空烘箱干燥,或者2)加入一定体积的95%乙醇,使得乙醇终体积浓度在10%-90%之间,进行醇沉,静置、取沉淀,离心,减压干燥,或者3)采用0.22um超滤膜过滤,将降解产物转移进超滤膜装置浓缩以后,用旋转蒸发仪进一步浓缩,减压干燥。
本发明中采用的分析和测量方法
分子量测定
多糖分子量的测定方法常用gpc凝胶连接示差检测器(refractiveindexdetector,rid)或者/和多角度激光散射仪(multi-anglelaserlightscattering,malls)测定。本发明的实施例中均采用gpc-ri-malls即gpc凝胶色谱与示差检测器和多角度激光散射仪联用来测定各种多糖的分子量。相关技术细节可以参考中国专利cn101261203b。具体过程如下:
精密称取100mg干燥多糖样品,加水溶解配制成1mg/ml的浓度,过0.22um滤膜,得供试样品溶液。采用凝胶排阻色谱测定分子量。实验方法如下:
色谱柱:tsk3000
流动相:0.1mol/lnacl
进样量:10ul
流速:1ml/min
检测器:示差检测器,18角度激光散射仪
检测结果和数据处理:采用仪器自带的图谱处理软件(astra)处理图谱,zimm图外推法计算得到样品的分子量。
催化剂对多糖降解速率的影响
为了考察催化剂对臭氧降解多糖速率的影响,本发明中还监测了多糖分子量随降解时间的变化情况,检测了在催化剂参与下不同时间点所取样品的分子量,并与未加催化剂时的降解效果比较。本发明中采用了如下催化剂或者反应条件来催化臭氧氧化反应:碱(氢氧根)、金属离子、双氧水、活性碳和紫外光,其中金属离子包括铁离子及其可溶性盐,镍离子及其可溶性盐,钴离子及其可溶性盐,以及锰离子(二氧化锰)。示例性的操作可参见实施例16和附图1。
硫酸根含量测定
采用离子色谱法测定硫酸多糖中硫酸根含量,方法如下:
利用硫酸根标准溶液分别配制浓度为1、5、10、25、50和100ppm的标准系列溶液,绘制标准曲线。精密称定聚古罗糖醛酸硫酸酯多糖的钠盐10mg,共2份,一份置5ml容量瓶中,加去离子水适量使溶解并定容至刻度,摇匀,即得游离硫酸根测定用供试品溶液;另一份置2ml安瓿瓶中,精密加入2mol/l三氟乙酸溶液1ml,熔封,120℃水解3h,精密移取0.2ml,90℃氮气吹干,残渣加1ml水使溶解,高速离心,精密移取上清液0.25ml置5ml容量瓶中,加水定容至刻度,摇匀,即得总硫酸根测定用供试品溶液。将标准溶液和供试品溶液分别注入离子色谱仪进行分析。
色谱条件:
色谱柱:metrosepasupp5-150/4.0column;柱温:30℃;流动相:3.2mmol/lna2co3-1mmol/lnahco3溶液;抑制剂:0.5%h2so4溶液;流速:0.7ml/min;进样量:10μl。
结果计算:按干燥品计算,计算公式如下:
so42-结合(%)=so42-总-so42-游离
本发明的优点在以下非限制性的实施例中进一步进行说明。但实施例中采用的具体材料及其用量,以及其他实验条件并不应理解为对本发明的限制。除非特别指明,本发明中份数和百分比均以质量计。
实施例
以下实施例中,由植物和中药材提取的多糖重量、降解产率及降解前后的分子量等数据列入表1。其中,多糖的提取工艺是以1份的中药材加10份水进行加热回流提取,得到的多糖干燥称重。多糖降解在臭氧条件下进行,降解前后的分子量都是用gpc-ri-malls方法测定。其余多糖降解前后的分子量及产率等数据列入表2。
实施例1:
步骤⑴:猴头菇多糖的提取。将药材干燥粉碎后,称取5kg放入100l的带冷凝水回收装置的反应釜,加水50l,浸泡12hr,搅拌,加热升温至100℃时开始计时。提取8hr,停止加热,通冷却水冷却至50摄氏度以下时将提取液放出,滤布过滤,滤液加100l乙醇(95%)沉淀,静置12hr,移除上清,离心收集沉淀,真空减压干燥,粉碎称重得多糖产品560g。
步骤⑵:猴头菇多糖的降解。称取上述得到的多糖粉末400g,加水4l混匀,加热促进溶解。放置4hr左右,待温度回调至30℃时,调节氧气钢瓶的出口压力至反应体系的压力维持在0.8mpa,开启臭氧发生器,调节输出功率,测得臭氧质量浓度为0.5g/l,将臭氧通入反应液底部,快速搅拌,使得溶液与臭氧反应充分。在反应装置顶部将尾气通过减压阀导出至尾气处理装置。尾气处理装置依次由6mnaoh溶液和1m硫代硫酸钠溶液串联组成。持续通入臭氧至1hr以后停止通入,继续搅拌30min。
步骤⑶:猴头菇多糖降解产物处理:待剩余的臭氧吸收完以后,拆开反应装置,取出降解后的多糖溶液并转移至旋转蒸发仪中减压浓缩,真空烘箱干燥。干燥后粉碎、称重,得降解多糖产物355.2g。
步骤⑷:猴头菇多糖降解前后多糖分子量测定:降解前和降解后的样品分子量如前文所述的方法进行。zimm图外推法计算得到样品的分子量分别为:降解前猴头菇多糖的分子量为650kda,降解后为60kda。猴头菇多糖及其降解产物的重量、分子量、产率等数据列入表1。
实施例2:
步骤⑴:称取5.0kg茯苓粉末,提取方法与实施例1相同。得到610g多糖粉末。
步骤⑵中压力设置为0.9mpa,其余与实施例1相同。
步骤⑶、⑷与实施例1相同,降解后得到降解茯苓多糖365.2g。降解前后的分子量分别测定为740kda和77kda。结果见表1。
实施例3:
步骤⑴:称取5.0kg银耳粉末,提取方法与实施例1相同。得到720g多糖粉末。
步骤⑵:压力设置为0.2mpa,降解时间为3hr,其余与实施例1相同。
步骤⑶:与实施例1不同之处在于反应后样品处理为乙醇沉淀,具体为在滤液中加入2倍体积的95%乙醇,搅拌使得沉淀均匀,放置于4℃冷库静置过夜。之后吸去上清液,下层沉淀离心,收集沉淀,烘箱干燥后粉碎称重为293.2g。
步骤⑷与实施例1相同,降解前后的分子量分别测定为530kda和46kda。结果见表1。
实施例4:
香菇多糖的提取、降解反应、产物处理及分子量测定与实施例3相同,结果见表1。
实施例5:
步骤⑴:灵芝多糖提取步骤同实施例3、4。
步骤⑵:压力设置为常压,即0.1mpa,降解时间为4hr,其余与实施例3、4相同。
步骤⑶:与实施例3、4不同之处在于反应后样品处理为超滤膜浓缩,具体为反应液经0.22um滤膜过滤以后,以截留分子量为20kda的超滤膜过滤,收集未透过液,旋转蒸发仪浓缩,真空干燥,得274.0g。
步骤⑷与实施例3、4相同,降解前后的分子量分别测定,降解前多糖的分子量要大于1000kda,降解以后为22kda。结果见表1。
实施例6:
枸杞多糖的提取、降解反应、产物处理及分子量测定与实施例5相同,结果见表1。
实施例7:
步骤⑴:黄芪多糖提取步骤同实施例5、6。
步骤⑵:与实施例5、6不同之处在于降解时间为3.5hr。
步骤⑶:与实施例5、6不同之处在于反应后样品处理为超滤膜浓缩,具体为反应液经0.22um滤膜过滤以后,以截留分子量为100kda的超滤膜过滤,收集未透过液,旋转蒸发仪浓缩,真空干燥,得293.2g。
步骤⑷与实施例5、6相同,降解前后的分子量分别测定,降解前为710kda,降解以后为75kda。结果见表1。
表1为中药材中提取得到的多糖及其降解前后分子量比较
实施例8:
以下8种多糖的降解过程和处理方法如下:称取褐藻胶、肝素、硫酸乙酰肝素、硫酸软骨素、硫酸皮肤素、透明质酸、壳聚糖及黄原胶各400g,分别加水10l溶解或者使溶胀,臭氧氧化降解反应的压力设置为0.3mpa,其余步骤同实施例5、6的步骤⑵。
反应后各样品处理如下:将降解后的反应液用0.22um的超滤膜过滤以后,转移至膜浓缩装置。膜浓缩步骤如下:1)初次以100kda的超滤膜浓缩,浓缩至样品液体为原来的三分之一时停止浓缩,收集透过液。2)将透过液再次装入2kda截留分子量的膜进一步浓缩,待浓缩到原体积的三分之一时补加3份的水继续浓缩至三分之一,收集未透过液。3)未透过液在旋转蒸发仪中浓缩,真空烘箱干燥以后粉碎,称重。
上述8个多糖降解前后的分子量测定方法同实施例1-7。褐藻胶、肝素、硫酸乙酰肝素、硫酸软骨素、硫酸皮肤素、透明质酸、壳聚糖及黄原胶的分子量、降解产率及降解后分子量列入表2。
实施例9:
聚甘露糖醛酸(pm)和聚古洛糖醛酸(pg)制备过程为:称取2kg海藻酸钠,加水20l,加热使充分溶胀,加稀hcl调ph至4左右,100℃反应8hr后停止加热,加naoh溶液调ph至8.0,离心,去除不溶物,再加稀hcl调ph至2.85,离心收集沉淀a。上清继续加hcl调ph至1.0,离心收集沉淀b。将上述沉淀a和沉淀b分别减压干燥,粉碎称重。由沉淀a得聚古洛糖醛酸800g,由b得聚甘露糖醛酸600g。
实施例10:
步骤⑴:聚甘露糖醛酸(pm)降解过程为:称取400g聚甘露糖醛酸粉末,加水溶解,配成20%浓度,调ph值至5.0,升温至50℃,通入臭氧。臭氧氧化降解装置同实施例1-8。反应体系压力设置为0.5mpa,臭氧流量为:10g/hr,共通入2hr,反应结束。
步骤⑵:降解产物处理:将降解后的反应液用0.22um的超滤膜过滤以后,转移至膜浓缩装置。膜浓缩步骤如下:1)初次以50kda的超滤膜浓缩,浓缩至样品液体为原来的三分之一时停止浓缩,收集透过液。2)将透过液再次装入2kda截留分子量的膜进一步浓缩,待浓缩到原体积的三分之一时补加3份的水继续浓缩至三分之一,收集未透过液。3)未透过液在旋转蒸发仪中浓缩,真空烘箱干燥以后粉碎,称重。
步骤⑶:降解前后的分子量测定同实施例1-8。实验结果列入表2。
实施例11:
步骤⑴:聚古洛糖醛酸(pg)降解过程:称取400g聚古洛糖醛酸粉末,加水混匀,加naoh溶解,测ph9.0,配成25%浓度,升温至70℃,通入臭氧。臭氧氧化降解装置和设置同实施例10。臭氧流量为:10g/hr,共通入2hr,反应结束。
步骤⑵:降解产物处理同实施例10。
步骤⑶:降解前后的分子量测定同实施例10。实验结果列入表2。
实施例12:
硫酸化聚甘露糖醛酸(s-pm)的制备过程为:称取200g聚甘露糖醛酸加吡啶2l,搅拌使混悬均匀,冷凝至0℃左右,慢慢加入预先冷却的氯磺酸-吡啶溶液500ml(含300g氯磺酸)。加完后继续搅拌3hr,反应结束。静置、滤出溶剂,固体加5l95%乙醇洗涤除去残余的吡啶溶剂,待乙醇滤干以后,加水5l使固体物质溶解,加naoh调ph至12左右,使结合吡啶充分挥发除去。加5l乙醇得沉淀,沉淀离心,烘干后粉碎称重,得230g固体粉末。测得分子量为5kda。
实施例13:
硫酸化聚古洛糖醛酸(s-pg)的制备方法同实施例12。得固体粉末240g,分子量为8kda。
实施例14:
硫酸化聚甘露糖醛酸(s-pm)降解过程为:称取200g聚甘露糖醛酸粉末,加水溶解,配成30%浓度,调ph值至7.0,升温至50℃,通入臭氧。臭氧氧化降解装置及设置同实施例10。臭氧流量为:10g/hr,共通入3hr,反应结束。
降解产物处理及分子量测定同实施例10。降解前后硫酸根含量均为40%,测定方法参见本说明书前面所公布的“硫酸根含量测定”中所用的方法。其余实验结果列入表2。
实施例15:
硫酸化聚古洛糖醛酸(s-pg)降解过程、降解产物处理及分子量测定同实施例14。降解前后的硫酸根含量均为38%。其余实验结果列入表2。
表2为购买及自制多糖降解前后的分子量及产率
实施例16:
本发明以褐藻胶的臭氧氧化降解为模型,对比考察了催化剂对褐藻胶降解速率的影响,方法如下:
步骤⑴:称取等质量的褐藻胶9份,每份200g,分别溶解于20l水中,加热促进溶解。溶解后待温度稳定在40℃时开始引入催化剂。除第1份以外,其余8份反应溶液的催化条件依次为:1mmfecl3、1mmniso4、1mmcocl3、1mmmno2,10mm的h2o2,20瓦功率的高效紫外灯提供的光照,10g活性碳细粉,5gnaoh。
步骤⑵:反应条件及反应过程中取样。臭氧流量同实施例1,压力设置为常压,即0.1mpa,通入臭氧开始反应,每隔10min取一次样品测试分子量。
步骤⑶:分子量测试:反应的起始原料褐藻胶的分子量为0min的分子量。其余时间点所取样品溶液均以10kda截留分子量的透析袋透析12hr,除去盐、金属离子和反应的小分子片段。透析后的样品经0.22um的滤膜过滤,得供试样品。测定方法同实施例1。附图1为上述反应条件下多糖分子量随时间变化的曲线。由图1可以看出,所选催化剂可以明显加速多糖的降解。
实施例17:
步骤1):甘露糖醛二酸寡糖产品的制备
如实施例9中制备聚甘露糖醛酸(pm),具体操作简述如下:将5kg海藻酸钠配成约10%的溶液,加稀盐酸调ph至3.0左右,升温至80℃,搅拌,反应10hr,停止加热,冷却至室温后,加naoh调ph值至9.0,再加稀盐酸回调ph至2.85,离心机5000rpm离心10min,收集上清,加hcl调ph至1.0,离心,收集沉淀,旋转蒸发仪浓缩,真空干燥得m段中间体1500g。称取500gm-段中间体,加蒸馏水溶解后,配成5l体积的溶液,naoh调ph至6.5,水浴加热,控制反应温度到75℃。调节氧气钢瓶出口压力,当系统压力稳定在0.1mpa时,调节出气口的气流量和臭氧发生器的功率,使得臭氧质量浓度流量达到8g/hr,通入反应液中。反应4hr后停止通入臭氧,加适量水调整溶液浓度至10%左右,以截留分子量为2000da的超滤膜过滤,收集未透过液,旋转蒸发仪浓缩,真空干燥,得350g甘露糖醛二酸产品a。
步骤2)药理活性评价
1、产品a对aβ诱导的神经细胞损伤的保护作用
按照“细胞活性评价模型”进行,实验过程如下:sh-sy5y细胞(神经母细胞瘤细胞)接种于96孔板(3000/孔),24hr后去处培养基,用药组每孔加入10ul药物(10mg/ml)预处理0.5hr(无血清培养配制,每个剂量3复孔),然后加入聚集的aβ1-42(aβ1-42以pbs溶液配制成1mg/ml,于4℃培养箱中孵育24hr,使其形成聚集态,终浓度2μm)孵育48hr,cck8检测细胞活力。
结果发现2μm的aβ1-42处理sh-sy5y细胞48小时后可诱导明显的细胞损伤,细胞存活率降低,而25、50、100μg/ml的产品a均可明显抑制aβ诱导的细胞存活率下降,见附图2。上述结果表明产品a在低浓度(25ug/ml)、中浓度(50ug/ml)和高浓度(100ug/ml)下均可保护神经细胞免受aβ的毒性作用。
本申请还涉及以下项目。
1、一种水溶性多糖的可控降解方法,其特征在于使所述多糖的水溶液与臭氧相接触,以使得所述多糖的糖链发生氧化降解反应。
2、根据项目1所述的方法,其中控制臭氧的消耗量,以便产生目标分子量的降解的多糖或者寡糖。
3、根据前述项目任一项的方法,其中所述臭氧消耗量的控制通过控制臭氧的流量和通入时间进行。
4、根据前述项目任一项的方法,其中所述降解反应在加压反应器中进行,其中反应器中的压力为0.1mpa-1.0mpa。
5、根据前述项目任一项的方法,其中反应在常压反应器中进行。
6、根据前述项目任一项的方法,其中多糖为1%-40%的水溶液优选4%-30%,更优选8-25%。
7、根据前述项目任一项的方法,其中降解反应时间不超过4小时,优选不超过3小时。
8、根据前述项目任一项的方法,其中反应在20-60℃,优选20-50℃的温度下进行。
9、根据前述项目任一项的方法,其中还包括在制备多糖水溶液的过程中调节ph值为3-10,以促进多糖的溶解。
10、根据前述项目任一项的方法,其中所述多糖为天然来源的水溶性多糖。
11、根据前述项目任一项的方法,其中所述多糖为天然来源的多糖经降解后获得的水溶性多糖。
12、根据前述项目任一项的方法,其中所述多糖为经化学修饰的水溶性多糖。
13、根据前述项目任一项的方法,其中所述经化学修饰的多糖选自硫酸化多糖、磷酸化多糖、甲酰化多糖和乙酰化多糖。
14、根据前述项目任一项的方法,其中所述多糖为从植物或中药材提取获得的多糖,包括猴头菇多糖、茯苓多糖、银耳多糖、香菇多糖、灵芝多糖、枸杞多糖、黄芪多糖、褐藻胶、聚甘露糖醛酸、聚古洛糖醛酸。
15、根据前述项目任一项的方法,其中所述多糖为动物来源的多糖,包括肝素、硫酸乙酰肝素、硫酸软骨素、硫酸皮肤素、透明质酸、壳聚糖。
16、根据前述项目任一项的方法,其中所述多糖为从微生物提取的多糖,包括黄原胶。
17、根据前述项目任一项的方法,其中的臭氧消耗量基于多糖固体计为10mg-500mg/g多糖。
18、根据前述项目任一项的方法,其中所述的氧化降解反应在催化剂存在或不存在下进行。
19、根据前述项目任一项的方法,其中所述氧化降解反应在催化剂存在下进行,反应时间不超过2小时。
20、根据前述项目任一项的方法,所述催化剂为碱、金属离子、双氧水、紫外光和活性碳中的一种或多种。
21、根据前述项目任一项的方法,其中碱是钠或钾的氢氧化物、钠或者钾的碳酸盐、钠或者钾的磷酸盐。
22、根据前述项目任一项的方法,其中金属离子可以是铁离子、镍离子、钴离子、锰离子。
23、根据前述项目任一项的方法,其中停止反应后加乙醇沉淀,乙醇体积浓度(v/v)为10%-90%。
24、根据前述项目任一项的方法,停止反应后用超滤膜浓缩,其中所选超滤膜的截留分子量范围为1kda–100kda。
- 还没有人留言评论。精彩留言会获得点赞!