一种新型固态发酵纤维素酶的方法
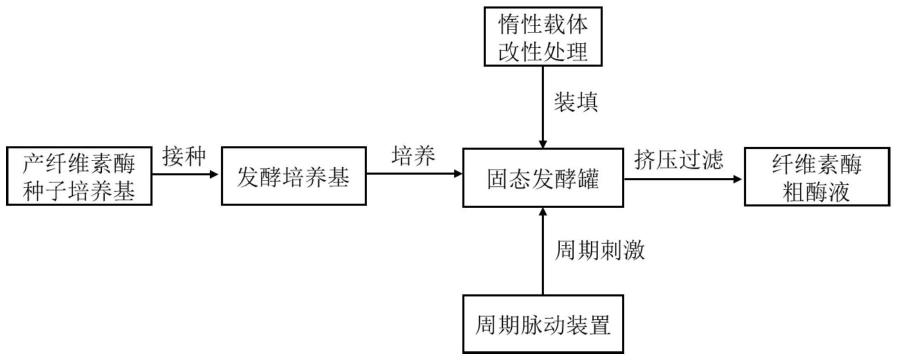
1.本发明属于发酵工程以及酶工程领域,具体涉及一种新型固态发酵纤维素酶的方法。
背景技术:
2.木质纤维素作为自然界最为丰富的一种可再生资源,充分利用廉价丰富的木质纤维素生物质资源是人们解决能源危机和环境问题的一条重要途径。纤维素酶是一类可以将木质纤维素降解为葡萄糖的酶系,主要包括内切葡聚糖酶(eg)、外切葡聚糖酶(cbh)和β-葡萄糖苷酶(cb)。然而纤维素酶的高成本、低产率限制了生物质能源的发展,因此亟待开发一种既高效又经济的纤维素酶生产工艺。
3.目前,纤维素酶的发酵菌株研究多集中在丝状真菌,如青霉、曲美、木霉等,其中里氏木霉(trichoderma)是一种可以生产包含多种纤维素酶的的丝状真菌,由于其产量高、稳定性好、产酶活力高、易于分离纯化,在工业中被广泛用于纤维素酶的生产。纤维素酶是一种诱导酶,乳糖、纤维二糖、微晶纤维素等可以诱导微生物菌株生产纤维素酶,因此选择合适的碳源对诱导物纤维素酶的生产有着重要的作用。
4.纤维素酶的生产主要有液态发酵和固态发酵,其中固态发酵是以气相为连续相、液相及其固体基质为固定相的三相生物反应系统。作为一种常用的发酵方式,具有产率高、能耗低、产生废水少等优点,为发酵微生物提供了天然适宜的生长环境,产生的酶系也更丰富,然而以传统营养性基质载体吸附固态发酵纤维素酶,存在底物易结块、产物分离提取难、发酵不稳定等问题。
5.在酶制剂的生产过程中,现有技术多采用固定化细胞液态发酵的方式,如中国发明专利申请公开号[cn109554302]公开的技术方案提出,使用海藻酸钠固定的菌株液态发酵饲用酶制剂,同时回收固定化细胞来恢复培养生产酶制剂。然而在实际操作过程中,随着发酵的进行,发酵液会变得非常粘稠,底物基质降解结块,导致发酵罐搅拌能耗会变得非常大,同时发酵结束后固定化细胞的回收繁琐,易造成染菌。
[0006]
为解决以上问题,本发明采用的惰性载体吸附固态发酵是一种新型的发酵方式,其具有以下优点:
①
为微生物提供了良好的吸附生长环境,提高固态发酵过程中的物质传递;
②
可以实现产物分离提取,降低了固态发酵纤维素酶的分离难度;
③
发酵菌株可以循环利用,采用连续化多批次发酵来提高纤维素酶的生产率。
技术实现要素:
[0007]
本发明的目的是针对现有技术所存在的不足,提供一种新型固态发酵纤维素酶的方法,通过该方法实现纤维素酶连续多批次发酵。
[0008]
本发明的技术方案如下:
[0009]
(1)载体的改性处理:将惰性载体切割为边长为5mm-10mm的立方体,之后浸泡在酸溶液中,在微波炉中处理5-15min,用去离子水洗涤至中性后,再浸泡在碱溶液中,在微波炉
0.005g/l,mnso4·
4h2o 0.0016g/l,znso4·
7h2o 0.0014g/l,cocl2·
6h2o 0.002g/l,吐温80 1ml/l。
[0027]
(2)发酵培养
[0028]
将种子液以10%(v/v)的量接种于100ml发酵培养基中,培养温度为28℃,ph为5.0,摇床转速为180rpm,培养时间为168h。
[0029]
发酵培养基为:微晶纤维素30g/l,酵母粉0.25g/l,蛋白胨0.75g/l,尿素0.3g/l,(nh4)2so
4 1.4g/l,kh2po
4 2g/l,cacl2·
2h2o 0.4g/l,mgso4·
7h2o 0.3g/l,feso4·
7h2o 0.005g/l,mnso4·
4h2o 0.0016g/l,znso4·
7h2o 0.0014g/l,cocl2·
6h2o 0.002g/l,吐温80 1ml/l。
[0030]
(3)纤维素酶酶活测定
[0031]
发酵结束后,将发酵液以8000rpm离心10min,取上清液进行测定,测定的纤维素酶作为对照纤维素酶活,纤维素酶活为0.262fpu/ml
[0032]
实施例1
[0033]
(1)载体改性处理
[0034]
将聚乙烯醇海绵(ppf)切割为边长为5mm的立方体,之后浸泡在1m的盐酸溶液中,在微波炉中处理5min,在去离子水充分洗涤至中性后,再浸泡在1m氢氧化钠溶液中,在微波炉中处理5min,最后用去离子水洗涤至中性,于80℃干燥24h,制得微波辅助改性的惰性载体。
[0035]
(2)种子培养
[0036]
菌株与种子培养基同对比实施例。
[0037]
(3)发酵培养
[0038]
以处理过后的聚乙烯醇海绵(ppf)为吸附载体,将惰性载体以装填量为20%装填在固态发酵罐中,之后加入发酵培养基,惰性载体与发酵培养基质量比为1:30,之后将种子液以10%(v/v)的量接种于发酵培养基中,培养温度为28℃,ph为5.0,培养时间为168h,发酵期间周期性通入无菌空气,脉动的压力强度为0.05mpa,脉动频率为1/60min-1
。
[0039]
发酵培养基为:乳糖30g/l,酵母粉0.25g/l,蛋白胨0.75g/l,尿素0.3g/l,(nh4)2so
4 1.4g/l,kh2po
4 2g/l,cacl2·
2h2o 0.4g/l,mgso4·
7h2o 0.3g/l,feso4·
7h2o 0.005g/l,mnso4·
4h2o 0.0016g/l,znso4·
7h2o 0.0014g/l,cocl2·
6h2o 0.002g/l,吐温80 1ml/l。
[0040]
(4)发酵酶活测定
[0041]
发酵结束后,通过板框挤压的方式收集发酵液,以8000rpm离心10min,取上清液进行酶活测定,ppf吸附固态发酵纤维素酶活为0.276fpu/ml,与对照实施例相比,发酵纤维素酶酶活提高了5.5%。
[0042]
实施例2
[0043]
(1)载体改性处理
[0044]
将聚氨酯海绵(puf)切割为边长为10mm的立方体,之后浸泡在1.5m的盐酸溶液中,在微波炉中处理10min,在去离子水充分洗涤至中性后,再浸泡在1.5m氢氧化钠溶液中,在微波炉中处理10min,最后用去离子水洗涤至中性,于80℃干燥24h,制得微波辅助改性的惰性载体。
[0045]
(2)种子培养
[0046]
菌株与种子培养基同对比实施例。
[0047]
(3)发酵培养
[0048]
以处理过后的聚氨酯海绵(puf)作为惰性吸附载体,以装填量为30%装填在固态发酵罐中,加入发酵培养基,惰性载体与发酵培养基质量比为1:60,之后将种子液以5%(v/v)的量接种于发酵培养基中,培养温度为28℃,ph为5.0,培养时间为168h,发酵期间周期性通入无菌空气,脉动的压力强度为0.15mpa,脉动频率为1/30min-1
。
[0049]
发酵培养基为:微晶纤维素30g/l,酵母粉0.25g/l,蛋白胨0.75g/l,尿素0.3g/l,(nh4)2so
4 1.4g/l,kh2po
4 2g/l,cacl2·
2h2o 0.4g/l,mgso4·
7h2o 0.3g/l,feso4·
7h2o 0.005g/l,mnso4·
4h2o 0.0016g/l,znso4·
7h2o 0.0014g/l,cocl2·
6h2o 0.002g/l,吐温80 1ml/l。
[0050]
(4)发酵酶活测定
[0051]
发酵结束后,通过板框挤压的方式收集发酵液,以8000rpm离心10min,取上清液进行酶活测定,puf吸附固态发酵纤维素酶活为0.310fpu/ml,与对照实施例相比,发酵纤维素酶酶活提高了18.3%。
[0052]
实施例3
[0053]
(1)载体改性处理
[0054]
将孔径为0.6mm炭黑聚氨酯海绵(paf)切割为边长为10mm的立方体,之后浸泡在2m的磷酸溶液中,在微波炉中处理15min,在去离子水充分洗涤至中性后,再浸泡在2m氨水溶液中,在微波炉中处理15min,最后用去离子水洗涤至中性,于80℃干燥24h,制得微波辅助改性的惰性载体。
[0055]
(2)种子培养
[0056]
菌株与种子培养基同对比实施例。
[0057]
(3)发酵培养
[0058]
以处理过后的炭黑聚氨酯海绵(paf)作为惰性吸附载体,将惰性载体以装填量为40%装填在固态发酵罐中,之后加入发酵培养基,惰性载体与发酵培养基质量比为1:40,之后将种子液以10%(v/v)的量接种于发酵培养基中,培养温度为28℃,ph为5.0,培养时间为168h,发酵期间周期性通入无菌空气,脉动的压力强度为0.10mpa,脉动频率为1/90min-1
。
[0059]
发酵培养基为:汽爆秸秆30g/l,酵母粉0.25g/l,蛋白胨0.75g/l,尿素0.3g/l,(nh4)2so
4 1.4g/l,kh2po
4 2g/l,cacl2·
2h2o 0.4g/l,mgso4·
7h2o 0.3g/l,feso4·
7h2o 0.005g/l,mnso4·
4h2o 0.0016g/l,znso4·
7h2o 0.0014g/l,cocl2·
6h2o 0.002g/l,吐温80 1ml/l。
[0060]
(4)发酵酶活测定
[0061]
发酵结束后,通过板框挤压的方式收集发酵液,以8000rpm离心10min,取上清液进行酶活测定,paf吸附固态发酵纤维素酶活为0.368fpu/ml,与对照实施例相比,发酵纤维素酶酶活提高了40.5%。
[0062]
实施例4
[0063]
(1)载体改性处理
[0064]
将孔径为0.6mm炭黑聚氨酯海绵(paf)切割为边长为8mm的立方体,之后浸泡在1m
磷酸溶液中,在微波炉中处理15min,在去离子水充分洗涤至中性后,再浸泡在1m氨水溶液中,在微波炉中处理15min,最后用去离子水洗涤至中性,于80℃干燥24h,制得微波辅助改性的惰性载体。
[0065]
(2)种子培养
[0066]
菌株与种子培养基同对比实施例。
[0067]
(3)连续多批次发酵培养
[0068]
以处理过后的炭黑聚氨酯海绵(paf)作为惰性吸附载体,将惰性载体以装填量为60%装填在固态发酵罐中,之后加入发酵培养基,惰性载体与发酵培养基质量比为1:40,之后将种子液以15%(v/v)的量接种于发酵培养基中,培养温度为28℃,ph为5.0,培养时间为168h,发酵期间周期性通入无菌空气,脉动的压力强度为0.05mpa,脉动频率为1/80min-1
。当发酵结束后,通过板框挤压的方式收集发酵液,保留载体与菌体,之后再补充新鲜的发酵培养基,培养条件与第1批次发酵条件相同,依次重复6个批次。
[0069]
发酵培养基为:汽爆秸秆30g/l,酵母粉0.25g/l,蛋白胨0.75g/l,尿素0.3g/l,(nh4)2so
4 1.4g/l,kh2po
4 2g/l,cacl2·
2h2o 0.4g/l,mgso4·
7h2o 0.3g/l,feso4·
7h2o 0.005g/l,mnso4·
4h2o 0.0016g/l,znso4·
7h2o 0.0014g/l,cocl2·
6h2o 0.002g/l,吐温80 1ml/l。
[0070]
(4)发酵酶活测定
[0071]
收集每批次得到的发酵液,以8000rpm离心10min,取上清液进行酶活测定,与对照实施例发酵纤维素酶相比,惰性载体吸附固态发酵纤维素酶在连续发酵6个批次过程中,每批次发酵时间缩短为120h,发酵过程中的每批次酶活保持相对稳定,平均每批次发酵酶活为0.318fpu/ml,与对照实施例相比,发酵纤维素酶酶活提高了21.4%。
[0072]
实施例5
[0073]
(1)载体改性处理
[0074]
将孔径为0.2mm的炭黑聚氨酯海绵(paf)切割为边长为5mm的立方体,之后浸泡在1m盐酸溶液中,在微波炉中处理10min,在去离子水充分洗涤至中性后,再浸泡在1m氢氧化钠溶液中,在微波炉中处理10min,最后用去离子水洗涤至中性,于80℃干燥24h,制得微波辅助改性的惰性载体。
[0075]
(2)种子培养
[0076]
菌株与种子培养基同对比实施例。
[0077]
(3)连续多批次发酵培养
[0078]
以处理过后的炭黑聚氨酯海绵(paf)作为惰性吸附载体,将惰性载体以装填量为40%装填在固态发酵罐中,之后加入发酵培养基,惰性载体与发酵培养基质量比为1:60,之后将种子液以10%(v/v)的量接种于发酵培养基中,培养温度为28℃,ph为5.0,培养时间为168h,发酵期间周期性通入无菌空气,脉动的压力强度为0.15mpa,脉动频率为1/30min-1
。当发酵结束后,通过板框挤压的方式收集发酵液,保留载体与菌体,之后再补充新鲜的发酵培养基,培养条件与第1批次发酵条件相同,依次重复7个批次。
[0079]
发酵培养基为:微晶纤维素30g/l,酵母粉0.25g/l,蛋白胨0.75g/l,尿素0.3g/l,(nh4)2so
4 1.4g/l,kh2po
4 2g/l,cacl2·
2h2o 0.4g/l,mgso4·
7h2o 0.3g/l,feso4·
7h2o 0.005g/l,mnso4·
4h2o 0.0016g/l,znso4·
7h2o 0.0014g/l,cocl2·
6h2o 0.002g/l,吐温
80 1ml/l。
[0080]
(4)发酵酶活测定
[0081]
收集每批次得到的发酵液,以8000rpm离心10min,取上清液进行酶活测定,与对照实施例发酵纤维素酶相比,惰性载体吸附固态发酵纤维素酶在连续发酵7个批次过程中,发酵时间缩短为120h,发酵过程中的每批次酶活保持相对稳定,平均每批次发酵酶活为0.290fpu/ml,与对照实施例相比,发酵纤维素酶酶活提高了10.7%。
[0082]
实施例6
[0083]
(1)载体改性处理
[0084]
将孔径为1.5mm的炭黑聚氨酯海绵(paf)切割为边长为15mm的立方体,之后浸泡在1m盐酸溶液中,在微波炉中处理5min,在去离子水充分洗涤至中性后,再浸泡在1m氢氧化钠溶液中,在微波炉中处理5min,最后用去离子水洗涤至中性,于80℃干燥24h,制得微波辅助改性的惰性载体。
[0085]
(2)种子培养
[0086]
菌株与种子培养基同对比实施例。
[0087]
(3)连续多批次发酵培养
[0088]
以处理过后的炭黑聚氨酯海绵(paf)作为惰性吸附载体,将惰性载体以装填量为50%装填在固态发酵罐中,之后加入发酵培养基,惰性载体与发酵培养基质量比为1:30,之后将种子液以10%(v/v)的量接种于发酵培养基中,培养温度为28℃,ph为5.0,培养时间为168h,发酵期间周期性通入无菌空气,脉动的压力强度为0.05mpa,脉动频率为1/100min-1
。当发酵结束后,通过板框挤压的方式收集发酵液,保留载体与菌体,之后再补充新鲜的发酵培养基,培养条件与第1批次发酵条件相同,依次重复5个批次。
[0089]
发酵培养基为:汽爆秸秆30g/l,酵母粉0.25g/l,蛋白胨0.75g/l,尿素0.3g/l,(nh4)2so
4 1.4g/l,kh2po
4 2g/l,cacl2·
2h2o 0.4g/l,mgso4·
7h2o 0.3g/l,feso4·
7h2o 0.005g/l,mnso4·
4h2o 0.0016g/l,znso4·
7h2o 0.0014g/l,cocl2·
6h2o 0.002g/l,吐温80 1ml/l。
[0090]
(4)发酵酶活测定
[0091]
收集每批次得到的发酵液,以8000rpm离心10min,取上清液进行酶活测定,与对照实施例发酵纤维素酶相比,惰性载体吸附固态发酵纤维素酶在连续发酵5个批次过程中,发酵时间缩短为144h,发酵过程中的每批次酶活保持相对稳定,平均每批次发酵酶活为0.305fpu/ml,与对照实施例相比,发酵纤维素酶酶活提高了16.4%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1