一种抗新型冠状病毒的全人源单克隆中和抗体及其应用的制作方法
1.本发明涉及生物医药领域,特别涉及一种抗新型冠状病毒的全人源单克隆中和抗体及其应用。
背景技术:
2.新型冠状病毒肺炎(covid
‑
19)的病原体是新型冠状病毒(sars
‑
cov2),可引起严重的急性呼吸系统疾病。根据世界卫生组织报告,疫病已经扩散到了世界各地,导致大量人员伤亡。covid
‑
19的临床特征包括发热、干咳和疲劳、呼吸衰竭,甚至导致死亡。到目前为止,针对新冠肺炎的疫苗和治疗特效药物大部分仍处于临床试验和初期紧急试用阶段,安全性和有效性需进一步验证。
3.sars
‑
cov2属冠状病毒科 (coronaviridae) 冠状病毒属 (coronavirus),是一类有包膜的单股正链rna病毒。新型冠状病毒基因编码多个结构蛋白,如s蛋白、n蛋白、m蛋白和e蛋白和等,s蛋白、m蛋白和e蛋白参与病毒细胞膜的形成,而n蛋白则参与病毒的核酸装配。研究表明,s蛋白是病毒入侵宿主细胞的关键蛋白,承担病毒与宿主细胞膜融合功能,决定了病毒的宿主范围和特异性,可通过其受体结合域(rbd)的基因重组或突变实现不同宿主间传播,并导致较高的死亡率和传染率。新冠病毒和当年的萨斯病毒(sars
‑
cov)一样,都是通过其s蛋白的受体结合域与宿主细胞表面的血管紧张素转换酶2(ace2)结合,诱导病毒囊膜与宿主细胞膜发生融合,实现病毒对宿主细胞的侵染。rbd部分表面由于与ace2特异结合具有一定的遗传保守性,也是病毒的弱点和广谱中和抗体的关键作用位点以及药物筛选的重要靶点。
4.新冠肺炎治疗方法中,新型冠状病毒肺炎康复患者体内存在多种抗体,能够中和病毒并阻止感染。使用康复者血浆疗法,在治疗重症患者的治疗过程中展现了良好的治疗效果,但是由于血浆来源有限、难以大规模制备、批间差异大和其它疾病感染风险等,使得这一疗法不能够大范围的推广应用。鉴于康复者血浆疗法的主要有效成分是中和抗体,从康复患者的血液中筛选全人源单克隆中和抗体在体外规模化生产,其成分单一,抗病毒机制明确,安全性有效性强,将是新冠肺炎治疗药物研发的重要方向。
技术实现要素:
5.为研制治疗和预防covid
‑
19的高效全人源单克隆中和抗体药物,本发明提供了一种在观察新型冠状病毒s蛋白rbd三维结构的基础上,设计筛选探针,目的是更为有效地从新型冠状病毒肺炎康复患者的外周血中筛选针对rbd表面遗传上保守的ace2受体结合表位的中和抗体。采用流式细胞技术从新冠肺炎康复患者的血液中筛选记忆b型淋巴细胞,单细胞巢式pcr技术获得单一b淋巴细胞表达抗体的重链和轻链基因序列,从单一b细胞中获得此细胞表达的针对新型冠状病毒中和抗体的重链和轻链。然后通过基因工程手段,构建稳定表达抗体的稳定细胞系,在体外规模化制备该单克隆中和抗体。使用x射线晶体衍射解析抗体与rbd复合物的三维结构,发现抗体与rbd大部分结合表位与ace2的结合表位重叠,能
够竞争性地阻断rbd与ace2结合,抑制病毒侵染宿主细胞。由于rbd与ace2结合表位遗传上较为保守,本发明所述抗体能够有效应对新冠病毒发生某些遗传突变,具有良好的广谱性。在不同假病毒感染hace2人源化细胞模型上验证单克隆中和抗体的安全性、有效性和广谱性。所述单克隆抗体在本申请中被命名为“yk
‑
cov2
‑
01”。
6.本发明提供了单克隆中和抗体:(i)、所述单克隆中和抗体的重链的三个cdr区:cdr1、cdr2和cdr3的氨基酸序列分别具有如seq id no.1、2和3所示的氨基酸序列;且(ii)、所述单克隆中和抗体的轻链的三个cdr区:cdr1、cdr2和cdr3的氨基酸序列分别具有如seq id no.4、5和6所示的氨基酸序列;或(iii)、(i)或(ii)所述氨基酸序列经取代、缺失或添加一个或多个氨基酸获得的氨基酸序列,且与(i)或(ii)所述氨基酸序列功能相同的氨基酸序列;或(iv)、与(i)、(ii)或(iii)所述氨基酸序列具有95%以上同一性的氨基酸序列。
7.在本发明的一些具体实施方案中,所述的单克隆中和抗体具有:(v)、所述单克隆中和抗体的重链的4个fr区:fr1、fr2、fr3、fr4的氨基酸序列分别如seq id no.7、8、9和10所示;且(vi)、所述单克隆中和抗体的轻链的4个fr区:fr1、fr2、fr3、fr4的氨基酸序列分别如seq id no.11、12、13和14所示;或(vii)、如(v)或(vi)所述氨基酸序列经取代、缺失或添加一个或多个氨基酸获得的氨基酸序列,且与(v)或(vi)所述氨基酸序列功能相同的氨基酸序列;(viii)、与(v)、(vi)或(vii)所述氨基酸序列具有95%以上同一性的氨基酸序列。
8.在本发明的一些具体实施方案中,所述的单克隆中和抗体具有:(ix)、其重链具有如seq id no.15所示的氨基酸序列,且(x)、其轻链具有如seq id no.16所示的氨基酸序列;或(xi)、(ix)或(x)所述氨基酸序列经取代、缺失或添加一个或多个氨基酸获得的氨基酸序列,且与(ix)或(x)所述氨基酸序列功能相同的氨基酸序列;或(xii)、与(ix)、(x)或(xi)所述氨基酸序列具有95%以上同一性的氨基酸序列。
9.在本发明的一些具体实施方案中,所述的单克隆中和抗体,所述多个为2个、3个、4个或5个。
10.本发明还提供了编码所述的单克隆中和抗体的核酸分子。
11.在本发明的一些具体实施方案中,编码所述重链的核酸分子具有:(xiii)、如seq id no.17所示的核苷酸序列;或(xiv)、如seq id no.17所示的核苷酸序列的互补核苷酸序列;或(xv)、与(xiii)或(xiv)的核苷酸序列编码相同蛋白质,但因遗传密码的简并性而与(xiii)或(xiv)的核苷酸序列不同的核苷酸序列;或(xvi)、与(xiii)、(xiv)或(xv)所示的核苷酸序列经取代、缺失或添加一个或两个核苷酸序列获得的核苷酸序列,且与(xiii)、(xiv)或(xv)所示的核苷酸序列功能相同或相似的核苷酸序列;或
(xvii)、与(xiii)、(xiv)、(xv)或(xvi)所述核苷酸序列具有至少95%序列一致性的核苷酸序列。
12.在本发明的一些具体实施方案中,编码所述轻链的核酸分子具有:(xviii)、如seq id no.18所示的核苷酸序列;或(xix)、如seq id no.18所示的核苷酸序列的互补核苷酸序列;或(xx)、与(xviii)或(xix)的核苷酸序列编码相同蛋白质,但因遗传密码的简并性而与(xviii)或(xix)的核苷酸序列不同的核苷酸序列;或(xxi)、与(xviii)、(xix)或(xx)所示的核苷酸序列经取代、缺失或添加一个或两个核苷酸序列获得的核苷酸序列,且与(xviii)、(xix)或(xx)所示的核苷酸序列功能相同或相似的核苷酸序列;或(xxii)、与(xviii)、(xix)、(xx)或(xxi)所述核苷酸序列具有至少95%序列一致性的核苷酸序列。
13.本发明还提供了表达载体,包括编码所述单克隆中和抗体的核酸分子。
14.此外,本发明还提供了转化或转染所述表达载体的宿主细胞。
15.基于上述研究,本发明还提供了所述单克隆中和抗体的制备方法,包括:培养所述的宿主细胞、诱导所述单克隆中和抗体的表达。
16.本发明还提供了结合物,包含经化学标记或生物标记的所述单克隆中和抗体。
17.所述化学标记为同位素、免疫毒素和/或化学药物;所述生物标记为生物素、亲和素或酶标记。
18.所述酶标记优选为辣根过氧化物酶或碱性磷酸酶。
19.所述免疫毒素优选为黄曲霉毒素、白喉毒素、绿脓杆菌外毒素、蓖麻毒蛋白、相思子毒蛋白、槲寄生凝集素、蒴莲根毒素、pap、造草素、白树毒素或丝瓜毒素。
20.本发明还提供了所述单克隆中和抗体或所述结合物与固体介质或半固体介质偶联制得的偶联物。
21.所述固体介质或非固体介质选自胶体金、聚苯乙烯平板或珠粒。
22.本发明还提供了所述单克隆中和抗体、所述结合物和/或所述偶联物在制备与新型冠状病毒的受体结合域特异性结合的作用剂的应用。
23.本发明还提供了所述单克隆中和抗体、所述结合物和/或所述偶联物在制备预防和/或治疗疾病的药物中的应用;所述疾病包括新型冠状病毒所致的疾病。
24.本发明还提供了所述单克隆中和抗体、所述结合物和/或所述偶联物在制备检测病毒的试剂或试剂盒中的应用;所述病毒包括新型冠状病毒。
25.更重要的是,本发明还提供了药物,包括所述单克隆中和抗体、所述结合物和/或所述偶联物以及药学上可接受的辅料。
26.本发明还提供了用于诊断covid
‑
19的诊断试剂,所述的诊断试剂中含有所述的单克隆中和抗体。
27.本发明还提供了用于诊断covid
‑
19的诊断试剂盒,所述的诊断试剂盒中含有所述的单克隆中和抗体。
28.本发明公开了一种所述单克隆中和抗体yk
‑
cov2
‑
01的fab与rbd蛋白复合物晶体进行x射线衍射,解析复合物三维结构的蛋白质晶体学的方法,发现所述抗体与rbd结合表
位与大部分ace2的结合表位重叠,由于rbd与ace2结合表位遗传上较为保守,能够精准识别rbd遗传保守的ace2结合表位即病毒的弱点,所述抗体能够有效应对新型冠状病毒发生遗传变异,具有良好的广谱特征。
29.本发明公开了一种构建sars
‑
cov2假病毒感染细胞的方法,整合两种近期出现的sars
‑
cov
‑
2变异病毒株(20a.eu1和b.1.1.7)刺突(s)蛋白的突变序列,以及对胞浆区肽段的19个氨基酸进行局部缺失突变,构建突变型s蛋白表达质粒,转染293t细胞进行表达,用western blot和流式细胞术检测确认s蛋白的表达。将s蛋白表达质粒与其它慢病毒包装质粒共转染293t细胞进行假病毒的包装,用包装好的假病毒分别感染293t
‑
hace2细胞和huh
‑
7细胞,并进行假病毒的组织半数感染量(tcid50)检测。建立以突变型sars
‑
cov
‑
2假病毒感染293t
‑
hace2细胞为基础的检测体系,用于评价抗体药物中和性能的应对病毒发生基因突变的能力。单克隆中和抗体yk
‑
cov2
‑
01对d614g和近期出现的累加b.1.1.7突变株基因和d614g病毒株均具有较高的中和活性,能够有效抑制病毒感染宿主细胞,抑制感染宿主细胞的半数有效浓度(ic
50
)为0.57 ng/ml。本发明的结果显示,所述抗体在covid
‑
19的诊断、治疗和预防药物中具有广泛的应用前景。
附图说明
30.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
31.图1a~图1c示流式分选sars
‑
cov2 s蛋白特异性结合的记忆b细胞;其中,图1a显示圈定人血单个核细胞群,图1b显示从图1a圈定的细胞中选择aqua blue
‑ꢀ
cd3
‑ꢀ
cd8a
‑
cd14
‑
d19
+ cd20
+ igg
hi
igm
lo cd27
+
的细胞,图1c显示从图1b中圈定的细胞中进一步选择ag(+)
+
ag(
‑
)
‑
的细胞;图2示抗体轻重链基因的pcr扩增产物核酸琼脂糖凝胶电泳图谱;图3a~图3b示yk
‑
cov2
‑
01抗体可变区序列检索结果输出图,其中,图3a为重链结果输出图;图3b为轻链结果输出图;图4a~图4b示yk
‑
cov2
‑
01抗体的亲和层析纯化和sds
‑
page检测图谱;其中,图4a示superdex 200 分子筛柱分离纯化图谱;图4b示sds
‑
page检测图谱;图5示使用大分子相互作用仪gator测定yk
‑
cov2
‑
01抗体对rbd 的结合亲和活性;图6示使用大分子相互作用仪gator测定yk
‑
cov2
‑
01抗体竞争性阻断sars
‑
cov2 s蛋白的rbd与受体ace2结合;图7a~图7b示yk
‑
cov2
‑
01抗体对不同sars
‑
cov
‑
2假病毒的中和能力;其中,图7a示抗体对野生sars
‑
cov2假病毒的中和效果;图7b示抗体对累加20a.eu1和b.1.1.7突变sars
‑
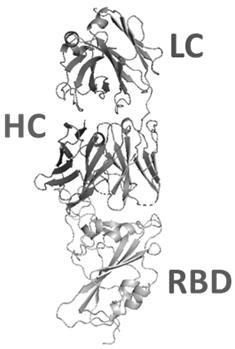
cov2假病毒的中和效果;图8a~图8b示x
‑
射线晶体衍射解析yk
‑
cov2
‑
01的fab与rbd 复合物三维结构,其中,图8a示yk
‑
cov2
‑
01与rbd复合物的整体的三维结构;图8b示yk
‑
cov2
‑
01和受体ace2在rbd上的结合表位及两者的重叠区域显示图;其中,hc:重链;lc:轻链;黑色虚线所包围表面为ace2在rbd上的结合表位,深灰色实线所包围表面为抗体在rbd上的结合表位;图9a~图9d示示本发明提供的单克隆中和抗体的重链和轻链序列:其中,图9a示重链的氨基酸序列;图9b示重链的核苷酸序列;图9c示轻链的氨基酸序列;图9d示轻链的核苷
酸序列。
具体实施方式
32.本发明公开了特异性结合sars
‑
cov2病毒的全人源单克隆抗体及其应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
33.术语:除非另有定义,本文使用的所有科技术语具有本领域普通技术人员所理解的相同含义。关于本领域的定义及术语,专业人员具体可参考current protocols in molecular biology(ausubel)。氨基酸残基的缩写是本领域中所用的指代20个常用l
‑
氨基酸之一的标准3字母和/或1字母代码。
[0034]“抗体”是指由能特异结合抗原的一种或多种多肽构成的蛋白质。抗体的一种形式构成了抗体的基本结构单元。这种形式是四聚物,它由两对完全相同的抗体链构成,每一对都有一个轻链和一个重链。在每对抗体链中,轻链和重链的可变区联合在一起共同负责结合抗原,而恒定区则负责抗体的效应器功能。
[0035]
抗体重链或轻链的“可变区”是该链的n端成熟区域。目前已知的抗体类型包括κ和λ轻链,以及α,γ(igg1,igg2,igg3,igg4),δ,ε和μ重链或它们的其它类型等价物。全长的免疫球蛋白“轻链”(大约25kda或大约214个氨基酸)包含一个由nh2
‑
末端上大约110个氨基酸形成的可变区,以及一个cooh
‑
末端上的κ或λ恒定区。全长的免疫球蛋白“重链”(大约50kda或大约446个氨基酸),同样包含一个可变区(大约116个氨基酸),以及重链恒定区之一,例如γ(大约330个氨基酸)。
[0036]
ꢀ“
抗体”包括任何同型体的抗体或免疫球蛋白,或保持与抗原特异结合的抗体片段,包括但不限于fab,fv,scfv和fd片段、嵌合抗体、人源化抗体、单链抗体以及包含抗体的抗原结合部分和非抗体蛋白质的融合蛋白质。抗体可以被标记和检测,例如,可以通过放射性同位素、能产生可检测物的酶、荧光蛋白质、生物素等等进行标记并被检测。抗体还可以结合于固相载体,包括但不限于聚苯乙烯平板或珠粒等等。
[0037]“人源化抗体”是指一种抗体,其包含来源于非人源抗体的cdr区、并且该抗体分子的其他部分来源于一种(或几种)人抗体。而且,为了保留结合亲和力,可以修饰骨架(称为fr)区段的一些残基。
[0038]
所述“单克隆抗体”系指具有单一分子组成的抗体分子的制备物。单克隆抗体组合物显示出对于特定表位的单一结合特异性和亲和性。
[0039]
所述药物中含有至少一种功能成分,还包括可药用的载体。优选地,所述可药用载体是水、缓冲水溶液、等渗盐溶液如pbs(磷酸盐缓冲液)、葡萄糖、甘露醇、右旋葡萄糖、乳糖、淀粉、硬脂酸镁、纤维素、碳酸镁、0.3%甘油、透明质酸、乙醇或聚亚烷基二醇如聚丙二醇、甘油三酯等。所用可药用载体的类型尤其依赖于根据本发明的组合物是否配制为用于口服、鼻、皮内、皮下、肌内或静脉施用。根据本发明的组合物可包含润湿剂、乳化剂或缓冲液物质作为添加剂。
[0040]
本文使用的“cdr区”或“cdr”是指免疫球蛋白的重链和轻链的高变区,如kabat et al.所定义(kabat et al., sequences of proteins of immunological interest, 5th ed., u.s. department of health and human services, nih, 1991,以及以后版本)。存在三个重链cdr和三个轻链cdr。根据情况,本文所用术语cdr或cdrs是为了指示这些区域之一、或者这些区域的几个或者甚至全部,所述区域包含通过抗体对抗原或其识别表位的亲和力而负责结合的大部分氨基酸残基。
[0041]
本发明提供一种针对新型冠状病毒s蛋白rbd遗传上保守的ace2结合表位、亲和力较高的全人源单克隆中和抗体。
[0042]
本发明所述的全人源中和抗体是通过sars
‑
cov
‑
2相关特异性探针标记
‑
流式分选
‑
单细胞巢式pcr技术筛选到的一种抗sars
‑ꢀ
cov
‑
2的单克隆抗体,及抗体的表达,分离和纯化,如图1a~4b所示。所述单克隆抗体由轻链和重链组成:其中重链可变区的cdr1、cdr2和cdr3区的氨基酸序列分别如seq id no.1、2、3所示,所述单克隆抗体的轻链可变区的cdr1、cdr2和cdr3区的氨基酸序列分别如seq id no.4、5、6所示。重链的4个fr区:fr1、fr2、fr3、fr4的氨基酸序列分别如seq id no.7、8、9和10所示;轻链的4个fr区:fr1、fr2、fr3、fr4的氨基酸序列分别如seq id no.11、12、13和14所示;所述重链具有如seq id no.15所示的氨基酸序列,具有如seq id no.17所示的核苷酸序列;所述轻链具有如seq id no.16所示的氨基酸序列,具有如seq id no.18所示的核苷酸序列。
[0043]
本发明还提供了一种含有上述功能元件的宿主细胞。在一个优选的实施方案中,所述细胞为expi 293f细胞用于瞬时表达所述抗体。在另一个优选的实施方案中,所述细胞为cho细胞,可以使用cho细胞构建稳转工程细胞株,实现产业化生产。
[0044]
本发明提供的单克隆抗体显示出对sars
‑
cov2假病毒感染细胞良好的中和保护效果,具有广泛的应用前景。本发明公开的单克隆抗体还具有以下的技术优势:(1)全人源,在临床应用上,不需要进行人源化改造以降低人抗鼠抗体反应(hama反应),即低免疫原性。(2)高亲和活性和高中和活性,单抗与 rbd抗原的亲和常数kd为1.19 nm,在sars
‑
cov2感染的细胞模型上,半数有效浓度ic
50
为0.57ng/ml。(3)作用机制明确:yk
‑
cov2
‑
01与rbd高度特异结合,显示单抗是靶向受体结合区域的,通过特异性阻断病毒与受体ace2的结合发挥抗病毒效应。(4)稳定性好:因为单抗基因来自人体的同一个细胞,是天然配对的,已知人体内igg1抗体的半衰期是21~28天,理论上公开的 单抗具有一致的人体内半衰期。本申请进一步包括一种治疗和/或预防和/或诊断新型冠状病毒所致疾病的产品,其以本发明所述抗体作为活性成分。
[0045]
本发明还提供了一种对yk
‑
cov2
‑
01的fab与rbd蛋白复合物晶体进行x射线衍射,解析复合物三维结构的蛋白质晶体学的方法,确定所述抗体能够精准识别病毒的弱点,具有良好的广谱特征。如图8a~图8b所示。
[0046]
本发明公开了一种针对sars
‑
cov2病毒s蛋白受体结合域(rbd)的全人源单克隆中和抗体。所述抗体采用在结构生物学基础上设计出针对rbd的宿主细胞受体ace2结合表位特异性探针,使用流式细胞仪分选b淋巴细胞和单细胞pcr技术从新冠肺炎康复患者的血液筛选获得,由独特的轻链和重链组成。所述重链的氨基酸序列如seq id no.15所示,所述重链的核苷酸序列如seq id no.17所示;所述轻链的氨基酸序列如seq id no.16所示,所述
轻链的核苷酸序列如seq id no.18所示。本发明所述抗体能够特异性识别和结合sars
‑
cov2 s 蛋白rbd。通过解析抗体与rbd复合物的晶体结构,发现抗体的cdrh3(23氨基酸)能够识别病毒隐藏的遗传上保守的宿主细胞受体ace2结合域,其表面积是1291a2,重叠率60%。抗体与rbd 的亲和常数kd值为1.19 nm,能够高效阻断病毒与宿主细胞受体ace2的结合。抗体中和sars
‑
cov2野生病毒侵染细胞的半数有效浓度ic
50
值为 0.75ng/ml。其对sars
‑
cov2病毒侵染人源化小鼠的能够有效保护。本发明公开的单克隆抗体对sars
‑
cov2病毒的中和能力具有高效性和广谱性,同时还具有全人源、稳定性好的特点,具有良好的产业化潜质。
[0047]
本发明提供的特异性结合sars
‑
cov2病毒的全人源单克隆抗体及其应用中,所用原料及试剂均可由市场购得。
[0048]
下面结合实施例,进一步阐述本发明:实施例1 全人源抗sars
‑
cov
‑
2单克隆抗体的筛选和制备1.1蛋白探针的标记将所需的sars
‑
cov
‑
2相关特异性探针偶联上荧光染料,过程如下:1.1.1按照avitag融合蛋白生物素化试剂盒(bira500,avidity)说明书进行反应体系配制。30
°
c条件下孵育30min。
[0049]
1.1.2使用30 kda超滤管将反应产物与1
×ꢀ
pbs(ph 7.4)进行交换,去除多余的生物素。
[0050]
1.1.3以20 min的间隔逐步添加1/5摩尔当量的链霉亲和素
‑
藻红蛋白(sa
‑
pe)或链霉亲和素
‑
别藻蓝蛋白(sa
‑
apc)至生物素标记的抗原特异性探针中,直到sa
‑
pe或sa
‑
apc:生物素标记的抗原特异性探针的摩尔比达到1:1。在4
°
c下轻轻摇动进行孵育。从而分别制备荧光素标记的探针:ag(
‑
)
‑
sa
‑
apc 和 ag(+)
‑
sa
‑
pe。
[0051]
1.2流式细胞仪分选单个抗原特异性b细胞采用ficoll
‑
hypaque密度梯度(1.077g/l)离心法分离康复患者的pbmc,过程如下:步骤:1.2.1将新鲜静脉血(肝素抗凝)与同等体积的1
×
pbs进行稀释。
[0052]
1.2.2按照外周血:ficoll为10:3比例将ficoll轻轻加至离心管底部;将稀释后的血样平铺到分离液液面上方,保持两液面界面清晰。
[0053]
1.2.3室温条件下,用水平转子以900
×
g,加速度设为4(单位为a,角速度),降速度设为0(单位为a,角速度),离心30min。
[0054]
1.2.4离心结束后,轻轻吸出中间白膜层置于新的离心管。并加入10倍体积的1
×
pbs,室温以600
×
g离心10min,弃上清。重复清洗一遍。
[0055]
1.2.5用完全rpmi1640培养基将1
×
pbs重悬备用,并进行活细胞计数。
[0056]
采用流式细胞分选技术从pbmc中分选出抗原特异性b细胞,具体步骤如下:1.2.6用1
×
pbs清洗细胞,并重悬至密度为1
×
106。按照1μl/ml的比例添加aqua blue染料,4℃条件下避光孵育30min。以600
×
g离心10min,弃上清。重复清洗一遍。
[0057]
1.2.7将pbmc使用流式抗体染色:anti
‑
cd3
‑
pe
‑
cy7, anti
‑
cd8a
‑
pe
‑
cy7, anti
‑
cd14
‑
pe
‑
cy7, anti
‑
cd20
‑
percp
‑
cy5.5, anti
‑
cd19
‑
fitc, anti
‑
igg
‑
apc
‑
h7, anti
‑
igm
‑
bv421, anti
‑
cd27
‑
pe
‑
cf594, ag(
‑
)
‑
sa
‑
apc和 ag(+)
‑
sa
‑
pe,每5
×ꢀ
106个pbmc细胞各加入2μl上述抗体,4℃条件下避光孵育40min后,使用含2%bsa的pbs重复洗涤2
‑
3次。利用bd facsaria
™ꢀ
iii cell sorter流式分选细胞仪,选择浆细胞特异的细胞表面标记物(aqua blue
‑ꢀ
cd3
‑ꢀ
cd8a
‑
cd14
‑
d19
+ cd20
+ igg
hi
igm
lo cd27
+ ag(+)
+
ag(
‑
)
‑
)分选浆细胞,直接将单个浆细胞分选至96孔板中,每孔中预先加入含有 20u rna酶抑制剂及2μl1
×
pbs,
‑
80℃冻存备用。流式分选的结果见图1a~图1c,图1a显示圈定人血单个核细胞群;图1b显示从图1a圈定的细胞中选择aqua blue
‑ꢀ
cd3
‑ꢀ
cd8a
‑
cd14
‑
d19
+ cd20
+ igg
hi
igm
lo cd27
+
的胞;图1c显示从图1b中圈定的细胞中进一步 选择ag(+)
+
ag(
‑
)
‑
的细胞。
[0058]
1.3利用单细胞
‑
pcr技术扩增全人源单抗可变区基因1.3.1反转录pcr,参考说明书(takara,6210a), 程序简单介绍如下:通过流式细胞仪分选了38个单细胞。向每个反应体系中同时加入5
×ꢀ
缓冲液4μl、 dntp 1 .1μl、反转录酶1μl、oligo dt引物1μl、水补齐至20μl。反转录pcr反应条件为:65℃保温 5 min后,冰上迅速冷却。接着,42℃反转录60min,随后 95℃ 预变性5min,冰上冷却。
[0059]
1.3.2巢式pcr取反转录产物4ul为模板, 进行pcr反应扩增h、κ、λ的可变区: 扩增重链可变区、kappa轻链可变区和λ轻链可变区的引物如下表1所示。
[0060]
表1.巢式pcr引物表1续
表1续
pcr反应体系中包含:2
×ꢀ
dna聚合酶缓冲液25μl、引物如上(表1所示)、模板(第一轮为反转录产物,第二轮为第一轮的pcr产物)2μl、水补齐至50μl。pcr反应条件为: 94℃ 预变性4min, 接着,94℃ 30s, 58℃(h、λ链)或60℃(κ链) 30s,72℃ 45min,50个循环,最后72℃延伸10min。
[0061]
1.3.3琼脂糖凝胶电泳 一个单细胞中重链和轻链基因均扩增成功的克隆,被认为是配对成功的克隆。 取5μl巢式pcr扩增产物经2%琼脂糖凝胶电泳。结果如图2所示,其中泳道1为重链可变区vh的pcr 产物, 扩增片段约450bp。取配对的阳性克隆连接到t载体上进行测序,测序获得的抗体可变区序列用vector nti软件及登录imgt网站进行分析。
[0062]
1.4抗sars
‑
cov
‑
2病毒全人源单克隆抗体真核表达载体的构建1.4.1分别将上述轻链/重链基因插入pcdna3.1(+/
‑
)表达载体(购自invitrogen公司)的单克隆酶切位点,构建抗sars
‑
cov2病毒全人源单克隆抗体的表达载体。
[0063]
1.4.2用上述连接产物转化dh5α感受态细菌,在含有氨苄青霉素的平板上37℃ 培养过夜。
[0064]
1.4.3挑取10个单菌落用特异性引物进行pcr,反应条件:94℃预变性3min, 94℃
变性30s,55℃退火30s,72℃延伸1min40s,28个循环,最后72℃再延伸5 min;1.4.4取5μl pcr产物在1% 琼脂糖凝胶上进行电泳检测,在阳性转化子中鉴定出了含有抗体重链或轻链基因的转化子。结果显示,本发明构建的sars
‑
cov
‑
2病毒单抗重链/轻链的重组表达载体其序列正确。
[0065]
1.5单抗的瞬时表达和亲和层析与分子筛纯化1.5.1使用expi293表达系统,取15ug重链表达质粒和15ug轻链表达质粒混合后转染expi293f细胞,按照说明书进行操作 (thermofisher scientific,a14635),转染后监测细胞状态,当细胞活率下降至70%,收获细胞。5000rpm/min离心40 min后,0.22μm瓶颈过滤器过滤收集上清。
[0066]
1.5.2使用体积为15 ml的现装protein a亲和层析柱进行亲和层析纯化。上样前使用8个柱体积的1
×
pbs缓冲液进行平衡,待电导显示到基线后进样。上样结束后,使用8个柱体积的1
×
pbs缓冲液洗涤色谱柱至基线平稳。 使用elution buffer液分次洗脱目的蛋白,待od280近基线后,停止收集,并向最终洗脱液中分别补入1ml 1m tris(ph 9.0)。使用截留分子量30 kda的超滤管将洗脱得到的蛋白超滤浓缩,nanodrop检测其浓度。
[0067]
1.5.3将超滤得到的抗体用superdex 200的分子筛柱子进一步纯化。将分子筛纯化的收集峰合并,用截留分子量30 kda的超滤管浓缩,nanodrop检测其浓度。
[0068]
1.5.4纯化后的单抗用sds
‑
page检测,结果见图4a~图4b,图4a为凝胶过滤层析纯化抗体的结果,图4b为sds
‑
page检测结果,其中1泳道为非还原sds
‑
page检测结果,2泳道为还原sds
‑
page检测结果。在还原电泳中,预期重链和轻链的分子量分别为50 kda和25 kda,泳道m为分子量标记。在非还原电泳中,预期全分子单抗的分子量为150 kda,符合预期。
[0069]
实施例2 yk
‑
cov2
‑
01抗体与rbd蛋白的结合活性分析利用gator非标记生物分子分析仪进行抗体与抗原的结合活性分析2.1.利用gnti细胞表达rbd
‑
嵌合物。依次经镍柱纯化和分子筛纯化后,按照dsb
‑
x
™ꢀ
biotin protein labeling kit(invitrogen
™
)说明书所示步骤将rbd 嵌合物进行生物素化标记。
[0070]
2.2将生物素化的rbd 嵌合物进行600倍稀释,取3 μl的rbd 嵌合物加入2000ul hbsep缓冲液中混合。将稀释后的rbd 以每孔200 μl的量装载至96孔样品板中。
[0071]
2.3 利用hrv3c酶将待检测抗体酶切成fab片段,利用亲和层析与分子筛纯化所得到的抗体fab。将抗体fab稀释1000倍后,继续按照1:3进行梯度稀释,共4个稀释度(36.2 nm, 12.1 nm, 4.02 nm和1.34 nm),每个稀释度样本取200 ul进行检测,同时取200 ul的hbsep缓冲液作为空白对照。并在样品孔列的两边加入一列的hbsep缓冲液作为baseline。
[0072]
2.4检测过程中,每个实验先在探针板的hbsep缓冲液中baseline平衡120s,然后循环loading 200s,在样品列的前面baseline 运行120s,在样品中运行600s作为结合,在样品列的后一列的hbsep中运行400s作为解离。拟合方法采用1:1model拟合。
[0073]
2.5分析及结果:通过软件拟合计算得到yk
‑
cov2
‑
01单抗与rbd 的亲和常数,见图5和表2。说明yk
‑
cov2
‑
01单抗与rbd 具有高的亲和力。
[0074]
表2. 单克隆中和抗体yk
‑
cov
‑
02与rbd 抗原的亲和力检测结果
分子名称k
off
(1/s)k
on
(1/ms)kd(m)yk
‑
cov2
‑
013.12
×
10
‑4±
1.60
×
10
‑62.63
×
105±
1.82
×
1021.19
×
10
‑9±
6.89
×
10
‑
12
实施例3 yk
‑
cov2
‑
01抗体竞争性阻断sars
‑
cov2 的rbd与受体ace2结合能力分析利用gator非标记生物分子分析仪进行抗体阻断sars
‑
cov
‑
2病毒rbd 嵌合物与受体ace2的结合能力分析3.1利用expi
‑
cho细胞表达受体ace2。依次经镍柱纯化和分子筛纯化后,按照dsb
‑
x
™ꢀ
biotin protein labeling kit(invitrogen
™
)说明书所示步骤将ace2进行生物素化标记。将生物素化后的ace2受体稀释至40ug/ml,摩尔浓度570nm。
[0075]
3.2 将rbd 稀释至30 ug/ml,摩尔浓度1000 nm。将抗体稀释至0.2mg/ml,与rbd 嵌合物 1:1混合。配制的混合液中抗体摩尔数量大于受体ace2的摩尔数量。
[0076]
3.3检测过程中,每个实验先在探针板的hbsep缓冲液中baseline平衡120s,然后循环loading 200s,在样品列的前面baseline 运行120s,在40 ug/ml的biotin
‑
ace2内20s即可达到最大的结合水平约为1.2 nm的响应值。在30 ug/ml的rbd 嵌合物中,结合400s,其中约20s左右到达结合的平台期,最大响应约为0.12 nm。在hbsep 1x buffer中解离600s,解离几乎完全。
[0077]
3.4分析及结果:通过软件拟合计算得到受体ace2与rbd 的亲和常数,见图6。说明yk
‑
cov2
‑
01单抗可完全阻断rbd 与受体ace2的结合。
[0078]
实施例4 微量中和法检测yk
‑
cov2
‑
01针对sars
‑
cov2假病毒中和能力和广谱性分析4 .1 sars
‑
cov2假病毒准备:为了检测单克隆中和抗体yk
‑
cov
‑
01针对sars
‑
cov2中和作用的广谱性,准备了野生型和突变型假病毒。
[0079]
将编码sars
‑
cov2 s蛋白的基因(genbank id:qhd43416 .1) 插入pcmv3
‑
cf载体,得到野生型假病毒质粒pcmv
‑
s
‑
cf
‑
wt。在野生型假病毒基础上,将sars
‑
cov
‑
2变异病毒株(20a.eu1和b.1.1.7)刺突蛋白的突变序列整合到pcmv
‑
s
‑
cf
‑
wt中,得到突变型假病毒质粒pcmv
‑
s
‑
cf
‑
mut。将ace2基因稳定转染入293t细胞,构建稳定表达人ace2的细胞ace2
‑
293t细胞。将293t细胞以5
×
105的密度接种至t75 细胞培养瓶中,置于37℃,5% co2的细胞培养箱中过夜培养,待细胞密度达到70
‑
90%后开始转染。利用lipofectamine 3000(invitrogen)将pcmv
‑
s
‑
cf
‑
wt或pcmv
‑
s
‑
cf
‑
mut分别与papax2和pcdh
‑
ef1
‑
cmv
‑
copgfp共转染到293t细胞中。6h后更换培养基。转染后24h收集第一批病毒,并更换新的5% fbs dmem。48h后,再次收集上清,并与第一批收集的上清混合,2000rpm,离心10min,去除细胞碎片,收集上清,并用0.45 um滤器过滤。
[0080]
病毒上清与lenti
‑
xtm concentator(clontech)按照3:1的比例充分混合均匀,置于4℃孵育过夜。4℃条件下,以1500
×
g离心45min,然后弃去上清,加入1/10
‑
1/100量的dmem或pbs重悬沉淀,最后将浓缩的病毒分装至冻存管,存于
‑
80℃。
[0081]
4.2 稀释抗体:将抗体用dmem培养基稀释到需要的浓度。首孔浓度为150μg/ml(100μl体系),首孔100μl,吸取25μl加入到下一孔,按照1:3进行稀释。每个梯度设置两个复孔。
[0082]
4.3稀释病毒:将假病毒用dmem按照所需浓度配制好,混匀后从第二排孔开始,每孔加入25μl,轻轻混匀。37℃孵育1h。首排孔设阴阳性对照不加病毒。
[0083]
4.4将ace2
‑
293t细胞稀释到4
×
105cell/ml,每孔加入50ul细胞悬液与抗体
‑
病毒
混合液混合。置于37℃,5%co2的细胞培养箱中培养24h后,补加50ul的10% fbs dmem,放入培养箱继续培养24h,在荧光显微镜下观察并统计病毒中和效果。
[0084]
4.5统计分析:没有病毒和抗体的细胞用作空白对照,没有抗体的细胞用作病毒对照。中和百分比计算为(样品信号
‑
空白对照信号)/(病毒对照信号
‑
空白对照信号)
×ꢀ
100%。使用graphpad prism 7进行统计分析。
[0085]
4.6结果:图7a~图7b显示不同抗体浓度对假病毒的中和效果。图7a显示抗体对野生sars
‑
cov2假病毒的中和效果;图7b显示抗体对累加20a.eu1和b.1.1.7突变sars
‑
cov2假病毒的中和效果。本发明公开的yk
‑
cov2
‑
01单抗在突变累加假病毒模型上ic
50
是0.57ng/ml。
[0086]
实施例5 yk
‑
cov2
‑
01抗体与rbd复合物的x射线衍射晶体结构解析5.1制备抗体fab和rbd 复合物5.1.1利用hrv3c酶将待检测抗体酶切成fab片段,利用hrv3c酶将待检测抗体酶切成fab片段,利用亲和层析与分子筛纯化所得到的抗体fab。
[0087]
5.1.2使用gnti细胞表达sars
‑
cov2 rbd
‑
嵌合物。利用镍柱纯化和分子筛纯化所得到的sars
‑
cov2 rbd
‑
嵌合物。
[0088]
5.1.3将sars
‑
cov2 rbd
‑
嵌合物和yk
‑
cov2
‑
01单抗fab按照分子量1:1比例混合并在冰上孵育1h,使其相互结合形成抗体fab和rbd 复合物。配制复合物的endo h酶切体系,并于室温孵育24h,利用endo h内切酶去除所得复合物表面的糖基化修饰。将所得酶切体系依次经过con a柱纯化系统和分子筛柱纯化系统,将去除糖基化修饰的复合物提纯,利用超滤浓缩法将复合物浓度调整至5mg/ml。
[0089]
5.2利用悬滴气相扩散法制备抗体fab和rbd 复合物晶体5.2.1按照jcsg晶体制备系列试剂盒说明书所述的相关步骤从384个晶体生长条件中筛选出制备复合物晶体的最优条件。取0.2μl的浓缩蛋白复合物滴加至点晶片上,同时取0.2μl的蛋白点晶池液滴加在蛋白复合物液滴上,储液池内加50μl相应的点晶液和3.5μl的5m nacl。将晶体培养板置于4~22℃的恒温箱中培养10~20天,观察蛋白晶体生长情况。选出的晶体最优生长条件的点晶液为20% peg 3350,0.5m硝酸钾溶液。
[0090]
5.2.2取0.5μl的浓缩蛋白复合物滴加至点晶片上,同时取0.5μl的蛋白点晶池液滴加在蛋白复合物液滴上,将点晶片倒扣至混有500μl的蛋白点晶池液和35μl的5m nacl的晶体培养板上并密封,将晶体培养板置于4~22℃的恒温箱中培养10~20天,待晶体生长到最佳状态时,将晶体捞出放置于液氮中保存。保存液为26% peg 3350,0.65m硝酸钾,40%甘油溶液。
[0091]
5.2.3将得到的fab和rbd复合物晶体在上海同步辐射光源17号线站(ssrf bl17u)进行晶体衍射并收集数据,所得数据使用ccp4,phenix,coot和pymol等软件进行蛋白质三维结构解析和优化修正,复合物的结构如图8a~图8b所示,其中,图8a为抗体fab与rbd复合物整体的三维结构;图8b为抗体和受体ace2在rbd上的结合表位显示图;结果显示,本发明抗体与rbd的结合表位与ace2结合位点的重叠率达60%,即表明本发明抗体拥有一定应对新冠病毒发生遗传变异的能力。
[0092]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应
视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1