一种末端1,1’-双取代吲哚乙烯衍生物及其制备方法
一种末端1,1
’‑
双取代吲哚乙烯衍生物及其制备方法
技术领域
1.本发明涉及有机合成技术领域,尤其涉及一种末端1,1'
‑
双取代吲哚乙烯衍生物及其制备方法。
背景技术:
2.烯烃类物质是一类具有碳碳双键官能团的化合物,对于许多天然产物、药物分子、聚合物材料以及光响应材料具有非常重要的意义。如何在分子中有效的引入烯基官能团以制备结构多样性的烯烃衍生物,尤其是制备具有末端烯基结构的化合物,一直是合成化学中备受关注的研究领域。末端吲哚乙烯是一类重要的杂芳基烯烃类化合物,不仅是一些生物活性的药物、农药或者天然生物碱的核心结构,而且是制备其他杂环化合物的关键中间体。例如,通过烯烃交叉复分解关环反应,可以将烯基吲哚转化为咔唑衍生物;通过烯烃的双羟基化反应,能够制备具有双羟基官能化的吲哚衍生物;通过烯烃的环氧化反应,能够制备具有光学活性的环氧化吲哚衍生物。目前,合成具有末端1,1'
‑
双取代吲哚乙烯衍生物的方法,主要是通过吲哚酮与甲基叶立德经过witting反应获得,如下图所示。
[0003][0004]
但是,该方法存在以下几个缺陷:(1)需要使用吲哚甲酮化合物作为原料,化合物多样性存在较大局限。(2)吲哚甲酮化合物需要使用吲哚作为原料进行制备,来源不广泛,增加合成步骤。(3)使用磷叶立德试剂,产生大量的副产物—三苯基氧磷。
[0005]
因此,如何克服以上技术缺陷提供一种末端1,1'
‑
双取代吲哚乙烯衍生物及其制备方法,成为亟待解决的技术问题。
技术实现要素:
[0006]
本发明的目的是提供一种末端1,1'
‑
双取代吲哚乙烯衍生物及其制备方法,使用吲哚作为合成原料成功制得多样性的末端没有取代基的烯基吲哚衍生物,副产物少,该方法不仅高效简便而且符合步骤经济性要求。
[0007]
在本发明的第一方面,提供一种末端1,1'
‑
双取代吲哚乙烯衍生物的制备方法,所述方法包括:
[0008]
将化合物i和化合物ii在有机溶剂和催化剂条件下反应,获得化合物iii所示的末端1,1'
‑
双取代吲哚乙烯衍生物,反应式如下所示:
[0009]
[0010]
其中,取代基r1选自甲基、甲氧基、苄氧基、甲酯基、乙酰基、氰基、硝基、氟、氯和卤素,且取代基r1的位置选自吲哚环上的3,4,5,6位;
[0011]
取代基r2选自烷基、卤素、苯基和第一取代苯基,所述第一取代苯基中的取代基选自c1
‑
c6的烷基、卤素和三氟甲基;
[0012]
取代基r3选自c1
‑
c6的烷基、芳基取代的烷基、萘环、芳香杂环、苯基和第二取代苯基,其中,所述第二取代苯基中的取代基选自三氟甲氧基、三氟甲基、氟、氯、甲酸酯基、c1
‑
c6烷基、苄氧基和苯氧基,所述第二取代苯基中的取代基的位置选自苯环上的对位或/和间位。
[0013]
进一步地,所述催化剂包括agoac和[rhcp*cl2]2。
[0014]
进一步地,所述催化剂和所述化合物i的摩尔量比为agoac:[rhcp*cl2]2:化合物i=(1.2~4):(0.01~0.3):1。
[0015]
进一步地,所述有机溶剂包括甲醇、乙醇、异丙醇、叔丁醇和三氟乙醇中的至少一种。
[0016]
进一步地,所述化合物i和所述化合物ii的摩尔量比为1:(2~4)。
[0017]
进一步地,所述反应的温度为40~80℃,所述反应的时间为12~24h。
[0018]
进一步地,所述将化合物i和化合物ii在有机溶剂和催化剂条件下反应,获得化合物iii所示的末端1,1'
‑
双取代吲哚乙烯衍生物,具体包括:
[0019]
将化合物i和化合物ii在有机溶剂和催化剂条件下反应,获得反应料;
[0020]
将所述反应料冷却至室温,后浓缩,获得粗产品;
[0021]
将所述粗产品用硅胶柱层析分离纯化,得到纯净的所述末端1,1'
‑
双取代吲哚乙烯衍生物。
[0022]
进一步地,所述用硅胶柱层析分离纯化中,使用的有机溶剂为石油醚和乙酸乙酯,所述石油醚和所述乙酸乙酯的体积比为(30~50):1。
[0023]
在本发明的第二方面,提供一种末端1,1'
‑
双取代吲哚乙烯衍生物,所述末端1,1'
‑
双取代吲哚乙烯衍生物的结构通式如下所示:
[0024][0025]
其中,取代基r1选自甲基、甲氧基、苄氧基、甲酯基、乙酰基、氰基、硝基、氟、氯和卤素,且取代基r1的位置选自吲哚环上的3,4,5,6位;
[0026]
取代基r2选自烷基、卤素、苯基和第一取代苯基,所述第一取代苯基中的取代基选自c1
‑
c6的烷基、卤素和三氟甲基
[0027]
取代基r3选自c1
‑
c6的烷基、芳基取代的烷基、萘环、芳香杂环、苯基和第二取代苯基,其中,所述第二取代苯基中的取代基选自三氟甲氧基、三氟甲基、氟、氯、甲酸酯基、c1
‑
c6烷基、苄氧基和苯氧基,所述第二取代苯基中的取代基的位置选自苯环上的对位或/和间位。
[0028]
本发明实施例中的一个或多个技术方案,至少具有如下技术效果或优点:
[0029]
本发明提供的一种末端1,1'
‑
双取代吲哚乙烯衍生物及其制备方法,本发明实施例的末端1,1'
‑
双取代吲哚乙烯衍生物为新的化合物,其制备方法使用吲哚作为合成原料成功制得一种末端没有取代基的烯基吲哚衍生物,副产物少,该方法不仅高效简便而且符合步骤经济性要求。
附图说明
[0030]
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图得到其它的附图。
[0031]
图1是本发明实施例1制备得到末端1,1'
‑
双取代吲哚乙烯衍生物的h nmr谱图;
[0032]
图2是本发明实施例1制备得到末端1,1'
‑
双取代吲哚乙烯衍生物的c nmr谱图谱图;
[0033]
图3为本发明实施例1制备得到末端1,1'
‑
双取代吲哚乙烯衍生物的高分辨质谱图。
具体实施方式
[0034]
下文将结合具体实施方式和实施例,具体阐述本发明,本发明的优点和各种效果将由此更加清楚地呈现。本领域技术人员应理解,这些具体实施方式和实施例是用于说明本发明,而非限制本发明。
[0035]
在整个说明书中,除非另有特别说明,本文使用的术语应理解为如本领域中通常所使用的含义。因此,除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域技术人员的一般理解相同的含义。若存在矛盾,本说明书优先。
[0036]
除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等,均可通过市场购买得到或者可通过现有方法制备得到。
[0037]
需要说明的是,在本文中,诸如“第一”和“第二”等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。
[0038]
本发明实施例提供的技术方案为解决上述技术问题,总体思路如下:
[0039]
根据本发明一种典型的实施方式,提供一种末端1,1'
‑
双取代吲哚乙烯衍生物的制备方法,所述方法包括:
[0040]
将化合物i和化合物ii在有机溶剂和催化剂条件下反应,获得化合物iii所示的末端1,1'
‑
双取代吲哚乙烯衍生物,反应式如下所示:
[0041][0042]
其中,取代基r1选自甲基、甲氧基、苄氧基、甲酯基、乙酰基、氰基、硝基、氟、氯和卤
素,且取代基r1的位置选自吲哚环上的3,4,5,6位;
[0043]
取代基r2选自烷基、卤素、苯基和第一取代苯基,所述第一取代苯基中的取代基选自c1
‑
c6的烷基、卤素和三氟甲基;
[0044]
取代基r3选自c1
‑
c6的烷基、芳基取代的烷基、萘环、芳香杂环、苯基和第二取代苯基,其中,所述第二取代苯基中的取代基选自三氟甲氧基、三氟甲基、氟、氯、甲酸酯基、c1
‑
c6烷基、苄氧基和苯氧基,所述第二取代苯基中的取代基的位置选自苯环上的对位或/和间位。
[0045]
本申请人发现将化合物i和化合物ii在有机溶剂和催化剂条件下反应能够获得化合物iii所示的末端1,1'
‑
双取代吲哚乙烯衍生物,使用吲哚作为合成原料,发展一种合成末端没有取代基的烯基吲哚衍生物的方法。该方法副产物少,不仅高效简便而且符合步骤经济性要求,制备得到的末端没有取代基的烯基吲哚衍生物种类多,具有多样性。
[0046]
作为优选的实施方式,所述化合物i和所述化合物ii的摩尔量比为1:(2~4)。该比值过高或过低不利于反应完全;
[0047]
作为优选的实施方式,所述反应温度为25~100℃(优选为60℃),反应时间为4h~24h。所述反应温度过低或过高均不利于反应的进行或者反应完全。
[0048]
作为优选的实施方式,所述催化剂包括agoac和[rhcp*cl2]2。选用该复合催化剂能较好地促进反应的进行,提升反应速率。
[0049]
作为优选的实施方式,所述催化剂和所述化合物i的摩尔量比为agoac:[rhcp*cl2]2:化合物i=(1.2~4):(0.01~0.3):1。该比值过低或过高都不利于反应完全生成化合物iii所示的末端1,1'
‑
双取代吲哚乙烯衍生物。
[0050]
作为优选的实施方式,所述有机溶剂包括甲醇、乙醇、异丙醇、叔丁醇和三氟乙醇中的至少一种。所述有机溶剂均为分析纯。
[0051]
作为优选的实施方式,所述反应完全后,进行分离纯化,所述分离纯化包括:将所述反应获得的产物冷却至室温,浓缩获得粗产品,后将所述粗产品用硅胶柱层析分离纯化,得到纯净的所述末端1,1'
‑
双取代吲哚乙烯衍生物。所述用硅胶柱层析分离纯化中,使用的有机溶剂为石油醚和乙酸乙酯,所述石油醚和所述乙酸乙酯的体积比为(30~50):1。
[0052]
根据本发明的另一种典型的实施方式,所述末端1,1'
‑
双取代吲哚乙烯衍生物的结构通式如下所示:
[0053][0054]
其中,取代基r1选自甲基、甲氧基、苄氧基、甲酯基、乙酰基、氰基、硝基、氟、氯和卤素,且取代基r1的位置选自吲哚环上的3,4,5,6位;
[0055]
取代基r2选自烷基、卤素、苯基和第一取代苯基,所述第一取代苯基中的取代基选自c1
‑
c6的烷基、卤素和三氟甲基;
[0056]
取代基r3选自c1
‑
c6的烷基、芳基取代的烷基、萘环、芳香杂环、苯基和第二取代苯基,其中,所述第二取代苯基中的取代基选自三氟甲氧基、三氟甲基、氟、氯、甲酸酯基、c1
‑
c6烷基、苄氧基和苯氧基,所述第二取代苯基中的取代基的位置选自苯环上的对位或/和间位。
[0057]
本发明实施例的末端1,1'
‑
双取代吲哚乙烯衍生物为新的化合物,种类多,具有多样性,末端没有取代基,这对于制备具有吲哚结构的药物及其活性研究具有重要意义。
[0058]
下面将结合实施例及实验数据对本申请的一种末端1,1'
‑
双取代吲哚乙烯衍生物的制备方法进行详细说明。
[0059]
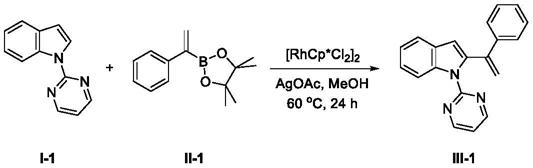
实施例1
[0060][0061]
本实施例中:r1为氢,r2为氢,r3为苯基。
[0062]
步骤:在10ml schlenk管中,加入化合物i
‑
1(0.2mmol),化合物ii
‑
1(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:88%。
[0063]
化合物iii
‑
1经测试:
[0064]1h nmr(400mhz,cdcl3)δ8.47(d,j=4.8hz,2h),8.22(d,j=8.2hz,1h),7.66(d,j=7.7hz,1h),7.30(t,j=7.6hz,1h),7.26(d,j=6.1hz,1h),7.23
–
7.17(m,2h),7.14
–
7.01(m,3h),6.89(s,1h),6.83(t,j=4.8hz,1h),5.69(s,1h),5.60(s,1h).具体如图1所示;
[0065]
13
c nmr(100mhz,cdcl3)δ157.7,157.2,143.1,140.4,140.0,137.2,128.9,127.8,127.3,126.7,123.7,122.0,120.6,116.7,115.1,113.5,109.8.具体如图1所示;
[0066]
hrms m/z:calcd for c
20
h
16
n3[m+h
+
]298.1339,found 298.1337.
[0067]
实施例2
[0068][0069]
本实施例中:r1为3
‑
甲基,r2为氢,r3为苯基。
[0070]
步骤:在10ml schlenk管中,加入化合物i
‑
2(0.2mmol),化合物ii
‑
1(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:81%。
[0071]
化合物iii
‑
2经测试:
[0072]1h nmr(400mhz,cdcl3)δ8.47(d,j=4.8hz,2h),8.30
–
8.24(m,1h),7.69
–
7.62(m,
1h),7.35
‑
7.26(m,2h),7.20
–
7.14(m,2h),7.13
–
7.05(m,3h),6.81(t,j=4.8hz,1h),5.87(d,j=1.4hz,1h),5.48(d,j=1.4hz,1h),2.41(s,3h).
[0073]
13
c nmr(101mhz,cdcl3)δ157.6,157.4,141.6,140.8,136.1,135.4,130.3,127.9,127.2,126.6,124.0,121.7,119.0,116.8,116.7,116.3,113.6,9.8.
[0074]
hrms m/z:calcd for c
21
h
18
n3[m+h
+
]312.1495,found 312.1495.
[0075]
实施例3
[0076][0077]
本实施例中:r1为3
‑
乙酰基,r2为氢,r3为苯基。
[0078]
步骤:在10ml schlenk管中,加入化合物i
‑
3(0.2mmol),化合物ii
‑
1(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=30:1~10:1,即得到纯净的产物,白色固体,产率:51%。
[0079]
化合物iii
‑
3经测试:
[0080]1h nmr(400mhz,cdcl3)δ8.49(d,j=4.7hz,2h),8.31(d,j=8.3hz,1h),7.48(d,j=7.7hz,1h),7.34(t,j=7.4hz,1h),7.26(dd,j=13.2,8.9hz,3h),7.15
–
7.04(m,3h),6.86(t,j=4.7hz,1h),5.76(s,1h),5.57(s,1h),2.30(s,3h).
[0081]
13
c nmr(100mhz,cdcl3)δ169.2,157.7,157.2,140.1,139.5,134.1,133.1,128.8,127.9,127.4,126.7,124.8,122.8,122.3,117.6,116.9,116.8,114.1,20.6.
[0082]
hrms m/z:calcd forc
22
h
18
n3o2[m+h
+
]356.1394,found 356.1398.
[0083]
实施例4
[0084][0085]
本实施例中:r1为3
‑
溴,r2为氢,r3为苯基。
[0086]
步骤:在10ml schlenk管中,加入化合物i
‑
4(0.2mmol),化合物ii
‑
1(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=30:1~10:1,即得到纯净的产物,白色固体,产率:47%。
[0087]
化合物iii
‑
4经测试:
[0088]1h nmr(400mhz,cdcl3)δ8.83(d,j=4.8hz,2h),8.29(d,j=8.2hz,1h),7.68(d,j=16.2hz,1h),7.60(d,j=7.6hz,1h),7.49(d,j=7.4hz,2h),7.35(t,j=7.6hz,2h),7.28
(d,j=6.9hz,1h),7.23
–
7.11(m,3h),7.01(s,1h).
[0089]
13
c nmr(101mhz,cdcl3)δ158.3,158.1,138.8,137.4,137.3,129.6,129.3,128.6,127.6,126.6,123.5,122.3,120.6,120.3,117.2,113.9,105.2.
[0090]
hrms m/z:calcd for c
20
h
15
brn3[m+h
+
]376.0444,found 376.0451.
[0091]
实施例5
[0092][0093]
本实施例中:r1为4
‑
甲基,r2为氢,r3为苯基。
[0094]
步骤:在10ml schlenk管中,加入化合物i
‑
5(0.2mmol),化合物ii
‑
1(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:88%。
[0095]
化合物iii
‑
5经测试:
[0096]1h nmr(400mhz,cdcl3)δ8.47(d,j=4.8hz,2h),8.04(d,j=8.3hz,1h),7.24
–
7.16(m,3h),7.13
–
7.01(m,4h),6.92(d,j=0.4hz,1h),6.83(t,j=4.8hz,1h),5.70(d,j=1.4hz,1h),5.59(d,j=1.4hz,1h),2.62(s,3h).
[0097]
13
c nmr(101mhz,cdcl3)δ157.7,157.3,143.3,140.5,139.5,137.0,130.1,128.6,127.8,127.3,126.7,123.9,122.4,116.7,115.0,111.0,108.4,18.7.
[0098]
hrms m/z:calcd for c
21
h
18
n3[m+h
+
]312.1495,found312.1497.
[0099]
实施例6
[0100][0101]
本实施例中:r1为4
‑
苄氧基,r2为氢,r3为苯基。
[0102]
步骤:在10ml schlenk管中,加入化合物i
‑
6(0.2mmol),化合物ii
‑
1(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:76%。
[0103]
化合物iii
‑
6经测试:
[0104]1h nmr(400mhz,cdcl3)δ8.46(d,j=4.8hz,2h),7.81(d,j=8.4hz,1h),7.54(d,j=7.4hz,2h),7.41(t,j=7.4hz,2h),7.37
–
7.31(m,1h),7.23
–
7.16(m,3h),7.10
–
7.01(m,4h),6.81(t,j=4.8hz,1h),6.74(d,j=7.9hz,1h),5.70(d,j=1.3hz,1h),5.57(d,j=
1.3hz,1h),5.26(s,2h).
[0105]
13
c nmr(101mhz,cdcl3)δ157.7,157.3,152.1,143.1,140.5,138.7,138.5,137.3,128.5,127.8,127.4,127.2,126.7,124.5,119.7,116.8,115.0,107.0,106.9,103.6,70.0.
[0106]
hrms m/z:calcd for c
27
h
22
n3o[m+h
+
]404.1757,found404.1740.
[0107]
实施例7
[0108][0109]
本实施例中:r1为4
‑
氯,r2为氢,r3为苯基。
[0110]
步骤:在10ml schlenk管中,加入化合物i
‑
7(0.2mmol),化合物ii
‑
1(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:75%。
[0111]
化合物iii
‑
7经测试:
[0112]1h nmr(400mhz,cdcl3)δ8.49(d,j=4.8hz,2h),8.14
–
8.05(m,1h),7.24(dd,j=6.4,5.2hz,2h),7.18(dt,j=4.1,2.3hz,2h),7.13
–
7.04(m,3h),7.01(d,j=0.6hz,1h),6.87(t,j=4.8hz,1h),5.74(d,j=1.2hz,1h),5.64(d,j=1.3hz,1h).
[0113]
13
c nmr(101mhz,cdcl3)δ157.8,157.0,142.6,140.8,140.1,137.7,127.9,127.6,127.4,126.7,125.7,124.3,121.8,117.2,116.0,112.0,107.7.
[0114]
hrms m/z:calcd for c
20
h
15
cln3[m+h
+
]332.0949,found332.0958.
[0115]
实施例8
[0116][0117]
本实施例中:r1为5
‑
甲基,r2为氢,r3为苯基。
[0118]
步骤:在10ml schlenk管中,加入化合物i
‑
8(0.2mmol),化合物ii
‑
1(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:76%。
[0119]
化合物iii
‑
8经测试:
[0120]1h nmr(400mhz,cdcl3)δ8.45(d,j=4.8hz,2h),8.13(d,j=8.5hz,1h),7.45(s,1h),7.22
–
7.16(m,2h),7.12(dd,j=8.5,1.2hz,1h),7.11
–
7.03(m,3h),6.82(s,1h),6.80(t,j=4.0hz,1h),5.68(d,j=1.2hz,1h),5.58(d,j=1.3hz,1h),2.48(s,3h).
[0121]
13
c nmr(100mhz,cdcl3)δ157.6,157.3,143.3,140.5,140.0,135.5,131.4,129.2,127.8,127.3,126.7,125.2,120.4,116.5,114.8,113.4,109.7,21.4.
[0122]
hrms m/z:calcd for c
21
h
18
n3[m+h
+
]312.1495,found 312.1497.
[0123]
实施例9
[0124][0125]
本实施例中:r1为5
‑
甲氧基,r2为氢,r3为苯基。
[0126]
步骤:在10ml schlenk管中,加入化合物i
‑
9(0.2mmol),化合物ii
‑
1(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:71%。
[0127]
化合物iii
‑
9经测试:
[0128]1h nmr(400mhz,cdcl3)δ8.44(d,j=4.8hz,2h),8.17(d,j=9.1hz,1h),7.22
–
7.17(m,2h),7.12(d,j=2.5hz,1h),7.11
–
7.04(m,3h),6.94(dd,j=9.1,2.6hz,1h),6.82(d,j=0.5hz,1h),6.80(t,j=4.8hz,1h),5.67(d,j=1.4hz,1h),5.59(d,j=1.4hz,1h),3.89(s,3h).
[0129]
13
c nmr(101mhz,cdcl3)δ157.6,157.2,155.5,143.3,140.6,140.5,132.1,129.6,127.9,127.3,126.6,116.5,114.9,114.7,113.1,109.8,102.5,55.7.
[0130]
hrms m/z:calcd for c
21
h
18
n3o[m+h
+
]328.1444,found328.1446.
[0131]
实施例10
[0132][0133]
本实施例中:r1为5
‑
苄氧基,r2为氢,r3为苯基。
[0134]
步骤:在10ml schlenk管中,加入化合物i
‑
10(0.2mmol),化合物ii
‑
1(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:66%。
[0135]
化合物iii
‑
10经测试:
[0136]1h nmr(400mhz,cdcl3)δ8.48(d,j=4.8hz,2h),8.26
–
8.16(m,1h),7.53(d,j=7.7hz,2h),7.44(t,j=7.6hz,2h),7.37(t,j=7.3hz,1h),7.24
‑
7.23(m,3h),7.17
–
7.02(m,4h),6.84(dd,j=7.8,2.9hz,2h),5.71(s,1h),5.63(s,1h),5.19(s,2h).
[0137]
13
c nmr(100mhz,cdcl3)δ157.6,157.1,154.7,143.3,140.6,140.4,137.4,132.3,129.6,128.5,127.8,127.5,127.3,126.6,116.5,114.9,114.7,113.8,109.9,104.1,70.6.
[0138]
hrms m/z:calcd for c
27
h
22
n3o[m+h
+
]404.1757,found404.1747.
[0139]
实施例11
[0140][0141]
本实施例中:r1为5
‑
氯,r2为氢,r3为苯基。
[0142]
步骤:在10ml schlenk管中,加入化合物i
‑
11(0.2mmol),化合物ii
‑
1(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:61%。
[0143]
化合物iii
‑
11经测试:
[0144]1h nmr(400mhz,cdcl3)δ8.48(d,j=4.8hz,2h),8.15(d,j=8.9hz,1h),7.62(d,j=1.9hz,1h),7.24(dd,j=8.9,2.1hz,1h),7.20
–
7.15(m,2h),7.12
–
7.03(m,3h),6.86(t,j=4.8hz,1h),6.83(d,j=0.6hz,1h),5.69(d,j=1.3hz,1h),5.62(d,j=1.3hz,1h).
[0145]
13
c nmr(100mhz,cdcl3)δ157.8,157.0,142.8,141.4,140.1,135.5,130.0,127.9,127.5,127.4,126.6,123.8,120.0,117.0,115.7,114.7,109.0.
[0146]
hrms m/z:calcd for c
20
h
15
cln3[m+h
+
]332.0949,found 332.0954.
[0147]
实施例12
[0148][0149]
本实施例中:r1为5
‑
溴,r2为氢,r3为苯基。
[0150]
步骤:在10ml schlenk管中,加入化合物i
‑
12(0.2mmol),化合物ii
‑
1(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:91%。
[0151]
化合物iii
‑
12经测试:
[0152]1h nmr(400mhz,cdcl3)δ8.50(d,j=4.8hz,2h),8.13(d,j=8.9hz,1h),7.81(d,j=1.9hz,1h),7.40(dd,j=8.9,2.0hz,1h),7.21
‑
7.18(m,2h),7.14
‑
7.18(m,3h),6.89(t,j=4.8hz,1h),6.86(d,j=0.6hz,1h),5.73(d,j=1.2hz,1h),5.65(d,j=1.2hz,1h).
[0153]
13
c nmr(100mhz,cdcl3)δ157.8,156.9,142.7,141.2,140.1,135.8,130.6,127.9,
127.4,126.6,126.4,123.0,117.0,115.7,115.2,108.9,29.7.
[0154]
hrms m/z:calcd for c
20
h
15
brn3[m+h
+
]376.0444,found 376.0457.
[0155]
实施例13
[0156][0157]
本实施例中:r1为5
‑
氰基,r2为氢,r3为苯基。
[0158]
步骤:在10ml schlenk管中,加入化合物i
‑
13(0.2mmol),化合物ii
‑
1(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=15:1~5:1,即得到纯净的产物,白色固体,产率:79%。
[0159]
化合物iii
‑
13经测试:
[0160]1h nmr(400mhz,cdcl3)δ8.54(d,j=4.8hz,2h),8.25(d,j=8.7hz,1h),8.03(d,j=1.2hz,1h),7.55(dd,j=8.7,1.6hz,1h),7.21
–
7.15(m,2h),7.15
–
7.06(m,3h),6.96(dd,j=5.7,3.9hz,2h),5.75(d,j=1.0hz,1h),5.69(d,j=1.1hz,1h).
[0161]
13
c nmr(101mhz,cdcl3)δ158.0,156.6,142.5,142.1,139.7,138.7,128.7,128.0,127.6,126.6,125.7,120.3,117.7,116.6,114.3,109.0,105.1.
[0162]
hrms m/z:calcd for c
21
h
15
n4[m+h
+
]323.1291,found323.1305.
[0163]
实施例14
[0164][0165]
本实施例中:r1为6
‑
甲基,r2为氢,r3为苯基。
[0166]
步骤:在10ml schlenk管中,加入化合物i
‑
14(0.2mmol),化合物ii
‑
1(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:88%。
[0167]
化合物iii
‑
14经测试:
[0168]1h nmr(400mhz,cdcl3)δ8.51(d,j=4.8hz,2h),8.04(s,1h),7.58(d,j=8.0hz,1h),7.26
–
7.18(m,2h),7.17
–
7.02(m,4h),6.89(s,1h),6.85(t,j=4.8hz,1h),5.73(d,j=1.0hz,1h),5.60(d,j=1.0hz,1h),2.52(s,3h).
[0169]
13
c nmr(100mhz,cdcl3)δ157.7,157.3,143.2,140.5,139.4,137.5,133.8,127.8,127.3,126.7,123.6,120.2,116.6,114.8,113.3,109.8,22.1.
[0170]
hrms m/z:calcd for c
21
h
18
n3[m+h
+
]312.1495,found 312.1493.
[0171]
实施例15
[0172][0173]
本实施例中:r1为6
‑
氟,r2为氢,r3为苯基。
[0174]
步骤:在10ml schlenk管中,加入化合物i
‑
15(0.2mmol),化合物ii
‑
1(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:85%。
[0175]
化合物iii
‑
15经测试:
[0176]1h nmr(400mhz,cdcl3)δ8.47(d,j=4.8hz,2h),7.99(dd,j=10.8,2.2hz,1h),7.56(dd,j=8.6,5.5hz,1h),7.21
–
7.16(m,2h),7.11
‑
7.05(m,3h),7.04
–
6.97(m,1h),6.88
–
6.81(m,2h),5.66(d,j=1.3hz,1h),5.58(d,j=1.3hz,1h).
[0177]
13
c nmr(100mhz,cdcl3)δ161.9,159.6,157.7,157.1,143.0,140.6,140.5,140.4,137.4,137.2,127.9,127.4,126.6,125.3,121.2,121.1,116.9,115.0,110.6,110.4,109.6,101.0,100.7.
[0178]
hrms m/z:calcd for c
20
h
15
fn3[m+h
+
]316.1245,found316.1245.
[0179]
实施例16
[0180][0181]
本实施例中:r1为6
‑
氯,r2为氢,r3为苯基。
[0182]
步骤:在10ml schlenk管中,加入化合物i
‑
16(0.2mmol),化合物ii
‑
1(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:90%。
[0183]
化合物iii
‑
16经测试:
[0184]1h nmr(400mhz,cdcl3)δ8.49(d,j=4.8hz,2h),8.26(d,j=1.7hz,1h),7.56(d,j=8.3hz,1h),7.22(dd,j=8.4,1.9hz,1h),7.18(dd,j=8.0,1.6hz,2h),7.12
–
7.03(m,3h),6.90
–
6.84(m,2h),5.69(d,j=1.3hz,1h),5.61(d,j=1.3hz,1h).
[0185]
13
c nmr(100mhz,cdcl3)δ157.8,156.9,142.8,140.8,140.2,137.4,129.6,127.9,127.4,127.4,126.6,122.7,121.3,117.1,115.4,113.8,109.5.
[0186]
hrms m/z:calcd for c
20
h
15
cln3[m+h
+
]332.0949,found332.0983.
[0187]
实施例17
[0188][0189]
本实施例中:r1为6
‑
溴,r2为氢,r3为苯基。
[0190]
步骤:在10ml schlenk管中,加入化合物i
‑
17(0.2mmol),化合物ii
‑
1(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:64%。
[0191]
化合物iii
‑
17经测试:
[0192]1h nmr(400mhz,cdcl3)δ8.52(d,j=4.8hz,2h),8.48
–
8.41(m,1h),7.54(d,j=8.3hz,1h),7.39(dd,j=8.3,1.7hz,1h),7.20(dd,j=8.0,1.6hz,2h),7.15
–
7.04(m,3h),6.93
–
6.86(m,2h),5.73(d,j=1.3hz,1h),5.64(d,j=1.3hz,1h).
[0193]
13
c nmr(100mhz,cdcl3)δ157.8,156.9,142.8,140.7,140.1,137.7,127.9,127.7,127.4,126.6,125.3,121.7,117.3,117.1,116.6,115.5,109.5.
[0194]
hrms m/z:calcd for c
20
h
15
brn3[m+h
+
]376.0444,found376.0461.
[0195]
实施例18
[0196][0197]
本实施例中:r1为6
‑
甲酸甲酯基,r2为氢,r3为苯基。
[0198]
步骤:在10ml schlenk管中,加入化合物i
‑
18(0.2mmol),化合物ii
‑
1(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=20:1~8:1,即得到纯净的产物,白色固体,产率:50%。
[0199]
化合物iii
‑
18经测试:
[0200]1h nmr(400mhz,cdcl3)δ8.91
–
8.83(m,1h),8.52(d,j=4.8hz,2h),7.95(dd,j=8.3,1.5hz,1h),7.69(dd,j=8.3,0.5hz,1h),7.22
–
7.14(m,2h),7.13
–
7.04(m,3h),6.93(d,j=0.7hz,1h),6.89(t,j=4.8hz,1h),5.73(d,j=1.2hz,1h),5.66(d,j=1.2hz,1h),3.93(s,3h).
[0201]
13
c nmr(100mhz,cdcl3)δ167.9,158.0,156.9,143.2,142.6,139.9,136.5,132.5,127.9,127.5,126.7,125.3,123.2,120.2,117.3,116.2,115.5,109.4,52.0.
[0202]
hrms m/z:calcd for c
22
h
18
n3o2[m+h
+
]356.1394,found356.1407.
[0203]
实施例19
[0204][0205]
本实施例中:r1为氢,r2为甲基,r3为苯基。
[0206]
步骤:在10ml schlenk管中,加入化合物i
‑
19(0.2mmol),化合物ii
‑
1(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:86%。
[0207]
化合物iii
‑
19经测试:
[0208]1h nmr(400mhz,cdcl3)δ8.30(d,j=0.6hz,2h),8.11(d,j=8.4hz,1h),7.69
–
7.63(m,1h),7.31
–
7.26(m,1h),7.24(dd,j=7.6,1.2hz,1h),7.21
‑
7.18(m,2h),7.12
–
7.04(m,3h),6.87(d,j=0.6hz,1h),5.67(d,j=1.4hz,1h),5.59(d,j=1.4hz,1h),2.15(s,3h).
[0209]
13
c nmr(100mhz,cdcl3)δ157.7,155.5,143.0,140.4,140.0,137.2,128.7,127.8,127.2,126.8,126.1,123.6,121.8,120.6,115.3,113.1,109.1,15.0.
[0210]
hrms m/z:calcd for c
21
h
18
n3[m+h
+
]312.1495,found312.1494.
[0211]
实施例20
[0212][0213]
本实施例中:r1为氢,r2为苯基,r3为苯基。
[0214]
步骤:在10ml schlenk管中,加入化合物i
‑
20(0.2mmol),化合物ii
‑
1(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:62%。
[0215]
化合物iii
‑
20经测试:
[0216]1h nmr(400mhz,cdcl3)δ8.66(s,2h),8.26(d,j=8.2hz,1h),7.68(d,j=7.5hz,1h),7.56
–
7.38(m,5h),7.38
–
7.30(m,1h),7.30
–
7.26(m,1h),7.25
‑
7.22(m,2h),7.11
‑
7.02(m,3h),6.93(s,1h),5.74(d,j=1.0hz,1h),5.63(d,j=1.1hz,1h).
[0217]
13
c nmr(101mhz,cdcl3)δ156.3,155.5,143.1,140.4,140.1,137.2,134.0,129.5,129.3,128.9,128.6,127.9,127.3,126.8,126.6,123.8,122.1,120.6,115.3,113.5,109.8.
[0218]
hrms m/z:calcd for c
26
h
20
n3[m+h
+
]374.1652,found374.1655.
[0219]
实施例21
[0220][0221]
本实施例中:r1为氢,r2为溴,r3为苯基。
[0222]
步骤:在10ml schlenk管中,加入化合物i
‑
21(0.2mmol),化合物ii
‑
1(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:60%。
[0223]
化合物iii
‑
21经测试:
[0224]1h nmr(400mhz,cdcl3)δ8.48(s,2h),8.24
–
8.16(m,1h),7.70
–
7.62(m,1h),7.35
–
7.29(m,1h),7.29
–
7.24(m,1h),7.23
–
7.17(m,1h),7.15
–
7.08(m,3h),6.89(d,j=0.6hz,1h),5.65(d,j=1.3hz,1h),5.60(d,j=1.4hz,1h).
[0225]
13
c nmr(100mhz,cdcl3)δ158.1,155.5,143.0,140.3,140.1,137.0,129.1,128.0,127.5,126.7,124.0,122.4,120.7,115.3,114.4,113.7,110.5.
[0226]
hrms m/z:calcd for c
20
h
15
brn
3+
[m+h
+
]376.0444,found 376.0443.
[0227]
实施例22
[0228][0229]
本实施例中:r1为氢,r2为氢,r3为4
‑
甲基苯基。
[0230]
步骤:在10ml schlenk管中,加入化合物i
‑
1(0.2mmol),化合物ii
‑
2(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:76%。
[0231]
化合物iii
‑
22经测试:
[0232]1h nmr(400mhz,cdcl3)δ8.49(d,j=4.8hz,2h),8.22(dd,j=8.3,0.8hz,1h),7.70
–
7.62(m,1h),7.35
–
7.20(m,2h),7.09(d,j=8.1hz,2h),6.93
–
6.82(m,4h),5.62(d,j=1.4hz,1h),5.56(d,j=1.4hz,1h),2.20(s,3h).
[0233]
13
c nmr(100mhz,cdcl3)δ157.7,157.3,143.0,140.3,137.6,137.2,137.0,128.6,126.6,123.7,122.0,120.6,116.7,114.4,113.5,109.7,21.0.
[0234]
hrms m/z:calcd for c
21
h
18
n
3+
[m+h
+
]312.1495,found 312.1486.
[0235]
实施例23
[0236][0237]
本实施例中:r1为氢,r2为氢,r3为4
‑
叔丁基苯基。
[0238]
步骤:在10ml schlenk管中,加入化合物i
‑
1(0.2mmol),化合物ii
‑
3(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:56%。
[0239]
化合物iii
‑
23经测试:
[0240]1h nmr(400mhz,cdcl3)δ8.48(d,j=4.8hz,2h),8.16(d,j=8.4hz,1h),7.70
–
7.61(m,1h),7.34
–
7.20(m,3h),7.17
–
7.05(m,4h),6.88(d,j=0.6hz,1h),6.82(t,j=4.8hz,1h),5.63(d,j=1.4hz,1h),5.57(d,j=1.4hz,1h),1.19(s,9h).
[0241]
13
c nmr(100mhz,cdcl3)δ157.7,157.4,150.3,142.8,140.4,137.5,137.2,128.9,126.6,124.7,123.7,122.0,120.6,116.6,114.5,113.3,109.5,34.4,31.1.
[0242]
hrms m/z:calcd forc
24
h
24
n
3+
[m+h
+
]354.1965,found 354.1975.
[0243]
实施例24
[0244][0245]
本实施例中:r1为氢,r2为氢,r3为4
‑
三氟甲氧基苯基。
[0246]
步骤:在10ml schlenk管中,加入化合物i
‑
1(0.2mmol),化合物ii
‑
4(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:70%。
[0247]
化合物iii
‑
24经测试:
[0248]1h nmr(400mhz,cdcl3)δ8.49(d,j=4.8hz,2h),8.21(dd,j=8.3,0.8hz,1h),7.71
–
7.63(m,1h),7.36
–
7.25(m,2h),7.23(dd,j=4.6,1.6hz,1h),7.22
–
7.19(m,1h),6.97
–
6.89(m,3h),6.87(t,j=4.8hz,1h),5.73(d,j=1.2hz,1h),5.58(d,j=1.2hz,1h).
[0249]
13
c nmr(100mhz,cdcl3)δ157.8,157.2,148.2,148.2,141.9,139.4,139.3,137.2,128.8,128.1,124.0,122.2,121.6,120.7,120.4,119.0,116.8,115.7,113.5,110.0.
[0250]
hrms m/z:calcd for c
21
h
15
f3n3o[m+h
+
]382.1162,found 382.1187.
[0251]
实施例25
[0252][0253]
本实施例中:r1为氢,r2为氢,r3为4
‑
甲酯苯基。
[0254]
步骤:在10ml schlenk管中,加入化合物i
‑
1(0.2mmol),化合物ii
‑
5(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:45%。
[0255]
化合物iii
‑
25经测试:
[0256]1h nmr(400mhz,cdcl3)δ8.45(d,j=4.8hz,2h),8.29(d,j=8.3hz,1h),7.77(d,j=8.4hz,2h),7.67(d,j=7.3hz,1h),7.38
–
7.30(m,1h),7.30
–
7.24(m,3h),6.91(s,1h),6.82(t,j=4.8hz,1h),5.78(d,j=1.0hz,1h),5.68(d,j=1.1hz,1h),3.84(s,3h).
[0257]
13
c nmr(100mhz,cdcl3)δ166.8,157.7,157.1,145.1,142.6,139.2,137.2,129.3,128.9,128.8,126.5,124.0,122.2,120.7,116.8,116.7,113.9,110.3,52.0.
[0258]
hrms m/z:calcd forc
22
h
18
n3o
2+
[m+h
+
]356.1394,found 356.1385.
[0259]
实施例26
[0260][0261]
本实施例中:r1为氢,r2为氢,r3为4
‑
氟苯基。
[0262]
步骤:在10ml schlenk管中,加入化合物i
‑
1(0.2mmol),化合物ii
‑
5(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:78%。
[0263]
化合物iii
‑
26经测试:
[0264]1h nmr(400mhz,cdcl3)δ8.53(d,j=4.8hz,2h),8.31
–
8.18(m,1h),7.76
–
7.65(m,1h),7.39
–
7.24(m,3h),7.23
–
7.16(m,2h),6.96
–
6.88(m,2h),6.85
–
6.75(m,2h),5.71(d,j=1.1hz,1h),5.57(d,j=1.2hz,1h).
[0265]
13
c nmr(100mhz,cdcl3)δ163.2,160.8,157.8,157.2,142.1,139.8,137.2,136.6,128.8,128.4,128.3,123.9,122.2,120.7,116.9,115.0,114.8,114.6,113.5,110.0.
[0266]
hrms m/z:calcd for c
20
h
15
fn3[m+h
+
]316.1245,found 316.1249.
[0267]
实施例27
[0268][0269]
本实施例中:r1为氢,r2为氢,r3为4
‑
氯苯基。
[0270]
步骤:在10ml schlenk管中,加入化合物i
‑
1(0.2mmol),化合物ii
‑
7(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:62%。
[0271]
化合物iii
‑
27经测试:
[0272]1h nmr(400mhz,cdcl3)δ8.50(d,j=4.8hz,2h),8.25(d,j=8.3hz,1h),7.69
–
7.63(m,1h),7.31(ddd,j=8.4,7.2,1.4hz,1h),7.26(dd,j=14.8,1.1hz,1h),7.17
–
7.11(m,2h),7.09
–
7.02(m,2h),6.93
–
6.85(m,2h),5.69(d,j=1.2hz,1h),5.57(d,j=1.2hz,1h).
[0273]
13
c nmr(101mhz,cdcl3)δ157.8,157.2,142.2,139.5,139.0,137.2,133.0,128.9,128.0,127.9,124.0,122.2,120.7,116.9,115.5,113.7,110.1.
[0274]
hrms m/z:calcd for c
20
h
15
cln3[m+h
+
]332.0949,found332.0957.
[0275]
实施例28
[0276][0277]
本实施例中:r1为氢,r2为氢,r3为4
‑
苯基苯基。
[0278]
步骤:在10ml schlenk管中,加入化合物i
‑
1(0.2mmol),化合物ii
‑
8(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:54%。
[0279]
化合物iii
‑
28经测试:
[0280]1h nmr(400mhz,cdcl3)δ8.48(d,j=4.8hz,2h),8.24(d,j=8.0hz,1h),7.68(d,j=7.3hz,1h),7.48(dd,j=5.1,3.4hz,2h),7.39(dd,j=10.3,4.8hz,2h),7.36
–
7.31(m,3h),7.31
–
7.23(m,4h),6.92(s,1h),6.82(t,j=4.8hz,1h),5.71(d,j=1.2hz,1h),5.65(d,j=1.2hz,1h).
[0281]
13
c nmr(100mhz,cdcl3)δ157.7,157.3,142.7,140.5,140.0,139.9,139.5,137.2,128.9,128.7,127.2,127.1,126.8,126.5,123.8,122.1,120.6,116.8,115.0,113.6,109.9.
[0282]
hrms m/z:calcd forc
20
h
20
n
3+
[m+h
+
]374.1652,found 374.1658.
[0283]
实施例29
[0284][0285]
本实施例中:r1为氢,r2为氢,r3为3
‑
苯氧基苯基。
[0286]
步骤:在10ml schlenk管中,加入化合物i
‑
1(0.2mmol),化合物ii
‑
8(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:66%。
[0287]
化合物iii
‑
29经测试:
[0288]1h nmr(400mhz,cdcl3)δ8.56(d,j=4.8hz,2h),8.36
–
8.22(m,1h),7.74
–
7.62(m,1h),7.40
–
7.25(m,5h),7.15
–
7.00(m,3h),6.95(t,j=4.8hz,1h),6.93
–
6.89(m,2h),6.89
–
6.82(m,2h),6.76(ddd,j=8.1,2.4,0.9hz,1h),5.73(d,j=1.2hz,1h),5.60(d,j=1.3hz,1h).
[0289]
13
c nmr(101mhz,cdcl3)δ157.8,157.4,157.3,156.5,142.7,142.5,139.7,137.2,129.6,129.1,128.9,123.9,122.9,122.1,122.1,120.6,118.3,118.2,117.8,116.7,115.6,113.7.
[0290]
hrms m/z:calcd for c
26
h
20
n3o[m+h
+
]390.1601,found390.1597.
[0291]
实施例30
[0292][0293]
本实施例中:r1为氢,r2为氢,r3为萘基。
[0294]
步骤:在10ml schlenk管中,加入化合物i
‑
1(0.2mmol),化合物ii
‑
10(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:45%。
[0295]
化合物iii
‑
30经测试:
[0296]1h nmr(400mhz,cdcl3)δ8.38(d,j=4.8hz,2h),8.27(d,j=8.1hz,1h),7.69(t,j=8.1hz,2h),7.61(d,j=8.0hz,2h),7.54(s,1h),7.48(d,j=8.5hz,1h),7.40
–
7.25(m,4h),6.95(s,1h),6.68(t,j=4.7hz,1h),5.74(d,j=19.2hz,2h).
[0297]
13
c nmr(100mhz,cdcl3)δ157.6,157.3,143.2,140.1,137.9,137.2,132.9,132.6,129.0,128.1,127.6,127.3,125.9,125.7,125.5,125.1,123.8,122.1,120.6,116.7,115.8,113.8,109.9.
[0298]
hrms m/z:calcd forc
24
h
18
n
3+
[m+h
+
]348.1495,found 348.1494.
[0299]
实施例31
[0300][0301]
本实施例中:r1为氢,r2为氢,r3为异丙烯基。
[0302]
步骤:在10ml schlenk管中,加入化合物i
‑
1(0.2mmol),化合物ii
‑
11(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:64%。
[0303]
化合物iii
‑
31经测试:
[0304]1h nmr(400mhz,cdcl3)δ8.80(d,j=4.8hz,2h),8.13(d,j=8.2hz,1h),7.58(dd,j=7.6,0.7hz,1h),7.28
–
7.22(m,1h),7.22
–
7.14(m,2h),6.67(s,1h),5.09(s,2h),1.96(s,3h).
[0305]
13
c nmr(100mhz,cdcl3)δ158.3,142.2,137.9,137.8,129.1,123.5,122.0,120.5,117.4,114.9,113.0,107.3,22.5.
[0306]
hrms m/z:calcd forc
15
h
14
n3[m+h
+
]236.1182,found236.1186.
[0307]
实施例32
[0308][0309]
本实施例中:r1为氢,r2为氢,r3为2
‑
己烯基。
[0310]
步骤:在10ml schlenk管中,加入化合物i
‑
1(0.2mmol),化合物ii
‑
12(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:54%。
[0311]
化合物iii
‑
32经测试:
[0312]1h nmr(400mhz,cdcl3)δ8.79(d,j=4.8hz,2h),8.21
–
8.14(m,1h),7.61
–
7.55(m,1h),7.28
–
7.24(m,1h),7.24
–
7.19(m,1h),7.19
–
7.14(m,1h),6.63(d,j=0.6hz,1h),5.18(d,j=1.7hz,1h),5.11(dd,j=2.8,1.3hz,1h),2.16(t,j=7.4hz,2h),1.38(tt,j=7.5,
6.1hz,2h),1.25(dt,j=16.9,7.2hz,2h),0.80(t,j=7.3hz,3h).
[0313]
13
c nmr(100mhz,cdcl3)δ158.2,143.1,141.8,137.6,129.1,123.4,122.0,120.4,117.3,114.0,113.2,107.8,35.9,30.5,22.3,13.8.
[0314]
hrms m/z:calcd forc
18
h
20
n3[m+h
+
]278.1652,found278.1641.
[0315]
实施例33
[0316][0317]
本实施例中:r1为氢,r2为氢,r3为苯异丁烯基。
[0318]
步骤:在10ml schlenk管中,加入化合物i
‑
1(0.2mmol),化合物ii
‑
13(0.4mmol),agoac(0.4mmol),[rhcp*cl2]2(0.004mmol),meoh(1.0ml),混合物置于60℃反应24h,tlc(用薄层层析色谱法)检测至反应完全。进行后处理提纯:冷却至室温,加压浓缩。粗产品用硅胶柱层析分离纯化[v(石油醚):v(乙酸乙酯)]=50:1~30:1,即得到纯净的产物,白色固体,产率:50%。
[0319]
化合物iii
‑
33经测试:
[0320]1h nmr(400mhz,cdcl3)δ8.78(d,j=4.8hz,2h),8.22(dd,j=8.3,0.7hz,1h),7.63
–
7.57(m,1h),7.30
–
7.23(m,2h),7.23
–
7.19(m,2h),7.17
–
7.11(m,2h),7.11
–
7.06(m,2h),6.66(d,j=0.6hz,1h),5.21(d,j=1.4hz,1h),5.13(d,j=1.4hz,1h),2.73(dd,j=9.6,6.6hz,2h),2.50(dd,j=9.8,6.5hz,2h).
[0321]
13
c nmr(100mhz,cdcl3)δ158.2,142.4,141.9,141.4,137.7,129.1,128.4,128.2,125.7,123.5,122.1,120.5,117.3,114.6,113.4,108.2,38.3,34.9.
[0322]
hrms m/z:calcd forc
22
h
20
n3[m+h
+
]326.1652,found326.1645.
[0323]
最后,还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
[0324]
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
[0325]
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1