一种甘露糖酶基因VbMan26A、重组质粒、重组菌株、甘露糖酶及其应用的制作方法
一种甘露糖酶基因vbman26a、重组质粒、重组菌株、甘露糖酶及其应用
技术领域
1.本发明涉及基因工程技术领域,具体涉及一种甘露糖酶基因vbman26a、重组质粒、重组菌株、甘露糖酶及其应用。
背景技术:
2.半纤维素是自然界中第二大丰富的碳水化合物,其主要存在于植物细胞壁中。半纤维素具有多种存在形式,主要有木聚糖、阿拉伯木聚糖、葡萄糖甘露聚糖、半乳葡萄甘露聚糖等。内切型甘露糖酶是最为重要的一种(内切型甘露糖酶通常被称为甘露糖酶)降解甘露聚糖的酶类。甘露糖酶随机切割甘露聚糖主链上的β
‑
1,4糖苷键,将甘露聚糖水解为甘露寡糖。甘露糖酶在半纤维多聚糖资源的利用及工业应用方面有巨大潜力。
3.由于蛋白质序列的差异,来自不同微生物的甘露糖酶往往具有不同的酶学性质,例如,不同的反应温度和ph,不一样的温度、酸碱度以及盐度的耐受性,以及不同的产物类型(产物为不同长度的甘露寡糖)等,但是在低温、碱性下具有高活性的甘露糖酶较为少见。
技术实现要素:
4.本发明的主要目的是提出一种甘露糖酶基因vbman26a、重组质粒、重组菌株、甘露糖酶及其应用,旨在提供一种在低温、碱性下具有高活性的甘露糖酶。
5.为实现上述目的,本发明提出一种甘露糖酶基因vbman26a,用于编码甘露糖酶,所述甘露糖酶基因vbman26a的核苷酸序列如seq id no:1所示。
6.本发明还提出一种甘露糖酶,所述甘露糖酶由如上所述的甘露糖酶基因vbman26a编码所得,且所述甘露糖酶的氨基酸序列如seq id no:2所示。
7.本发明还提出一种重组质粒,所述重组质粒包括如上所述的甘露糖酶基因vbman26a。
8.可选地,所述重组质粒还包括表达载体pet
‑
28a。
9.本发明还提出一种重组菌株,所述重组菌株包括如上所述的甘露糖酶基因vbman26a。
10.可选地,所述重组菌株的宿主细胞为大肠杆菌。
11.进一步地,本发明还提出一种制备益生素甘露寡糖的方法,包括以下步骤:采用如上所述的甘露糖酶水解甘露聚糖,得到益生素甘露寡糖。
12.可选地,所述甘露聚糖包括魔芋精粉、刺槐豆胶和象牙果甘露糖中的任意一种。
13.更进一步地,本发明还提出一种如上所述的甘露糖酶在制备洗涤用品中的应用。
14.本发明提供的甘露糖酶基因vbman26a,由其编码所得甘露糖酶在的低温和碱性条件下均具有高活性,能够有效的将甘露聚糖水解为2~3个残基的甘露寡糖,可适用于制备益生素甘露寡糖,也可用于制备洗涤用品。
附图说明
15.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅为本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
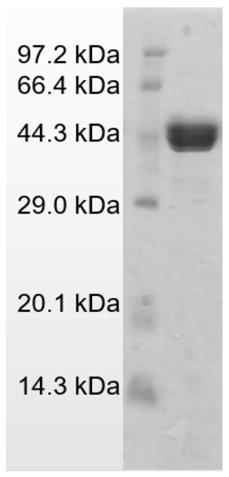
16.图1为实施例4制备的甘露糖酶中,甘露糖酶基因vbman26a的蛋白表达分析结果图;
17.图2为实施例4制备的甘露糖酶在不同ph值条件下的相对酶活;
18.图3为实施例4制备的甘露糖酶的ph稳定性分析结果图;
19.图4为实施例4制备的甘露糖酶在不同温度条件下的相对酶活;
20.图5为实施例4制备的甘露糖酶的温度稳定性分析结果图;
21.图6为实施例4制备的甘露糖酶对各种甘露聚糖的水解能力测试结果图。
22.本发明目的的实现、功能特点及优点将结合实施例,参照附图做进一步说明。
具体实施方式
23.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
24.由于蛋白质序列的差异,来自不同微生物的甘露糖酶往往具有不同的酶学性质,例如,不同的反应温度和ph,不一样的温度、酸碱度以及盐度的耐受性,以及不同的产物类型(产物为不同长度的甘露寡糖)等,但是在低温、碱性下具有高活性的甘露糖酶较为少见。
25.鉴于此,本发明提出一种甘露糖酶基因vbman26a,用于编码甘露糖酶,所述甘露糖酶基因vbman26a的核苷酸序列如seq id no:1所示。
26.本发明提供的甘露糖酶基因vbman26a在genbank基因数据库中通过对比搜索(blastp,为美国国立生物信息研究中心开发的免费序列相似性搜索程序,网址为:https://blast.ncbi.nlm.nih.gov/blast.cgi)找到一种来源于海洋微生物(verrucomicrobiae bacterium dg1235)的甘露糖酶编码基因,该基因全长1152个碱基,通过同源结构模拟(https://swissmodel.expasy.org/)显示该基因5’端69个碱基编码信号肽,因此,在表达时将其去除。然后根据大肠杆菌密码子偏爱性以实现琼脂糖酶的大量表达,发明人将该编码基因序列密码子优化,最终获得核苷酸序列如seq id no:1所示的甘露糖酶基因vbman26a。对该甘露糖酶基因vbman26a进行重组表达可以制取甘露糖酶,该甘露糖酶具有生物学活性,且经功能鉴定后,证实其具有在低温下高活性,适应碱性ph的优势,使得由甘露糖酶基因vbman26a其编码所得甘露糖酶能够有效的将甘露聚糖水解为2~3个残基的甘露寡糖,可适用于制备益生素甘露寡糖,也可用于制备洗涤用品。
27.进一步地,本发明还提出一种甘露糖酶,所述甘露糖酶由如上所述的甘露糖酶基因vbman26a编码所得,且所述甘露糖酶的氨基酸序列如seq id no:2所示。该甘露糖酶含有360个氨基酸残基,理论分子量为41190.85道尔顿,等电点为5.67;此外,该甘露糖酶为内切型:可以将各种常见的甘露聚糖水解为2~3个残基的甘露寡糖;在10~40℃下表现出70%
以上的酶活,最适反应温度为20℃;在ph为4~11条件下孵育2h后表现出80%以上的酶活,最适反应ph为8.0。
28.合成的甘露糖酶基因vbman26a位于pu57载体上,合成基因的5’端和3’端带有限制性酶切位点bamh 1和xho 1。该两个限制性酶切位点将用于把甘露糖酶基因vbman26a克隆至合适的表达载体上,以构建重组质粒。基于此,本发明还提出一种重组质粒,所述重组质粒包括甘露糖酶基因vbman26a。
29.进一步地,在经过对表达细胞和本发明提出的甘露糖酶的氨基酸结构的多次考量后,优选为以大肠杆菌表达载体pet
‑
28a作为重组质粒的载体,并利用上述合成基因的5’端和3’端带有的限制性酶切位点bamh 1和xho 1,把甘露糖酶基因vbman26a克隆至大肠杆菌表达载体pet
‑
28a,得到上述重组质粒。其原因在于:大肠杆菌表达载体pet
‑
28a本身具有如上所述的酶切位点,便于重组操作,且其本身具有卡那霉素抗性基因,可以用于载体筛选。更进一步地,上述重组质粒的具体制备方法可以通过以下步骤实现:
30.通过人工合成获得甘露糖酶基因vbman26a,所合成的甘露糖酶基因vbman26a位于pu57载体上,通过酶切位点bamh 1和xho 1将甘露糖酶基因vbman26a从pu57载体上切下来,酶切获得的dna片段再连接至经同样酶切(bamh 1和xho 1酶切)的大肠杆菌表达载体pet
‑
28a上,连接产物转化到大肠杆菌dh5α中,试剂盒提取质粒,用bamh 1和xho 1双酶切质粒进行鉴定,酶切正确的即为重组质粒pet
‑
28a
‑
vbman26a。
31.此外,本发明还提出一种重组菌株,所述重组菌株包括如上所述的甘露糖酶基因vbman26a。
32.该重组菌株可以由包含上述的甘露糖酶基因vbman26a的重组质粒转化宿主表达细胞获得,将该重组质粒导入宿主表达细胞中,目的基因即可随着宿主细胞的繁殖而复制。通常来说,表达细胞可以是大肠杆菌,也可以是酵母等细胞,或者是其他类型的细胞例如动物细胞等,在本实施例中,表达细胞优选为大肠杆菌bl21(rosetta)。
33.进一步地,上述重组菌株可以通过下述步骤制得:
34.步骤s1、将甘露糖酶基因vbman26a通过酶切位点bamh 1和xho 1连接到载体pet
‑
28a上,连接产物转化到大肠杆菌dh5α中,用试剂盒提取质粒,通过bamh 1和xho 1双酶切进行鉴定,酶切正确的即为重组质粒pet
‑
28a
‑
vbman26a;
35.步骤s2、将重组质粒pet
‑
28a
‑
vbman26a采用cacl2法转化大肠杆菌bl21(rosetta),得到含有重组质粒pet
‑
28a
‑
vbman26a的重组大肠杆菌bl21(rosetta),即获得重组菌株。
36.本发明进一步提出一种由甘露糖酶基因vbman26a制备甘露糖酶的方法,具体操作步骤如下:
37.步骤s10、将甘露糖酶基因vbman26a通过酶切位点bamh 1和xho 1连接到载体pet
‑
28a上,连接产物转化到大肠杆菌dh5α中,用试剂盒提取质粒,通过bamh 1和xho 1双酶切进行鉴定,酶切正确的即为重组质粒pet
‑
28a
‑
vbman26a;
38.步骤s20、将重组质粒pet
‑
28a
‑
vbman26a采用cacl2法转化大肠杆菌bl21(rosetta),得到含有重组质粒pet
‑
28a
‑
vbman26a的大肠杆菌bl21(rosetta)(即为重组表达菌株);
39.步骤s30、将含有重组质粒pet
‑
28a
‑
vbman26a的大肠杆菌bl21(rosetta)按1:(90
~110)的比例(优选为1:100)接种至zyp
‑
5052培养基中,于37℃、180~220rpm(优选为200rpm)条件下培养至od
600
(波长600nm处的吸光度)为0.95~1.05,然后将温度降低至18~22℃(优选为20℃),继续培养20~26h(优选为24h)后,离心收集菌体,将菌体悬浮于histrap a缓冲液,然后通过压力破碎后离心取上清液(上清液中即包含由重组菌株发酵形成的重组蛋白);
40.步骤s40、在8~10℃的温度环境下,将上清液通过histrap亲和层析柱后,使用histrap b缓冲液在akta蛋白纯化仪上梯度洗脱层析柱上的重组蛋白,然后使用截留分子量为10kda的millipore浓缩管将重组蛋白换液至磷酸盐缓冲液中浓缩至蛋白浓度为1mg/ml,得到纯化的甘露糖酶。
41.其中,所述histrap a缓冲液的ph值为7.4,所述histrap a缓冲液包括以下摩尔浓度的组分:500mm的nacl、20mm的咪唑和20mm的na2hpo4;所述histrap b缓冲液的ph值为7.4,所述histrap b缓冲液包括以下摩尔浓度的组分:500mm的nacl、500mm的咪唑和20mm的na2hpo4。
42.zyp
‑
5052培养基的具体配方如下:1%蛋白胨、5%酵母提取物,50mm na2hpo4、50mm kh2po4、25mm(nh4)2so4、0.5%丙三醇、0.05%葡萄糖、0.2%乳糖、2mm mgso4、卡那霉素100μg/ml和氯霉素34μg/ml。
43.所述磷酸盐缓冲液含有以下摩尔浓度的组分:137mm nacl、2.7mm kcl、10mm na2hpo4和1.8mm kh2po4。
44.需要说明的是,上述涉及到基因合成、重组质粒及重组菌株制备、以及重组菌株发酵培养获得重组蛋白等的实施方式中,未说明具体实验方式、实验原材料者,均按照基因工程及基于基因工程进行微生物发酵培养制备蛋白质的常规方法进行。
45.由上述提供的方法制备所得的甘露糖酶在低温和碱性下具有较好的酶活力,能够用于水解常见的甘露聚糖,基于此,本发明还提出一种制备益生素甘露寡糖的方法,包括以下步骤:采用如上所述的甘露糖酶水解甘露聚糖,得到益生素甘露寡糖。
46.进一步地,所述甘露聚糖包括魔芋精粉、刺槐豆胶和象牙果甘露糖中的任意一种,本发明提供的甘露糖酶可有效将上述三种甘露聚糖水解为2~3个残基的甘露寡糖。
47.此外,本发明提供的甘露糖酶可用于洗涤工业中,用于制备洗涤用品,尤其是需要在碱性、低温的特征洗涤衣物上的污渍等相关洗涤用品。
48.以下结合具体实施例和附图对本发明的技术方案作进一步详细说明,应当理解,以下实施例仅仅用以解释本发明,并不用于限定本发明。
49.实施例1甘露糖酶基因vbman26a的获得
50.以黑曲霉(aspergillus niger bk01)甘露糖酶的蛋白质序列(uniprotkb号:a2qkt4)为查询序列,用blastp程序搜索genbank蛋白质序列资源库,找到本发明所涉及的甘露糖酶基因;根据大肠杆菌密码子的偏爱性,对甘露糖酶基因密码子进行优化设计,得到甘露糖酶基因vbman26a,其核苷酸序列如seq id no:1所示。甘露糖酶基因vbman26a在苏州金维智公司合成,合成的甘露糖酶基因vbman26a位于pu57载体上,合成基因的5’端和3’端带有限制性酶切位点bamh 1和xho 1。
51.实施例2重组质粒的制备
52.(1)用限制性内切酶bamh 1和xho 1(均购自takara公司)将实施例1获得的甘露糖
酶基因vbman26a从pu57载体上切下来,割胶回收切下的vbman26a dna片段;
53.(2)将vbman26a dna片段通过t4 dna连接酶(购自takara公司)连接到pet
‑
28a载体(一种用于在大肠杆菌中重组表达外源基因的商业化载体,购自novagen公司,该载体上带有卡那霉素抗性基因)上;
54.(3)将连接产物通过cacl2法转化到大肠杆菌dh5α(一种生物学实验室常规的克隆菌株,购自invitrogen公司,保存于武汉轻工大学实验室)感受态细胞中。将转化的细胞涂布在含有100μg/ml卡那霉素(购自sigma公司)的lb琼脂平板上进行阳性转化子筛选;其中涉及到的大肠杆菌dh5α感受态细胞的制备及cacl2转化方法是生物学实验室的常规操作,具体方法可参考current protocols in molecular biology一书中关于dna转化的章节(doi.org/10.1002/0471142727.mb0108s37);其中用到的lb琼脂平板是通过在lb培养基(每升中含有10g nacl、5g酵母提取液和10g蛋白胨)加入2.5%的琼脂制备而成。
55.(4)挑取单克隆接种至含有100μg/ml卡那霉素的lb培养基中,过夜培养,然后用试剂盒提取质粒,通过bamh 1和xho 1双酶切进行鉴定,酶切结果正确的即为重组质粒pet
‑
28a
‑
vbman26a。
56.实施例3重组菌株的制备
57.(1)将实施例2获得的重组质粒pet
‑
28a
‑
vbman26a采用cacl2法转化大肠杆菌bl21(rosetta)(购自novagen公司,为实验室常见的基因工程表达菌,该菌株自带有氯霉素抗性,保存于武汉轻工大学实验室)感受态细胞;其中感受态大肠杆菌bl21(rosetta)的制备及转化方法与实施例2步骤(3)中的方法相同;
58.(2)将转化后的大肠杆菌bl21(rosetta)涂布在含有卡那霉素(100μg/ml)和氯霉素(34μg/ml,购自sigma公司)的lb琼脂平板上,在此双抗性平板上生长的菌落为重组菌株。
59.实施例4甘露糖酶的制备
60.(1)将实施例3制备的重组菌株过夜培养后(培养基中加100μg/ml卡那霉素和34μg/ml的氯霉素),按1:100的比例接种至zyp
‑
5052培养基中,于37℃、200rpm条件下培养至od
600
(600nm处的吸光度)为0.95~1.05,然后将温度降低至20℃,继续培养24h后,5000r/min离心收集菌体,将菌体悬浮于histrap a缓冲液,然后通过压力破碎后离心取上清液(含有由重组表达菌株发酵形成的重组蛋白);其中,histrap a缓冲液的ph值为7.4,包括以下摩尔浓度的组分:500mm的nacl、20mm的咪唑和20mm的na2hpo4;zyp
‑
5052培养基的具体配方如下:1%蛋白胨、5%酵母提取物、50mm na2hpo4、50mm kh2po4、25mm(nh4)2so4、0.5%丙三醇、0.05%葡萄糖、0.2%乳糖、2mm mgso4、卡那霉素100μg/ml和氯霉素34μg/ml;
61.(2)取步骤(1)制得的上清液通过histrap亲和层析柱(购自通用公司)后,使用histrap b缓冲液在akta上梯度洗脱上清液中的重组蛋白,然后使用millipore浓缩管将重组蛋白换液至磷酸盐缓冲液中浓缩至蛋白浓度为1mg/ml,得到纯化的甘露糖酶;其中,histrap b缓冲液的ph值为7.4,包括以下摩尔浓度的组分:500mm的nacl、500mm的咪唑和20mm的na2hpo4;磷酸缓冲液含有以下摩尔浓度的组分:137mm nacl,2.7mm kcl,10mm na2hpo4,1.8mm kh2po4。
62.对实施例4制备的甘露糖酶的甘露糖酶基因vbman26a的蛋白表达、酶活、最适反应条件等进行分析测定,测定方法及结果如下:
63.1、甘露糖酶基因vbman26a的蛋白表达分析
64.对实施例4步骤(1)中细胞破碎制得的上清液和步骤(2)中纯化后的甘露糖酶,分别进行sds
‑
page(十二烷基硫酸钠
‑
聚丙烯酰胺凝胶电泳)测试,结果如图1所示(图1中:泳道1标准蛋白质marker,泳道2为纯化后的样品)。
65.由图1可知,在纯化后的甘露糖酶中,甘露糖酶基因vbman26a在大肠杆菌中得到了高效的表达,并且通过亲和层析进行了有效的纯化。
66.2、甘露糖酶的酶活分析(还原糖法,也即dns法)
67.配制标准的反应体系为2ml,包括:0.5ml约1:20稀释的甘露糖酶、1ml反应缓冲液以及0.5ml魔芋精粉(购自megazyme公司)溶液(0.25%);将该反应体系在水浴中孵育15min后加入dns试剂(3,5
‑
二硝基水杨酸),沸水水浴5min,然后冷却至室温;再将该反应体系定容至25ml,在520nm测定吸光度。还原糖的定量采用木糖标准品做标准曲线,1单位(u)甘露糖酶活的活性定义为每分钟能够释放1μmol还原糖所需的甘露糖酶毫克数。
68.经dns法测定,纯化后的甘露糖酶的酶活约为716u/mg。
69.3、甘露糖酶最适反应ph温度分析
70.将甘露糖酶分散在ph值分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0和11.0的缓冲液(ph 3~8的缓冲液由mcilvaine缓冲液制备,ph 9~11的缓冲液由甘氨酸
‑
氢氧化钠(50mm)缓冲液制备)中,于30℃温度下,分别通过上述dns法测定酶活。其中,ph 3~8的缓冲液由mcilvaine缓冲液制备的方法如下:用摩尔浓度为200mm的na2hpo4溶液和摩尔浓度为100mm的柠檬酸溶液进行勾对配制至所需要的ph值,具体比例如下表1所示:
71.表1由mcilvaine缓冲液制备对应ph值缓冲液的比例
72.phna2hpo4体积(ml)柠檬酸体积(ml)3.004.1115.894.007.7112.295.010.3009.706.012.6307.377.016.4703.538.019.4500.55
73.ph 9~11的缓冲液由甘氨酸
‑
氢氧化钠(50mm)缓冲液制备的方法如下:将甘氨酸溶解在水中,用氢氧化钠滴定到需要的ph(9.0,10.0,11.0)。
74.各ph反应区间的相对酶活的计算结果如图2所示。由图2可知,本实施例制备的甘露糖酶在ph值为8具有最高的活性。
75.4、甘露糖酶的ph稳定性分析
76.将甘露糖酶分散在不同ph(ph值为3~11)的缓冲液体系中,于4℃温度下孵育2h后,在30℃、ph值为8.0的条件下,通过上述dns法测定酶活,以测得的最高酶活值设定为100%,计算其他各ph反应区间的相对酶活,结果如图3所示。
77.由图3可知,本实施例制备的甘露糖酶在ph为4~11条件下,孵育2h后表现出80%以上的酶活。
78.综合如上所述的3、4两项的考察结果,可知,本发明提出的甘露糖酶具有宽泛的ph耐受范围,最适ph在碱性范围之内。
79.5、甘露糖酶最适反应温度分析
80.将甘露糖酶分散在ph值为8.0的缓冲液体系中,分别于10℃、20℃、30℃、40℃、50℃、60℃、70℃和80℃温度下,通过上述dns法测定酶活。结果如图4所示。
81.由图4可知,本实施例制备的甘露糖酶在低温区间具有较高的活性,其最适温度为20℃。
82.6、甘露糖酶的温度稳定性分析
83.将甘露糖酶分散在ph值为7.0的缓冲液体系中,分别置于50℃和60℃下孵育1h后,在20℃、ph值为8.0的条件下,通过上述dns法测定酶活,以测得的最高酶活值设定为100%,计算其他各ph反应区间的相对酶活,结果如图5所示。
84.由图5可知,本实施例制备的甘露糖酶在40℃温度下孵育2h后保持约80%的酶活。
85.实施例5甘露糖酶水解各种甘露聚糖的能力测试
86.分别将魔芋精粉、刺槐豆胶和象牙果甘露糖(均购自megazyme公司)作为底物,在标准反应体系(上述酶活分析中提供的标准反应体系)和20℃、ph 8.0的反应条件下反应不同时间后,进行薄层层析分析(薄层层析硅胶板购自merck公司)。薄层层析所用的展开剂为正丁醇:乙酸:水=10:5:1(体积比),条带显影剂为浓硫酸:甲醇=5:95(体积比),喷洒显影剂后将薄层板置于115℃、10min。
87.分析结果如图6所示,图6中:泳道1、2和3分别为灭活甘露糖酶孵育魔芋精粉、刺槐豆胶以及象牙果甘露糖的样品;泳道4为甘露糖和甘露寡糖(二糖,三糖和四糖);泳道5、6和7分别为甘露糖酶孵育魔芋精粉、刺槐豆胶以及象牙果甘露糖后的样品。由图6可知,本发明实施例制备的甘露糖酶vbman26a可有效地将常见的甘露聚糖水解为2~3个残基的甘露寡糖。
88.综上所述,本发明提供的甘露糖酶基因vbman26a,通过载体转入大肠杆菌后,获得重组表达菌株,然后重组表达菌株经过高密度发酵工艺、亲和纯化方法后,制得高纯度的甘露糖酶,所制得的甘露糖酶在低温下具有高活性、在碱性条件下显示最佳活力,可有效地将甘露聚糖水解为2~3个残基的甘露寡糖,因此本重组甘露聚糖酶可用于甘露寡糖的制备以及洗剂工业中,例如制备需要碱性、低温的特征洗涤衣物上的污渍的相关产品。
89.以上仅为本发明的优选实施例,并非因此限制本发明的专利范围,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包括在本发明的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1