一种检测活的不可培养状态金黄色葡萄球菌的方法
本发明涉及一种微生物检测方法,特别涉及一种检测活的不可培养状态金黄色葡萄球菌的方法。
背景技术:
食源性病原体可通过食物导致人类患严重疾病,金黄色葡萄球菌是重要的病原菌之一,容易污染牛奶、肉、蛋和鱼等高蛋白食品。食品中的金黄色葡萄球菌在一定条件下会产生肠毒素,导致食物中毒,由金黄色葡萄球菌引起的食品安全问题广泛存在,引起人们的广泛关注。
细菌的活的不可培养状态(viablebutnonculturable,vbnc)状态又称为活的非可培养。处于这种状态的细菌虽然不能在其常用培养基上形成菌落,但仍具有代谢活性,而且在适当条件下复苏后可以恢复到可培养状态。食源性致病菌在食品加工、贮藏过程中,受到多种因素影响,这些因素可能会诱导其进入vbnc状态。有些vbnc状态致病菌仍保留致病活性,有些vbnc状态致病菌虽然丧失致病性但复苏后致病性会随之恢复,因此vbnc状态致病菌给食品安全和质量带来隐患。
如何检测活的不可培养状态金黄色葡萄球菌是降低这种致病菌感染的关键之一。平板计数法常被用于微生物检测,但却无法检测到vbnc状态细菌。虽然对于vbnc状态细菌的检测仍没有标准化的方法,但分子生物学方法在检测vbnc状态细菌方面具有一定优势,比如叠氮溴化乙锭(ema)或叠氮溴化丙锭(pma)与聚合酶链式反应(pcr)或lamp技术结合的检测方法,以及基于mrna的反转录pcr法。这些方法可避免死菌带来的假阳性,因此可有效检测活的vbnc状态细菌。但现有方法操作复杂,检测灵敏度相对较低,提高对vbnc状态细菌检测的灵敏度是十分必要的,也是目前需要克服的技术障碍,因此,需要提供一种灵敏度高、操作方便的检测活的不可培养状态金黄色葡萄球菌的方法,推动vbnc状态细菌检测的应用。
技术实现要素:
本发明为了解决上述技术问题,提供一种检测活的不可培养状态金黄色葡萄球菌的方法,通过实时荧光定量聚合酶链式反应(qrt-pcr)技术考察对数生长期和vbnc状态金黄色葡萄球菌中与细胞壁形成、粘附、生物被膜形成相关基因的表达变化来选择一种在vbnc状态中也高效表达的基因用于检测vbnc状态金黄色葡萄球菌,发现vbnc状态金黄色葡萄球菌sara的表达和对数生长期金黄色葡萄球菌液的相比没有显著性差异,因此以全局调控因子sara作为依赖于mrna的反转录pcr技术的靶标来检测活的不可培养状态金黄色葡萄球菌。
检测方法具体包括以下步骤:
(1)取30ml的待测菌液样品,在4℃条件下以8000×g重复离心多次富集菌体,加入1ml的0.85%nacl溶液重悬;
(2)分别取1.5ml和1ml的对数生长期金黄色葡萄球菌液和重悬的待测菌液样品于4℃条件下,以13400×g离心2min收集菌体;
(3)用rnase-freeddh2o洗涤2次,去除上清液;
(4)加入100μl1mg/ml的溶葡萄球菌酶于37℃恒温水浴锅中处理1h;
(5)使用rna提取试剂盒进行rna的提取;
(6)使用超微量紫外可见分光光度计对rna的提取样品进行检测,测定260nm和280nm吸收值;
(7)对提取好的rna溶液进行反转录;
(8)对反转录的样品进行处理,配制pcr反应液,引物序列见下表1-3;
表1金黄色葡萄球菌生物被膜形成相关基因和内参gyrb引物序列
表2金黄色葡萄球菌pbp1基因和ebps基因序列
表3金黄色葡萄球菌生物被膜形成相关基因序列
(9)通过steponeplusreal-timepcr系统采用两步法pcr的扩增标准程序进行扩增:第一步:预变性,95℃,30s,重复1次;第二步:pcr反应,95℃,5s,60℃,30s,重复40次;
(10)以gyrb作为内参,用2-△△ct法计算基因表达水平的倍数变化,待测菌液样品中pbp1、ebps、icaa、icab、icac、icad、fnba、fnbb、ebh和agra的表达水平显著低于对数生长期,sara的表达和对数生长期金黄色葡萄球菌液的相比没有显著性差异,从数据分析上看,p值>0.05,证明待测菌液样品中存在不可培养状态金黄色葡萄球菌。
步骤(1)中,待测菌液样品中可培养菌数为0,活菌总数不为0。
步骤(5)中,rna的提取使用rnapreppure总rna提取试剂盒并按照说明书进行,离心皆在25℃条件下操作。
步骤(7)中,反转录过程按照maximahminusfirststrandcdnasynthesiskitwithdsdnase试剂盒说明书进行,实验全程在冰盒上进行操作
步骤(8)中,使用tb
本发明的有益效果:
本发明发现了一种在vbnc状态金黄色葡萄球菌中高效表达的基因,vbnc状态金黄色葡萄球菌sara的表达和对数生长期金黄色葡萄球菌液的相比没有显著性差异,该基因可以作为反转录pcr技术的分子标靶用于对vbnc状态金黄色葡萄球菌的检测,大幅提高检测灵敏度,有助于有效地评价vbnc细菌的潜在危害。
附图说明
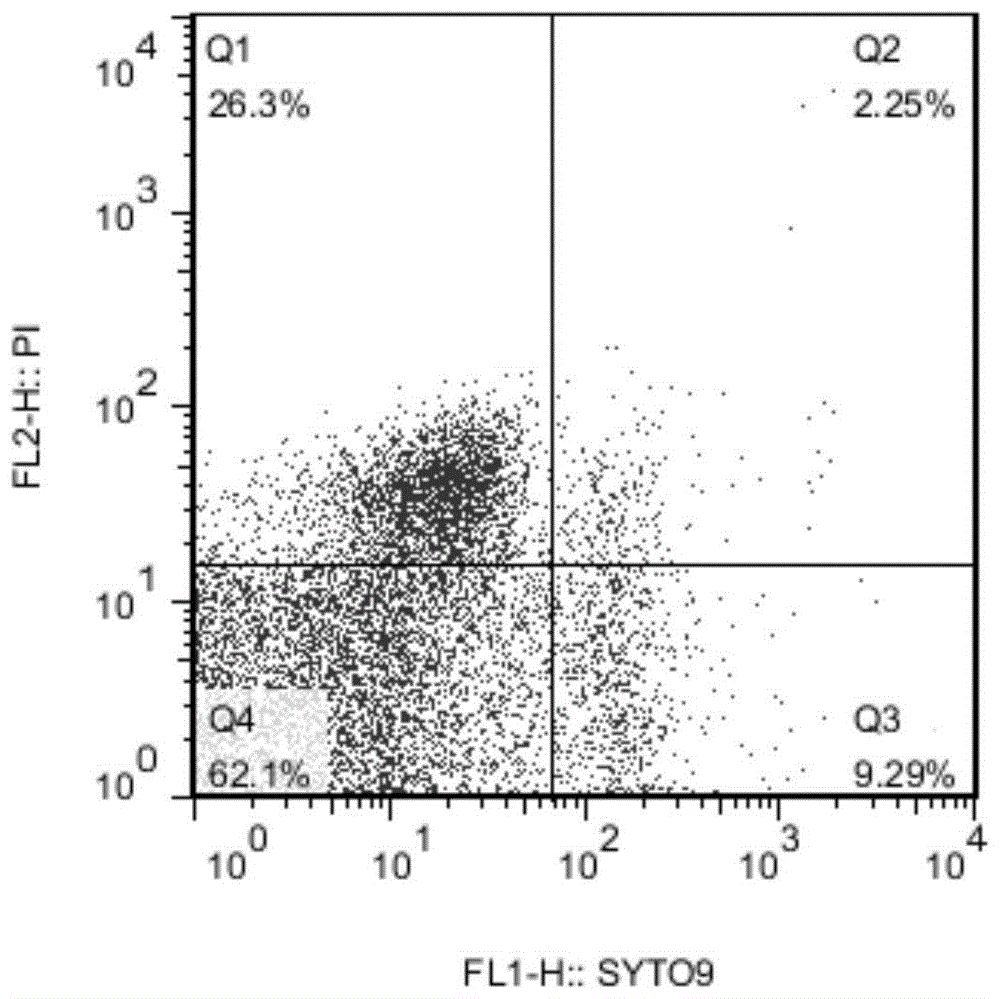
图1是流式细胞仪检测下-20℃柠檬酸诱导金黄色葡萄球菌活细胞的百分率。
图2是pbp1在对数生长期和vbnc状态金黄色葡萄球菌中的相对表达(**表示p<0.01)。
图3是ebps在对数生长期和vbnc状态金黄色葡萄球菌中的相对表达(***表示p<0.001)。
图4是9种生物被膜形成相关基因在对数生长期和vbnc状态金黄色葡萄球菌中的相对表达(***表示p<0.001)。
具体实施方式
本发明首先在-20℃条件下,以柠檬酸-磷酸氢二钠溶液(ph4.0)作为诱导液诱导金黄色葡萄球菌进入vbnc状态。
通过qrt-pcr检测对数生长期和vbnc状态金黄色葡萄球菌中pbp1基因表达的变化。
通过qrt-pcr检测对数生长期和vbnc状态金黄色葡萄球菌中ebps基因表达的变化。
通过qrt-pcr检测对数生长期和vbnc状态金黄色葡萄球菌中9个与生物被膜形成相关基因的表达变化,包括icaa、icab、icac、icad、fnba、fnbb、ebh、agra和sara。
实验1.金黄色葡萄球菌vbnc状态的诱导和检测方法:
(1)从-80℃低温冰箱中取出冻藏的金黄色葡萄球菌nctc8325-4菌种,在提前倒好的无菌胰蛋白胨大豆琼脂(tsa)平板上划线,将划线平板倒置于37℃恒温培养箱中,培养24h;
(2)挑一个单菌落接种于20ml的无菌胰蛋白胨大豆肉汤(tsb)培养基中,在振荡培养箱中37℃、200r/min摇床培养12h;
(3)从摇床中取出培养的菌液,将菌液以1:100的稀释度转移到tsb中37℃、200r/min摇床培养4.5h,此时的金黄色葡萄球菌处于对数生长期;
(4)取出摇床培养4.5h的菌液,在4℃下以8000×g离心20min,弃掉上清;
(5)用柠檬酸-na2hpo4缓冲溶液(ph4.0)重悬菌体,使重悬后的诱导菌液初始浓度达到108cfu/ml左右;
(6)将制备好的诱导菌液分装,于-20℃条件下保存;
(7)每3天取出冻藏的菌液在室温下自然解冻1h,参照gb4789.2-2010方法,选择合适的稀释梯度采用平板计数法来测定诱导液中的可培养菌数;
(8)当诱导液中的可培养菌数少于1cfu/ml时,对原始菌液进行10倍浓缩,当10倍浓缩后的菌液的可培养菌数降为0cfu/ml,这时我们认为金黄色葡萄球菌进入了不可培养状态;
(9)使用live/deadbaclight试剂盒对不可培养的金黄色葡萄球菌细胞进行染色,然后通过流式细胞仪测定活细胞含量;若仍有活细胞存在,说明金黄色葡萄球菌细胞已完全进入vbnc状态。
实验结果:
-20℃下金黄色葡萄球菌在柠檬酸-磷酸氢二钠(ph4.0)中诱导72天后可培养细胞数降至不可检测水平(<0.1cfu/ml)。经过流式细胞仪检测发现进入不可培养状态的金黄色葡萄球菌仍有活细胞存在(图1)。实验结果表明金黄色葡萄球菌在第72天已完全进入vbnc状态。
实验2.vbnc状态金黄色葡萄球菌pbp1的基因表达变化检测方法:
(1)取30ml的vbnc状态菌液,在4℃条件下以8000×g重复离心多次富集菌体,加入1ml的0.85%nacl溶液重悬;
(2)分别取1.5ml和1ml的对数生长期菌液和重悬的vbnc状态菌液于4℃条件下,以13400×g离心2min收集菌体;
(3)用rnase-freeddh2o洗涤2次,去除上清液;
(4)加入100μl的溶葡萄球菌酶(1mg/ml)于37℃恒温水浴锅中处理1h;
(5)参照rnapreppure总rna提取试剂盒说明书进行rna的提取,离心皆在25℃条件下操作;
(6)打开quawell6000超微量紫外可见分光光度计,取1.5μlrnase-freeddh2o进行“blank”调零,每次取1.5μl样品选择“measure”进行检测,测定260nm和280nm吸收值;
(7)对提取好的rna溶液进行反转录,实验过程按照maximahminusfirststrandcdnasynthesiskitwithdsdnase试剂盒说明书进行,实验全程在冰盒上进行操作;
(8)使用tb
(9)通过steponeplusreal-timepcr系统采用两步法pcr的扩增标准程序在20μl的总反应体积下进行扩增。第一步:预变性,95℃,30s,重复1次;第二步:pcr反应,95℃,5s,60℃,30s,重复40次。
(10)以gyrb作为内参,用2-△△ct法计算基因表达水平的倍数变化。
表1金黄色葡萄球菌pbp1基因和内参gyrb引物序列
实验结果:
pbp1在金黄色葡萄球菌进入vbnc状态后的表达变化如图2所示,pbp1的表达在vbnc细胞中显著下调(**表示p<0.01)。
实验3.vbnc状态金黄色葡萄球菌ebps的基因表达变化
实验方法:
(1)取30ml的vbnc状态菌液,在4℃条件下以8000×g重复离心多次富集菌体,加入1ml的0.85%nacl溶液重悬;
(2)分别取1.5ml和1ml的对数生长期菌液和重悬的vbnc状态菌液于4℃条件下,以13400×g离心2min收集菌体;
(3)用rnase-freeddh2o洗涤2次,去除上清液;
(4)加入100μl的溶葡萄球菌酶(1mg/ml)于37℃恒温水浴锅中处理1h;
(5)参照rnapreppure总rna提取试剂盒说明书进行rna的提取,离心皆在25℃条件下操作;
(6)打开quawell6000超微量紫外可见分光光度计,取1.5μlrnase-freeddh2o进行“blank”调零,每次取1.5μl样品选择“measure”进行检测,测定260nm和280nm吸收值;
(7)对提取好的rna溶液进行反转录,实验过程按照maximahminusfirststrandcdnasynthesiskitwithdsdnase试剂盒说明书进行,实验全程在冰盒上进行操作;
(8)使用tb
(9)通过steponeplusreal-timepcr系统采用两步法pcr的扩增标准程序在20μl的总反应体积下进行扩增。第一步:预变性,95℃,30s,重复1次;第二步:pcr反应,95℃,5s,60℃,30s,重复40次。
(10)以gyrb作为内参,用2-△△ct法计算基因表达水平的倍数变化。
表2金黄色葡萄球菌ebps基因和内参gyrb引物序列
实验结果:
金黄色葡萄球菌中的ebps在进入vbnc状态后的表达变化如图3所示,金黄色葡萄球菌在vbnc状态下ebps的表达水平显著低于对数生长期(***表示p<0.001)。
实验4.vbnc状态金黄色葡萄球菌生物被膜形成相关基因表达变化
实验方法:
(1)取30ml的vbnc状态菌液,在4℃条件下以8000×g重复离心多次富集菌体,加入1ml的0.85%nacl溶液重悬;
(2)分别取1.5ml和1ml的对数生长期菌液和重悬的vbnc状态菌液于4℃条件下,以13400×g离心2min收集菌体;
(3)用rnase-freeddh2o洗涤2次,去除上清液;
(4)加入100μl的溶葡萄球菌酶(1mg/ml)于37℃恒温水浴锅中处理1h;
(5)参照rnapreppure总rna提取试剂盒说明书进行rna的提取,离心皆在25℃条件下操作;
(6)打开quawell6000超微量紫外可见分光光度计,取1.5μlrnase-freeddh2o进行“blank”调零,每次取1.5μl样品选择“measure”进行检测,测定260nm和280nm吸收值;
(7)对提取好的rna溶液进行反转录,实验过程按照maximahminusfirststrandcdnasynthesiskitwithdsdnase试剂盒说明书进行,实验全程在冰盒上进行操作;
(8)使用tb
(9)通过steponeplusreal-timepcr系统采用两步法pcr的扩增标准程序在20μl的总反应体积下进行扩增。第一步:预变性,95℃,30s,重复1次;第二步:pcr反应,95℃,5s,60℃,30s,重复40次。
(10)以gyrb作为内参,用2-△△ct法计算基因表达水平的倍数变化。
表3金黄色葡萄球菌生物被膜形成相关基因和内参gyrb引物序列
实验结果:
金黄色葡萄球菌中的生物被膜形成相关基因在进入vbnc状态后的表达变化如图4所示。与对数生长期细胞相比,vbnc状态金黄色葡萄球菌细胞中icaa、icab、icac、icad、fnba、fnbb、ebh和agra显著下调;但是在vbnc细胞中全局调控因子sara的表达与对数生长期细胞中的表达相似。由于sara在vbnc状态金黄色葡萄球菌细胞中表达稳定,因此可以作为依赖于mrna的反转录pcr技术的靶基因来检测vbnc状态金黄色葡萄球菌。
结论
本发明在-20℃下采用柠檬酸-磷酸氢二钠(ph4.0)对金黄色葡萄球菌进行诱导,发现金黄色葡萄球菌在柠檬酸-磷酸氢二钠(ph4.0)中第72天被诱导进入vbnc状态。通过qrt-pcr对对数生长期和经过-20℃柠檬酸诱导进入vbnc状态的金黄色葡萄球菌细胞的pbp1、ebps、9种生物被膜形成相关基因的表达变化进行分析,结果发现在vbnc细胞中全局调控因子sara的表达与对数生长期细胞中的表达相似。鉴于sara在vbnc状态金黄色葡萄球菌细胞中高效表达,由此可作为一种用于检测vbnc状态金黄色葡萄球菌的分子靶标。
- 还没有人留言评论。精彩留言会获得点赞!