一种高产核酸片段的制备方法与流程
1.本发明属于生物技术领域,尤其涉及一种高产核酸片段的制备方法。
背景技术:
2.核酸片段的制备主要通过合成、pcr扩增方法及通过质粒扩增后酶切获取,其中pcr方法因体外聚合酶识别、添加、切割过程中的低概率的突变的存在难以保证批间的均一性,而从质粒中酶切获取核酸片段由于细胞内复杂的复制机制可以有效保证基因序列的稳定,限制性内切酶又是专一性切割,保证了目标核酸片段的批间一致性。因此,通常更倾向于采用质粒酶切方式获取大量质量均一的目标核酸片段。
3.在核酸片段的制备过程中,先通过pcr扩增或者全序列合成获得目标核酸片段,将其插入到质粒载体中获得重组质粒,通过重组质粒的扩增与酶切,最终获取大量的目标核酸片段。通常重组质粒中只含有一个copy的目标核酸片段,在目标核酸片段需求量比较低时,低收率的目标核酸片段亦能满足需求,但当需求量比较大时,目标核酸片段产量较低问题就变得异常突出,物料需求增多,生产周期延长,直接导致经济效益的低下。因此如何提高单位质粒中目标核酸片段的含量成为提高经济效益亟需解决的一大问题。
技术实现要素:
4.本发明实施例的目的在于提供一种高产核酸片段的制备方法,旨在解决背景技术中提出的问题。
5.本发明实施例是这样实现的,一种高产核酸片段的制备方法,其包括以下步骤:
6.在目标基因序列的5
′
和3
′
端分别引入同一个限制性内切酶的识别位点,以便经单一酶切获取目的基因片段,并保证片段的均一性;
7.利用酶切、连接方式将目的基因片段与载体骨架连接成一种含有至少2copy的目的基因片段的重组质粒。
8.扩增并收集重组质粒,利用单一限制性内切酶酶切重组质粒,得到酶切液;
9.将酶切液利用akta经阴离子交换树脂分离纯化,收集目的基因片段。
10.作为本发明实施例的另一种优选方案,所述步骤中,引入的限制性内切酶的识别位点为同一个酶。
11.作为本发明实施例的另一种优选方案,所述步骤中,重组质粒含有2~10个copy的目的基因片段。
12.作为本发明实施例的另一种优选方案,所述步骤中,重组质粒含有2~3个copy的目的基因片段。
13.作为本发明实施例的另一种优选方案,所述步骤中,目的基因片段的获取是通过直接酶切或者pcr与酶切相结合方法获取含有目的基因片段的酶切产物,经电泳分离、回收和纯化处理,得到目的基因片段。
14.作为本发明实施例的另一种优选方案,所述步骤中,载体骨架为去磷酸化载体骨
架片段,其是通过直接酶切或者pcr与酶切相结合方法获取含有ori区和抗生素抗性基因区的载体骨架片段的酶切产物,经电泳分离、回收和纯化处理,得到载体骨架片段;然后将载体骨架片段进行去磷酸化处理后,再经纯化回收,得到去磷酸化载体骨架片段。
15.作为本发明实施例的另一种优选方案,所述抗生素抗性基因为卡那霉素抗性基因,以避免抗生素残留及抗性基因向环境的扩散。
16.本发明实施例提供的一种高产核酸片段的制备方法,其首先根据“质量源于设计”的理念,从质粒层面着手,增加质粒中目标基因片段的含量,进而提高单位发酵液中质粒的含量,提高了单一批次的目标基因片段的产量。
17.其中,目的基因的掺入方式可以是不同的酶切位点插入,可以是同一酶切位点串联后插入,可以是同尾酶酶切、串联后插入,也可以是混合形式。
18.根据设计,可通过直接酶切或者pcr与酶切相结合方法分别获取目的基因片段与载体骨架片段。
19.根据设计,目的基因片段或其自连接片段与去磷酸化载体骨架片段连接,并转化,经抗性筛选获取含有多个copy目的基因片段的重组质粒。
20.其中目的基因的自连接片段是将目的基因片段与连接酶反应,自发的连接在一起,然后经琼脂糖凝胶电泳后,再进行切胶回收和纯化处理,得到目的基因自连接片段。
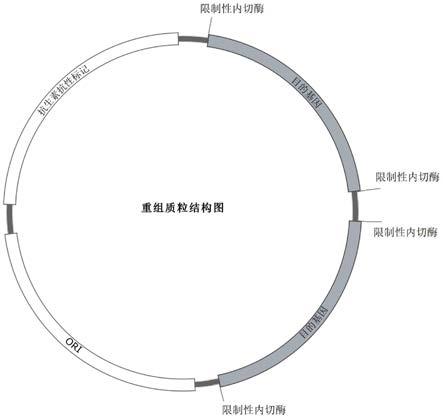
21.另外,扩增并收集重组质粒,利用单一限制性内切酶酶切,即可将多个目的基因片段从重组质粒中切割下来。然后将酶切液利用akta进行上样分析,经阴离子交换树脂分离纯化,收集目的峰及载体峰,分析峰面积及检测测定样品中目的基因片段的含量和载体的含量。该方法酶切操作简便,单一批次质粒样品中目的基因片段的产量高,样品中载体片段的含量低降低了其对目的基因片段分离的影响,样品中目的基因片段的含量高易于分离及提高纯度。
22.本发明提供了一种依据所述的核酸片段制备方法的一种实施例:构建含有两个拷贝目的基因片段的重组质粒,并制备目的基因片段,以验证其可行性,通过实施例可制得含有2copy及以上的目的基因片段的重组质粒,且不影响整体质粒拷贝数,提高了单一批次菌体获得的质粒产量,增大了单一批次纯化工作中所得目的基因片段的产量,实现了单一批次质粒样品中目的基因片段的高产出,缩短了生产周期,提高了设备利用率,增加了经济效益。
附图说明
23.图1为质粒puc57
‑
kan
‑
yh酶切图谱;其中,m:dna marker;1:质粒puc57
‑
kan
‑
yh的kpni酶切。
24.图2为回收的yh自连片段电泳检测图谱;其中,m:dna marker;1:yh自连片段。
25.图3为重组质粒的鉴定结果图;其中,m:dna marker;a中1~5为质粒电泳检测;b中1~5为质粒ndei酶切电泳检测;c中1~5为质粒kpni酶切电泳检测。
26.图4为不同质粒菌株的质粒产量及目的基因片段产量分析结果图,其中1~5分别为2yh01、2yh02、2yh03、2yh04、2yh05。
27.图5为质粒产量及目的基因片段产量对比分析结果图,其中2yh01为重组质粒。
28.图6为重组质粒的结构图。
29.图7为纯化前酶切电泳检测图;其中,1为原质粒样;2为重组质粒样;m为dna marker。
30.图8为纯化后回收目的基因片段的电泳检测图;其中,m为dna marker;1为重组质粒样回收片段;2为原质粒样回收片段。
31.图9为重组质粒样制备片段的色谱谱图和色谱谱图积分结果图。其中,图9的(b)为图9的(a)中色谱谱图的局部放大图。
32.图10为原质粒样品制备片段的色谱谱图和色谱谱图积分结果图。其中,图10的(b)为图10的(a)中色谱谱图的局部放大图。
具体实施方式
33.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
34.该实施例提供了高产核酸片段制备的一种实施方法,其包括以下步骤:
35.实施例1重组质粒的构建
36.s1、取含有目的基因的puc57
‑
kan
‑
yh质粒的菌株,接种于含有50μg/ml的kan的lb液体培养基,于37℃、220rpm过夜振荡培养,取过夜培养物,利用质粒小量抽提试剂盒进行质粒提取,获得puc57
‑
kan
‑
yh目标质粒。
37.s2、取puc57
‑
kan
‑
yh目标质粒10μg,用限制性内切酶kpni酶切,于37℃酶切40min,反应液经1%的琼脂糖凝胶电泳分离后,切胶回收约3759bp的目标片段条带和2579bp的载体片段,然后经dna胶回收试剂盒纯化获得yh目的基因片段和载体骨架片段,如图1所示。
38.s3、在回收的载体骨架片段溶液中加入小牛肠碱性磷酸酶(ciap)进行去磷酸化处理,于50℃反应60min,然后直接用胶回收试剂盒对去磷酸化载体骨架片段进行纯化回收,获得puc57
‑
kan去磷酸化载体骨架片段。
39.s4、取回收的yh目的基因片段,用dna ligation mix对yh目的基因片段进行自连接反应,于16℃连接反应5min后,再经1%的琼脂糖凝胶电泳分离后,切胶回收约7518bp的目标片段条带,然后经dna胶回收试剂盒纯化获得yh目的基因自连片段,如图2所示。
40.s5、取去磷酸化载体骨架片段、yh目的基因自连片段与dna ligation mix混合成8.6μl连接液,具体的,连接体系如下表1:
41.表1
42.组分浓度(ng/μl)体积(μl)去磷酸化载体骨架片段23.50.3yh目的基因自连片段5.34ligationmix
‑
4.3总体系
‑
8.6
43.将上述连接体系于16℃连接反应20min,然后置于冰浴中,得到连接液,备用。
44.s6、取上述的连接液与大肠杆菌感受态细胞trans10轻轻混合,置于冰浴中30min,42℃热击90sec,迅速置入冰浴中2min,加入200μl无抗的lb培养基于37℃孵育复苏1h,然后涂布含50μg/ml的kan抗性lb平板;接着,取上述涂布的抗性平板,静置5min,然后倒置放置,
并于37℃恒温培养箱中培养至出现明显菌落(培养时长不超过20h)。抗性平板上长出的阳性克隆,即为疑似含有重组质粒的目标菌株。
45.s7、取上述筛选出的目标菌株,接种于含50μg/ml的kan抗性lb液体培养基,于37℃、220rpm下振荡培养过夜,获得质粒菌株培养物;取质粒菌株培养物,利用质粒小量抽提试剂盒进行质粒提取,获得其质粒溶液;然后,取1μl质粒溶液经1%的琼脂糖凝胶电泳分离检测,所测条带大小与理论值(约10097bp)相符,即为目标重组质粒。
46.另外,该重组质粒的酶切鉴定方法如下:
47.取1μg抽提的重组质粒,分别用限制性内切酶ndei或者kpni单独酶切,于37℃酶切反应40min,酶切产物经1%的琼脂糖凝胶电泳分离检测,如附图3所示,限制性内切酶ndei酶切后所得条带大小呈单条带,且其大小与理论预期(约10097bp)相符,而限制性内切酶kpni酶切后所得条带大小呈现双条带,且其大小与其理论预期(约3759bp和2579bp)相符,则所得质粒为目标含有2copy的yh片段的重组质粒,如附图6所示。综上检测结果表明成功构建出含双拷贝yh片段重组质粒,命名为puc57
‑
kan
‑
yh
‑
yh。则所得质粒菌分别命名为2yh01、2yh02、2yh03、2yh04、2yh05。
48.实施例2高产质粒菌株的筛选及重组质粒的目的基因片段产量分析:
49.一、高产质粒菌株的筛选
50.取鉴定正确的5株新制质粒菌株与原质粒菌株,分别接种于含50μg/ml的kan抗性lb液体培养基,于37℃、220rpm下振荡培养过夜。于分光光度计的600nm下测定各菌液的od
600
值。将各菌液用无菌水调整至适当od
600
,分别取适量体积的菌液,用质粒小量抽提试剂盒提取质粒,并用相同的体积(100μl)进行洗脱。然后用超微量分光光度计测定各质粒溶液的浓度,计算出个样品中质粒的含量及目的基因片段的含量。根据目的基因片段含量,从中筛选出目的基因片段产量较高的质粒及其对应质粒菌株。
51.经相同条件的扩增培养后,取等量的菌量进行质粒提取,测得5株质粒菌株2yh01~2yh05的每od菌液中质粒含量分别为4.80μg、2.41μg、4.57μg、4.69μg、3.62μg,以及原质粒菌株中每od菌液中质粒含量为3.47μg。以原质粒菌的质粒和理论目的基因含量作为参比进行相对定量分析并作图,见图4。经分析菌株2yh01,2yh03,2yh04的质粒含量均高于原质粒菌,平均提高了约35%;由于原质粒大小为6338bp,新构建质粒大小为10097bp,经换算后,其摩尔量略低于原质粒,表明各菌株中的质粒拷贝数与原质粒差别不明显;由于原质粒中含有1co py目的基因片段,而新质粒中含有2copy目的基因片段,经换算后可知,新质粒的理论目的基因片段产量较高,达到原质粒的目的基因片段产量的近2倍,与理论预期相符。综上结果,优选重组质粒菌株2yh01进行后续研究。
52.二、重组质粒的目的基因片段产量分析
53.选取原质粒菌株及重组质粒菌株,分别进行摇瓶扩增培养,经相同条件的扩增培养后,取等量的菌量进行质粒提取,分析质粒含量,测得每od菌液中质粒含量分别为1.85μg、3.74μg。以原质粒菌的质粒和理论目的基因含量作为参比进行相对定量分析并作图,见图5。经分析重组质粒菌株的质粒含量高于原质粒菌,提高了约1倍;根据质粒大小,经换算后,其摩尔量略高于原质粒,表明重组质粒菌株中的质粒拷贝数与原质粒差别不明显;根据质粒中目的基因片段理论含量多少,经换算后可知,重组质粒的理论目的基因片段产量较高,达到原质粒的目的基因片段产量的2倍,与理论预期相符。
54.实施例3目的基因片段的分离纯化分析
55.(1)质粒扩增与提取
56.分别取上述重组质粒菌株与原质粒菌株,分别接种于含50μg/ml的kan抗性lb液体培养基,于37℃、220rpm下振荡培养过夜。分别取菌液于8000
×
g离心2min收集菌体,并分别提取质粒。
57.(2)酶切消化
58.分别取1mg的重组质粒与原质粒用限制性内切酶kpni酶切,电泳检测直至酶切完全,如附图7所示。
59.(3)目的基因片段的纯化
60.取一定量的酶切液利用akta进行上样分析。经层析柱nanoq
‑
15l分离纯化,分别收集目的峰及载体峰。分析峰面积及检测测定两种样品中目的基因片段的含量和载体的含量。具体如下:
61.层析柱的平衡:用a液(10mm tris
‑
hcl,1mm edta,0.4m nacl,ph8.0)对nanoq
‑
15l层析柱(21.2
×
150mm)进行平衡处理,流速4ml/min,处理3个柱体积。平衡结束时,将uv检测波长a260调至零点,准备上样。
62.上样:取含有0.92mg质粒的酶切液,以4ml/min的流速进行上样。
63.洗涤1:用a液对上样后的层析柱进行冲洗,流速4ml/min,洗涤3个柱体积,使260nm波长下的紫外检测值下降至稳定。
64.洗涤2:以a液为基础液,与b液(10mm tris
‑
hcl,1mm edta,1mnacl,ph 8.0)混合制成0%~40%b的线性比例混合液,用2个柱体积混合液进行线性洗脱洗涤,流速4ml/min。
65.洗脱:将a液与b液制成40%~65%b的线性比例混合液,用15个柱体积混合液进行线性洗脱,流速4ml/min,收集260nm波长下的紫外检测值大于5mau吸收峰,分别收集目的片段峰与载体片段峰。
66.检测:通过nano超微量分光光度计的紫外法测定目的基因片段的浓度,琼脂糖凝胶电泳检测目的基因片段的大小,如附图8所示。
67.从图8的电泳结果显示,回收到的片段大小与理论预期(约3759bp)一致,为目的基因片段;且为单一条带,无杂带,表明回收的片段溶液为纯的目的基因片段溶液,其紫外检测结果为其实际含量。
68.另外,上述两种质粒样中目的基因片段的纯化效果对比分析如表2所示。
69.表2
70.[0071][0072]
从表2在相同质粒量条件下,重组质粒酶切样品中回收的目的基因片段量高于原质粒样,回收的载体片段量明显低于原质粒样;而回收的目的基因片段占回收dna片段总量的比例比原质粒样高15.1%,与单位质粒量中目的基因片段含量的理论增加量(15.2%)相一致,表明单位质粒量在一定的总dna回收率下,目的基因片段的初始含量越高,回收的目的基因片段量越高。本实验中,该批次重组质粒样品中目的基因片段产量比原质粒样仅仅提高了3.8%,与理论产量增加25.6%相差较大,原因是由于重组质粒样品纯化后回收dna总量偏低,比原质粒样的回收率低了14.3个百分点,限制了目的基因片段的产量增加量。因此当在一定的总dna回收率下,重组质粒可显著提高纯化填料介质的利用效率及单一批次的目的基因片段产物产量,缩短生产周期,提高生产效率。
[0073]
(4)目的基因片段纯度检测
[0074]
取收集的目的基因片段溶液,分别利用hplc进行检测,分析样品的纯度。采用色谱柱tskgel dna
‑
npr(4.6mm
×
7.5cm),于25℃下,进样100μl,使用a液(20mm tris
‑
hcl,ph 8.8)和b液(20mm tris
‑
hcl,1m nacl,ph 8.8),以0.5ml/min的流速,线性梯度洗脱,于260nm下检测吸收峰,如图9和图10所示。
[0075]
根据色谱谱图积分结果显示,重组质粒样制备片段(s1样品,图9)的纯度为97.75%,原质粒样品制备片段(d1样品,图10)的纯度为98.00%,均符合要求,且纯度差异不明显,表明该该方法制备的重组质粒在提高目的基因片段产量的同时,不影响后续纯化的纯度。
[0076]
综上所述,实施例依据本发明的制备方法构建出的一种新的重组质粒,含有2copy目的基因片段,且不影响整体质粒拷贝数和质粒产量,改造增大了单一批次所得目的基因片段的产量,实现了高产目的基因片段的目的,缩短了生产周期,提高了设备利用率,增加了经济效益。
[0077]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1