靶向成纤维细胞活化蛋白探针、制备方法及其在制备PET显像剂中的应用
靶向成纤维细胞活化蛋白探针、制备方法及其在制备pet显像剂中的应用
技术领域
1.本发明涉及靶细胞探针技术领域,具体涉及靶向成纤维细胞活化蛋白探针、制备方法及其在制备pet显像剂中的应用。
背景技术:
2.在传统的诊断治疗方法中,主要是针对肿瘤实质细胞的靶点。近来,肿瘤微环境和肿瘤间质越来越成为人们关注的焦点,这使得新的诊断和治疗方式成为可能。癌相关成纤维细胞(caf)是肿瘤的主要组成部分,占总肿瘤质量可达到的90%。caf与正常成纤维细胞的不同之处在于其成纤维细胞活化蛋白(fibroblast activation protein,fap)的相对特异性表达,通常与各自癌症的不良预后和结局有关。fap具有二肽基肽酶和胶原酶活性,可裂解基质中包括明胶和变性的ⅰ型胶原在内的诸多二肽基肽酶活性的底物,参与细胞外基质(ecm)降解,促进肿瘤细胞从原发部位脱离、侵袭和转移。fap在正常组织中几乎不表达,但是在多种肿瘤,如卵巢癌、胰腺癌和肝细胞癌的癌相关成纤维细胞(caf)中高表达。因此,fap有望成为肿瘤显像新靶点。
3.初步临床研究结果表明,与最常用正电子发射断层(pet)显像剂(探针)[
18
f]氟代脱氧葡萄糖([
18
f]fdg)比较,
68
ga或
18
f标记fap抑制剂(fapi)显像剂(也称探针)在胃癌和胆道系统恶性肿瘤显像效果有明显优势,在大多数肿瘤原发病灶的界限肿瘤、恶性肿瘤肝脏转移和骨转移灶方面有一定的优势,在常见实体恶性肿瘤应用上大体检测价值与[
18
f]fdg相近。较为常用的
68
ga标记fapi显像剂[
68
ga]fapi
‑
04,在临床前和初步临床实验中显示出高肿瘤/靶器官放射性摄取比值和快速清除特性。但是,[
68
ga]fapi
‑
04在胰腺中会出现多样化摄取,摄取相对不稳定,给胰腺良恶性诊断解读带来一定难度,除非已有胰腺明确病理证实;少部分患者会出现胆道系统的[
68
ga]fapi
‑
04生理性摄取;此外,
68
ga半衰期较短(67.71min),不适于长距离运输。由于
18
f半衰期(109.8min)较长,适于长距离运输和延迟显像。近来,
18
f标记fapi显像剂发展较快并正在迅速临床转化。基于临床前和临床pet显像研究发现:[
18
f]fapi
‑
42在胆道系统、胰腺及胆囊系统中具有生理性摄取,少部分患者出现肠道轻微摄取。最近国外学者基于click化学反应研制成功新型
18
f标记fapi显像剂[
18
f]fglc
‑
fapi,初步生物学评估表明,[
18
f]fglc
‑
fapi显示出与[
68
ga]fapi
‑
04相同甚至更高的肿瘤摄取值。然而,[
18
f]fglc
‑
fapi通过肝胆和肠道代谢途径排泄,会造成腹部肿瘤检测的检出率降低。此外,在合成方法上,现有的fapi显像剂,尤其是[
18
f]fglc
‑
fapi,标记过程繁琐,耗时较长,放化产率较低。
技术实现要素:
[0004]
为解决现有fapi显像剂的靶向性及药代动力学特性差,以及克服现有的fapi显像剂在肝胆系统、胆道系统、胰腺和肠道系统的生理性摄取量高的缺陷,本发明提供了一种靶向成纤维细胞活化蛋白(fap)探针,具体为一类具有优良药代动力学特性的含双配体新型
fapi探针(显像剂)。
[0005]
另外,为解决现有fapi显像剂的合成标记过程繁琐、耗时长以及放化产率低的问题,本发明还提供了制备所述靶向成纤维细胞活化蛋白探针的方法。
[0006]
本发明的目的还在于提供所述靶向成纤维细胞活化蛋白(fap)探针的应用,具体是在制备肿瘤和多种疾病生物学功能显像剂中的应用。
[0007]
本发明的目的通过如下技术方案实现。
[0008]
一种靶向成纤维细胞活化蛋白探针,具体为正电子核素标记靶向成纤维细胞活化蛋白小分子抑制剂(fapi)探针,由fap药效基团配体、吡喃葡萄糖胺基配体(r)、联结基团、结合金属离子螯合基团以及放射性金属核素(x
n+
)构成。
[0009]
在该靶向fap探针中,双配体为fap药效基团和吡喃葡萄糖胺基。其中,fap药效基团为靶向fap配体;吡喃葡萄糖胺基为[
18
f]fdg类似物基团,包括2
‑
乙酰氨基
‑2‑
脱氧
‑
β
‑
d
‑
吡喃葡萄糖胺基或葡萄糖胺基,其作用机理可能涉及葡萄糖转运体和某些酶,也可改善靶向fap配体药代动力学特性。
[0010]
在优选的实施例中,所述吡喃葡萄糖胺基包括2
‑
乙酰氨基
‑2‑
脱氧
‑
β
‑
d
‑
吡喃葡萄糖胺基或葡萄糖胺基;
[0011]
和/或,所述联结基团包括聚乙二醇基(peg2)、天冬氨酸基(asp2)以及谷氨酸基(glu),联结基团可改善和提高靶向fap配体药代动力学特性;
[0012]
和/或,所述结合金属离子螯合基团为1,4,7
‑
三氮杂环九烷基
‑
n’,n
”‑
二乙酸基
‑
n
‑
乙酰基(
‑
nota)或其类似物(
‑
dota),可特异性结合放射性金属核素;
[0013]
和/或,所述放射性金属核素x
n+
为
68
ga
3+
、[al
18
f]
2+
、
64
cu
2+
或其它放射性金属离子。
[0014]
更优选的实施例中,所述1,4,7
‑
三氮杂环九烷基
‑
n’,n
”‑
二乙酸基
‑
n
‑
乙酰基的类似物包括2
‑
s
‑
(4
‑
异硫氰基苄基)
‑
1,4,7
‑
三氮杂环壬烷
‑
1,4,7
‑
三乙酸(p
‑
scn
‑
bn
‑
nota)或1,4,7,10
‑
四氮杂环十二烷
‑
n’,n”n
”’‑
三乙酸基
‑
n
‑
乙酰基(
‑
dota)。
[0015]
在优选的实施例中,上述任一项所述的靶向成纤维细胞活化蛋白(fap)探针,表示为[x
n+
]nota
‑
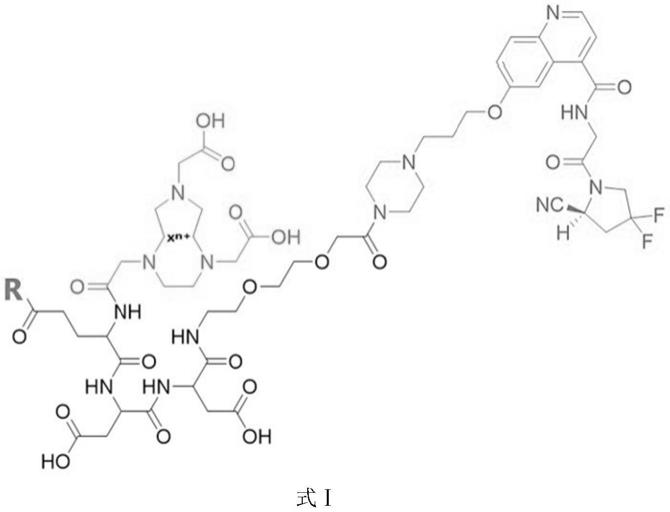
fapt,所述联结基团包括两个聚乙二醇基、两个天冬氨酸基以及一个谷氨酸基,化学结构式如式ⅰ所示:
[0016][0017]
其中,r为x
n+
为
68
ga
3+
、[al
18
f]
2+
、
64
cu
2+
或其它放射性金属离子。
[0018]
本发明提供所述的靶向成纤维细胞活化蛋白(fap)探针([x
n+
]nota
‑
fapt及其类似物[x
n+
]dota
‑
fapt)的制备方法,以nota
‑
fapt或dota
‑
fapt为前体原料,分别与
68
ga
3+
、[al
18
f]
2+
、
64
cu
2+
等发生螯合反应并经小柱分离纯化,制成靶向成纤维细胞活化蛋白(fap)探针[x
n+
]nota
‑
fapt;以dota
‑
fapt为前体原料,分别与
68
ga
3+
、
64
cu
2+
、
177
lu等发生螯合反应并经小柱分离纯化,制成靶向成纤维细胞活化蛋白(fap)探针[x
n+
]dota
‑
fapt。
[0019]
一种靶向成纤维细胞活化蛋白(fap)探针的制备方法,以nota
‑
fapt或其类似物dota
‑
fapt为前体原料,分别与放射性金属核素x
n+
发生螯合反应并经小柱分离纯化,制成fap探针[x
n+
]nota
‑
fapt或其类似物[x
n+
]dota
‑
fapt。
[0020]
放射合成靶向fap探针[x
n+
]nota
‑
fapt的关键是其前体原料nota
‑
fapt或
‑
dota的制备。在优选的实施例中,所述的前体原料nota
‑
fapt或其类似物dota
‑
fapt采用如下方法制备:
[0021]
fap药效基团配体修饰
‑
peg2后形成fap药效基团配体
‑
peg2,fap药效基团配体
‑
peg2修饰asp2、glu及吡喃葡萄糖胺基配体后,最后修饰螯合基团
‑
nota或
‑
dota,经制备型hplc分离纯化收集产品峰,即可获得纯化所述的前体原料nota
‑
fapt或dota
‑
fapt。
[0022]
在优选的实施例中,所述靶向成纤维细胞活化蛋白探针为[
68
ga]nota
‑
fapt或[
68
ga]dota
‑
fapt,所述的[
68
ga]nota
‑
fapt或[
68
ga]dota
‑
fapt用以下方法制备:
[0023]
以nota
‑
fapt或其类似物dota
‑
fapt为前体原料,所述的前体原料nota
‑
fapt或dota
‑
fapt与弱酸性
68
gacl3溶液在85
‑
110℃加热下反应,用hlb小柱或sep
‑
pak c18小柱分离纯化,即得到[
68
ga]nota
‑
fapt或[
68
ga]dota
‑
fapt注射液。
[0024]
在优选的实施例中,所述靶向成纤维细胞活化蛋白探针为[
18
f]alf
‑
nota
‑
fapt,所述的[
18
f]alf
‑
nota
‑
fapt用以下方法制备:
[0025]
以nota
‑
fapt为前体原料,所述的前体原料nota
‑
fapt在alcl3和乙腈的酸性溶液中与
18
f
‑
反应,经hlb小柱或sep
‑
pak c18小柱分离纯化,即得到[
18
f]alf
‑
nota
‑
fapt注射液。
[0026]
在优选的实施例中,所述靶向成纤维细胞活化蛋白探针为[
64
cu]nota
‑
fapt或[
64
cu]dota
‑
fapt,所述的[
64
cu]nota
‑
fapt或[
64
cu]dota
‑
fapt用以下方法制备:
[0027]
以nota
‑
fapt或其类似物dota
‑
fapt为前体原料,所述的前体原料nota
‑
fapt或dota
‑
fapt与
64
cucl2在乙酸钠酸性缓冲溶液中室温下温育反应15min,经hlb小柱或sep
‑
pak c18小柱分离纯化,得到符合要求的[
64
cu]nota
‑
fapt或[
64
cu]dota
‑
fapt注射液。
[0028]
本发明提供所述的靶向成纤维细胞活化蛋白(fap)探针([x
n+
]nota
‑
fapt及其类似物[x
n+
]dota
‑
fapt)在肿瘤正电子发射断层(pet)显像中的应用,包括[x
n+
]nota
‑
fapt或[x
n+
]dota
‑
fapt应用于肺腺癌、脑胶质瘤等多种实体瘤pet显像,并可进一步应用于肺腺癌、脑胶质瘤等多种实体瘤疗效评价,也可用于其它肿瘤和疾病pet显像应用。
[0029]
一种靶向成纤维细胞活化蛋白(fap)探针在制备pet显像剂中的应用,所述靶向fap探针为上述任一项所述的靶向fap探针。
[0030]
优选的实施例中,所述靶向成纤维细胞活化蛋白(fap)在制备靶向肿瘤fap高表达的pet显像剂中的应用。
[0031]
更优选的实施例中,所述靶向fap探针在制备肺腺癌、脑胶质瘤pet显像剂中的应用。
[0032]
更优选的实施例中,所述靶向fap探针在制备其它肿瘤和疾病pet显像剂中的应用。
[0033]
与现有技术相比,本发明具有如下优点和有益效果:
[0034]
(1)本发明的fap探针,其中的fap药效基团配体修饰
‑
peg2后形成fap药效基团配体
‑
peg2,fap药效基团配体
‑
peg2修饰asp2、glu及吡喃葡萄糖胺基后,最后修饰螯合基团
‑
nota或
‑
dota,通过优化化学结构,改善了探针的体内药代动力学特性和靶向性,增加亲水性并减少了肝胆系统、胆道系统、胰腺系统以及肠道系统的摄取。
[0035]
(2)本发明的fap探针,包括[x
n+
]nota
‑
fapt及其类似物[x
n+
]dota
‑
fapt,表现出优良的体内药代动力学特性,给药后15min时即可在肿瘤中具有较高摄取,便于肿瘤早期显像。
[0036]
(3)本发明的fap探针的制备方法中,nota
‑
fapt前体原料不仅可用核素
68
ga标记,且可用半衰期较长的核素
18
f标记,并可进一步用半衰期更长核素如
64
cu
2+
等标记,非常有利于商业化运输和延迟成像,从而形成探针[x
n+
]nota
‑
fapt;前体原料dota
‑
fapt可由正电子核素
68
ga
3+
、
64
cu
2+
等标记,也可由诊疗核素
177
lu标记,从而形成探针[x
n+
]dota
‑
fapt。并且,本发明中解决了前体原料nota
‑
fapt或dota
‑
fapt的制备,在与正电子核素一步反应和小柱分离纯化后,即可获得产品,可实现高产率和高纯度自动化合成,满足临床pet显像需要。
[0037]
(4)本发明的fap探针可应用于制备pet显像剂中包括在制备靶向肿瘤fap高表达的pet显像剂中的应用,在制备肺腺癌、脑胶质瘤pet显像剂中的应用,或者,在制备其它肿瘤和疾病pet显像剂中的应用,提高肿瘤及疾病的检出效率。
附图说明
[0038]
图1a为前体原料nota
‑
fapt(r=2
‑
乙酰氨基
‑2‑
脱氧
‑
β
‑
d
‑
吡喃葡萄糖胺基)的hplc分析图谱;
[0039]
图1b为前体原料nota
‑
fapt(r=2
‑
乙酰氨基
‑2‑
脱氧
‑
β
‑
d
‑
吡喃葡萄糖胺基)的ms分析图谱;
[0040]
图2a为[
18
f]alf
‑
nota
‑
fapt注射液在放射性保留时间rt=8.38min的代表性放射性hplc分析图谱;
[0041]
图2b为前体nota
‑
fapt在紫外吸收保留时间rt=8.17min的代表性紫外吸收hplc分析图谱;
[0042]
图3a为[
18
f]alf
‑
nota
‑
fapt注射液在体内血清1h时的放射性hplc分析色谱图;
[0043]
图3b为[
18
f]alf
‑
nota
‑
fapt注射液在体内尿液1h时的放射性hplc分析色谱图;
[0044]
图4a为[
18
f]alf
‑
nota
‑
fapt注射液在体外血清2h时的放射性hplc分析图谱;
[0045]
图4b为[
18
f]alf
‑
nota
‑
fapt注射液在pbs缓冲液2h时的放射性hplc分析图谱;
[0046]
图5为[
18
f]alf
‑
nota
‑
fapt注射液在fap高表达的a549
‑
fap肺腺癌细胞中不同时间点的摄取和抑制图,以及在野生型a549肺腺癌细胞中不同时间点的摄取图;
[0047]
图6为[
18
f]alf
‑
nota
‑
fapt注射液在fap高表达的293t
‑
fap细胞中60分钟时的摄取和抑制图,以及在野生型293t细胞中60分钟时的摄取图;
[0048]
图7为[
18
f]alf
‑
nota
‑
fapt亲和力测定的肿瘤细胞铺板示意图;
[0049]
图8为[
18
f]alf
‑
nota
‑
fapt亲和力测定结果图;
[0050]
图9a为[
18
f]alf
‑
nota
‑
fapt在昆明鼠体内30分钟、60分钟、90分钟3个时间点的生物分布图;
[0051]
图9b为60min时[
18
f]p
‑
fapi(
18
f
‑
p
‑
fapi)、[
18
f]p
‑
fapi(
18
f
‑
p
‑
fapi)竞争抑制以及[
18
f]fapi
‑
42(
18
f
‑
fapi
‑
42))的分布图;
[0052]
图10为[
18
f]alf
‑
nota
‑
fapt在fap高表达的u87胶质瘤模型中60分钟时小动物pet/ct图(左)、竞争抑制显像图(右);
[0053]
图11为[
18
f]alf
‑
nota
‑
fapt在fap高表达的a549
‑
fap肺腺癌模型中60分钟时小动物pet/ct图(左)、竞争抑制显像图(右);
[0054]
图12为[
18
f]alf
‑
nota
‑
fapt在a549
‑
fap高表达肺腺癌模型中60分钟时小动物pet/ct显像图(左)、在野生型a549肺腺癌模型中60分钟时小动物pet/ct显像图(右);
[0055]
图13a为同一模型[
18
f]alf
‑
nota
‑
fapt(fapt)和[
18
f]fapi
‑
42(fapi42)的pet显像定量比较图;
[0056]
图13b为同一模型[
18
f]alf
‑
nota
‑
fapt(nota
‑
fapt)和[
18
f]fapi
‑
42(nota
‑
fapi
‑
42)的pet显像图;
[0057]
图14a为[
18
f]alf
‑
nota
‑
fapt在a549
‑
fap肺腺癌模型中不同时间的小动物pet/ct图;
[0058]
图14b为[
18
f]alf
‑
nota
‑
fapt在a549
‑
fap肺腺癌模型中不同时间的小动物不同器官随着时间推移的%id值的变化图;
[0059]
图14c为[
18
f]alf
‑
nota
‑
fapt在a549
‑
fap肺腺癌模型中不同时间的小动物肿瘤与肌肉的%id值之比随着时间的变化图;
[0060]
图15a为[
18
f]alf
‑
nota
‑
fapt在u87胶质瘤模型中不同时间的小动物pet/ct显像图;
[0061]
图15b为[
18
f]alf
‑
nota
‑
fapt在u87胶质瘤模型中不同时间的小动物不同器官%id值随时间变化图;
[0062]
图16a为健康志愿者在30分钟时[
18
f]alf
‑
nota
‑
fapt(
18
f
‑
alf
‑
fapt)和[
18
f]fapi
‑
42(
18
f
‑
alf
‑
api
‑
42)pet显像结果比较图;
[0063]
图16b为健康志愿者在60分钟时[
18
f]alf
‑
nota
‑
fapt(
18
f
‑
alf
‑
fapt)和[
18
f]fapi
‑
42(
18
f
‑
alf
‑
api
‑
42)pet显像结果比较图;
[0064]
图16c为健康志愿者在60分钟时[
18
f]alf
‑
nota
‑
fapt(
18
f
‑
alf
‑
fapt)和[
18
f]fapi
‑
42(
18
f
‑
alf
‑
api
‑
42)pet显像结果比较图;
[0065]
图17a为肺癌患者的[
18
f]alf
‑
nota
‑
fapt pet/ct显像图;
[0066]
图17b为胃癌患者的[
18
f]alf
‑
nota
‑
fapt pet/ct显像图;
[0067]
图17c为阑尾印戒细胞癌患者经治疗处理后的[
18
f]alf
‑
nota
‑
fapt pet/ct显像图。
具体实施方式
[0068]
以下结合具体实施例对本发明的技术方案作进一步详细的描述,但本发明的保护范围及实施方式不限于此。本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
[0069]
并且,除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
[0070]
本发明靶向成纤维细胞活化蛋白(fap)探针,具体为正电子核素标记靶向fap小分子抑制剂(fapi)探针,由fap药效基团配体、吡喃葡萄糖胺基配体(r)、联结基团、结合金属离子螯合基团以及放射性金属核素x
n+
构成。
[0071]
在优选的实施例中,所述吡喃葡萄糖胺基包括2
‑
乙酰氨基
‑2‑
脱氧
‑
β
‑
d
‑
吡喃葡萄糖胺基或葡萄糖胺基;
[0072]
和/或,所述联结基团包括聚乙二醇基(peg2)、天冬氨酸基(asp2)以及谷氨酸基(glu);
[0073]
和/或,所述结合金属离子螯合基团为1,4,7
‑
三氮杂环九烷基
‑
n’,n
”‑
二乙酸基
‑
n
‑
乙酰基(
‑
nota)或其类似物;更优选的实施例中,所述1,4,7
‑
三氮杂环九烷基
‑
n’,n
”‑
二乙酸基
‑
n
‑
乙酰基的类似物包括2
‑
s
‑
(4
‑
异硫氰基苄基)
‑
1,4,7
‑
三氮杂环壬烷
‑
1,4,7
‑
三乙酸(p
‑
scn
‑
bn
‑
nota)或1,4,7,10
‑
四氮杂环十二烷
‑
n’,n”n
”’‑
三乙酸基
‑
n
‑
乙酰基(
‑
dota)。
[0074]
和/或,所述放射性金属核素x
n+
为
68
ga
3+
、[al
18
f]
2+
、
64
cu
2+
或其它放射性金属离子。
[0075]
在一个具体优选的实施例中,所述的靶向fap探针表示为[x
n+
]nota
‑
fapt,所述联结基团包括两个聚乙二醇基、两个天冬氨酸基以及一个谷氨酸基,化学结构式如式ⅰ所示:
[0076][0077]
其中,r为x
n+
为
68
ga
3+
、[al
18
f]
2+
、
64
cu
2+
或其它放射性金属离子。
[0078]
本发明的靶向fap探针的制备。
[0079]
首先,进行前体原料的制备。fap药效基团修饰配体
‑
peg2后形成fap药效基团配体
‑
peg2,fap药效基团
‑
peg2修饰asp2、glu及吡喃葡萄糖胺基配体后,最后修饰螯合基团
‑
nota或
‑
dota,经制备型hplc分离纯化收集产品峰,经冷冻干燥,即可获得纯化所述的前体原料nota
‑
fapt或dota
‑
fapt。
[0080]
前体原料nota
‑
fapt或dota
‑
fapt的制备,为进一步解决一步法自动化合成[x
n+
]nota
‑
fapt及其类似物探针[x
n+
]dota
‑
fapt奠定了基础。
[0081]
其次,进行探针的放射合成,其中,放射性金属核素x
n+
=
68
ga
3+
,[al
18
f]
2+
,64cu
2+
或其它放射性金属离子。以nota
‑
fapt为前体原料,分别与
68
ga
3+
、[al
18
f]
2+
、
64
cu
2+
或其它放射性金属离子反应,调节反应溶液至合适ph,完成
68
ga
3+
、[al
18
f]
2+
、
64
cu
2+
或其他金属离子的螯合反应后,经小柱分离纯化,即可制成[x
n+
]nota
‑
fapt探针;以dota
‑
fapt为前体原料,分别与
68
ga
3+
、
64
cu
2+
、
177
lu等发生螯合反应并经小柱分离纯化,制成靶向fap探针[x
n+
]dota
‑
fapt。
[0082]
在一个优选的实施例中,以nota
‑
fapt(r=2
‑
乙酰氨基
‑2‑
脱氧
‑
β
‑
d
‑
吡喃葡萄糖胺基)为前体原料,在弱酸性(ph 3.5
‑
4.5)和85
‑
110℃条件下,优选条件在ph 4.0和100℃时,与
68
gacl3发生螯合反应后,经sep
‑
pak plus c18小柱或hlb小柱分离纯化,可制备[
68
ga]nota
‑
fapt注射液,合成反应如合成路线1所示。
[0083][0084][0085]
在一个优选的实施例中,以nota
‑
fapt为前体原料,在弱酸性(ph 3.6
‑
4.4)和85
‑
100℃条件下,优选条件在ph4.0和95℃时,与al
18
f发生螯合反应后,经sep
‑
pak plus c18小柱或hlb小柱分离纯化,可获得[
18
f]alf
‑
nota
‑
fapt注射液,合成反应如合成路线2所示。
[0086][0087]
进一步的,在另外一个优选的实施例中,以nota
‑
fapt为前体原料,在弱酸性(ph 5.0
‑
6.5)和25
‑
90℃条件下,优选条件在ph5.6和80℃时,与
64
cucl2发生螯合反应后,经sep
‑
pak plus c18小柱或hlb小柱分离纯化,可获得[
64
cu]alf
‑
nota
‑
fapt注射液,合成反应如合成路线3所示。
[0088][0089]
以下结合具体实施例对本发明的fap探针及其制备方法与应用进行详细描述说明。
[0090]
实施例1前体nota
‑
fapt的制备
[0091]
前体原料nota
‑
fapt(r=2
‑
乙酰氨基
‑2‑
脱氧
‑
β
‑
d
‑
吡喃葡萄糖胺基)用以下方法制备:
[0092]
fap药效基团配体修饰
‑
peg2后形成fap药效基团配体
‑
peg2,再由fap药效基团配体
‑
peg2修饰asp2、glu及2
‑
乙酰氨基
‑2‑
脱氧
‑
β
‑
d
‑
吡喃葡萄糖胺基配体后,最后与
‑
nota结合,生成nota
‑
fapt,用制备型hplc分离纯化收集产品峰,即可获得纯化前体产品nota
‑
fapt。
[0093]
nota
‑
fapt化学产率较高,纯度大于95%。nota
‑
fapt的hplc和ms测定结果分别见图1a和图1b所示,质谱ms(m/z)测定nota
‑
fapt分子量(mr.)为1478.48。
[0094]
前体原料dota
‑
fapt(r=2
‑
乙酰氨基
‑2‑
脱氧
‑
β
‑
d
‑
吡喃葡萄糖胺基,或葡萄糖胺基)以及nota
‑
fapt(r=葡萄糖胺基)按上述类似方法反应制备,产品经hplc和ms测定。
[0095]
实施例2[
18
f]alf
‑
nota
‑
fapt的放射合成
[0096]
在装有nota
‑
fapt(r=2
‑
乙酰氨基
‑2‑
脱氧
‑
β
‑
d
‑
吡喃葡萄糖胺基)(50μg/μl,50μl)的反应瓶中,依次加入2mm alcl3溶液6μl、冰醋酸5μl和乙腈300μl,混匀。由回旋加速器通过
18
o(p,n)
18
f核反应生产的
18
f
‑
,在n2载带下,捕集在sep
‑
pak qma阴离子小柱中,
18
o
‑
水被收集在回收瓶中。用生理盐水(或醋酸钠缓冲液)0.3~0.4ml将阴离子(qma)小柱中
18
f
‑
洗脱入小瓶中,取其中50μl加入上述反应瓶中。搅拌混匀后,100℃加热反应10~15min左右。冷却,加水6~8ml到反应瓶中,混匀,转移至hlb小柱或sep
‑
pak c18小柱中。反应瓶中溶液全部转移完后,用10ml
×
3注射用水冲洗小柱,吹干小柱。最后,用乙醇1.5ml洗脱产品经无菌滤膜后收集在接收瓶中,用生理盐水将其稀释成含5%乙醇的产品溶液,得到符合要求的[
18
f]alf
‑
nota
‑
fapt(r=2
‑
乙酰氨基
‑2‑
脱氧
‑
β
‑
d
‑
吡喃葡萄糖胺基)注射液。[
18
f]alf
‑
nota
‑
fapt未校正放射化学产率为10~30%,总放射合成时间为35min。
[0097]
[
18
f]alf标记nota
‑
fapt(r=葡萄糖胺基)可参照上述类似方法制备。
[0098]
实施例3[
68
ga]nota
‑
fapt和[
64
cu]nota
‑
fapt的放射合成
[0099]
在含前体nota
‑
fapt(r=2
‑
乙酰氨基
‑2‑
脱氧
‑
β
‑
d
‑
吡喃葡萄糖胺基)(50μg/μl)50μl的反应管中加入1.25m乙酸钠溶液200μl。从
68
ge/
68
ga发生器中用0.05m盐酸4ml洗脱
68
gacl3至上述反应管中,混匀,调溶液ph至4.0,100℃加热反应10~15min左右。冷却,加入生理盐水4ml到反应瓶中,混匀,转移至hlb小柱或sep
‑
pak c18小柱中。待反应瓶中溶液全部转移完后,用10ml
×
2注射用水冲洗小柱,吹干小柱。然后,用乙醇1.5ml洗脱产品并经无菌滤膜后收集到接收瓶中,用生理盐水将其稀释成含5%乙醇的产品溶液,得到符合要求的[
68
ga]nota
‑
fapt(r=2
‑
乙酰氨基
‑2‑
脱氧
‑
β
‑
d
‑
吡喃葡萄糖胺基)注射液。[
68
ga]nota
‑
fapt未校正放射化学产率为20~50%,总放射合成时间为30min。
[0100]
在反应管中依次加入nota
‑
fapt(r=2
‑
乙酰氨基
‑2‑
脱氧
‑
β
‑
d
‑
吡喃葡萄糖胺基)(50μg/μl)100μl和
64
cucl2溶液0.100
‑
1.000ml,用乙酸钠溶液调至ph 4.0
‑
5.6,室温或反应10~15min。最后用生理盐水稀释并经无菌滤膜过滤后收集到接收瓶中,得到符合要求的[
64
cu]nota
‑
fapt(r=2
‑
乙酰氨基
‑2‑
脱氧
‑
β
‑
d
‑
吡喃葡萄糖胺基)注射液。[
64
cu]nota
‑
fapt未校正放射化学产率为50~70%。
[0101]
68
ga和
64
cu标记nota
‑
fapt(r=葡萄糖胺基)可参照以上类似方法制备。
[0102]
实施例4[
68
ga]dota
‑
fapt和[
64
cu]dota
‑
fapt的放射合成
[0103]
在反应管中依次加入dota
‑
fapt(r=2
‑
乙酰氨基
‑2‑
脱氧
‑
β
‑
d
‑
吡喃葡萄糖胺基)(50μg/μl)50μl和1.25m乙酸钠溶液200μl。从
68
ge/
68
ga发生器中用0.05m盐酸4ml洗脱
68
gacl3至上述反应管中,混匀,调溶液ph至4.0,100℃加热反应10min。冷却,加入生理盐水4ml到反应瓶中,混匀,转移至hlb小柱中。待反应瓶中溶液全部转移完后,用10ml
×
2注射用水冲洗小柱,吹干小柱。然后,用乙醇1.5洗脱产品并经无菌滤膜后收集到接收瓶中,用生理盐水将其稀释成含5%乙醇的产品溶液,得符合要求的[
68
ga]dota
‑
fapt(r=2
‑
乙酰氨基
‑2‑
脱氧
‑
β
‑
d
‑
吡喃葡萄糖胺基)注射液。[
68
ga]dota
‑
fapt未校正放射化学产率为30~60%,总
放射合成时间约30min。
[0104]
在反应管中依次加入dota
‑
fapt(r=2
‑
乙酰氨基
‑2‑
脱氧
‑
β
‑
d
‑
吡喃葡萄糖胺基)(50μg/μl)100μl和
64
cucl2溶液0.100
‑
1.0ml,用乙酸钠溶液调至ph 4.0
‑
5.6,室温~90℃反应10~15min。最后用生理盐水稀释并经无菌滤膜过滤后收集到接收瓶中,得到符合要求的[
64
cu]dota
‑
fapt(r=2
‑
乙酰氨基
‑2‑
脱氧
‑
β
‑
d
‑
吡喃葡萄糖胺基)注射液。[
64
cu]dota
‑
fapt未校正放射化学产率为30~70%。
[0105]
68
ga和
64
cu标记dota
‑
fapt(r=葡萄糖胺基)可参照以上类似方法制备。此外,以dota
‑
fapt(r=2
‑
乙酰氨基
‑2‑
脱氧
‑
β
‑
d
‑
吡喃葡萄糖胺基,葡萄糖胺基)为前体,采用常规
177
lucl3标记法可制备合适产率的[
177
lu]dota
‑
fapt。
[0106]
实施例5产品放化纯度和稳定性的测定
[0107]
用放射性高效液相色谱(hplc)和薄层色谱法(tlc)测定药物注射液的放射化学纯度。hplc分析条件:分析柱为zorbax eclipse xdb
‑
c18柱。流动相为0.1%三氟乙酸(tfa)的乙腈溶液:0.1%tfa的水溶液,行梯度洗脱:0min时,含0.1%tfa的乙腈溶液/0.1%tfa的水溶液:10/90;逐渐升到10min时,0.1%tfa的乙腈溶液/0.1%tfa的水溶液:80/20。流速为1ml/min,紫外检测波长210nm和254nm。用确定结构的非放射性标准品[
19
f]alf
‑
nota
‑
fapt、[ga
3+
]nota
‑
fapt、[cu
2+
]nota
‑
fapt、[ga
3+
]dota
‑
fapt、[cu
2+
]dota
‑
fapt和[lu
3+
]dota
‑
fapt,分别与相应的放射性探针[
18
f]alf
‑
nota
‑
fapt、[
68
ga]nota
‑
fapt、[
64
cu]nota
‑
fapt、[
68
ga]dota
‑
fapt、[
64
cu]dota
‑
fapt和[
177
lu]dota
‑
fapt注射液共同注射到hplc中,或共同点样行tlc,以确定其保留时间(rt)或比移值rf是否一致,并证实制备探针的真实性。用hplc法测定其放射化学纯度均大于95%。其中,代表性例子[
18
f]alf
‑
nota
‑
fapt注射液放射性hplc分析结果示于图2a和图2b(放射峰和紫外峰保留时间分别为rt=8.38mi和rt=8.17),放射化学纯度大于95%。
[0108]
tlc法检测靶向成纤维细胞活化蛋白(fap)[x]nota
‑
fapt注射液的放射化学纯度。取一条硅胶板,放到屏蔽铅玻璃后面,用毛细管吸取少许放射性样品及其标准品(浓度0.5mg/ml),一同轻轻点在硅胶板上距离一头1.5cm处,用电吹风吹干。在层析缸内进行层析,展开剂为甲醇:1.0m乙酸铵=50:50(v/v),层析后用热空气吹干,采用放射性tlc扫描仪行薄层扫描。扫描后,用碘染色tlc板,检测放射性样品和标准品的比移值(rf)。代表性[
18
f]alf
‑
nota
‑
fapt注射液rf=0.45。
[0109]
hplc法检测体内外[x]nota
‑
fapt稳定性。代表性例子就是用hplc检测动物血清中和尿中[
18
f]alf
‑
nota
‑
fapt体内稳定性。[
18
f]alf
‑
nota
‑
fapt在血清中和尿中放化纯度示于图3a和图3b。由图3a和图3b可知道,在60min时,尿液中只出现单一主峰,没有检测到其它副峰,提示[
18
f]alf
‑
nota
‑
fapt在尿中1h内没有脱氟和分解现象发生(图3b);在血清中也未见明显的脱氟现象(图3a)。[
18
f]alf
‑
nota
‑
fapt在pbs缓冲液和体外血清中2h时放化纯度大于90%(见图4a和图4b所示),表明其体外稳定性良好。
[0110]
用同样方法检测其它[x
n+
]nota
‑
fapt体外稳定性,均只发现单一主峰。这些结果表明,其它[x
n+
]nota
‑
fapt在血清中较稳定。
[0111]
实施例6酯水分配系数测定实验
[0112]
分别取正辛醇和水3ml加入试管中,然后加入[
18
f]alf
‑
nota
‑
fapt药物,振摇,离心,取上下两层各100ul,分三管,使用伽马计数器测量放射性数值。经测定[
18
f]alf
‑
nota
‑
fapt脂水分配系数logp=
‑
1.85
±
0.07(n=4),[
18
f]fapi
‑
42log p=
‑
2.43
±
0.02(n=4)。结果显示,[
18
f]alf
‑
nota
‑
fapt具有明显亲水性,但其亲水性低于[
18
f]fapi
‑
42。
[0113]
实施例7体外细胞摄取与抑制实验
[0114]
fap高表达的a549
‑
fap摄取抑制实验。
[0115]
常规培养中科院上海细胞库的肿瘤细胞株a549,经转染处理得fap高表达的a549
‑
fap。取对数生长期的癌细胞,用0.25%的胰酶消化,pbs洗细胞两次;1000转/s离心5min,收集细胞,调整细胞密度约6
×
106/ml。于24孔板中每孔加入0.1ml细胞悬液,培养24h,待细胞贴壁后更换新鲜培养液并将其随机分为a、b、c、d、e五组,加入[
18
f]alf
‑
nota
‑
fapt后继续培养,抑制组同时加入fapi
‑
04抑制剂,于5min、15min、30min、60min、120min后分别用pbs洗3次,之后加入十二烷基硫酸钠使细胞脱落,收集每个孔的细胞,测定细胞的计数,细胞的计数即内摄入胞浆内的标记探针。
[0116]
细胞摄取与抑制实验结果:[
18
f]alf
‑
nota
‑
fapt在a549
‑
fap细胞中快速摄取,在60分钟时达到13.63
±
1.50%id/百万细胞,并且在120分钟时还能维持在16.33
±
0.55%id/百万细胞,在野生型a549细胞及a549
‑
fap细胞抑制组中,均表现为较低的摄取值,表明[
18
f]alf
‑
nota
‑
fapt在a549
‑
fap细胞中有相对较高的摄取且具有特异性(见图5所示)。
[0117]
fap高表达的293t
‑
fap摄取抑制实验。
[0118]
常规培养中科院上海细胞库的肿瘤细胞株293t,经转染处理得fap高表达的293t
‑
fap。取对数生长期的癌细胞,用0.25%的胰酶消化,pbs洗细胞两次;1000转/s离心5min,收集细胞,调整细胞密度约6
×
106/ml。于24孔板中每孔加入0.1ml细胞悬液,培养24h,待细胞贴壁后更换新鲜培养液并将其随机分为a、b、c、d、e五组,加入[
18
f]alf
‑
nota
‑
fapt后继续培养,抑制组同时加入fapi
‑
04抑制剂,于5min、15min、30min、60min、120min后分别用pbs洗3次,之后加入十二烷基硫酸钠使细胞脱落,收集每个孔的细胞,测定细胞的计数,细胞的计数即内摄入胞浆内的标记探针。
[0119]
细胞摄取实验结果:[
18
f]alf
‑
nota
‑
fapt在293t
‑
fap细胞中快速摄取,在60分钟时达到115.21
±
3.51%id/百万细胞,在抑制组中,表现为较低的摄取值,表明[
18
f]alf
‑
nota
‑
fapt在293t
‑
fap细胞中有相对较高的摄取且具有特异性(见图6所示)。
[0120]
亲和力测定。肿瘤细胞铺板:铺一个24孔板,三孔细胞一组,8组(见图7所示)。竞争抑制剂(nota
‑
fapi)的浓度分别为(0,10
‑5,10
‑6,10
‑7,10
‑8,10
‑9,10
‑
10
,10
‑
11
m)。将各个浓度的抑制剂溶于0.5ml培养基中,分别加入到各孔,之后向各孔中加入0.5ml的显像剂(0.5μci/0.5ml/孔)。37℃孵育1h后,用pbs洗三遍。用naoh的sds溶液消融细胞后用γ计数器测放射性。代表性的[
18
f]alf
‑
nota
‑
fapt竞争性结合实验结果见图8所示。[
18
f]alf
‑
nota
‑
fapt的ic50值为1.16nm,[
18
f]fapi
‑
42的ic50值为14nm,结果表明[
18
f]alf
‑
nota
‑
fapt具有更强的亲和力。
[0121]
实施例8[
18
f]alf
‑
nota
‑
fapt体内生物分布实验
[0122]
正常昆明小鼠体内[
18
f]alf
‑
nota
‑
fapt生物分布实验。6只昆明小鼠随机分成2组,每组3只,每只经尾静脉注射0.1
‑
0.2ml含20
‑
40μci[
18
f]alf
‑
nota
‑
fapt的溶液,于注射后30、60、90min移除眼球取血后处死小鼠。解剖取各感兴趣脏器(血液、脑、心脏、肺、肝、胆、肾、脾脏、胃、小肠、肌肉与股骨等组织)的组织样本,称重,测量其放射性计数,计算不同时间点每克组织放射性注射剂量的百分比(%id/g)。
[0123]
生物分布结果:[
18
f]alf
‑
nota
‑
fapt在健康昆明小鼠体内生物分布实验结果如图9a所示。结果表明在30min时股骨中存在最高放射性摄取,且随着时间的推移未见较大改变;血液和肾脏具有适度放射性摄取,肝和胆囊放射性摄取较低,但pet显像表明肾脏具有较高放射性摄取,这与动物pet显像结果不完全一致;其它脏器胃、脾、肺、心脏、脑、肌肉、肠放射性摄取均较低。
[0124]
[
18
f]fapi
‑
42在荷瘤模型体内生物分布示于图9b。结果表明,胆囊中具有最高放射性摄取,骨和肿瘤具有较高放射性摄取,肠道、肺、肾、肌肉和血液具有适度放射性摄取,其它组织器官放射性摄取较低。
[0125]
体内生物分布结果表明,[
18
f]alf
‑
nota
‑
fapt优于[
18
f]fapi
‑
42。具体的,[
68
ga]fapi
‑
04(
68
ga
‑
fapi
‑
04)[
18
f]fapi
‑
42(
18
f
‑
fapi
‑
42)和[
18
f]p
‑
fapi(
18
f
‑
p
‑
fapi)的结构式如下所示。
[0126][0127][0128]
[
68
ga]nota
‑
fapt在小鼠体内生物分布与[
18
f]alf
‑
nota
‑
fapt大致类似。但是,[
68
ga]fapi
‑
04和[
18
f]fapi
‑
42在肝胆系统和肠道系统中具有较高放射性摄取,在胰腺中具有不稳定放射性摄取。[
18
f]alf
‑
nota
‑
fapt和[
68
ga]nota
‑
fapt表现出与[
68
ga]fapi
‑
04和[
18
f]fapi
‑
42不完全一样的体内生物分布特点,前两者比后两者显示出更优药代动力学特性。
[0129]
实施例9模型动物pet显像实验
[0130]
micro
‑
pet/ct显像研究利用siemens inveon micro
‑
pet/ct(分辨率大约为1.4mm,孔径12cm,轴向视野12.7cm),采集工作站为inveon acquirision workplace(irw)
2.0,数据采集前建立新workflow(包含ct acquirsion,reconstruction,pet acquirision,pet histogram,pet recon.),受试裸鼠动物为经腋下移植a549fap肺腺癌细胞株,u87脑胶质瘤细胞株,a549肺腺癌细胞株等,制成裸鼠腋下肿瘤模型。经10%水合氯醛麻醉后行pet/ct扫描,采集显像剂[
18
f]alf
‑
nota
‑
fapt注射200μci后60分钟时的pet/ct图像(a549
‑
fap;u87;a549)。
[0131]
pet显像后处死模型动物解剖取肿瘤组织,经病理免疫组化结果证实:a549fap肺腺癌组织和u87脑胶质瘤组织为fap高表达,而a549肺腺癌组织为fap低表达或不表达。pet显像结果表明:[
18
f]alf
‑
nota
‑
fapt在a549fap肺腺癌模型中具有较高摄取,且抑制显像可见摄取明显下降,为特异性摄取(见图10所示);在u87脑胶质瘤模型中也具有较高摄取,且抑制显像可见摄取明显下降,为特异性摄取(见图11所示),而在a549野生型肺腺癌模型中则几乎没有摄取(见图12所示)。在同一模型中[
18
f]alf
‑
nota
‑
fapt(nota
‑
fapt)和[
18
f]fapi
‑
42(nota
‑
fapi
‑
42)pet显像结果比较示于图13a。在同一只u87瘤鼠模型中[
18
f]alf
‑
nota
‑
fapt与[
18
f]fapi
‑
42的对比显像结果显示:[
18
f]alf
‑
nota
‑
fapt的肿瘤摄取值在15min时升至接近6%id/g,至120min一直维持着比较高的摄取,而[
18
f]fapi
‑
42在10min时达到最高摄取值后开始出现下降,最后摄取值维持在3%id/g左右。
[0132]
可见,在肿瘤摄取方面,[
18
f]alf
‑
nota
‑
fapt明显优于[
18
f]fapi
‑
42。另外,在其他脏器的显像中,[
18
f]fapi
‑
42可见明显的胆囊摄取以及肠道摄取,而[
18
f]alf
‑
nota
‑
fapt图像中除了脊柱及关节的摄取稍高,胆囊及肠道均表现为低摄取(图13b)。
[0133]
此外,[
18
f]alf
‑
nota
‑
fapt在a549fap肺腺癌(见图14a、图14b和图14c所示)和u87脑胶质瘤模型(见图15a和图15b所示)中均具有较高摄取,从15分钟开始到120分钟,肿瘤一直维持着比较高的摄取。
[0134]
实施例10人体pet显像实验
[0135]
联影uexplorer pet/ct常规显像和重建方法:按照临床规范要求,患者静脉注射放射性显像剂后静息约60分钟,随后行pet/ct图像扫描采集。全身ct扫描的管电压为120kv,并采用自动毫安技术进行螺旋扫描。全身pet使用静态3d采集模式进行扫描,采集时间为5min/全身。采集数据经时间衰减校正与组织衰减校正后采用有序子集期望最大化算法(osem)与飞行时间技术(tof)进行图像重建,最终获得3d pet图像用于临床定量分析与诊断。
[0136]
健康志愿者[
18
f]alf
‑
nota
‑
fapt(
18
f
‑
alf
‑
fapt)和[
18
f]fapi
‑
42pet(
18
f
‑
alf
‑
fapi
‑
42)显像比较(见图16a、图16b和图16c)显示:[
68
ga]fapi
‑
04和[
18
f]fapi
‑
42在肝胆系统和肠道系统中具有较高放射性摄取,在胰腺中具有不稳定放射性摄取;而[
18
f]alf
‑
nota
‑
fapt在肝胆系统和肠道系统中具有很低放射性摄取,在胰腺中具有较高的稳定放射性摄取,且具有适度的血液放射性摄取;其它组织器官[
18
f]alf
‑
nota
‑
fapt和[
18
f]fapi
‑
42摄取大致类似。总之,[
18
f]alf
‑
nota
‑
fapt表现出与[
68
ga]fapi
‑
04和[
18
f]fapi
‑
42不完全一样的体内生物分布特点,[
18
f]alf
‑
nota
‑
fapt表现出更优药代动力学特性。
[0137]
患者[
18
f]alf
‑
nota
‑
fapt pet/ct显像示于图17a~图17c。由图17a~图17c可知,肺癌治疗后肿瘤残余(见图17a所示)、胃癌(见图17b所示)以及阑尾印戒细胞癌治疗后腹膜转移(见图17c所示),在pet/ct图像中均可看到肿瘤病灶有一定程度的摄取。
[0138]
[
18
f]alf
‑
nota
‑
fapt在脑胶质瘤、肺腺癌等多种实体瘤中均有较高摄取,可用于较
高表达fappet显像。本发明中[x
n+
]nota
‑
fapt类似物也可表现出与[
18
f]alf
‑
nota
‑
fapt相类似的生物学功能,在肿瘤和其它疾病pet显像中可发挥重要的临床诊断作用。尽管可能需要通过其结构优化,来进一步改善其药代动力学特性,但对本领域普通技术人员来说,可根据上述说明对其结构加以改进或变换,而所有这些改进和变换都应属于本发明所附权利要求的保护范围。
[0139]
以上所述实施例的各技术特征可以进行任意的组合,本说明书为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述。然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。而且,以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1