一种显著提高羊栖菜多糖益生活性的方法
1.本发明属于羊栖菜深加工领域,具体涉及一种显著提高羊栖菜多糖益生活性的方法。
背景技术:
2.羊栖菜(sargassum fusiforme),隶属于褐藻门,墨角藻目,马尾藻科,马尾藻属,是一种暖温带一亚热带性海藻,主要生长在太平洋西北部,在我国沿海北自辽东半岛南到广东雷州半岛,日本(北海道南部、经本州至九州)和朝鲜沿岸(东岸、南岸及西南岸)。自古以来,它就被广泛认可为药食两用的食材,被记录于南齐陶弘景(公元452
‑
536)所著《神农本草经》中,羊栖菜“性味苦,咸,寒,具软坚散结,利水消肿,泻热化痰”功能。现代研究表明,羊栖菜主要含有水分、碳水化合物、蛋白、脂肪和一些微量元素,是一种高纤维、低蛋白、低脂肪的健康食物,因此素来就有“长寿菜”的美誉。其中多糖是羊栖菜的一个重要活性成分,通过研究羊栖菜多糖的提取工艺、挖掘羊栖菜多糖的活性功能价值可以为羊栖菜资源的进一步开发利用提供理论依据,有助于我国的羊栖菜产业升级。
3.专利申请cn201710544846.5公开了一种羊栖菜水溶性多糖的制备方法,对羊栖菜进行超声浸取,利用活性肽和低盐溶液,结合溶胀法和超声波法进行细胞破碎,大大缩短了提取时间,提取效果好,提高了多糖的得率和抗氧化、抗凝血、抗炎、抗癌、抗肿瘤、免疫调节等生物学功能,但存在操作步骤繁杂、提取成本高等问题。专利cn201910820755.9公开了一种褐藻多糖脱色脱蛋白的方法,即紫外(uv)结合过氧化氢(h2o2)法,过程中不使用酸、碱和有机溶剂,绿色无污染,操作简单、安全、经济、省时,但是所得多糖活性不明确。专利申请cn202011178210.1公开了一种羊栖菜多糖及其提取方法,该提取方法通过利用超声辅助热水的方法提取羊栖菜多糖,并采用响应面法优化热水提取时间、超声时间、超声功率及料液比等工艺参数,使得粗多糖得率26%,但是同样所得多糖活性不明确,应用价值有限。
4.本发明采用超声辅助热水提取,获得主要含岩藻糖、半乳糖和甘露糖且分子量为100
‑
300kda的羊栖菜多糖;结合uv/h2o2的进一步处理制备改性的羊栖菜多糖,操作过程简单高效、经济环保。本发明的方法显著提高了羊栖菜多糖的益生活性,具有良好的应用价值。
技术实现要素:
5.为了克服现有技术的缺点和不足,本发明的目的在于提供一种显著提高羊栖菜多糖益生活性的方法。本发明采用uv/h2o2的方法处理分子量为100
‑
300kda且单糖组成为岩藻糖、半乳糖、甘露糖、葡萄糖和木糖的摩尔比为(50~61):(21~32):(11~16):(1~5):(1~4)的羊栖菜多糖,显著提高了羊栖菜多糖的益生活性。本发明的羊栖菜多糖用来制备益生活性的食品或健康产品。
6.本发明目的是通过以下技术方案实现:
7.一种显著提高羊栖菜多糖益生活性的方法,包括以下步骤:
8.1)将羊栖菜粉进行脱脂脱色,获得脱脂脱色的羊栖菜粉;
9.2)将脱脂脱色的羊栖菜粉通过超声辅助热水提取,获得羊栖菜多糖;
10.3)uv/h2o2处理:将羊栖菜多糖、水以及h2o2混合,获得混合液,混合液中羊栖菜多糖的终浓度为2
‑
25mg/ml,h2o2的终浓度为10
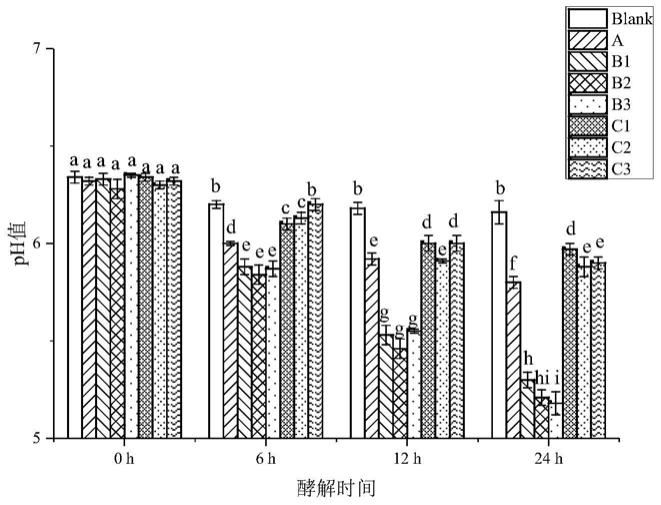
‑
200mmol/l;将混合液进行紫外辐照处理,平均辐照量为1000
‑
10000mj/cm2,辐照时间为5
‑
200min,得到改性的羊栖菜多糖即益生活性高的羊栖菜多糖;
11.步骤2)中所述羊栖菜多糖的分子量为100
‑
300kda且单糖组成为岩藻糖、半乳糖、甘露糖、葡萄糖和木糖,岩藻糖、半乳糖、甘露糖、葡萄糖和木糖的摩尔比为(50~61):(21~32):(11~16):(1~5):(1~4),各单糖总量满足100%。
12.步骤2)的具体步骤为将脱脂脱色的羊栖菜粉与水混合,超声处理,热水提取,离心,醇沉,复溶,干燥,获得羊栖菜多糖。
13.所述脱脂脱色的羊栖菜粉与水的质量体积比为1g:(25
‑
50)ml;所述超声处理的条件:超声功率200
‑
800w,超声处理的温度20
‑
70℃,超声处理的时间20
‑
60min。所述热水提取的条件为在80
‑
100℃提取2
‑
5h。
14.所述醇沉的沉淀剂为乙醇溶液,在醇沉时乙醇的终浓度为80%;醇沉后,将沉淀于室温下挥干乙醇;加入水复溶,真空冷冻干燥。
15.步骤1)的具体步骤为将羊栖菜粉碎和超微粉碎,采用乙醇溶液回流处理,将沉淀烘干。所述乙醇溶液的体积浓度为95%。回流处理的次数为1
‑
4次,回流处理的总时间为2
‑
6h。
16.所述超微粉碎的时间2.5
‑
20min。
17.步骤3)中辐照完成后,透析,干燥。
18.紫外辐照处理时平均辐照量为5000
‑
8000mj/cm2。
19.本发明具有以下优点和有益效果:
20.本发明的方法操作简单,安全高效、经济环保;本发明采用超声辅助提取羊栖菜多糖并结合uv/h2o2处理,获得改性羊栖菜多糖,该多糖在体外酵解过程中能显著地被微生物所利用,降低培养基ph值,促进微生物产生短链脂肪酸。此发明方法显著提高了羊栖菜多糖的益生活性。
附图说明
21.图1为不同酵解时间段各组培养基ph值变化图;a:实施例1,b1:实施例2,b2:实施例3,b3:实施例4,c1:对比例1,c2:对比例2,c3:对比例3;blank表示的是空白组;
22.图2为不同酵解时间段各组中碳水化合物的含量图;a:实施例1,b1:实施例2,b2:实施例3,b3:实施例4,c1:对比例1,c2:对比例2,c3:对比例3;
23.图3为不同酵解时间段中各组中总短链脂肪酸的含量图;a:实施例1,b1:实施例2,b2:实施例3,b3:实施例4,c1:对比例1,c2:对比例2,c3:对比例3;blank表示的是空白组,“a,b,c,d,e,f,g,h”表示组间有显著性差异(p<0.05)。
具体实施方式
24.下面结合具体实施例对本发明作进一步详细地描述,但本发明的实施方式不限于
此。
25.实施例1
26.按以下步骤通过超声辅助提取方法对羊栖菜多糖进行提取:
27.(1)洗净、烘干、粉碎后的羊栖菜经超微粉碎5min后,称取50g羊栖菜超微粉,加入200ml体积分数为95%乙醇,微沸状态下回流3次,共5h,以去除脂质、色素和小分子物质,然后离心收集沉淀并烘干。
28.(2)取预处理后羊栖菜超微粉,按料液比1:50(g/ml)的比例,加入纯水,在400w的超声功率下,25℃下超声处理30min,完成后继续于100℃下提取4h,提取液经离心取上清,将上清真空浓缩后缓慢加入95%乙醇至乙醇终体积浓度为80%,搅拌混匀,置于4℃下静置12h,离心弃上清,所得沉淀于室温下挥干乙醇,加入纯水复溶,真空冷冻干燥(冷冻干燥的温度为
‑
50~
‑
80℃),得羊栖菜多糖a。本实施例所得羊栖菜多糖的分子量为228.08kda,单糖组成摩尔比分别为岩藻糖(60.39%)、半乳糖(24.99%)、甘露糖(11.71%)、葡萄糖(1.17%)、木糖(1.74%)。
29.实施例2
30.按以下步骤通过超声辅助提取方法结合uv/h2o2法对羊栖菜多糖进行提取和处理:
31.(1)洗净、烘干、粉碎后的羊栖菜经超微粉碎5min后,称取50g羊栖菜超微粉,加入200ml体积分数为95%乙醇,微沸状态下回流3次,共5h,以去除脂质、色素和小分子物质,然后离心收集沉淀并烘干。
32.(2)取预处理后羊栖菜超微粉,按料液比1:50(g/ml)的比例,加入纯水,在400w的超声功率下,25℃下超声处理30min,完成后继续于100℃下提取4h,提取液经离心取上清,将上清真空浓缩后缓慢加入95%乙醇至乙醇终体积浓度为80%,搅拌混匀,置于4℃下静置过夜,离心弃上清,所得沉淀于室温下挥干乙醇,加入纯水复溶,真空冷冻干燥,得羊栖菜多糖。本实施例所得羊栖菜多糖的分子量为228.08kda,单糖组成摩尔比分别为岩藻糖(60.39%)、半乳糖(24.99%)、甘露糖(11.71%)、葡萄糖(1.17%)、木糖(1.74%)。
33.(3)取适量上述所得羊栖菜多糖,溶于纯水中,再加入适量h2o2,使得多糖终浓度为5.0mg/ml,h2o2终浓度为100mmol/l。然后将其置于紫外下以5000mj/cm2的辐照强度辐照处理5min,500da截留透析袋透析48h,冷冻干燥后得羊栖菜多糖b1。
34.实施例3
35.按以下步骤通过超声辅助提取方法结合uv/h2o2法对羊栖菜多糖进行提取和处理:
36.(1)洗净、烘干、粉碎后的羊栖菜经超微粉碎10min后,称取50g羊栖菜超微粉,加入200ml 95%乙醇,微沸状态下回流3次,共6h,以去除脂质、色素和小分子物质,然后离心收集沉淀并烘干。
37.(2)取预处理后羊栖菜超微粉,按料液比1:40(g/ml)的比例,加入纯水,在600w的超声功率下,50℃下超声处理40min,完成后继续于100℃下提取4h,提取液经离心取上清,将上清真空浓缩后缓慢加入95%乙醇至乙醇终体积浓度为80%,搅拌混匀,置于4℃下静置过夜,次日离心弃上清,所得沉淀于室温下挥干乙醇,加入纯水复溶,真空冷冻干燥,得羊栖菜多糖。本实施例所得羊栖菜多糖的分子量为201.23kda,单糖组成摩尔比分别为岩藻糖(58.00%)、半乳糖(21.57%)、甘露糖(15.44%)、葡萄糖(1.16%)、木糖(3.83%)。
38.(3)取适量上述所得羊栖菜多糖,溶于纯水中,再加入适量h2o2,使得多糖终浓度为
10mg/ml,h2o2终浓度为150mmol/l。然后将其置于紫外下以6000mj/cm2的辐照强度辐照处理30min,500da截留透析袋透析48h,冷冻干燥后得羊栖菜多糖b2。
39.实施例4
40.按以下步骤通过超声辅助提取方法结合uv/h2o2法对羊栖菜多糖进行提取和处理:
41.(1)洗净、烘干、粉碎后的羊栖菜经超微粉碎15min后,称取50g羊栖菜超微粉,加入200ml 95%乙醇,微沸状态下回流3次,共5h,以去除脂质、色素和小分子物质,然后离心收集沉淀并烘干。
42.(2)取预处理后羊栖菜超微粉,按料液比1:30(g/ml)的比例,加入纯水,在800w的超声功率下,50℃下超声处理60min,完成后继续于100℃下提取4h,提取液经离心取上清,将上清真空浓缩后缓慢加入体积分数为95%乙醇溶液至乙醇终体积浓度为80%,搅拌混匀,置于4℃下静置过夜,次日离心弃上清,所得沉淀于室温下挥干乙醇,加入纯水复溶,真空冷冻干燥,得羊栖菜多糖。本实施例所得羊栖菜多糖的分子量为198.67kda,单糖组成摩尔比分别为岩藻糖(50.58%)、半乳糖(31.29%)、甘露糖(11.61%)、葡萄糖(4.79%)、木糖(1.82%)
43.(3)取适量上述所得羊栖菜多糖,溶于纯水中,再加入适量h2o2,使得多糖终浓度为20mg/ml,h2o2终浓度为150mmol/l。然后将其置于紫外下以6500mj/cm2的辐照强度辐照处理60min,500da截留透析袋透析48h,冷冻干燥后得羊栖菜多糖b3。
44.对比例1
45.按以下步骤通过传统热水提取法对羊栖菜多糖进行提取:
46.(1)洗净、烘干、粉碎后的羊栖菜经超微粉碎15min后,称取50g羊栖菜超微粉,加入200ml 95%乙醇,微沸状态下回流3次,共5h,以去除脂质、色素和小分子物质,然后离心收集沉淀并烘干。
47.(2)取预处理后羊栖菜超微粉,按料液比1:30(g/ml)的比例加入纯水,于100℃下提取4h,提取液经离心取上清,将上清真空浓缩后缓慢加入95%乙醇至乙醇终体积浓度为80%,搅拌混匀,置于4℃下静置过夜,离心弃上清,所得沉淀于室温下挥干乙醇,加入纯水复溶,真空冷冻干燥,得羊栖菜多糖c1。
48.对比例2
49.按以下步骤通过传统热水提取法结合uv/h2o2法对羊栖菜多糖进行提取和处理:
50.(1)洗净、烘干、粉碎后的羊栖菜经超微粉碎15min后,称取50g羊栖菜超微粉,加入200ml体积分数为95%乙醇溶液,微沸状态下回流3次,共5h,以去除脂质、色素和小分子物质,然后离心收集沉淀并烘干。
51.(2)取预处理后羊栖菜超微粉,按料液比1:30(g/ml)的比例加入纯水,于100℃下提取4h,提取液经离心取上清,将上清真空浓缩后缓慢加入体积分数为95%乙醇溶液至乙醇终体积浓度为80%,搅拌混匀,置于4℃下静置过夜,离心弃上清,所得沉淀于室温下挥干乙醇,加入纯水复溶,真空冷冻干燥,得羊栖菜多糖。
52.(3)取适量上述所得羊栖菜多糖,溶于纯水中,再加入适量h2o2,使得多糖终浓度为15mg/ml,h2o2终浓度为100mmol/l。然后将其置于紫外下以5000mj/cm2的辐照强度辐照处理60min,500da截留透析袋透析48h,冷冻干燥后得羊栖菜多糖c2。
53.对比例3
54.按以下步骤通过超声辅助提取方法结合uv/h2o2法对龙须菜多糖进行提取和处理:
55.(1)洗净、烘干、粉碎后的龙须菜经超微粉碎5min后,称取50g羊栖菜超微粉,加入200ml体积分数为95%乙醇溶液,微沸状态下回流3次,共5h,以去除脂质、色素和小分子物质,然后离心收集沉淀并烘干。
56.(2)取预处理后龙须菜超微粉,按料液比1:50(g/ml)的比例,加入纯水,在400w的超声功率下,25℃下超声处理40min,完成后继续于100℃下提取4h,提取液经离心取上清,将上清真空浓缩后缓慢加入体积分数为95%乙醇溶液至乙醇终体积浓度为80%,搅拌混匀,置于4℃下静置过夜,离心弃上清,所得沉淀于室温下挥干乙醇,加入纯水复溶,真空冷冻干燥,得龙须菜多糖。
57.(3)取适量上述所得龙须菜多糖,溶于纯水中,再加入适量h2o2,使得多糖终浓度为10mg/ml,h2o2终浓度为100mmol/l。然后将其置于紫外下以5000mj/cm2的辐照强度辐照处理5min,500da截留透析袋透析48h,冷冻干燥后得龙须菜多糖c3。
58.效果验证
59.体外人体粪便菌群酵解是目前衡量样品益生活性的常用方法之一,通过测定酵解产物的ph值变化、碳水化合物含量和短链脂肪酸的生成,可以衡量粪便微生物是否可以利用待测样品代谢产生酸性代谢产物,降低肠道环境ph值,从而抑制有害菌的繁殖生长,维持肠道稳态,提高肠道健康活力。本实施例选择实施例1、2、3和4方法制得的羊栖菜多糖a、b1、b2和b3与对比例1(传统热水提取法)所得羊栖菜多糖c1、对比例2(传统热水提取结合uv/h2o2处理法)所得羊栖菜多糖c2和对比例3(超声辅助提取结合uv/h2o2法)所得龙须菜多糖c3采用体外肠道菌群酵解实验进行了益生活性对比:
60.(1)人体粪便混合物的制备
61.d
‑
pbs的配制:将100.0mg无水氯化钙,100.0mg六水合硫酸镁,200.0mg氯化钾,200.0mg磷酸二氢钾,8.0g氯化钠,2.886g十二水合磷酸氢二钠,溶于1.0l蒸馏水中,在121℃条件下灭菌15分钟,备用。
62.筛选出四位具有良好的饮食作息习惯、且胃肠道健康三个月内未服用抗生素类药物的志愿者(两男两女,年龄在20
‑
30岁之间)。在同一时间点,向4位健康的志愿者取一定量的新鲜粪便,混合后立刻加入到配制的dpbs溶液中,配制成20%(w/v)的固液混合物,搅拌均匀,用两层纱布过滤,收集滤液,备用。
63.(2)羊栖菜多糖体外酵解
64.酵解培养基的制备:5.0g蛋白胨,5.0g胰蛋白胨,4.5g酵母提取物,4.5g nacl,4.5g kcl,2.0g果胶,4.0g粘蛋白,3.0g酪蛋白,2.0g阿拉伯半乳聚糖,1.5g nahco3,0.69g mgso4·
h2o,1.0g瓜尔胶,0.8g l
‑
半胱氨酸hcl
·
h2o,0.5g kh2po4,0.5g k2hpo4,0.4g胆盐,0.08g cacl2,0.005g feso4·
7h2o,1.0ml吐温80和4.0ml刃天青溶液(0.025%w/v)作为厌氧指示剂,用蒸馏水定容于1.0l容量瓶中。在使用前将生长培养基在121℃下灭菌15min,备用。
65.将实施例所得羊栖菜多糖a、b1、b2和b3以及对比例所得多糖c进行体外酵解,按40%人体粪便液、40%发酵培养基、20%多糖的酵解体系将4ml多糖溶液(25mg/ml)、8ml发酵培养基、8ml粪便溶液于三角瓶中,以无菌蒸馏水作为空白对照组,每组设置3个平行进行厌氧培养。
66.(3)ph值测定
67.在酵解0、6、12、24h时,从多糖组和空白组中分别取样至测试管中,并置于冰水浴中,保持20min,停止多糖发酵,然后6000r/min高速离心6min,取上清液,测定ph值。
68.(4)碳水化合物消耗量测定
69.量取(3)中的上清液,按照苯酚硫酸法分别检测多糖组和空白组酵解液中的总糖含量。最终总糖含量=多糖组总糖含量
‑
空白组总糖含量。以发酵0h时各组的总糖含量为100%。
70.(5)短链脂肪酸测定
71.利用气相色谱gc方法测定酵解产物中的短链脂肪酸含量。标准曲线的制作:分别准确配制不同浓度乙酸、丙酸、丁酸和戊酸混合标准样品液,用0.45μm微孔滤膜过滤后,进行gc分析,以scfa(mm)浓度为横坐标,出峰面积为纵坐标,绘制标准曲线,得到scfa标准品的回归方程和相关系数。
72.色谱条件为:agilent 6890n气相色谱和ae
‑
ffap(30m
×
250μm
×
0.25μm)色谱柱。gc分析条件:fid检测器,载气为n2;n2的流速为0.8ml/min,分流比为1:10。空气的流速为400ml/min,h2的流速为40ml/min;检测器温度为280℃,进样口温度为250℃;升温程序为100℃保持1min,以15℃/min升至180℃,再以10℃/min升至220℃。样品进样量为0.2μl,每个样品均进行3次独立重复测定。恒压:11psi。
73.将酵解培养基在12000r/min下离心5min,上清液用0.45μm微孔滤膜过滤后,气相色谱上样进行分析,条件参数同上,根据线性回归方程计算其浓度。
74.图1为不同酵解时间段各组培养基ph值变化图;a:实施例1,b1:实施例2,b2:实施例3,b3:实施例4,c1:对比例1,c2:对比例2,c3:对比例3;blank表示的是空白组。
75.图2为不同酵解时间段各组中碳水化合物的含量图;a:实施例1,b1:实施例2,b2:实施例3,b3:实施例4,c1:对比例1,c2:对比例2,c3:对比例3。
76.图3为不同酵解时间段中各组中总短链脂肪酸的含量图;a:实施例1,b1:实施例2,b2:实施例3,b3:实施例4,c1:对比例1,c2:对比例2,c3:对比例3;blank表示的是空白组,“a,b,c,d,e,f,g,h”表示组间有显著性差异(p<0.05)。
77.由图1可知,发酵24h后,与blank组相比,超声辅助提取方法结合uv/h2o2法得到的羊栖菜多糖b1、b2和b3组的ph值下降剧烈,都下降了1.0左右;而仅用超声辅助提取方法得到的羊栖菜多糖a组和对比例所得多糖c1、c2和c3组的ph值只分别下降了0.4
‑
0.5。说明b1、b2和b3组相比于a、c1、c2和c3组的微生物产生了更多酸性物质,从而使ph值下降更为剧烈。从碳水化合物的消耗(图2)和总短链脂肪酸的生成(图3)来看,这个结果得到了进一步验证。发酵24h后,b1、b2和b3组的碳水化合物消耗量分别达到了52%,56%和57%,而a、c1、c2和c3组仅消耗了17%
‑
30%的碳水化合物;b1、b2和b3组中的总短链脂肪酸分别达到了129.68、130.54和138.78mmol/l,显著高于blank组(56.67mmol/l)、a(78.21mmol/l)、c1(60.32mmol/l)、c2(70.32mmol/l)和c3组(76.45mmol/l)。可知,采用本发明所述方法得到的羊栖菜多糖b1、b2和b3在肠道菌群酵解实验中都具有更显著的活性。综上说明,超声辅助提取方法结合uv/h2o2处理法是一种能显著提高羊栖菜多糖益生活性的制备方法。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1