一种含硼有机自由基化合物及其制备方法与应用
1.本发明属于有机自由基化合物技术领域,具体涉及一种含硼有机自由基化合物及其制备方法与应用。
背景技术:
2.有机自由基化合物是指存在一个或多个未成对电子的分子或离子。由于未成对电子的存在,这类化合物往往展现出独特的电子结构和物理化学性质。一方面,分子轨道中的未成对电子使其具有红外/近红外吸光性质、自旋磁性、电荷传输能力等,赋予其作为光、电、磁功能材料的巨大潜力;另一方面,未成对电子带来的高反应活性,使自由基易分解或与环境中的水、氧等发生反应,降低其化学稳定性。因此,有机自由基化合物的稳定策略、合成方法和功能材料一直是领域研究的热点。
3.有机双自由基化合物,是指存在两个未成对电子的分子或离子,未配对的两个电子也可以通过电子离域进行成键,在双自由基态和完全成键态之间形成“共振混合”态。因此,有机双自由基分子不仅有基于自由基的物化性质,而且在实现化学稳定性方面具有显著优势,使得其在有机电子材料、有机自旋材料等领域备受关注。在分子设计层面,为获得稳定的双自由基分子,通常采用大的共轭骨架使自由基充分离域,采用大空间位阻基团对电子自旋密度集中处加以保护。但是,此类策略带来了诸多合成上的挑战,限制了有机双自由基化合物的新功能探索和新材料构建,成为领域发展的瓶颈问题。
4.我们设计并合成了一种含硼有机双自由基化合物,即在稠合茚并芴共轭骨架上引入硼原子并进行结构拓展,通过引入硼原子进行稳定双自由基,并且调控分子的电子结构和性质。我们制备的这种含硼有机双自由基分子具有良好的化学稳定性,展现出低单
‑
三线态能差、近红外光吸收、磁学性能等性质,在有机自旋电子器件、双极性有机场效应晶体管、近红外染料等领域具有良好的应用潜力。
技术实现要素:
5.有鉴于此,为解决现有技术中稳定的有机自由基化合物数量较少、合成难度大、调节自由基特性的手段有限等技术问题,本发明提供一种含硼有机自由基化合物及其制备方法与应用。
6.本发明解决上述技术问题采取的技术方案如下。
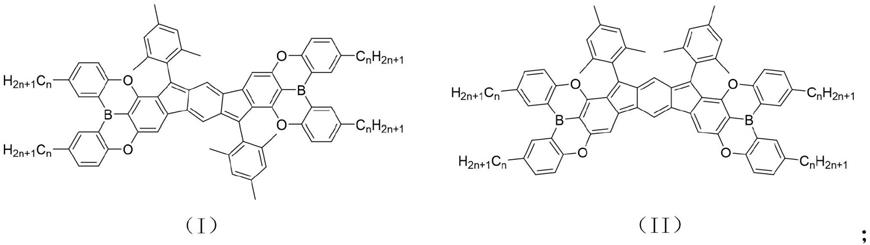
7.本发明提供一种含硼有机自由基化合物,化学结构式如式(ⅰ)或式(ⅱ)所示:
[0008][0009]
所述式(ⅰ)和式(ⅱ)中,n分别独立的为1~6的整数。
[0010]
本发明还提供上述含硼有机自由基化合物的制备方法:惰性气氛保护下,将待氧化前体溶解在有机溶剂中,再加入2,3
‑
二氯
‑
5,6
‑
二氰基
‑
1,4
‑
苯醌,在加热条件下发生氧化反应,反应结束后,冷却,经柱层析、重结晶提纯,得到含硼有机自由基化合物;
[0011]
所述待氧化前体的化学结构式如式(iii)或式(iv)所示:
[0012][0013]
所述式(iii)和式(iv)中,n分别独立的为1~6的整数。
[0014]
优选的是,所述有机溶剂为甲苯或二甲苯。
[0015]
优选的是,所述待氧化前体、2,3
‑
二氯
‑
5,6
‑
二氰基
‑
1,4
‑
苯醌的物质的量比为1:(1~2)。
[0016]
优选的是,所述氧化反应的反应温度为50~100℃,反应时间为0.5~1.5h。
[0017]
本发明还提供上述含硼有机自由基化合物在制备有机电子自旋器件、双极性有机场效应晶体管或近红外染料中的应用。
[0018]
与现有技术相比,本发明的有益效果为:
[0019]
1、本发明利用茚并芴单元设计含硼有机自由基化合物,可获得明显的单线态双自由基结构;分子骨架上自旋密度集中处使用均三甲基苯基作为空间位阻进行保护,可增加自由基分子的稳定性;硼原子的引入可以稳定双自由基并且调节分子的电子分布、能级结构等性质;烷基链的引入和碳数增加显著提升了分子的溶解度,经检测,当n=0时,含硼有机自由基化合物在二氯甲烷中的溶解度为~0.2mg ml
‑1;当n=2时,含硼有机自由基化合物在二氯甲烷中的溶解度为~1mg ml
‑1;当n=4时,含硼有机自由基化合物在二氯甲烷中的溶解度大于3mg ml
‑1。
[0020]
2、本发明的含硼有机自由基化合物,在多种溶剂中具有良好的溶解度,当n≥2时,所述的含硼有机自由基化合物在二氯甲烷、氯仿、甲苯、四氢呋喃中的溶解度均大于1mg ml
‑1,为溶液加工和器件组装提供便利。
[0021]
3、本发明的含硼有机自由基化合物,具有空气稳定性,经检测,稀溶液的吸收光谱在空气中保持12h无变化,为实际应用提供可能。
[0022]
4、本发明的含硼有机自由基化合物,合成方法常规易操作,产率合理,提纯工艺便捷,有利于大量合成。
[0023]
5、经过实验检测,本发明合成的含硼有机自由基化合物,具有近红外光吸收性质,有制备近红外染料的潜力;本发明合成的含硼有机自由基化合物具有窄带隙特征,且能级分布可以提供双极性传输性质,有制备双极性有机场效应晶体管器件的潜力;本发明合成的含硼有机自由基化合物,显现出明显的顺磁性质,有制备有机电子自旋器件的潜力。
附图说明
[0024]
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
[0025]
图1为本发明实施例1的含硼有机自由基化合物(产物6)的紫外可见吸收光谱;
[0026]
图2为本发明实施例3的含硼有机自由基化合物(产物15)的紫外可见吸收光谱;
[0027]
图3为本发明实施例1的含硼有机自由基化合物(产物6)的稀溶液(1
×
10
‑5m)的空气稳定性测试图谱;
[0028]
图4为本发明实施例3的含硼有机自由基化合物(产物15)的稀溶液(1
×
10
‑5m)的空气稳定性测试图谱;
[0029]
图5为本发明实施例1的含硼有机自由基化合物(产物6)的电化学测试循环伏安曲线;
[0030]
图6为本发明实施例3的含硼有机自由基化合物(产物15)的电化学测试循环伏安曲线;
[0031]
图7为本发明实施例1的含硼有机自由基化合物(产物6)的变温电子自旋共振测试图谱;
[0032]
图8为本发明实施例3的含硼有机自由基化合物(产物15)的变温电子自旋共振测试图谱。
具体实施方式
[0033]
为了进一步说明本发明,下面结合具体实施方式对本发明的优选实施方案进行描述,但是应当理解,这些描述只是为进一步说明本发明的特征和优点而不是对本发明专利要求的限制。
[0034]
本发明的含硼有机自由基化合物,其化学结构式如式(ⅰ)或式(ⅱ)所示:
[0035]
[0036]
式(ⅰ)和式(ⅱ)中,n分别独立的为1~6的整数。
[0037]
本发明的含硼有机自由基化合物的制备方法,惰性气体(一般采用氩气)保护下,将待氧化前体溶解在甲苯或二甲苯中,再加入2,3
‑
二氯
‑
5,6
‑
二氰基
‑
1,4
‑
苯醌的甲苯或二甲苯溶液,待氧化前体、2,3
‑
二氯
‑
5,6
‑
二氰基
‑
1,4
‑
苯醌的物质的量比为1:(1~2),在50
‑
100℃加热条件下进行氧化反应,时长为0.5~1.5h,反应结束后,冷却,经柱层析、重结晶提纯,得到式(ⅰ)或式(ⅱ)所示的含硼有机自由基化合物。
[0038]
以结构式为式(ⅰ)的一个含硼有机自由基化合物为例,反应通式如下:
[0039][0040]
上述技术方案中,待氧化前体的化学结构式如式(iii)或式(iv)所示:
[0041][0042]
式(iii)和式(iv)中,n分别独立的为1~6的整数。
[0043]
本发明的含硼有机自由基化合物在制备有机电子自旋器件、双极性有机场效应晶体管或近红外染料中的应用。
[0044]
在本发明中所使用的术语,一般具有本领域普通技术人员通常理解的含义,除非另有说明。为了使本领域的技术人员更好地理解本发明的技术方案,下面将结合实施例对本发明作进一步的详细介绍。
[0045]
在以下实施例中,未详细描述的各种过程和方法是本领域中公知的常规方法。下述实施例中所用的材料、试剂、装置、仪器、设备等,如无特殊说明,均可从商业途径获得。
[0046]
实施例1
[0047]
含硼有机自由基化合物,结构式如下:
[0048][0049]
上述含硼有机自由基化合物的制备:
[0050]
步骤一、将2,5
‑
二溴
‑
1,3
‑
二氟苯(1g,36.8mmol)、4
‑
乙基苯酚(13.46g,
110.4mmol)和碳酸钾(15.26g,110.4mmol)投入干燥的带有冷凝管的反应瓶中,进行三次以上抽真空、通氩气的抽换气操作后,注入干燥的n,n
‑
二甲基甲酰胺溶剂(45ml)充分溶解,随后升温至170℃反应12h。得到的反应混合物用甲苯稀释后投入水中,甲苯(30ml)萃取水层三次,收集甲苯层并用无水硫酸钠干燥。减压除去甲苯后,硅胶柱层析(洗脱剂为石油醚:二氯甲烷=12:1)纯化,得到无色粉末,记作反应物1。产量15.21g,产率87%。
[0051]
对得到的分子1进行1h nmr和
13
c nmr分析。1h nmr(400mhz,cdcl3)δ7.22(d,j=8.4hz,4h),6.98(d,j=8.5hz,4h),6.69(s,2h),2.71
–
2.61(m,4h),1.26(t,6h).
13
c nmr(101mhz,cdcl3)δ156.83,153.54,129.42,119.39,115.93,105.00,28.28,15.74.
[0052][0053]
步骤二、将反应物1(500mg,1.05mmol)投入严格烘烤的带有冷凝管的反应瓶中,进行三次以上抽真空、通氩气的抽换气操作后,溶于5ml干燥的甲苯中。反应体系降温至
‑
78℃稳定片刻后,逐滴滴加正丁基锂溶液(1.6m,0.69ml,1.10mmol),反应10min。随后在
‑
78℃下逐滴滴加三溴化硼(0.12ml,1.26mmol),0℃下反应1h。将反应体系重新降温至
‑
30℃后,逐滴滴加n,n
‑
二异丙基乙胺(0.40ml,2.10mmol),随后升温至110℃反应12h。将反应混合物倒入水中,甲苯(20ml)萃取水相三次,所得甲苯层水洗一次后用无水硫酸钠干燥。旋蒸除去甲苯后,粗品用甲醇洗涤两次,得到白色粉末,记作反应物2。产量183.5mg,产率43.2%。
[0054]
对得到的分子进行1h nmr和
13
c nmr分析。1h nmr(400mhz,cdcl3)δ8.43(s,2h),7.59
–
7.52(m,2h),7.43(d,2h),7.34(s,2h),2.85(q,4h),1.38(t,6h).
13
c nmr(101mhz,cdcl3)δ158.52,157.62,138.56,133.80,132.94,118.25,111.80,28.50,15.88.
[0055][0056]
步骤三、将反应物2(200mg,0.50mmol)、联硼酸频哪醇酯(188.6mg,0.74mmol)、乙酸钾(485.8mg,4.95mmol)和[1,1'
‑
双(二苯基膦基)二茂铁]二氯化钯(10.9mg,0.016mmol)投入干燥的带有冷凝管的反应瓶中,进行三次以上抽真空、通氩气的抽换气操作后,溶于10ml干燥的二氧六环中。随后升温至110℃反应12h。反应结束后,反应混合物投入水中,用二氯甲烷(10ml)萃取水相三次,所得的二氯甲烷相水洗一次后用无水硫酸钠干燥。减压除去二氯甲烷后,粗品用甲醇洗涤两次,得到浅灰色粉末,记作反应物3。产量175.4mg,产率78%。
[0057]
对得到的分子进行1h nmr分析。1h nmr(500mhz,cdcl3)δ8.48(d,2h),7.64(s,2h),7.56(dd,2h),7.47(d,2h),2.85(q,4h),1.42
–
1.35(m,18h).
[0058][0059]
步骤四、将反应物3(150mg,0.33mmol)、2,5
‑
二溴对苯二甲醛(44.0mg,0.15mmol)、碳酸钾(530.7mg,3.85mmol)和四三苯基膦钯(17.43mg,0.015mmol)投入干燥的带有冷凝管的反应瓶中,进行三次以上抽真空、通氩气的抽换气操作后,依次注入干燥的甲苯(6ml),通气除氧的乙醇(3ml),通气除氧的水(3ml)。随后升温至80℃反应12h。反应结束后,抽滤反应体系,所得固体用水、甲醇、正己烷充分洗涤,所得滤液用少量氯仿萃取,旋干氯仿得到的固体依次用甲醇、正己烷充分洗涤。合并所得固体真空干燥后得到黄绿色粉末,记作反应物4。产量94mg,产率79%。
[0060]
对得到的分子进行1h nmr分析。1h nmr(400mhz,cdcl3)δ10.24(s,2h),8.54(s,4h),8.31(s,2h),7.62(d,4h),7.54(d,4h),7.33(s,4h),2.90(q,8h),1.42(t,12h).
[0061][0062]
步骤五、无水无氧条件下,将反应物4(260mg,0.33mmol)分散在40ml干燥的四氢呋喃中。在25℃下逐滴加入均三甲基苯基溴化镁(1m,3.32ml,3.32mmol),反应30min。反应结束后,反应混合物投入水中,用乙酸乙酯萃取水相。乙酸乙酯层干燥、旋干,得到的固体置于干燥的反应瓶中,溶于30ml干燥的二氯甲烷,室温下逐滴加入三氟化硼乙醚(0.55ml,2.3mmol),反应20min后用少量甲醇淬灭,终止反应。反应体系旋干,得到灰蓝色固体,记作反应物5。产量166mg,产率60%。
[0063][0064]
步骤六、无水条件下,将反应物5(165mg,0.17mmol)溶于23ml干燥的甲苯中。将2,3
‑
二氯
‑
5,6
‑
二氰基
‑
1,4
‑
苯醌(38mg,0.17mmol)溶于2ml干燥的甲苯中。将2,3
‑
二氯
‑
5,6
‑
二氰基
‑
1,4
‑
苯醌的甲苯溶液逐滴转移至反应体系,随后升温至80℃反应1h。反应结束后,待反应体系冷却,通过中性氧化铝柱层析(洗脱剂为甲苯)。所得固体用二氯甲烷/乙腈重结晶,得到深蓝色固体,记作产物6。产量为60mg,产率36.2%。
[0065]
对得到的分子进行1h nmr分析。1h nmr(400mhz,cdcl3)δ8.39(d,4h),7.52(d,2h),7.45
–
7.36(m,4h),7.29(s,4h),7.12(s,4h),6.54(d,2h),2.81(dd,8h),2.53(s,6h),2.26(s,12h),1.35(dt,7.6hz,12h).
[0066][0067]
实施例2
[0068]
含硼有机自由基化合物,结构式如下:
[0069][0070]
上述含硼有机自由基化合物的制备:
[0071]
步骤一、将2,5
‑
二溴
‑
1,3
‑
二氟苯(1g,36.8mmol)、4
‑
叔丁基苯酚(16.58g,110.4mmol)和碳酸钾(15.26g,110.4mmol)投入干燥的带有冷凝管的反应瓶中,进行三次以上抽真空、通氩气的抽换气操作后,注入干燥的n,n
‑
二甲基甲酰胺溶剂(45ml)充分溶解,随后升温至170℃下反应12h。得到的反应混合物用甲苯稀释后投入水中,甲苯(30ml)萃取水层三次,收集甲苯层并用无水硫酸钠干燥。旋蒸除去甲苯后,粗品用硅胶柱层析(洗脱剂为石油醚:二氯甲烷=12:1)纯化,得到无色粉末,记作反应物7。产量15.74g,产率93%。
[0072]
对得到的分子进行1h nmr分析。1h nmr(400mhz,cdcl3)δ7.45(d,4h),7.02(d,4h),6.77(s,2h),1.38(s,18h).
[0073][0074]
步骤二、将反应物7(3.0g,5.64mmol)投入严格烘烤的带有冷凝管的反应瓶中,进行三次以上抽真空、通氩气的抽换气操作后,溶于25ml干燥的间二甲苯中。反应体系降温至
‑
30℃稳定片刻后,逐滴滴加正丁基锂溶液(1.6m,3.70ml,5.92mmol),反应10min。随后在
‑
30℃下逐滴滴加三溴化硼(0.66ml,6.77mmol),随后在室温(25℃)下反应1h。将反应体系重新降温至
‑
30℃后,逐滴滴加n,n
‑
二异丙基乙胺,随后升温至120℃反应12h。将反应混合物倒入水中,甲苯(20ml)萃取水相三次,所得甲苯层水洗一次后用无水硫酸钠干燥。旋蒸除去甲苯后,粗品用硅胶柱层析(洗脱剂为石油醚:二氯甲烷=10:1)纯化,得到白色粉末,记作反应物8。产量990.2mg,产率39%。
[0075]
对得到的分子进行1h nmr分析。1h nmr(400mhz,cdcl3)δ8.73(d,2h),7.80(d,2h),
7.49(d,2h),7.39(s,2h),1.48(s,18h).
[0076][0077]
步骤三、将反应物8(980mg,2.13mmol)、联硼酸频哪醇酯(811.3mg,3.20mmol)、乙酸钾(2.09g,21.3mmol)和[1,1'
‑
双(二苯基膦基)二茂铁]二氯化钯(46.8mg,0.064mmol)投入干燥的带有冷凝管的反应瓶中,进行三次以上抽真空、通氩气的抽换气操作后,溶于50ml干燥的二氧六环中。随后升温至110℃反应12h。反应结束后,反应混合物投入水中,用二氯甲烷(20ml)萃取水相三次,所得的二氯甲烷相水洗一次后用无水硫酸钠干燥。旋转蒸发除去二氯甲烷后,粗品用硅胶柱层析(洗脱剂为石油醚:二氯甲烷=1:1)纯化,得到淡黄色粉末,记作反应物9。产量861.5mg,产率80%。
[0078]
对得到的分子进行1h nmr分析。1h nmr(400mhz,cdcl3)δ8.79(d,2h),7.81(dd,2h),7.69(s,2h),7.53(d,2h),1.52(s,18h),1.44(s,12h).
[0079][0080]
步骤四、将反应物9(330mg,0.65mmol)、2,5
‑
二溴对苯二甲醛(75.9mg,0.26mmol)、碳酸钾(914.2mg,6.62mmol)和四三苯基膦钯(30.0mg,0.026mmol)投入干燥的带有冷凝管的反应瓶中,进行三次以上抽真空、通氩气的抽换气操作后,依次注入干燥的甲苯(11ml),通气除氧的乙醇(5.5ml),通气除氧的水(5.5ml)。随后升温至90℃反应12h。反应结束后,抽滤反应体系,所得固体用水、甲醇、正己烷充分洗涤,所得滤液用少量氯仿萃取,旋干氯仿得到的固体依次用甲醇、正己烷充分洗涤。合并所得固体真空干燥后得到黄绿色粉末,记作反应物10。产量200mg,产率86%。
[0081]
对得到的分子进行1h nmr分析。1h nmr(400mhz,cdcl3)δ10.28(s,2h),8.84(d,4h),8.35(d,2h),7.91
–
7.83(m,2h),7.59(d,4h),7.37(d,4h),1.55(s,36h).
[0082][0083]
步骤五、无水无氧条件下,将反应物10(130mg,0.15mmol)分散在25ml干燥的四氢呋喃中。在25℃下逐滴加入均三甲基苯基溴化镁(1m,1.45ml,1.45mmol),反应30min。反应结束后,反应混合物投入水中,用乙酸乙酯萃取水相。乙酸乙酯层干燥、旋干,得到的固体置于干燥的反应瓶中,溶于25ml干燥的二氯甲烷,室温下逐滴加入三氟化硼乙醚(0.29ml,2.3mmol),反应20min后用少量甲醇淬灭,终止反应。反应体系旋干,得到灰蓝色固体,记作反应物11。产量122mg,产率76%。
[0084][0085]
步骤六、无水条件下,将反应物11(122mg,0.22mmol)溶于18ml干燥的甲苯中。将2,3
‑
二氯
‑
5,6
‑
二氰基
‑
1,4
‑
苯醌(50.4mg,0.22)溶于2ml干燥的甲苯中。将2,3
‑
二氯
‑
5,6
‑
二氰基
‑
1,4
‑
苯醌的甲苯溶液逐滴转移至反应体系,随后升温至80℃反应1h。反应结束后,待反应体系冷却,通过中性氧化铝柱层析(洗脱剂为甲苯)。所得固体用二氯甲烷/乙腈重结晶,得到深蓝色固体,记作产物12。产量为70.6mg,产率58.7%。
[0086]
对得到的分子进行1h nmr分析。1h nmr(400mhz,cdcl3)δ8.69(d,4h),7.78(d,2h)7.64(d,2h),7.48(d,2h),7.32(s,2h),7.15(s,4h),6.61(d,2h),2.57(s,6h),2.29(s,12h),1.50(s,36h).
[0087][0088]
实施例3
[0089]
含硼有机自由基化合物,结构式如下:
[0090][0091]
上述含硼有机自由基化合物的制备:
[0092]
步骤一、将反应物3(300mg,0.66mmol)、1,3
‑
二溴间苯二甲醛(88.0mg,0.30mmol)、碳酸钾(208mg,1.50mmol)和四三苯基膦钯(34.9mg,0.03mmol)投入干燥的带有冷凝管的反应瓶中,进行三次以上抽真空、通氩气的抽换气操作后,依次注入干燥的四氢呋喃(15ml),通气除氧的水(3ml)。随后升温至80℃反应12h。反应结束后,抽滤反应体系,所得固体用水、甲醇、正己烷充分洗涤,所得滤液用少量氯仿萃取,旋干氯仿得到的固体依次用甲醇、正己烷充分洗涤。合并所得固体真空干燥后得到黄绿色粉末,记作反应物13。产量191mg,产率81%。
[0093]
对得到的分子进行1hnmr和
13
c nmr分析。1h nmr(400mhz,cdcl3)δ10.21(s,2h),8.76(s,1h),8.50(s,4h),7.84(s,1h),7.59(d,4h),7.49(d,4h),7.30(s,4h),2.87(q,8h),1.40(t,12h).
[0094][0095]
步骤二、无水无氧条件下,将反应物13(100mg,0.13mmol)分散在20ml干燥的四氢呋喃中。在25℃下逐滴加入均三甲基苯基溴化镁(1m,1.28ml,1.28mmol),反应30min。反应结束后,反应混合物投入水中,用乙酸乙酯萃取水相。乙酸乙酯层干燥、旋干,得到的固体置于干燥的反应瓶中,溶于30ml干燥的二氯甲烷,室温下逐滴加入三氟化硼乙醚(0.26ml,2.04mmol),反应20min后用少量甲醇淬灭,终止反应。反应体系旋干,得到灰蓝色固体,记作反应物14。产量66mg,产率52%。
[0096][0097]
步骤三、无水条件下,将反应物14(66mg,0.067mmol)溶于10ml干燥的甲苯中。将2,3
‑
二氯
‑
5,6
‑
二氰基
‑
1,4
‑
苯醌(15.2mg,0.067mmol)溶于2ml干燥的甲苯中。将2,3
‑
二氯
‑
5,6
‑
二氰基
‑
1,4
‑
苯醌的甲苯溶液逐滴转移至反应体系,随后升温至80℃反应1h。反应结束后,待反应体系冷却,通过中性氧化铝柱层析(洗脱剂为甲苯)。所得固体用二氯甲烷/乙腈重结晶,得到深蓝色固体,记作产物15。产量为37mg,产率50%。
[0098]
对得到的分子进行质谱分析。maldi tof
‑
ms:计算分子量c
70
h
58
b2o4:984.4521,测得分子量:984.4552[m]。
[0099][0100]
实施例4
[0101]
含硼有机自由基化合物,结构式如下:
[0102][0103]
上述含硼有机自由基化合物的制备:
[0104]
步骤一、将反应物9(300mg,0.66mmol),4,6
‑
二溴间苯二甲醛(88.1mg,0.30mmol),碳酸钾(208.1mg,1.51mmol)和四三苯基膦钯(34.9mg,0.030mmol)投入干燥的带有冷凝管的反应瓶中,进行三次以上抽真空、通氩气的抽换气操作后,依次注入精制的四氢呋喃(15ml),通气除氧的水(3ml)。随后升温至80℃反应12h。反应结束后,抽滤反应体系,所得固体用水、甲醇、正己烷充分洗涤,所得滤液用少量氯仿萃取,减压除去氯仿得到的固体依次用甲醇、正己烷充分洗涤。合并所得固体真空干燥后得到草绿色粉末,记作反应物16。产量200mg,产率81%。
[0105][0106]
步骤二、无水无氧条件下,将反应物16(150mg,0.19mmol)分散在30ml干燥的四氢呋喃中。在25℃下逐滴加入均三甲基苯基溴化镁(1m,1.92ml,1.92mmol),反应30min。反应结束后,反应混合物投入水中,用乙酸乙酯萃取水相。乙酸乙酯层干燥、旋干,得到的固体置于干燥的反应瓶中,溶于30ml干燥的二氯甲烷,室温下逐滴加入三氟化硼乙醚(0.43ml,3.0mmol),反应20min后用少量甲醇淬灭,终止反应。反应体系旋干,得到浅黄色固体,记作反应物17。产量154mg,产率70%。
[0107]
步骤三、无水条件下,将反应物17(150mg,0.15mmol)溶于20ml干燥的甲苯中。将2,3
‑
二氯
‑
5,6
‑
二氰基
‑
1,4
‑
苯醌(41.4mg,0.18mmol)溶于2ml干燥的甲苯中。将2,3
‑
二氯
‑
5,6
‑
二氰基
‑
1,4
‑
苯醌的甲苯溶液逐滴转移至反应体系,随后升温至80℃反应1h。反应结束后,待反应体系冷却,通过中性氧化铝柱层析(洗脱剂为甲苯)。所得固体用氯仿/乙腈重结晶,得到深紫红色固体,记作产物18。产量为101mg,产率67.3%。
[0108][0109]
实施例5
[0110]
含硼有机自由基化合物,结构式如下:
[0111][0112]
上述含硼有机自由基化合物的制备:
[0113]
步骤一、将2,5
‑
二溴
‑
1,3
‑
二氟苯(1g,36.8mmol)、苯酚(10.38g,110.4mmol)和碳酸钾(15.26g,110.4mmol)投入干燥的带有冷凝管的反应瓶中,进行三次以上抽真空、通氩气的抽换气操作后,注入干燥的n,n
‑
二甲基甲酰胺溶剂(45ml)充分溶解,随后升温至170℃反应12h。得到的反应混合物用甲苯稀释后投入水中,甲苯(30ml)萃取水层三次,收集甲苯层并用无水硫酸钠干燥。减压除去甲苯后,硅胶柱层析(洗脱剂为石油醚:二氯甲烷=12:1)纯化,得到无色粉末,记作反应物19。产量14.22g,产率92%。
[0114]
对得到的分子19进行1h nmr分析。1h nmr(400mhz,cdcl3)δ7.22(d,j=8.4hz,4h),6.98(d,j=8.5hz,4h),6.69(s,2h).
[0115][0116]
步骤二、将反应物19(500mg,1.20mmol)投入严格烘烤的带有冷凝管的反应瓶中,进行三次以上抽真空、通氩气的抽换气操作后,溶于5ml干燥的间二甲苯中。反应体系降温至
‑
30℃稳定片刻后,逐滴滴加正丁基锂溶液(1.6m,0.72ml,1.26mmol),反应5min后升至50℃反应30min。随后在
‑
30℃下逐滴滴加三溴化硼(0.14ml,1.44mmol),40℃下反应1h。将反应体系重新降温至0℃后,逐滴滴加n,n
‑
二异丙基乙胺(0.45ml,2.40mmol),随后升温至120℃反应12h。将反应混合物倒入水中,甲苯(20ml)萃取水相三次,所得甲苯层水洗一次后用无水硫酸钠干燥。旋蒸除去甲苯后,粗品用甲醇洗涤两次,得到白色粉末,记作反应物20。产量208.8mg,产率50.0%。
[0117]
对得到的分子20进行1h nmr分析。1h nmr(400mhz,cdcl3)δ8.40(s,2h),7.61
–
7.54(m,2h),7.40(d,2h),7.38(s,2h).
[0118][0119]
步骤三、将反应物20(200mg,0.57mmol)、联硼酸频哪醇酯(217.2mg,0.86mmol)、乙酸钾(485.8mg,4.95mmol)和[1,1'
‑
双(二苯基膦基)二茂铁]二氯化钯(10.9mg,0.016mmol)投入干燥的带有冷凝管的反应瓶中,进行三次以上抽真空、通氩气的抽换气操作后,溶于10ml干燥的二氧六环中。随后升温至110℃反应12h。反应结束后,反应混合物投入水中,用二氯甲烷(10ml)萃取水相三次,所得的二氯甲烷相水洗一次后用无水硫酸钠干燥。减压除
去二氯甲烷后,粗品用甲醇洗涤两次,得到浅灰色粉末,记作反应物21。产量158.0mg,产率70%。
[0120]
对得到的分子进行1h nmr分析。1h nmr(500mhz,cdcl3)δ8.42(d,2h),7.69(s,2h),7.55(dd,2h),7.42(d,2h),1.35(s,12h).
[0121][0122]
步骤四、将反应物21(150mg,0.38mmol)、2,5
‑
二溴对苯二甲醛(44.0mg,0.15mmol)、碳酸钾(530.7mg,3.85mmol)和四三苯基膦钯(17.43mg,0.015mmol)投入干燥的带有冷凝管的反应瓶中,进行三次以上抽真空、通氩气的抽换气操作后,依次注入干燥的甲苯(8ml),通气除氧的乙醇(4ml),通气除氧的水(4ml)。随后升温至90℃反应12h。反应结束后,抽滤反应体系,所得固体用水、甲醇、二氯甲烷、正己烷充分洗涤,所得固体真空干燥后得到黄绿色粉末,记作产物22。产量94mg,产率84%。产物22在二氯甲烷、氯仿、甲苯、四氢呋喃等常用溶剂中几乎不溶解。
[0123][0124]
对实施例1中合成的含硼有机自由基化合物(产物6)、实施例3中合成的含硼有机自由基化合物(产物15)进行紫外可见吸收光谱分析,如图1、图2所示,含硼有机自由基化合物(产物6)的主吸收峰位在627nm,表现出近红外吸收性质;含硼有机自由基化合物(产物15)的主吸收峰位在754、551nm,表现出可见、近红外吸收性质。如图3、图4所示,含硼有机自由基化合物(产物6)、含硼有机自由基化合物(产物15)的稀溶液(1
×
10
‑5m)在空气中放置12h,吸收光谱未发生变化,表现出良好的稳定性。说明本发明所述的含硼有机自由基化合物具有明显的近红外吸收性质,且具备良好的稳定性,有制备近红外染料的应用潜力。
[0125]
对实施例1中合成的含硼有机自由基化合物(产物6)、实施例3中合成的含硼有机自由基化合物(产物15)进行电化学测试分析,如图5、图6所示,计算可得含硼有机自由基化合物(产物6)的homo能级和lumo能级分别为
‑
5.02ev和
‑
3.29ev,带隙为1.73ev;计算可得含硼有机自由基化合物(产物15)的homo能级和lumo能级分别为
‑
4.72ev和
‑
3.63ev,带隙为1.09ev。本发明的含硼有机自由基化合物的能级结构和窄带隙性质,表明其具有作为双极性有机场效应晶体管材料的潜力。
[0126]
对实施例1中合成的含硼有机自由基化合物(产物6)、实施例3中合成的含硼有机自由基化合物(产物15)进行变温电子顺磁共振(esr)分析,如图7、图8所示,含硼有机自由基化合物,在30℃就有明显的esr信号响应,g
e
值分别为2.0030和2.0035,表明了自由基单电子的存在。温度升高能够观察到esr信号增强,表明热激发三线态双自由基的数量随温度上升而增多,证明了所述含硼有机自由基化合物是单线态双自由基基态。显著的顺磁性质表明,所述的含硼有机自由基化合物具有作为有机自旋电子器件材料的潜力。
[0127]
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1