抗OX40抗体及其应用的制作方法
抗ox40抗体及其应用
1.本技术是申请日为2015年10月15日、申请号为cn2015800837165、发明名称为“抗 ox40抗体及其应用”的中国专利申请的分案申请。
技术领域
2.本发明涉及医药生物领域,尤其涉及一种抗ox40抗体及其应用。
背景技术:
3.t细胞活化需要两种信号协同作用:第一信号由t细胞抗原受体(tcr)识别抗原产生, 经cd3分子将信号转导至细胞内,第一信号决定t细胞在适应性免疫应答中的特异性;第二 信号是由抗原提呈细胞(apc)或者靶细胞表面的共刺激分子与t细胞表面的相应的协同刺 激分子受体相互作用而产生。共刺激信号刺激抗原特异性t细胞增殖,并分化为效应t细胞。 如果缺乏共刺激信号,t细胞则会进入无反应或自身免疫耐受状态,甚至进入程序性死亡。
4.ox40(又称tnfrsf4、act35、cd134、imd16或txgp1l)是tnfr受体超家族成 员,是i型跨膜糖蛋白,ox40主要表达于活化的cd4+t细胞和cd8+t细胞上(paterson等 (1987)molimmunol24:1281
–
1290)。其胞外段由3个半胱氨酸富集域和一个c端不完全crd 组成(deannem等(2006)structure14:1321-1330)。ox40是次级共刺激分子。与cd28不同, ox40不表达于静止的t细胞表面,而在t细胞活化24-72小时有较高的表达。其配体ox40l (tnfsf4,txgp1,ox-40l,gp34或cd252)是ii型跨膜糖蛋白,表达于活化的抗原提呈 细胞,如树突状细胞、b细胞等(godfrey,w.r等(1994)jexpmed180:757
–
762)。ox40/ox40l 信号在t细胞的活化、增值以及抑制凋亡过程中发挥着非常重要的作用。研究表明激活型的 ox40抗体能够有效地促进t细胞增殖和活化,并产生较好的抗肿瘤作用(brendand.curti等 (2013)cancerres73:7189-7198)。
5.stefanien.linch等人对ox40激活性抗体和其他治疗肿瘤的方法的联和使用做了详细的 整理与描述(stefanien.linch等(2015)frontiers in oncology 5:1-14)。已有的报道也显示当放 疗和ox40激活性抗体联用时可以明显延长小鼠的生存期(gough m j等(2010)j immunother33(8):798-809;kjaergaard j等(2005)103(1):156-164)。
6.本领域仍需要能够与ox40高亲和性结合、并且具有ox40激动剂活性的抗ox40抗体。
技术实现要素:
7.为解决上述技术问题,本发明的目的是提供一种良好特异性、较高的亲和性和稳定性的 抗ox40抗体及其应用。
8.本发明第一方面涉及抗ox40抗体或其抗原结合部分,其包括选自如下一组的cdr区:
9.1)其重链可变区cdr1、cdr2、cdr3的序列分别如seq id no:5-7所示,轻链可变 区
cdr1、cdr2、cdr3的序列分别如seq id no:14-16所示,或者其重链可变区和轻链 可变区与前述序列相比满足以下二者中至少一个的序列:a)结合相同抗原表位;b)同一性 大于70%、80%、85%、90%或97%;
10.2)其重链可变区cdr1、cdr2、cdr3的序列分别如seq id no:23-25所示,轻链可 变区cdr1、cdr2、cdr3的序列分别如seq id no:32-34所示,或者其重链可变区和轻 链可变区与前述序列相比满足以下二者中至少一个的序列:a)结合相同抗原表位;b)同一 性大于70%、80%、85%、90%或97%;
11.3)其重链可变区cdr1、cdr2、cdr3的序列分别如seq id no:41-43所示,轻链可 变区cdr1、cdr2、cdr3的序列分别如seq id no:50-52所示,或者其重链可变区和轻 链可变区与前述序列相比满足以下二者中至少一个的序列:a)结合相同抗原表位;b)同一 性大于70%、80%、85%、90%或97%。
12.根据本发明第一方面任一项的抗ox40抗体或其抗原结合部分,其还包括选自于如下一 组的重链可变区框架区:
13.1)其重链可变区fr1、fr2、fr3、fr4的序列分别如seq id no:8-11所示;
14.2)其重链可变区fr1、fr2、fr3、fr4的序列分别如seq id no:26-29所示;
15.3)其重链可变区fr1、fr2、fr3、fr4的序列分别如seq id no:44-47所示。
16.根据本发明第一方面任一项的抗ox40抗体或其抗原结合部分,其还包括选自于如下一 组的轻链可变区框架区:
17.1)其轻链可变区fr1、fr2、fr3、fr4的序列分别如seq id no:17-20所示;
18.2)其轻链可变区fr1、fr2、fr3、fr4的序列分别如seq id no:35-38所示;
19.3)其轻链可变区fr1、fr2、fr3、fr4的序列分别如seq id no:53-56所示。
20.根据本发明第一方面任一项的抗ox40抗体或其抗原结合部分,包括选自于如下一组的 重链可变区,其序列如seq id no:4、22和40所示,或者其重链可变区与前述序列相比满 足以下二者中至少一个的序列:a)结合相同抗原表位、b)同一性大于70%、80%、85%、90% 或97%。
21.进一步的,包括选自于如下一组的重链可变区,其序列如seq id no:4、22和40所示, 或者其重链可变区cdr区与前述序列相比满足以下二者中至少一个的序列:a)结合相同抗 原表位;b)突变氨基酸的个数不超过3个。
22.进一步的,包括选自于如下一组的重链可变区,其序列如seq id no:4、22、40、62、 66、69、72和79所示。
23.根据本发明第一方面任一项的抗ox40抗体或其抗原结合部分,包括选自于如下一组的 轻链可变区,其序列如seq id no:13、31和49所示,或者其轻链可变区cdr区与前述序 列相比满足以下二者中至少一个的序列:a)结合相同抗原表位、b)同一性大于70%、80%、 85%、90%或97%。
24.进一步的,包括选自于如下一组的轻链可变区,其序列如seq id no:13、31和49所 示,或者其轻链可变区与前述序列相比满足以下二者中至少一个的序列:a)结合相同抗原表 位;b)突变氨基酸的个数不超过3个。
25.进一步的,包括选自于如下一组的轻链可变区,其序列如seq id no:13、31、49和74 所示。
26.根据本发明第一方面任一项的抗ox40抗体或其抗原结合部分,其为全抗体、双特异性 抗体、scfv、fab、fab'、f(ab')2或fv。
27.在本发明的一个实施方案中,当其为scfv时,其重链和轻链可变区之间可含有连接肽, 所述连接肽的序列如seq id no 1所示。
28.根据本发明第一方面任一项的抗ox40抗体或其抗原结合部分,其重链恒定区选自igg、 igm、ige、igd和iga。
29.在本发明的实施方案中,其重链恒定区选自igg1、igg2、igg3和igg4。
30.在本发明的具体实施方案中,其重链恒定区为igg1或igg4。
31.根据本发明第一方面任一项的抗ox40抗体或其抗原结合部分,其轻链恒定区为κ或λ。
32.本发明第二方面涉及核酸分子,其包含能够编码抗体重链可变区的核酸序列,所述重链 可变区包含选自如下一组的氨基酸序列:
33.(1)seq id no:5-7;
34.(2)seq id no:23-25;
35.(3)seq id no:41-43;
36.(4)与前述(1)~(3)序列相比满足以下二者中至少一个的序列:a)结合相同抗原表位;b) 同一性大于70%、80%、85%、90%或97%。
37.进一步的,所述重链可变区包含选自如下一组的氨基酸序列:
38.seq id no:4、22和40,或与前述序列相比满足以下二者中至少一个的序列:a)结合 相同抗原表位、b)同一性大于70%、80%、85%、90%或97%。
39.进一步的,包括选自于如下一组的重链可变区,其序列如seq id no:4、22和40所示, 或者其重链可变区与前述序列相比满足以下二者中至少一个的序列:a)结合相同抗原表位; b)突变氨基酸的个数不超过3个。
40.进一步的,包括选自于如下一组的重链可变区,其序列如seq id no:4、22、40、62、 66、69、72和79所示。
41.在本发明的实施方案中,所述核酸分子还包含能够编码抗体重链恒定区的核酸序列;所 述重链恒定区选自igg、igm、ige、igd和iga。
42.在本发明的实施方案中,其重链恒定区选自igg1、igg2、igg3和igg4。
43.在本发明的具体实施方案中,其重链恒定区为igg1或igg4。
44.本发明第二方面涉及核酸分子,其包含能够编码抗体轻链可变区的核酸序列,所述轻链 可变区包含选自如下一组的氨基酸序列:
45.(1)seq id no:14-16;
46.(2)seq id no:32-34;
47.(3)seq id no:50-52;
48.(4)与前述(1)~(3)序列相比满足以下二者中至少一个的序列:a)结合相同抗原表位;b) 同一性大于70%、80%、85%、90%或97%。
49.进一步的,所述重链可变区包含选自如下一组的氨基酸序列:
50.seq id no:13、31和49,或与前述序列相比满足以下二者中至少一个的序列:a)结合 相同抗原表位;b)同一性大于70%、80%、85%、90%或97%。
51.进一步的,包括选自于如下一组的轻链可变区,其序列如seq id no:13、31和49所 示,或者其轻链可变区与前述序列相比满足以下二者中至少一个的序列:a)结合相同抗原表 位;b)突变氨基酸的个数不超过3个。
52.进一步的,包括选自于如下一组的轻链可变区,其序列如seq id no:13、31、49和74 所示。
53.在本发明的实施方案中,所述核酸分子还包含能够编码抗体轻链恒定区的核酸序列;所 述轻链恒定区为κ型或λ型。
54.本发明第四方面涉及载体,其含有本发明第二或第三方面任一项的核酸分子。
55.根据本发明第四方面任一项的载体,其含有本发明第二方面任一项的核酸分子和第三方 面任一项的核酸分子。
56.本发明第五方面涉及宿主细胞,其含有本发明第二或第三方面任一项的核酸分子或本发 明第四方面任一项的载体。
57.本发明第六方面涉及偶联物,其含有本发明第一方面任一项的抗ox40抗体或其抗原结 合部分,以及其它生物活性物质,所述抗ox40抗体或其抗原结合部分直接或通过连接片段 与其它生物活性物质偶联。
58.在本发明的实施方案中,所述其它生物活性物质选自可间接抑制肿瘤细胞生长、或通过 激活机体免疫反应从而抑制或杀灭细胞,从而达到治疗肿瘤的化学物质、多肽、酶、细胞因 子或其他具有生物活性的单一物质或混合物质,例如白介素类、肿瘤坏死因子、趋化因子、 纳米颗粒等。
59.本发明第七方面涉及组合物(例如药物组合物),其含有本发明第一方面任一项的抗ox40 抗体或其抗原结合部分、第二方面或第三方面任一项的核酸分子、第四方面任一项的载体、 第五方面任一项的宿主细胞、或者本发明第六方面任一项的偶联物,以及任选的药学上可接 受的载体或赋形剂,以及任选的其它生物活性物质。根据本发明第七方面任一项的组合物(例 如药物组合物),所述其它生物活性物质包括但不限于其它抗体、融合蛋白或药物(例如抗肿 瘤药物,如放、化疗药物)。
60.本发明还涉及本发明第一方面任一项的抗ox40抗体或其抗原结合部分、第二方面或第 三方面任一项的核酸分子、第四方面任一项的载体、第五方面任一项的宿主细胞、第六方面 任一项的偶联物或第七方面任一项组合物用于制备预防或治疗肿瘤的用途。
61.借由上述方案,本发明至少具有以下优点:
62.本发明利用酵母展示技术,通过筛选和进一步亲和力成熟得到了具有良好特异性、较高 的亲和性和稳定性的抗ox40抗体,该抗体能够特异性地与人ox40结合,其可以通过和活 化的t细胞结合进而增强t细胞的活化作用,对肿瘤生长具有显著的抑制作用。另外,本发 明的抗ox40抗体为全人源抗体,与传统的鼠源、嵌合抗体和人源化抗体相比,具有更低的 免疫原性,减少病人的排异反应,具有更好的成药能力。
63.本发明包含以下的实施方式:
64.1、一种抗ox40抗体或其抗原结合部分,其特征在于:其包括选自如下一组的cdr区:
65.1)其重链可变区cdr1、cdr2、cdr3的序列分别如seq id no:5-7所示,轻链可变 区cdr1、cdr2、cdr3的序列分别如seq id no:14-16所示,或者其重链可变区和轻链 可变区与
前述序列相比满足以下二者中至少一个的序列:a)结合相同抗原表位;b)同一性 大于70%、80%、85%、90%或97%;
66.2)其重链可变区cdr1、cdr2、cdr3的序列分别如seq id no:23-25所示,轻链可 变区cdr1、cdr2、cdr3的序列分别如seq id no:32-34所示,或者其重链可变区和轻 链可变区与前述序列相比满足以下二者中至少一个的序列:a)结合相同抗原表位;b)同一 性大于70%、80%、85%、90%或97%;
67.3)其重链可变区cdr1、cdr2、cdr3的序列分别如seq id no:41-43所示,轻链可 变区cdr1、cdr2、cdr3的序列分别如seq id no:50-52所示,或者其重链可变区和轻 链可变区与前述序列相比满足以下二者中至少一个的序列:a)结合相同抗原表位;b)同一 性大于70%、80%、85%、90%或97%。
68.2、根据实施方式1所述的抗ox40抗体或其抗原结合部分,其特征在于:包括选自于如 下一组的重链可变区,其序列如seq id no:4、22和40所示,或者其重链可变区与前述序 列相比满足以下二者中至少一个的序列:a)结合相同抗原表位;b)同一性大于70%、80%、 85%、90%或97%。
69.3、根据实施方式2所述的抗ox40抗体或其抗原结合部分,其特征在于:包括选自于如 下一组的重链可变区,其序列如seq id no:4、22和40所示,或者其重链可变区cdr区 与前述序列相比满足以下二者中至少一个的序列:a)结合相同抗原表位;b)突变氨基酸的 个数不超过3个。
70.4、根据实施方式3所述的抗ox40抗体或其抗原结合部分,其特征在于:包括选自于如 下一组的重链可变区,其序列如seq id no:4、22、40、62、66、69、72和79所示。
71.5、根据实施方式1所述的抗ox40抗体或其抗原结合部分,其特征在于:包括选自于如 下一组的轻链可变区,其序列如seq id no:13、31和49所示,或者其轻链可变区与前述 序列相比满足以下二者中至少一个的序列:a)结合相同抗原表位;b)同一性大于70%、80%、 85%、90%或97%。
72.6、根据实施方式5所述的抗ox40抗体或其抗原结合部分,其特征在于:包括选自于如 下一组的轻链可变区,其序列如seq id no:13、31和49所示,或者其轻链可变区cdr区 与前述序列相比满足以下二者中至少一个的序列:a)结合相同抗原表位;b)突变氨基酸的 个数不超过3个。
73.7、根据实施方式6所述的抗ox40抗体或其抗原结合部分,其特征在于:包括选自于如 下一组的轻链可变区,其序列如seq id no:13、31、49和74所示。
74.8、根据实施方式1所述的抗ox40抗体或其抗原结合部分,其特征在于:其为全抗体、 双特异性抗体、scfv、fab、fab'、f(ab')2或fv。
75.9、根据实施方式8所述的抗ox40抗体或其抗原结合部分,其特征在于:当其为scfv 时,其重链和轻链可变区之间可含有连接肽。
76.10、根据实施方式1所述的抗ox40抗体或其抗原结合部分,其特征在于:其重链恒定 区选自igg、igm、ige、igd和iga。
77.12、根据实施方式1所述的抗ox40抗体或其抗原结合部分,其特征在于:其轻链恒定 区为κ或λ。
78.13、一种核酸分子,其特征在于:其包含能够编码抗体重链可变区的核酸序列,所
实施方式23的偶联物,以及任选的药学上可接受的载体或赋形剂,以及任选的其它生物活性 物质。
100.25、实施方式1-12任一项的抗ox40抗体或其抗原结合部分、实施方式13-20的核酸分 子、实施方式21的载体、实施方式22的宿主细胞、实施方式23的偶联物、或者实施方式24 的组合物用于制备预防或治疗肿瘤的用途。
101.上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依 照说明书的内容予以实施,以下以本发明的较佳实施例并配合附图详细说明如后。
附图说明
102.图1是纯化的anti-hox40scfv对hox40的结合的结果图,
103.其中,x轴表示egfp的荧光强度,y轴表示anti-hlg-pe的荧光强度;
104.图2是anti-ox40抗体的特异性检测,
105.其中,x轴表示egfp的荧光强度,y轴表示anti-hlg-pe的荧光强度;
106.图3是亲和力提高的酵母单克隆染色结果图;
107.图4是elisa法检测三种抗体与hox40的结合能力图;
108.图5是elisa法检测亲和力成熟后的不同重链突变体与hox40的结合能力图;
109.图6是elisa法检测亲和力成熟后的h96位重链突变体和不同轻链突变体与hox40的 结合能力图;
110.图7是anti-hox40抗体体外激动剂活性的检测结果图;
111.图8是h96-l80的3种igg亚型的体外agonist活性对比图;
112.图9是anti-ox40抗体与人和恒河猴的cd4+t和cd8+t细胞结合能力检测图;
113.图10是o21 scfv抗体激动剂活性检测结果图;
114.图11是o21 scfv和lgg两种形式的激动剂活性检测结果;
115.图12是h96-l80的igg1和igg4两种亚型的体外对t细胞亚型的影响;
116.图13是o21 mab在体内对肿瘤(pc-3)生长抑制作用的结果图;
117.图14是o21 mab在体内对肿瘤(a375)生长抑制作用的结果图;
118.图15是45℃加速稳定实验评价anti-ox40抗体稳定性的结果图,
119.其中a为浓度检测,b为单体含量检测,c为nf-κb系统对体外活性的检测;
120.图16是h96-l80抗体的药物代谢动力学检测结果。
具体实施方式
121.下面结合附图和实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于 说明本发明,但不用来限制本发明的范围。
122.以下对本发明做进一步描述:在本发明中,除非另有说明,否则本文中使用的科学和技 术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的蛋白质和核酸化学、分 子生物学、细胞和组织培养、微生物学、免疫学相关术语和实验室操作步骤均为相应领域内 广泛使用的术语和常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解 释。
123.在本发明中,术语“抗体”是指通常由两对相同的多肽链(每对具有一条“轻”(l)链
和一 条“重”(h)链)组成的免疫球蛋白分子。抗体轻链可分类为κ和λ轻链。重链可分类为μ、 δ、γ、α或ε,并且分别将抗体的同种型定义为igm、igd、igg、iga和ige。在轻链和重链 内,可变区和恒定区通过大约12或更多个氨基酸的“j”区连接,重链还包含大约3个或更多 个氨基酸的“d”区。各重链由重链可变区(vh)和重链恒定区(ch)组成。重链恒定区由3个结 构域(ch1、ch2和ch3)组成。各轻链由轻链可变区(vl)和轻链恒定区(cl)组成。轻链恒定区 由一个结构域cl组成。抗体的恒定区可介导免疫球蛋白与宿主组织或因子,包括免疫系统 的各种细胞(例如,效应细胞)和经典补体系统的第一组分(c1q)的结合。vh和vl区还可被细 分为具有高变性的区域(称为互补决定区(cdr)),其间散布有较保守的称为构架区(fr)的区 域。各vh和vl由按下列顺序:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4从氨基末端 至羧基末端排列的3个cdr和4个fr组成。各重链/轻链对的可变区(vh和vl)分别形成抗 体结合部位。氨基酸至各区域或结构域的分配遵循kabat sequences of proteins ofimmunological interest(national institutes of health,bethesda,md.(1987and 1991)),或chothia &lesk(1987)j.mol.biol.196:901-917;chothia等人(1989)nature 342:878-883的定义。本发 明中所述的氨基酸的位置根据abysis在线工具比对得到 (http://www.bioinf.org.uk/abysis/index.html),并不代表氨基酸的序列中的实际排位。
124.术语“抗体”不受任何特定的产生抗体的方法限制。例如,其包括,特别地,重组抗体、单 克隆抗体和多克隆抗体。抗体可以是不同同种型的抗体,例如,igg(例如,igg1,igg2,igg3 或igg4亚型),iga1,iga2,igd,ige或igm抗体。
125.在本发明中,术语抗体的“抗原结合部分”是指全长抗体的一个或多个部分,所述部分保 持结合抗体所结合的相同抗原(例如,ox40)的能力,与完整抗体竞争对抗原的特异性结合。 通常参见,fundamental immunology,ch.7(paul,w.,ed.,第2版,raven press,n.y. (1989),其以其全文通过引用合并入本文,用于所有目的。可通过重组dna技术或通过完整 抗体的酶促或化学断裂产生抗原结合部分。在一些情况下,抗原结合部分包括fab、fab'、 f(ab')2、fd、fv、dab和互补决定区(cdr)片段、单链抗体(例如,scfv)、嵌合抗体、双抗体(diabody)和这样的多肽,其包含足以赋予多肽特异性抗原结合能力的抗体的至少一部分。
126.在本发明中,术语“载体”指的是,可将编码某蛋白的多聚核苷酸插入其中并使蛋白获得 表达的一种核酸运载工具。载体可通过转化、转导或转染宿主细胞,使其携带的遗传物质元 件在宿主细胞内表达得以表达。举例来说,载体包括:质粒;噬菌粒;柯斯质粒;人工染色 体如酵母人工染色体(yac)、细菌人工染色体(bac)或p1来源的人工染色体(pac);噬 菌体如λ噬菌体或m13噬菌体及动物病毒等。用作载体的动物病毒种类有逆转录酶病毒(包 括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤 病毒、乳头多瘤空泡病毒(如sv40)。一种载体可能含有多种控制表达的元件,包括启动子 序列、转录起始序列、增强子序列、选择元件及报告基因。另外,载体还可含有复制起始位 点。载体还有可能包括有协助其进入细胞的成分,如病毒颗粒、脂质体或蛋白外壳,但不仅 仅只有这些物质。
127.在本发明中,术语“宿主细胞”指的是导入载体的细胞,包括如下许多细胞类型,如大肠 杆菌或枯草菌等原核细胞,如酵母细胞或曲霉菌等真菌细胞,如s2果蝇细胞或sf9等昆虫细 胞,或者如纤维原细胞,cho细胞,cos细胞,nso细胞,hela细胞,bhk细胞,hek 293细
胞或人细胞的动物细胞。
128.在本发明中,“特异性结合”指的是,指两分子间的非随机结合反应,如抗体和产生该抗 体的抗原间的反应。此处,结合第一种抗原的抗体对第二种抗原的结合亲和力是检测不到或 很弱。在某些实施方式中,一个某抗原特异性抗体是指以亲和力(kd)≤10-5
m(如10-6
m、 10-7
m、10-8
m、10-9
m、10-10
m等)结合该抗原,其中kd指解离率与结合率的比值(koff/kon), 其可以采用本领域技术人员熟悉的方法进行测定。
129.实施例
130.实施例1重组人ox40的表达和相关egfp细胞制备
131.s1.1、根据蛋白数据库uniprot上人ox40的氨基酸序列(p43489),得到人ox40胞外 结构域的氨基酸序列(hox40)(即p43489中第1位残基至216位残基);
132.s1.2、根据蛋白数据库uniprot上人免疫球蛋白gamma1(igg1)的恒定区氨基酸序列 (p01857),得到人igg1-fc(hfc)的结构域氨基酸序列(即p01857中第104位残基至330 位残基);
133.s1.3、根据蛋白数据库uniprot上小鼠免疫球蛋白gamma1(igg1)的恒定区氨基酸序列 (p01868),得到小鼠igg1-fc(mufc)的结构域氨基酸序列(即p01868中第98位残基至324位残基);
134.s1.4、通过人工合成的方式得到步骤s1.1~s1.3中的dna片段,合成好的基因序列分别 经fermentas公司的hindiii与ecori双酶切亚克隆到商业化载体pcdna4/myc-hisa (invitrogen,v863-20)中,测序验证构建质粒的准确性,获得重组质粒dna即:pcdna4
‑ꢀ
hox40-hfc、pcdna4-hox40-mufc;
135.s1.5、根据蛋白数据库uniprot上信息得到增强型绿色荧光蛋白egfp氨基酸序列 (c5mky7)、人ox40的氨基酸序列(p43489)、鼠ox40的氨基酸序列(p47741)、人cd137 的氨基酸序列(q07011)、人cd27氨基酸序列(p26842);
136.s1.6、通过人工合成的方式得到步骤s1.5中的dna片段,合成好的基因序列分别经 fermentas公司的hindiii与ecori双酶切亚克隆到商业化载体pcdna4/myc-hisa(invitrogen, v863-20)中,测序验证构建质粒的准确性,获得重组质粒dna即:pcdna4-hox40-egfp、 pcdna4-hcd137-egfp、pcdna4-mox40-egfp和pcdna4-hcd27-egfp。
137.s1.7、将步骤s1.6中的egfp重组质粒转染到hek293(atcc,crl-1573
tm
)细胞中, 转染48h后通过荧光激活信号分选(facs)确认hox40、hcd137、mox40、hcd27的表达。
138.s1.8、将pcdna4-hox40-fc、pcdna4-hox40-mufc瞬时转染至hek293细胞用于蛋白 生产。将重组表达质粒用freestyle293培养基稀释并加入转化所需pei(polyethylenimine)溶 液,将每组质粒/pei混合物分别加入细胞悬液中,放置在37℃,10%co2,90rpm中培养; 培养5~6天后,收集瞬时表达培养上清液,通过proteina亲和层析法,初步纯化得到hox40
‑ꢀ
fc、hox40-mufc蛋白样品,用于以下各实施例。得到的蛋白样品利用sds-page进行初步 的检测,可以清晰的看到目的条带。
139.实施例2从酵母展示文库中筛选anti-hox40抗体,克隆表达和鉴定
140.2.1方法
141.采用酵母展示技术筛选针对人ox40的全人抗体。通过克隆来自150个健康人的pbmc 的igm和igg cdna中的vh和vl基因到特定载体,构建scfv酵母展示文库(vh和vl 中间
的连接序列是ggggsggggsggggs(seq id no:1)连接肽),库容为5
×
108。将10 倍库容的酵母库复苏,诱导酵母表面表达抗体,用100nm生物素化的hox40抗原利用磁珠 分选的方式富集二次,然后用生物素化的hox40做流式分选再富集两次。得到的酵母涂板, 挑取单克隆。单克隆酵母经扩增和诱导表达后用anti-myc抗体和生物素化的hox40或对照抗 原hcd137染色分析,抗原阳性/对照酵母阴性的酵母为阳性酵母。
142.将经过facs确认的酵母克隆进行酵母菌落pcr和测序,pcr引物为:sequence-f:cgtagaatcgagaccgaggaga(seq id no:2);sequence-r: ctggtggtggtggttctgctagc(seq id no:3);测序的引物为sequence-r。得到测序 结果后用bioedit软件对序列进行比对分析。
143.将上述得到的单链抗体scfv基因及前述的人igg1-fc基因融合后经fermentas公司的 hindiii与ecori双酶切克隆到商业化载体pcdna4/myc-hisa中,按照分子克隆的标准操作 进行克隆和质粒小提。提取后的质粒在hek293细胞中瞬时表达,并通过protein a柱纯化。
144.取hox40-egfp细胞,重悬于0.5%pbs-bsa buffer中,加入上述纯化后2μg的anti
‑ꢀ
hox40scfv抗体,同时设置相关对照,阴性对照为2μg的higg1蛋白。二抗为ebioscience的 anti-hig-pe。染色完毕后流式细胞仪进行检测。以此方法鉴定能结合细胞表面hox40抗原的 抗体。
145.经过筛选和鉴定后得到3株特性较好的抗体分别是o3scfv、o19scfv、o21scfv。如图1 所示,3株抗hox40的抗体均能够与细胞表面hox40相结合,而阴性对照不能够与细胞表面 hox40相结合。上述抗体重链和轻链可变区之间含有连接肽序列ggggsggggsggggs (seq id no:1)。
146.2.2序列
147.2.2.1o3 scfv重链可变区氨基酸序列:
148.qvqlqqwgagllkpsetlsltcgfngeyftdyfwtwvrqppgealewlaliywddderyspslknrliitkdisknqvvltmthmepadtgtyycarwggslmnafdvwgpgtm vtvss(seq id no:4)
149.横线部分分别为cdr1、cdr2、cdr3,其序列编号分别为seq id no:5-7;未划横线 部分分别为fr1、fr2、fr3、fr4,其序列编号分别为seq id no:8-11;
150.其对应的dna序列为:
151.caggtgcagctacagcagtggggcgcaggactgttgaagccttcggagaccctgt ccctcacctgcggtttcaatggagaatacttcactgattacttctggacctgggtccggc agccccccggagaggccctggagtggcttgcactcatttattgggatgatgatgagcgc tacagcccatctctgaagaacagactcatcatcaccaaggacatttccaaaaaccaggt ggtccttacaatgacccacatggagcctgcggacacaggcacctattactgtgcgagat ggggtggttctttaatgaacgcttttgatgtctggggcccagggacaatggtcaccgtc tcttca(seq id no:12)
152.其轻链可变区氨基酸序列:
153.qsaliqpasvsgspgqsitisctgtssdvggynyvswyqrhpgkaprlmiydvtkrps gvsnrfsgsksgntasltisglqaedeadyycssytsssiavfgggtqltvl(seq id no:13) 其中横线部分分别为cdr1、cdr2、cdr3,其序列编号分别为seq id no:14-16;未 划横线部分分别为fr1、fr2、fr3、fr4,其序列编号分别为seq id no:17-20;
ctgtgtaagaaataactacttcttcgatctctggggccgtggtaccctggtcaccgtctc ctca(seq id no:48)
170.其轻链可变区氨基酸序列:
171.eivltqspatlslspgeratlscrasqsvssylawyqqkpgqaprlliydasdratgipa rfsgsgsgtdftltisslepedfavyycqlrsnwppgytfgqgtkveik(seq id no:49) 其中横线部分分别为cdr1、cdr2、cdr3,其序列编号分别为seq id no:50-52;未 划横线部分分别为fr1、fr2、fr3、fr4,其序列编号分别为seq id no:53-56;
172.其对应的dna序列为:
173.gaaattgtgttgacacagtctccagccaccctgtctttgtctccaggggaaagagc caccctctcctgcagggccagtcagagtgttagcagctacttagcctggtaccaacaga aacctggccaggctcccaggctcctcatctatgatgcatccgacagggccactggcatc ccagccaggttcagtggcagtgggtctgggacagacttcactctcaccatcagcagcct tgagcctgaagattttgcagtttattactgtcagctgcgtagcaactggcctccggggta cacttttggccaggggaccaaggtggagatcaaa(seq id no:57)
174.实施例3 3株抗体的scfv型抗体格式化为igg型抗体
175.根据蛋白数据库uniprot上人免疫球蛋白gamma4(igg4)的恒定区氨基酸序列(p01861), 得到人igg4恒定区氨基酸序列。将筛选得到的o3、o19、o21的重链可变区vh序列与人 igg4恒定区基因序列拼接在一起,将拼接好的基因合成,经fermentas公司hindiii和ecori 双酶切亚克隆至载体pcdna4/myc-hisa中得到pcdna4-o21hc、pcdna4-o3hc、pcdna4
‑ꢀ
o19hc。
176.根据蛋白数据库uniprot上人免疫球蛋白kappa的恒定区氨基酸序列(p01834),得到人 kappa轻链恒定区氨基酸序列。将筛选得到的o21的轻链可变区vl序列与人kappa轻链恒 定区基因序列拼接在一起;根据蛋白数据库uniprot上人免疫球蛋白lambda的恒定区氨基酸 序列(a0m8q6),得到人lambda轻链恒定区氨基酸序列,将筛选得到的o3、o19的轻链可 变区vl序列与人lambda轻链恒定区基因序列拼接在一起,将拼接好的基因合成,经fermentas 公司hindiii和ecori双酶切亚克隆至载体pcdna4/myc-hisa中得到pcdna4-o21lc; pcdna4-o3lc;pcdna4-o19lc。
177.利用aidlab公司提供的质粒大提试剂盒(pl14)对上述得到的重链和轻链质粒进行质 粒大提。将重组构建的轻链和重链质粒共转染hek293细胞进行抗体表达。将重组表达质粒 用freestyle293培养基稀释并加入转化所需pei(polyethylenimine)溶液,将每组质粒/pei混 合物分别加入细胞悬液中,放置在37℃,10%co2,120rpm中培养,培养5~6天后,收集瞬 时表达培养上清液,通过proteina亲和层析法,纯化得到anti-hox40抗体:o3mab、o19mab 和o21mab。
178.实施例4 anti-hox40 abs特性鉴定
179.抗体是否特异性识别hox40的鉴定:
180.纯化的anti-hox40抗体与hox40、hcd137和hcd27蛋白的结合
181.取实施例1构建的表达hox40-egfp、hcd137-egfp和hcd27-egfp的hek293细胞, 重悬于0.5%pbs-bsa buffer中,加入anti-hox40 mab蛋白,冰上孵育20min。洗涤后加入 ebioscience二抗anti-hig-pe,冰上20min。洗涤后将细胞重悬于500μl0.5%pbs-bsabuffer中, 流式细胞仪进行检测。结果如图2所示,三株抗体(o3mab、o19mab和o21mab)
h65位:s突变成n h67位:i突变成m h96位:n突变成d 191.表2亲和力提高的酵母单克隆序列分析结果
[0192][0193]
实施例6:scfv型抗体格式化为igg型抗体
[0194]
按照实施例3中的方法对亲和力成熟后的scfv型抗体格式化为igg型抗体型抗体,得到一系列的anti-ox4021#mab的变体,具体序列信息如下:
[0195]
6.1anti-ox4021#h28h33mab
[0196]
其重链可变区氨基酸序列:
[0197]
横线部分分别为cdr1、cdr2、cdr3,框内所示为突变部分,其序列编号分别为seqidno:63、42和43;未划横线部分分别为fr1、fr2、fr3、fr4,其序列编号分别为seqidno:64、45、46和47;
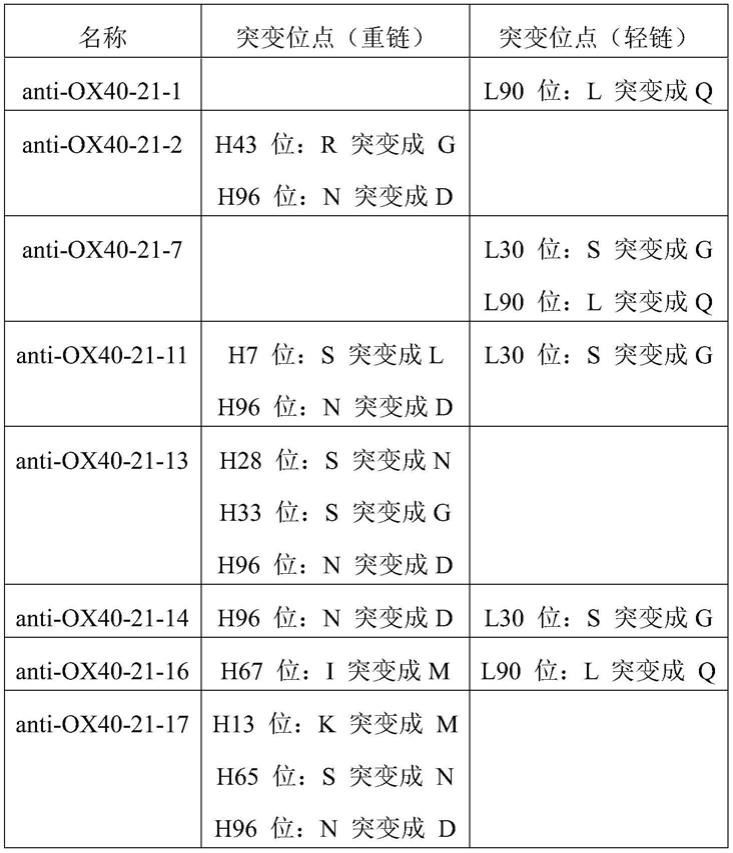
[0198]
其对应的dna序列为:
[0199][0200]
其轻链可变区氨基酸序列:
[0201]
eivltqspatlslspgeratlscrasqsvssylawyqqkpgqaprlliydasdratgiparfsgsgsgtdftltisslepedfavyycqlrsnwppgytfgqgtkveik(seqidno:49)
[0202]
其中横线部分分别为cdr1、cdr2、cdr3,其序列编号分别为seqidno:50-52;未划横线部分分别为fr1、fr2、fr3、fr4,其序列编号分别为seqidno:53-56;
[0203]
其对应的dna序列为:
[0204]
gaaattgtgttgacacagtctccagccaccctgtctttgtctccaggggaaagagccaccctctcctgcagggccagtcagagtgttagcagctacttagcctggtaccaacagaaacctggccaggctcccaggctcctcatctatgatgcatccgacagggccactggcatcccagccaggttcagtggcagtgggtctgggacagacttcactctcaccatcagcagccttgagcctgaagattttgcagtttattactgtcagctgcgtagcaactggcctccggggtacacttttggccaggggaccaaggtggagatcaaa(seqidno:57)
[0205]
6.2、anti-ox4021#h65mab
[0206]
其重链可变区氨基酸序列:
[0207][0208]
横线部分分别为cdr1、cdr2、cdr3,框内所示为突变部分,其序列编号分别为seqidno:41、67和43;未划横线部分分别为fr1、fr2、fr3、fr4,其序列编号分别为seqidno:44-47;
[0209]
其对应的dna序列为:
[0210][0211]
其轻链可变区氨基酸序列:
[0212]
eivltqspatlslspgeratlscrasqsvssylawyqqkpgqaprlliydasdratgiparfsgsgsgtdftltisslepedfavyycqlrsnwppgytfgqgtkveik(seqidno:49)
[0213]
其中横线部分分别为cdr1、cdr2、cdr3,其序列编号分别为seqidno:50-52;未划横线部分分别为fr1、fr2、fr3、fr4,其序列编号分别为seqidno:53-56;
[0214]
其对应的dna序列为:
[0215]
gaaattgtgttgacacagtctccagccaccctgtctttgtctccaggggaaagagccaccctctcctgcagggccagtcagagtgttagcagctacttagcctggtaccaacagaaacctggccaggctcccaggctcctcatctatgatgcatccgacagggccactggcatcccagccaggttcagtggcagtgggtctgggacagacttcactctcaccatcagcagccttgagcctgaagattttgcagtttattactgtcagctgcgtagcaactggcctccggggtacacttttggccaggggaccaaggtggagatcaaa(seqidno:57)
[0216]
6.3、anti-ox4021#h96mab
[0217]
其重链可变区氨基酸序列:
[0218][0219][0220]
横线部分分别为cdr1、cdr2、cdr3,框内所示为突变部分,其序列编号分别为seqidno:41、42和70;未划横线部分分别为fr1、fr2、fr3、fr4,其序列编号分别为seqidno:44-47;
[0221]
其对应的dna序列为:
[0222][0223]
其轻链可变区氨基酸序列:
[0224]
eivltqspatlslspgeratlscrasqsvssylawyqqkpgqaprlliydasdratgiparfsgsgsgtdftltisslepedfavyycqlrsnwppgytfgqgtkveik(seqidno:49)
[0225]
其中横线部分分别为cdr1、cdr2、cdr3,其序列编号分别为seqidno:50-52;未划横线部分分别为fr1、fr2、fr3、fr4,其序列编号分别为seqidno:53-56;
[0226]
其对应的dna序列为:
[0227]
gaaattgtgttgacacagtctccagccaccctgtctttgtctccaggggaaagagccaccctctcctgcagggccagtcagagtgttagcagctacttagcctggtaccaacagaaacctggccaggctcccaggctcctcatctatgatgcatccgacagggccactggcatcccagccaggttcagtggcagtgggtctgggacagacttcactctcaccatcagcagccttgagcctgaagattttgcagtttattactgtcagctgcgtagcaactggcctccggggtacacttttggccaggggaccaaggtggagatcaaa(seqidno:57)
[0228]
6.4、anti-ox4021#vhnew-l80
[0229]
其重链可变区氨基酸序列:
[0230][0231]
横线部分分别为cdr1、cdr2、cdr3,框内所示为突变部分,其序列编号分别为seqidno:63、67和70;未划横线部分分别为fr1、fr2、fr3、fr4,其序列编号分别为seqidno:44-47;
[0232]
其对应的dna序列为:
[0233][0234]
其轻链可变区氨基酸序列:
[0235][0236]
其中横线部分分别为cdr1、cdr2、cdr3,框内所示为突变部分,其序列编号分别为seqidno:75-77;未划横线部分分别为fr1、fr2、fr3、fr4,其序列编号分别为seqidno:53-56;
[0237]
其对应的dna序列为:
[0238][0239]
6.5、anti-ox4021#h96-l80mab
[0240]
其重链可变区氨基酸序列:
[0241][0242]
横线部分分别为cdr1、cdr2、cdr3,框内所示为突变部分,其序列编号分别为seqidno:41、42和70;未划横线部分分别为fr1、fr2、fr3、fr4,其序列编号分别为seqidno:44-47;
[0243]
其对应的dna序列为:
[0244][0245][0246]
其轻链可变区氨基酸序列:
[0247][0248]
其中横线部分分别为cdr1、cdr2、cdr3,框内所示为突变部分,其序列编号分别为seqidno:75-77;未划横线部分分别为fr1、fr2、fr3、fr4,其序列编号分别为seqidno:53-56;
[0249]
其对应的dna序列为:
[0250][0251]
实施例7:anti-hox40abs特性鉴定
[0252]
7.1纯化的anti-hox40抗体与hox40结合能力检测(elisa法)
[0253]
以包被缓冲液(50mmna2co3,nahco3ph9.6)稀释hox40-mufc至2μg/ml,100μl/well,4℃过夜。洗板后,3%bsa-pbs37℃封闭1h。将anti-hox40抗体分别从2000ng/ml开始,进行2倍梯度稀释,共11个浓度,稀释液(1%bsa-pbs)作对照,37℃孵育2h。加入羊抗人igg-hrp(goatanti-humanigg-hrpconjugated),37℃孵育1h。加可溶性单组分tmb底物显色液,室温避光显色5-10min。2nh2so450μl/well,终止显色反应。置mdspectramaxplus384酶标仪上读od450nm-650nm值,应用软件softmaxprov5.4进行数据处理和作图分析,结果如图4-6所示。由图4可知,由scfv转变为igg型抗体后,o19mab亲和力依然比较低;o21mab亲和力变化不大,亲和力比较好;o3mab亲和力显著提高。由图5和图6可知,上述的anti-ox4021#mab的变体均能和ox40结合,且经过体外亲和力成熟后的anti-ox4021#vhnew-l80mab,anti-ox4021#h96-l80mab与anti-ox4021#mab相比,亲和力大约提高两倍。
[0254]
7.2通过表面等离子共振(spr)分析a-hox40mabs与hox40的动力学亲和力常数
[0255]
anti-hox40抗体针对重组的人ox40的结合动力学通过表面等离振子共振(surfaceplasmonresonance,srp)方法,使用biacorex100仪器测量。cm5芯片偶联anti-humanfc抗体(不交叉识别mousefc),将待测抗体用runningbuffer稀释至5nm并被芯片上抗体捕获作为配体。ox40-mufc用runningbuffer稀释至1000-1.37nm二倍稀释。进样时
cd4和peanti-human cd8a(cat#301008),冰上孵育20min。洗涤后将细胞重悬于500μl 0.5%pbs-bsabuffer中,流式细胞仪进行检测。结果如图9c所示,h96-l80可以很好的结合活化的恒河猴 cd4+t和cd8+t细胞,提示h96-l80可以结合恒河猴ox40。
[0269]
实施例10:anti-ox40抗体促进t细胞的活化和增殖
[0270]
10.1用t细胞活化和增殖来研究anti-ox40scfv抗体的体外活性和评价其激动剂(agonist) 功能。
[0271]
利用人淋巴细胞分离液(天津灏洋)密度梯度离心从健康捐献者外周血浓缩白细胞中分 离外周血单个核细胞pbmc,接种到rpmi完全培养基中。预先用50μl 1μg/ml的anti-cd3包 被96孔板,4℃过夜。实验组用50μl 2μg/ml的o21 scfv,37℃包被2h,和同时加上soluble 形式终浓度2μg/ml o21 scfv+终浓度4μg/ml cross-link(jackson immunoresearchlaboratories:109-006-008),阴性对照为rpmi完全培养基。pbmc量为2
×
105/孔,培养五天 后取上清。如图10所示,利用ifn-γelisa检测试剂盒(ebioscience)检测上清中ifn-γ的 水平(图10a),以及用brdu染色试剂盒(罗氏:11647229001)检测t细胞增殖(图10b), 可见o21 scfv在coating和cross-link两种用药方式下均有较好的活化pbmc和促进t细胞 增殖的活性。
[0272]
10.2用体外pbmc和cd4+t细胞活化评价o21 scfv和igg两种形式的agonist活性
[0273]
利用人淋巴细胞分离液(天津灏洋)密度梯度离心从健康捐献者外周血浓缩白细胞中分 离外周血单个核细胞pbmc,接种到rpmi完全培养基中。用cd4+t细胞分离试剂盒(美天 旎,cat#no.130-096-533)从pbmc中分离cd4+t细胞。预先用50μl 1μg/ml的anti-cd3包被 96孔板,4℃过夜。实验组用50μl 2μg/ml的o21 scfv或o21 ma
[0274]
b,37℃包被2h,阴性对照为同等剂量的higg-fc。pbmc和cd4+t细胞量为2
×
105/孔, 培养五天后取上清,利用ifn-γelisa检测试剂盒(ebioscience)检测上清中ifn-γ的水平。
[0275]
如图11所示,对于pbmc和cd4+t细胞,可以看出在体外o21抗体的全抗体mab型 比scfv型有更好的agonist活性。
[0276]
实施例11:igg1和igg4亚型的anti-ox40抗体h96-l80对t细胞亚群的影响
[0277]
按照实施例10操作,获得人外周血单核细胞(pbmc),将pbmc用溶解的抗 cd28(0.5μg/ml)和结合板的抗cd3(3μg/ml)和抗人ox40mab h96-l80 igg1或igg4(10μg/ml) 刺激。48小时后,收获细胞。用biolegend抗体apc anti-human cd4和pe anti-human cd8a (cat#301008)染色,或用biolegend抗体apc anti-human cd4和pe anti-human foxp3 (cat#320208)染色,流式细胞仪进行检测。结果如下图所示,o21 mab h96-l80 igg1和igg4 两种亚型可以降低cd4+foxp3+treg在cd4+t细胞中的比例(图12a),但对cd4+t与 cd8+t细胞的比例没有影响(图12b)。
[0278]
实施例12:anti-ox40抗体在小鼠体内对肿瘤生长的抑制作用
[0279]
12.1使用植入肿瘤细胞pc-3和人pbmc的nod-scid小鼠肿瘤肿瘤模型,来评价anti
‑ꢀ
ox40抗体在体内的药效
[0280]
在第0天用pc-3(atcc crl-1435
tm
)和人的外周血单个核细胞(pbmc)一起进行皮 下(sc)注射小鼠,并在第0、7天用10mg/kg的o21mab或pbs腹腔注射给药,pbs作为 阴性对照,每组5只小鼠。每周两次观察肿瘤的形成,并用游标卡尺测量肿瘤长径和短径, 计算肿
瘤体积,绘制肿瘤生长曲线图,结果如图13所示,可以看出抗体o21 mab可以显著 抑制肿瘤生长。
[0281]
12.2使用植入肿瘤细胞a375和人pbmc的nod-scid小鼠肿瘤肿瘤模型,来评价anti
‑ꢀ
ox40抗体在体内的药效
[0282]
在第0天用7
×
106的a375(atcc crl-1619
tm
)和1
×
106人的外周血单个核细胞(pbmc) 一起进行皮下(sc)注射小鼠,并在第0、7天用1mg/kg的o21 mab或pbs腹腔注射给药, pbs作为阴性对照,每组5只小鼠。每周两次观察肿瘤的形成,并用游标卡尺测量肿瘤长径 和短径,计算肿瘤体积,绘制肿瘤生长曲线图,如图14所示,可以看出抗体o21 mab可以 显著抑制肿瘤生长。
[0283]
实施例13:anti-ox40 abs稳定性检测
[0284]
对anti-hox40抗体o21 mab的稳定性用45℃加速稳定性实验进行检测。具体实验方法 为:将抗o21 mab抗体浓缩至约10mg/ml,置于45℃水浴,在第0天、第10天、第20天、 第30天收样进行浓度、sec-hplc、nf-κb分析实验。sec-hplc采用岛津lc20at hplc液 相色谱仪进行分析实验,将样品浓缩至1mg/ml,流速为0.5ml/min上样,总上样量为50ug, 上样后进行等度洗脱30min;nf-κb按实施例7进行操作,结果如图15所示,可以看到anti
‑ꢀ
hox40抗体o21 mab在体外有较好的稳定性。
[0285]
实施例14anti-hox40抗体o21 mab的药物代谢动力学评价
[0286]
用10mg/kg和1mg/kg的剂量来评价h96-l80 igg1抗体的药物代谢动力学。使用balb/c、 雌性、8周龄小鼠,取16只小鼠,每个剂量分为a/b两组,每组四只。向所有的小鼠静脉注 射h96-l80 igg1抗体200μg(10mg/kg)或20ug(1mg/kg),给药后分14个时间点分别取血 100μl,每个时间点取一组小鼠,两组轮换。分离血清。用elisa方法检测血清中受试蛋白的 浓度:hox40-mufc包板,加入适当稀释度的血清样品,然后加入goat anti-human igg hrp (sigma catno:a0170),用tmb显色。使用h96-l80 igg1抗体作为标准蛋白做标准曲线。 利用winnolin软件计算药代动力学参数。平均c-t曲线如图16所示,经检测,本发明的h96
‑ꢀ
l80 igg1抗体比较稳定,1mg/kg的剂量其体内半衰期平均为205小时;10mg/kg的剂量其体 内半衰期平均为371小时。经检测,没有anti-h96-l80的抗抗体产生。
[0287]
以上所述仅是本发明的优选实施方式,并不用于限制本发明,应当指出,对于本技术领 域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型, 这些改进和变型也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1