一种基于丙二酰辅酶A再生的柚皮素体外酶促合成方法
一种基于丙二酰辅酶a再生的柚皮素体外酶促合成方法
技术领域
1.本发明涉及一种基于丙二酰辅酶a再生的柚皮素体外酶促合成方法,分类号为c12n9,属于生物医药技术领域。
背景技术:
2.丙二酰辅酶a(malonyl
‑
coenzyme a)是一种辅酶a衍生物。作为一种关键的中间代谢物,丙二酰辅酶a在多种代谢途径中发挥重要作用,是细胞内合成脂肪酸和甘油三酯的重要前体分子(kastaniotis a j, et al. biochim biophys acta mol cell biol lipids, 2017, 1862(1): 39
‑
48.),也是合成聚酮类化合物(shimizu y, et al. chembiochem, 2017, 18(1): 50
‑
65.)和许多平台化合物(kildegaard k r, et al. microb cell fact, 2016, 15: 53.)的原材料。
3.一般而言,细胞内的辅酶a经乙酰辅酶a合成酶(acetyl
‑
coa synthase, acs)和乙酰辅酶a羧化酶(acetyl
‑
coa carboxylase, acc)的先后催化,形成丙二酰辅酶a(qu q, et al. cell death dis, 2016, 7(5): e2226.)。丙二酰辅酶a在参与细胞反应并被消耗的同时,脱去羧基重新生成辅酶a(waki t, et al. nat commun, 2020, 11(1): 870.)。因此,丙二酰辅酶a在细胞内处于一种动态平衡。由于丙二酰辅酶a的胞内含量低,分离和纯化难度较大,并且难以通过化学方法合成,导致其市场价格通常远高于其下游产品,因而制约了这一辅助因子在工业化生产中的广泛应用。
4.近年来,学者们尝试通过多种途径提高微生物细胞内丙二酰辅酶a的量,如通过提高细胞内乙酰辅酶a的含量(krivoruchko a, et al. metab eng, 2015, 28: 28
‑
42.)或乙酰辅酶a羧化酶的表达水平(wang j c, et al. biosci biotechnol biochem, 2016, 80(6): 1214
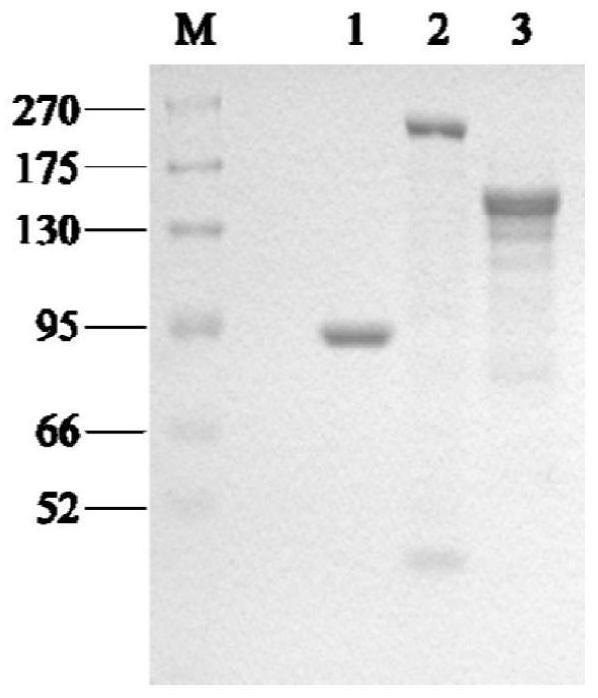
‑
1222.)等手段促进丙二酰辅酶a的形成,同时限制丙二酰辅酶a流向与目标分子无关的通路(yang d,et al. proc natl acad sci u s a, 2018, 115(40): 9835
‑
9844.),从而提高目标分子的产量。然而,目前在体外合成体系中尚无类似策略降低因丙二酰辅酶a带来的高生产成本。
技术实现要素:
5.本发明所要解决的技术问题是,克服现有技术的不足而提供一种基于丙二酰辅酶a再生的柚皮素酶促合成方法,该方法首先建立一种丙二酰辅酶a的再生体系,以显著降低了体外酶促合成柚皮素时因昂贵的丙二酰辅酶a所带来的高成本,该体系同样适应于其他需要以丙二酰辅酶a为底物的生化反应;同时构建一种高活性三功能酶,并通过优化体外反应条件显著提高了目标分子的产量和底物的总转化率。
6.本发明提供了一种基于丙二酰辅酶a再生的柚皮素体外酶促合成方法,具体包括以下步骤:步骤1、克隆丙二酰辅酶a再生体系中关键酶基因从大肠杆菌中克隆acs基因,构建重组质粒pet
‑
32a
‑
acs,从毕赤酵母中克隆acc1
基因,构建重组质粒pgap
‑
neo
‑
acc1;步骤2、重组蛋白acs和acc1的诱导表达与纯化将重组质粒pet
‑
32a
‑
acs转化感受态大肠杆菌,iptg诱导表达、纯化,得到重组蛋白acs;同时将重组质粒pgap
‑
neo
‑
acc1转化毕赤酵母,经过表达和纯化,得到重组蛋白acc1;步骤3、从头合成柚皮素的重组三功能酶的构建、表达与纯化利用重叠延伸pcr技术,将大豆的4
‑
香豆酰辅酶a连接酶基因4cl1和查尔酮异构酶基因chi以及高粱的查尔酮合酶基因chs2用柔性连接肽(ggggs)2相连接,构建原核表达质粒pet
‑
32a
‑
sumo
‑
4cl1
‑
(ggggs)2‑
chs2
‑
(ggggs)2‑
chi,将原核表达质粒pet
‑
32a
‑
sumo
‑
4cl1
‑
(ggggs)2‑
chs2
‑
(ggggs)2‑
chi转化大肠杆菌,iptg诱导表达、纯化,得到重组三功能酶;步骤4、建立基于丙二酰辅酶a再生的体外酶促合成体系基于丙二酰辅酶a再生的体外酶促合成体系至少包含tris
‑
hcl、磷酸钾缓冲液、甘油、mgcl2、atp、coa、醋酸钠、nahco3、acs、acc1,并在该体系中加入用于合成柚皮素的重组三功能酶,然后在一定条件下反应得到反应产物。
7.本发明设计一种丙二酰辅酶a再生的反应体系,在构建乙酰辅酶a合成酶acs基因与乙酰辅酶a羧化酶acc1基因的重组表达质粒的基础上,将重组质粒分别转化大肠杆菌和酵母细胞,表达目的蛋白,并将纯化的acs与acc1重组蛋白加入柚皮素体外酶促合成体系中,实现了丙二酰辅酶a的再生,以及以4
‑
香豆酸为底物在体外低成本酶促合成柚皮素。本发明设计了一个新的反应体系,无需添加昂贵的丙二酰辅酶a便能对其进行再生利用,并最终生成柚皮素。该体系仅需添加低成本的无机盐、atp和能够维持丙二酰辅酶a循环生成的辅酶a,反应产物单一,易于分离纯化,成本可控,使柚皮素体外合成在生产层面成为可能,同时为其他利用丙二酰辅酶a进行生产的方案提供新思路。
8.所述步骤1中,克隆acs基因时,设计一对pcr引物:正向引物为5
’‑
gctgatatcggatccgaattcatgagccaaattcacaaacac
‑3’
,斜体碱基示酶切位点ecori;反向引物为5
’‑
gtggtggtggtggtgctcgagttacgatggcatcgcgatag
‑3’
,斜体碱基示酶切位点xhoi;克隆acc1基因时,设计一对pcr引物:正向引物为5
’‑
ctatttcgaaacgaggaattcatgagcgaagaaagcttattc
‑3’
,斜体碱基示酶切位点ecori;反向引物为5
’‑
tcgggcccaagctggcggccgcctttcaaagtcttcaacaatttttc
‑3’
,斜体碱基示酶切位点noti。
9.采用南京诺唯赞生物科技股份有限公司的非连接酶依赖型单片段快速克隆试剂盒(clonexpress ii one step cloning kit)将pcr片段分别克隆至原核表达质粒pet
‑
32a(+)和酵母表达质粒pgap
‑
neo。
10.所述步骤2中,取重组质粒pet
‑
32a
‑
acs,常规转化感受态大肠杆菌bl21(de3),37 ℃、220 rpm培养过夜;挑取3~5个菌落,接种至含有100
ꢀµ
g/ml氨苄青霉素的lb培养基中,37 ℃、250 rpm培养过夜;按照1:100转接至300 ml含有100
ꢀµ
g/ml氨苄青霉素的lb培养基,37 ℃ 250 rpm培养约2 h,至菌液od
600nm
达0.4~0.6;向菌液中加入iptg至终浓度0.1 mm,20 ℃诱导表达4 h,4 ℃离心收集菌体;参照碧云天beyogold
™ꢀ
his
‑
tag purification resin试剂说明书纯化重组蛋白;用tris
‑
cl缓冲液(ph 7.5)常规透析纯化的重组蛋白,再用peg 20000进行浓缩,收集蛋白溶液,加入甘油至终浓度10%,分装,
‑
80 ℃保存备用。
4cc,4cc为重组三功能酶;将配制的合成体系置于恒温摇床中,在25~35 ℃、600 rpm条件下反应6 h,加入naoh溶液至终浓度为1 m,终止反应。
18.反应产物的检测:取上述已经终止反应的100 μl反应液,加入等体积乙酸乙酯,萃取2 h,吸取上层有机相。同上再次萃取,合并有机相,空气干燥,加入75 μl hplc级甲醇溶解,再加入75 μl 50% hplc级乙腈,混匀,经0.22 μm有机系微孔滤膜过滤,进行高效液相色谱分析(hplc)。
19.本发明建立了一种丙二酰辅酶a的体外再生体系,并在此基础上以4
‑
香豆酸为原料在重组三功能酶的催化下从头合成柚皮素,其产量高达3.99 mg/l;并且本发明的柚皮素体外酶促合成体系成分简单,不存在工程菌细胞内复杂的调控作用,反应过程易于精确控制、副产物少、产品分离相对简单、生产周期明显缩短、生产成本显著降低。
附图说明
20.图1为本发明三功能酶纯化蛋白的sds
‑
page电泳图。图中:1表示acs,2表示acc1,3表示4cc。
21.图2为本发明中hplc法分析三功能酶活性的结果图。图中:a表示4
‑
香豆酸标准品,出峰时间为6.11 min;b表示柚皮素标准品,出峰时间为11.22 min;c表示实验组。
具体实施方式
22.下面结合实施例对本发明的技术方案做进一步的详细说明:本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护权限不限于下述的实施例。
23.实施例中所涉及材料的来源:g
‑
418购自gibco公司;0.4 mm玻璃珠购自柏奥易杰easybio公司。毕赤酵母gs115购自invitrogen公司;非变性裂解液由本实验室配制,每升含6.9 g nah2po4
•
h2o,17.54 g nacl,蒸馏水溶解后用10 m氢氧化钠调节ph值至8.0;pet
‑
32a
‑
sumo载体由本实验室构建:将novagen公司的pet
‑
32a(+)载体中的硫氧还蛋白trxa替换为小分子泛素样修饰蛋白sumo后得到;pgap
‑
neo载体由本实验室构建:将invitrogen公司的pgapz a载体的博来霉素抗性基因替换为新霉素抗性基因后得到。
24.本实施例所涉及的其余试剂及材料均为市购,此处不再一一列举。本实施例中所涉及的“%”若没有特殊说明,一般为质量百分比。
25.实施例11.重组质粒的构建根据genbank数据库提供的大肠杆菌乙酰辅酶a合成酶基因acs和酵母乙酰辅酶a羧化酶基因acc1的核苷酸序列信息,设计两对引物序列,用于将acs基因的编码区克隆至大肠杆菌表达载体pet
‑
32a(+),将acc1基因的编码区克隆至毕赤酵母表达载体pgap
‑
neo:pcr扩增acs基因的正向引物为5
’‑
gctgatatcggatccgaattcatgagccaaattcacaaacac
‑3’
(如seq id no.3所示),斜体碱基表示酶切位点ecori;反向引物为5
’‑
gtggtggtggtggtgctcgagttacgatggcatcgcgatag
‑3’
(如seq id no.4所示),斜体碱基表示酶切位点xhoi。
26.pcr扩增acc1基因的正向引物为5
’‑
ctatttcgaaacgaggaattcatgagcgaagaaagcttattc
‑3’
(如seq id no.5所示),斜体碱基表示酶切位点ecori;反向引物为5
’‑
tcgggcccaagctggcggccgcctttcaaagtcttcaacaatttttc
‑3’
(如seq id no.6所示),斜体碱基表示酶切位点noti。
27.参照康为世纪super pfx dna polymerase操作说明建立如下pcr扩增体系:试剂100μl反应体系5
×
superpfxhfbuffer20μldntpmix,10mmeach2μlforwardprimer,10μm5μlreverseprimer,10μm5μltemplatedna1μlsuperpfxdnapolymerase1μlddh2o66μl扩增acs基因的模板dna为培养4 h的大肠杆菌dh5α菌液1 μl,扩增acc1基因的模板dna为毕赤酵母gs115的cdna,pcr反应条件如下:步骤温度时间预变性98℃3min变性98℃5s退火45℃15s延伸72℃2min30s终延伸72℃10minpcr反应产物进行dna凝胶电泳并对目的条带进行胶回收。载体pet
‑
32a(+)和pgap
‑
neo分别经ecori/xhoi和ecori/noti双酶切,进行dna凝胶电泳并对目的条带进行胶回收。使用南京诺唯赞生物科技股份有限公司的非连接酶依赖型单片段快速克隆试剂盒(clonexpress ii one step cloning kit)连接目的片段和载体,常规转化感受态大肠杆菌dh5α,均匀涂布于氨苄抗性的lb平板,37 ℃过夜培养。第二天挑单菌落,接种至3 ml氨苄抗性的lb液体培养基中,37 ℃ 250 rpm培养15 h,提取质粒后进行测序鉴定,获得重组质粒pet
‑
32a
‑
acs 和pgap
‑
neo
‑
acc1。
28.用重叠延伸pcr技术拼接关键酶基因4cl1、chs2和chi,用南京诺唯赞生物科技股份有限公司的非连接酶依赖型单片段快速克隆试剂盒(clonexpress ii one step cloning kit)将pcr片段克隆至原核表达质粒pet
‑
32a
‑
sumo,构建重组质粒pet
‑
32a
‑
sumo
‑
4cl1
‑
(ggggs)2‑
chs2
‑
(ggggs)2‑
chi。构建重组质粒pet
‑
32a
‑
sumo
‑
4cl1
‑
(ggggs)2‑
chs2
‑
(ggggs)2‑
chi过程中,根据黄豆的4
‑
香豆酰辅酶a连接酶基因4cl1和查尔酮异构酶基因chi以及高粱的查尔酮合酶基因chs2设计引物,克隆4cl1基因时,设计一对pcr引物:正向引物为5
’‑
gaacagattggtggtggatccatggcaccttctccacaa
‑3’
,斜体碱基示酶切位点bamhi;反向引物为5
’‑
cgacccacctccgcccgacccacctccgccactagtattggccaccaccaaacc
‑3’
。
29.克隆chs2基因时,设计一对pcr引物:正向引物为5
’‑
ggcggaggtgggtcggctagcatggccggcgcgactgtg
‑3’
;反向引物为5
’‑
actgcccccgccacccgatcccccgccaccggatccggcggtgatggccgctccg
‑3’
;克隆chi基因时,设计一对pcr引物:正向引物为5
’‑
ggtggcgggggcagtgaattcatggcaacgatcagcgcg
‑3’
;反向引物为5
’‑
gtggtggtggtggtgctcgagtcagactataatgccgtggc
‑3’
,斜体碱基示酶切位点xhoi。
30.2.重组蛋白的诱导表达与纯化2.1acs的诱导表达与纯化取重组质粒pet
‑
32a
‑
acs,常规转化感受态大肠杆菌bl21(de3),37℃、220rpm培养过夜;挑取3~5个菌落,接种至含有100
µ
g/ml氨苄青霉素的lb培养基中,37℃、250rpm培养过夜;按照1:100转接至300ml含有100
µ
g/ml氨苄青霉素的lb培养基,37℃250rpm培养约2h,至菌液od
600nm
达0.4~0.6;向菌液中加入iptg至终浓度0.1mm,20℃诱导表达4h,4℃离心收集菌体;参照碧云天beyogold
™
his
‑
tagpurificationresin试剂说明书纯化重组蛋白;用tris
‑
cl缓冲液(ph7.5)常规透析纯化的重组蛋白,再用peg20000进行浓缩,收集蛋白溶液,加入甘油至终浓度10%,分装,
‑
80℃保存备用。重组蛋白acs的氨基酸序列如seqidno.1所示。
31.2.2acc1的表达与纯化取重组质粒pgap
‑
neo
‑
acc1,采用licl法转化毕赤酵母gs115(购自invitrogen公司),涂板为含有500
µ
g/ml遗传霉素g
‑
418(购自gibco公司)的ypd平板,30℃恒温培养箱中倒置培养;3d后,挑取单菌落,接种至2ml含有500
µ
g/mlg
‑
418的ypd液体培养基中,30℃、250rpm培养24h;按质量比1:100转接到300ml含有500
µ
g/mlg
‑
418的ypd液体培养基,30℃、250rpm继续培养12h;4℃、5000g离心10min,收集菌体;加入16.5g0.4mm玻璃珠(购自柏奥易杰easybio公司)和21ml非变性裂解液(由本实验室配制,称取6.9gnah2po4•
h2o和17.54gnacl,溶于800ml蒸馏水,用10m氢氧化钠调节ph值至8.0,再用蒸馏水定容至1l),在涡旋振荡仪中破碎酵母菌体;离心,收集裂解上清,进行硫酸铵沉淀,硫酸铵终浓度为40%饱和度;4℃、7000g离心20min,弃上清,沉淀用非变性裂解液溶解;参照碧云天beyogold
™
his
‑
tagpurificationresin试剂说明书纯化重组蛋白;配制ph7.5透析缓冲液(含100mmtris
‑
hcl和100mm磷酸钾),对纯化后的蛋白透析3次,3h/次;peg20000浓缩透析后的蛋白溶液,加入甘油至终浓度10%,分装,
‑
80℃保存备用。重组蛋白acc1的氨基酸序列如seqidno.2所示。
32.2.3重组三功能酶的油道表达与纯化取原核表达质粒pet
‑
32a
‑
sumo
‑
4cl1
‑
(ggggs)2‑
chs2
‑
(ggggs)2‑
chi,按常规方法转化大肠杆菌bl21(de3)或rosetta(de3),经0.05mmiptg于16℃诱导表达12h,利用镍柱亲和纯化重组三功能酶蛋白4cc,透析,peg20000浓缩,加入甘油至终浓度10%,分装,
‑
80℃保存备用。
33.对上述三种纯化蛋白进行sds
‑
page电泳,结果见图1,图中1表示acs,2表示acc1,3表示4cc。
34.3.基于丙二酰辅酶a再生的柚皮素体外酶促合成体系的建立设计丙二酰辅酶a的体外合成体系,该体系含有100mmtris
‑
hcl(ph7.5)、100mm磷酸钾缓冲液(ph7.5)、10%甘油、5mmmgcl2、0.1mg/mlbsa、1%dmso、1mmβ
‑
巯基
乙醇、6 mm atp、1 mm coa、10 mm 醋酸钠、50 mm nahco3、0.6 mm 4
‑
香豆酸、60 μg/ml acs、60 μg/ml acc1、60 μg/ml 4cc。将配制的合成体系置恒温摇床中, 30 ℃、600 rpm反应6 h,加入naoh溶液至终浓度为1 m,终止反应。
35.4.产品柚皮素的检测条件取上述已经终止反应的反应液100 μl,加入等体积乙酸乙酯,萃取2 h,吸取上层有机相。同上再次萃取,合并有机相,空气干燥,加入75 μl hplc级甲醇溶解,再加入75 μl 50% hplc级乙腈,混匀,经0.22 μm有机系微孔滤膜过滤,进行高效液相色谱分析(hplc),hplc检测结果如图2所示,图中a表示4
‑
香豆酸标准品,出峰时间为6.11 min;b表示柚皮素标准品,出峰时间为11.22 min;c表示实验组(即上述丙二酰辅酶a的体外合成体系反应后的产物)。hplc检测条件如下:仪器设备:美国安捷伦公司1260液质联用仪(agilent 1260)。
36.色谱柱:agilent c18column(150
×
4.6 mm,5 μm,thermo fisherscientific.inc.,san jose,ca,usa)。柱温:35 ℃。
37.流动相:a(乙腈),b(milli q水),梯度洗脱:0
‑
4 min,a:20%
‑
22%,b:80%
‑
78%;4
‑
7 min,a:22%
‑
42%,b:78%
‑
58%;7
‑
10 min,a:42%
‑
38%,b:58%
‑
62%;10
‑
15 min,a:38%
‑
95%,b:62%
‑
5%;15
‑
24 min,a:95%,b:5%;24
‑
25 min,a:95%
‑
20%,b:5%
‑
80%。
38.进样量:20 μl;流速:1 ml/min;检测器:紫外检测器(vwd);检测波长:λ=280 nm;330 nm。
39.经测定,柚皮素的产量为3.99 mg/l。
40.柚皮素具有多种药理生理活性,在生物医药领域具有广泛的应用前景。与微生物细胞工厂发酵法相比较,本发明提供了一种操作简便、产品分离相对简单、生产周期明显缩短、生产成本显著降低的制备方法。以酿酒酵母生产柚皮素为例,发酵培养一般超过48小时,而使用本发明的制备方法,每次耗时仅3小时,受原材料和人力的限制较小,易于放大。如果算上人工成本,则相对生产成本还会进一步降低,因此潜在的经济效益将是相当可观的。
41.以上所述,仅为本发明中的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉该技术的人在本发明所揭露的技术范围内,可理解想到的变换或替换,都应涵盖在本发明的包含范围之内,因此,本发明的保护范围应该以权利要求书的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1