低强度超声促进体细胞重编程为诱导性多能干细胞的方法
1.本发明涉及超声医学和再生医学技术领域,尤其是涉及一种诱导性多能干细胞的制备方法和应用。
背景技术:
2.通过将四种转录因子oct4,sox2,klf4和c
‑
myc基因(又称山中因子)转导到已分化的体细胞中,诱导体细胞退分化重新编程为具有多能干细胞性质的细胞群体,这类细胞被命名为诱导性多能干细胞(induced pluripotent stem cells,ipscs)。2006年日本科学家山中伸弥(shinya yamanaka)对24个转录因子进行筛选,最终确定了四因子的重编程方法,先后在小鼠和人的成纤维细胞中诱导出ipscs,为世人瞩目。随后世界多个生物研究室都相继完成ipscs的诱导,并证实了ipscs具有与胚胎干细胞极为相似的属性,能够进行自我更新和分化为三胚层,在疾病模型构建、药物筛选和干细胞疗法等研究中具有广阔的应用前景,是再生医学的重要里程碑。
3.理论上全身细胞都可以被重编程为ipscs,且由于细胞是自体来源,可以免受伦理和免疫排斥的限制。然而,ipscs的转染成功率低、培养周期长、制备成本高成为其在临床上推广和应用的瓶颈。例如,在一个培养周期中,仅约0.5%的小鼠胚胎成纤维细胞(约12天)和约0.0002%的人真皮成纤维细胞(约25天)能够被成功诱导出ipscs。近十几年来,许多研究通过改变生物载体(使用不同的病毒株)或添加化合物小分子来提高ipscs的诱导效率,被证实具有提升重编程的效果,然而其培养成本也随之上涨。超声仪是一种常见的仪器,其发射振动频率在20khz以上的机械波,在临床上不仅用于人体组织或血流成像,还可用于促骨折愈合、加速软组织再生和抑制炎症等理化治疗作用,具有低成本、无电离辐射且适用范围广泛等优势。此外,低强度脉冲超声可用于介导血脑屏障开放、促进成骨细胞再生和神经源细胞分化,在调节细胞功能及代谢方面具有特殊效果。据报道,在ipscs培养的早期,细胞的能量代谢和供能方式发生剧烈变化,这些变化由于细胞的线粒体息息相关。有文献报道,线粒体渗透性转换孔(mptp)开放的细胞具有更高效的形成ipscs的能力。mptp开放介导phf8蛋白降低h3k9me2/h3k27me3的甲基化水平,促进ipscs的产生。而超声亦有调节mptp的能力,低强度超声结合微泡产生的空化效应,能够促使细胞mptp开放,这为超声调节细胞代谢或促进细胞重编程奠定基础。此外,超声还具有重塑染色质的作用,其为染色质的多位点开放和多基因表达提供了条件。最后,超声空化效应会改变细胞内ros水平,后者在重编程或者及维持ipsc形态中有着重要作用。总而言之,超声作为一种临床上常用的诊断及治疗技术,在再生医学领域尤其是介导细胞重编程、提高ipscs产生效率方面有特殊效用。
4.本发明充分利用自主搭建的超声辐照平台的优势结合细胞重编程实验,利用无辐射、安全、经济的超声促进体细胞重编程,提高ipscs细胞的获取效率,开发一种新型的高效细胞重编程辅助技术。
技术实现要素:
5.为了解决现有技术体细胞重编程为ipscs细胞效率不高的问题,本发明提出低强度超声促进体细胞重编程为诱导性多能干细胞的方法。
6.为了达到上述目的,本发明利用超声相关生物学效应,在体细胞重编程早期进行刺激作用,促进诱导性多能干细胞的产生。提供了一种低强度超声促进体细胞重编程生成诱导性多能干细胞的方法,包括以下步骤:
7.(1)转染,使用慢病毒载体把oct4、sox2、klf4、c
‑
myc转染体细胞;
8.(2)转染后48h,采用超声辐照连续处理1
‑
5天,期间每日更换ipscs培养基,细胞异位过表达四种转录因子oct4、sox2、klf4、c
‑
myc,每日更换ipscs培养基,培养至细胞形态发生改变出现干细胞克隆体,此后更换为干细胞培养基,得到诱导性多能干细胞。
9.进一步地,所述步骤(1)的操作是:提前一天取6孔板培养基,每孔加入1ml 0.1%明胶铺板30min,取2
×
104个体细胞种植到所述6孔板中,每孔加入2ml相应的体细胞培养基,细胞培养箱(37℃,5%co2)中过夜。
10.慢病毒转染当天提前1h更换无血清培养基;取载有四种转录因子oct4、sox2、klf4、c
‑
myc的慢病毒(moi=20)和5μg/ml聚凝胺混合后加入待转染的所述6孔板中,置于条件为37℃,5%co2培养箱中继续过夜;次日吸弃旧培养基,每孔加入2ml新鲜的相应的体细胞培养基后继续培养。转染后48h,荧光显微镜下分析细胞转染情况。
11.进一步地,按下述公式取载有四种转录因子oct4、sox2、klf4、c
‑
myc的慢病毒体积和5μg/ml聚凝胺混合后加入待转染所述6孔板中,
12.病毒体积=(细胞数目
×
moi)/病毒滴度。
13.进一步地,所述体细胞是hdf;
14.所述体细胞培养基是hdf培养基;
15.所述hdf培养基(500ml)为添加50ml胎牛血清、5ml l
‑
谷氨酰胺、5ml非必需氨基酸、5ml青霉素/链霉素、435ml dmem培养基。
16.进一步地,所述ipscs培养基(500ml)为添加50ml胎牛血清、5ml l
‑
谷氨酰胺、5ml非必需氨基酸、5mlβ
‑
巯基乙醇(10mm)、1000u/ml白血病抑制因子和405ml knockout dmem。
17.进一步地,所述干细胞培养基(500ml)为添加50ml血清替代物、5ml l
‑
谷氨酰胺、5ml非必需氨基酸、5mlβ
‑
巯基乙醇(10mm)、1000u/ml白血病抑制因子和405ml knockout dmem。
18.进一步地,所述步骤(2)超声辐照处理是输出能量为声强0.2~1.4w/cm2、频率1mhz、占空比10%,辐照时间1分钟的脉冲波。
19.进一步地,所述步骤(2)超声辐照处理是输出能量为声强0.8w/cm2、频率1mhz、占空比10%,辐照时间1分钟的脉冲波。
20.进一步地,所述步骤(2)中采用超声辐照连续处理1
‑
5天,期间每日更换ipscs培养基;细胞异位过表达四种转录因子oct4、sox2、klf4、c
‑
myc,培养15
‑
20天,期间每日更换ipscs培养基,至细胞形态发生改变出现干细胞克隆体,此后更换为干细胞培养基,得到诱导性多能干细胞。
21.本发明还提供所述低强度超声促进体细胞重编程生成诱导性多能干细胞的方法得到的诱导性多能干细胞在制备自体细胞治疗药物中的应用。
22.本发明优点有:在细胞发生重编程的早期,向细胞提供超声刺激,通过超声特有的生物物理刺激方式改变细胞生长条件和调控其活动代谢,加快ipscs的产生;而且这种诱导的生产过程简单而有效,因此具有能够提高ipscs产出率和为临床提供自体细胞治疗的可能性。
附图说明
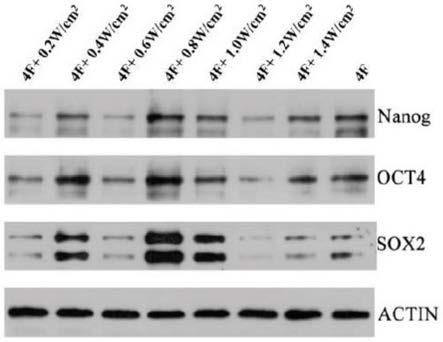
23.图1本发明不同处理组中多能基因nanog、oct4、sox2的蛋白表达ecl化学发光法实验结果图;
24.图2本发明不同处理组中多能基因nanog、oct4、sox2的蛋白表达量统计图;
25.图3本发明超声介导mptp开放验证示意图。
具体实施方式
26.下面将结合附图以及具体实施例来详细说明本发明,在此以本发明的示意性实施例及说明用来解释本发明,但并不作为对本发明的限定。
27.1.声场发射
28.超声辐照装置包括信号发生器
‑
功率放大器
‑
超声换能器,以水听器
‑
示波器
‑
计算机辅助采集声学参数,为细胞重编程环境提供一个均匀稳定的声场。
29.泰克afg3102c任意函数发生器提供标准形状的稳定波形,如正弦波、方波、脉冲波、三角波等等。此外,它允许用户利用自己定义的形状,生成所谓的任意波形。而且可以调制来自内部信号源或外部信号源的信号,生成扫频或输出信号突发。通过调节信号发生器的输出电压,改变声场的刺激强度,提供不同的超声能量。
30.本说明书中使用minicircuits lzy
‑
22+高功率放大器,输出最大值功率可达50w。
31.本说明书使用探头为1mhz平面探头,利用声场近场进行辐照。
32.2.细胞培养
33.增殖期p3人成纤维细胞(hdf)在hdf培养基中培养,每日换液。hdf培养基(500ml):50ml胎牛血清、5ml l
‑
谷氨酰胺、5ml非必需氨基酸、5ml青霉素/链霉素、435ml dmem培养基。
34.3.ipscs诱导
35.转染前一天取6孔板培养基,每孔加入1ml 0.1%明胶铺板30min,将步骤2.细胞培养的hdf细胞消化离心后,取2
×
104个hdf细胞种植到覆盖有1ml0.1%明胶的6孔板中,每孔加入2ml hdf培养基,细胞培养箱(37℃,5%co2)中过夜。慢病毒转染当天提前1h更换无血清培养基,记为第0天;
36.按下述公式取载有四种转录因子oct4、sox2、klf4、c
‑
myc的慢病毒体积和5μg/ml聚凝胺混合后加入待转染的所述6孔板中,置于条件为37℃,5%co2培养箱中继续过夜;
37.病毒体积=(细胞数目
×
moi)/病毒滴度
38.次日吸弃旧培养基,每孔加入2ml新鲜hdf培养基后继续培养。转染后48h,荧光显微镜下分析细胞转染情况。
39.4.超声辐照
40.在慢病毒转染后48小时开始进行超声辐照,分别设置8组,1~7组分别设置不同超
声强度(0.2w/cm2、0.4w/cm2、0.6w/cm2、0.8w/cm2、1.0w/cm2、1.2w/cm2、1.4w/cm2,频率1mhz,占空比10%,辐照时间1分钟),最后一组为无超声辐照组(4f),作为实验对照。
41.8组均采用超声辐照连续处理5天,期间每日更换ipscs培养基,培养15~20天左右,期间每日更换ipscs培养基,细胞形态发生改变,出现干细胞克隆体,过渡更换为干细胞培养基,得到诱导性多能干细胞。
42.ipscs培养基(500ml):50ml胎牛血清、5ml l
‑
谷氨酰胺、5ml非必需氨基酸、5mlβ
‑
巯基乙醇(10mm)、1000u/ml白血病抑制因子和405ml knockout dmem。
43.干细胞培养基(500ml):50ml血清替代物、5ml l
‑
谷氨酰胺、5ml非必需氨基酸、5mlβ
‑
巯基乙醇(10mm)、1000u/ml白血病抑制因子和405ml knockout dmem。
44.5.重编程效率的量化
45.显微镜下观察细胞,当发现类似干细胞形态的细胞团时开始进行计数,比较不同超声声强处理后干细胞团数量之间的差异。结果表明,声强为0.8w/cm2的实验组干细胞团数量最多。
46.6.超声介导hdf线粒体渗透性转化孔(mptp)开放验证
47.分别使用calcein am染色细胞质(绿色)、mitotracker染色线粒体(红色)、hoechst 33342染色细胞核(蓝色)对按照上文方法超声辐照后的hdf的mptp开放情况进行染色分析。calcein am能渗入细胞,分布在细胞质和细胞器中,使整个细胞在激发光下发出绿色荧光,加入calcein am荧光淬灭剂后,细胞内calcein am荧光将被淬灭。若线粒体mptp开放,calcein am淬灭剂便能进入线粒体内将内部calcein am清除,此时荧光显微镜下只观察到线粒体发出的红光和细胞核发出的蓝光;若mptp不开放,则细胞质荧光被淬灭,而线粒体仍保留calcein am绿色荧光,此时mitotracker的红色荧光与calcein am的绿色荧光叠加呈黄色。control组和超声组进行实验,结果如图3所示,从实验结果得知,与control组相比,超声组仅观察到线粒体的红光及细胞核的蓝光,证实超声处理细胞后的细胞质和线粒体内calcein am荧光均被淬灭,表明超声具有介导mptp开放的作用。
48.7.western blot检测多能基因的蛋白表达
49.为进一步验证感染人成纤维细胞的多能基因蛋白表达情况,对不同组别的干细胞多能基因表达情况进行比较,选择多能干细胞的基因中具有代表性的oct4、sox2和nanog作为目标基因,gapdh为内参进行分析。利用western blot方法检测已诱导成功的ipscs多能因子的蛋白表达情况。
50.使用慢病毒转染及超声处理hdf后,在培养周期的第15天左右,取部分细胞提取蛋白,通过western blot分析多能基因nanog、oct4、sox2的蛋白表达差异。过程如下:
51.使用ripa裂解液(50mmol/ltrishcl,ph 7.4,1mmol/l edta,1mmol/lpmsf,aprotinin 1μg/ml,leupeptin 1μg/ml)提取细胞总蛋白。冰上孵育30min;移入离心管,4℃,15000rpm离心15min,取上清;采用抗干扰lowry法蛋白定量试剂盒(购自珠海健康元生物技术公司)以lowry法进行蛋白定量;随后各样品取12μl此蛋白加入3μl 5
×
sds上样缓冲液,100℃煮沸5min;进行sds
‑
聚丙烯酰胺凝胶电泳,电转移蛋白至nc膜;5%脱脂奶粉封闭,4℃孵育过夜,次日加入oct4、sox2和nanog的一抗室温孵育3h;漂洗后加入oct4、sox2和nanog的hrp标记的二抗(羊抗鼠igg 1:2000,海门碧云天生物公司)室温孵育l h,tbst缓冲液冲洗3次,每次5min;ecl化学发光法显示结果,压片曝光。结果如图1所示。统计分析后,
oct4、sox2和nanog的表达量如图2所示。
52.本发明在细胞重编程的基础上加入超声辐照。通过不同超声能量刺激改变细胞生长条件。在早期细胞发生剧烈重塑的条件下,施加不同的超声能量场,加快重编程过程,缩短重编程周期,提高ipscs细胞获取效率。
53.以上对本发明实施例所提供的技术方案进行了详细介绍,本文中应用了具体个例对本发明实施例的原理以及实施方式进行了阐述,以上实施例的说明只适用于帮助理解本发明实施例的原理;同时,对于本领域的一般技术人员,依据本发明实施例,在具体实施方式以及应用范围上均会有改变之处,综上所述,本说明书内容不应理解为对本发明的限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1