一种模拟体内微环境的干细胞和关节软骨细胞共培养体系的构建方法
1.本发明涉及一种模拟体内微环境的干细胞和关节软骨细胞共培养体系的构建方法,属于细胞生物学技术领域。
背景技术:
2.骨关节炎(oa)是一种晚期关节软骨损伤,影响了全球四分之一以上的成年人口。其临床表现包括关节疼痛、关节畸形和关节活动受限。软骨缺损修复的关键在于软骨再生。近年来,随着组织工程学的发展,有学者将自体关节软骨细胞植入软骨缺损处,发现其能够促进软骨缺损的修复。然而,关节软骨细胞体外纯化、培养和扩增比较困难,在体外达到实验所需细胞数量的周期较长,而修复周期越长对软骨损伤的恢复就越不利。在这种背景下,因干细胞具有多向分化以及高度增殖的能力,使应用干细胞治疗骨性关节炎成为研究热点。自1990年代以来,大量的临床研究已经证实将干细胞或含干细胞的材料植入关节腔可有效缓解轻度至中度软骨,产生透明软骨,减轻患者痛苦并改善生活质量。目前研究较多的干细胞包括骨髓间充质干细胞、胚胎干细胞、脂肪间充质干细胞、牙髓干细胞、人脐带间充质干细胞、肌源性干细胞和人羊膜上皮细胞等。干细胞移植后与局部自体软骨细胞的相互作用是骨性关节炎恢复的重要机制之一,然而,目前此类研究并没有在骨性关节炎的微环境去进行或者仍未深入探索研究。另一方面,il
‑
1β是目前公认的模拟骨性关节炎微环境的的细胞因子。因此,在il
‑
1β所模拟的骨性关节炎微环境下将具有强大分化能力的干细胞与软骨细胞进行共培养以此构建研究两者相互作用的研究体系对进一步研究干细胞移植修复骨性关节炎的效应机制尤为重要。本发明以人羊膜上皮细胞为例进行研究。
3.人羊膜上皮细胞是近年来在干细胞实验领域广受关注的“种子细胞”之一。人羊膜上皮细胞位于羊膜的最内层,由受精卵发育早期的囊胚内细胞团分化而来,早于原肠胚的形成,因此保留了原肠胚形成前的胚胎细胞可塑性。独特的组织胚胎学来源使人羊膜上皮细胞兼具原始的胚胎干细胞特性和上皮细胞样形态结构,在不同外源性因子作用下,具有向神经细胞、骨细胞、心肌细胞、脂肪细胞等三胚层细胞分化的潜能。另外,人羊膜上皮细胞较其他干细胞取材方便、来源丰富、免疫原性低,且人羊膜上皮细胞具有非致瘤性,应用更具安全性,有望成为再生医学一种可靠的细胞来源。虽然以往的研究已经证明了羊膜上皮细胞的软骨分化能力,但软骨细胞和人羊膜上皮细胞在骨性关节炎的微环境下的相互作用仍不清楚。
技术实现要素:
4.本发明提供了一种模拟体内微环境的干细胞和关节软骨细胞共培养体系的构建方法,包括如下步骤:
5.(1)前期准备:预处理transwell双层培养室,并将关节软骨细胞和干细胞进行预培养;
6.(2)共培养操作:
7.取干细胞转移到transwell双层培养室上层中,取关节软骨细胞接种到transwell双层培养室下层,加入共培养培养液培养;
8.或者,取关节软骨细胞转移到transwell双层培养室上层中,取干细胞接种到transwell双层培养室下层,加入共培养培养液培养;
9.(3)检测关节软骨细胞增殖能力和凋亡率,并观察和检测干细胞的形态变化及软骨特异性标志物表达。
10.进一步地,上述技术方案中,所述干细胞包括人羊膜上皮细胞、骨髓间充质干细胞、胚胎干细胞、脂肪间充质干细胞、牙髓干细胞、人脐带间充质干细胞、肌源性干细胞。
11.进一步地,上述技术方案中,transwell双层培养室的预处理方法为:将transwell双层培养室用i型胶原蛋白包被18
‑
24h,用pbs清洗后备用。
12.进一步地,上述技术方案中,所述关节软骨细胞的预培养方法为:将原代关节软骨细胞接种于培养容器中,加入关节软骨细胞培养液培养,待细胞融合率达80%
‑
90%时进行传代。一般传至第二代即可用于构建共培养体系。
13.进一步地,上述技术方案中,所述关节软骨细胞培养液包括10
‑
15v%胎牛血清和1
‑
2v%青链霉素的dmem/f12。
14.进一步地,上述技术方案中,所述干细胞的预培养方法为:将原代干细胞接种于培养容器中,加入干细胞培养液培养,待细胞融合率达80%
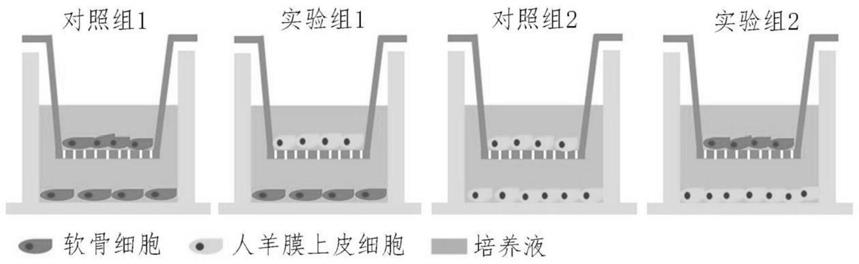
‑
90%时进行传代。一般传至第三代即可用于构建共培养体系。
15.进一步地,上述技术方案中,所述干细胞为人羊膜上皮细胞时的培养液包括10
‑
20ng/ml表皮生长因子、1
‑
2v%青链霉素、10
‑
15v%胎牛血清、1
‑
2v%非必需氨基酸、55
‑
60μmol/lβ
‑
巯基乙醇、1
‑
2mmol/l丙酮酸钠的dmem/f12;
16.所述干细胞为骨髓间充质干细胞时的培养液包括含10
‑
15v%胎牛血清、1
‑
2v%青链霉素的dmem/f12;
17.所述干细胞为胚胎干细胞时的培养液包括10
‑
15v%胎牛血清、1
‑
2v%青链霉素的dmem/f12;
18.所述干细胞为脂肪间充质干细胞时的培养液包括10
‑
15v%胎牛血清、1
‑
2v%青链霉素的α
‑
mem;
19.所述干细胞为牙髓干细胞时的培养液包括10
‑
15v%胎牛血清、1
‑
2v%青链霉素的α
‑
mem;
20.所述干细胞为人脐带间充质干细胞时的培养液包括10
‑
15v%胎牛血清和1
‑
2v%双抗的h
‑
dmem;
21.所述干细胞为肌源性干细胞时的培养液包括10
‑
15v%胎牛血清、1
‑
2v%青链霉素的dmem/f12。
22.进一步地,上述技术方案中,transwell双层培养室的上层细胞接种密度为4
×
104‑
16
×
104个/ml,下层的细胞接种密度为1
×
104‑4×
104个/ml,上下层接种细胞密度比例为3:1
‑
4:1;所述的transwell双层培养室在上层与下层之间设置的半透膜的孔径为0.4μm。
23.进一步地,上述技术方案中,所述共培养培养液包括10
‑
15v%胎牛血清,1
‑
2v%青霉素
‑
链霉素,10
‑
15ng/ml il
‑
β的高糖dmem培养基。
24.进一步地,上述技术方案中,当干细胞在上层培养室时,共培养的时间为24~48h;当关节软骨细胞在上层培养室时,共培养的时间为7~21d。
25.本发明还提供了根据上述模拟体内微环境的干细胞和关节软骨细胞共培养体系的构建方法构建的骨性关节炎体外细胞模型。
26.发明有益效果
27.本发明旨在构建一种模拟体内微环境的干细胞和关节软骨细胞共培养体系,如人羊膜上皮细胞和关节软骨细胞共培养体系,用于提供一种新的骨性关节炎体外细胞模型。
28.本发明打破单一细胞研究的固有思路,把干细胞与关节软骨细胞结合起来,采用非接触式共培养方式搭建干细胞和关节软骨细胞共培养体系。通过调整共培养所用的培养基,既适于关节软骨细胞生长,又适于干细胞生长。共培养体系中上述两种细胞可以通过transwell跨膜交换胞外分泌物质。该体系能够更好地模拟骨性关节炎的微环境,提供了一种更真实反映干细胞与关节软骨细胞在骨性关节炎体外微环境下的相互作用。
附图说明
29.图1为模拟体内微环境的人羊膜上皮细胞和关节软骨细胞共培养体系模型。
30.图2为人羊膜上皮细胞的形态观察、生长曲线绘制及免疫荧光鉴定。
31.图3为人羊膜上皮细胞的流式细胞鉴定。
32.图4为人羊膜上皮细胞对关节软骨细胞增殖的影响检测,数值以平均值
±
标准差(每组n=3)表示,***p<0.001;*p<0.05vs.对照组。
33.图5为人羊膜上皮细胞对关节软骨细胞凋亡的影响检测,数值以平均值
±
标准差表示(每组n=3),**p<0.01vs.对照组。
34.图6为关节软骨细胞诱导人羊膜上皮细胞软骨分化的形态观察与甲苯胺蓝染色及免疫组化染色检测。
35.图7为关节软骨细胞诱导人羊膜上皮细胞软骨分化的rt
‑
qpcr检测,数值以平均值
±
标准差表示(每组n=3),***p<0.001vs.对照组。
具体实施方式
36.下述非限定性实施例可以使本领域的普通技术人员更全面地理解本发明,但不以任何方式限制本发明。
37.实施例1
38.下文将结合具体附图详细描述本发明具体实施例。应当注意的是,下述实施例中描述的技术特征或者技术特征的组合不应当被认为是孤立的,它们可以被相互组合从而达到更好的技术效
39.本发明的人羊膜上皮细胞和关节软骨细胞共培养体系的建立方法,包括以下步骤:
40.预处理transwell细胞小室:将transwell细胞小室用i型胶原蛋白包被18
‑
24h,用pbs清洗后备用。
41.从procell购买关节软骨细胞,并将第二代的细胞用于体外实验。将细胞在含10v%胎牛血清的dmem/f12中培养;分离培养原代人羊膜上皮细胞。
42.人羊膜上皮细胞和关节软骨细胞获取和分离培养:
43.①
原代人羊膜上皮细胞细胞分离和培养:用镊子及直钳将羊膜从胎盘钝性剥离下来,生理盐水洗净。用200
‑
400ml含1
‑
2v%青链霉素的pbs液漂洗羊膜组织2
‑
3次,除去血细胞,尽快在2h内处理标本。从pbs中取出羊膜,沥干多余水分,置于灭菌培养皿中,剪成3cm2左右,挪至10cm培养皿中,加入0.25v%胰酶20ml,剪碎,转移至细胞筛网中,用瓶底研磨10min,37℃恒温水浴锅中消化30min,用200目钢网过滤以去除组织块,加入5ml
‑
10ml 10v%
‑
15v%胎牛血清中和胰酶,收集细胞悬液。未消化的羊膜组织可以继续用胰酶消化2
‑
3次。所有的细胞悬液,1200rpm离心3分钟,弃上清,用羊膜上皮细胞培养液重悬沉淀。台盼蓝计数,以1x105/cm2接种到直径为10cm的培养皿中。置体积分数为5%co2,37℃细胞培养箱内培养2h后轻轻将未贴壁的细胞吸出,再接种于新培养皿中。在饱和湿度、37℃、5%co2培养箱静置培养,48h后首次换液,待细胞达80
‑
90%融合时,用0.25v%胰酶/0.02v%edta消化传代培养,绘制第1代人羊膜上皮细胞的生长曲线。
44.②
关节软骨细胞培养:将原代关节软骨细胞接种于10cm的培养皿,加入关节软骨细胞培养液,在37℃,5%co2培养箱中培养,待细胞融合率达85%后消化传代。
45.(1)人羊膜上皮细胞对关节软骨细胞增殖和凋亡的影响
46.实验组1:取第三代人羊膜上皮细胞接种至transwell双层培养室上层,接种密度为4
×
104‑
16
×
104个/ml个/ml;取第二代关节软骨细胞接种至transwell双层培养室下层,接种密度为1
×
104‑4×
104个/ml,上下层接种细胞密度比例为3:1
‑
4:1。加入共培养培养液,24h和48h后检测关节软骨细胞增殖和凋亡率等指标。
47.对照组1:transwell双层培养室上下层均接种关节软骨细胞,其他条件与步骤和实验组相同(图1)。
48.(2)关节软骨细胞对人羊膜上皮细胞软骨分化的影响
49.实验组2:取第二代关节软骨细胞接种至transwell双层培养室上层,接种密度为4
×
104‑
16
×
104个/ml。取第三代人羊膜上皮细胞接种至transwell双层培养室下层,接种密度为1
×
104‑4×
104个/ml,上下层接种细胞密度比例为3:1
‑
4:1。共培养7d,14d和21d后检测人羊膜上皮细胞的软骨分化相关指标;
50.对照组2:transwell双层培养室均接种人羊膜上皮细胞,其他条件与步骤和实验组相同(图1)。
51.检测关节软骨细胞增殖能力和凋亡率,并观察和检测人羊膜上皮细胞的形态变化及软骨特异性标志物表达。
52.如图2和图3所示,为分离培养的人羊膜上皮细胞的鉴定。主要包括细胞形态观察、he染色、细胞生长曲线、免疫荧光鉴定角蛋白(ck19)和波形蛋白(vimentin)、流式细胞仪鉴定细胞表面标志物。结果显示在光学显微镜下,体外原代培养的人羊膜上皮细胞在光镜下呈典型上皮细胞形态。图2a为在光学显微镜下(
×
100,比例尺=200μm)在不同培养时间下原代(p0)和传代的人羊膜上皮细胞(p1
‑
p2)的细胞形态观察;人羊膜上皮细胞第1代的苏木精
‑
伊红染色(
×
400,比例尺=50μm)(p3);图2b为第1代人羊膜上皮细胞的生长曲线;图2c为免疫荧光评估人羊膜上皮细胞中的细胞角蛋白19(ck19)和波形蛋白(vimentin)表达(
×
400,比例尺=50μm)。细胞接种后3d内贴壁生长,刚贴壁的细胞呈圆形,折光性较强。完全贴壁后细胞胞质展开,呈不规则多角形,折光性减弱。原代人羊膜上皮细胞7d左右形成单层贴
壁细胞,呈铺路石样生长。传代后第2代细胞增殖速度加快,5d左右可形成单层贴壁细胞。苏木精
‑
伊红染色后观察,传代第1代细胞大小较均一,细胞核染蓝色,核膜清晰,核仁明显,胞浆染红色,胞质丰富(图2a)。传代第1代人羊膜上皮细胞接种于培养瓶后,0
‑
2d为细胞生长潜伏期,以细胞贴壁过程为主。2
‑
5d生长曲线曲率最大,为人羊膜上皮细胞快速增殖的指数生长期;6d后生长速度减缓,细胞基本长满培养瓶底,进入平顶期。传代第1代培养细胞符合典型的细胞生长曲线(图2b)。免疫荧光染色检测显示ck19阳性表达,少量表达波形蛋白(图2c)。流式细胞术检测发现人羊膜上皮细胞中cd29,cd44,cd73,cd90,cd105,ssea
‑
4,sox2和oct
‑
4呈阳性表达,cd31,cd34,cd45,cd49d,hla
‑
dr呈阴性表达,这和之前的报道一致,表明提取的人羊膜上皮细胞纯度较高,无混杂血细胞和羊膜间充质干细胞(图3)。
53.如图4所示人羊膜上皮细胞对关节软骨细胞活力的影响。结果表明,人羊膜上皮细胞和关节软骨细胞的共培养可以显着增强关节软骨细胞的增殖,并且趋势是时间依赖性的(图4a)。为了进一步确认人羊膜上皮细胞对关节软骨细胞增殖的影响,我们使用流式细胞仪检测了每组关节软骨细胞的24h和48h细胞周期分布。结果显示与人羊膜上皮细胞共培养24h和48h后,实验组1关节软骨细胞的s期的比例相比于对照组1的显著增加,表明人羊膜上皮细胞可以增强关节软骨细胞的增殖能力,差异具有统计学意义(*p<0.05,***p<0.001)(图4b和图4c)。另外,我们使用annexin v和pi双重染色试剂盒定量关节软骨细胞的凋亡。与人羊膜上皮细胞共培养24h和48h后,关节软骨细胞的凋亡率显着降低,表明人羊膜上皮细胞可以减少关节软骨细胞的凋亡,差异具有统计学意义(**p<0.01)(图5a和图5b)。
54.在人羊膜上皮细胞和关节软骨细胞共培养体系模型中,在诱导的第7d,对照组2中的人羊膜上皮细胞无明显变化,而治疗组中的细胞则处于软骨形成分化阶段,聚集蛋白聚糖(aggrecan)和2型胶原蛋白(col2)出现了少量表达,而在第14d,实验组2人羊膜上皮细胞软骨形成分化阶段几乎分化完成。共培养21d,对照组2和治疗组2之间细胞中的aggrecan和col2表达几乎存在明显视觉变化。这些结果表明关节软骨细胞与人羊膜上皮细胞共培养,可诱导人羊膜上皮细胞软骨分化作用(图6)。我们还使用rt
‑
qpcr检测aggrecan和col2的表达,结果显示,与关节软骨细胞共培养后,人羊膜上皮细胞的aggrecan和col2的mrna表达水平显着增加,差异具有统计学意义(***p<0.001)(图7)。
55.本发明的关节软骨细胞与人羊膜上皮细胞共培养体系的建立方法,以原代培养的人羊膜上皮细胞和关节软骨细胞为材料,以transwell双层培养室为骨架建立了两种细胞的共培养体系,两种细胞之间既存在一定的相互联系,又可以相互分离,从而可以对关节软骨细胞与人羊膜上皮细胞在共培养体系的基础上进行相对独立的研究,尤其适用于基于两种细胞相互调控基础上的生理、病理及药理研究,在骨性关节炎相关研究中具有较高的实用价值。
56.本文虽然已经给出了本发明的一些实施例,但是本领域的技术人员应当理解,在不脱离本发明精神的情况下,可以对本文的实施例进行改变。上述实施例只是示例性的,不应以本文的实施例作为本发明权利范围的限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1