一种蝴蝶花基因沉默体系的构建方法
1.本发明涉及生物技术领域,具体地涉及一种蝴蝶花vigs基因沉默体系的构建方法。
背景技术:
2.病毒诱导的基因沉默(virus
‑
induced gene silencing,vigs)是一种转录后基因沉默现象,可引起内源mrna序列特异性降解,相应表型发生变异,从而可以通过植物表型或生理指标上的变化反应该基因功能。vigs技术具有快速、高效、通量高等优点,能够方便快捷地研究基因功能,甚至可以用来研究一些突变后会致死的基因功能,因此该技术被广泛应用于植物生长发育、抗病虫、代谢调控等方面功能基因研究中。
3.蝴蝶花(iris japonica)为鸢尾科(iridaceae)鸢尾属宿根花卉,其花叶俱佳,四季常绿,生长适应性强,从我国广东省至陕西省均有分布,是一种良好的园林地被植物。但蝴蝶花遗传再生相对困难,以花器官作为外植体进行愈伤组织诱导效率极低,自然结实率低且种子具休眠特性亦无法用种胚作为外植体,以地下根茎作为外植体则消毒困难,诱导效率也很低,因此利用转基因技术验证蝴蝶花基因功能尚存在技术瓶颈。模式植物中研究已证实:vigs技术试验周期短,不依赖转基因操作,具有低成本、高通量等优点,目前该技术仍较少应用于单子叶植物中。建立以鸢尾为代表的单子叶植物vigs技术体系,可快速有效地对该类植物关键基因进行功能验证,对于解析其重要性状分子机制具有理论和实践意义,为实现我国花卉分子育种奠定基础。
技术实现要素:
4.本发明要解决的技术问题是,克服现有技术中的不足,提供一种蝴蝶花基因沉默体系的构建方法。
5.为解决技术问题,本发明的解决方案是:
6.提供一种蝴蝶花基因沉默体系构建方法,包括下述步骤:
7.(1)蝴蝶花目的基因片段的克隆
8.根据蝴蝶花转录组数据注释为目的基因的转录本保守区域设计酶切引物(产物长度约为200
‑
300bp),并在正向和反向引物5’端分别添加限制性内切酶xba i和sac i的识别碱基,以及保护碱基序列gctctaga和cgagctc;
9.提取蝴蝶花rna,逆转录成cdna,pcr扩增获得目的基因片段;电泳,切胶回收pcr产物;连接peasy
‑
blunt载体,转化大肠杆菌dh5α感受态;37℃暗培养过夜后挑取单克隆,用载体自带引物pcr鉴定获得阳性克隆后,测序确认pcr产物的正确性;
10.(2)构建含蝴蝶花目的基因trv载体的根癌农杆菌
11.提取步骤(1)中经测序验证的含有蝴蝶花目的基因片段的pcr产物克隆载体质粒;使用xba i和sac i两个限制性内切酶对该克隆载体质粒和ptrv2质粒进行酶切,酶切条件37℃、40分钟;电泳、切胶回收目的基因和ptrv2载体酶切片段,使用t4 dna连接酶将目的基
因和ptrv2载体酶切回收片段进行连接,连接条件为16℃、3小时;
12.将连接产物转化大肠杆菌dh5α感受态,37℃暗培养过夜后挑取单克隆,使用载体酶切位点两侧序列设计的引物ptrv2
‑
f(5
’‑
tgggagatgatacgctgtt
‑3’
,seq id no.1)和ptrv2
‑
r(5
’‑
cctaaaacttcagacacg
‑3’
,seq id no.2)进行阳性单克隆pcr检测并测序;
13.提取获得的阳性克隆质粒,使用冻融法转化农杆菌gv3101,28℃暗培养两天后挑取单克隆,使用ptrv2
‑
f和ptrv2
‑
r引物进行阳性单克隆pcr检测;
14.(3)以农杆菌介导侵染蝴蝶花植株
15.将含有ptrv1、ptrv2、ptrv2
‑
报告基因、ptrv2
‑
目的基因片段的农杆菌gv3101菌液50
‑
100μl加入至5ml含50mg/l卡那霉素和50mg/l利福平的luria
‑
bertani(lb)培养液,放入摇床中28℃、200rpm摇菌16小时,再转入含有50mg/l卡那霉素、50mg/l利福平、10mm mes(2
‑
吗啉乙磺酸)和20μm as(腺嘌呤硫酸盐)的150ml lb液体培养基,放入摇床中28℃、200rpm摇菌16小时;当菌液的od
600
为1.5
‑
2.0时,4000rpm、25℃离心10分钟收集菌体;用含有10mm mgcl2、10mm mes、200μm as的150ml侵染缓冲液分别重悬菌体;取含有ptrv1的农杆菌gv3101菌液与含有ptrv2的农杆菌gv3101菌液,按照体积比1:1混合(以此用于参照系);取含有ptrv1的农杆菌gv3101菌液与含有ptrv2
‑
报告基因的农杆菌gv3101菌液,按照体积比1:1混合;取含有ptrv1的农杆菌gv3101菌液与含有ptrv2
‑
目的基因片段的农杆菌gv3101菌液,按照体积比1:1混合;25℃避光静置活化4小时;
16.以混合后的农杆菌gv3101菌液分别对蝴蝶花植株进行侵染处理;将植株在湿度60%,20
‑
21℃环境暗培养3天之后,改为在湿度60%,光照14
‑
16小时、25℃、4000lxs/黑暗10
‑
8小时、18℃条件继续培养直至出现表型。
17.(4)基因沉默植株的检测
18.首先经过一段时间观察,记录侵染植株形态变化,选择其中出现预期表型的植株,提取其叶片总rna并反转录成cdna,使用ptrv2
‑
f和ptrv2
‑
r引物进行pcr,检测带目的基因的ptrv2重组载体是否进入植物体内;使用qpcr对野生型(untreated)、仅转入ptrv2空载(trv)和含目的基因
‑
ptrv2重组载体的植株进行目的基因表达定量,其中目的基因表达量较低的植株即为基因沉默成功的植株。
19.本发明所述步骤(1)中,所述报告基因具体是指绿色荧光蛋白(green fluorescent protein,gfp),所述蝴蝶花转录组数据注释为目的基因的转录本保守区域,具体是指:蝴蝶花转录组数据注释为蝴蝶花八氢番茄红素脱氢酶pds转录本保守区域。
20.本发明所述步骤(3)中进行侵染处理时,所用蝴蝶花植株是苗龄为1年生植株。
21.本发明所述步骤(3)中进行侵染处理时,侵染部位包括根状茎、茎尖或叶片;其中,(1)以根状茎和茎尖为侵染对象时,侵染前先用1ml注射器针头在根状茎或茎尖扎2
‑
3个孔,随后将扎孔部位淹没在侵染液中,将其放入真空泵中
‑
0.9kg/cm2(
‑
0.09mpa)抽真空30分钟,放气20分钟;
22.(2)以叶片为侵染对象时,先用1ml注射器针头在蝴蝶花叶片背部轻轻划十字,但切勿划穿,再用去掉针头的1ml注射器,将上述各混合液分别对准十字中心注射。
23.发明原理描述:
24.目前应用最广的vigs载体为烟草脆裂病毒(tobacco rattle virus,trv),但其在植物上的应用效果因种而异,trv能够有效应用于茄科植物的基因沉默,但对一些非茄科植
物,特别是非茄科单子叶植物,基因沉默效率较低。从技术和材料自身角度考虑,如果能够利用vigs技术建立以蝴蝶花为代表的单子叶多年生植物的基因沉默体系,对于实现和加快其基因功能研究,解析重要性状分子机制具有重要意义。
25.尽管trv
‑
vigs系统可以在一些双子叶模式植物中起作用,但该系统的作用模式并非对所有植物(特别是单子叶模式植物)起作用的。目前病毒载体的转染技术还没有形成一套非常成熟有效的方法,已有的报道也只是在少数植物中获得成功,如烟草、番茄、拟南芥等,许多接种条件和步骤还需要进一步优化,特别是通过农杆菌介导法使病毒感染单子叶植物尚未成功(姚丹青等,2009),另一方面,病毒针对的宿主具有专一性,trv病毒源自烟草,对以茄科为代表的双子叶植物感染效果较好,尚难以感染单子叶植物(李杰等,2021)。在本发明提出之前,本领域研发人员因为上述的原因,普遍认为trv
‑
vigs系统难以应用于单子叶植物,特别是抗病性较强的鸢尾属植物。因此不会将蝴蝶花等鸢尾属植物视为潜在的trv宿主,或不会认为该属植物会在一定程度上对trv敏感。
26.申请人的研发团队克服技术偏见,将trv
‑
vigs系统首次应用于蝴蝶花基因功能研究。通过建立快速高效的蝴蝶花病毒介导的基因沉默系统,确定最适蝴蝶花侵染受体、最佳菌液浓度、最佳侵染部位,并采用叶背十字切割注射法对蝴蝶花植株进行侵染等,显著提高了农杆菌侵染及基因沉默的效率,实现在基因组规模上高通量、功能性分析单子叶植物中鸢尾属植物基因功能。
27.与现有技术相比,本发明的有益效果为:
28.(1)本发明首次实现了在基因组规模上高通量、功能性分析单子叶宿根植物中鸢尾属基因功能。
29.(2)蝴蝶花叶片革质,抗性强不易感病,本发明通过确定最适蝴蝶花侵染受体、最佳菌液浓度、最佳侵染部位,并采用叶背十字切割注射法对蝴蝶花植株进行侵染等,显著提高了农杆菌侵染及基因沉默的效率,本发明获得的效果相比现有报道具备突出的实质性特点和显著的进步;
30.(3)本发明建立了一种快速高效的蝴蝶花病毒介导的基因沉默系统,可以用于蝴蝶花功能基因及转录因子基因功能验证,具体地可用于色素代谢、生长发育及休眠调控等重要性状调控基因功能验证分析。本发明的基因沉默体系简便、快速、高效,可为解析蝴蝶花重要性状分子机制奠定基础。
附图说明
31.图1是本发明实施例1中含叶绿素荧光蛋白重组病毒载体侵染蝴蝶花植株的荧光观察图;
32.图2是本发明实施例1中含叶绿素荧光蛋白重组病毒载体侵染蝴蝶花植株叶片表皮细胞的激光共聚焦图;
33.图3是本发明实施例1中基因沉默植株pcr检测重组质粒片段的琼脂糖凝胶电泳图;
34.图4是本发明实施例2中含蝴蝶花pds基因重组病毒沉默载体侵染蝴蝶花植株的表型图;
35.图5是本发明实施例2中基因沉默植株pcr检测重组质粒片段的琼脂糖凝胶电泳
图;
36.图6是本发明实施例2中野生型、含ptrv2空载和ptrv2
‑
pds植株中pds基因表达量图。
具体实施方式
37.下述实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到。
38.实施例1利用trv
‑
vigs技术向蝴蝶花中转入绿色荧光蛋白(green fluorescent protein,gfp)基因
39.蝴蝶花1年生植株购自杭州天景水生植物园;ptrv1、连接gfp基因片段的ptrv2质粒由中国农业大学园艺系赠送;大肠杆菌dh5α购自诺唯赞生物科技有限公司;农杆菌gv3101购自上海唯地生物技术有限公司。
40.一、分别构建含ptrv1载体和连gfp报告基因片段ptrv2载体的根癌农杆菌
41.将ptrv1、连接gfp基因片段的ptrv2质粒(ptrv2
‑
gfp)使用冻融法转化农杆菌gv3101,28℃暗培养两天后挑取单克隆,使用ptrv2
‑
f和ptrv2
‑
r引物进行阳性单克隆pcr检测。
42.二、含trv
‑
gfp农杆菌侵染蝴蝶花植株
43.将含有ptrv1、ptrv2、ptrv2
‑
gfp的农杆菌gv3101菌液50μl加入至5ml含50mg/l卡那霉素和50mg/l利福平的lb培养液,放入摇床中28℃ 200rpm摇菌16小时,再转入含有50mg/l卡那霉素、50mg/l利福平、10mm mes和20μm as的150ml lb液体培养基,放入摇床中28℃ 200rpm摇菌16小时;当菌液的od
600
约为1.5时,4000rpm、25℃离心10分钟收集菌体。用含有10mm mgcl2、10mm mes、200μm as的150ml侵染缓冲液分别重悬菌体。分别将含有ptrv1的农杆菌gv3101菌液与含有ptrv2的农杆菌gv3101菌液、含有ptrv1的农杆菌gv3101菌液与含有gfp基因的ptrv2的农杆菌gv3101菌液按照1:1混合,25℃避光静置活化4小时。
44.用1ml注射器针头在蝴蝶花叶片背部轻轻划十字,但切勿划穿,再用去掉针头的1ml注射器,将上述各混合液分别对准十字中心注射。将所述植株和没有注射菌液的空白对照组植株在湿度60%,20℃环境暗培养3天之后,于湿度60%,光照14小时、25℃、4000lxs/黑暗10小时、18℃条件继续培养3天。
45.三、利用trv
‑
vigs体系转入gfp基因植株检测
46.采用叶背十字切割注射法对蝴蝶花植株进行农杆菌侵染。侵染6天后(结果见图1),空白对照组、ptrv2空载体植株在紫外线照射下,未观察到绿色荧光,而gfp基因转化植株在紫外线照射下,观察到绿色荧光,结果表明gfp基因转化成功。
47.使用天根多糖多酚试剂盒(cat.#rr047a)提取空白对照组、侵染ptrv2空载和gfp基因转化蝴蝶花叶片的总rna,操作步骤按试剂盒自带说明书进行。使用primescript
tm ii,1st strand cdna synthesis kit试剂盒(takara,cat#6210a)将总rna逆转录为cdna,操作步骤按试剂盒自带说明书进行,然后稀释20倍备用。用引物ptrv2
‑
f(5
’‑
tgggagatgatacgctgtt
‑3’
,seq id no.1)和ptrv2
‑
r(5
’‑
cctaaaacttcagacacg
‑3’
,seq id no.2)进行pcr检测,检测结果如图2,没有注射菌液的空白对照组植株没有检测到条带,注
射菌液的ptrv2空载体植株和gfp基因转化植株均能检测到条带,且gfp基因转化植株条带较长,表明gfp基因转化成功,也表明此实验中农杆菌介导的trv病毒载体侵染蝴蝶花的步骤可行。
48.实施例2利用trv
‑
vigs技术沉默1年生蝴蝶花八氢番茄红素脱氢酶(phytoene desaturase,pds)基因
49.蝴蝶花1年生植株购自杭州天景水生植物园;ptrv1、ptrv2质粒由中国农业大学园艺系赠送;大肠杆菌dh5α购自诺唯赞生物科技有限公司;农杆菌gv3101购自上海唯地生物技术有限公司。
50.一、蝴蝶花pds基因片段的克隆
51.使用天根多糖多酚试剂盒(cat.#rr047a)提取蝴蝶花茎尖的总rna,操作步骤按试剂盒自带说明书进行。使用primescript
tm ii,1st strand cdna synthesis kit试剂盒(takara,cat#6210a;lot#ak4601)将蝴蝶花总rna逆转录为cdna,操作步骤按试剂盒自带说明书进行。
52.根据蝴蝶花转录组数据注释为pds的转录本保守区域设计酶切引物,并在正向和反向引物5’端分别添加限制性内切酶xba i和sac i的识别碱基和保护碱基序列gctctaga和cgagctc(如表1所示)。提取蝴蝶花rna,逆转录成cdna,使用高保真酶pcr扩增获得蝴蝶花pds基因片段,核苷酸序列如seq id no.3所示。电泳,切胶回收pcr产物,连接全式金生物技术有限公司的peasy
‑
blunt zero cloning vector载体,得到连接产物;转入大肠杆菌dh5α中,抗性筛选挑取阳性克隆,将阳性克隆进行液体培养,提取37℃暗培养过夜后挑取单克隆,用peasy
‑
blunt zero cloning vector载体自带引物(如表2所示)pcr鉴定获得阳性克隆后,测序确认pcr产物的正确性。
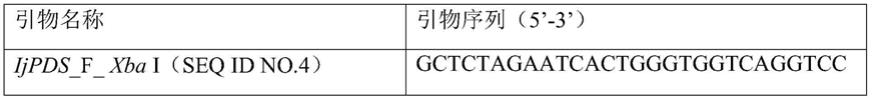
53.表1.蝴蝶花pds基因片段扩增引物列表
[0054][0055][0056]
表2.载体自带引物列表
[0057]
引物名称引物序列(5
’‑3’
)m13_f(seq id no.6)gtaaaacgacggccagtm13_r(seq id no.7)caggaaacagctatgac
[0058]
二、含蝴蝶花pds基因trv沉默载体农杆菌的构建
[0059]
提取上述测序验证的含有沉默pds基因片段的peasy
‑
blunt zero cloning vector载体质粒,对其和ptrv2质粒使用xba i和sac i两个限制性内切酶于37℃酶切40分钟。
[0060]
电泳、切胶回收大小为241bp的pds基因片段和ptrv2载体酶切片段,使用t4 dna连接酶将pds基因片段和ptrv2载体酶切回收片段进行连接,连接条件为16℃ 3小时。
[0061]
将连接产物转化大肠杆菌dh5α感受态,37℃暗培养过夜后挑取单克隆,使用载体酶切位点两侧序列设计的引物ptrv2
‑
f和ptrv2
‑
r进行菌落pcr,对克隆进行鉴定。提取上述
步骤获得的阳性克隆质粒,使用冻融法转化农杆菌gv3101,28℃暗培养两天后挑取单克隆,使用ptrv2
‑
f和ptrv2
‑
r引物进行菌落pcr检测。
[0062]
三、含ptrv1,ptrv2空载及ptrv2
‑
pds的农杆菌侵染蝴蝶花植株
[0063]
将含有ptrv1、ptrv2、ptrv2
‑
pds的农杆菌gv3101菌液100μl加入至5ml含50mg/l卡那霉素和50mg/l利福平的lb培养液,放入摇床中28℃200 rpm摇菌16小时,再转入含有50mg/l卡那霉素、50mg/l利福平、10mm mes和20μm as的150ml lb液体培养基,放入摇床中28℃200 rpm摇菌16小时;当菌液的od
600
约为2.0时,4000rpm、25℃离心10分钟收集菌体。用含有10mm mgcl2、10mm mes、200μm as的150ml侵染缓冲液分别重悬菌体。分别将含有ptrv1的农杆菌gv3101菌液与含有ptrv2的农杆菌gv3101菌液、含有ptrv1的农杆菌gv3101菌液与含有沉默pds基因的ptrv2的农杆菌gv3101菌液按照体积比1:1混合,25℃避光静置活化4小时。
[0064]
在蝴蝶花1年生植株上,选择生长形态相似的叶片用于侵染操作,具体操作方法同实施例2;蝴蝶花2年生成熟植株叶片在湿度60%,光照15小时、25℃、4000lxs/黑暗9小时、18℃条件下培养28天。
[0065]
四、基因沉默植株检测
[0066]
按上述方法培养大约12.43天开始出现表型变化。使用ptrv2
‑
f和ptrv2
‑
r引物检测,含ptrv2
‑
pds重组质粒植株约占36.70%。侵染24天后(结果见图4),1年生植株空白对照组、ptrv2空载体植株未有光漂白表型,而pds基因沉默植株出现明显光漂白表型。
[0067]
使用天根多糖多酚试剂盒(cat.#rr047a)提取空白对照组、侵染ptrv2空载和出现光漂白表型的侵染ptrv2
‑
pds蝴蝶花叶片的总rna,操作步骤按试剂盒自带说明书进行。使用primescript
tm ii,1st strand cdna synthesis kit试剂盒(takara,cat#6210a;)将总rna逆转录为cdna,操作步骤按试剂盒自带说明书进行,然后稀释20倍备用。用引物ptrv2
‑
f和ptrv2
‑
r进行pcr检测,检测结果如图4,没有注射菌液的空白对照组植株没有检测到条带,注射菌液的trv空载体植株和pds基因沉默植株均能检测到条带,且pds基因沉默植株条带较长(附图5)。使用qpcr检测上述植株中pds基因表达情况(附图6),其中含ptrv2
‑
pds重组质粒的植株表达量显著低于野生型和含trv2空载植株。综上,pds基因在蝴蝶花中沉默成功。
[0068]
实施例3利用trv
‑
vigs技术沉默1个月生蝴蝶花pds基因
[0069]
蝴蝶花1个月生植株购自杭州天景水生植物园;ptrv1、ptrv2质粒由中国农业大学园艺系赠送;大肠杆菌dh5α购自诺唯赞生物科技有限公司;农杆菌gv3101购自上海唯地生物技术有限公司。
[0070]
一、蝴蝶花pds基因片段的克隆
[0071]
该步骤的内容与实施例2中操作完全相同;
[0072]
二、含蝴蝶花pds基因trv沉默载体农杆菌的构建
[0073]
该步骤的内容与实施例2中操作完全相同;
[0074]
三、含ptrv1及ptrv2
‑
pds的农杆菌侵染蝴蝶花植株
[0075]
将含有ptrv1、ptrv2
‑
pds的农杆菌gv3101菌液50μl加入至5ml含50mg/l卡那霉素和50mg/l利福平的lb培养液,放入摇床中28℃200 rpm摇菌16小时,再转入含有50mg/l卡那霉素、50mg/l利福平、10mm mes和20μm as的150ml lb液体培养基,放入摇床中28℃200 rpm
摇菌16小时;当菌液的od
600
约为1.5时,4000rpm、25℃离心10分钟收集菌体。用含有10mm mgcl2、10mm mes、200μm as的150ml侵染缓冲液分别重悬菌体。分别将含有ptrv1的农杆菌gv3101菌液与含ptrv2
‑
pds的农杆菌gv3101菌液按照体积比1:1混合,25℃避光静置活化4小时。
[0076]
在蝴蝶花1个月生小植株上,选择生长形态相似的叶片用于侵染操作;用1ml注射器针头在叶片背部轻轻划十字,但切勿划穿,再用去掉针头的1ml注射器,将上述各混合液分别对准十字中心注射;将所述植株和没有注射菌液的空白对照组植株在湿度60%,20℃环境暗培养3天之后,于湿度60%,光照15小时、25℃、4000lxs/黑暗9小时、18℃条件继续培养28天。
[0077]
四、基因沉默植株检测
[0078]
按上述方法培养大约24.3天左右,蝴蝶花1个月生小植株叶片开始出现表型变化。使用ptrv2
‑
f和ptrv2
‑
r引物检测,含ptrv2
‑
pds重组质粒植株约占10%。
[0079]
实施例4利用trv
‑
vigs技术沉默2个月生蝴蝶花pds基因
[0080]
蝴蝶花2个月生植株购自杭州天景水生植物园;ptrv1、ptrv2质粒由中国农业大学园艺系赠送;大肠杆菌dh5α购自诺唯赞生物科技有限公司;农杆菌gv3101购自上海唯地生物技术有限公司。
[0081]
一、蝴蝶花pds基因片段的克隆
[0082]
该步骤的内容与实施例2中操作完全相同;
[0083]
二、含蝴蝶花pds基因trv沉默载体农杆菌的构建
[0084]
该步骤的内容与实施例2中操作完全相同;
[0085]
三、含ptrv1及ptrv2
‑
pds的农杆菌侵染蝴蝶花植株
[0086]
将含有ptrv1、ptrv2
‑
pds的农杆菌gv3101菌液75μl加入至5ml含50mg/l卡那霉素和50mg/l利福平的lb培养液,放入摇床中28℃200 rpm摇菌16小时,再转入含有50mg/l卡那霉素、50mg/l利福平、10mm mes和20μm as的150ml lb液体培养基,放入摇床中28℃200 rpm摇菌16小时;当菌液的od
600
约为1.7时,4000rpm、25℃离心10分钟收集菌体。用含有10mm mgcl2、10mm mes、200μm as的150ml侵染缓冲液分别重悬菌体。分别将含有ptrv1的农杆菌gv3101菌液与含有ptrv2的农杆菌gv3101菌液、含有ptrv1的农杆菌gv3101菌液与含有沉默pds基因的ptrv2的农杆菌gv3101菌液按照体积比1:1混合,25℃避光静置活化4小时。
[0087]
在蝴蝶花2个月生小植株上,选择生长形态相似的叶片用于侵染操作,具体操作方法同实施例2;蝴蝶花2个月生小植株叶片在湿度60%,光照15小时、25℃、4000lxs/黑暗9小时、18℃条件下培养28天。
[0088]
四、基因沉默植株检测
[0089]
按上述方法培养大约22.37天开始出现表型变化。使用ptrv2
‑
f和ptrv2
‑
r引物检测,含ptrv2
‑
pds重组质粒植株约占23.3%。
[0090]
实施例5利用trv
‑
vigs技术沉默2年生成熟蝴蝶花pds基因
[0091]
蝴蝶花2年生成熟植株购自杭州天景水生植物园;ptrv1、ptrv2质粒由中国农业大学园艺系赠送;大肠杆菌dh5α购自诺唯赞生物科技有限公司;农杆菌gv3101购自上海唯地生物技术有限公司。
[0092]
一、蝴蝶花pds基因片段的克隆
[0093]
该步骤的内容与实施例2中操作完全相同;
[0094]
二、含蝴蝶花pds基因trv沉默载体农杆菌的构建
[0095]
该步骤的内容与实施例2中操作完全相同;
[0096]
三、含ptrv1及ptrv2
‑
pds的农杆菌侵染蝴蝶花植株
[0097]
将含有ptrv1、ptrv2
‑
pds的农杆菌gv3101菌液90μl加入至5ml含50mg/l卡那霉素和50mg/l利福平的lb培养液,放入摇床中28℃200 rpm摇菌16小时,再转入含有50mg/l卡那霉素、50mg/l利福平、10mm mes和20μm as的150ml lb液体培养基,放入摇床中28℃200 rpm摇菌16小时;当菌液的od
600
约为1.85时,4000rpm、25℃离心10分钟收集菌体。用含有10mm mgcl2、10mm mes、200μm as的150ml侵染缓冲液分别重悬菌体。分别将含有ptrv1的农杆菌gv3101菌液与含有ptrv2的农杆菌gv3101菌液、含有ptrv1的农杆菌gv3101菌液与含有沉默pds基因的ptrv2的农杆菌gv3101菌液按照体积比1:1混合,25℃避光静置活化4小时。
[0098]
在蝴蝶花2年生成熟植株上,选择生长形态相似的叶片用于侵染操作,具体操作方法同实施例2;蝴蝶花2年生成熟植株叶片在湿度60%,光照15小时、25℃、4000lxs/黑暗9小时、18℃条件下培养28天。
[0099]
四、基因沉默植株检测
[0100]
按上述方法培养大约14.3天开始出现表型变化。使用ptrv2
‑
f和ptrv2
‑
r引物检测,含ptrv2
‑
pds重组质粒植株约占16.7%。
[0101]
从上述实施例结果可以看出,一年生植株为蝴蝶花基因沉默最佳受体材料。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1