一种乌饭树实时荧光定量PCR内参基因的筛选方法
一种乌饭树实时荧光定量pcr内参基因的筛选方法
技术领域
1.本发明涉及植物基因工程技术,具体地,涉及一种乌饭树实时荧光定量pcr内参基因的筛选方法。
背景技术:
2.乌饭树(vaccinium bracteatum thunb.)是杜鹃花科(ericaceae)越橘属(vaccinium)常绿灌木,与蓝莓同属,其小浆果是饮食中酚类物质如黄酮醇和花青素的丰富来源。乌饭树也是一种药用植物,其果实和叶提取物具有镇定催眠、预防癌症等积极作用。
3.乌饭树的果、叶、根均可入药食用,记载于《开宝本草》、《本草纲目》、《中药大辞典》等中医药典籍,被我国历代本草学家极为推崇。在《中药大辞典》中,乌饭树被记载为具有“益精气、强筋骨、明目止泻”的功效;在唐代《本草拾遗》中就有记载“乌饭树树叶取汁渍米作乌饭,食之健如牛筋;止泻除睡,强筋益气力”。乌饭树中的黑色素含有极为丰富的有效成分,如花青素类、黄酮类、多酚类化合物、绿原酸类、环烯醚萜苷类、单宁类、三菇类、有机酸类、肌醇类和维生素等。随着对乌饭树资源的研究不断深入,其叶和果实中功能性成分的分子验证尤为重要。
4.实时荧光定量pcr(qrt-pcr)是分子验证的重要手段,而qrt-pcr验证最重要的一个环节是内参基因的选择。传统的越橘属所使用的内参基因如actin、β-tubulin等,在乌饭树果实膨大成熟过程中,一般呈上调表达模式,不适合分析果实发育基因的转录水平。现有技术中,关于乌饭树内参基因的鉴定工作还未有相关报道。
技术实现要素:
5.本发明的目的是为了克服现有技术存在的问题,提供一种乌饭树实时荧光定量pcr内参基因的筛选方法。
6.为了实现上述目的,本发明提供一种乌饭树实时荧光定量pcr内参基因的筛选方法,包括以下步骤:
7.(1)利用乌饭树转录组测序数据,挑选n个乌饭树候选内参基因,以挑选的n个所述乌饭树候选内参基因为模板,分别设计实时荧光定量pcr的内参基因引物对,其中n≥2;
8.(2)以乌饭树组织的rna反转录获得的cdna为模板,以所述内参基因引物对为反应引物对,进行实时荧光定量pcr分析;
9.(3)将所述实时荧光定量pcr得到的数据导入genorm、normfinder和bestkeeper软件进行分析,筛选出最优内参基因和/或内参基因组合。
10.优选地,步骤(1)中所述乌饭树候选内参基因为肌动蛋白1、肌动蛋白2、肌动蛋白3、肌动蛋白4、肌动蛋白5、核糖体蛋白、泛素结合酶、泛素蛋白基因、烟酰胺腺嘌呤二核苷酸和腺苷酸激酶,所述肌动蛋白1、肌动蛋白2、肌动蛋白3、肌动蛋白4、肌动蛋白5、核糖体蛋白、泛素结合酶、泛素蛋白基因、烟酰胺腺嘌呤二核苷酸和腺苷酸激酶的核苷酸序列依次如seq id no.1-seq id no.10所示。
11.优选地,所述肌动蛋白1、肌动蛋白2、肌动蛋白3、肌动蛋白4、肌动蛋白5、核糖体蛋白、泛素结合酶、泛素蛋白基因、烟酰胺腺嘌呤二核苷酸和腺苷酸激酶对应的所述内参基因引物对的核苷酸序列依次如seq id no.11-seq id no.30所示。
12.优选地,所述设计实时荧光定量pcr的内参基因引物对的过程包括:利用primer premier软件提供多个与所述乌饭树候选内参基因合适的备选引物对,将所述备选引物对进行评分和特异性评价,筛选出该乌饭树候选内参基因对应的所述内参基因引物对。
13.优选地,所述评分的条件包括:
14.a、引物的长度在20-24bp之间;
15.b、引物3’端的5个碱基中含有1-3个g、c,末尾不是a;
16.c、扩增长度在80-150bp之间;
17.d、引物序列的gc含量在50%-60%范围内;
18.e、引物序列自身二聚体和交叉二聚体连续的碱基数少于4个,不连续的少于7个;
19.f、没有发卡结构的二聚体。
20.优选地,所述特异性评价通过所述实时荧光定量pcr的溶解曲线进行评价。
21.优选地,步骤(2)中,以1μg所述乌饭树组织的rna反转录获得的cdna为基准,所述内参基因引物对中的每条引物的用量为0.1
×
10-3-1
×
10-3
μmol。
22.优选地,所述实时荧光定量pcr的反应程序为:90-100℃预变10-20min;90-100℃解链5-15s,55-65℃退火25-35s,反应35-45个循环。
23.优选地,步骤(2)中,所述乌饭树组织选自乌饭树果实、乌饭树叶片和乌饭树嫩根中的至少一种。
24.通过上述技术方案,本发明的有益效果为:
25.本发明通过分析各乌饭树候选内参基因的表达变化,筛选出稳定性较高的基因作为乌饭树实时荧光定量pcr的内参基因,为研究乌饭树基因表达水平的变化奠定良好基础,将有助于在乌饭树基因表达研究中获得可靠的标准化qrt-pcr数据。
附图说明
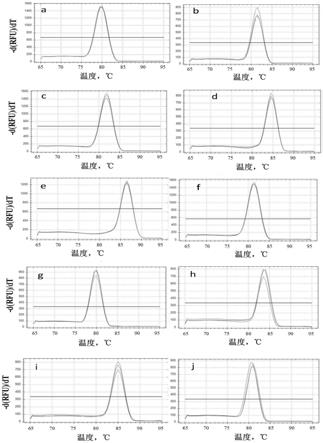
26.图1是实施例中10个乌饭树候选内参基因的溶解曲线图,其中,a为actin1,b为actin2,c为actin3,d为actin4,e为actin5,f为rp,g为ube,h为ubq,i为nadh,j为adk;
27.图2是实施例中10个乌饭树候选内参基因的ct值分布图;
28.图3是实施例中genorm软件分析乌饭树候选内参基因的表达稳定性;
29.图4是实施例中genorm软件分析乌饭树内参基因的最适数目;
30.图5是实施例中以nadh、adk、nadh+adk作为内参基因,分析乌饭树3个不同成熟度果实(绿果s1、红果s2和蓝果s3)中aco与pg的表达量。
具体实施方式
31.在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
id no.16所示:
50.正向引物actin3-f:ctccaaggacagattcaagagg(seq id no.15);
51.反向引物actin3-r:gagcagcacgacaagagaat(seq id no.16);
52.扩增长度:136bp;tm值:58.2℃;
53.肌动蛋白4(actin4)对应的内参基因引物对的核苷酸序列如seq id no.17和seq id no.18所示:
54.正向引物actin4-f:ggactctggtgatggtgtgag(seq id no.17);
55.反向引物actin4-r:gctctgctgtagtagtgaagg(seq id no.18);
56.扩增长度:158bp;tm值:60.6℃;
57.肌动蛋白5(actin5)对应的内参基因引物对的核苷酸序列如seq id no.19和seq id no.20所示:
58.正向引物actin5-f:gtcgtcttctccactaccat(seq id no.19);
59.反向引物actin5-r:acacggctctacattaccag(seq id no.20);
60.扩增长度:196bp;tm值:55.4℃;
61.核糖体蛋白(rp)对应的内参基因引物对的核苷酸序列如seq id no.21和seq id no.22所示:
62.正向引物rp-f:gcacagcgattcagttctag(seq id no.21);
63.反向引物rp-r:caactacggacagagcactt(seq id no.22);
64.扩增长度:137bp;tm值:56.3℃;
65.泛素结合酶(ube)对应的内参基因引物对的核苷酸序列如seq id no.23和seq id no.24所示:
66.正向引物ube-f:cccaaatccttcagacccat(seq id no.23);
67.反向引物ube-r:cctcgtcacttatctcctcatc(seq id no.24);
68.扩增长度:164bp;tm值:61.1℃;
69.泛素蛋白基因(ubq)对应的内参基因引物对的核苷酸序列如seq id no.25和seq id no.26所示:
70.正向引物ubq-f:ctactggcaatcctactcctac(seq id no.25);
71.反向引物ubq-r:ggaaatagagacggaccaagac(seq id no.26);
72.扩增长度:150bp;tm值:59.1℃;
73.烟酰胺腺嘌呤二核苷酸(nadh)对应的内参基因引物对的核苷酸序列如seq id no.27和seq id no.28所示:
74.正向引物nadh-f:acacctcgtccagcaatatc(seq id no.27);
75.反向引物nadh-r:ctcaaccgcctcaaccttag(seq id no.28);
76.扩增长度:162bp;tm值:59.9℃;
77.腺苷酸激酶(adk)对应的内参基因引物对的核苷酸序列如seq id no.29和seq id no.30所示:
78.正向引物adk-f:gtgtcacttggctactggag(seq id no.29);
79.反向引物adk-r:ggcttcttcagtgcttcatc(seq id no.30);
80.扩增长度:183bp;tm值:57.6℃.
81.根据本发明,所述设计实时荧光定量pcr的内参基因引物对的过程可以是采用现有技术公开的或者常规的引物设计软件,针对每个乌饭树候选内参基因设计出多个适于该乌饭树候选内参基因的引物对,再通过溶解曲线等方式进行评价,以选出最合适于该乌饭树候选内参基因的引物对作为内参基因引物对。
82.作为本发明中设计内参基因引物对的一种优选实施方式,所述设计实时荧光定量pcr的内参基因引物对的过程包括:利用primer premier软件提供多个与某个所述乌饭树候选内参基因合适的备选引物对,将多个所述备选引物对进行评分和特异性评价,筛选出该乌饭树候选内参基因对应的所述内参基因引物对。
83.根据本发明,primer premier软件可以采用现有的各种版本,优选为采用primer premier 6软件。
84.根据本发明,对备选引物对进行评分的条件包括:
85.a、引物的长度在20-24bp之间,过短则不易扩增,过长会增高延伸温度不适合聚合酶反应的进行;
86.b、引物3’端的5个碱基中含有1-3个g、c,末尾不是a;
87.c、扩增长度在80-150bp之间;
88.d、引物序列的gc含量在50%-60%范围内;
89.e、引物序列自身二聚体和交叉二聚体连续的碱基数少于4个,不连续的少于7个;
90.f、没有发卡结构的二聚体。
91.优选情况下,评分的条件b中引物3’端的5个碱基中含有3个g、c。
92.根据本发明,对备选引物对进行特异性评价通过所述实时荧光定量pcr的溶解曲线进行评价,具体地,判断备选引物对所对应的乌饭树候选内参基因的溶解曲线是否为单峰,如果为单峰,则表明该备选引物对具有特异性。
93.示例性地,实时荧光定量pcr的溶解曲线获得的过程为:将实时荧光定量pcr的反应液体系经65℃、0.05s,每0.05s上升0.5℃,直至95℃,连续检测信号。
94.根据本发明,步骤(2)中,实时荧光定量pcr分析所使用的乌饭树组织的rna反转录获得的cdna,可以通过常规的试剂盒或者现有技术中公开的方式制得,也可以是在现有试剂盒或方法的基础上进行改进。示例性地,可以采用rnaprep pure多糖多酚植物总rna提取试剂盒(sybr green)获得乌饭树组织的rna,再将乌饭树组织的rna使用fastquant rt kit(with gdnase)进行反转录,得到相应的cdna。
95.根据本发明,在获得提取得到的乌饭树组织的rna后,采用酶标仪进行rna的纯度及浓度检测,衡量核酸是否被污染的重要指标为od
260
/od
280
,高质量的rna其比值在1.8~2.1之间,od
230
/od
280
是用来判断有机试剂及多糖污染的指标,当其比值大于2时,rna纯度较高。
96.根据本发明,步骤(2)中,以1μg所述乌饭树组织的rna反转录获得的cdna为基准,所述内参基因引物对中的每条引物的用量为0.1
×
10-3-1
×
10-3
μmol。
97.具体地,实时荧光定量pcr的模板采用1μg乌饭树组织的rna反转录获得的cdna的100倍稀释液;实时荧光定量pcr的反应液体系的总体积可以采用常规的体积规格,例如10μl、25μl、50μl;反应液体系包括cdna的100倍稀释液、含有内参基因引物对的两条引物的溶液和缓冲液。示例性地,实时荧光定量pcr的反应液体系可以采用已有的试剂盒或者在已有
试剂盒的基础上改进获得的体系,例如rnaprep pure多糖多酚植物总rna提取试剂盒(sybr green)试剂盒,其含有的缓冲液为2
×
superreal premix plus。
98.根据本发明,在对乌饭树组织进行rna提取时,对乌饭树组织进行如下的预处理:将乌饭树组织在液氮中迅速研磨成粉末,加入β-巯基乙醇浓度为3-8%的裂解液,涡旋剧烈震荡使乌饭树组织与裂解液充分混匀。具体地,乌饭树组织与β-巯基乙醇浓度为3-8%的裂解液的质量体积比为50-100:0.7(g/ml)。
99.根据本发明,所述实时荧光定量pcr的反应程序为:90-100℃预变10-20min;90-100℃解链5-15s,55-65℃退火25-35s,反应35-45个循环。示例性地,实时荧光定量pcr的反应程序为:905℃预变15min;95℃解链10s,60℃退火30s,反应40个循环。
100.根据本发明,步骤(3)中,将实时荧光定量pcr得到的数据导入genorm、normfinder和bestkeeper软件进行分析的具体过程为:genorm和normfinder根据候选内参基因相对表达量q进行评价,bestkeeper根据候选内参基因的ct值进行评价;最后采用几何平均值法计算乌饭树候选内参基因表达稳定性的综合排名。
101.以下将通过实施例对本发明进行详细描述。
102.以下实施例中,乌饭树果实来自安徽省南陵县徽王莓岭蓝莓生态园,rnaprep pure多糖多酚植物总rna提取试剂盒、fastquant rt kit(with gdnase)、superreal premix plus(sybr green)试剂盒均购自天根生化科技(北京)有限公司,其它原料和试剂盒均为市售品。
103.制备例
104.s1、采用rnaprep pure多糖多酚植物总rna提取试剂盒提取乌饭树果实样品的rna,实验开始前先将镊子、枪头、离心管、研钵等进行严格的灭菌处理,并提前60min将制冰机打开,提前30min将实验室与超净工作台紫外灯打开进行紫外杀菌处理,实验全程需在超净台上进行,谨防各类污染;rna的提取步骤参考多糖多酚植物总rna提取试剂盒的使用说明书,并作了如下改进:
105.①
取0.08g乌饭树果实样品作为组织样品,在液氮中迅速研磨成粉末,加入β-巯基乙醇浓度为5%的裂解液sl700μl(665μl裂解液sl中加入35μl的β-巯基乙醇),涡旋剧烈震荡使组织样品与裂解液sl充分混匀;
106.②
说明书中离心30s改为离心1min;
107.③
说明书中最后一步加入40μl的rnase-free ddh2o,室温放置5min,12000rpm(~13400
×
g)离心1min,得到rna溶液;
108.s2、将2μl步骤s1中提取得到的rna溶液采用酶标仪进行rna的纯度及浓度检测;制备1.5%的琼脂糖凝胶电泳,取5μl提取得到的rna溶液,加入loading buffer混匀后进行琼脂糖凝胶电泳,28srrna条带亮度约为18srna条带亮度的1.5~2.0倍,说明rna无降解、具有良好的完整性;
109.s3、使用tiangen fastquant rt kit(with gdnase)并参照其使用说明书进行反转录,具体步骤为:
110.①
将步骤s1获得的rna溶液在冰上解冻;5
×
gdna buffer、fq-rt primer mix、10
×
fast rt buffer、rnase-free ddh2o在室温(15-25℃)解冻,解冻后迅速置于冰上;使用前将每种溶液涡旋振荡混匀,简短离心以收集残留在管壁的液体;以下操作步骤在冰上进
行,为了保证反应液配制的准确性,进行各项反应时,先配制成混合液,然后再分装到每个反应管中;
111.②
按照表1所示的基因组dna去除体系配制混合液,彻底混匀,简短离心以收集残留在管壁的液体,得到反应液a;
112.③
按照表2所示的反转录反应体系配制混合液mix;
113.④
将反转录反应中的混合液mix,加到反应液a中,充分混匀后,依次在42℃孵育15min,95℃孵育3min之后放于冰上,得到乌饭树果实的rna反转录获得的cdna。
114.表1基因组dna去除体系
115.组成成分体积5
×
gdna buffer2μltotal rna1μgrnase-free ddh2o补足至10μl
116.表2反转录反应体系
117.组成成分体积10
×
fast rt buffer2μlrt enzyme mix1μlfq-rt primer mix2μlrnase-free ddh2o补足至10μl
118.实施例
119.(1)根据植物内参基因相关研究文献中提供的方法,在乌饭树果实的转录组数据库中,挑选10个乌饭树候选内参基因,分别为肌动蛋白1(actin1)、肌动蛋白2(actin2)、肌动蛋白3(actin3)、肌动蛋白4(actin4)、肌动蛋白5(actin5)、核糖体蛋白(rp)、泛素结合酶(ube)、泛素蛋白基因(ubq)、烟酰胺腺嘌呤二核苷酸(nadh)和腺苷酸激酶(adk),其中,10个乌饭树候选内参基因的核苷酸序列依次如seq id no.1-seq id no.10所示;
120.将10个乌饭树候选内参基因的核苷酸序列依次复制输入primer premier 6软件中,设置筛选引物的评分条件后,利用primer premier 6软件为输入的乌饭树候选内参基因的基因序列提供m条合适的备选引物对,并会对所设计的备选引物对进行综合评分,在primer premier 6软件中选出评分为最高的备选引物对引物后,再通过软件分析是否形成二聚体、发卡结构等dna二级结构,最终选择符合以下条件的引物序列,以作为对应的乌饭树候选内参基因的内参基因引物对,具体见表3:
121.①
引物的长度在20-24碱基之间,过短则不易扩增,过长会增高延伸温度不适合聚合酶反应的进行;
122.②
引物3’端的5个碱基中最好有3个g、c,末尾最好不是a;
123.③
扩增长度在80-150bp之间;
124.④
引物序列的gc含量在50%-60%范围内;
125.⑤
选择自身二聚体和交叉二聚体连续的碱基数少于4个,不连续的少于7个的引物序列;
126.⑥
选择没有发卡结构的二聚体;
127.将获得的内参基因引物对由华大基因公司合成,采用page纯化方式获得;
128.表3乌饭树候选内参基因对应的引物对
[0129][0130]
(2)将步骤(1)获得的各组内参基因引物对的引物,分别装入引物管中并以12000rpm离心3min,再加入内参基因引物对的摩尔数
×
105倍的ddh2o,涡旋振荡混匀使其充分溶解,制成内参基因引物对各自的浓度为10μm的正向引物工作液和反向引物工作液;
[0131]
以制备例获得的乌饭树果实rna反转录的cdna为荧光定量反应体系的模板,使用superreal premix plus(sybr green)试剂盒,在bio-rad cfx实时荧光定量pcr(qrt-pcr)仪上进行qrt-pcr反应,qrt-pcr反应的反应体系按表4配制,qrt-pcr反应的扩增条件如表5所示,反应结束后导出数据,每个样品做三次技术性重复;
[0132]
表4实时荧光定量pcr的反应体系
[0133]
反应成分体积2
×
superreal premix plus(sybr green)5μl正向引物(10μm)0.5μl反向引物(10μm)0.5μlcdna0.5μlrnase free dh2o3.5μl
[0134]
表5实时荧光定量pcr的扩增条件
[0135][0136]
同时,以qrt-pcr反应的反应体系生成溶解曲线,来判断内参基因引物对的特异性,溶解曲线的具体操作程序为:65℃、0.05s,每0.05s上升0.5℃,直至95℃,连续检测信号,结果见图1。从图1可以看出,表3中所示的10个乌饭树候选内参基因对应的引物对溶解峰单一,无引物二聚体,证明可以用于后续荧光定量pcr的分析;
[0137]
(3)将步骤(2)获得的qrt-pcr数据导入genorm、normfinder和bestkeeper三个软件,分析乌饭树候选内参基因表达的稳定性;其中,genorm和normfinder根据候选内参基因相对表达量q进行评价,bestkeeper根据候选内参基因的ct值进行评价;最后采用几何平均值法计算乌饭树候选内参基因表达稳定性的综合排名。
[0138]
具体过程为:读取步骤(2)中qrt-pcr获得的ct值,10个乌饭树候选内参基因的ct值箱线图如图2所示,ct值在17.61-29.73的范围内波动,不同的候选内参基因在乌饭树果实中的表达有一定差异,核糖体蛋白(rp)的变化差异最大,肌动蛋白3(actin3)、烟酰胺腺嘌呤二核苷酸(nadh)、腺苷酸激酶(adk)的变化差异都比较小。
[0139]
genorm、normfinder和bestkeeper软件的分析结果如下:
[0140]
①
genorm分析候选内参基因的稳定性
[0141]
genorm软件通过平均表达稳定指数m来衡量候选内参基因的表达稳定性,m值越小,表明候选内参基因的表达稳定性越好;若m《1.5,则表示候选内参基因的表达相对稳定,可作为乌饭树的内参基因,若m》1.5,则表示候选内参基因的表达不稳定,不能作为乌饭树的内参基因;genorm软件的分析结果见图3和表6。10个乌饭树候选内参基因的m值均小于1.5,且都低于0.5,其中,肌动蛋白2(actin2)、烟酰胺腺嘌呤二核苷酸(nadh)和腺苷酸激酶(adk)的m值小于0.15,表达稳定性较好;10个候选内参基因的稳定性从低到高依次为:
[0142]
rp《actin5《ubq《actin1《actin4《ube《actin3《actin2《nadh=adk。
[0143]
②
genorm分析候选内参基因组合
[0144]
genorm软件还能够通过分析配对差异值vn/n+1,确定候选内参基因的最佳数目,选择多个稳定的候选内参基因从而消除使用单一内参基因引起的偏差。vn/n+1的阈值为0.15,当vn/n+1《0.15,则表明最适的内参基因数量为n个,无需选择更多的内参基因;当vn/n+1》0.15,则需引入第n+1个内参基因;genorm软件的配对差异值vn/n+1分析结果见图4,,所有的vn/n+1均小于0.15,v2/3配对变异值为0.044,说明乌饭树果实选择2个基因作为内参基因时结果即稳定可靠,无需选择更多的内参基因。
[0145]
③
normfinder分析候选内参基因的稳定性
[0146]
normfinder软件根据表达稳定值m衡量候选内参基因的表达稳定性;稳定值越小,则该基因的表达稳定性越好,分析结果见表6;nadh的稳定值最小,说明该基因的稳定性越好,肌动蛋白2(actin2)的稳定值最大,则肌动蛋白2(actin2)的稳定性最差,这个结果同genorm软件的分析结果基本一致。
[0147]
④
bestkeeper分析候选内参基因的稳定性
[0148]
bestkeeper软件主要根据候选内参基因ct值的标准偏差sd分析内参基因的稳定性,sd越小,表明候选内参基因的稳定性越好;若sd》1,则说明该基因不稳定,分析结果见表6;其中,肌动蛋白1(actin1)的sd值最小,表明肌动蛋白1(actin1)基因的稳定性最好,其他几个候选基因的sd值均小于1。综合标准差与变异系数,肌动蛋白1(actin1)、泛素结合酶(ube)和烟酰胺腺嘌呤二核苷酸(nadh)这3个基因的稳定性最好;泛素蛋白基因(ubq)、肌动蛋白5(actin5)与核糖体蛋白(rp)这3个基因的稳定性最差。
[0149]
表6 genorm、normfinder和bestkeeper分析候选内参基因的表达稳定值和排名
[0150][0151]
⑤
三个软件综合分析候选内参基因的稳定性
[0152]
为了进一步确定乌饭树候选内参基因的表达稳定性以及三个软件的可靠性,将10个乌饭树候选内参基因分别按照在各个软件分析中的稳定性排序进行打分,按照稳定性从高到低的顺序打1-10分,结果见表7;综合三个软件的总分,分数最低的认为是稳定性最好的候选内参基因。表7的数据证明,总分排序的结果与genorm软件的分析结构最为相似,特别是最稳定的内参基因,即在所有样品中最稳定的候选内参基因是烟酰胺腺嘌呤二核苷酸(nadh)和腺苷酸激酶(adk),稳定性比较差的候选内参基因是肌动蛋白5(actin5)和核糖体蛋白(rp)。
[0153]
表7候选内参基因表达稳定性的综合排名
[0154]
基因genormnormfinderbestkeeper综合排名nadh1135adk2349ube55212actin349114actin462614actin2310518actin176720ubq84820actin598926
rp1071027
[0155]
内参基因稳定性的验证
[0156]
为了进一步验证筛选得到的内参基因的稳定性,以稳定性较好的nadh、adk、nadh+adk、rp以及actin5分别作为内参基因,分析目的基因多聚半乳糖醛酸酶基因(pg)和1-氨基环丙烷-1-羧酸氧化酶基因(aco)在乌饭树不同成熟度的果实中的表达模式。
[0157]
pg和aco一般均随着果实成熟而上调表达;根据候选nadh、adk、nadh+adk、rp以及actin5各自的表达量,计算目的基因pg和aco在乌饭树不同成熟度果实(绿果s1、红果s2和蓝果s3)中的相对表达量,结果见图5。用候选内参基因rp分析aco1、aco2和pg这三个基因的变化趋势时,可以看出分析得到的aco1和aco2变化趋势是与预期不符的;用候选内参基因actin5分析aco1、aco2和pg这三个基因的变化趋势时,同样可以看出分析得出的pg变化趋势是与预期不符的;而在用nadh、adk及nadh+adk作为内参基因分析得出的结果,与预期的表达趋势是大体一致的,进一步验证了nadh和adk作为内参基因的可靠性。
[0158]
但是,在分析pg基因中,nadh和adk两个基因的组合与nadh、adk的结果有一些差别,故不建议选择两个基因的组合作为内参基因,综合内参稳定性验证的结果,认为烟酰胺腺嘌呤二核苷酸(nadh)是最适合乌饭树果实基因实时荧光定量pcr(qrt-pcr)的内参基因。
[0159]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1