一种小鼠乳腺癌细胞的分离培养及传代培养方法与流程
1.本发明属于动物细胞的分离培养方法技术领域,具体涉及一种小鼠乳腺癌细胞的分离培养和传代培养方法。
背景技术:
2.乳腺癌是女性最常见的恶性肿瘤之一。近年来,乳腺癌的发病正日渐年轻化,且并不是单纯在女性体内发病的恶性肿瘤疾病。目前,手术及放化疗是治疗乳腺癌的主要手段。
3.近几年来,乳腺癌治疗取得了很大进展,已有多种针对乳腺癌的治疗手段。随着治疗研究的不断深入,越来越多的相关治疗被发现能提高患者的综合治疗效果,但后期易复发转移,传统的治疗方法无法达到很好的效果。
4.为更加深入地研究乳腺癌的发病机理以及各种药物或治疗手段的治疗效果,动物实验是必不可少的环节。其中,构建患有乳腺癌的试验动物的患病动物模型造模是动物实验的进行的前提和基础。目前,小鼠乳腺癌细胞(4t1)原位接种是最常见的乳腺癌动物模型造模方法。利用已有肿瘤细胞,将其转移至动物脂肪垫内,人为的将动物改造成为乳腺癌肿瘤模型,极大程度的提高了乳腺癌模型的造模成功率。
5.患病动物模型造模的前提是获得纯度高活性大的乳腺癌细胞,那么从癌组织中分离提取、培养、传代培养出合适质量和数量的乳腺癌细胞十分重要。目前,研究较多的是对mcf细胞(即人乳腺癌细胞)的分离提取和培养。一方面,当采用小鼠等动物进行实验时,mcf细胞的适用性有可能存在一定问题;另一方面,现有的乳腺癌细胞的分离提取以及培养方法存在,早期换液频繁、细胞活力有限、原代培养时间长等问题。
6.另外,乳腺癌细胞提取培养过程还容易受到成纤维细胞的污染,导致细胞活力下降。
技术实现要素:
7.为解决目前4t1细胞在提取、培养和传代培养过程中存在的换液频繁、培养时间过长以及培养出来的细胞活力有限的技术问题,本发明提供了一种4t1细胞的分离培养和传代培养方法,所采取的技术方案如下:
8.一种小鼠乳腺癌细胞的分离培养方法,该方法将经过预处理的离体新鲜小鼠乳腺癌组织碎块进行清洗后,放入到胶原酶i溶液中进行消化处理;消化处理后加入培养后离心留取沉淀物;将所得的沉淀物转移至含培养基的培养瓶内后在培养箱中进行培养,培养48h后开始首次更换全部培养基;培养结束后去除未贴壁细胞即获得目标细胞;更换培养基后培养目标细胞,待目标细胞形成细胞集落,细胞融合度达到70%后即获得可传代培养的小鼠乳腺癌细胞,分离提取结束。
9.优选地,该方法的步骤如下:
10.1)将经过预处理新鲜离体的小鼠乳腺癌组织标本切成1mm3大小的组织碎片,并利用pbs清洗两次;
11.2)将步骤(1)中经过清洗的组织块放入到盛有胶原酶i的ep管内,进一步粉碎成肉泥后消化3min;
12.3)向步骤(2)经过消化后的溶液中加入含有10%胎牛血清的dmem/f12培养基,混合均匀后,离心留取沉淀物;
13.4)将步骤(3)所得沉淀物转移至含有10%胎牛血清的dmem/f12培养基的培养瓶后放在培养箱内进行培养,培养48h后开始首次换液,当培养至无悬浮组织块时培养结束,培养结束后去除未贴壁细胞,获得目标细胞;如果首次换液后继续培养至48~72小时后,培养瓶中仍有组织块则进行第二次换液,直至培养瓶中无悬浮组织块,培养结束。
14.5)使用配方为:89%dmem/f12+10%fbs+1%三抗的完全培养基培养步骤(4)的目标细胞;培养3~7天当细胞集落形成,细胞融合度达到70%后,即获得可传代培养的小鼠乳腺癌细胞。
15.优选地,步骤(1)所述预处理是去除多余的血液、脂肪和结缔组织。
16.优选地,步骤(2)的胶原酶i需经过37℃的预热。
17.优选地,步骤(4)的培养条件是:37℃、5%co2。
18.一种上述分离培养方法获得细胞的传代培养方法,该方法的步骤如下:
19.1)将产生集落的细胞中的培养基和组织块去除,并加入pbs进行洗涤,洗涤后弃掉pbs;
20.2)向弃掉pbs的细胞培养瓶内加入胰蛋白酶,使胰蛋白酶均匀覆盖在全部细胞上,在37℃下消化处理0.5~1min;
21.3)消化结束后,加入完全培养基终止消化:
22.4)将步骤(3)经消化的细胞制成细胞悬液后转移至离心管内离心分离细胞,离心留取细胞沉淀;
23.5)向步骤(4)所得的细胞沉淀内加入完全培养基,细胞沉淀重新悬浮后,按照1:2~4的比例进行传代培养。
24.优选地,步骤(2)所用胰蛋白酶为37℃预热的含有0.02%edta的0.25%胰蛋白酶。
25.优选地,步骤(3)是利用显微镜观察细胞状态,当细胞开始变圆时,轻拍培养瓶底部,促使细胞脱落后加入4倍胰蛋白酶体积的完全培养基终止消化。
26.相对于现有技术,本发明获得的有益效果:
27.本发明在保证原代细胞分离培养纯度的条件下,缩短简化了原代细胞分离培养方法。该方法将现有技术中原代分离培养早期频繁换液方式,调整为48h首次完全换液,采用完全换液方法,之后每2~3天完全换液一次,保证原代小鼠乳腺癌细胞的营养支持;培养至第7~10天镜下可见大量的集落形成,根据集落细胞的长势来决定首次传代的时间,不必等到细胞融合度达到80~90%再传代,大大缩减了换液的次数和环节。同时,本发明的方法还缩短了原代培养时间,现有技术中原代培养时间为10~14天,本发明中原代培养时间约为7~10天。
28.通过调整胰蛋白酶消化浓度、用量、时间,最大程度地保留了细胞生长活力,通过实验验证通过本发明方法制备的4t1细胞其活力均明显优于市购的4t1细胞。并且本发明提供的原代细胞分离培养和传代培养方法具有简便、稳定性好、重复性好的优点。
附图说明
29.图1为4t1细胞培养至第7天时显微镜下的细胞。
30.图2为实施例3中利用本发明的方法培养完成的4t1细胞在显微镜下的情况。
31.图3为实施例4中4t1细胞培养至第4代时显微镜下的细胞。
32.图4为实施例5中4t1细胞培养至第4代时显微镜下的细胞。
33.图5为实施例6中4t1细胞培养至第4代时显微镜下的细胞。
具体实施方式
34.下面结合具体实施例对本发明做进一步说明,但本发明不受实施例的限制。
35.以下实施例所用的材料、试剂、方法、仪器等,未经特殊说明,均为本领域常规材料、试剂、方法、仪器。本领域技术技术人员均可通过商业渠道获得。
36.如无特别说明,本技术中试剂的浓度均为质量浓度;如无特别说明,本发明中涉及的实验技术均采用生物学中的通用方法。所用的pbs是购自北京索莱宝科技有限公司的型号为p1020的pbs溶液;所用的胰蛋白酶是购自gibco的25200072;cck8试验所用的试剂盒为美仑ma0218
‑
t。
37.实施例1 4t1细胞的分离培养
38.本实施提供了一种4t1细胞的分离培养方法,该方法的步骤如下:
39.(1)取离体的新鲜的乳腺癌组织标本进行前处理,组织标本完好区域且含肿瘤组织多的区域,切取1cm3大小组织块;
40.(2)将上述步骤中的组织块切制成1mm3大小的组织碎片;
41.(3)离体的组织块在pbs中清洗2次,放入盛有胶原酶ⅰ的5ml ep管中,用眼科剪,将组织剪碎至肉泥状,消化3min;
42.(4)向ep管中加入和胶原酶ⅰ等体积的含10%胎牛血清的dmem/f12培养基;
43.(5)利用离心机在1000rpm条件下离心3min,离心后弃上清,余下细胞沉淀及组织块,移至25cm2培养瓶中,将组织块均匀的铺在瓶底(培养瓶中含有10%胎牛血清的dmem/f12培养基);
44.(6)将步骤5)的组织块置37℃、5%co2的恒温培养箱中培养,48h后弃掉原有培养基,并用pbs洗1~2次后,更换为新鲜的含10%胎牛血清的dmem/f12完全培养基,首次换液后继续培养48h发现培养瓶中已无悬浮组织块培养结束,培养结束后去除未贴壁细胞,得到的贴壁细胞中含有所述乳腺癌肿瘤细胞。
45.(7)取上述提取方法制得的贴壁细胞,使用89%dmem/f12+10%fbs+1%三抗的完全培养基进行培养,培养3天完全换液;
46.(8)培养至第7天时,显微镜下观察到大量细胞集落形成,即得乳腺癌肿瘤细胞,可用于后续的传代培养。大量细胞集落中的“大量”是指显微镜下具有70%以上的细胞。
47.(9)取上述培养方法所得乳腺癌肿瘤细胞,加入37℃预温的质量浓度为0.25%胰蛋白酶,使胰蛋白酶均匀覆盖全部的乳腺癌肿瘤细胞,室温下控制胰蛋白酶消化时间为0.5~1min;
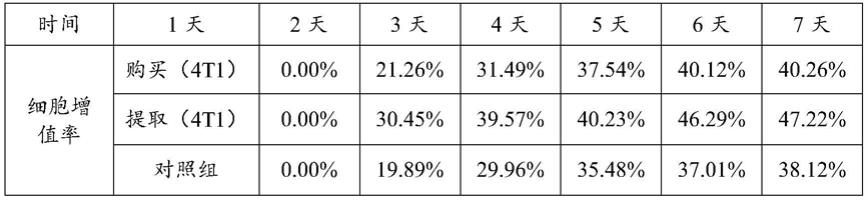
48.(10)通过镜下观察,当细胞开始变圆时,轻拍培养瓶底部,使细胞脱落下来,立即加入完全培养基终止胰蛋白酶消化;
49.(11)轻轻吹打细胞培养瓶底部后收集细胞悬液,弃上清后,用完全培养基重悬,吹打至单细胞悬液,然后按照可比例进行稀释和传代培养。
50.实施例2 4t1细胞的传代培养
51.实验方法:将产生集落的细胞中的培养基和组织块去除,并加入pbs进行洗涤,洗涤后弃掉pbs;向弃掉pbs的细胞培养瓶内加入胰蛋白酶,使胰蛋白酶均匀覆盖在全部细胞上,在37℃下消化处理0.5~1min;消化结束后,加入完全培养基终止消化,吹打细胞,制成细胞悬液;将细胞悬液转移至离心1000rpm离心3min后留取细胞沉淀;向细胞沉淀内加入完全培养基,细胞沉淀重新悬浮后,将一瓶细胞传代成两瓶细胞继续培养。
52.镜下观察:第48h可见少量小的长梭形或者纺锤状贴壁细胞散在分布;培养至第7d(如图1所示),原来散在分布的长梭形细胞呈集落生长,细胞集落与集落之间有空隙没有细胞生长;培养至第10d,原来的细胞集落处细胞密集生长,类似于旋涡样排列,此时不必等到细胞长到80~90%的融合度,根据集落的长势情况决定首次原代细胞传代的时间,避免集落细胞高度密集生长而影响原代细胞的活性。
53.实施例3市购4t1细胞与本发明获得的4t1细胞活力的对比
54.对购买的小鼠乳腺癌肿瘤细胞的培养方法使用说明书建议的方法,隔天换液,细胞密度达到90%时使用0.25%胰蛋白酶消化3min。而对从小鼠乳腺癌肿瘤组织中提取和培养原代小鼠乳腺癌细胞使用本发明中的培养方法。同时,设置对照组,对照组的培养方法与实施例1中的方法相同,不同之处在于:细胞提取后首次换液时间为6h,换液间隔为6h;在更换89%dmem/f12+10%fbs+1%三抗的完全培养基后,培养至细胞融合度达到80%以上后再进行后续处理。对三种细胞进行细胞的cck8实验,结果见表1。结果表明,使用本发明的培养方法获得细胞,其细胞增殖活力与直接购买的小鼠乳腺癌肿瘤细胞的细胞增殖活力相似,甚至高于直接购买的小鼠乳腺癌肿瘤细胞。此外,本发明的培养方法获得的细胞活力也明显优于对照组所培养出细胞的细胞活力。
55.表1市购4t1细胞与本发明获得的4t1细胞活力对比
[0056][0057]
实施例4 4t1细胞的传代培养
[0058]
本实施例提供了一种4t1细胞的传代培养方法,是将实施例1制备出的原代细胞,按照如下步骤进行传代培养:
[0059]
1)将产生集落的细胞中的培养基和组织块去除,并加入pbs进行洗涤,洗涤后弃掉pbs;
[0060]
2)向弃掉pbs的细胞培养瓶内加入经37℃预热的含有0.02%edta的0.25%的胰蛋白酶,使胰蛋白酶均匀覆盖在全部细胞上,在37℃下消化处理0.5~1min;
[0061]
3)用显微镜观察细胞状态,当细胞开始变圆时,轻拍培养瓶底部,促使细胞脱落后加入4倍胰蛋白酶体积的完全培养基终止消化:
[0062]
4)将步骤(3)经消化的细胞制成细胞悬液后转移至离心管内离心分离细胞,离心留取细胞沉淀;
[0063]
5)向步骤(4)所得的细胞沉淀内加入完全培养基,细胞沉淀重新悬浮后,将一瓶细胞传代成四瓶细胞进行培养。
[0064]
细胞传代至第4代后,对细胞进行显微镜观察,显微镜下的细胞图如图3所示。
[0065]
实施例5 4t1细胞的传代培养
[0066]
本实施例提供了一种4t1细胞的传代培养方法,是将实施例1制备出的原代细胞,按照如下步骤进行传代培养:
[0067]
1)将产生集落的细胞中的培养基和组织块去除,并加入pbs进行洗涤,洗涤后弃掉pbs;
[0068]
2)向弃掉pbs的细胞培养瓶内加入经37℃预热的含有0.02%edta的0.25%的胰蛋白酶,使胰蛋白酶均匀覆盖在全部细胞上,在37℃下消化处理0.5~1min;
[0069]
3)用显微镜观察细胞状态,当细胞开始变圆时,轻拍培养瓶底部,促使细胞脱落后加入4倍胰蛋白酶体积的完全培养基终止消化:
[0070]
4)将步骤(3)经消化的细胞制成细胞悬液后转移至离心管内离心分离细胞,离心留取细胞沉淀;
[0071]
5)向步骤(4)所得的细胞沉淀内加入完全培养基,细胞沉淀重新悬浮后,按照一瓶细胞传代成三瓶细胞进行培养。
[0072]
细胞传代至第4代后,对细胞进行显微镜观察,显微镜下的细胞图如图4所示。
[0073]
实施例6 4t1细胞的传代培养
[0074]
本实施例提供了一种4t1细胞的传代培养方法,是将实施例1制备出的原代细胞,按照如下步骤进行传代培养:
[0075]
1)将产生集落的细胞中的培养基和组织块去除,并加入pbs进行洗涤,洗涤后弃掉pbs;
[0076]
2)向弃掉pbs的细胞培养瓶内加入经37℃预热的含有0.02%edta的0.25%的胰蛋白酶,使胰蛋白酶均匀覆盖在全部细胞上,在37℃下消化处理0.5~1min;
[0077]
3)用显微镜观察细胞状态,当细胞开始变圆时,轻拍培养瓶底部,促使细胞脱落后加入4倍胰蛋白酶体积的完全培养基终止消化:
[0078]
4)将步骤(3)经消化的细胞制成细胞悬液后转移至离心管内离心分离细胞,离心留取细胞沉淀;
[0079]
5)向步骤(4)所得的细胞沉淀内加入完全培养基,细胞沉淀重新悬浮后,将一瓶细胞传代成两瓶后继续培养。
[0080]
细胞传代至第4代后,对细胞进行显微镜观察,显微镜下的细胞图如图5所示。
[0081]
虽然本发明已以较佳的实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可以做各种改动和修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1