印第安纳沙门菌及其三种血清抗原同时检测实时荧光定量PCR引物、探针、试剂盒和方法与流程
印第安纳沙门菌及其三种血清抗原同时检测实时荧光定量pcr引物、探针、试剂盒和方法
技术领域
1.本发明属于生物技术技术领域,具体涉及一种印第安纳沙门菌及其三种血清抗原同时检测实时荧光定量pcr引物、探针、试剂盒和方法。
背景技术:
2.沙门菌是一种重要的食源性致病菌,具有多种血清型,截至目前已发现近2700种。印第安纳血清型沙门菌(salmonella enterica subsp.enterica serovar indiana,以下简称印第安纳沙门菌或s.indiana),隶属于沙门菌属肠道种肠道亚种(i亚种),血清式为4:z:1,7,菌体抗原为o:4群,鞭毛一相抗原为h:z,二相抗原为h:1,7,是食品中特别是禽肉类中较常见的一种血清型,可感染人类,国内于1984年首次报道。
3.鉴于近年来特别是2009年以来,该血清型在临床和食品样品中呈现出检出率快速持续上升趋势,且对多种常用抗生素甚至临床一线沙门菌感染用药(如喹诺酮类和头孢类)出现多重耐药的状况日渐增加,其复杂的耐药机制和多种可移动元件给临床治疗带来极大困难。因此对该血清型沙门菌的检测、鉴定和监测工作,对开展相关研究、评估和治疗所引起的沙门菌感染具有重要意义。
4.目前国内外现有的印第安纳沙门菌的血清学鉴定技术,仍然以传统的血清凝集实验为主,同时也有一些基于分子生物学实验或基因组方法的血清学鉴定方法面世,以下分别介绍。
5.(1)传统血清凝集方法,通过在不同培养基上培养具有不同生长状态的菌落,使用进口或国产血清试剂与在玻片上进行抗原抗体凝集反应,并观察反应现象,采取一定凝集流程逐步缩小范围,从而判断相对应的特异性血清群或血清因子(包括菌体o抗原46种和两种鞭毛h抗原近150种),具体方法步骤见(食品安全国家标准微生物学检验沙门菌检验gb 4789.4
‑
2016)。针对印第安纳血清型,该方法需要分别对o:4、h:z和h:1,7以及其相关多价血清oma、hma和hmd均凝集成功,且其他非相关的多价和单价血清试剂均不凝集方可。该方法对试剂品牌和质量、菌株鞭毛抗原培养状态和操作人员经验要求较高,另外配备整套检测试剂(o和h,单价和多价试剂共约200种)价格较为昂贵,但不配备整套试剂很可能无法检出最终结果,此外还具有耗时长、工作量较大、鉴定结果不稳定的缺陷。
6.(2)基于多重pcr和微球技术(xmap
@
ssa)的luminex平台,沙门菌分子血清型鉴定试剂,该方法可使用多重pcr方法一次性鉴定7种o抗原和35种h抗原,优点在于可较为准确判断血清抗原因子,如印第安纳沙门菌的三种抗原因子均包含在该试剂盒中,但缺点为:单株菌测试的价格极其昂贵、需要配套使用luminex仪器平台、可检测的o和h抗原种类不全、无法检出未包含在检测范围内的血清因子、操作流程需要专业培训、菌株多的话耗时较长,方法参见(dunbar,s.a.,ritchie,v.b.,hoffmeyer,m.r.,rana,g.s.&zhang,h.(2015).multiplex bead suspension arrays for the detection and serotyping of salmonella spp.methods in molecular biology,1225,1e27)。
7.(3)全基因组学测序技术,使用二代或三代全基因组测序(wgs)技术,对测序数据进行生物信息学分析比对,在相关数据库进行查找获得血清型,方法参见(uelze l,borowiak m,deneke c,et al.performance and accuracy of four open
‑
source tools for in silico serotyping of salmonella spp.based on whole
‑
genome short
‑
read sequencing data.appl environ microbiol.2020;86(5):e02265
‑
19.)该方法也存在一些问题:测序价格目前仍未便宜到全民普及的价格,测序需要试剂盒提取质量较高的基因组,测序结果分析需要具有一定的生信分析能力和掌握相关的基因组处理软件,另外获得测序结果时长目前仍然不够迅速。
8.(4)pcr或实时荧光定量pcr等分子生物学方法,针对印第安纳沙门菌的特征基因,设计相应的引物和探针,使用分子生物学技术进行检测,目前可检索到的相关专利或文献包括:
9.(5)(a)zhang p,zhuang l,zhang d,et al.serovar
‑
specific polymerase chain reaction for detection of salmonella enterica serovar indiana.foodborne pathog dis.2018;15(12):776
‑
781;
10.(b)wang yx,zhang ay,yang yq,et al.sensitive and rapid detection of salmonella enterica serovar indiana by cross
‑
priming amplification.j microbiol methods.2018;153:24
‑
30;
11.(c)广东省微生物研究所(广东省微生物分析检测中心)申请的中国专利cn201911399987,16种不同血清型沙门菌特异性新分子靶标及其快速检测方法。
12.其中,(a)方法采用单个特征性基因对印第安纳血清型沙门菌进行检测,使用了56株印第安纳沙门菌、146株非印第安纳沙门菌(31种血清型)和14株非沙门菌建立方法并使用156株临床菌株进行验证;(b)方法采用了对印第安纳特征序列进行交叉引物扩增(cpa)和核酸检测条(nads)技术,对42株菌株(包含20种血清型的25株沙门菌和17株非沙门菌)进行了验证,并对100只鸡的肝及粪便拭子样品进行了检测;(c)方法是其公开的16种不同血清型沙门菌特异性新分子靶标及其快速检测方法中的一种,使用pcr方法进行检测,用于验证的菌株数量不明。
13.这三种方法基于特征性基因或引物对,使用一定数量的菌株进行方法建立和验证,但存在以下问题:
14.(1)扩增靶标均为某一个或多个非血清抗原因子的特征性基因,由于沙门菌血清学鉴定的判定原理是基于血清抗原,因此设计原理决定了在未对沙门菌所有血清型(目前已发现近2700种)全部测试前,无法完全证明这些方法的准确性和代表性;
15.(2)方法的准确性直接依赖于所测试的已知血清型或血清因子的菌株数目,因此需要具备数目庞大且信息完善的菌株库和数据库,但这一点非常难,目前世界上除了负责对沙门菌新血清型进行最终雪人的三个who参比实验室保存有最多的沙门菌血清型外,其他任何一个实验室都很难做到;
16.(3)部分方法(如方法b)使用的cpa方法和普通pcr方法相比流程和时间上并未缩减很多,但后续检测增加了nads试剂条的费用和实验操作步骤,且该部分并非为常规分子生物学检测必备环节,需单独进行试剂配备和技术储备。
技术实现要素:
17.针对以上已有印第安纳沙门菌检测方法存在的问题和缺陷,本技术提出了一种针对印第安纳沙门菌及其三种血清抗原同时检测的实时荧光定量pcr引物、探针、试剂盒和方法。该方法针对决定该血清型的对应wzx基因的印第安纳沙门菌o:4抗原、所述对应flic基因的印第安纳沙门菌鞭毛h:z抗原和对应fljb基因的印第安纳沙门菌鞭毛h:1,7抗原进行设计,且经1100多株菌株验证,具有灵敏、高通量、快速的特点,能够实现对沙门菌中印第安纳血清型及其相应三种血清因子的快速筛查。
18.本发明提供如下技术方案:
19.一种对印第安纳沙门菌及其三种血清抗原同时检测的实时荧光定量pcr引物,包括:
20.针对印第安纳沙门菌o:4抗原的特异性上游引物序列seq id no.1:
[0021]5’‑
caagccgagcatacctatcat
‑3’
;
[0022]
针对印第安纳沙门菌o:4抗原的特异性下游引物序列seq id no.2:
[0023]5’‑
tggaatcggagctattgcttat
‑3’
;
[0024]
针对印第安纳沙门菌鞭毛h:z抗原的特异性上游引物序列seq id no.3:
[0025]5’‑
ttctgatgccgctgatactg
‑3’
;
[0026]
针对印第安纳沙门菌鞭毛h:z抗原的特异性下游引物序列seq id no.4:
[0027]5’‑
aggtttcgcaggttctttagt
‑3’
;
[0028]
针对印第安纳沙门菌鞭毛h:1,7抗原的特异性上游引物序列seq id no.5:
[0029]5’‑
cgaatggtgcacctagtgtaa
‑3’
;
[0030]
针对印第安纳沙门菌鞭毛h:1,7抗原的特异性下游引物序列seq id no.6:
[0031]5’‑
gtcgagatcagcaccagtaaag
‑3’
。
[0032]
进一步地,所述印第安纳沙门菌o:4抗原对应的基因为wzx基因,所述印第安纳沙门菌鞭毛h:z抗原对应的基因为flic基因,所述印第安纳沙门菌鞭毛h:1,7抗原对应的基因为fljb基因。
[0033]
本发明还提供一种对印第安纳沙门菌及其三种血清抗原同时检测的实时荧光定量pcr探针,包括:
[0034]
针对印第安纳沙门菌o:4抗原的特异性实时荧光定量pcr探针seq id no.7:
[0035]5’‑
fam
‑
tagctttccacccgaccaattcgg
‑3’‑
bhq1;
[0036]
针对印第安纳沙门菌鞭毛h:z抗原的特异性实时荧光定量pcr探针seq id no.8:
[0037]5’‑
hex
‑
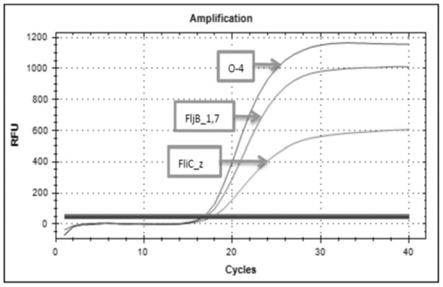
acagtgccatcatcagcaacattgac
‑3’‑
bhq1;
[0038]
针对印第安纳沙门菌鞭毛h:1,7抗原的特异性实时荧光定量pcr探针seq id no.9:
[0039]5’‑
cy5
‑
aggtagtgcggttaaatttgacgcaga
‑3’‑
bhq2。
[0040]
进一步地,所述印第安纳沙门菌o:4抗原对应的基因为wzx基因,所述印第安纳沙门菌鞭毛h:z抗原对应的基因为flic基因,所述印第安纳沙门菌鞭毛h:1,7抗原对应的基因为fljb基因。
[0041]
本发明还提供一种对印第安纳沙门菌及其三种血清抗原同时检测的实时荧光定量pcr检测试剂盒,其特征在于,包括含有上述的实时荧光定量pcr引物和如上述的实时荧
光定量pcr探针以及实时荧光定量pcr反应组分构建的实时荧光定量pcr扩增反应体系。
[0042]
进一步地,所述实时荧光pcr扩增反应体系以25μl计,包括12.5μl的实时荧光定量pcr预混液、0.8μl的如权利要求1所述的序列为seq id no.1的上游引物、0.8μl的如权利要求1所述的序列为seq id no.3的上游引物、0.8μl的如权利要求1所述的序列为seq id no.5的上游引物、0.8μl的如权利要求1所述的序列为seq id no.2的下游引物、0.8μl的如权利要求1所述的序列为seq id no.4的下游引物、0.8μl的如权利要求1所述的序列为seq id no.6的下游引物、0.5μl的如权利要求2所述的序列为seq id no.7的实时荧光定量pcr探针、0.5μl的如权利要求2所述的序列为seq id no.8的实时荧光定量pcr探针、0.5μl的如权利要求2所述的序列为seq id no.9的实时荧光定量pcr探针、1.2μl的ddh2o和5μl的待测菌株基因组模板dna。
[0043]
本发明还提供一种对印第安纳沙门菌及其三种血清抗原同时检测的实时荧光定量pcr检测方法,包括以下步骤:
[0044]
1)将生化鉴定为沙门菌的待测菌株,划线接种于非选择性平板上,于37℃下恒温培养箱过夜培养后,刮取菌株培养物到1ml无菌水中,置于沸水浴或100℃金属浴中加热10min后,迅速置于冰水浴或冷冻环境5min后,于12000rpm离心10min,然后取上清200μl作为待测菌株基因组模板dna;
[0045]
2)采用权利要求5所述的试剂盒、所述步骤1)提取的待测菌株基因组模板dna制成实时荧光pcr定量反应体系;
[0046]
3)将步骤2)配制得到的反应体系于:95℃预变性15min;95℃变性15s,60℃退火20s,72℃延伸30s,35个循环,60℃采集荧光。
[0047]
4)根据扩增反应结果判定待测菌株三种血清抗原对应基因的阴阳性,来判断鉴定待测菌株是否包含三种血清抗原以及是否为印第安纳沙门菌;如果三种血清抗原检测结果均为阳性,代表所检测样品包含o:4,h:z和h:1,7三种血清抗原,且该待测菌株为印第安纳沙门菌;如三种基因中有一种或一种以上基因的检测结果为阴性,代表该待测菌株只包含阳性基因相应的血清抗原,但该菌株不是印第安纳沙门菌且。
[0048]
进一步地,所述步骤4)中判定是某种血清抗原对应的基因反应阴阳性的标准为:当扩增反应的ct值≤25为阳性,当扩增反应的ct值>25为阴性。
[0049]
本发明的有益效果为:
[0050]
1、本发明针对印第安纳沙门菌的o:4,h:z和h:1,7三种血清抗原的决定基因wzx、flic和fljb直接设计引物和探针,能够对印第安纳沙门菌及其三种血清抗原进行同时检测鉴定;并且本发明提供的实时荧光定量pcr鉴定和检测印第安纳沙门菌及其三种血清抗原的方法使用了更多血清型和更多数目的菌株进行方法建立和验证,具有更好的准确性和代表性。
[0051]
2、本发明提供的实时荧光定量pcr引物、探针及其检测方法,针对包括传统血清学检测的检测时间长、程序复杂、试剂昂贵、经验操作要求高、工作量大和目前新兴基因组分析困难以及分子生物学方法检测的试剂昂贵和代表性、准确性不足等现有印第安纳沙门菌检测方法所存在的问题,从沙门菌血清学鉴定的原理出发,针对印第安纳血清型沙门菌及其三种血清抗原即o:4、h:z和h:1,7,建立了高通量、快速筛查的实时荧光定量pcr方法。本发明提供的引物、探针、试剂盒和实时荧光定量pcr方法不仅可一次性筛查待测沙门菌是否
为印第安纳血清型,还可以分别单纯对o:4,h:z和h:1,7三种血清抗原的存在与否进行准确检测和鉴定。
[0052]
3、相对于现有方法的通量、检测时间、操作流程、试剂价格和结果可比性,该方法具有更高的检测通量,根据不同型号qpcr仪器的通量,可同时批量检测多个样本(如96个或更多)。
[0053]
与此同时,所需的的检测时间更短,本发明提供的方法提取dna时间为0.5小时,检测时间为1.5小时,扩增后即可观察结果,无需进一步分析和等待,与传统血清检测及鉴定方法所需的2~3天、luminex方法所需的1~2天、wgs方法所需的1~3周等相比,检测和分析时长短很多;
[0054]
本发明提供的实时荧光定量pcr鉴定和检测印第安纳沙门菌及其三种血清抗原的方法具有更好的操作简易度,仅需普通实时荧光定量pcr检测所需仪器试剂耗材和检测流程即可,不涉及更多复杂的检测或分析技术,对操作人员的经验要求或专项实验技能或分析要求较低,且相比于传统血清、luminex试剂、wgs、nads等具有更低的试剂和分析价格。
附图说明
[0055]
在下文中将基于实施例并参考附图来对本发明进行更详细的描述。其中:
[0056]
图1为本发明提供的实施例4的阳性样品与阴性比对样品实时荧光定量pcr扩增曲线比对示意图;
[0057]
图2为本发明提供的实施例6的1)中typhimurium沙门菌atcc10428及其三种血清检测荧光定量结果;
[0058]
图3为本发明提供的实施例6的2)中kiambu沙门菌who eqas 2013s2及其三种血清检测荧光定量结果;
[0059]
图4为为本发明提供的实施例6的3)中schwarzengrund沙门菌who eqas 2017s6及其三种血清检测荧光定量结果;
[0060]
图5为本发明提供的实施例6的4)中carno沙门菌who eqas 2015s4及其三种血清检测荧光定量结果;
[0061]
图6为本发明提供的实施例6的5)中colindale沙门菌who eqas 2012s6及其三种血清检测荧光定量结果;
[0062]
图7为本发明提供的实施例6的6)中indiana沙门菌cfsa664及其三种血清检测荧光定量结果;
[0063]
图8为本发明提供的实施例6的7)中enteritidis沙门菌atcc13076及其三种血清检测荧光定量结果。
[0064]
具体实施例方式
[0065]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0066]
实施例1
[0067]
本实施例提供一种对印第安纳沙门菌及其三种血清抗原同时检测的实时荧光定
量pcr引物和探针,挑选具有不同血清型的沙门菌参考菌株80余株,所述参考菌株的来源途径包括:购买的标准菌株、参加国际国内质控考核的考核株,或其他实验室赠送菌株,或本实验室经多种方法验证确认血清型的菌株,均具有或已获得确定的血清抗原信息。针对上述参考菌株,分别设计和构建特异性针对对应wzx基因的印第安纳沙门菌o:4抗原、对应flic基因的鞭毛h:z抗原和对应flib基因的鞭毛h:1,7抗原的实时荧光定量pcr引物,并使用参考菌株测试和调整优化以进行方法构建,包括:
[0068]
针对印第安纳沙门菌o抗原的特异性上游引物序列seq id no.1:
[0069]5’‑
caagccgagcatacctatcat
‑3’
;
[0070]
针对印第安纳沙门菌o抗原的特异性下游引物序列seq id no.2:
[0071]5’‑
tggaatcggagctattgcttat
‑3’
;
[0072]
针对印第安纳沙门菌鞭毛h:z抗原的特异性上游引物序列seq id no.3:
[0073]5’‑
ttctgatgccgctgatactg
‑3’
;
[0074]
针对印第安纳沙门菌鞭毛h:z抗原的特异性下游引物序列seq id no.4:
[0075]5’‑
aggtttcgcaggttctttagt
‑3’
;
[0076]
针对印第安纳沙门菌鞭毛h:1,7抗原的特异性上游引物序列seq id no.5:
[0077]5’‑
cgaatggtgcacctagtgtaa
‑3’
;
[0078]
针对印第安纳沙门菌鞭毛h:1,7抗原的特异性下游引物序列seq id no.6:
[0079]5’‑
gtcgagatcagcaccagtaaag
‑3’
。
[0080]
对上述印第安纳沙门菌及其三种血清抗原同时检测的实时荧光定量pcr探针包括:
[0081]
针对印第安纳沙门菌o抗原的特异性实时荧光定量pcr探针seq id no.7:
[0082]5’‑
fam
‑
tagctttccacccgaccaattcgg
‑3’‑
bhq1;
[0083]
针对印第安纳沙门菌鞭毛h:z抗原的特异性实时荧光定量pcr探针seq id no.8:
[0084]5’‑
hex
‑
acagtgccatcatcagcaacattgac
‑3’‑
bhq1;
[0085]
针对印第安纳沙门菌鞭毛h:1,7抗原的特异性实时荧光定量pcr探针seq id no.9:
[0086]5’‑
cy5
‑
aggtagtgcggttaaatttgacgcaga
‑3’‑
bhq2。
[0087]
实施例2
[0088]
本实施例提供含有实施例1提供的实时荧光定量pcr引物和探针的对印第安纳沙门菌及其三种血清抗原同时检测的实时荧光定量pcr检测试剂盒,包括含实施例1中的seq id no.1~seq id no.6的实时荧光定量pcr上下游引物和seq id no.7~seq id no.9的实时荧光定量pcr探针;
[0089]
实时荧光pcr扩增反应体系以25μl计,包括12.5μl的实时荧光定量pcr预混液,0.8μl的序列为seq id no.1的上游引物、0.8μl的序列为seq id no.3的上游引物、0.8μl的序列为seq id no.5的上游引物、0.8μl的序列为seq id no.2的下游引物、0.8μl的序列为seq id no.4的下游引物、0.8μl的序列为seq id no.6的下游引物、0.5μl的序列为seq id no.7的实时荧光定量pcr探针、0.5μl的序列为seq id no.8的实时荧光定量pcr探针、0.5μl的序列为seq id no.9的实时荧光定量pcr探针、1.2μl的ddh2o,5μl的模板dna。
[0090]
实施例3
[0091]
本实施例提供一种对印第安纳沙门菌及其三种血清抗原同时检测的实时荧光定量pcr检测方法,包括以下步骤:
[0092]
1)将生化鉴定为沙门菌的待测菌株,划线接种于bha平板上,于37℃下恒温培养箱过夜培养后,使用无菌棉签从bha平板刮取适量菌苔至盛有1ml无菌水的1.5ml ep管中,将菌落捻磨至无菌水中制成菌悬液,浊度为1麦氏浊度左右即可,将ep管置于沸水浴或100℃金属浴中加热10min后,迅速置于冰水浴或冷冻环境5min后,于12000rpm离心10min,然后取上清200μl作为基因组dna;
[0093]
2)采用实施例2提供的的试剂盒、步骤1)提取的待测样品基因组dna制成实施例2提供的25μl实时荧光定量pcr反应体系;
[0094]
3)将步骤2)配制得到的反应体系于:95℃预变性15min;95℃变性15s,60℃退火20s,72℃延伸30s,35个循环,60℃采集荧光;
[0095]
4)将反应结果文件从仪器导出,使用实时荧光定量pcr仪器附带软件获得每孔样品中三种目标基因的ct值,根据ct值判定三种基因检测结果阴阳性(扩增反应ct值≤25为阳性,扩增反应ct值>25的为阴性);根据三种基因检测结果的阴阳性来判断鉴定待测菌株是否包含三种血清抗原以及是否为印第安纳沙门菌,如果三种血清抗原检测结果均为阳性,代表所检测样品包含o:4,h:z和h:1,7三种血清抗原,且为印第安纳沙门菌;如三种基因中有一种或一种以上基因的检测结果为阴性,代表该待测菌株只包含阳性基因相应的血清抗原,但该菌株不是印第安纳沙门菌。
[0096]
实施例4—检测结果的特异性比对实验
[0097]
选取一株针对三种基因的血清抗原均为阳性的印第安纳沙门菌菌株的基因组dna作为阳性样品,采用ddh2o作为三种阴性对照样品,分别采用实施例3的方法进行实时荧光定量pcr检测,检测结果如附图1所示,三种颜色的基线即为三种阴性对照样品的扩增曲线,带有上升之后平缓增长的三条曲线分别为三种血清抗原对应基因的阳性样品扩增曲线,可见,本技术提供的印第安纳沙门菌及其三种血清抗原同时检测实时定量pcr引物和探针组成的试剂盒,并采用此试剂盒在95℃预变性15min;95℃变性15s,60℃退火20s,72℃延伸30s,35个循环,60℃采集荧光的条件下进行实时荧光定量pcr可以特异性地检出三种血清抗原均为阳性的印第安纳沙门菌。
[0098]
实施例5—检测结果的灵敏性比对实验
[0099]
将印第安纳沙门菌dna,用无dnase和rnase的高纯水进行10倍稀释,分别进行荧光pcr测试,以印第安纳沙门菌dna稀释液中三种基因的任意一个基因的扩增反应ct值先到达25时,所检测到的印第安纳沙门菌dna的总量作为该方法的灵敏度。结果显示,该方法检测印第安纳沙门菌的灵敏度为0.06ng/ul dna,即待测菌株模板dna在该浓度条件下可检出三种基因阳性结果(扩增反应ct值≤25)。
[0100]
实施例6—检测结果的特异性验证实验
[0101]
1)选用标准菌株typhimurium沙门菌atcc 10428(o抗原为o:4,鞭毛抗原分别为h:i和h:1,2),按照标准流程使用金属浴法提取基因组dna,使用荧光定量pcr仪的fam通道、hex通道和cy5通道分别检测o:4抗原、h:z抗原和h:1,7抗原。
[0102]
实验条件:配制25μl实时荧光pcr定量扩增反应体系,体系包括:12.5μl的实时荧光定量pcr预混液、三种上游引物各0.8μl(seq id no.1、seq id no.3和seq id no.5)、三
种下游引物各0.8μl(seq id no.2、seq id no.4和seq id no.6)、三种实时荧光定量pcr探针各0.5μl(seq id no.7、seq id no.8和seq id no.9)、1.2μl的ddh2o和5μl的待测菌株基因组模板dna,在荧光定量pcr仪设置反应条件(95℃预变性15min;95℃变性15s,60℃退火20s,72℃延伸30s,35个循环,60℃采集荧光)。
[0103]
实验结果:如图2所示,fam通道阳性,hex通道阴性,cy5通道阴性,表明o:4抗原检测结果为阳性,h:z抗原和h:1,7抗原检测结果为阴性,荧光定量pcr结果与血清型结果相符。
[0104]
2)选用标准菌株kiambu沙门菌who eqas 2013s2(o抗原为o:4,鞭毛抗原分别为h:i和h:1,5),按照标准流程使用金属浴法提取基因组dna,使用荧光定量pcr仪的fam通道、hex通道和cy5通道分别检测o:4抗原、h:z抗原和h:1,7抗原。
[0105]
实验条件:配制25μl实时荧光pcr定量扩增反应体系,体系包括:12.5μl的实时荧光定量pcr预混液、三种上游引物各0.8μl(seq id no.1、seq id no.3和seq id no.5)、三种下游引物各0.8μl(seq id no.2、seq id no.4和seq id no.6)、三种实时荧光定量pcr探针各0.5μl(seq id no.7、seq id no.8和seq id no.9)、1.2μl的ddh2o和5μl的待测菌株基因组模板dna,在荧光定量pcr仪设置反应条件(95℃预变性15min;95℃变性15s,60℃退火20s,72℃延伸30s,35个循环,60℃采集荧光)。
[0106]
实验结果:如图3所示,fam通道阳性,hex通道阳性,cy5通道阴性,表明o:4抗原和h:z抗原检测结果为阳性,h:1,7抗原检测结果为阴性,荧光定量pcr结果与血清型结果相符。
[0107]
3)选用标准菌株schwarzengrund沙门菌who eqas 2017s6(o抗原为o:4,鞭毛抗原分别为h:d和h:1,7),按照标准流程使用金属浴法提取基因组dna,使用荧光定量pcr仪的fam通道、hex通道和cy5通道分别检测o:4抗原、h:z抗原和h:1,7抗原。
[0108]
实验条件:配制25μl实时荧光pcr定量扩增反应体系,体系包括:12.5μl的实时荧光定量pcr预混液、三种上游引物各0.8μl(seq id no.1、seq id no.3和seq id no.5)、三种下游引物各0.8μl(seq id no.2、seq id no.4和seq id no.6)、三种实时荧光定量pcr探针各0.5μl(seq id no.7、seq id no.8和seq id no.9)、1.2μl的ddh2o和5μl的待测菌株基因组模板dna,在荧光定量pcr仪设置反应条件(95℃预变性15min;95℃变性15s,60℃退火20s,72℃延伸30s,35个循环,60℃采集荧光)。
[0109]
实验结果:如图4所示,fam通道阳性,hex通道阴性,cy5通道阳性,表明o:4抗原和h:1,7抗原检测结果为阳性,h:z抗原检测结果为阴性,荧光定量pcr结果与血清型结果相符。
[0110]
4)选用标准菌株carno沙门菌who eqas 2015s4(o抗原为o:1,3,19,鞭毛抗原分别为h:z和h:l,w),按照标准流程使用金属浴法提取基因组dna,使用荧光定量pcr仪的fam通道、hex通道和cy5通道分别检测o:4抗原、h:z抗原和h:1,7抗原。
[0111]
实验条件:配制25μl实时荧光pcr定量扩增反应体系,体系包括:12.5μl的实时荧光定量pcr预混液、三种上游引物各0.8μl(seq id no.1、seq id no.3和seq id no.5)、三种下游引物各0.8μl(seq id no.2、seq id no.4和seq id no.6)、三种实时荧光定量pcr探针各0.5μl(seq id no.7、seq id no.8和seq id no.9)、1.2μl的ddh2o和5μl的待测菌株基因组模板dna,在荧光定量pcr仪设置反应条件(95℃预变性15min;95℃变性15s,60℃退火
20s,72℃延伸30s,35个循环,60℃采集荧光)。
[0112]
实验结果:如图5所示,fam通道阴性,hex通道阳性,cy5通道阴性,表明o:4抗原和h:1,7抗原检测结果为阴性,h:z抗原检测结果为阳性,荧光定量pcr结果与血清型结果相符。
[0113]
5)选用标准菌株colindale沙门菌who eqas 2012s6(o抗原为o:6,7,鞭毛抗原分别为h:r和h:1,7),按照标准流程使用金属浴法提取基因组dna,使用荧光定量pcr仪的fam通道、hex通道和cy5通道分别检测o:4抗原、h:z抗原和h:1,7抗原。
[0114]
实验条件:配制25μl实时荧光pcr定量扩增反应体系,体系包括:12.5μl的实时荧光定量pcr预混液、三种上游引物各0.8μl(seq id no.1、seq id no.3和seq id no.5)、三种下游引物各0.8μl(seq id no.2、seq id no.4和seq id no.6)、三种实时荧光定量pcr探针各0.5μl(seq id no.7、seq id no.8和seq id no.9)、1.2μl的ddh2o和5μl的待测菌株基因组模板dna,在荧光定量pcr仪设置反应条件(95℃预变性15min;95℃变性15s,60℃退火20s,72℃延伸30s,35个循环,60℃采集荧光)。
[0115]
实验结果:如图6所示,fam通道阴性,hex通道阴性,cy5通道阳性,表明o:4抗原和h:z抗原检测结果为阴性,h:1,7抗原检测结果为阳性,荧光定量pcr结果与血清型结果相符。
[0116]
6)选用样品分离株indiana沙门菌cfsa664(o抗原为o:4,鞭毛抗原分别为h:z和h:1,7),按照标准流程使用金属浴法提取基因组dna,使用荧光定量pcr仪的fam通道、hex通道和cy5通道分别检测o:4抗原、h:z抗原和h:1,7抗原。
[0117]
实验条件:配制25μl实时荧光pcr定量扩增反应体系,体系包括:12.5μl的实时荧光定量pcr预混液、三种上游引物各0.8μl(seq id no.1、seq id no.3和seq id no.5)、三种下游引物各0.8μl(seq id no.2、seq id no.4和seq id no.6)、三种实时荧光定量pcr探针各0.5μl(seq id no.7、seq id no.8和seq id no.9)、1.2μl的ddh2o和5μl的待测菌株基因组模板dna,在荧光定量pcr仪设置反应条件(95℃预变性15min;95℃变性15s,60℃退火20s,72℃延伸30s,35个循环,60℃采集荧光)。
[0118]
实验结果:如图7所示,fam通道阳性,hex通道阳性,cy5通道阳性,表明o:4抗原、h:z抗原和h:1,7抗原检测结果均为阳性,荧光定量pcr结果与血清型结果相符。
[0119]
7)选用标准菌株enteritidis沙门菌atcc13076(o抗原为o:9,12,只有一相鞭毛抗原h:g,m,无二相鞭毛抗原),按照标准流程使用金属浴法提取基因组dna,使用荧光定量pcr仪的fam通道、hex通道和cy5通道分别检测o:4抗原、h:z抗原和h:1,7抗原。
[0120]
实验条件:配制25μl实时荧光pcr定量扩增反应体系,体系包括:12.5μl的实时荧光定量pcr预混液、三种上游引物各0.8μl(seq id no.1、seq id no.3和seq id no.5)、三种下游引物各0.8μl(seq id no.2、seq id no.4和seq id no.6)、三种实时荧光定量pcr探针各0.5μl(seq id no.7、seq id no.8和seq id no.9)、1.2μl的ddh2o和5μl的待测菌株基因组模板dna,在荧光定量pcr仪设置反应条件(95℃预变性15min;95℃变性15s,60℃退火20s,72℃延伸30s,35个循环,60℃采集荧光)。
[0121]
实验结果:如图8所示,fam通道阴性,hex通道阴性,cy5通道阴性,表明o:4抗原、h:z抗原和h:1,7抗原检测结果均为阴性,荧光定量pcr结果与血清型结果相符。
[0122]
虽然已经参考优选实施例对本发明进行了描述,但在不脱离本发明的范围的情况
下,可以对其进行各种改进并且可以用等效物替换其中的部件。尤其是,只要不存在结构冲突,各个实施例中所提到的各项技术特征均可以任意方式组合起来。本发明并不局限于文中公开的特定实施例,而是包括落入权利要求的范围内的所有技术方案。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1