一株高效降解玉米赤霉烯酮耐高温的菌株及其菌剂
1.本发明涉及一株高效降解玉米赤霉烯酮耐高温的菌株及其菌剂在降解粮食中玉米赤霉烯酮和呕吐毒素中的应用。
背景技术:
2.玉米赤霉烯酮(zearalenone,zen)是一种非甾体类雌激素类真菌毒素,又称f-2毒素,化学名6-(10-羟基-6-氧基碳烯基)-β-雷锁酸-μ-内酯。是一种酚的二羟基苯酸的内酯结构,与动物内源性雌激素β-雌二醇结构相似。是由镰刀菌属如三线镰刀菌、串珠镰刀菌、禾谷镰刀菌、木贼镰刀菌、粉红镰刀菌等多种镰刀菌产生的一类有毒次级代谢产物。玉米赤霉烯酮能够污染粮食作物,如玉米,小麦和大豆等,造成人类食品安全的问题。玉米赤霉烯酮还会污染饲料,引发动物中毒。动物食用大量玉米赤霉烯酮污染的饲料后会出现生殖毒性、细胞毒性、遗传毒性和免疫毒性等毒性作用,产生的毒性通过对机体的生殖功能和免疫机能等的抑制作用影响动物与人类的健康。
3.脱氧雪腐镰刀烯醇(deoxynivalenol,don)又名呕吐毒素,是由镰刀菌属如禾谷镰刀菌、木贼镰刀菌、粉红镰刀菌等多种镰刀菌产生的一种单端孢霉烯族化合物,是真菌毒素中的一种。don毒素同能够污染粮食作物,造成人类食品安全问题和引发动物中毒。呕吐毒素具有很强的细胞毒性和免疫毒性,对动物的消化系统、血液系统、神经系统都有着很大的影响,被欧盟列为三级致癌物。
4.目前玉米赤霉烯酮毒素与呕吐毒素在谷物中普遍存在,现在因此找到一种合适的能够去除或降低这种毒素毒性的方法尤为重要。
5.粮食在农田中、运输期间以及作为食品和饲料成品加工、储藏和食用期间,都有可能出现被zen和don毒素污染的情况。在我国大部分地区农产品样品中,zen污染情况严重,检出率较高,而且由于zen热稳定性极强,不能通过常规处理完全清除。因此zen可以在谷物类的成品食物中检测到,比如面包或馒头。武亭亭等人对粮食加工过程中玉米赤霉烯酮的污染情况进行调查,检测结果显示玉米研磨加工中zen毒素检出率达34%;小麦粉中zen毒素检出率超出74%。don的热稳定性同样极强,在谷物中don的检出率同样很高,并且don在胃肠中吸收,进入血液系统后对肝脏等各个器官造成伤害,进入人体后8h,会被完全吸收,完全检测不到呕吐毒素及其代谢物。
6.迄今为止,国内外对玉米赤霉烯酮毒素和呕吐毒素的脱毒方法主要有物理法,化学法和生物法三大类。物理法主要包括辐射法,吸附剂吸附法,热处理法等,化学法主要是让zen和don与碱,氧化剂,有机溶剂发生化学作用,将zen和don转化成其他物质,降低毒性。目前化学法主要包括双氧水处理法,臭氧处理法,碳酸钠浸泡法等。虽然物理法和化学法可以达到一定的脱毒效果,但其仍然存在着一些不足比如脱毒效果不理想,脱毒产物不明确,可能造成若干重要营养物质的损失,化学脱毒剂残留,成本较高等等。生物法可以解决上述理化脱毒中存在的问题,生物法是在一种温和的环境下进行脱毒,不仅不会造成食品和饲料营养物质的损失,适口性的改变,也不会带来有毒有害的化学物质。生物法脱毒方式目前
有两种:一是微生物吸附脱毒,其作用机制为菌体细胞吸附毒素形成稳定复合物,但是这一过程容易受到温度和菌体浓度影响,且过程可逆;二是微生物或其代谢产物降解脱毒,是利用微生物分泌的胞内酶、胞外酶以及次级代谢产物使zen和don的毒性减弱甚至降解成为无毒的物质。并且微生物繁殖速度快,种类繁多,基因资源丰富,降解真菌毒素潜力巨大。因此生物法是目前降解谷物与饲料中zen和don最好的方法。
7.综上所述,为了保障人们的食品安全和身体健康,解决农产品和饲料zen和don污染的问题。有必要从自然资源中分离出安全、高效降解玉米赤霉烯酮和呕吐毒素的菌株,丰富能够同时降解玉米赤霉烯酮和呕吐毒素降解菌的资源库。进一步研究其生物特性,毒素降解特性及降解机理。为粮食中玉米赤霉烯酮和呕吐毒素降解提供技术支撑。
技术实现要素:
8.本发明的目的在于克服现有技术中的不足,提供一株高效降解玉米赤霉烯酮耐高温的菌株及其菌剂,为粮食中玉米赤霉烯酮和呕吐毒素降解提供技术支撑。
9.本发明是通过以下技术方案实现的:一株耐高温高效降解玉米赤霉烯酮和呕吐毒素的枯草芽孢杆菌(bacillus subtilis),命名为bac.sp.haut.1,该菌株是从河南省郑州市荥阳市西种植玉米的土壤中分离得到,2021年8月2日保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),地址:北京市朝阳区北辰西路1号院3号,保藏号为cgmcc no.22996,与其它生物的情况一样,本发明具有降解玉米赤霉烯酮活性的菌,bac.sp.haut.1仍然可能发生突变或变异。因此,可以利用本领域已知的物理和化学方法得到该菌株的突变株,例如,可以通过用化学药剂如亚硝基胍(ntg)及其它化学诱变剂,或用物理方法如紫外、co60辐照处理得到其突变株,这些诱变突变株,只要保留了降解玉米赤霉烯酮这样一个能力特征,也属于本发明的一部分。
10.本发明还提供一种菌剂,它的活性成分为枯草芽孢杆菌(bacillus subtilis)bac.sp.haut.1(保藏编号为cgmcc no.22996)或其衍生的突变株。本发明提供上述菌剂可以为液态菌剂也可以为固态菌剂,并通过现有技术中已公开的制备方法来制备。
11.进一步地,枯草芽孢杆菌bac.sp.haut.1对玉米赤霉烯酮有降解效果的为胞外酶。
12.进一步地,枯草芽孢杆菌bac.sp.haut.1经85℃高温处理20min后,活菌数为1
×
10
8-1
×
109cfu/ml。
13.一种高效降解玉米赤霉烯酮和降解呕吐毒素的菌剂,该菌剂主要活性成分为枯草芽孢杆菌bac.sp.haut.1,形态为固态粉末状。
14.本发明还要求保护所述菌剂在降解粮食中玉米赤霉烯酮和呕吐毒素中的应用。
15.进一步地,将所制菌剂按0.5%-1%添加至被玉米赤霉烯酮和呕吐毒素污染的谷物、饲料原料与饲料中,混合,检测活细胞数达到1
×
10
8-1
×
10
10
cfu/ml。
16.一种固态粉末状菌剂的制备方法,步骤如下:
17.(1)枯草芽孢杆菌bac.sp.haut.1在na固体培养基中活化成长;
18.(2)将(1)中得到的枯草芽孢杆菌bac.sp.haut.1挑至加入葡萄糖的na液体培养基中,ph 7.0-7.5,发酵条件为温度27-37℃,转速150rpm-200rpm,培养48h,使得发酵液中活菌数在1
×
10
9-1
×
10
11
cfu/ml,得到液态菌剂;
19.(3)以液态菌剂的质量为1,加入的2%-4%淀粉,1%-2%焦亚硫酸钠,1%-2%l盐
酸半胱氨酸的保护剂,进行喷雾干燥制备得固态菌剂。
20.进一步地,喷雾干燥的条件为:进风温度175-180℃,出风温度80-85℃,进料速度为1-1.5l/h。
21.进一步地,取800-950μl发酵液(1
×
10
9-1
×
10
11
cfu/ml)与25-50μl浓度为100μg/ml玉米赤霉烯酮共培养6h,对玉米赤霉烯酮的降解率达90%以上;
22.进一步地,取800-950μl发酵液(1
×
10
9-1
×
10
11
cfu/ml)与25-50μl浓度为100μg/ml呕吐毒素共培养72h,对呕吐毒素的降解率达60%以上。
23.本发明的有益效果在于:本发明中对枯草芽孢杆菌bac.sp.haut.1降解玉米赤霉烯酮的活性物质定位分析方法,将发酵液分为无细胞上清液、菌体悬浮液和细胞内提取物,分别测定降解率,主要降解活性物质集中于无细胞上清液。对无细胞上清液进行加热处理、蛋白酶k处理和蛋白酶k+sds处理,无细胞上清液降解活性下降,因此可确定,降解活性物质主要为胞外酶。
附图说明
24.图1为菌株bac.sp.haut.1降解zen的48h的降解动力曲线;
25.图2为菌株bac.sp.haut.1无细胞上清液、菌体悬浮液和胞内提取物对zen的降解率和将无细胞上清液进行加热处理、蛋白酶k处理和蛋白酶k+sds处理后,三个处理组的降解率;
26.图3为菌株bac.sp.haut.1在na培养基上培养24h的菌落形态;
27.图4为菌株bac.sp.haut.1经革兰氏染色后,与光学显微镜下放大1000倍所采集的图像;
28.图5为菌株bac.sp.haut.1降解12h前后zen含量的高效液相色谱图;
29.图6为菌株bac.sp.haut.1降解12h前后don含量的高效液相色谱图。
具体实施方式
30.下面将结合发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
31.实施例1
32.菌株bac.sp.haut.1的降解效果及降解活性成分的确定。
33.1.菌株活化
34.将菌株接种于涂布了zen毒素的无机盐培养基(毒素浓度20ug/ml)进行活化,置于37℃霉菌培养箱培养48h。
35.2.菌株发酵
36.将活化后的菌株挑至含葡萄糖的na培养基进行发酵,至于37℃,150r/min摇床发酵48h。
37.3.菌株bac.sp.haut.1的降解动力曲线
38.移取发酵液950μl于10ml离心管中,加入50μl100μg/ml玉米赤霉烯酮毒素,涡旋
30s混合均匀,使降解体系中zen浓度定为5μg/ml。分别在培养后6h、12h、24h、36h和48h取样,测定zen的降解率。
39.结果如图1所示,zen的降解率随着时间逐渐增高,在6h时,zen降解率达到90%以上。
40.4.菌株菌液、上清液、菌悬液与胞内提取物的降解实验
41.将菌株发酵液在4℃、8000r/min离心10min,移取离心后的上清液于10ml离心管中,放置4℃冰箱中保存,剩余沉淀菌体使用灭菌后的磷酸盐缓冲液(pbs)冲洗沉淀两次后,再次使用pbs缓冲液重悬,制成菌悬液。将菌悬液放置冰上,置于超声波细胞破碎器内,超声3s,间隔3s,持续15min,然后12000r/min冷冻离心20min,取上清液用0.22μm的抽滤器无菌抽滤得到滤液即为胞内提取物。分别取5ml上清液进行121℃高温加热处理20min,制得处理组1,加入蛋白酶k,浓度定为5mg/ml,制得处理组2,加入5mg蛋白酶k和0.05gsds制得处理组3,并对分别取950μl菌株上清液、菌悬液、胞内提取物和处理组1、2、3与50μl zen毒素标准液置于灭菌的10ml离心管中,旋涡30s,使zen终浓度为5μg/ml。气浴摇床置于暗处,培养条件设置为150r/min、37℃、48h,3组平行实验。反应结束后,测定降解率。
42.各个部分的降解效果如图2所示。菌株对zen的降解率主要集中于无细胞上清液内,菌体起到了一定的吸附作用,胞内提取物基本没有降解作用。无细胞上清液经加热、蛋白酶k和蛋白酶k+sds处理后,上清液降解率因此初步推断降解zen的活性成分为胞外酶。
43.实施例2
44.zen和don高效降解菌株bac.sp.haut.1的鉴定
45.1.基因组dna提取
46.1)取1.5ml离心管,加入200μl预处理液和三颗玻璃珠,然后加入适量菌样品,放入研磨仪中研磨至充分。
47.2)加入20μlproteinasek溶液,混匀,37℃放置30~60min。
48.3)加入200μl裂解液,充分颠倒混匀,70℃放置10min。
49.4)加200μl无水乙醇,充分颠倒混匀,短离心以去除管盖内壁液滴。
50.5)过吸附柱,洗涤液洗1次,漂洗液洗2次。
51.6)吸附柱室温放置5~10分钟,以彻底晾干吸附材料中残余的漂洗液。
52.7)将吸附转入一个新离心管,向吸附膜中间位置悬空滴加50-100μl ddh 2o,室温放置5-10min,12,000rpm离心2min,将溶液收集到离心管中。
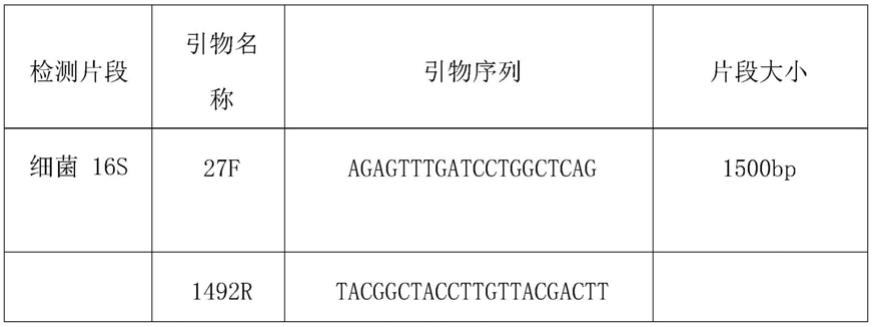
53.2.16s扩增
54.表2:引物信息
[0055][0056]
表3:pcr扩增反应体系和条件
[0057][0058]
3.pcr产物检测及纯化
[0059]
3μl pcr产物进行1.0%的琼脂糖凝胶检测,观察条带性状。
[0060]
pcr产物纯化按照磁珠纯化标准操作流程操作,利用磁珠能够吸附或者释放带电荷物质的原理,在高盐低ph溶液吸附dna,在低盐高ph溶液释放dna,从而达到分离提纯dna产物的目的。
[0061]
4.测序
[0062]
将纯化后的pcr产物进行上机检测。
[0063]
5.结果比对
[0064]
测序结果进行ncbi-blast比对。
[0065]
比对结果如表四所示,该菌株16s dna鉴定结果为芽孢杆菌属(bacillus)表4:blast比对结果
[0066][0067][0068]
6.生理生化鉴定
[0069]
将菌株bac.sp.haut.1划线至发酵培养基上,观察菌落形态如图3,挑取菌落进行革兰氏染色,使用光学显微镜观察如图4。无菌操作挑取分离出菌株的纯培养物,接种于生化反应管中,于37℃培养48h,测定糖、盐类、mr、vp、吲哚实验等11种生理生化指标。观察并记录结果,结果如表4所示。经生理生化特征显示,最终鉴定结果显示该菌株为枯草芽孢杆菌。
[0070]
表5菌株bac.sp.haut.1的生理生化鉴定
[0071][0072]
注:“+”为阳性反应,
“‑”
为阴性反应。
[0073]
实施例3
[0074]
菌株耐高温的试验
[0075]
将按照实施例1中所述方法制得的发酵液进行85℃水浴20min,使用无菌生理盐水稀释加热处理后的发酵液,稀释最终倍数为10-7
、10-8
和10-9
。将稀释液涂布至na固体培养基中,37℃倒置培养12h,观察各个浓度平板生长情况,计算活菌数。
[0076]
经计算可得发酵液85℃水浴20min后,活菌数仍可达到活菌数为1
×
10
8-1
×
109cfu/ml。因此可得,该菌株可以耐受高温,在短时间高温加工环境下,可以保证有较高的活菌数,不影响菌株后续的降解效果。
[0077]
实施例4
[0078]
菌制剂的制备试验
[0079]
1.菌株活化
[0080]
将菌株接种于涂布了zen毒素的无机盐培养基(毒素浓度20ug/ml)进行活化,置于37℃霉菌培养箱培养48h。
[0081]
2.菌株种子液
[0082]
将活化后的菌株挑至含葡萄糖的na培养基进行发酵,至于37℃,150r/min摇床发酵24h,使od值达到1
×
108cfu/ml。
[0083]
3.发酵培养
[0084]
采用30l的小型发酵罐,将上述种子液按照4%接种量接种于发酵罐中,发酵罐中的含葡萄糖na培养基提前进行121℃高压蒸汽灭菌20min。发酵条件为:ph 7.0-7.5,温度37,搅拌转速为180rpm,溶氧量为60%,培养时间为36h-50h,至发酵罐内活菌数达1
×
10
9-1
×
10
11
cfu/ml。
[0085]
4.喷雾干燥
[0086]
麦麸和玉米芯粉按照任意比例混合为基料,将生产出的发酵液与基料按照质量比1:5混合均匀,按重量比加入的2%-4%淀粉,1%-2%焦亚硫酸钠,1%-2%l-盐酸半胱氨酸的保护剂,进行喷雾干燥制备得固态菌剂。喷雾干燥的条件为:进风温度175-180℃,出风温度70-80℃,进料速度为1-1.5l/h。
[0087]
5.菌剂应用
[0088]
取所制的液态菌剂950μl和50μl浓度为100μg/ml玉米赤霉烯酮混合,共培养12h后,测定玉米赤霉烯酮毒素含量。
[0089]
玉米赤霉烯酮的提取及检测:采用三倍体积二氯甲烷对混合液的玉米赤霉烯酮毒素进行提取,提取后在35℃下使用氮气缓慢吹干,吹干后1ml甲醇复溶0.22μm滤膜过滤打入进样瓶,使用高效液相色谱法检测毒素;
[0090]
降解效果如图5所示,能够清晰比对出玉米赤霉烯酮降解前后的含量,毒素出峰时间为5.09min,降解率达到95.3%。
[0091]
取所制的液态菌剂950μl和50μl浓度为100μg/ml呕吐毒素混合,共培养72h后,测定呕吐毒素含量。
[0092]
呕吐毒素的提取及检测:采用呕吐毒素免疫亲和柱对反应后的菌液中呕吐毒素进行提取,提取后使用高效液相色谱法检测毒素。
[0093]
降解效果如图6所示,能够清晰比对出呕吐毒素降解前后的含量,毒素出峰时间为6.6min,降解率达65.6%。
[0094]
所制固态菌剂按0.5%-1%添加至被玉米赤霉烯酮污染的谷物、饲料原料与饲料中,混合均匀,检测到活细胞数达到1
×
10
8-1
×
10
10
cfu/ml。
[0095]
在现有技术中,“一株解淀粉芽孢杆菌及其在降解玉米赤霉烯酮中的应用”(中国专利公开号cn103981133a)中,将该株解淀粉芽孢杆菌在适宜条件下培养24小时,和终浓度为5μg/ml玉米赤霉烯酮加入mm培养基共培养72小时,降解率为95.99%。“高效降解玉米赤霉烯酮的枯草芽孢杆菌及其应用”(中国专利公开号cn105385616a)中,该株枯草芽孢杆菌在适宜条件下培养后,与20μg/ml玉米赤霉烯酮共培养6h,降解率为100%;
[0096]
与现有技术比较,该菌株在适宜条件培养48h后,与玉米赤霉烯酮共培养24h后,降解率为97%以上,在高效降解玉米赤霉烯酮的同时,该菌株与呕吐毒素共培养72h,对呕吐毒素的降解率也可达60%以上。
[0097]
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1